除藻生物体的制作方法
本公开涉及用于控制各种藻类的组合物和方法。
背景技术:
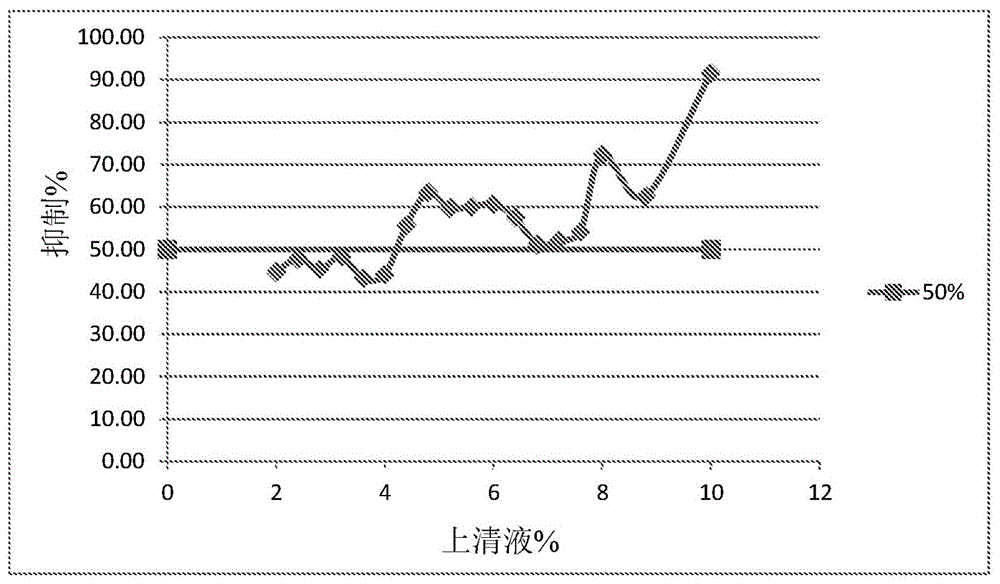
:有毒藻类已经在全世界的湖泊、水库和河流中广泛大量繁殖。大量繁殖引起家畜死亡并且威胁人体健康和水域生态系统。尽管已经提出若干消除大量繁殖的途径,但那些途径很难成功。不存在完全移除有毒藻类的方法。因此,需要设计多种策略的各种途径。技术实现要素:水藻大量繁殖已经成为世界范围的环境问题。最近,除藻细菌作为可能用于抑制水体藻类大量繁殖的药剂已经吸引了广泛关注。提供来源于球孢白僵菌(beauveriabassiana)、短短芽孢杆菌(brevibacillusbrevis)、孢淡灰链霉菌(streptomycesspororaveus)、埃吉类芽孢杆菌(paenibacilluselgii)或链霉菌属(streptomycessp.)发酵物的已分离化合物和组合物,其具有除藻特性。在一个方面中,提供来源于球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)发酵物的已分离化合物和组合物,其具有除藻特性。在一个特定方面中,来自这类生物体的发酵产物可以调节或抑制一或多种藻类物种,如莱茵衣藻(chlamydomonasreinhardtii)、羊角月牙藻(pesudokirchneriellasubacpitata)、四尾栅列藻(scenedesmusquadricata)、鱼腥藻属(anabaenasp.)、弱细颤藻(oscillatoriatenuis)、铜绿微囊藻(microcystisaeruginosa)、舟形藻属(naviculasp.)、水绵属(spirogyrasp.)或轮藻属(charasp.)。进一步提供一种在某一位置调节或抑制至少一种藻类物种的方法,其使用一定量的具有来源于一或多种以下物种的细胞的细胞悬浮液或全细胞培养液,或来源于其的上清液、滤液、细胞级分、一或多种代谢物、一或多种化合物和/或提取物来进行:球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409),其中所述一或多种物种产生一或多种控制藻类的物质,所述方法对调节所述藻类有效,所述藻类如莱茵衣藻、羊角月牙藻、四尾栅列藻、鱼腥藻属、弱细颤藻、铜绿微囊藻、舟形藻属、水绵属或轮藻属。在一个方面中,本公开涉及以对控制藻类侵扰有效的量在某一位置施用全细胞培养液、上清液、滤液或细胞级分。非石灰处理位置可以是水体,或在油漆中,或在混凝土、路面、瓦片、瓷制品、乙烯树脂、砖、灰泥、纤维玻璃和铝表面上。这些表面可以经过涂漆或未经涂漆。一般来说,将除藻剂施用于表面上,直到其潮湿为止或直到观察到径流为止。此外,上文所阐述的组合物可以与抗生素或抗真菌剂组合,确切地说与针对土传细菌有效的抗生素组合进行施用。在一个相关方面中,提供一种组合,其包含上文所阐述的物质和另一种针对土传细菌有效的抗生素。这些组合也可以是组合物。在一个相关方面中,提供这些物质和抗生素在调配这些组合中的用途。再此外,上文所阐述的组合物可以调配为可尘化粉末(dp)、可溶性粉末(sp)、水溶性颗粒(sg)、水分散性颗粒(wg)、可湿润性粉末(wp)、颗粒(gr)(缓慢或快速释放)、可溶性浓缩物(sl)、油可混溶性液体(ol)、超低容量液体(ul)、可乳化性浓缩物(ec)、可分散性浓缩物(dc)、乳液(水包油(ew)和油包水(eo)两者)、微乳液(me)、悬浮液浓缩物(sc)、基于油的悬浮液浓缩物(od)、气溶胶、成雾/烟雾调配物、胶囊悬浮液(cs)以及种子处理剂调配物。附图说明为了对本公开的特征和优势进行更完全理解,现在参考本发明具体实施方式以及附图,并且其中:图1表示在96孔培养板中,球孢白僵菌o379(nrrl-67406)对羊角月牙藻的剂量反应。图2表示在96孔培养板中,球孢白僵菌o379(nrrl-67406)对鱼腥藻属的剂量反应。图3表示在96孔培养板中,短白僵菌hnym3,o989(nrrl-b67408)对羊角月牙藻的剂量反应。图4表示在96孔培养板中,短白僵菌属hnym3,o989(nrrl-b67408)对鱼腥藻属的剂量反应。图5表示在96孔培养板中,孢淡灰链霉菌f18,p842(nrrl-b67410)对羊角月牙藻的剂量反应。图6表示在96孔培养板中,孢淡灰链霉菌f18,p842(nrrl-b67410)对鱼腥藻属的剂量反应。图7表示在96孔培养板中,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对羊角月牙藻的剂量反应。图8表示在96孔培养板中,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对鱼腥藻属的剂量反应。图9表示在96孔培养板中,链霉菌属q004(nrrl-67409)对羊角月牙藻的剂量反应。图10表示在96孔培养板中,链霉菌属q004(nrrl-67409)对鱼腥藻属的剂量反应。具体实施方式除非另外定义,否则本文所用的所有技术和科学术语均具有与本发明所属领域的一般技术人员通常所理解相同的含义。尽管在本发明的实践或测试中还可以使用与本文所描述的那些方法和材料类似或等效的任何方法和材料,但是现在描述优选的方法和材料。必须指出,除非上下文另外明确规定,否则如本文和所附权利要求书中所用,单数形式“一(a/an)”和“所述”包括复数个参考物。举例来说,“一种物质”还涵盖「多种物质」。如本文所定义,术语“调节”用于意味着在某一位置改变藻类侵扰的量或藻类侵扰扩散的速率,或杀灭藻类、对藻类具有致死性或毒性。“调节藻类侵扰”还涵盖调节所述侵扰的影响。如本文所用,“藻类”是指各种主要水生真核光合生物体中的任一种,其尺寸在单细胞形式到巨型海藻范围内。所述术语可以进一步指在地球上负责大量光合成的光合原生生物。作为一个群组,藻类具有多源性。因此,所述术语可以指被认为是来自以下群组的藻类的任何原生生物:囊泡藻(alveolate)、绿色变形藻(chloraraachniophyte)、隐藻(cryptomonad)、褐藻(euglenid)、灰藻(glaucophyte)、鞭毛藻(haptophyte)、红藻类(如红藻(rhodophyta))、不等鞭毛藻(stramenopile)和绿藻(viridaeplantae)。所述术语是指真核生物中的绿色、黄绿色、棕色和红色藻类。所述术语还可以指原核生物中的蓝藻细菌。所述术语还是指绿藻类、蓝藻类和红藻类。在一个实施例中,藻类是丝状或浮游绿或蓝藻细菌。如本文所定义,“来源于”和“获自”意味着从特定来源直接分离或获得,或者具有从特定来源分离或获得的物质或生物体的识别特征。这些术语在整个本说明书中可互换地使用。如本文所定义,“来源于球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)”意味着细胞培养液包含来自球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)的细胞,细胞悬浮液包含来自球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)的细胞,以及细胞级分、上清液、滤液或提取物从发酵物收集。提取物可以不仅来源于细胞悬浮液或全细胞培养液,而且还来源于本身源于所述全细胞培养液或细胞悬浮液的滤液、上清液或级分。如本文所定义,“已分离化合物”基本上不含其他化合物或物质,如通过分析方法(包括(但不限于)色谱法、电泳法)所测定,例如是纯度至少约20%、优选地纯度至少约40%、更优选地纯度约60%、甚至更优选地纯度约80%、最优选地纯度约90%、并且甚至最优选地纯度约95%。如本文所定义,“全培养液培养物”或“全细胞培养液”是指含有细胞和发酵培养基两者的液体培养物。全细胞培养液还可以获自在培养板上生长的细菌,通过从所述培养板采集细胞并且将其悬浮于水或其他液体中来进行。术语“全培养液培养物”和“全细胞培养液”可互换地使用。如本文所定义,“上清液”是指当通过离心、过滤、沉降或所属领域中已知的的其他手段将在培养液中生长或在另一液体中从琼脂培养板采集的细胞去除时所剩余的液体。如本文中所定义,“滤液”是指来自已经穿过膜的全培养液培养物的液体。如本文所定义,“提取物”是指用溶剂(水、清洁剂、缓冲液、有机溶剂)从细胞去除并且通过离心、过滤、相分配或其他方法与所述细胞分离的液体物质。如本文所定义,“灭活”微生物是指死亡的微生物,或不处于活性生长阶段的微生物(例如孢子)。非限制性灭活方式包括热杀灭或化学杀灭。在一个实施例中,微生物可以被溶解。本公开的组合物可以来源于球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)。所述组合物可以是细胞悬浮液或全细胞培养液以及来源于所述全细胞培养液或细胞悬浮液的滤液、上清液或级分。如上文所提及,化合物和组合物可以获自、可获自或来源于具有球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)的识别特征的生物体或上文所阐述的任何组合。所述方法包含培育这些生物体,和任选地通过将这些化合物与这些生物体的细胞分离来获得化合物。确切地说,生物体在营养培养基中使用所属领域中已知的方法来进行培育。生物体可以通过振荡烧瓶培养;通过在实验室或工业发酵器中,在合适的培养基中并且在允许细胞生长的条件下进行的的小规模或大规模发酵(包括(但不限于)连续、分批、分批进料或固态发酵)来进行培育。培养可以在合适的营养培养基中使用所属领域中已知的程序进行,所述培养基包含碳和氮来源以及无机盐。合适的培养基可以从商业来源购得或根据已公布的组合物制备。一个特定实施例公开于下文实例和美国专利第6,194,194号中,其以引用的方式并入。在培养之后,可以使细胞浓缩,并且随后将其悬浮于缓冲液中以获得细胞悬浮液。在一个实施例中,使用死亡细胞的悬浮液。细胞悬浮液中的活细胞可以用过以下中的至少一种来加以杀灭:辐射、加热、干燥或用其他物理手段中的化学手段来处理细胞。死亡细胞悬浮液不是针对藻类物种的活性所需的。在一个特定实施例中,调节藻类并且尤其对藻类具有毒性的物质可以从悬浮液中提取。提取物可以通过色谱来分级分离。可以使用所属领域中已知的方法来分析色谱级分针对藻类,如莱茵衣藻、羊角月牙藻、四尾栅列藻、鱼腥藻属、弱细颤藻、铜绿微囊藻、舟形藻属、水绵属或轮藻属的毒性活性;一个特定实施例公开于下文实例中。这一过程可以使用相同或不同的色谱方法重复一或多次。在一个实施例中,组合物可以包含从球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)发酵物收集的全细胞培养液培养物、液体培养物或悬浮液。上文所阐述的组合物可以按任何方式进行调配。调配物实例包括(但不限于)可乳化性浓缩物(ec)、可湿润性粉末(wp)、可溶性液体(sl)、气溶胶、超低容量浓缩溶液(ulv)、可溶性粉末(sp)、微型胶囊、水分散颗粒、流体(fl)、微乳液(me)、纳米乳液(ne)等。在本文所描述的任何调配物中,活性成分的百分比处于0.01%到99.99%范围内。另一个实施例是非调配型全细胞培养液或浓缩全细胞培养液。组合物还可以选自许多调配物类型,包括可尘化粉末(dp)、可溶性粉末(sp)、水溶性颗粒(sg)、水分散性颗粒(wg)、可湿润性粉末(wp)、颗粒(gr)(缓慢或快速释放)、可溶性浓缩物(sl)、油可混溶性液体(ol)、超低容量液体(ul)、可乳化性浓缩物(ec)、可分散性浓缩物(dc)、乳液(水包油(ew)和油包水(eo)两者)、微乳液(me)、悬浮液浓缩物(sc)、基于油的悬浮液浓缩物(od)、气溶胶、成雾/烟雾调配物、胶囊悬浮液(cs)以及种子处理剂调配物。在任何实例中所选择的调配物类型将取决于所设想的特定目的以及微生物的物理、化学和生物学特性。在另一个实施例中,组合物可以呈液体、凝胶或固体形式。固体组合物可以通过将固体载剂悬浮于一或多种活性成分的溶液中,并且在温和条件下干燥所述悬浮液(如在室温下蒸发或在65℃或低于65℃的温度下真空蒸发)来加以制备。组合物可以包含用凝胶囊封的活性成分。这类凝胶囊封的材料可以通过以下方式来加以制备:将凝胶形成剂(例如明胶、纤维素或木质素)与活或灭活微生物的培养物或悬浮液或培养物或悬浮液的无细胞滤液或细胞级分混合,或与经过喷雾或冷冻干燥的培养物、细胞或细胞级分混合或在本发明方法中所用的除藻化合物的溶液中混合;并且诱导药剂的凝胶形成。而在另一个实施例中,组合物可以另外包含出于乳化、分散、湿润、扩散、整合、崩解控制、活性成分稳定化和流动性或生锈抑制改进的目的而使用的表面活性剂。在一个特定实施例中,表面活性剂是非植物毒性非离子型表面活性剂,其优选地属于环境保护局(epa)列表4b(以全文引用的方式并入本文中)。在另一个特定实施例中,非离子型表面活性剂是聚氧化乙烯(20)单月桂酸酯。表面活性剂的浓度可以在总调配物的0.1%-35%之间的范围内,优选的范围是5%-25%。分散剂和乳化剂(如非离子型、阴离子型、两性和阳离子型分散剂和乳化剂)的选择以及所采用的量由组合物的性质和药剂促进本发明组合物分散的能力来决定。组合物还可以包括(但不限于)氨基糖苷抗生素,其包括许多对植物、真菌和动物细胞具有毒性的分子(例如卡那霉素(kanamycin)、新霉素(neomycin)、健大霉素(gentamycin)、衍生物g418和巴龙霉素(paromycin))(奈普(nap)等人1992),以及细菌性新霉素磷酸转移酶ii和艾洛西丁(aerocyanidin)、艾洛卡文(aerocavin)、3,6-二羟基-吲哚噁嗪和单酰胺菌素sb-26.180。在一个实施例中,上文所阐述的组合物和物质可以用于在某一位置调节或抑制藻类侵扰的量,所述位置如封闭或敞开的水体或在固体表面上,如塑料、混凝土、木材、纤维玻璃、由铁和聚氯乙烯制成的管道、覆盖有涂层材料和/或油漆的表面。在另一个实施例中,有效微生物抑制藻类的生长,所述藻类如莱茵衣藻、羊角月牙藻、四尾栅列藻、鱼腥藻属、弱细颤藻、铜绿微囊藻、舟形藻属、水绵属、轮藻属或其任何组合。提供用含有活性代谢物或化合物的上清液、滤液或提取物来施用有效除藻控制,所述活性代谢物或化合物产生于或获自或来源于球孢白僵菌o379(nrrl-67406)、短短芽孢杆菌hnym3,o989(nrrl-b67408)、孢淡灰链霉菌f18,p842(nrrl-b67410)、埃吉类芽孢杆菌sd17,p858(nrrl-b67407)或链霉菌属q004(nrrl-67409)上清液、滤液或提取物,或施用前述的组合。在有效藻类控制中,菌株或上清液或滤液或提取物、代谢物和/或化合物单独或与另一种除藻物质组合施用。有效量被定义为足以调节藻类侵扰的微生物细胞、上清液、滤液或提取物、代谢物和/或化合物单独或与另一种除藻物质组合或不与其组合的那些量。有效比率可能受所存在的藻类物种、害虫生长阶段、害虫种群密度和环境因素(如温度、风速、雨、当日时间和季节性)影响。在特定实例中将处于有效范围内的量可通过实验室或现场测试(如本发明实例中所列的测试)来确定。而在另一个实施例中,本文所阐述的组合物还可以与另一种微生物和/或杀虫剂(例如杀真菌剂、除藻剂)组合。其他微生物可以包括(但不限于)来源于以下的药剂:芽孢杆菌属(bacillussp.)(例如坚强芽孢杆菌(bacillusfirmus)、苏云金芽孢杆菌(bacillusthuringiensis)、短小芽抱杆菌(bacilluspumilus)、地衣芽孢杆菌(bacilluslicheniformis)、淀粉消化芽孢杆菌(bacillusamyloliquefaciens)、枯草杆菌(bacillussubtilis))、拟青霉菌属(paecilomycessp.)(淡紫拟青霉菌(p.lilacinus))、巴斯德氏芽菌属(pasteuriasp.)(穿透性巴斯德氏芽菌(p.penetrans))、假单胞菌属(pseudomonassp.)、短芽孢杆菌属(brevabacillussp.)、蜡蚧菌属(lecanicilliumsp.)、白粉寄生孢属(ampelomycessp.)、南极假丝酵母属(pseudozymasp.)、链霉菌属(streptomycessp.)(比基尼链霉菌(s.bikiniensis)、哥斯达黎加链霉菌(s.costaricanus)、除虫链霉菌(s.avermitilis))、伯克霍尔德氏菌属(burkholderiasp.)、木霉属(trichodermasp.)、胶霉属(gliocladiumsp.)、除虫菌素(avermectin)、漆斑菌属(myrotheciumsp.)、拟青霉菌属(paecilomycesspp.)、鞘氨醇杆菌属(sphingobacteriumsp.)、线虫捕捉菌属(arthrobotryssp.)、绿盘菌(chlorosplrnium)、螺菌(neobulgaria)、轮层炭菌(daldinia)、曲霉(aspergillus)、毛壳菌(chaetomium)、溶杆菌属(lysobacterspp)、巴氏粒毛盘菌(lachnumpapyraceum)、亚厚孢蜡蚧孢(verticilliumsuchlasporium)、少孢节丛孢菌(arthrobotrysoligospora)、厚垣孢蜡蚧孢(verticilliumchlamydosporium)、罗氏被毛孢(hirsutellarhossiliensis)、厚垣孢普可尼亚菌(pochoniachlamydosporia)、糙皮侧耳(pleurotusostreatus)、发光类脐菇(omphalotusolearius)、日本亮耳菌(lampteromycesjaponicas)、短波单胞菌属(brevudimonassp.)或麝香霉属(muscodorsp.)。在另一个实施例中,组合物还可以与以下中的一或多种组合使用(如在组合混合物中,或同时或依序施用):3-(4-氯-2,6-二甲基苯基)-4-羟基-8-氧杂-1-氮杂螺[4,5]癸-3-烯-2-酮;3-(4'-氯-2,4-二甲基[1,1'-联二苯]-3-基)-4-羟基-8-氧杂-1-氮杂螺-[4,5]癸-3-烯-2-酮;4-[[(6-氯-3-吡啶基)甲基]甲氨基]-2(5h)-呋喃酮;4-[[(6-氯-3-吡啶基)甲基]环丙基氨基]-2(5h)-呋喃酮;3-氯-n2-[(1s)-1-甲基-2-(甲磺酰基)乙基]-n1-[2-甲基-4-[1,2,2,2-四氟-1-(三氟甲基)乙基]苯基]-1,2-苯二甲酰胺;2-氰基-n-乙基-4-氟-3-甲氧基-苯磺酰胺;2-氰基-n-乙基-3-甲氧基-苯磺酰胺;2-氰基-3-二氟甲氧基-n-乙基-4-氟-苯磺酰胺;2-氰基-3-氟甲氧基-n-乙基-苯磺酰胺;2-氰基-6-氟-3-甲氧基-n,n-二甲基-苯磺酰胺;2-氰基-n-乙基-6-氟-3-甲氧基-n-甲基-苯磺酰胺;2-氰基-3-二氟甲氧基-n,n-二甲基苯磺酰胺;3-(二氟甲基)-n-[2-(3,3-二甲基丁基)苯基]-1-甲基-1h-吡唑-4-甲酰胺;n-乙基-2,2-二甲基丙酰胺-2-(2,6-二氯-α,α,α-三氟-对甲苯基)腙;n-乙基-2,2-二氯-1-甲基环丙烷-甲酰胺-2-(2,6-二氯-α,α,α-三氟-对甲苯基)腙烟碱;硫代碳酸o-{(e-)-[2-(4-氯-苯基)-2-氰基-1-(2-三氟甲基苯基)-乙烯基]}酯s-甲酯;(e)-n1-[(2-氯-1,3-噻唑-5-基甲基)]-n2-氰基-n1-甲基乙脒;1-(6-氯吡啶-3-基甲基)-7-甲基-8-硝基-1,2,3,5,6,7-六氢-咪唑并[1,2-a]吡啶-5-醇;甲磺酸4-[4-氯苯基-(2-亚丁基-亚肼基)甲基)]苯基酯;及n-乙基-2,2-二氯-1-甲基环丙烷甲酰胺-2-(2,6-二氯-α,α,α-三氟-对甲苯基)腙。在本公开中,以下表面活性剂可以与上文所提及的微生物发酵物一起使用以促进乳化、分散、溶解和渗透。非离子型表面活性剂的非限制性实例包括脱水山梨糖醇脂肪酸酯、聚氧化烯脱水山梨糖醇脂肪酸酯、聚氧化烯脂肪酸酯、甘油脂肪酸酯、聚氧化烯甘油脂肪酸酯、聚甘油脂肪酸酯、聚氧化烯聚甘油脂肪酸酯、蔗糖脂肪酸酯、树脂酸酯、聚氧化烯树脂酸酯、聚氧化烯烷基醚、聚氧化烯烷基苯基醚、烷基(多)糖苷和聚氧化烯烷基(多)糖苷。优选地,可以使用不具有氮原子的含有醚基的非离子型表面活性剂和含有酯基的非离子型表面活性剂。阴离子型表面活性剂的非限制性实例包括羧酸、磺酸、含有硫酸酯基的表面活性剂和含有磷酸酯基的表面活性剂,以及含有羧酸和磷酸酯基的表面活性剂。羧酸表面活性剂的非限制性实例包括具有6-30个碳原子的脂肪酸或其盐、多羟基羧酸盐、聚氧化烯烷基醚羧酸盐、聚氧化烯烷基酰胺醚羧酸盐、洛定酸(rhodinicacid)盐、二聚酸盐、聚合物酸盐和松油脂肪酸盐。磺酸表面活性剂的非限制性实例包括烷基苯磺酸盐、烷基磺酸盐、烷基萘磺酸盐、萘磺酸盐、联苯基醚磺酸盐、烷基萘磺酸的缩合物和萘磺酸的缩合物。含有硫酸酯基的表面活性剂的非限制性实例包括烷基硫酸酯盐(烷基硫酸盐)、聚氧化烯烷基硫酸酯盐(聚氧化烯烷基硫酸盐)、聚氧化烯烷基苯基醚硫酸盐、三苯乙烯化酚硫酸酯盐、聚氧化烯二苯乙烯化酚硫酸酯盐和烷基多糖苷硫酸盐。含有磷酸酯基的表面活性剂的非限制性实例包括烷基磷酸酯盐、烷基苯基磷酸酯盐、聚氧化烯烷基磷酸酯盐和聚氧化烯烷基苯基磷酸酯盐。盐的非限制性实例包括金属盐(如na、k、ca、mg和zn的盐)、铵盐、烷醇胺盐和脂肪族胺盐。两性表面活性剂的非限制性实例包括含有氨基酸基团、含有甜菜碱基团、含有咪唑啉基团和含有氧化胺基团的表面活性剂。含有氨基酸基团的表面活性剂的非限制性实例包括酰基氨基酸盐、酰基肌氨酸盐、丙烯酰基甲基氨基丙酸盐、烷基氨基丙酸盐和酰基酰胺乙基羟基乙基甲基羧酸盐。含有甜菜碱基团的表面活性剂的非限制性实例包括烷基二甲基甜菜碱、烷基羟基乙基甜菜碱、酰基酰胺丙基羟基丙基氨磺基甜菜碱、酰基酰胺丙基羟基丙基氨磺基甜菜碱和蓖麻醇酸酰胺丙基二甲基羧基甲基氨甜菜碱。含有咪唑啉基团的表面活性剂的非限制性实例包括烷基羧基甲基羟基乙基咪唑啉甜菜碱和烷基乙氧基羧基甲基咪唑啉甜菜碱。含有氧化胺基团的表面活性剂的非限制性实例包括氧化烷基二甲基胺、氧化烷基二乙醇胺和氧化烷基酰胺丙基胺。可以使用一种类型的上文所提及的表面活性剂,并且可以使用两种或超过两种类型的上文所提及的表面活性剂的混合物。在这些表面活性剂中的一种包含聚氧化烯基团的情况下,所述聚氧化烯基团可以是聚氧化乙烯基并且所添加的聚氧化乙烯基团的平均摩尔数可以是1到50。作为表面活性剂,可以使用至少一种选自含有酯基的非离子型表面活性剂、不具有氮原子的含有醚基的非离子型表面活性剂、两性表面活性剂、羧酸阴离子型表面活性剂和磷酸阴离子型表面活性剂的化合物。以下肥料组分可以与上文所提及的微生物发酵物一起使用。其具体实例可以是无机或有机化合物,其可以提供如n、p、k、ca、mg、s、b、fe、mn、cu、zn、mo、cl、si和na的元素,尤其n、p、x、ca和mg。这类无机化合物的实例包括硝酸铵、硝酸钾、硫酸铵、氯化铵、磷酸铵、硝酸钠、尿素、碳酸铵、磷酸钾、过磷酸钙、融合磷酸盐肥料(3mgo.cao.p2o5.3casio2)、硫酸钾、氯化钾、石灰的硝酸盐、熟石灰、石灰的碳酸盐、硫酸镁、氢氧化镁和碳酸镁。有机化合物的实例包括飞禽粪便、牛粪、树皮堆肥、氨基酸、蛋白胨、氨基酸溶液、发酵提取物、有机酸(如柠檬酸、葡萄糖酸和丁二酸)的钙盐以及脂肪酸(如甲酸、乙酸、丙酸、辛酸、癸酸和己酸)的钙盐。这些肥料组分可以与表面活性剂一起使用。在肥料组分以基础肥料形式向土壤中充分施用的情况下,如在水稻植物或蔬菜的户外栽培中所见,不必混合肥料组分。实例本文所阐述的组合物及方法将在以下非限制性实例中进行进一步说明。实例仅是说明各种实施例,而不在本文所列举的材料、条件、重量比、工艺参数等方面对所主张的发明进行限制。实例1.球孢白僵菌o379(nrrl-67406)是一种真菌,其作为羊角月牙藻(pesudokirchnneriellasubcapitata)上的初始命中者(initialhit)被发现,并且其活性在羊角月牙藻和莱茵衣藻(chamydomonasreinhardtii)两者上得到验证。微生物由其its序列识别为球孢白僵菌o379(nrrl-67406)。球孢白僵菌o379(nrrl-67406)具有经验证命中的任何除藻剂的最广泛活性。其对已用其进行筛选的所有物种均具有活性,并且其对除了铜绿微囊藻以外的所有物种的活性均大于75%。然而,在表1中所示,球孢白僵菌o379(nrrl-67406)的lc50在某种程度上高于其他热门命中者,确切地说对于绿藻类较高。当在模拟受藻类侵扰的水稻田的系统中进行测试时,球孢白僵菌o379(nrrl-67406)对鱼腥藻属具有中等控制,但对总体叶绿素a含量无控制。表1球孢白僵菌o379(nrrl-67406)抗菌谱和lc50概述已分离出球孢白僵菌o379(nrrl-67406),并且筛选和识别为最早成功者。活性在莱茵衣藻上得到验证。初始筛选通过以下来进行:在48孔培养板中向750μl对数早期羊角月牙藻或莱茵衣藻培养物(分别使用布里斯托氏培养基(bristol'smedium)或改良型博尔德3n培养基(modifiedbold3nmedium),ph6.2)中给予100μl无细胞上清液。每次处理对两个孔进行给予。将培养板在全谱荧光灯下培育三天。通过对每一孔测量叶绿素a的荧光(ex:440nm,em:680mn)来对在羊角月牙藻上筛选的分离株进行评分。与未经处理的对照物相比得到叶绿素a减少75%的任何分离株均被视为成功者。通过比较经过处理的孔与未经处理的孔来对在莱茵衣藻上筛选的分离株进行目测评分。引起孔所表现出的绿色比未经处理的孔浅75%的分离株被视为成功者。识别微生物物种.使用qigendneasy植物微型试剂盒从球孢白僵菌o379(nrrl-67406)中提取dna。在次日使用its1和its4引物来执行pcr扩增。确认在琼脂糖凝胶上存在条带,并且使用mobioultracleanpcr净化试剂盒来净化pcr反应物,并且将其送到戴维斯测序公司(davissequencing)。使用bioedit对序列进行比对,并且在blast核苷酸数据库上检索所得共同序列。微生物识别为球孢白僵菌o379(nrrl-67406)。抗菌谱测试.微藻类.在广谱藻类物种上测试球孢白僵菌o379(nrrl-67406)。作为抗菌谱测试的一部分,在从v8培养基移动到mbi-1培养基(m1)之后,在羊角月牙藻上测试球孢白僵菌o379(nrrl-67406)。球孢白僵菌o379(nrrl-67406)具有在验证成功的任一除藻剂中的最广谱活性。其对已用其进行测试的所有物种均具有活性,但在表2中所示,其对铜绿微囊藻的活性均小于75%抑制。表2球孢白僵菌o379(nrrl-67406)对微藻类的抗菌谱活性对微藻物种的抗菌谱测试以与在羊角月牙藻上进行的初始筛选极类似的方式进行。测试在48孔培养板中,通过向750μl藻类培养物中给予100μl无细胞上清液来进行。并非初始测试后接两次验证,而是并行测试两个单独发酵物用于抗菌谱测试。如果对于每一发酵物均发现大于75%抑制,那么分离株被视为对所述抗菌谱物种“具有活性”。如果发酵中的一个或两个得到介于50%与75%之间的抑制,那么分离株被视为对所述抗菌谱物种“在某种程度上具有活性”。大藻类.在两种大藻类物种水绵属和轮藻属上测试球孢白僵菌o379(nrrl-67406)。对测试进行目测评分。在轮藻属上测试发酵物,并且4或高于4的得分被视为具有活性。在表3中所示,一个发酵物一试四份进行水绵属测试。在表4中所示,四份重复试验中的至少三个必须展示强活性以被视为成功者。表3球孢白僵菌o379(nrrl-67406)对轮藻属的抗菌谱活性表4球孢白僵菌o379(nrrl-67406)对水绵属的抗菌谱活性得分活性水绵属++++具有活性对轮藻属的抗菌谱测试通过以下来执行:将轮藻的小枝放置在含有9毫升贻贝水和1ml无细胞上清液的15mlfalcon管中。在五天之后,对管进行目测评分。均匀地黄色或褐色化的小枝评分为“2”,部分地黄色或褐色化的小枝评分为“1”,并且健康的小枝评分为“0”。对每一样品测试三份重复试验。将三个得分加在一起。得分为“4”或大于4被视为“具有活性”。得分为“3”被视为“在某种程度上具有活性”。对水绵属仅测试一个发酵物。将水绵的小束转移到48孔培养板中的750μlerem培养基中,接着向培养板给予100μl无细胞上清液,每次处理进行四份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。如果在四份重复试验中的三个中所有小束死亡,那么分离株被视为具有活性。剂量反应.测定球孢白僵菌o379(nrrl-67406)无细胞上清液的各种剂量反应。在图1和图2中所示,使用96孔培养板来执行微藻类剂量反应。在表5和表6中所示,在48孔培养板(水绵属)中或在15mlfalcon离心管(轮藻属)中执行大藻类剂量反应。表5:在48孔培养板中,球孢白僵菌o379(nrrl-67406)对水绵属的剂量反应表6:在15ml管中,球孢白僵菌o379(nrrl-67406)对轮藻属的剂量反应微藻类剂量反应在96孔培养板中执行,其中对250μl对数早期藻类培养物给予各种体积的球孢白僵菌o379(nrrl-67406)无细胞上清液。对每一体积,对两个孔进行给予。将分析物在荧光灯下培育三天。通过将200μl从每一孔转移到黑色96孔培养板中,接着在微板读数仪中读取叶绿素a的荧光(ex:440nm,em:680nm)来对分析物进行评分。通过比较经过处理的孔的相对荧光单位与未经处理的孔的相对荧光单位来计算抑制%。对轮藻属的剂量反应通过以下来执行:将轮藻的小枝放置在含有球孢白僵菌o379(nrrl-67406)无细胞上清液于贻贝水中的各种稀释液的15mlfalcon管中。每次处理进行两份重复试验。在五天之后,对管进行目测评分。对水绵属的剂量反应在48孔培养板中进行。将水绵的小束转移到48孔培养板中的750μlerem培养基中,并且接着向培养板给予各种体积的无细胞上清液,每次处理进行两份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。其中所有细胞死亡的孔评分为“+”,其中一些细胞死亡并且一些存活的孔评分为“+/-”,而具有健康小束的孔评分为“-”。水稻藻类分析.在意图模拟水稻田中藻类侵扰的生物分析中测试球孢白僵菌o379(nrrl-67406)。分析在容纳有具有水稻的小罐的透明塑料杯中进行。用100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的混合培养物填充所述杯。用5ml(5%v/v)球孢白僵菌o379(nrrl-67406)无细胞上清液处理所述杯,并且在灯下培育总计14天。在处理之后第4、7和14天,对所述杯中叶绿素a(存在于所有藻类物种中)和藻蓝蛋白(仅存在于蓝藻细菌中)的荧光进行评分。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。表7:水稻藻类分析中叶绿素a和藻蓝蛋白的抑制%球孢白僵菌o379(nrrl-67406)在第四天使鱼腥藻属之生长抑制大致75%,并且在第7天抑制大致60%。然而,总叶绿素a在两天均增加。到第14天为止,色素浓度的变化在重复试验之间不一致。在任一经过处理的植物中均未发现负面影响。混合藻类培养物通过以下来加以制备:将1.6升1/8霍兰德氏培养基(hoagland'smedium)与100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的成熟培养物中的每一种组合。将100ml培养物添加到容纳有具有在粘土聚集土壤中生长的两周龄水稻(oryzasativa)的5.5×5.5cm罐的透明塑料杯中。用5ml球孢白僵菌o379(nrrl-67406)处理两个杯,用1ppm铜(来自pondmaster水域除藻剂)处理两个杯,并且三个杯未经处理。将杯在全谱灯下培育总计14天。在处理之后第4、7和14天,使用分光光度计对杯中叶绿素a和藻蓝蛋白的荧光进行评分。用移液管将三毫升培养物样品移取到侧面透明的塑料比色皿中,并且对于叶绿素a在ex:440nm,em:680nm下,而对于藻蓝蛋白在ex:630nm,ex:660nm下读取荧光。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。实例2.发现短短芽孢杆菌hnym3,o989(nrrl-b67408)在莱茵衣藻上验证成功,并且通过16srrna识别为短短芽孢杆菌hnym3,o989(nrrl-b67408)。在广谱藻类物种上测试短短芽孢杆菌hnym3,o989(nrrl-b67408)的经过发酵的上清液,并且发现其具有极广谱活性。所测试的物种中所述短短芽孢杆菌不具有活性的唯一物种是绿藻类四尾栅列藻。其对除弱细颤藻以外的所有剩余物种的活性均大于75%。在表8中所示,短短芽孢杆菌hnym3,o989(nrrl-b67408)的lc50适当地较低。当在模拟受藻类侵扰的水稻田的系统中进行测试时,短短芽孢杆菌hnym3,o989(nrrl-b67408)无表现,在处理之后四和七天时,叶绿素a含量无明显变化,而藻蓝蛋白含量明显增加。这表明短短芽孢杆菌hnym3,o989(nrrl-b67408)在这一测试中促进鱼腥藻属生长,尽管已发现其在低剂量下活体外控制同一物种。表8:短芽孢杆菌hnym3,o989(nrrl-b67408)抗菌谱和lc50概述从土壤中分离并且从v8琼脂中选取出短白僵菌hnym3,o989(nrrl-b67408),并且在v8培养基中生长以用于初始筛选。短白僵菌hnym3,o989(nrrl-b67408)识别为最早在莱茵衣藻上成功,并且其活性得到验证。初始筛选通过以下来进行:在48孔培养板中向750μl对数早期莱茵衣藻培养物(改良型博尔德3n培养基,ph6.2)中给予100μl无细胞上清液。每次处理对两个孔进行给予。将培养板在全谱荧光灯下培育三天。通过比较经过处理的孔与未经处理的孔来对在莱茵衣藻上筛选的分离株进行目测评分。引起孔所表现出的绿色比未经处理的孔浅75%的分离株被视为成功者。识别微生物物种名称.在3/12/2012使用mobioultraclean微生物dna分离试剂盒从短白僵菌hnym3,o989(nrrl-b67408)中提取dna,并且在次日使用fd1/rd1引物来执行pcr。使用mobioultracleanpcr净化试剂盒来纯化pcr产物,并且将其提交到戴维斯测序公司。使用bioedit来组装共同序列,并且在blast核苷酸数据库和eztaxon中进行检索。微生物识别为短短芽孢杆菌hnym3,o989(nrrl-b67408)。抗菌谱测试.微藻类.在广谱藻类物种上测试短白僵菌hnym3,o989(nrrl-b67408)。四尾栅列藻是所述短白僵菌不具有活性的唯一物种,并且在剩余物种中,弱细颤藻是所述短白僵菌的控制低于75%的唯一物种。表9:短白僵菌hnym3,o989(nrrl-b67408)对微藻类的抗菌谱活性对微藻物种的抗菌谱测试以与在羊角月牙藻上进行的初始筛选极类似的方式进行。测试在48孔培养板中,通过向750μl藻类培养物中给予100μl无细胞上清液来进行。并非初始测试后接两次验证,而是并行测试两个单独发酵物用于抗菌谱测试。如果对于每一发酵物均发现大于75%抑制,那么分离株被视为对所述抗菌谱物种“具有活性”。如果发酵中的一个或两个得到介于50%与75%之间的抑制,那么分离株被视为对所述抗菌谱物种“在某种程度上具有活性”。大藻类.在两种大藻类物种水绵属和轮藻属上测试短白僵菌hnym3,o989(nrrl-b67408)。对测试进行目测评分。在轮藻属上测试发酵物,并且4或高于4的得分被视为具有活性。一个发酵物一试四份进行水绵属测试。四份重复试验中的至少三个必须展示强活性以被视为成功者。表10:短白僵菌hnym3,o989(nrrl-b67408)对轮藻属的抗菌谱活性表11:短白僵菌hnym3,o989(nrrl-b67408)对水绵属的抗菌谱活性得分活性水绵属++++具有活性对轮藻属的抗菌谱测试通过以下来执行:将轮藻的小枝放置在含有9毫升贻贝水和1毫升无细胞上清液的15毫升falcon管中。在五天之后,对管进行目测评分。均匀地黄色或褐色化的小枝评分为“2”,部分地黄色或褐色化的小枝评分为“1”,并且健康的小枝评分为“0”。对每一样品测试三份重复试验。将三个得分加在一起。得分为“4”或大于4被视为“具有活性”。得分为“3”被视为“在某种程度上具有活性”。对水绵属仅测试一个发酵物。将水绵的小束转移到48孔培养板中的750μlerem培养基中,接着向培养板给予100μl无细胞上清液,每次处理进行四份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。如果在四份重复试验中的三个中小束死亡,那么分离株被视为具有活性。剂量反应.测定短白僵菌hnym3,o989(nrrl-b67408)无细胞上清液的各种剂量反应。使用96孔培养板来执行微藻类剂量反应。(图3和图4)在48孔培养板(水绵属)中或在15mlfalcon离心管(轮藻属)中执行大藻类剂量反应。(表12和表13)表12:在48孔培养板中,短白僵菌hnym3,o989(nrrl-b67408)对水绵属的剂量反应表13:在15ml管中,短白僵菌hnym3,o989(nrrl-b67408)对轮藻属的剂量反应微藻类剂量反应在96孔培养板中执行,其中对250μl对数早期藻类培养物给予各种体积的短白僵菌hnym3,o989(nrrl-b67408)无细胞上清液。对每一体积,对两个孔进行给予。将分析物在荧光灯下培育三天。通过将200μl从每一孔转移到黑色96孔培养板中,接着在微板读数仪中读取叶绿素a的荧光(ex:440nm,em:680nm)来对分析物进行评分。通过比较经过处理的孔的相对荧光单位与未经处理的孔的相对荧光单位来计算抑制%。对轮藻属的剂量反应通过以下来执行:将轮藻的小枝放置在含有球孢白僵菌o379(nrrl-67406)无细胞上清液于贻贝水中的各种稀释液的15mlfalcon管中。每次处理进行两份重复试验。在五天之后,对管进行目测评分。对水绵属的剂量反应在48孔培养板中进行。将水绵的小束转移到48孔培养板中的750μlerem培养基中,并且接着向培养板给予各种体积的无细胞上清液,每次处理进行两份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。其中所有细胞死亡的孔评分为“+”,其中一些细胞死亡并且一些存活的孔评分为“+/-”,而具有健康小束的孔评分为“-”。水稻藻类分析.在意图模拟水稻田中藻类侵扰的生物分析中测试短白僵菌hnym3,o989(nrrl-b67408)。分析在容纳有具有水稻的小罐的透明塑料杯中进行。用100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的混合培养物填充所述杯。用5ml(5%v/v)短白僵菌hnym3,o989(nrrl-b67408)无细胞上清液处理所述杯,并且在灯下培育总计14天。在第4、7和14天,对所述杯中叶绿素a(存在于所有藻类物种中)和藻蓝蛋白(仅存在于蓝藻细菌中)的荧光进行评分。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。(表14)表14:水稻藻类分析中叶绿素a和藻蓝蛋白的抑制%对于三个时间点中的任一个,未发现叶绿素a明显减少。在处理之后第4和7天,对于两个重复试验,藻蓝蛋白水平均增加。在任一重复试验中均未发现对水稻植物的负面影响。混合藻类培养物通过以下来加以制备:将1.6l1/8霍兰德氏培养基与100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的成熟培养物中的每一种组合。将100ml培养物添加到容纳有具有在粘土聚集土壤中生长的两周龄水稻的5.5×5.5cm罐的透明塑料杯中。用5mlo989处理两个杯,用1ppm铜(来自pondmaster水域除藻剂)处理两个杯,并且三个杯未经处理。将杯在全谱灯下培育总计14天。在处理之后第4、7和14天,使用分光光度计对杯中叶绿素a和藻蓝蛋白的荧光进行评分。用移液管将三毫升培养物样品移取到侧面透明的塑料比色皿中,并且对于叶绿素a在ex:440nm,em:680nm下,而对于藻蓝蛋白在ex:630nm,ex:660nm下读取荧光。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。实例3.发现孢淡灰链霉菌f18,p842(nrrl-b67410)在莱茵衣藻上验证成功,并且通过16srrna分析识别为淡紫灰链霉菌(streptomyceslavendulae)家族的成员,其中最接近的物种匹配是孢淡灰链霉菌f18,p842(nrrl-b67410)与野尻链霉菌(streptomycesnorjiriensis)。发现其对代表性微藻类和大藻类物种具有广谱活性,仅对四尾栅列藻和弱细颤藻不具有活性。尽管在发酵物之间存在一定不一致性,但孢淡灰链霉菌f18,p842(nrrl-b67410)在极低浓度下对一些藻类具有活性;0.05%v/v的p842剂量可以得到对莱茵衣藻的99%控制。在意图模拟受藻类侵扰的水稻田的测试中,在处理之后七天时,孢淡灰链霉菌f18,p842(nrrl-b67410)对叶绿素a的抑制比1ppm铜更大,但存在蓝绿藻类色素藻蓝蛋白增加,表明鱼腥藻属的生长得到促进。表15:孢淡灰链霉菌f18,p842(nrrl-b67410)抗菌谱和lc50概述从土壤中分离出孢淡灰链霉菌f18,p842(nrrl-b67410)。从r2a琼脂中选取出放线菌,并且经过发酵以用于筛选。链霉菌属q004(nrrl-67409)识别为最早在莱茵衣藻上成功,并且其活性得到验证。初始筛选通过以下来进行:在48孔培养板中向750μl对数早期莱茵衣藻培养物(改良型博尔德3n培养基,ph6.2)中给予100μl无细胞上清液。每次处理对两个孔进行给予。将培养板在全谱荧光灯下培育三天。与未经处理的对照物相比得到叶绿素a减少75%的任何分离株均被视为成功者。通过比较经过处理的孔与未经处理的孔来对在莱茵衣藻上筛选的分离株进行目测评分。引起孔所表现出的绿色比未经处理的孔浅75%的分离株被视为成功者。识别微生物物种.使用mobioultraclean微生物dna分离试剂盒从孢淡灰链霉菌f18,p842(nrrl-b67410)中提取dna,并且在同一天使用fd1/rd1引物来执行pcr。使用mobioultracleanpcr净化试剂盒来纯化pcr产物,并且将其送到戴维斯测序公司。在bioedit中构筑共同序列,并且在blast核苷酸数据库和eztaxon上进行检索。孢淡灰链霉菌f18,p842(nrrl-b67410)识别为淡紫灰链霉菌家族的成员,其中最接近的匹配是孢淡灰链霉菌f18,p842(nrrl-b67410)和野尻链霉菌。抗菌谱测试.微藻类.在广谱微藻物种上测试孢淡灰链霉菌f18,p842(nrrl-b67410)。其具有中等广谱活性,其中对羊角月牙藻、鱼腥藻属和铜绿微囊藻的活性强。其在某种程度上对硅藻舟形藻属具有活性。其对四尾栅列藻或弱细颤藻不具有活性。表16:孢淡灰链霉菌f18,p842(nrrl-b67410)对微藻类的抗菌谱活性对微藻物种的抗菌谱测试以与在羊角月牙藻上进行的初始测试极类似的方式进行。测试在48孔培养板中,通过向750μl藻类培养物中给予100μl无细胞上清液来进行。并非初始测试后接两次验证,而是并行测试两个单独发酵物用于抗菌谱测试。如果对于每一发酵物均发现大于75%抑制,那么分离株被视为对所述抗菌谱物种“具有活性”。如果发酵中的一个或两个得到介于50%与75%之间的抑制,那么分离株被视为对所述抗菌谱物种“在某种程度上具有活性”。大藻类.在两种大藻类物种水绵属和轮藻属上测试链霉菌属q004(nrrl-67409)。对测试进行目测评分。在轮藻属上测试发酵物,并且4或高于4的得分被视为具有活性。一个发酵物一试四份进行水绵属测试。四份重复试验中的至少三个必须展示强活性以被视为成功者。表17:孢淡灰链霉菌f18,p842(nrrl-b67410)对轮藻属的抗菌谱活性表18:孢淡灰链霉菌f18,p842(nrrl-b67410)对水绵属的抗菌谱活性得分活性水绵属++++具有活性对轮藻属的抗菌谱测试通过以下来执行:将轮藻的小枝放置在含有9ml贻贝水和1ml无细胞上清液的15mlfalcon管中。在五天之后,对管进行目测评分。均匀地黄色或褐色化的小枝评分为“2”,部分地黄色或褐色化的小枝评分为“1”,并且健康的小枝评分为“0”。对每一样品测试三份重复试验。将三个得分加在一起。得分为“4”或大于4被视为“具有活性”。得分为“3”被视为“在某种程度上具有活性”。对水绵属仅测试一个发酵物。将水绵的小束转移到48孔培养板中的750μlerem培养基中,接着向培养板给予100μl无细胞上清液,每次处理进行四份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。如果在四份重复试验中的三个中小束死亡,那么分离株被视为具有活性。剂量反应.测定孢淡灰链霉菌f18,p842(nrrl-b67410)无细胞上清液的各种剂量反应。使用96孔培养板来执行微藻类剂量反应。(图5和图6)在48孔培养板(水绵属)中或在15mlfalcon离心管(轮藻属)中执行大藻类剂量反应。(表19和表20)表19:在48孔培养板中,孢淡灰链霉菌f18,p842(nrrl-b67410)对水绵属的剂量反应表20:在15ml管中,孢淡灰链霉菌f18,p842(nrrl-b67410)对轮藻属的剂量反应微藻类剂量反应在96孔培养板中执行,其中对250μl对数早期藻类培养物给予各种体积的链霉菌属q004(nrrl-67409)无细胞上清液。对每一体积,对两个孔进行给予。将培养板在荧光灯下培育三天。通过将200μl从每一孔转移到黑色96孔培养板中,接着在微板读数仪中读取叶绿素a的荧光(ex:440nm,em:680nm)来对分析物进行评分。通过比较经过处理的孔的相对荧光单位与未经处理的孔的相对荧光单位来计算抑制%。对轮藻属的剂量反应通过以下来执行:将轮藻的小枝放置在含有孢淡灰链霉菌f18,p842(nrrl-b67410)无细胞上清液于贻贝水中的各种稀释液的15mlfalcon管中。每次处理进行两份重复试验。在五天之后,对管进行目测评分。对水绵属的剂量反应在48孔培养板中进行。将水绵的小束转移到48孔培养板中的750μlerem培养基中,并且接着向培养板给予各种体积的无细胞上清液,每次处理进行两份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。其中所有细胞死亡的孔评分为“+”,其中一些细胞死亡并且一些存活的孔评分为“+/-”,而具有健康小束的孔评分为“-”。水稻藻类分析.在意图模拟水稻田中藻类侵扰的生物分析中测试孢淡灰链霉菌f18,p842(nrrl-b67410。分析在容纳有具有水稻的小罐的透明塑料杯中进行。用100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的混合培养物填充所述杯。用5ml(5%v/v)链霉菌属q004(nrrl-67409)无细胞上清液处理所述杯,并且在灯下培育总计14天。在处理之后第4、7和14天,对所述杯中叶绿素a(存在于所有藻类物种中)和藻蓝蛋白(仅存在于蓝藻细菌中)的荧光进行评分。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。表21:水稻藻类分析中叶绿素a和藻蓝蛋白的抑制%在第4天,对叶绿素a的控制在重复试验之间不一致,但在一个杯中的抑制仍超过50%。在第7天,对叶绿素a的控制一致,为约64%抑制,然而,藻蓝蛋白增加。这表明蓝绿藻类物种鱼腥藻属的含量增加,但总藻类含量降低。这与铜极大地不同,对于铜,在第7天叶绿素a含量几乎不变化,但藻蓝蛋白减少巨大。混合藻类培养物通过以下来加以制备:将1.6l1/8霍兰德氏培养基与100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的成熟培养物中的每一种组合。将100ml培养物添加到容纳有具有在粘土聚集土壤中生长的两周龄水稻的5.5×5.5cm罐的透明塑料杯中。用5ml孢淡灰链霉菌f18,p842(nrrl-b67410)处理两个杯,用1ppm铜(来自pondmaster水域除藻剂)处理两个杯,并且三个杯未经处理。将杯在全谱灯下培育总计14天。在第4、7和14天,使用分光光度计对杯中叶绿素a和藻蓝蛋白的荧光进行评分。用移液管将3ml培养物样品移取到侧面透明的塑料比色皿中,并且对于叶绿素a在ex:440nm,em:680nm下,而对于藻蓝蛋白在ex:630nm,ex:660nm下读取荧光。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。实例4.发现埃吉类芽孢杆菌sd17,p858(nrrl-b67407)在莱茵衣藻上验证成功,并且识别为埃吉类芽孢杆菌sd17,p858(nrrl-b67407)。在广谱藻类物种上测试分离株,并且发现其具有一般广谱活性。埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对除了四尾栅列藻和弱细颤藻以外的所有所测试物种均具有活性。当进行抗菌谱测试时,发现埃吉类芽孢杆菌sd17,p858(nrrl-b67407)在12%v/v剂量下对羊角月牙藻的抑制小于75%,然而,在对相同物种的剂量反应中,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)的不同发酵物在低到0.8%v/v剂量下具有95%抑制。这种情况以及发酵物之间对鱼腥藻属的结果变化表明,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)发酵物不太一致,但其上清液仍可能在极低剂量下具有活性。当在被设计成模拟受藻类侵扰的水稻田的系统中进行测试时,在对叶绿素a和藻蓝蛋白的抑制方面,在处理之后第三天和第七天,与其他热门除藻剂成功者中的任一种相比,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)的表现与1ppm铜更类似。表22:埃吉类芽孢杆菌sd17,p858(nrrl-b67407)抗菌谱和lc50概述从苔藓和土壤中分离出埃吉类芽孢杆菌sd17,p858(nrrl-b67407)。在莱茵衣藻上筛选埃吉类芽孢杆菌sd17,p858(nrrl-b67407),并且识别为最早成功者。其活性得到验证。初始筛选通过以下来进行:在48孔培养板中向750μl对数早期莱茵衣藻培养物(改良型博尔德3n培养基,ph6.2)中给予100μl无细胞上清液。每次处理对两个孔进行给予。将培养板在全谱荧光灯下培育三天。与未经处理的对照物相比得到叶绿素a减少75%的任何分离株均被视为成功者。通过比较经过处理的孔与未经处理的孔来对在莱茵衣藻上筛选的分离株进行目测评分。引起孔所表现出的绿色比未经处理的孔浅75%的分离株被视为成功者。识别微生物物种名称.经由使用fd1/rd1引物进行群落pcr来使来自埃吉类芽孢杆菌sd17,p858(nrrl-b67407)的16srrna扩增。将其送到戴维斯测序公司,并且在bioedit中对序列进行比对。在blast核苷酸数据库和eztaxon上检索所得共同序列。微生物识别为埃吉类芽孢杆菌sd17,p858(nrrl-b67407)。抗菌谱测试.微藻类.在广谱藻类物种上测试埃吉类芽孢杆菌sd17,p858(nrrl-b67407)。所得抗菌谱活性是适当地广谱,其中对鱼腥藻属、铜绿微囊藻和舟形藻属具有强活性;对羊角月牙藻具有较弱活性;而对四尾栅列藻或弱细颤藻无活性。表23:埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对微藻类的抗菌谱活性对微藻物种的抗菌谱测试以与在羊角月牙藻上进行的初始筛选极类似的方式进行。测试在48孔培养板中,通过向750μl藻类培养物中给予100μl无细胞上清液来进行。并非初始测试后接两次验证,而是并行测试两个单独发酵物用于抗菌谱测试。如果对于每一发酵物均发现大于75%抑制,那么分离株被视为对所述抗菌谱物种“具有活性”。如果发酵中的一个或两个得到介于50%与75%之间的抑制,那么分离株被视为对所述抗菌谱物种“在某种程度上具有活性”。大藻类.在两种大藻类物种水绵属和轮藻属上测试埃吉类芽孢杆菌sd17,p858(nrrl-b67407)。对测试进行目测评分。在轮藻属上测试一个发酵物,并且4或高于4的得分被视为具有活性。一个发酵物一试四份进行水绵属测试。四份重复试验中的至少三个必须展示强活性以被视为成功者。表24:埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对轮藻属的抗菌谱活性表25:埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对水绵属的抗菌谱活性得分活性水绵属++++具有活性对轮藻属的抗菌谱测试通过以下来执行:将轮藻的小枝放置在含有9ml贻贝水和1ml无细胞上清液的15mlfalcon管中。在五天之后,对管进行目测评分。均匀地黄色或褐色化的小枝评分为“2”,部分地黄色或褐色化的小枝评分为“1”,并且健康的小枝评分为“0”。对每一样品测试三份重复试验。将三个得分加在一起。得分为“4”或大于4被视为“具有活性”。得分为“3”被视为“在某种程度上具有活性”。对水绵属仅测试一个发酵物。将水绵的小束转移到48孔培养板中的750μlerem培养基中,接着向培养板给予100μl无细胞上清液,每次处理进行四份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。如果在四份重复试验中的三个中小束死亡,那么分离株被视为具有活性。剂量反应.测定埃吉类芽孢杆菌sd17,p858(nrrl-b67407)无细胞上清液的各种剂量反应。使用96孔培养板来执行微藻类剂量反应。(图7和图8)在48孔培养板(水绵属)中或在15mlfalcon离心管(轮藻属)中执行大藻类剂量反应。(表26和表27).应注意,在抗菌谱测试期间,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)测定为在12%v/v剂量下仅“在某种程度上具有活性”,但在这一测试中,其在低到0.8%剂量下得到95%抑制。这表明埃吉类芽孢杆菌sd17,p858(nrrl-b67407)的活性在发酵物之间显著变化。表26:在48孔培养板中,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对水绵属的剂量反应表27:在15ml管中,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)对轮藻属的剂量反应微藻类剂量反应在96孔培养板中执行,其中对250μl对数早期藻类培养物给予各种体积的埃吉类芽孢杆菌sd17,p858(nrrl-b67407)无细胞上清液。对每一体积,对两个孔进行给予。将培养板在荧光灯下培育三天。通过将200μl从每一孔转移到黑色96孔培养板中,接着在微板读数仪中读取叶绿素a的荧光(ex:440nm,em:680nm)来对分析物进行评分。通过比较经过处理的孔的相对荧光单位与未经处理的孔的相对荧光单位来计算抑制%。对轮藻属的剂量反应通过以下来执行:将轮藻的小枝放置在含有p858无细胞上清液于贻贝水中的各种稀释液的15mlfalcon管中。每次处理进行两份重复试验。在五天之后,对管进行目测评分。对水绵属的剂量反应在48孔培养板中进行。将水绵的小束转移到48孔培养板中的750μlerem培养基中,并且接着向培养板给予各种体积的无细胞上清液,每次处理进行两份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。其中所有细胞死亡的孔评分为“+”,其中一些细胞死亡并且一些存活的孔评分为“+/-”,而具有健康小束的孔评分为“-”。水稻藻类分析.在意图模拟水稻田中藻类侵扰的生物分析中测试埃吉类芽孢杆菌sd17,p858(nrrl-b67407)。分析在容纳有具有水稻的小罐的透明塑料杯中进行。用100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的混合培养物填充所述杯。用5ml(5%v/v)埃吉类芽孢杆菌sd17,p858(nrrl-b67407)无细胞上清液处理所述杯,并且在灯下培育总计14天。在处理之后第4、7和14天,对所述杯中叶绿素a(存在于所有藻类物种中)和藻蓝蛋白(仅存在于蓝藻细菌中)的荧光进行评分。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。表28:水稻藻类分析中叶绿素a和藻蓝蛋白的抑制%在这一分析中,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)的活性与1ppm铜的活性类似。在处理之后四天时,两者均具有对叶绿素a的大于50%抑制和对藻蓝蛋白的大约大于75%抑制。在第七天,任一除藻剂对叶绿素a均无控制,但继续控制藻蓝蛋白。然而,埃吉类芽孢杆菌sd17,p858(nrrl-b67407)仅获到对蓝藻色素的60%控制,而铜具有大于95%控制。铜在第14天继续控制藻蓝蛋白,而p858的控制在那之前停止。混合藻类培养物通过以下来加以制备:将1.6l1/8霍兰德氏培养基与100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的成熟培养物中的每一种组合。将100ml培养物添加到容纳有具有在粘土聚集土壤中生长的两周龄水稻的5.5×5.5cm罐的透明塑料杯中。用5ml埃吉类芽孢杆菌sd17,p858(nrrl-b67407)处理两个杯,用1ppm铜(来自pondmaster水域除藻剂)处理两个杯,并且三个杯未经处理。将杯在全谱灯下培育总计14天。在处理之后第4、7和14天,使用分光光度计对杯中叶绿素a和藻蓝蛋白的荧光进行评分。用移液管将三毫升培养物样品移取到侧面透明的塑料比色皿中,并且对于叶绿素a在ex:440nm,em:680nm下,而对于藻蓝蛋白在ex:630nm,ex:660nm下读取荧光。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。实例5.链霉菌属q004(nrrl-67409)识别为在莱茵衣藻上验证命中者,并且通过16srrna测序识别为淡紫灰链霉菌家族的成员,很可能是孢淡灰链霉菌或野尻链霉菌。针对广谱藻类物种测试链霉菌属q004(nrrl-67409),并且发现其在某种程度上具有广谱活性。链霉菌属q004(nrrl-67409)对除四尾栅列藻、鱼腥藻属和弱细颤藻以外的所有所测试物种具有活性。虽然这使得分离株的抗菌谱在某种程度上比大部分除藻剂验证命中者更广,但其抗菌谱在前五种热门除藻剂命中者中最窄。另外,链霉菌属q004(nrrl-67409)的lc50对于大部分藻类物种相对较高。在意图模拟受藻类侵扰的水稻田的测试中,在第三天和第七天,链霉菌属q004(nrrl-67409)展现对叶绿素a的一定抑制,但这一活性在重复试验之间不一致。在这一测试中,对于第三天和第七天,链霉菌属q004(nrrl-67409)始终升高蓝藻色素藻蓝蛋白的浓度。表29:链霉菌属q004(nrrl-67409)抗菌谱和lc50概述链霉菌属q004(nrrl-67409)识别为最早在莱茵衣藻上成功,并且其活性得到验证。初始筛选通过以下来进行:在48孔培养板中向750μl对数早期莱茵衣藻培养物(改良型博尔德3n培养基,ph6.2)中给予100μl无细胞上清液。每次处理对两个孔进行给予。将培养板在全谱荧光灯下培育三天。与未经处理的对照物相比得到叶绿素a减少75%的任何分离株均被视为成功者。通过比较经过处理的孔与未经处理的孔来对在莱茵衣藻上筛选的分离株进行目测评分。引起孔所表现出的绿色比未经处理的孔浅75%的分离株被视为成功者。识别微生物物种.使用mobioultraclean微生物dna分离试剂盒从链霉菌属q004(nrrl-67409)中提取dna,并且在同一天使用fd1和rd1引物来执行pcr。使用mobioultracleanpcr净化试剂盒来纯化pcr反应物,并且将其送到戴维斯测序公司。在bioedit中对序列进行比对,并且产生共同序列。在blast核苷酸数据库和eztaxon中检索共同序列。链霉菌属q004(nrrl-67409)识别为淡紫灰链霉菌群组的成员,其中最接近的匹配是孢淡灰链霉菌和野尻链霉菌。抗菌谱测试.微藻类.在广谱微藻物种上测试链霉菌属q004(nrrl-67409)。在五种热门除藻剂成功者中,链霉菌属q004(nrrl-67409)的抗菌谱最窄,其对四尾栅列藻、鱼腥藻属或弱细颤藻不具有活性,并且对舟形藻属的抑制小于75%。表30:q004(nrrl-67409)对微藻类的抗菌谱活性对微藻物种的抗菌谱测试以与在羊角月牙藻上进行的初始测试极类似的方式进行。测试在48孔培养板中,通过向750μl藻类培养物中给予100μl无细胞上清液来进行。并非初始测试后接两次验证,而是并行测试两个单独发酵物用于抗菌谱测试。如果对于每一发酵物均发现大于75%抑制,那么分离株被视为对所述抗菌谱物种“具有活性”。如果发酵中的一个或两个得到介于50%与75%之间的抑制,那么分离株被视为对所述抗菌谱物种“在某种程度上具有活性”。大藻类.在两种大藻类物种水绵属和轮藻属上测试链霉菌属q004(nrrl-67409)。对测试进行目测评分。在轮藻属上测试两个发酵物,并且4或高于4的得分被视为具有活性。一个发酵物一试四份进行水绵属测试。四份重复试验中的至少三个必须展示强活性以被视为成功者。表31:链霉菌属q004(nrrl-67409)对轮藻属的抗菌谱活性表32:链霉菌属q004(nrrl-67409)对水绵属的抗菌谱活性对轮藻属的抗菌谱测试通过以下来执行:将轮藻的小枝放置在含有9ml贻贝水和1ml无细胞上清液的15mlfalcon管中。在五天之后,对管进行目测评分。均匀地黄色或褐色化的小枝评分为“2”,部分地黄色或褐色化的小枝评分为“1”,并且健康的小枝评分为“0”。对每一样品测试三份重复试验。将三个得分加在一起。得分为“4”或大于4被视为“具有活性”。得分为“3”被视为“在某种程度上具有活性”。对水绵属仅测试一个发酵物。将水绵的小束转移到48孔培养板中的750μlerem培养基中,接着向培养板给予100μl无细胞上清液,每次处理进行四份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。如果在四份重复试验中的三个中小束死亡,那么分离株被视为具有活性。剂量反应.测定链霉菌属q004(nrrl-67409)无细胞上清液的各种剂量反应。使用96孔培养板来执行微藻类剂量反应。(图9和图10)在48孔培养板(水绵属)中或在15mlfalcon离心管(轮藻属)中执行大藻类剂量反应。(表33和表34)表33:在48孔培养板中,链霉菌属q004(nrrl-67409)对水绵属的剂量反应表34:在15ml管中,链霉菌属q004(nrrl-67409)对轮藻属的剂量反应微藻类剂量反应在96孔培养板中执行,其中对250μl对数早期藻类培养物给予各种体积的链霉菌属q004(nrrl-67409)无细胞上清液。对每一体积,对两个孔进行给予。将培养板在荧光灯下培育三天。通过将200μl从每一孔转移到黑色96孔培养板中,接着在微板读数仪中读取叶绿素a的荧光(ex:440nm,em:680nm)来对分析物进行评分。通过比较经过处理的孔的相对荧光单位与未经处理的孔的相对荧光单位来计算抑制%。对轮藻属的剂量反应通过以下来执行:将轮藻的小枝放置在含有链霉菌属q004(nrrl-67409)无细胞上清液于贻贝水中的各种稀释液的15mlfalcon管中。每次处理进行两份重复试验。在五天之后,对管进行目测评分。对水绵属的剂量反应在48孔培养板中进行。将水绵的小束转移到48孔培养板中的750μlerem培养基中,并且接着向培养板给予各种体积的无细胞上清液,每次处理进行两份重复试验。在三天之后,对培养板中小束的健康状况进行目测评分。其中所有细胞死亡的孔评分为“+”,其中一些细胞死亡并且一些存活的孔评分为“+/-”,而具有健康小束的孔评分为“-”。水稻藻类分析.在意图模拟水稻田中藻类侵扰的生物分析中测试链霉菌属q004(nrrl-67409)。分析在容纳有具有水稻的小罐的透明塑料杯中进行。用100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的混合培养物填充所述杯。用5ml(5%v/v)链霉菌属q004(nrrl-67409)无细胞上清液处理所述杯,并且在灯下培育总计14天。在处理之后第4、7和14天,对所述杯中叶绿素a(存在于所有藻类物种中)和藻蓝蛋白(仅存在于蓝藻细菌中)的荧光进行评分。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。表35:水稻藻类分析中叶绿素a和藻蓝蛋白的抑制%链霉菌属q004(nrrl-67409)在处理之后第7天和第4天具有对叶绿素a的一定控制,但这在重复试验之间不一致。在第7天和第4天,藻蓝蛋白对于两个重复试验均增加,表明链霉菌属q004(nrrl-67409)刺激鱼腥藻属的生长。混合藻类培养物通过以下来加以制备:将1.6l1/8霍兰德氏培养基与100ml莱茵衣藻、鱼腥藻属、舟形藻属和水绵属的成熟培养物中的每一种组合。将100ml培养物添加到容纳有具有在粘土聚集土壤中生长的两周龄水稻的5.5×5.5cm罐的透明塑料杯中。用5ml链霉菌属q004(nrrl-67409)处理两个杯,用1ppm铜(来自pondmaster水域除藻剂)处理两个杯,并且三个杯未经处理。将杯在全谱灯下培育总计14天。在处理之后第4、7和14天,使用分光光度计对杯中叶绿素a和藻蓝蛋白的荧光进行评分。用移液管将3ml培养物样品移取到侧面透明的塑料比色皿中,并且对于叶绿素a在ex:440nm,em:680nm下,而对于藻蓝蛋白在ex:630nm,ex:660nm下读取荧光。通过比较经过处理的杯与三个未经处理的杯的平均值来计算抑制%。实例概述实例1-5概述于下表中。表36本发明可以在不脱离其精神或本质特征的情况下,以其他形式实施或以其他方式进行。因此,本公开被视为在所有方面均是说明性而非限制性的,并且意图将出现在等效含义及范围内的所有变化包涵于其中。生物材料的寄存以下生物材料已由农业研究培养物寄存中心(agriculturalresearchculturecollection,nrrl)(美国伊利诺伊州61604皮奥里亚市北方大学街1815号(1815n.universitystreet,peoria,illinois61604,usa))根据布达佩斯条约(budapesttreaty)寄存,并且所述生物材料具有以下编号:所述菌株已经在以下条件下进行寄存:确保在本专利申请等待审查期间,由专利商标委员会决定根据37c.f.r.§1.14和35u.s.c.§122所授权的人可以获得培养物。寄存物表示所寄存菌株的基本上纯的培养物。视需要,可以在已申请本申请书的同族专利或其成果的国家根据外国专利法获得寄存物。但是,应理解,存放物的可获得性不构成以废除政府活动所授予的专利权的形式实践本发明的许可。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1