利用淋巴瘤细胞株所构建的免疫缺陷裸鼠模型的制作方法
本申请属于动物肿瘤模型构建技术领域,具体涉及一种利用淋巴瘤细胞株所构建的、可稳定传代的免疫缺陷裸鼠模型及其构建方法的专利申请事宜。
背景技术
动物肿瘤模型的构建,是相关疾病尤其是肿瘤研究中常用研究标本材料之一。其中肿瘤移植瘤模型又因其在抗肿瘤新药的筛选及疗效评估方面具有较大的应用价值,因而是主要的动物肿瘤模型构建目标、构建工作之一。
利用已建立的细胞株或病人肿瘤组织种植于免疫缺陷动物体内,进而构建肿瘤移植瘤模型,是目前常用的肿瘤模型构建方法。但实际应用表明,利用这种构建方法构建实体移植瘤动物模型时较为容易,而针对淋巴瘤动物模型构建时,则存在较为明显的无法稳定传代的技术缺陷。因此目前尚未见到较好的利用特定淋巴瘤细胞株所构建的、可稳定传代的免疫缺陷小鼠模型构建的有关报道。
现有技术中,构建淋巴瘤动物模型时,利用对应方法构建的淋巴瘤动物模型主要有:化学物质诱导型、电离辐射诱发型、癌块移植型以及人源化小鼠模型等。其中用已建立的淋巴瘤细胞株或病人淋巴瘤组织种植于免疫缺陷动物体内建立移植性淋巴瘤模型,是目前研究最多的肿瘤模型,这种模型又可分为两种:同种移植模型和异种移植模型。
受限于构建方法差异,同种移植模型研究及应用范围较为局限,其典型模型为运用鼠源性淋巴瘤细胞株a20接种同源小鼠建立的类似人弥漫性大b细胞淋巴瘤模型。而异种移植则应用较为多见,典型的淋巴瘤细胞株如:人b细胞淋巴瘤细胞株dohh2、fscclbjab、dg75,t细胞淋巴瘤细胞株jurkat,burkitt淋巴瘤细胞株raji和人霍奇金h/rs细胞株l1236、l428、hdlm2、l540、kmh2等,将这些常用的淋巴瘤细胞株移植小鼠后即可构建对应的淋巴细胞瘤小鼠模型。典型工作例如:wagner等(3′-[18f]fluoro-3′-deoxythymidine([18f]-flt)aspositronemissiontomographytracerforimagingproliferationinamurineb-celllymphomamodelandinthehumandisease,cancerresearch,2003)将dohh2细胞株种植于cb-17scid/scid小鼠皮下,植入后3-4周小鼠即长出约2.0g左右的淋巴瘤;再如:邵晓枫等(人b淋巴瘤裸鼠腹腔内移植模型,中国肿瘤临床,2001)接种raji细胞至5周龄左右雌性裸鼠腹腔并连续传代,建立b细胞淋巴瘤腹腔模型。但是需要注意的是,这些淋巴瘤移植瘤模型,或者无详细传代报道,或者并非皮下接种,而系统性的皮下移植瘤模型的构建对于淋巴瘤研究是十分重要的,因而关于这方面的工作仍有必要加强。
技术实现要素:
本申请主要目的在于提供一种利用淋巴瘤细胞株所构建的、可稳定传代的免疫缺陷裸鼠模型的构建方法,从而为相关药物筛选、疗效评估等研究奠定基础。
本申请所采取的技术方案详述如下。
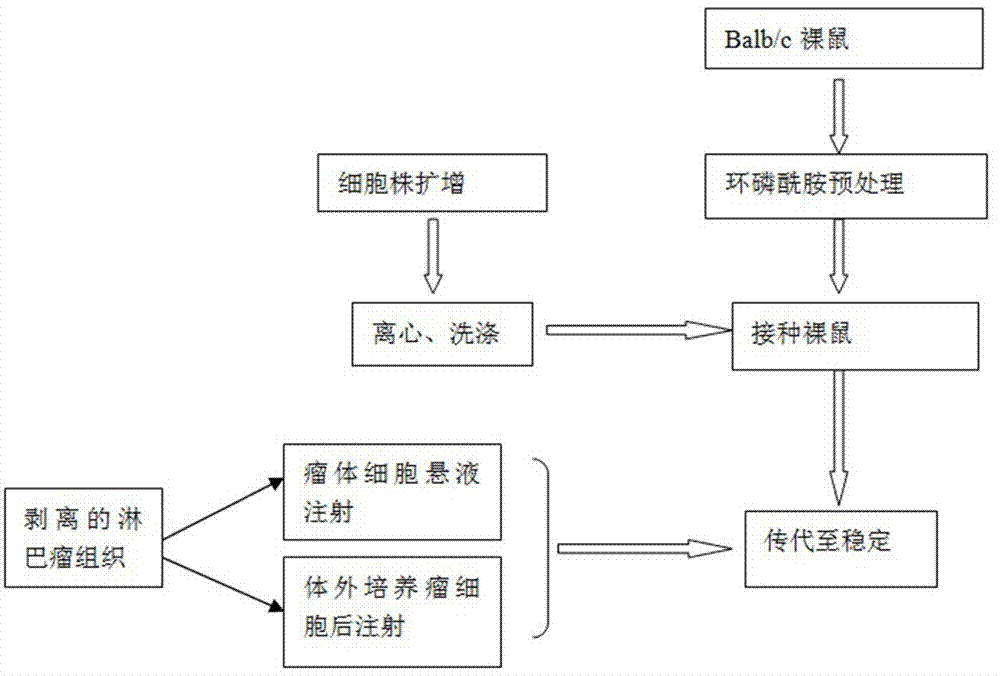
一种利用淋巴瘤细胞株所构建的免疫缺陷裸鼠模型的构建方法,该方法利用nk细胞淋巴瘤细胞株、t细胞淋巴瘤细胞株或b细胞淋巴瘤细胞株构建而成,其主要特点在于皮下接种且可稳定传代,具体构建方法包括如下步骤:
(1)分别对接种对象及淋巴瘤细胞株进行预处理,
接种对象采用免疫缺陷型裸鼠(具体例如为:balb/c裸鼠);
以balb/c裸鼠(裸鼠要求为:3-4周龄、15-20g)为例:接种淋巴瘤细胞前,注射抑制免疫药物,如环磷酰胺;以注射环磷酰胺为例,裸鼠腹腔连续注射环磷酰胺两天,注射量按100mg/kg计(注射液体积按0.2ml计),每天一次;
淋巴瘤细胞株采用nk细胞淋巴瘤细胞株、t细胞淋巴瘤细胞株或b细胞淋巴瘤细胞株;接种当天,按如下方式处理待接种细胞:
将生长状态良好的细胞培养液离心、收集细胞,并用无血清的1640培养液清洗不少于两遍,清洗后1000rpm离心5min收集细胞,再用无血清的1640培养液重悬细胞,调整细胞浓度为:(5~20)×106/200μl;
(2)制备注射液,并注射裸鼠;
将步骤(1)中预处理后淋巴瘤细胞株培养液与基质胶混合均匀,以此作为注射液,制备完成后,皮下注射至裸鼠腋窝;每只裸鼠注射300~500μl注射液(优选注射液体积为400μl);
以体积比计,所述淋巴瘤细胞株培养液与基质胶的比例为1:0.8~1.5;优选比例为1:1,即,以注射液体积为400μl计,每只裸鼠注射200μl的t或b细胞淋巴瘤细胞株培养液与200μl基质胶的混合物;
需要解释的是,实验中发现,随着基质胶用量的适当增加,肿瘤的最终成瘤率及瘤体生长状况虽无明显影响,但由于基质胶影响细胞转移,导致动物体吸收瘤体细胞时间较长,进而影响最终肿瘤大小测定,而当基质胶用量较少时,肿瘤成瘤率虽然也无影响,但肿瘤生长速度明显变慢,因此,对于基质胶用量需要慎重确定最适用量范围。
注射完成后,正常培养裸鼠;
(3)肿瘤细胞传代,待步骤(2)中裸鼠体内肿瘤直径长径达1.0~1.5cm左右成为成熟瘤体后,无菌环境操作剥离瘤块,并剪成小块,在研磨器里研磨分散肿瘤细胞;
与步骤(2)相同,调整细胞浓度后与基质胶混合,注射裸鼠;
需要说明的是,采用将肿瘤组织研磨成悬液方式进行传代,或者将研磨分散后肿瘤细胞培养扩增后再进行传代均可,也可直接将肿瘤组织剪成小块进行接种(但已有实验及经验表明,这种方法成瘤率较低,并不适合实际应用);
注射完成后,正常培养裸鼠,直至肿瘤长出,表明传代成功,此为第一代裸鼠,
重复此传代步骤,在传至不少于5代时,表明可稳定传代的淋巴瘤模型构建成功。
对于所构建的淋巴瘤模型,可结合形态学、流式细胞学以及免疫组化实验,对生长出来的肿瘤以及传代过程中细胞株进行鉴定,以确保传代细胞株及肿瘤模型的构建稳定
利用以上方法所构建的淋巴瘤裸鼠模型,可用于抗淋巴瘤药物筛选、或疗效评估等应用场景。
现有技术中,较少按照常规操作方式将细胞淋巴瘤细胞株接种免疫缺陷裸鼠的报道,其主要原因是:受裸鼠体内外环境和其自身的免疫状况的影响,淋巴瘤细胞接种至裸鼠体内后难以成瘤,且成瘤率低,而即使能长出肿瘤,也不能达到稳定传代,难以进行细胞淋巴瘤体内实验的研究。因而,这一领域一直缺少较好的、突破性的报道。
本申请所提供的利用淋巴瘤细胞株构建淋巴瘤动物模型的构建方法,其利用基质胶的固定作用,可将淋巴瘤细胞固定在皮下,从而保证裸鼠的成瘤率,表现出成瘤快、成瘤率高的技术优势;另一方面,传代过程中,配合相关肿瘤组织培养液的冷冻操作,可随时复苏和直接构建传代用淋巴瘤动物模型。
总体而言,由于本申请所提供构建方法,可较好使动物肿瘤模型稳定传代,从而为相关研究奠定应用基础,因而具有较好的实用价值和推广应用意义。
附图说明
图1为本申请所提供利用细胞淋巴瘤细胞株构建可稳定传代的免疫缺陷裸鼠模型的构建方法的技术路线图;
图2为传代过程中b细胞淋巴瘤生长曲线;其中a为不同代系中dohh2肿瘤生长曲线图,b为不同代系中ly8肿瘤生长曲线图,c为不同代系中raji肿瘤生长曲线图;
图3为对所形成肿瘤组织的形态学观察图;其中上图为生物发光成像显示结果,下图为组织形态学观察结果;
图4为对传代过程中dohh2,ly8以及raji肿瘤组织表面分子表达情况检测结果;
图5为传代过程中不同代系不同肿瘤组织的原位杂交结果;
图6传代过程中不同代系yt肿瘤组织的he染色结果;
图7为传代过程中不同代系yt肿瘤组织免疫组化检测结果;
图8为传代过程中不同代系yt肿瘤组织细胞流式检测结果;
图9为传代过程中不同代系yt肿瘤组织原位杂交结果;
附图中f0表示传代前所形成初始肿瘤代系的裸鼠,f1表示第一代裸鼠,以此类推,f6表示第六代裸鼠,f10表示第十代裸鼠,f12表示第十二代裸鼠。
具体实施方式
下面结合实施例对本申请做进一步的解释说明,在介绍具体实施例前,就下述实施例中涉及部分生物材料、实验设备等情况简要介绍说明如下。
生物材料:
裸鼠:3-4周龄balb/c裸鼠(15-20g左右),购买于北京维通利华实验动物有限公司,在spf级条件下提供无菌饲料和水,饲养1周适应环境后进行相关实验操作;
nk细胞淋巴瘤细胞株:yt(rrid:cvcl_1797)购买于expasy公司;
b细胞淋巴瘤细胞株:dohh2(dsmzno.:acc47)、ly8(rrid:cvcl_8803)、raji(atcc®ccl-86™)等,分别购买于dsmz,expasy,atcc三个公司;
t细胞淋巴瘤细胞株:具体可利用karpas(rrid:cvcl_1324)细胞株(购买于expasy);需要解释的是,利用t细胞淋巴瘤细胞株构建相关模型时,由于部分实验结果尚不够完整和全面,因此下述实施例中并未涉及该部分实验结果。
实验试剂:
环磷酰胺(0.2g规格),江苏盛迪医药有限公司;
无血清1640(500ml规格):gibco公司产品;
基质胶,corning公司产品(类型为高浓度基质胶,货号为354248),需要强调的是,相关操作时注意要在冰上操作,否则基质胶容易凝固;
实验设备:
流式细胞仪facscantotm,bd公司产品。
实施例1
分别以b细胞淋巴瘤dohh2、ly8、raji细胞株为例(dohh2为滤泡细胞淋巴瘤,ly8为弥漫大b细胞淋巴瘤,raji为伯基特细胞淋巴瘤,这三种分别是侵袭性低中高的b细胞淋巴瘤类型),构建了免疫缺陷裸鼠模型,具体构建过程参见图1所示,具体介绍如下。
(1)分别对接种对象及淋巴瘤细胞株进行预处理,
对balb/c裸鼠进行预处理,具体为:接种淋巴瘤细胞前,注射抑制免疫药物环磷酰胺;具体方式为,裸鼠腹腔连续注射环磷酰胺两天,注射量按100mg/kg计(注射液体积按0.2ml计),每天一次;
b细胞淋巴瘤细胞株在接种当天,按如下方式处理:
将生长状态良好的细胞培养液离心、收集细胞,并用无血清的1640培养液清洗不少于两遍,清洗后1000rpm离心5min收集细胞,再用无血清的1640培养液重悬细胞,调整细胞浓度为:5×106/200μl;
(2)制备注射液,并注射裸鼠;
将步骤(1)中预处理后b细胞淋巴瘤细胞株培养液与基质胶按1:1体积比混合均匀,以此作为注射液,制备完成后,皮下注射至裸鼠腋窝;
每只裸鼠注射400μl注射液,即每只裸鼠注射200μl的b细胞淋巴瘤细胞株培养液与200μl基质胶的混合物;
注射完成后,正常培养裸鼠。
(3)肿瘤细胞传代,待步骤(2)中裸鼠体内肿瘤长径达1.0~1.5cm左右后,无菌环境操作剥离瘤块,并剪成小块,在研磨器里研磨分散肿瘤细胞;
与步骤(2)相同,调整细胞浓度后与基质胶混合,注射裸鼠;
注射完成后,正常培养裸鼠,直至肿瘤长出,表明传代成功,此为第一代裸鼠,
重复此传代步骤进行传代,对传代过程中不同代系所形成的肿瘤组织进行检测、分析,以评价所构建模型的稳定性效果。
对传代过程中,不同代系裸鼠肿瘤组织生长情况进行记录,结果如图2所示。从图2中可以看出,随着传代的增加,不同类型肿瘤的生长曲线略有差异,但总体生长趋势保持一致,表明传代效果是较为稳定的。
对所形成肿瘤组织进行形态学观察(需要解释的是,总体上每个代系所形成de肿瘤组织xingtai均较为类似,因此图中仅是第10代结果),结果如图3所示。图3(上图)中,通过生物发光成像结果可以看出,所形成的肿瘤组织无扩散,表明肿瘤组织位置较为固定,进一步的组织形态学观察表明(图3下图):在raji肿瘤及其传代组织中显示伯基特淋巴瘤的形态学特征,细胞较弥漫大b细胞淋巴瘤小,he染色显示肿瘤细胞中等大小,呈圆形,胞质均衡,核仁明显,期间散布自噬细胞,可观察到“星空现象”;而dohh2肿瘤组织的he染色显示:正常结构消失,异质细胞扩散,体积较大,细胞呈圆形或椭圆形,胞质丰富,核仁明显,易见有丝分裂,大细胞数量超过15个/hpf,未见中心细胞,发现中心母细胞片状增殖;在ly-8肿瘤模型的活组织切片he染色表明:结构完全消失和弥漫性非典型淋巴细胞增殖,这表明中,大淋巴细胞与小淋巴细胞和组织细胞混合,大细胞显示丰富的嗜碱性或两性细胞质,不规则的核轮廓和具有单个中心定位核仁的囊泡染色质,存在具有突出的类似霍奇金细胞核仁的散在的扩大的细胞,有丰富的核分裂象、局灶性坏死和凋亡小体。
对传代过程中不同代系的dohh2、ly8以及raji肿瘤组织表面分子表达情况分别进行检测,阳性结果如图4所示,与各类型淋巴瘤特征一致,表明肿瘤组织未发生变异。
需要说明的是,相关表面分子的检测是各种b细胞淋巴瘤诊断所要进行的必要检测,检测结果均支持各种类型淋巴瘤的诊断。
进一步地,发明人对不同代系的dohh2肿瘤组织、raji肿瘤组织、ly8肿瘤组织进行了eb病毒(epstein-barrvirus,ebv)的原位杂交,结果显示(图5所示):ebv在dohh2及ly8各代组织中呈阴性;在raji及其传代组织中ebv呈强阳性表达。
综合上述结果可以看出,所构建肿瘤模型传代较为稳定,可以用于相关药物筛选或疗效评估鉴定使用,但为确保较好模型构建效果,应在稳定传代5代后才能最终确定模型构建较为成功。
实施例2
与实施例1操作过程类似,发明人利用nk细胞淋巴瘤细胞株(yt细胞株)同样构建了可稳定传代的肿瘤模型。具体构建过程不再详述,仅就部分结果简要解释说明如下。
对所形成肿瘤组织进行形态学观察,结果如图6所示。从图中可以看出,显微镜下可见弥散分布的异型淋巴细胞,细胞体积较大,胞浆丰富,细胞核型不规则,染色质较粗,期间见多少不等的凋亡坏死细胞。总体而言,传代过程中肿瘤细胞形态较为一致,表明传代效果是较为稳定的。
对传代过程中不同代系的yt肿瘤组织表面部分特征性分子(cd3ε,cd56、granzymeb、perforin)表达情况进行免疫组化检测,结果如图7所示,检测结果均为阳性,表明肿瘤组织未发生变异。
同时,利用流式检测技术,对传代过程中肿瘤组织进行流式检测,结果分别如图8所示。检测结果表明肿瘤细胞未发生明显变异,传代稳定。
进一步地,发明人对不同代系的yt肿瘤组织进行了eb病毒(epstein-barrvirus,ebv)的原位杂交,结果如图9所示,结果表明:ebv阳性,这表明所形成肿瘤特性明显,传代特性稳定。
- 还没有人留言评论。精彩留言会获得点赞!