种植金心吊兰改良土壤的方法与流程
本发明属于土壤改良与修复领域,涉及一种金心吊兰改良土壤的方法。
背景技术
土地盐碱化是一个世界性的严重问题,天津滨海盐碱地是中国之海盐碱地代表之一,多年来,人们研究出了物理措施改良法、化学试剂改良法等众多方法,其中物理方法存在一些改良不彻底,无法根治以及大面积应用困难等问题,而化学法则会出现化学试剂残留等不足。在众多改良方法中,生物治理方法由于优点较多越来越受到重视。植被与土壤之间相互作用,形成物质和能量循环的一个连续过程,使生物改良成为可能。种植植物会对土壤性质产生影响,这种影响通过根际土向四周扩散从而形成复杂的体系。
酶是土壤组分中最活跃的有机成分之一,土壤酶和土壤微生物一起共同推动土壤的代谢过程。土壤酶可来源于土壤中动物、植物和微生物细胞的分泌物及其残体的分解物。土壤中各有机、无机营养物质的转化速度,主要取决于转化酶、蛋白酶、磷酸酶、脲酶及其他水解酶类和多酚氧化酶、硫酸盐还原酶等氧化还原酶类的酶促作用。土壤酶活性反映了土壤中各种生物化学过程的强度和方向,其活性是土壤肥力评价的重要指标之一,同时也是土壤自净能力评价的一个重要指标。土壤酶的活性与土壤理化特性、肥力状况和农业措施有着显著的相关性。
目前,尚未有通过金心吊兰改良土壤的方法的报道。
技术实现要素:
本发明的目的是克服现有技术的不足,提供一种高效简捷、低成本并适合大规模应用的种植金心吊兰改良土壤的方法。
本发明的技术方案概述如下:
种植金心吊兰改良土壤的方法,包括如下步骤:将金心吊兰幼苗种植在盐碱土壤,在15-27℃通风、散光日照15-17小时之间、3-4天浇水一次,培养28-35天,得到改良的土壤。
本发明的优点:
本发明的方法高效简捷、低成本,可以对盐碱土壤改良后再种植其它植物,并可通过测定土壤酶活力,来判定土壤是否改良,便于大规模检测鉴定。
附图说明
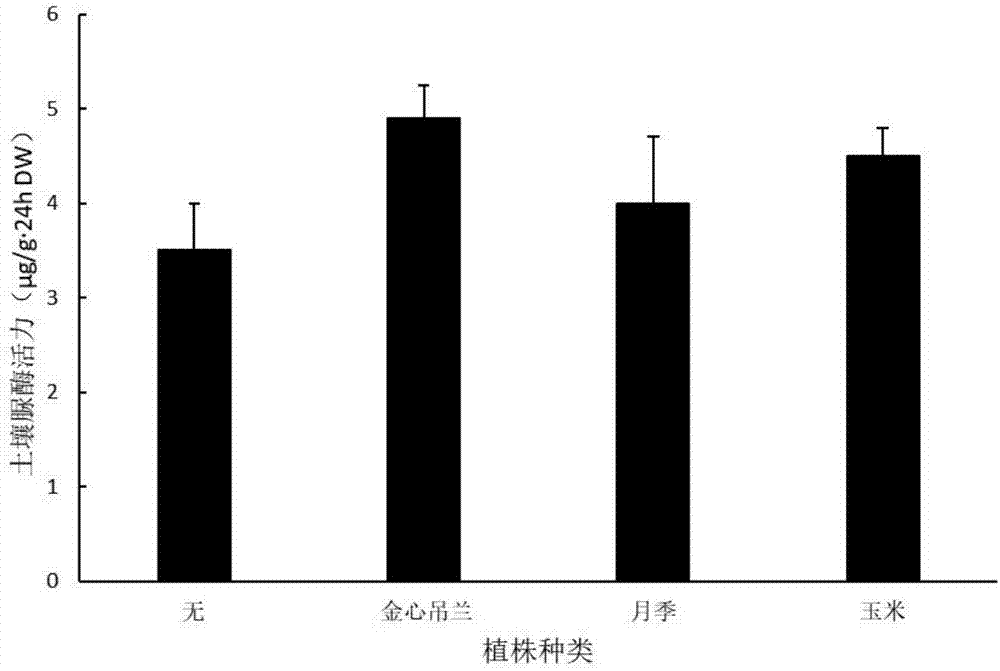
图1为不同植物对土壤脲酶活性的影响效果对比图。
图2为不同植物对土壤蔗糖酶活性的影响效果对比图。
图3为不同植物对土壤磷酸酶活性的影响效果对比图。
具体实施方式
以天津津南区天津大学盐碱地土壤为例,但对本发明不作任何限定。
金心吊兰(吊兰属,金心吊兰种),月季(蔷薇属,月季)和玉米(玉蜀黍属,玉米)
实施例1
将金心吊兰幼苗、月季幼苗和玉米幼苗分别种植在盐碱土壤,另用一份盐碱土壤为空白对照,在15-27℃通风、散光日照15-17小时之间、3-4天浇水一次,培养30天。
金心吊兰长势较好。
月季及玉米出现不同程度萎蔫。
通过酶活测定来判断植物土壤改良效果,包括如下步骤:
一.土壤脲酶的活性测定:
1.风干金心吊兰根际土壤,过18目筛,称取5g土样于烧杯中;
2.加入1ml甲苯,室温放置15min;
3.加入10ml质量浓度为10%尿素水溶液和20ml柠檬酸缓冲液(ph6.7),混匀,37℃;恒温培养24h;
4.摇荡混合均匀,滤纸过滤;
5.吸取1ml滤液,移入50ml容量瓶中,加入质量浓度为1.35mol/l的苯酚钠水溶液4ml,加入质量浓度为0.9%的次氯酸钠水溶液3ml,随加随摇匀,放置20min,用水定容至刻度;
6.在分光光度计上578nm处进行比色测定(1h内蓝色保持稳定);
7.参考标准曲线,计算出的每小时每克土样中经脲酶水解产生氨态氮的毫克数为4.9μg/g·24hdw,见图1。
(标准曲线绘制:取0.4717g硫酸铵,用ddh2o定容至1000ml,得到0.1mg/ml氮的标准液,吸取配置好的10ml氮的标准液,,定容至l00ml,分别吸取1、3、5、7、9、11、13ml稀释的质量浓度为0.1mg/ml的氮水溶液,移至50ml容量瓶中,用水定容至20ml,加入4ml苯酚钠,摇匀,再加入3ml次氯酸钠,摇荡混匀,放置20min,用水定容至刻度。将着色液在578nm处测定吸光度值,以吸光度值为纵坐标,以标准溶液浓度为横坐标,绘制曲线图。)
用风干月季根际土壤或用风干玉米根际土壤替代风干金心吊兰根际土壤,以及空空白对照,测量方法同上,得到的结果见图1。
二.土壤磷酸酶的活性测定:
1.称取1g新鲜过筛的金心吊兰根际土壤,放入50ml三角瓶中;
2.加入0.2ml甲苯,再加入4mlph=6.5磷酸缓冲液及1ml质量浓度为0.05mol/l的对硝基苯磷酸二钠水溶液,摇匀后封住瓶口,37℃恒温培养1h;
3.加入1ml质量浓度为0.5mol/l的cacl2水溶液和4ml质量浓度为0.5mol/l的naoh水溶液,用滤纸过滤;
4.在紫外分光光度计上410nm处测定滤液的吸光值;
5.参考对硝基苯酚绘制的标准曲线,计算出的每小时每千克土壤样品产生的p-np的毫克数为92mg/g·24hdw,见图2。
(标准曲线的绘制:称取1g对硝基苯酚溶于700ml水中,定容至1l,冰箱保存。用水将配好的标准溶液稀释100倍,分别吸取稀释后的标准溶液1、2、3、4、5ml,移入50ml三角瓶中,分别用水定容到5ml,再加入1ml质量浓度为0.5mol/l的cacl2水溶液和4ml质量浓度为0.5mol/l的naoh水溶液,轻摇几秒钟,滤纸过滤,410nm下测定吸光度值,绘制标准曲线。)
用风干月季根际土壤或用风干玉米根际土壤替代风干金心吊兰根际土壤,以及空空白对照,测量方法同上,得到的结果见图2。
三.土壤蔗糖酶的活性测定:
1.称取金心吊兰根际土壤10g,移入100ml容量瓶中;
2.加入质量浓度为8%的蔗糖水溶液30ml,再加入ph5.5磷酸缓冲液10ml和甲苯1ml,混匀后,37℃恒温培养24h;
3.过滤后,吸取1ml滤液,移入50ml容量瓶中,加入dns试剂3ml,煮沸5min,在自来水流下冷却3min。因生成3-氨基-5-硝基水杨酸,溶液因而呈橙黄色,最后用ddh2o定容至50ml;
4.在分光光度计上于508nm处进行比色;
5.参考以葡萄糖绘制的标准曲线,计算出的每小时每克土壤样品中经蔗糖转化酶水解产生的葡萄糖的毫克数为120μg/g·hdw,见图3。
(标准曲线绘制:分别吸取0、0.1、0.2、0.3、0.4、0.5ml质量浓度为1mg/ml的标准葡萄糖水溶液于试管中,再定容至1ml,加入dns试剂3ml,摇匀,煮沸5min,取出后在冷水浴中冷却至室温,在540nm波长下比色,以od值为纵坐标,以葡萄糖浓度为横坐标,绘制标准曲线。)
用风干月季根际土壤或用风干玉米根际土壤替代风干金心吊兰根际土壤,以及空空白对照,测量方法同上,得到的结果见图3。
上述植物的培养天数可以选择28-35天中的任何一天。
- 还没有人留言评论。精彩留言会获得点赞!