胎源性成年胆汁淤积性肝损伤动物模型、其特异性生物标志物及应用的制作方法
本发明涉及动物模型构建技术领域,具体涉及一种胎源性成年胆汁淤积性肝损伤动物模型、其特异性生物标志物及应用。
背景技术:
已知胆汁淤积的发生是由于胆汁代谢异常或胆汁流动障碍所致,其可导致肝损伤,甚至纤维化、肝硬化。疏水性胆汁酸主要包括胆酸(cholicacid,ca)、鹅脱氧胆酸(chenodeoxycholicacid,cdca)和鼠胆酸(muricholicacid,mca)等,其在肝细胞内蓄积被认为是胆汁淤积性肝损伤发生的重要诱导因素。内质网应激(endoplasmicreticulumstress)已证实是成年胆汁淤积性肝损伤的主要发病机制之一。胆汁酸可以通过增加葡萄糖调节蛋白78(glucose-regulatedprotein78,grp78)诱导肝细胞线粒体损伤和内质网应激。c/ebp的同源蛋白(ccat/enhancer-bindinghomologuesprotein,chop)为内质网应激诱导的转录调控因子,是内质网应激过程中高诱导表达基因之一,其缺失可减轻胆管结扎所致小鼠胆汁淤积性肝损伤。人群研究已发现宫内发育迟缓患儿出生后血清总胆汁酸浓度升高,提示宫内发育迟缓与胆汁酸代谢异常密切相关。
胆汁淤积性肝损伤动物模型的建立对于探寻防治药物具有十分重要的意义。目前成年胆汁淤积性肝损伤动物模型主要有:肝总胆管结扎模型、a-萘异硫氰酸酯诱导模型和雌激素苯甲酸雌二醇诱导模型等。其中,药物(如a-萘异硫氰酸酯、雌激素苯甲酸雌二醇)相关动物模型的造模方法具有简单易行、成功率高等优点,因而广泛用于成年胆汁淤积性肝损伤相关的研究。胎源性成年胆汁淤积性肝损伤主要表现为孕期受到不良环境的影响,导致子代出生后出现胆汁淤积性肝损伤症状。其疾病特点主要体现在疾病的诱因源于宫内,造成胆汁酸代谢相关基因如胆固醇-27羟化酶(cholesterol27α-hydroxylase,cyp27a1)的编程改变,并持续至成年,成年时期即便无诱因仍可发生胆汁淤积性肝损伤。此外,成年胆汁淤积性肝损伤多表现为胆汁酸合成限速酶胆固醇-7羟化酶(cholesterol7α-hydroxylase,cyp7a1)表达增加,因此现有的动物模型无法模拟胎源性成年胆汁淤积性肝损伤的病理生理状态,更无法用于胎源性成年胆汁淤积性肝损伤的发生机制及防治研究。我们至今尚未见国内外有胎源性成年胆汁淤积性肝损伤动物模型的报道,因此人们亟需一种具有宫内起源的、稳定可靠、便捷的动物模型,这对于胎源性成年胆汁淤积性肝损伤的机制及防治药物的研究具有重要意义。
越来越多的研究证实,糖皮质激素是决定胎儿成熟和出生后命运的关键,宫内糖皮质激素过暴露可编程胎儿多疾病易感。地塞米松为合成类糖皮质激素,在临床上可促进胎儿肺成熟、减少新生儿呼吸窘迫综合征发生并降低围产儿死亡率,因此被广泛用于早产相关妊娠疾病。世界卫生组织对29个国家359个机构的母婴健康调查资料显示,各国对孕22-36周早产儿出生前使用合成类糖皮质激素预防性治疗率平均为54%,其中我国的使用率为68%,某些国家使用率最高可达91%。然而,孕期应用地塞米松具有“双刃剑”效应。流行病学和基础研究发现,孕期应用地塞米松不仅会降低子代出生体重,还可引起子代肝脏多种疾病的发生,母亲分娩前接受地塞米松治疗后的婴儿胆酸合成速率增加。我们近期发现,孕期地塞米松暴露可引起成年子代大鼠胆汁淤积性肝损伤的发生。
技术实现要素:
本发明目的之一在于提供一种胎源性成年胆汁淤积性肝损伤动物模型,采用一种简便易行、有效可靠、可重复性强、成功率高的方法,构建得到所述胎源性成年胆汁淤积性肝损伤动物模型。
本发明目的之二在于提供所述胎源性成年胆汁淤积性肝损伤动物模型的特异性生物标志物,所述特异性生物标志物cyp27a1在胎儿期和成年期的表达均持续增加,可成为药物的干预靶标。
本发明目的之三在于提供所述胎源性成年胆汁淤积性肝损伤动物模型的应用,所述胎源性成年胆汁淤积性肝损伤动物模型在阐明胎源性成年胆汁淤积肝损伤的发生机制以及研发早期防治药物方面具有重要意义。
本发明实现目的之一采用以下技术方案:
一种胎源性成年胆汁淤积性肝损伤动物模型,采用以下方法步骤构建得到:
步骤1:取正常受孕的大/小鼠,在孕9-20天期间给予0.2mg/kg.d地塞米松皮下注射,该过程中孕鼠自由饮水和饮食;
步骤2:上述步骤1的给予地塞米松处理的母鼠自然生产f1子代仔鼠,选取窝仔数≥10只的窝仔,留取每窝仔数10只,且雌雄各半,仔鼠母乳喂养4周后断奶,断奶后雌雄分笼继续正常饮食饲养;
步骤3:取上述步骤2的正常饮食至28周龄的f1子代雌性仔鼠,检测28周龄的血清和肝脏胆汁淤积性肝损伤相关指标,血清和肝脏胆汁淤积性肝损伤相关指标升高判定为胎源性成年胆汁淤积性肝损伤的发生,所述28周龄的f1子代雌性仔鼠即为胎源性成年胆汁淤积性肝损伤动物模型。
其中,所述步骤1中,大/小鼠为spf级wistar、sd大鼠或昆明种小鼠。
其中,所述步骤3中,血清和肝脏胆汁淤积性肝损伤相关指标为谷丙转氨酶(alanineaminotransferase,alt)、谷草转氨酶(aspartateaminotransferase,ast)、谷氨酰转肽酶(glutamyltranspeptidase,ggt)、碱性磷酸酶(alkalinephosphatase,alp)、总胆红素(totalbilirubin,tbi)、直接胆红素(directbilirubin,dbi)和总胆汁酸(totalbileacid,tba)、grp7和chop。
本发明实现目的之二采用以下技术方案:
一种胎源性成年胆汁淤积性肝损伤动物模型的特异性生物标志物,所述特异性生物标志物为cyp27a1,所述cyp27a1在胎源性成年胆汁淤积性肝损伤动物模型的胎儿期和成年期表达显著增加。
在现有技术中,成年胆汁淤积性肝损伤多表现为胆汁酸合成限速酶cyp7a1表达增加,而本发明胎源性成年胆汁淤积性肝损伤动物模型经检测,则表现为cyp7a1表达不增加反而降低,而cyp27a1的表达在胎儿期和出生后成年期都表现为增加,因此cyp27a1成为胎源性成年胆汁淤积性肝损伤动物模型的一个重要标志物。
本发明实现目的之三采用以下技术方案:
一种胎源性成年胆汁淤积性肝损伤动物模型的应用,所述胎源性胆汁淤积性肝损伤动物模型用于筛选胎源性成年胆汁淤积性肝损伤的治疗药物。
进一步,所述胎源性成年胆汁淤积性肝损伤的治疗药物包括尼伐地平。
与现有技术相比,本发明具有以下有益效果:
(1)本发明提供的胎源性成年胆汁淤积性肝损伤动物模型采用一种通过大/小鼠在孕9-20天期间给予0.2mg/kg.d地塞米松皮下注射,经自然生产f1子代雌性仔鼠正常饮食至28周龄得到,此方法重复性高、操作简便,出生后无需进行其他药物处理或者手术等操作,因此便于推广应用,同时由于地塞米松广泛用于早产相关妊娠疾病,目前尚未得到广泛的关注,此动物模型的建立对临床使用地塞米松的范围将起到警示作用。
(2)与传统的成年胆汁淤积性肝损伤的标志物胆汁酸合成限速酶(cyp7a1)表达增加不同,本发明提出一种针对胎源性成年胆汁淤积性肝损伤动物模型的特异性生物标志物—cyp27a1,cyp27a1在胎源性成年胆汁淤积性肝损伤动物模型的胎儿期和成年期表达显著增加,cyp27a1表达增加成为胎源性成年胆汁淤积性肝损伤的一个重要标志物,具有重要的临床指导意义。
(3)胎源性成年胆汁淤积性肝损伤起源于宫内,发病于成年期,现有的动物模型无法模拟胎源性成年胆汁淤积性肝损伤的病理生理状态,更无法用于胎源性成年胆汁淤积性肝损伤的机制及防治研究,而本发明提供的胎源性成年胆汁淤积性肝损伤动物模型正是起因于宫内、发病于成年期的动物模型,非常稳定,能模拟成年后胆汁淤积性肝损伤发生的疾病表型,对研究胎源性成年胆汁淤积性肝损伤的发生机制,确定其毒性靶标,以及研发早期防治药物都具有重要意义。
附图说明
图1为本发明实施例1中孕期地塞米松暴露对f1子代12周龄雌性大鼠胆汁淤积性肝损伤相关指标的影响图;
图2为本发明实施例1中孕期地塞米松暴露对f1子代28周龄雌性大鼠胆汁淤积性肝损伤相关指标的影响图;
图3为本发明实施例1中孕期地塞米松暴露对f1子代28周龄雌性大鼠肝脏胆汁酸代谢功能及对胎肝cyp27a1表达的影响图;
图4为本发明实施例1中孕期地塞米松暴露对f1子代28周龄雄性大鼠胆汁淤积性肝损伤相关指标的影响图;
图5为本发明实施例1中孕期地塞米松暴露对f1子代28周龄雄性大鼠肝脏胆汁酸代谢功能的影响图;
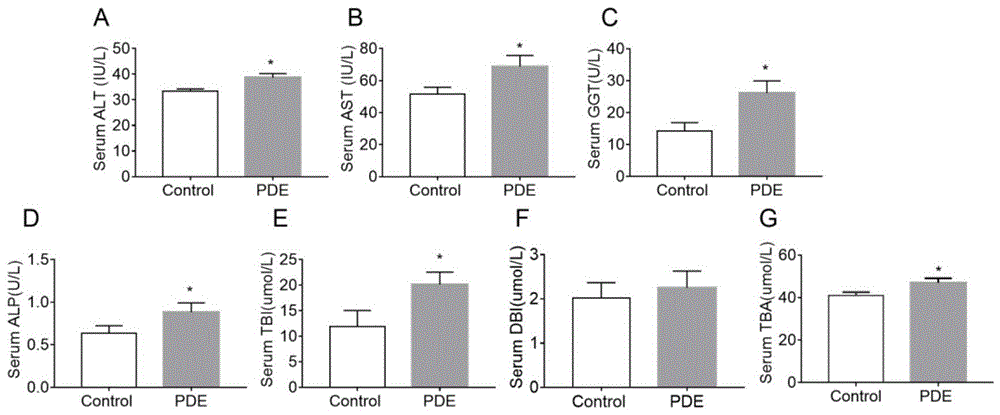
图6为本发明实施例2中尼伐地平对胎源性成年胆汁淤积性肝损伤动物模型28周龄大鼠血清肝损伤相关指标的影响图;
图7为本发明实施例2中尼伐地平对胎源性成年胆汁淤积性肝损伤动物模型28周龄大鼠血清胆汁淤积相关指标的影响图。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
本发明以下实施例中,所述gd9指孕期第9天,所述gd20指孕期第20天,所述pd1指产后第1天。本发明不局限于实施例中wistar大鼠,任意spf级大/小鼠均可,本发明中大/小鼠指大鼠或小鼠,包括wistar、sd大鼠或昆明种小鼠。所述的正常饮食是配方与《中华人民共和国国家标准gb14924.3-2001》规定的小鼠、大鼠配合饲料相同。
【实施例1】胎源性成年胆汁淤积性肝损伤动物模型的构建
步骤如下:
1.动物和处理
雄性wistar大鼠20只(体重260-300g),雌鼠wistar大鼠40只(体重200-240g)。由湖北省动物中心提供。自由饮水进食,适应性喂养7天后,按照雄:雌=1:2合笼,次晨阴道涂片,确定受孕大鼠,记为孕0天。将孕鼠随机分为两组:对照组和孕期地塞米松暴露(prenataldexamethasoneexposure,pde)组,实验组(pde组)妊娠大鼠在gd9到gd20用0.2mg/kg.d地塞米松皮下注射处理,而对照组给予相同体积生理盐水。部分孕鼠于孕20天处死取胎鼠肝脏,检测肝脏胆汁酸代谢相关指标;部分孕鼠自然生产f1子代仔鼠。
在产后第一天(pd1),选取窝仔数≥10只的窝仔,留取每窝仔数10只,且雌雄各半,f1子代仔鼠母乳喂养4周后断奶,断奶后雌雄分笼继续正常饮食饲养;。断奶后,正常饮食,分别在出生后12和28周龄,在对照组和pde组的每窝仔鼠中随机选择2只f1子代仔鼠(雌雄各1只),乙醚麻醉后获取血清和肝脏组织储存在-80℃冰箱,用于进一步分析。
2.胆汁淤积性肝损伤相关血清学检测
采用试剂盒检测alt、ast、ggt、alp、tbi、dbi和tba活性或浓度。实验前血清样本冰上静置解冻并充分混匀,试剂盒平衡至室温。按照试剂盒说明书检测各管吸光度,以蒸馏水为空白对照,根据标准品计算测定血清alt、ast、ggt、alp、tbi、dbi和tba的活性或浓度。
3.引物设计和定量pcr反应检测肝脏胆汁酸代谢基因变化
从ncbi网站(http://www.ncbi.nlm.nih.gov)下载目的基因和管家基因的mrna序列,应用primer5.0设计上下游引物,引物序列见表1。并在ncbi网站上行核苷酸blast同源比对,确证扩增片段的特异性。将大鼠肝脏组织用于总rna提取、逆转录和定量pcr,在abiprism7500仪器上进行。每一份cdna样本均在相同的实验条件下检测目的基因和管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,gapdh),同时测定引物扩增效率。通过溶解曲线及pcr产物凝胶电泳鉴定产物的特异性。同时根据目的基因与管家基因的相对表达来进行半定量分析cyp7a1、cyp27a1、胆汁酸盐输出泵(bilesaltexcretorypump,bsep)、多糖耐药相关蛋白2(multidrugresistance-associatedprotein2,mrp2)、钠离子依赖的牛磺酸转运体(na+-dependenttaurocholatetransporter,ntcp)、grp78和chop表达。
表1引物序列
4.蛋白质免疫印迹
根据标准方法进行蛋白质印迹。用ripa裂解缓冲液裂解大鼠肝组织和细胞。用bca蛋白质测定试剂盒测定样品的蛋白质浓度。将肝脏组织和细胞裂解物与5×上样缓冲液混合并在100℃下加热5min。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,然后转移到聚偏二氟乙烯膜(polyvinylidenefluoride,pvdf)上。5%脱脂奶粉封闭后,分别与grp78(1:1000)、chop(1:500)、gapdh(1:5000)一抗在4℃下过夜。用tbst洗涤三次后,将膜与1:5000稀释的二抗在摇床上孵育1h。用tbst洗涤三次后,用ecl-化学发光试剂盒显影。使用bio-idvl化学发光成像系统进行图像采集,采用imagej软件分析目的条带的光密度值。
5.统计分析
spss17用于数据分析。计量资料采用均数±标准误(mean±sem)表示。采用student’st-test配对检验两个样本均数之间差异;采用单因素anova方差分析进行多个样本均数间的比较。p<0.05,表示差异具有统计学意义结果。
6.实验结果分析
6.1孕期地塞米松暴露对f1子代12周龄雌性大鼠胆汁淤积性肝损伤相关指标的影响
如附图1所示,与对照组比较,pde组雌性f1子代12周龄大鼠血清肝损伤特异性指标—alt、ast和ggt水平增加(p<0.05,p<0.01,图1a-1c),pde组雌性f1子代12周龄大鼠血清胆汁淤积相关指标—alp和tbi水平增加(p<0.05,p<0.01,图1d-1e),dbi无明显改变(p<0.05,图1f),血清胆汁酸水平增加(p<0.05,图1g)。提示,pde组雌性f1子代12周龄大鼠出现胆汁淤积性肝损伤症状。
6.2孕期地塞米松暴露对f1子代28周龄雌性大鼠胆汁淤积性肝损伤相关指标的影响
如附图2所示,与对照组比较,pde组雌性f1子代28周龄雌性大鼠血清肝损伤特异性指标—alt、ast和ggt水平增加(p<0.05,p<0.01,图2a-2c)。与对照组相比,肝脏内质网应激指标—pde组雌性f1子代大鼠grp78的mrna表达水平增加(p<0.05,图2d),chop表达也有一定的增加趋势(图2e),同时grp78和chop的蛋白表达水平均增加(p<0.05,图2f-2h)。pde组雌性f1子代28周龄大鼠血清胆汁淤积相关指标—alp、tbi和dbi水平增加(p<0.05,p<0.01,图2i-2k),血清胆汁酸水平增加(p<0.05,图2l)。提示,pde组f1子代28周龄雌性大鼠存在胆汁淤积性肝损伤,且较12周龄雌性大鼠明显。
6.3孕期地塞米松暴露对f1子代28周龄雌性大鼠肝脏胆汁酸代谢功能的影响
如附图3所示,与对照组相比,pde组f1子代28周龄雌性大鼠肝脏胆汁酸合成酶cyp27a1的mrna表达水平增加(p<0.05,图3a)、cyp7a1的mrna表达水平降低(图3b),胆汁酸输出功能基因bsep的mrna表达水平降低(p<0.05,图3c),mrp2的表达无明显改变(图3d),摄入功能基因ntcp的mrna表达水平明显降低(p<0.05,图3e)。提示,肝脏胆汁酸代谢功能紊乱。
同时,针对28周龄(成年期)雌性大鼠肝脏胆汁酸合成酶cyp27a1表达水平增加的情况,进一步检测胎儿期雌性大鼠肝脏胆汁酸合成酶cyp27a1表达水平,发现胎儿期cyp27a1的mrna表达水平增加(p<0.01,图3f)。因此,cyp27a1可作为胎源性成年胆汁淤积性肝损伤动物模型的一个重要特异性生物标志物。
6.4孕期地塞米松暴露对f1子代28周龄雄性大鼠胆汁淤积性肝损伤相关指标的影响
如附图4所示,与对照组比较,pde组雌性f1子代28周龄大鼠雄血清肝损伤特异性指标—alt、ggt无明显改变,仅ast水平增加(p<0.05,图4b)。与对照组相比,肝脏内质网应激指标—pde雄性f1子代大鼠grp78和chop的mrna表达无明显改变(图4d,4e),同时grp78和chop的蛋白表达水平无明显改变(图4f-4h)。pde雌性f1子代28周龄大鼠血清胆汁淤积相关指标—alp和dbi无明显改变,仅tbi水平增加(p<0.05,图4j),血清胆汁酸水平无明显改变(图4l)。提示,pde对f1子代28周龄雄性大鼠胆汁淤积性肝损伤相关指标影响较弱,主要是雌性大鼠损伤显著。
6.5孕期地塞米松暴露对f1子代28周龄雄性大鼠肝脏胆汁酸代谢功能的影响
如附图5所示,与对照组相比,pde组雄性f1子代肝脏cyp27a1、cyp7a1、bsep、mrp2和ntcp的mrna表达无明显改变(图5a-5e)。提示pde对子代28周龄雄性大鼠肝脏胆汁酸代谢功能影响较弱。
由上述结果可知,在孕9-20天期间给予0.2mg/kg.d地塞米松皮下注射,自然生产的f1子代雌性仔鼠正常饮食至28周龄,经检测血清和肝脏胆汁淤积性肝损伤相关指标均稳定升高,则28周龄的f1子代雌性仔鼠即为稳定的胎源性成年胆汁淤积性肝损伤动物模型。
【实施例2】利用本发明动物模型筛选胎源性成年胆汁淤积性肝损伤的治疗药物
步骤如下:
1.按照实施例1的方法步骤构建胎源性成年胆汁淤积性肝损伤动物模型;
2.对步骤1构建的胎源性成年胆汁淤积性肝损伤动物模型给予尼伐地平药物处理:
选取pde组雌性子代,出生后8周到12周给予cyp27a1活性抑制剂尼伐地平(nilvadipine)1.4mg/kg.d处理,在28周检测尼伐地平对pde组成年雌性子代大鼠胆汁淤积性肝损伤的影响。实验分为四组:以未暴露地塞米松并给予相同体积生理盐水的组为对照组;pde组;以pde组给予尼伐地平药物干预的为尼伐地平处理组;尼伐地平组。按照实施例1中步骤2的血清学检测方法检测尼伐地平对胎源性成年胆汁淤积性肝损伤动物模型28周龄雌性大鼠血清肝损伤相关指标的影响。
3.实验结果分析
3.1尼伐地平对胎源性成年胆汁淤积性肝损伤动物模型28周龄雌性大鼠血清肝损伤相关指标的影响
如图6所示,与对照组相比,pde组子代大鼠(28周龄)血清ast、ggt、alt活性增加(p<0.05,图6a-c)。与pde组比较,尼伐地平处理组大鼠血清ast和ggt活性降低(p<0.05,图6a-c)。
3.2尼伐地平对胎源性成年胆汁淤积性肝损伤动物模型28周龄雌性大鼠血清胆汁淤积相关指标的影响
如图7所示,与对照组相比,pde子代大鼠(28周龄)alp活性和tbi、dbi水平增加,tba水平增加(p<0.05,图7a-c)。与pde组比较,尼伐地平处理组大鼠血清alp活性和tbi水平降低(p<0.05,图7a-c),tba水平降低(p<0.05,图7d)。
由上述结果可知,尼伐地平对胎源性成年胆汁淤积性肝损伤具有治疗作用。
综上所述,本发明提供一种胎源性成年胆汁淤积性肝损伤动物模型,通过在孕9-20天期间给予0.2mg/kg.d地塞米松皮下注射,自然生产的f1子代雌性仔鼠正常饮食至28周龄,经检测血清和肝脏胆汁淤积性肝损伤相关指标均稳定升高,则28周龄的f1子代雌性仔鼠即为稳定的胎源性成年胆汁淤积性肝损伤动物模型。所述胎源性成年胆汁淤积性肝损伤动物模型的特异性生物标志cyp27a1在胎源性成年胆汁淤积性肝损伤动物模型的胎儿期和成年期表达显著增加,成为胎源性成年胆汁淤积性肝损伤的一个重要标志物,具有重要的临床指导意义。此模型可应用于阐明胎源性成年胆汁淤积肝损伤的发生机制,确定其毒性靶标,以及研发早期防治药物方面。
序列表
<110>武汉大学
<120>胎源性成年胆汁淤积性肝损伤动物模型、其特异性生物标志物及应用
<160>16
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
gcctccaaggagtaagaaac20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
gtctgggatggaattgtgag20
<210>3
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>3
actgcaccagttacaggtgctttaca26
<210>4
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>4
ccatgtcgttccgtactgggtact24
<210>5
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>5
ccataaggtgttgtgccacggaaa24
<210>6
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>6
gcccaaatgccttcgcagaag21
<210>7
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>7
aaccgggaaggtcaagttctccat24
<210>8
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>8
ttgtcagagtcactggtccaagca24
<210>9
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>9
atctgttaatcctgggcagacgct24
<210>10
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>10
tgggagacaatcccgatgttggaa24
<210>11
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>11
aggatggaggtgcacaacgtatca24
<210>12
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>12
agcccagtgagagcatgataagca24
<210>13
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>13
gtttgctgaggaagacaaaaagctc25
<210>14
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>14
cacttccatagagtttgctgataattg27
<210>15
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>15
cgccttcaacgacgagttcgtg22
<210>16
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>16
gctgttcttatccaccgacttc22
- 还没有人留言评论。精彩留言会获得点赞!