一种磁悬浮育种方法与流程
本发明涉及动植物以及微生物生命科学研究领域,尤其涉及一种植物磁悬浮育种方法。
背景技术:
重力是影响地球上生物的重要环境因素之一,深度参与植物生命周期与形态建成。1957年10月4日世界上第一颗人造卫星发射成功,为太空微重力育种奠定了基础,1984年,美国航空航天局(nasa)开展"植物重力和空间"专题研讨会讨论(刘佳惟,2017)。我国从1975年开始发射返回式卫星,自1987年以来,我国已将6000多份种质材料,1122个作物品种送上过太空。
太空育种虽然应用了微重力因素,但其机理目前尚不清楚。江丕栋(1990)认为,能够敏锐感受重力的植物对重力的感应不是即时的,只有在感受重力超过一定时间后才会做出相应的反应。horneck等(1995)发现微重力对dna的修复系统有阻碍或抑制作用。halstead等(1994)发现宇宙飞船携带大豆、拟南芥根细胞后,出现的细胞核现象分布异常,浓缩的染色质显著增加,可能是在细胞的有丝分裂与空间微重力有关。重力的大小和方向能影响植物的向重性、激素的分布、生理代谢和ca2+含量分布以及细胞结构等(江丕栋,2000)。
关于微重力的感受部位目前主要存在两种假说:“质膜理论”和“淀粉体-平衡石理论”。“淀粉体-平衡石理论”假说认为微重力可搅乱平衡细胞严格的结构极性(perbal,1997)。阎田等(1997)以根冠细胞中平衡石位移作为重力反应的指标,认为回转器旋转对绿豆根冠细胞中平衡石位移产生影响。“质膜理论”假说认为是重力感受的部位在原生质体。也有学者认为,位于质膜和细胞外基质接合面是重力感受体(staves,1992;wayne,1992)。这两种假说都存在缺陷性,其研究对象往往是植物根系,或者研究条件未涉及磁悬浮情况,不能全面反应植物整体信息(许冬倩,2015)。
磁悬浮技术(electromagneticlevitation,简称eml技术)是指利用磁力克服重力使物体悬浮的一种技术。
微重力环境能使作物产生优良变异,磁悬浮条件下,植物受到比它所生存的地球环境大得多的重力加速度,代谢过程和基因表达是否发生变化,发生什么样的变化,这将具有非常重要的研究价值。
发端于上世纪六十年代的太空育种技术,利用微重力育种培育了大量优良的新品种,太空育种技术的应用前景可观,但是受费用高昂、环境条件难以控制等诸多因素限制,很难在地面完成,难以大规模推广。
目前常规育种培育技术,由于没有新的突变体产生,很难培育出较多的新品种,新基因资源缺乏成了限制育种的障碍,因此,迫切需要引入新的技术来发掘新的基因资源,以培育出新的优良品种。
技术实现要素:
本发明目的是针对上述问题,提供一种改变种子代谢与基因状况的磁悬浮育种方法。
为了实现上述目的,本发明的技术方案是:
一种磁悬浮育种方法,包括以下步骤:
s1、将植物种子清洗数次后,用清水浸泡,待植物种子充分吸胀;
s2、将上述植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60~180min并连续处理1~20天;
s3、将上述植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理1~10天;
s4、将上述处理过后的植物种子播于苗盘中,将苗盘置于25℃恒温光照培养箱中进行正常管护;
s5、待植物种子长出幼苗后,将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60~180min并连续处理1~20天;
s6、将上述幼苗再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理1~10天;
s7、将处理过后的幼苗置于25℃恒温光照培养箱中进行正常培养。
进一步的,所述步骤s2中将植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60~180min并连续处理1~20天。此阶段采用地球重力引力的1/2进行处理,一方面能让种子逐渐适应失重环境,另一方面模拟了太空育种火箭的发射初级阶段。
进一步的,所述步骤s3中将植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理1~10天。
进一步的,所述步骤s5中将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60~180min并连续处理1~20天。此阶段采用地球重力引力的1/2进行处理,一方面能让植株逐渐适应失重环境,另一方面模拟了太空育种火箭发射升空后的初级阶段。
进一步的,所述步骤s6中将幼苗再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理1~10天。
所述磁悬浮育种方法主要有两个阶段,第一阶段:采用0.5~0.9×g微重力每天处理60~180min连续10~20天会让植物有个适应阶段,降低植物死亡率,增加突变率。第二个阶段采用0~0.5×g微重力阶段每天处理24h,连续处理5~10天,让植物的基因突变率达到最大化。
与现有技术相比,本发明具有的优点和积极效果是:
本发明中的磁悬浮育种技术是一种新兴的交叉学科,其技术操作简单、环境条件易控制、费用低廉,是一种在地面上就能实现的全新的育种途径,能够有效增加生物变异来源,并且通过实验证明,磁悬浮微重力环境能有效影响植物材料的光合蛋白产量,通过磁悬浮微重力处理后的植物材料,能很大程度上引起植物代谢与基因的改变,根据实验结果,通过上述方法,植物基因突变率比常规育种提高了300~1000倍,效果非常显著。而且花期也比常规育种发生了变化,作物产量增加明显,给植物育种领域的发展作出了一定的贡献。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
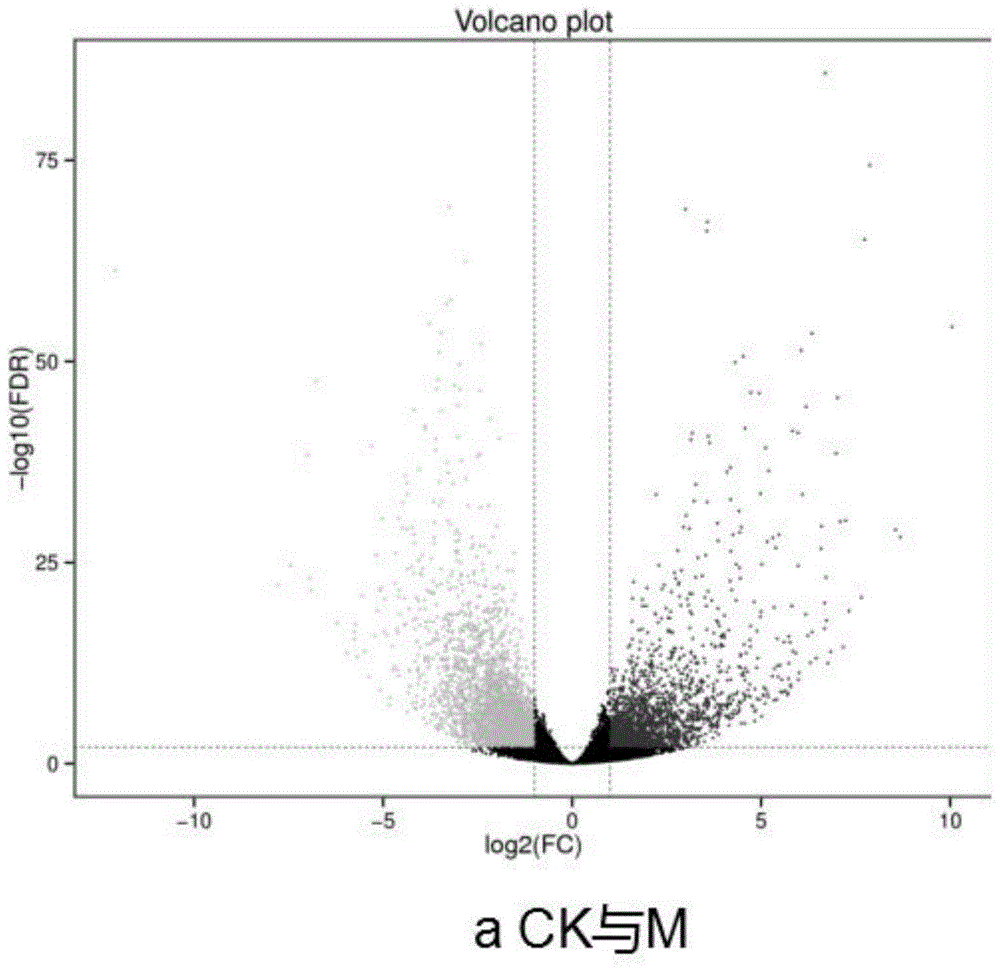
图1为差异表达基因图a;
图2为差异表达基因图b;
图3为差异表达基因图c;
图4为差异基因go注释图a;
图5为差异基因go注释图b;
图6为差异基因go注释图c;
图7为差异基因kegg注释图a;
图8为差异基因kegg注释图b;
图9为差异基因kegg注释图c;
图10为差异表达基因通路富集散点图a;
图11为差异表达基因通路富集散点图b;
图12为差异表达基因通路富集散点图c。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
实施例1、一种磁悬浮育种方法,包括以下步骤:s1、将植物种子清洗数次后,用清水浸泡,待植物种子充分吸胀;s2、将植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60min并处理1天;s3、将植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h;s4、将处理过后的植物种子播于苗盘中,将苗盘置于25℃恒温光照培养箱中进行正常管护;s5、待植物种子长出幼苗后,将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60min并处理1天;s6、将幼苗再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h;s7、将处理过后的幼苗置于25℃恒温光照培养箱中进行正常培养。
实施例2、一种磁悬浮育种方法,包括以下步骤:s1、将植物种子清洗数次后,用清水浸泡,待植物种子充分吸胀;s2、将植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理100min并处理1天;s3、将植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理5天;s4、将处理过后的植物种子播于苗盘中,将苗盘置于25℃恒温光照培养箱中进行正常管护;s5、待植物种子长出幼苗后,将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理120min并连续处理10天;s6、将幼苗再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理5天;s7、将处理过后的幼苗置于25℃恒温光照培养箱中进行正常培养。
实施例3、一种磁悬浮育种方法,包括以下步骤:s1、将植物种子清洗数次后,用清水浸泡,待植物种子充分吸胀;s2、将植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理180min并处理1天;s3、将植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理10天;s4、将处理过后的植物种子播于苗盘中,将苗盘置于25℃恒温光照培养箱中进行正常管护;s5、待植物种子长出幼苗后,将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理180min并连续处理20天;s6、将幼苗再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理10天;s7、将处理过后的幼苗置于25℃恒温光照培养箱中进行正常培养。
实施例4、一种磁悬浮育种方法,包括以下步骤:s1、将植物种子清洗数次后,用清水浸泡,待植物种子充分吸胀;s2、将植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60min并连续处理10天;s3、将植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理10天;s4、将处理过后的植物种子播于苗盘中,将苗盘置于25℃恒温光照培养箱中进行正常管护;s5、待植物种子长出幼苗后,将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理60min并处理1天;s6、将幼苗再次置于磁悬浮发生装置中用0×g的磁悬浮微重力处理24h并处理5天;s7、将处理过后的幼苗置于25℃恒温光照培养箱中进行正常培养。
实施例5、一种磁悬浮育种方法,包括以下步骤:s1、将植物种子清洗数次后,用清水浸泡,待植物种子充分吸胀;s2、将植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理100min并连续处理20天;s3、将植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理5天;s4、将处理过后的植物种子播于苗盘中,将苗盘置于25℃恒温光照培养箱中进行正常管护;s5、待植物种子长出幼苗后,将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理120min并连续处理10天;s6、将幼苗再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理10天;s7、将处理过后的幼苗置于25℃恒温光照培养箱中进行正常培养。
实施例6、一种磁悬浮育种方法,包括以下步骤:s1、将植物种子清洗数次后,用清水浸泡,待植物种子充分吸胀;s2、将植物种子置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理180min并连续处理20天;s3、将植物种子再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理10天;s4、将处理过后的植物种子播于苗盘中,将苗盘置于25℃恒温光照培养箱中进行正常管护;s5、待植物种子长出幼苗后,将幼苗置于磁悬浮发生装置中用0.5~0.9×g的磁悬浮微重力处理180min并连续处理20天;s6、将幼苗再次置于磁悬浮发生装置中用0~0.5×g的磁悬浮微重力处理24h并连续处理10天;s7、将处理过后的幼苗置于25℃恒温光照培养箱中进行正常培养。
将实施例4、5、6作为超强度组(l),实施例1、2、3作为中等强度组(m)与常规育种组(ck,自然突变组)进行比较分析。实例1~6为对s1、s3、s5、s6的处理时间采用正交实验设计进行了优化。
1、测序数据与质量分析
磁悬浮微重力处理样品比对到参考基因组上的结果可知(表1),与对照相比较,磁悬浮微重力处理材料产生新基因1659个,其中1289个被证实具有明确的生物学功能。
表1:样品参考基因组比对表
2、差异表达基因分析
在检测差异表达基因过程中,以foldchange(表示差异倍数)≥2同时fdr(表示错误发现率)<0.01作为筛选标准。如图1、图2、图3所示,显示样品中基因表达水平的差异。中等强度组与ck组差异表达基因有5478个,其中上调有2201个,下调有3277个;超低强度组与ck组对比差异表达基因有10082个,其中有4766个基因表达上调,5316个基因表达下调;中等强度组和超低强度组对比,差异表达基因有3677个,其中1819个基因表达上调,1858个基因表达下调。
3、差异表达基因功能注释和富集分析
3.1、差异表达基因go注释
对磁悬浮处理的差异表达基因进行go注释,结果显示如图4、图5、图6(纵坐标左边为基因数目所占百分比,右边为基因数目)所示。ck组与中等强度组相比较,共有3959个差异表达基因被注释,ck组与超低强度组比较,共有7226个差异表达基因被注释,中等强度组与超低强度组比较,共有2656个差异基因被注释。在生物学过程中,差异表达基因主要集中在代谢过程和细胞过程,其次在单一生物过程、生物调节、定位、刺激应答和细胞成分的组织和生物发生;细胞组分主要集中在细胞、细胞部分和生物膜上,其次主要集中在生物膜部分、细胞器以及细胞器部分和大分子复合物上;在分子功能上主要体现在催化活性和结合上,其次是转导活性、结构分子活性、核酸结合转录因子活性。
3.2、差异表达基因hegg注释
对磁悬浮处理差异表达基因的注释通路类型进行分类如图7、图8、图9(横坐标为注释到基因个数及其在个数中所占基因总数的百分比)所示,ck组与中等强度组比较,有2118个差异基因被注释,ck组与超低强度组比较,有4207个差异基因被注释,中等强度组组与超低强度组比较,有1465个差异基因被注释。在ck组与中等强度组对比中,碳代谢中差异基因数量最多有132个,其次是氨基酸的生物合成和核糖体代谢通路中,分别占总基因数的7.74%和7.66%,基因个数分别为94和93个;在ck组与超低强度组对比中,核糖体代谢通路中差异基因数量最多有225个,占比9.50%,其次是碳代谢途径有197个,占比8.32%和氨基酸的生物合成途径有159个差异基因,占比6.71%;在中等强度组和超低强度组对比中,差异表达基因主要集中在碳代谢途径中,占比10.67%,有92个差异基因,其次是氨基酸的生物合成有69个,占比8.00%和光合作用途径有57个差异基因,占比6.61%。
3.3、差异表达基因kegg通路富集分析
差异表达基因的通路富集分析是表示差异表达基因在某一通路上是否发生显著差异,pathway显著性富集分析是应用超几何检验,找出在差异表达基因中显著性富集的pathway。在磁悬浮处理中对差异表达基因kegg通路富集分析,显示显著性q值最小的前20个通路的富集因子图(如图10、图11、图12所示),图中纵坐标表示通路名称,横坐标表示富集因子,表示差异基因注释到相应通路基因比例与所有基因中注释到该通路基因比例的比值。其中,富集因子越大,表示差异基因在该通路中富集水平越显著。在图中,ck组与中等强度组、ck组与超低强度组和中等强度组与超低强度组之间对比,光合蛋白代谢通路参考价值较其他代谢通路要更有价值,其次是光合作用。
结论:磁悬浮微重力处理植物材料,在ck组与中等强度组对比中,磁悬浮微重力环境能大很大程度上引起植物代谢与基因的改变。碳代谢中差异基因数量最多有132个,其次是氨基酸的生物合成和核糖体代谢通路中,分别占总基因数的7.74%和7.66%,基因个数分别为94和93个;在ck组与超低强度组对比中,核糖体代谢通路中差异基因数量最多有225个,占比9.50%,其次是碳代谢途径有197个,占比8.32%和氨基酸的生物合成途径有159个差异基因,占比6.71%;在中等强度组组和超低强度组对比中,差异表达基因主要集中在碳代谢途径中,占比10.67%,有92个差异基因,其次是氨基酸的生物合成有69个,占比8.00%和光合作用途径有57个差异基因,占比6.61%。磁悬浮微重力处理植物材料能有效影响光合蛋白代谢通路参考价值较其他代谢通路要更有价值,其次是光合作用。
本发明的适用范围:本方法适用于植物的种子、雌雄配子、细胞、活体植株;动物的雌雄配子、细胞、个体;微生物的孢子、个体以及各类生物材料的育种与生命科学领域的研究。而且在本发明基础上的耦合其它增加基因突变的方法以及在本发明基础上的拓展育种也属于本发明范围。
本发明中的磁悬浮育种技术是一种新兴的交叉学科,其技术操作简单、环境条件易控制、费用低廉,是一种在地面上就能实现的全新的育种途径,能够有效增加生物变异来源,并且通过实验证明,磁悬浮微重力环境能有效影响植物材料的光合蛋白产量,通过磁悬浮微重力处理后的植物材料,能很大程度上引起植物代谢与基因的改变,给动植物及微生物育种与科学研究领域的发展作出了一定的贡献。
- 还没有人留言评论。精彩留言会获得点赞!