一种华北落叶松胚性组织超低温保存的方法与流程
本发明涉及一种植物愈伤组织的保持方法,特别涉及一种华北落叶松细胞系胚性愈伤组织的低温保存方法,属于林木育种的组培技术领域。
背景技术:
常温条件下,胚性培养物的长期继代保存,往往存在着许多不可避免的问题:首先,长期重复的继代保存,继代成本高;并且,如果在操作过程中出现人为或环境干扰,造成培养物的污染,很可能造成胚性细胞系的重大损失;更加值得注意的是,经过长时间的继代培养,可能会引起体细胞无性系变异,从而导致胚性培养物胚性能力的下降甚至丧失。超低温冷冻保存技术是目前应用十分广泛和成功的种质长期保存的方法,它能够有效地遏制变异的发生,保存胚性材料的发育潜能,且以最少的量和最低的风险保存材料的完整性。国外采用体细胞胚胎发生快速繁殖已成为针叶树优质苗木规模化生产的重要途径,而且体细胞胚胎发生技术可以和冷藏保存法结合起来。将植物组织长期储存于液氮中,便于进行长期无性系试验。
现有植物胚性愈伤组织保存方法主要有如下两种,培养继代保存法和超低温冷冻保存法,其中超低温保存方法需要在低温保存前对组织进行预培养,使愈伤组织适当脱水,降低细胞内含水量,使细胞的分裂与分化同步,从而增强材料在面对低温保存过程中剧烈的温度变化和高度脱水时的抗逆境能力。针叶树胚性组织的超低温保存预培养的常见方法是预培养时培养基中添加高浓度蔗糖、山梨醇等,提高渗透压,使细胞脱水,以达到增加抗寒能力的作用。
虽然现有的低温冷冻保存方法能够在一定程度上降低遗传变异频率,保证遗传稳定性以及细胞活力和形态发生的潜能保存,但是不同超低温冷冻保存方法中预培养时间、预培养基成分及预处理等不同,胚性组织恢复,解冻后的细胞存活率以及恢复生长率也不同。例如:申请号为cn201910437126.8的发明专利申请公开了一种抗松材线虫病马尾松胚性愈伤组织超低温保存方法,将马尾松细胞系的胚性愈伤组织置于含有蔗糖的增殖培养基中预处理后,于冷冻管中,加入冷冻保护剂,进行程序降温,温度降至-80℃后取出冷冻管并迅速投入液氮,进行超低温保存;使用时,取超低温保存胚性愈伤组织水浴温度为30℃~40℃条件下进行解冻,待冰完全溶化后立即将冷冻管取出,虽然在30-35℃解冻后的胚性愈伤组织细胞活性最高达100%,超低温保存后的愈伤与正常增殖的愈伤组织在外观及显微结构上无明显差异,且低温保存后的愈伤组织仍具有分化形成体胚的能力,但上述专利在冷冻保存前,才将固体培养物放在液体中分散,再进行预培养。本专利采用的是长期继代保存的液体增殖培养物,本身组织分散性、均一性更好,且组织长期在液体培养基中生长,适应性更强。
本发明就华北落叶松胚性细胞系超低温冷冻保存进行探究,探讨适合于华北落叶松胚性培养物超低温冷冻保存中材料预培养、冷冻保存方式等流程的方法,以期为长期稳定低保存华北落叶松胚性培养物等种质资源奠定技术基础。
技术实现要素:
本发明的目的是针对现有植物愈伤组织超低温保存过程中存在预处理方法、冷冻保护剂及超低温保存后的解冻方法等方面的缺陷,提供一种华北落叶松胚性组织超低温保存的方法,通过调整预处理培养基培养以提高预培养效率和恢复生长效率。本发明方法通过液体梯度预处理与采用混合型冷冻保护剂更适合于华北落叶松胚性愈伤组织的冷冻保存,且在37℃水浴解冻后的胚性愈伤组织细胞活性最高达78%,超低温保存后的愈伤与正常增殖的愈伤组织在外观及显微结构上无明显差异,且低温保存后的愈伤组织仍具有分化形成体胚的能力。
为实现本发明的目的,本发明一方面提供一种华北落叶松胚性组织超低温保存的方法,包括对华北落叶松胚性愈伤组织进行渗透剂浓度逐渐升高的液体梯度预培养处理。
其中,所述液体梯度预培养处理为在液体培养过程中,向液体培养基中逐步添加渗透剂,且渗透剂的添加量梯度升高。
特别是,所述渗透剂选择山梨醇或蔗糖,优选为山梨醇。
尤其是,所述渗透剂在液体培养基中的浓度为0.1-0.5mol/l,优选为0.2-0.4mol/l。
特别是,所述华北落叶松胚性愈伤组织选择华北落叶松的细胞系胚性愈伤组织。
尤其是,所述华北落叶松胚性愈伤组织选择华北落叶松细胞系胚性悬浮愈伤组织液。
特别是,所述华北落叶松细胞系胚性悬浮愈伤组织液按照如下方法制备获得:
a)以华北落叶松未成熟合子胚为外植体,在固体培养基上诱导处理,获得胚性愈伤组织;
b)将步骤a)诱导处理获得的胚性愈伤组织接种于液体增殖培养基中,进行液体增殖培养,每2周继代1次,继代方式为用60目和100目细胞筛过滤,滤去大块细胞团,过滤后培养液沉淀1~2h,弃上清,加入新鲜液体增殖培养基,继代培养3-4天获得的培养液,即为本发明的华北落叶松细胞系胚性悬浮愈伤组织液。
其中,步骤a)中所述固体培养基为:1/2lv+2,4-d1.5-2.5mg/l+6-ba0.5-1.5mg/l+蔗糖30g/l+植物凝胶3g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,优选为1/2lv+2,4-d2mg/l+6-ba1mg/l+蔗糖30g/l+植物凝胶3g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,ph5.8;
特别是,诱导培养的培养条件为:24±1℃下暗培养6周。
其中,步骤b)中所述液体增殖培养基为:1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,ph5.8;优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l。
特别是,所述液体增殖培养的培养条件:24±1℃下暗培养。
本发明另一方面提供一种华北落叶松胚性组织超低温保存的方法,包括如下顺序进行的步骤:
1)将华北落叶松胚性愈伤组织置于含有渗透剂的液体增殖培养基中进行液体梯度预培养处理;
2)液体梯度预培养处理后的胚性愈伤组织置于冷冻管内,加入复合冷冻保护剂,进行程序降温,温度降低至-40℃后取出,然后投入液氮中进行超低温保存;
3)使用时,取出超低温保存胚性愈伤组织的冷冻管,进行解冻处理。
其中,步骤1)中所述液体梯度预培养处理时间为20-72h,优选为24-48h,进一步优选为48h。
特别是,所述渗透剂选择山梨醇或蔗糖,优选为山梨醇。
尤其是,所述渗透剂的浓度为0.1-0.5mol/l,优选为0.2-0.4mol/l。
其中,步骤1)中所述华北落叶松胚性愈伤组织选择植华北落叶松细胞系胚性愈伤组织。
特别是,所述华北落叶松细胞系胚性愈伤组织选择华北落叶松细胞系胚性悬浮愈伤组织液。
其中,步骤1)中所述液体增殖培养基为:1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l。
特别是,步骤1)中所述液体梯度预培养处理包括如下步骤:
1-1)将华北落叶松细胞系胚性愈伤组织置于第一预培养基中,进行第一阶段的预培养处理20-36h;
1-2)第一阶段预培养结束后,将愈伤组织取出再置于第二预培养基中,进行第二阶段的预培养处理20-36h。
其中,步骤1-1)中所述第一预培养基为含有渗透剂浓度为0.1-0.3mol/l的液体增殖培养基。
特别是,所述渗透剂的浓度优选为0.2mol/l。
尤其是,所述第一预培养基为1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.1-0.3mol/l山梨醇,优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.2mol/l山梨醇。
特别是,步骤1-1)中所述第一阶段预培养时间优选为24h;步骤1-2)中所述第二阶段预培养时间优选为24h。
其中,步骤1-2)中所述第二预培养基为含有渗透剂浓度为0.3-0.5mol/l的液体增殖培养基。
特别是,所述渗透剂的浓度优选为0.4mol/l。
尤其是,所述第二预培养基为:1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.3-0.5mol/l山梨醇,优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.4mol/l山梨醇。
特别是,步骤1-1)、1-2)中所述液体增殖培养基为:1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l。
尤其是,在第一阶段预培养处理后,还包括采用60目和100目细胞筛过滤,滤除第一预培养基后,置于第二预培养基中,进行第二阶段预培养处理
其中,步骤2)中所述复合冷冻保护剂为dmso和山梨醇或dmso和蔗糖;优选为dmso和山梨醇。
特别是,所述复合冷冻保护剂中dmso的浓度≤10%,优选为5-10%;所述山梨醇的浓度为0.3-0.5mol/l,优选为0.4mol/l;所述蔗糖的浓度为0.3-0.5mol/l,优选为0.4mol/l。
尤其是,所述复合冷冻保护剂为:0.4mol/l山梨醇+5-10%dmso或0.4mol/l蔗糖+5-10%dmso;优选为0.4mol/l山梨醇+5-10%dmso。
特别是,所述复合冷冻保护剂为:0.4mol/l山梨醇+5%dmso;0.4mol/l山梨醇+10%dmso;0.4mol/l蔗糖+5%dmso或0.4mol/l蔗糖+10%dmso;优选为0.4mol/l山梨醇+5%dmso。
其中,所述复合冷冻保护剂与预培养处理的培养物的体积之比为(1-4):1,优选为2:1。
特别是,还包括在液体梯度预培养处理后,采用60目和100目细胞筛过滤,滤除培养液,获得预培养处理的胚性愈伤组织培养物。
尤其是,步骤2)中所述程序降温为将冷冻管放入程序降温盒进行程序降温,降温速度为-1℃/min,置于-40℃的冰箱中,程序降温至少4小时以后,直至温度降低至-40℃。
其中,步骤3)中所述解冻处理为将取出的超低温保存胚性愈伤组织的冷冻管置于室温或于水浴温度为30-50℃条件下进行,待冰完全融化。
特别是,所述解冻处理优选为在水浴温度为37-42℃条件下进行,进一步优选为水浴温度为37℃。
由于胚性愈伤组织含水量较高(>90%),控制组织失水速度和失水量是影响预培养效果的关键。组织失水速度太快、失水量大,可能会造成组织过度脱水,从而引起细胞收缩、变形,细胞内外液溶质浓度升高,ph值发生变化,胞内生化环境恶化,造成脱水伤害;而失水速度过慢、失水量小,组织会因含水量太高从而导致胞内结冰,解冻时导致膜系统的破坏。因此预培养时渗透剂浓度由低到高梯度预培养可以提高组织的超低温耐性,有效控制组织失水速率并适应失水环境,使细胞分裂与分化同步,细胞内自由水含量降低,从而增强抗寒力。与固体预培养相比,通过液体悬浮组织的预培养能够使组织与培养基接触更为充分,使得适应梯度高渗环境组织或细胞更多,可有效提高冷冻保存的细胞存活率。本发明方法对华北落叶松的细胞系胚性愈伤组织通过在渗透剂浓度逐渐升高的梯度中预培养,可以有效控制组织失水速率,使组织可以适应失水环境,避免细胞失水过快受到损伤,因此本研究中采用的是0.2mol/l、0.4mol/l渗透剂梯度预培养的方式。
与现有技术相比,本发明方法具有如下优点和好处:
本发明采用液体梯度预培养相较单一浓度渗透剂的预处理,渗透剂浓度由低到高梯度预培养,可以更有效地控制组织失水速率,使组织可以适应失水环境,避免细胞失水过快受到损伤,增强组织的超低温耐性。并且相较固体组织,液体组织细胞分散性好,冷冻保护充分,利于细胞存活,液体悬浮体系增殖、成熟效率更高,更利于体胚发生的规模化繁育和应用。
本发明的细胞系胚性愈伤组织为长期培养的稳定的液体悬浮组织,而不是临用时将固体愈伤组织分散在液体组织里。因此本发明的愈伤组织为悬浮系液体组织,其增殖系数、稳定增殖和体胚诱导的效果好。
超低温保存前对组织进行预培养适当脱水,降低细胞内含水量,使细胞的分裂与分化同步,从而增强材料在面对低温保存过程中剧烈的温度变化和高度脱水时的抗逆境能力。
本发明方法适于对华北落叶松优良胚性细胞系的长期超低温保存,采用本发明方法长期保存华北落叶松胚性细胞后,胚性组织恢复培养迅速,1周左右时间即可从冻存条件下恢复;而且冷冻保存后恢复生长率与不经过冷冻保存的相比,恢复生长率达到66%以上,高达66.67~70.00%;另外随着冻存时间的延长,恢复生长率无显著差异,因此本发明方法适用于华北落叶松优良胚性细胞系的长期超低温保存。
本发明方法中以dmso和山梨醇或dmso和蔗糖的复合型冷冻保护剂,dmso的浓度保持在5-10%之间,既能降低高浓度dmso对胚性细胞的毒害作用,又能使得胚性细胞脱水,使得细胞质达到一定的浓度,提供抗冻能力,利于冷冻后细胞的存活。
本发明方法对胚性愈伤组织细胞采用渗透剂浓度梯度增加的液体增殖预培养,即对胚性细胞进行梯度预培养,显著提高解冻后细胞的存活率,细胞存活率提高至61%以上,达到61.45-74.13%。
采用本发明方法对超低温冷冻后的胚性细胞进行解冻处理,解冻效果好,细胞存活率高达59%以上,达到59-78.22%;由于解冻温度造成的解冻速度适中,一方面降低了细胞吸水和去质壁分离的损伤,另一方面又很大程度避免解冻速度慢引起细胞内发生再结晶而造成细胞破裂和细胞死亡,因而显著提高了细胞存活率。
附图说明
图1为不同解冻方式对细胞存活率的影响;
图2为华北落叶松胚性愈伤组织超低温保存后的恢复生长图,其中2a为恢复生长0天;2b为恢复生长7天;2c为恢复生长14天;2d为恢复生长28天;
图3为不同液氮冻存时间对胚性组织恢复生长率的影响。
图4冷冻保存的胚性组织恢复培养后诱导体细胞胚成熟
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1供试材料
供试材料选用稳定的华北落叶松胚性细胞系bl13-25a的继代3-4天的胚性悬浮液进行超低温冷冻保存研究,具体如下:
(1)华北落叶松胚性愈伤组织的诱导
以华北落叶松未成熟合子胚为外植体,进行胚性愈伤组织的诱导。胚性愈伤组织诱导固体培养基为:1/2lv+2,4-d1.5-2.5mg/l+6-ba0.5-1.5mg/l+蔗糖30g/l+植物凝胶3g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,优选为1/2lv+2,4-d2mg/l+6-ba1mg/l+蔗糖30g/l+植物凝胶3g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,ph5.8,24±1℃下暗培养6周后,诱导获得胚性愈伤组织。(lv培养基为:kno31900mg/l+nh4no31650mg/l+kh2po4340mg/l+cacl2.2h2o22mg/l+mgso4.7h2o1850mg/l+h3bo331mg/l+znso4.7h2o43mg/l+mnso4.h2o21mg/l+na2moo4.2h2o1.25mg/l+ki4.15mg/l+cuso4.5h2o0.5mg/l+cocl20.125mg/l+feso4.7h2o27.8mg/l+na2edta.2h2o37.3mg/l+肌醇100mg/l+维生素b10.1mg/l+尼克酸0.5mg/l+维生素b60.1mg/l)
(2)胚性悬浮液的制备
在100ml三角瓶中加入30ml液体增殖培养基,起始接种量为2%(w/v),即向培养基中添加0.6g胚性愈伤组织;其中:
液体增殖培养基为:1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l;
液体增殖培养条件:摇床转数105转/分钟,ph5.8,24±1℃下暗培养;
每2周继代1次,继代方式为用60目和100目细胞筛过滤,滤去大块细胞团,过滤后培养液沉淀1~2h,弃上清,加入新鲜液体增殖培养基。
取继代培养3-4天的胚性悬浮液为供试材料(即本发明超低温冷冻保存的胚性愈伤组织,华北落叶松胚性细胞系bl13-25a的继代3-4天的胚性悬浮液),进行超低温冷冻保存。
实施例2
1、预培养处理
根据针叶树通常使用的预培养方式,本研究以添加高浓度的蔗糖或山梨醇进行梯度培养的方式进行。预培养的培养液采用液体增殖培养基,分别以0.2mol/l和0.4mol/l的浓度进行梯度预培养,每个浓度培养24h。
1-1)第一阶段预培养处理
以继代培养3-4天的胚性悬浮液为供试材料,在100ml三角瓶中加入30ml第一预培养基,进行第一阶段的预培养处理;其中:
起始接种量为2%(w/v),即向培养基中添加0.6g胚性愈伤组织;
第一预培养基为:1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.2mol/l山梨醇;
第一阶段预培养处理条件:摇床转数105转/分钟,ph5.8,24±1℃下暗培养,培养时间为24h(通常为20-36h);
1-2)第二阶段预培养处理
在第一阶段预培养处理24h(通常为20-36h)后,采用60目和100目细胞筛过滤,滤除培养液后,置于第二预培养基中,进行第二阶段预培养处理,其中:
第二预培养基为:1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.4mol/l山梨醇;
第二阶段预培养处理条件:摇床转数105转/分钟,ph5.8,24±1℃下暗培养;第二阶段预培养处理的培养时间为24h(通常为20-36h)。
本发明的胚性愈伤组织悬浮材料经过渗透剂浓度逐渐升高的梯度预培养处理后,可以使胚性愈伤组织与预培养液体培养基接触更为充分,使得适应梯度高渗环境组织或细胞更多,可有效提高冷冻保存的细胞存活率;而且由于胚性愈伤组织含水量较高,控制组织失水速度和失水量是影响预培养和冷冻保存效果的关键,相较单一浓度渗透剂的预处理,渗透剂浓度由低到高梯度预培养,可以更有效地控制组织失水速率,使组织梯度失水,逐渐提高细胞质浓度,适应失水环境,避免细胞失水过快受到损伤,因此本专利采用浓度为0.2-0.4mol/l的渗透剂梯度预培养的方式。
2、冷冻处理
第二阶段预培养处理24h(通常为20-36h)后,采用60目和100目细胞筛过滤,滤除培养液,将培养物分装至2ml的冷冻管内,每支冷冻管内装入0.6ml过滤后的培养物,然后再分别添加冷冻保护液,冷冻保护液的添加量为1.2ml;冷冻保护液与培养物的体积之比为2:1(通常为(1-4):1)冷冻保护液的组成如下:山梨醇0.4mol/l+dmso5%;
将冷冻管放入程序降温盒(nalgenetmcryo1℃freezingcontainer)进行程序降温,降温速度为-1℃/min,置于-40℃的冰箱中。程序降温至少4小时以后,直至温度降低至-40℃后,将冷冻管取出,迅速投入液氮生物容器中保存。
3、解冻处理
将存储在液氮生物容器内不同时间(1、7、14、28天)的冷冻管取出,分别置于4℃冰箱内放置、室温下放置、37℃水浴、42℃水浴以及50℃水浴条件下进行解冻;其中:
将冷冻处理后的冷冻管分别于4℃冰箱、室温(25℃,通常为15-30℃)下,静置,直至愈伤组织完全复融;
将冷冻处理后的冷冻管分别置于水浴锅中进行解冻,其中分别控制水浴锅的温度为37℃、42℃、50℃,直至愈伤组织完全复融;
待组织复融后,滤掉冷冻保护液,每个冷冻管中的复融后的愈伤组织分别用液体增殖培养基洗涤3-4次,其中,所述液体增殖培养基为:1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l,优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l;
用滤纸吸干组织表面液体培养基后,备用。解冻复融后的胚性培养物用于ttc检测,检测冷冻愈伤组织复溶后的胚性细胞的活力,从而确定最佳解冻方式。
实施例3
1、预培养处理
1-1)第一阶段预培养处理
与实施例2的相同;
1-2)第二阶段预培养处理
其余与实施例2的相同;
2、冷冻处理
除了冷冻保护液为山梨醇0.4mol/l+dmso10%之外,其余与实施例2相同。
3、解冻处理
与实施例2相同。
实施例4
1、预培养处理
1-1)第一阶段预培养处理
除了第一预培养基为:1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.2mol/l蔗糖之外,其余与实施例2的相同;
1-2)第二阶段预培养处理
除了第二预培养基为:1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.4mol/l蔗糖之外,其余与实施例2的相同;
2、冷冻处理
除了冷冻保护液为蔗糖0.4mol/l+dmso5%之外,其余与实施例2相同。
3、解冻处理
与实施例2相同。
实施例5
1、预培养处理
1-1)第一阶段预培养处理
除了第一预培养基为:1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.2mol/l蔗糖之外,其余与实施例2的相同;
1-2)第二阶段预培养处理
除了第二预培养基为:1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/l+0.4mol/l蔗糖之外,其余与实施例2的相同;
2、冷冻处理
除了冷冻保护液为蔗糖0.4mol/l+dmso10%之外,其余与实施例2相同。
3、解冻处理
与实施例2相同。
对照例1
以继代培养3-4天的胚性悬浮液的供试材料采用60目和100目细胞筛过滤,滤除培养液后的培养物,为对照例1,即不进行预处理、不进行冷冻处理。
对照例2
将继代培养3-4天的胚性悬浮液的供试材料采用60目和100目细胞筛过滤,滤除培养液,培养物分装至2ml的冷冻管内,每支冷冻管内装入0.6ml过滤后的培养物,然后直接进行冷冻处理,即将冷冻管放入程序降温盒(nalgenetmcryo1℃freezingcontainer)进行程序降温,降温速度为-1℃/min(通常为-1℃/min,优选为-1℃/min),置于-40℃的冰箱中。程序降温至少4小时以后,直至温度降低至-40℃后,将冷冻管取出,迅速投入液氮生物容器中保存。
对照例2的愈伤组织不进行预处理,不添加冷冻保护剂,直接进行冷冻处理。
试验例1细胞存活率检测
采用氯化三苯四氮唑(ttc)还原法(ttc法)测定冷冻后组织的细胞活力。ttc即2,3,5———氯化三苯基四氮唑(2,3,5-tripheny1-2h-tetrazoliumchloride),可以用来测定脱氢酶的活性。在细胞的线粒体中四氮唑(tetrazolium)从电子传递链上接受电子形成formazan衍生物,从而使原来无色的细胞变成红色。细胞活力强,新陈代谢旺盛,这种转化能力就强,红色深;而死细胞新陈代谢停止不能使四氮唑转变成formazan衍生物,细胞不变色。经ttc处理后的细胞,用蒸馏水洗去残余的ttc,然后经乙醇脱色使细胞中的formazan衍生物(红色)全部洗脱到乙醇中,细胞转成无色。然后取上清液测吸光值。吸光值越大,表明细胞的活力越强。具体操作如下:
将实施例2-5中超低温冷冻保存1天的冷冻管内培养物解冻复融,并洗涤后的胚性材料、对照例1未经冷冻处理的愈伤组织材料、对照例2的冷冻后解冻复融的愈伤组织材料分别放入10ml试管中,加入5ml0.5%ttc溶液,在25℃黑暗条件下培育24h;ttc被脱氢酶还原成不溶于水的三苯基甲腙(ttf),吸去未被还原的ttc溶液,再用蒸馏水冲洗3-4次;加入5ml95%乙醇,在65℃恒温水浴中培育30min;抽提ttc被脱氢酶还原生成的红色ttf;冷却后取上清,岛津uv2550分光光度计测定其在485nm下的吸光值,每个处理做3次重复。测定结果如表1所示。
其中以对照例1的未经过超低温冷冻保存的愈伤组织为对照,其中对照例1的组织ttc法测定的吸光度值为100%,按照公式(1)计算细胞相对存活率:
测定结果如表1所示。
表1愈伤组织冷冻后细胞存活率测定结果
从测定结果可知:
1、采用本发明方法超低温保存植物愈伤组织,冷冻复融后的组织细胞存活率高,达到61.45%以上,实施例2方法处理保存的植物愈伤组织细胞存活率达到74.13%。
2、与对照例2相比,即对照组愈伤组织不进行预处理且冷冻过程中不添加冷冻保护剂,直接进行冷冻保存的组织细胞存活率显著低于本发明方法处理的组织细胞存活率,平均细胞存活率为23.54%(该比值为没有经过任何过程处理直接放到液氮里的组织与没有经过液氮保存的组织相比)。低温冰冻会使细胞内水结冰,造成细胞结构不可逆的破坏。植物组织不经过预处理,会导致细胞死亡,因此细胞存活率较低。
为了进一步研究预培养方式和冷冻保护剂类型的影响,进行双因素的方差分析,结果见表2。由分析结果可知,冷冻保护剂的浓度对细胞存活率具有极显著性影响(p<0.01),由于实验使用的冷冻保护剂dmso对细胞具有一定毒害作用,高浓度的dmso会造成细胞死亡,因此5%dmso更适合华北落叶松胚性愈伤组织的冷冻保护;渗透剂的类型,包括山梨醇或蔗糖,对细胞存活率的影响显著(p<0.05)。
表2超低温冷冻前预处理因素方差分析表
由表2的双因素的方差分析结果可知:本发明实施例2的保存方法,即0.2mol/l、0.4mol/l山梨醇分别预培养24h,以0.4mol/l山梨醇添加5%dmso作为冷冻保护剂,更有利于华北落叶松胚性愈伤冷冻后的细胞存活。
试验例2解冻方式对细胞存活率的影响试验
植物材料的超低温保存过程中,冷冻和解冻都可能造成细胞的冰冻伤害,采用合适的解冻方式才可以避免解冻过程中水分吸收导致的渗透压剧烈变化对细胞膜系统造成破坏。
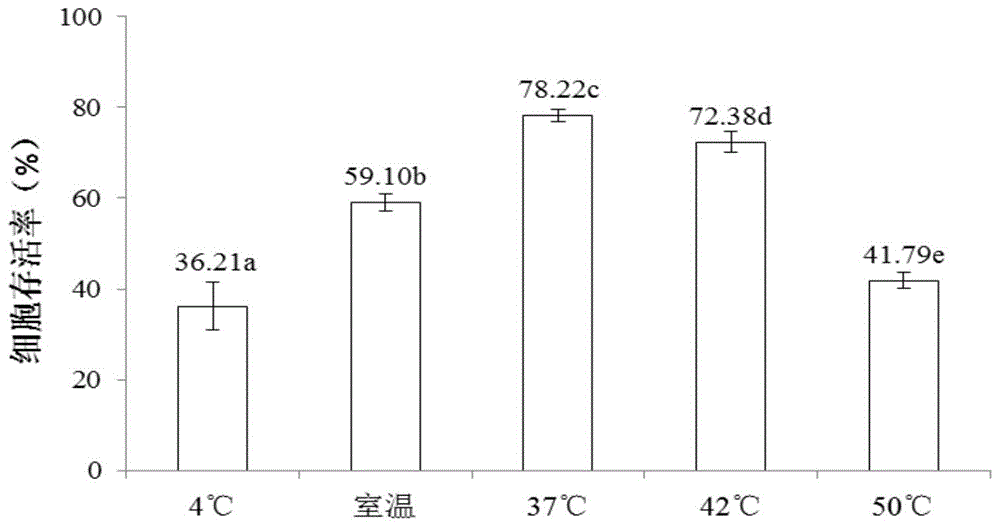
以实施例2中超低温冷冻保存1天后的植物材料进行解冻试验,将冷冻1天后的冷冻管分别置于4℃冰箱、室温下放置;置于37℃、42℃、50℃水浴锅内,进行水浴解冻,以上述五种方式进行解冻,待组织复融后,滤掉冷冻保护液,每个冷冻管中的组织分别用液体增殖培养基洗涤3-4次。滤纸吸干组织表面液体培养基后,用于ttc检测,从而确定最佳解冻方式,测定结果如图1。
由图1可以看出:随着解冻温度逐渐升高,细胞存活率呈现先升高后降低的趋势,解冻效果为37℃水浴>42℃水浴>室温>50℃水浴>4℃冰箱,其中以37℃水浴解冻效果最好,细胞存活率平均为78.22%,可能由于该温度造成的解冻速度适中,一方面降低了细胞吸水和去质壁分离的损伤,另一方面又很大程度避免解冻速度慢引起细胞内发生再结晶而造成细胞破裂和细胞死亡。4℃冰箱中进行的解冻,就是解冻速度过于缓慢,引起细胞内的再结晶,从而造成细胞存活率较低。
试验例3冷冻后组织恢复生长检测
以上试验得到的最有效超低温冷冻保存程序为:培养基中附加0.2mol/l、0.4mol/l山梨醇分别预培养24h;以0.4mol/l山梨醇和5%dmso作为冷冻保护剂,程序性降温后,液氮冷冻保存;1周后,取出冷冻的胚性组织,37℃水浴进行解冻;液体培养基冲洗3次。
以实施例2中超低温冷冻保存7天后的植物材料进行解冻试验,将冷冻7天后的冷冻管置于37℃水浴锅内,进行水浴解冻后用液体培养基冲洗3次。
经过以上程序,解冻后的胚性组织表面较光滑,无丝状结构(如图2a),将其置于固体增殖培养基:1/2lv+2,4-d0.1-0.3mg/l+6-ba0.05-0.15mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/+植物凝胶2.8g/l上,优选为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/+植物凝胶2.8g/l上25℃黑暗条件下进行恢复培养;恢复培养7天后,在胚性组织的某个部分最先长出白色半透明的丝状胚性愈伤组织(如图2b);恢复培养14天后,在冷冻的愈伤组织各个部分陆续有胚性愈伤组织长出,并且不断增大(如图2c);至恢复培养28天,已在冷冻的胚性组织表面包裹了一层重新生长的胚性愈伤组织(如图2d)。
试验例4冷冻保存时间对组织恢复生长率的影响试验
超低温保存的目标是长期、安全、稳定的保存优良种质。因此,本实验研究了超低温保存时间对解冻后组织的恢复生长的影响。
以实施例2中超低温冷冻保存1、7、14、28天后的植物材料进行解冻试验,将冷冻保存后的冷冻管置于37℃水浴锅内,进行水浴解冻后用液体培养基冲洗3次。
将解冻复融后的胚性培养物转移到固体增殖培养基(固体增殖培养基为1/2lv+2,4-d0.2mg/l+6-ba0.1mg/l+蔗糖30g/l+水解酪蛋白400mg/l+谷氨酰胺500mg/+植物凝胶2.8g/l);每皿接种6块胚性愈伤组织,5次重复。在25℃黑暗条件下,进行胚性愈伤组织超低温冷冻后的恢复培养。
培养过程中,不断观察愈伤组织恢复生长情况,并在培养10天后统计恢复生长率,愈伤组织恢复生长率按照公式(2)计算,测定结果如图2所示。以不经过冷冻保存的胚性愈伤组织的增殖培养为对照。
由图3可见,未经过超低温保存的胚性组织的生长率为100%;胚性组织冷冻保存1、7、14、28天后,进行解冻恢复培养,发现四个保存时间后的恢复生长率之间并无显著差异,与未经超低温保存的对照组相比,本发明方法处理的胚性组织恢复生长率下降,降低至66.67~70.00%。液氮保存时间对华北落叶松胚性愈伤组织的恢复生长无显著影响,本发明方法的超低温保存条件可以达到长期保存的目的。
试验例5体细胞胚的成熟试验
以实施例2的经超低温保存的组织进行体细胞胚的成熟培养,将实施例2的超低温冷冻保存1、7、14、28天后的植物材料解冻,并恢复生长培养,将恢复生长的愈伤组织置于成熟培养基上进行分化培养,观察愈伤分化能力,其中组织恢复培养方法参照试验例4。
体胚的成熟过程设置过渡培养阶段和成熟培养阶段。将液体悬浮组织均匀分散于滤纸上,真空抽滤掉残存的液体培养基,置于过渡培养基上,过渡培养阶段条件为1/2lv培养基+活性炭(ac)2g/l+蔗糖10g/l,不添加植物生长调节剂,24±1℃暗培养7天。
成熟阶段以1/2lv培养基为基本培养基,添加aba16mg/l,蔗糖50g/l;phytagel7g/l;peg75g/l,附加水解酪蛋白400mg/l,谷氨酰胺500mg/l,ph调至5.8,24±1℃下暗培养8周左右,成熟培养后的成熟体胚如图4。
由图4可见,经超低温冷冻保护而恢复生长的胚性组织能够诱导出结构正常的体细胞胚,具备体胚再生能力的胚性组织为100%;与之相比,直接经液氮保存后存活的组织则失去了正常体胚的形成能力。因此,经冷冻保护处理的超低温保存不但维持了胚性组织的增殖生长能力,而且没有降低胚性组织的分化潜能。
本发明上述实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!