HDGF对动脉粥样硬化的影响
hdgf对动脉粥样硬化的影响
技术领域
1.本发明涉及生物医学领域,具体涉及hdgf对动脉粥样硬化的影响。
背景技术:
2.心血管疾病(cardiovascular disease,cvd)已成为现代社会威胁人类健康的公共卫生问题,尽管全球医疗卫生水平在不断提升,但cvd仍然是危害人类生命健康的头号杀手。据美国心脏病学会(aha)统计,到2030年,cvd引起的死亡人数将增至2360万以上,而动脉粥样硬化(atherosclerosis,as)是导致卒中和心衰等严重cvd的重要病理基础。
3.巨噬细胞作为炎性因子的主要来源和斑块内先天性免疫应答的主要细胞在as各个阶段都发挥关键作用。巨噬细胞是治疗as的重要干预靶点,通过干预巨噬细胞来减少斑块内炎症反应和稳定斑块,对预防急性心血管事件的发生具有重要意义。
技术实现要素:
4.针对现有技术的不足,本发明提出了hdgf对动脉粥样硬化的影响,具体通过小鼠模型进行研究与反映。
5.本发明的目的可以通过以下技术方案实现:
6.一种小鼠模型构建方法,包括以下步骤:
7.步骤1:构建雄性apoeko小鼠和单核细胞特异性hdgf敲除的apoeko小鼠(hdgfmac
‑
koapoeko),分别给予正常和高脂饮食喂养;检测动物模型血脂含量;检测hdgf含量以及hdgf与巨噬细胞的共定位,检测血管中m1和m2型巨噬细胞特征标记物含量、测血浆中炎症因子的表达、斑块内活性氧水平与血管舒张功能;
8.步骤2:将apoeko和hdgfmac
‑
koapoeko分别给予尾静脉注射腺病毒过表达hdgf进行补救实验,给予正常和高脂饮食喂养,重复上述动物检测实验,检测恢复hdgf后是否促进apoeko小鼠as斑块的生成;
9.步骤3:构建小鼠骨髓来源的两种单核细胞模型,体外分别给予lps+ifnγ诱导m1型巨噬细胞,给予il
‑
4诱导m2型巨噬细胞,检测细胞内hdgf的含量;通过sirna和腺病毒转染建立hdgf缺失和过表达细胞模型,再给予lps+ifnγ和il
‑
4刺激,检测m1和m2型巨噬细胞相关靶蛋白的表达,炎症因子的含量;给予ox
‑
ldl刺激后进行染色检测细胞内脂质含量。
10.可选地,还包括以下步骤:构建雄性apoeko小鼠和单核细胞特异性hdgf敲除的apoeko小鼠分别给予正常和高脂饮食喂养,抑制小鼠糖酵解通路,检测斑块内糖摄取水平,检测斑块糖酵解酶hk1、pfkfb3和ldha的mrna和蛋白变化及相应酶的活性;检测斑块中atp、adp和nad+等代谢产物含量;提取骨髓来源巨噬细胞,检测细胞外酸化率、糖酵解水平以及耗氧率;
11.建立人外周血和小鼠骨髓来源的两种单核细胞,通过sirna和腺病毒转染建立hdgf缺失和过表达细胞模型,给予2
‑
dg预处理、lps+ifnγ和il
‑
4刺激,检测2
‑
nbd
‑
脱氧葡萄糖摄取反应糖酵解水平、氧化磷酸化水平、细胞中atp、adp和nad+等代谢产物含量、pdhk1
的蛋白表达和活性以及线粒体膜电位;
12.建立人外周血和小鼠骨髓来源的两种单核细胞,通过sirna和腺病毒转染建立hdgf缺失和过表达细胞模型,体外给予lps+ifnγ和il
‑
4刺激,收集细胞进行rna
‑
seq测序和代谢组学分析。
13.可选地,通过油红o染色检测斑块脂质含量,通过masson染色检测斑块胶原含量,通过he染色检测斑块面积、计算内膜/中膜比值。
14.可选地,还包括以下步骤:
15.构建雄性apoeko小鼠和单核细胞特异性mettl3敲除的小鼠,分别给予正常和高脂饮食喂养周,抑制小鼠糖酵解通路;检测所述小鼠的血脂含量、斑块脂质含量、斑块胶原含量、斑块面积、内膜/中膜比值、hdgf含量、hdgf与巨噬细胞的共定位、血管中m1和m2型巨噬细胞特征标记物含量、血浆中炎症因子的表达、斑块内糖摄取水平、斑块糖酵解酶hk1、pfkfb3和ldha的mrna和蛋白变化及相应酶的活性、以及斑块中atp、adp和nad+等代谢产物含量;提取骨髓来源巨噬细胞,检测所述巨噬细胞的2
‑
nbd
‑
脱氧葡萄糖摄取反应糖酵解水平与氧化磷酸化水平;
16.将apoeko和mettl3mac
‑
koapoeko分别给予尾静脉注射腺病毒过表达mettl3进行补救实验,给予正常和高脂饮食喂养16周,重复上述步骤,检测是否恢复mettl3后hdgf含量增加并促进apoeko小鼠as斑块的生成;
17.建立人外周血和小鼠骨髓来源的两种单核细胞,通过sirna和腺病毒转染建立mettl3缺失和过表达细胞模型,给予2
‑
dg预处理,lps+ifnγ和il
‑
4刺激24h,mrna半衰期实验检测m1型巨噬细胞内hdgf mrna的稳定性,及rna
‑
m6a修饰对hdgf表达的影响;检测m1和m2型巨噬细胞相关靶蛋白的表达和炎症因子的含量,以及细胞内糖酵解和氧化磷酸化水平;收集细胞进行merip
‑
seq,检测hdgf发生m6a修饰的水平及具体的修饰位点。
18.可选地,通过腹腔注射糖酵解通路抑制剂2
‑
脱氧
‑
d葡萄糖抑制小鼠糖酵解通路。
19.本发明的有益效果:
20.与现有的实验模型相比,本发明构建的小鼠模型:
21.明确hdgf促进as发生发展的作用;
22.验证mettl3介导hdgf的rna
‑
m6a修饰稳定hdgf蛋白表达,改变能量代谢重编程诱导m1型巨噬细胞极化促进as形成的分子机制。
23.通过本发明的方法构建的小鼠模型,能够作为研究平台反应hdgf对动脉粥样硬化的影响与作用机理,具有较高的研究价值。
附图说明
24.下面结合附图对本发明作进一步的说明。
25.图1为本技术的小鼠模型反映的hdgf参与as发展过程中巨噬细胞极化;
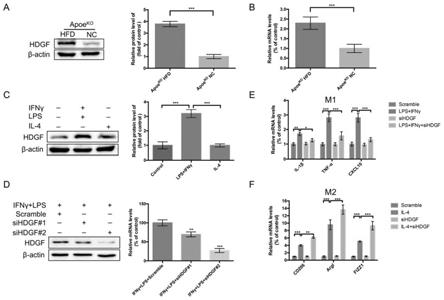
26.图2为本技术的小鼠模型反映的hdgf通过调控能量代谢重编程诱导m1型巨噬细胞极化;
27.图3为本技术的小鼠模型反映的巨噬细胞特异性敲除hdgf的apoe
ko
小鼠抑制动脉粥样硬化形成;
28.图4为本技术的小鼠模型反映的rna
‑
m6a修饰酶mettl3介导hdgf的蛋白稳定表达;
29.图5为本技术的小鼠模型反映的mettl3通过hdgf调控能量代谢重编程介导m1巨噬细胞极化;
30.图6为本技术的小鼠模型反映的巨噬细胞特异性敲除mettl3的apoe
ko
小鼠抑制动脉粥样硬化形成。
具体实施方式
31.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
32.在本发明的一些示例中,通过构建小鼠模型,反映hdgf对动脉粥样硬化(as)发生发展及巨噬细胞极化的作用,所述小鼠模型的构建方法步骤具体如下。
33.(1)构建雄性apoe
ko
小鼠和单核细胞特异性hdgf敲除的apoe
ko
小鼠(hdgf
mac
‑
ko
apoe
ko
),分别给予正常和高脂饮食喂养4、8、12、16周建立as动物模型模拟斑块发展不同时期。在不同阶段检测动物模型血脂含量,油红o染色检测斑块脂质含量,masson染色检测斑块胶原含量,he染色检测斑块面积、计算内膜/中膜比值,免疫组化检测hdgf含量以及hdgf与巨噬细胞的共定位,rt
‑
pcr检测血管中m1和m2型巨噬细胞特征标记物含量,elisa检测血浆中炎症因子的表达,dhe染色检测斑块内活性氧水平,血管张力测定仪检测血管舒张功能。
34.将apoe
ko
和hdgf
mac
‑
ko
apoe
ko
分别给予尾静脉注射腺病毒过表达hdgf进行补救实验,给予正常和高脂饮食喂养16周,重复上述动物检测实验,检测恢复hdgf后是否促进apoe
ko
小鼠as斑块的生成。
35.(2)建立人外周血和小鼠骨髓来源的两种单核细胞模型,体外分别给予lps+ifnγ诱导m1型巨噬细胞,给予il
‑
4诱导m2型巨噬细胞,检测细胞内hdgf的含量;通过sirna和腺病毒转染建立hdgf缺失和过表达细胞模型,再给予lps+ifnγ和il
‑
4刺激,检测m1和m2型巨噬细胞相关靶蛋白的表达,炎症因子的含量;给予ox
‑
ldl刺激后进行油红o染色检测细胞内脂质含量。
36.通过以上检测结果明确hdgf是否参与as的发生发展过程,以及hdgf对巨噬细胞极化的影响。
37.在本发明的一些示例中,构建了小鼠模型,以研究hdgf促进巨噬细胞发生极化的分子机制,其中构建模型的方法如下所示。
38.(1)构建雄性apoe
ko
小鼠和单核细胞特异性hdgf敲除的apoe
ko
小鼠(hdgf
mac
‑
ko
apoe
ko
)分别给予正常和高脂饮食喂养4、8、12、16周建立as动物模型模拟斑块发展不同时期,小鼠腹腔注射剂量为500mg/kg的糖酵解通路抑制剂2
‑
脱氧
‑
d葡萄糖(2
‑
dg)抑制糖酵解通路,氟脱氧葡萄糖正电子发射计算机断层扫描(
18
f
‑
fdg pet
‑
ct)检测斑块内糖摄取水平,rt
‑
pcr和western blot检测斑块糖酵解酶hk1、pfkfb3和ldha的mrna和蛋白变化及相应酶的活性;高效液相色谱检测斑块中atp、adp和nad
+
等代谢产物含量;提取骨髓来源巨噬细胞,xf24海马生物能量测定仪(seahorse)检测细胞外酸化率(extracellular acidification rate,ecar)和流式检测2
‑
nbd
‑
脱氧葡萄糖摄取反应糖酵解水平,seahorse
检测耗氧率(o
2 consumption rate,ocr)反应氧化磷酸化水平。
39.(2)建立人外周血和小鼠骨髓来源的两种单核细胞,通过sirna和腺病毒转染建立hdgf缺失和过表达细胞模型,给予2
‑
dg(0.25μm)预处理,lps+ifnγ和il
‑
4刺激24h,seahorse检测ecar和流式检测2
‑
nbd
‑
脱氧葡萄糖摄取反应糖酵解水平,seahorse检测ocr反应氧化磷酸化水平;高效液相色谱检测细胞中atp、adp和nad
+
等代谢产物含量;检测pdhk1的蛋白表达和活性,jc
‑
1染色检测线粒体膜电位。
40.(3)建立人外周血和小鼠骨髓来源的两种单核细胞,通过sirna和腺病毒转染建立hdgf缺失和过表达细胞模型,体外给予lps+ifnγ和il
‑
4刺激,收集细胞进行rna
‑
seq测序和代谢组学分析。
41.通过以上实验探索hdgf通过影响能量代谢重编程促使m1型巨噬细胞极化的具体机制。
42.在本发明的一些示例中,通过构建小鼠模型,反映m1型巨噬细胞hdgf的rna
‑
m6a修饰水平及其调控hdgf表达的分子机制,其构建步骤如下。
43.(1)构建雄性敲除apoe的小鼠(apoe
ko
小鼠)和单核细胞特异性mettl3敲除的小鼠(mettl3
mac
‑
ko
apoe
ko
),分别给予正常和高脂饮食喂养4、8、12、16周建立as动物模型模拟斑块发展不同时期,小鼠腹腔注射2
‑
dg(500mg/kg)抑制糖酵解通路。在不同阶段检测动物模型血脂含量,油红o染色检测斑块脂质含量,masson染色检测斑块胶原含量,he染色检测斑块面积、计算内膜/中膜比值,免疫组化检测hdgf含量以及hdgf与巨噬细胞的共定位,rt
‑
pcr检测血管中m1和m2型巨噬细胞特征标记物含量,elisa检测血浆中炎症因子的表达,
18
f
‑
fdg pet
‑
ct检测斑块内糖摄取水平,rt
‑
pcr和western blot检测斑块糖酵解酶hk1、pfkfb3和ldha的mrna和蛋白变化及相应酶的活性;高效液相色谱检测斑块中atp、adp和nad
+
等代谢产物含量;提取骨髓来源巨噬细胞,seahorse检测ecar和流式检测2
‑
nbd
‑
脱氧葡萄糖摄取反应糖酵解水平,seahorse检测ocr反应氧化磷酸化水平。
44.将apoe
ko
和mettl3
mac
‑
ko
apoe
ko
分别给予尾静脉注射腺病毒过表达mettl3进行补救实验,给予正常和高脂饮食喂养16周,重复上述动物检测实验,检测是否恢复mettl3后hdgf含量增加并促进apoe
ko
小鼠as斑块的生成。
45.(2)建立人外周血和小鼠骨髓来源的两种单核细胞,通过sirna和腺病毒转染建立mettl3缺失和过表达细胞模型,给予2
‑
dg(0.25μm)预处理,lps+ifnγ和il
‑
4刺激24h,mrna半衰期实验检测m1型巨噬细胞内hdgf mrna的稳定性,及rna
‑
m6a修饰对hdgf表达的影响;检测m1和m2型巨噬细胞相关靶蛋白的表达和炎症因子的含量,以及细胞内糖酵解和氧化磷酸化水平。收集细胞进行merip
‑
seq,检测hdgf发生m6a修饰的水平及具体的修饰位点。
46.(3)建立人外周血和小鼠骨髓来源的两种单核细胞,通过sirna和腺病毒转染建立mettl3缺失和过表达细胞模型,体外给予lps+ifnγ和il
‑
4刺激,通过rip和串联质谱检测与hdgf rna
‑
m6a特异性结合的甲基化识别酶。
47.(4)以hdgf为靶点,应用ds小分子对接软件设计应用于临床的靶向药物。
48.通过以上实验明确hdgf在as发生发展过程中表达量增加的具体机制,主要通过mettl3介导发生m6a修饰稳定hdgf的mrna,从而增加hdgf的蛋白表达。
49.在本发明的又一些示例中,通过构建小鼠模型,反映hdgf对as发生发展及巨噬细胞极化的作用,具体步骤可以如下所示。
50.通过胚胎干细胞技术,在体外构建一个在hdgf基因两端分别含有一个loxp位点的基因序列,然后将其转入胚胎干细胞内,重新植入到假孕小鼠的子宫内,使其重新发育成为一个完整的胚胎,最终培育出hdgf
fl/fl
小鼠。将hdgf
fl/fl
与巨噬细胞特异性cre工具鼠lysm
‑
cre进行交配,通过对子代小鼠基因鉴定筛选出hdgf
mac
‑
ko
小鼠。将hdgf
mac
‑
ko
和hdgf
fl/fl
小鼠分别与apoe
ko
小鼠杂交,获得hdgf
mac
‑
ko
apoe
ko
小鼠。
51.(2)取8周龄hdgf
mac
‑
ko
apoe
ko
和hdgf
wt
apoe
ko
小鼠,分别给予正常和高脂饮食喂养4、8、12、16周建立as动物模型模拟斑块发展不同时期,在不同阶段通过elisa检测血浆中总胆固醇、甘油三酯和低密度脂蛋白
‑
胆固醇等血脂含量,油红o染色检测斑块脂质含量,masson染色检测斑块胶原含量,he染色检测斑块面积、计算内膜/中膜比值,dhe染色检测斑块内活性氧含量,免疫荧光双染鉴定hdgf含量以及hdgf与巨噬细胞cd68的共定位,rt
‑
pcr检测血管中m1型巨噬细胞特征标记物il
‑
1β、il
‑
6、cox
‑
2、inos、gro1、mcp
‑
1、tnfα、nlrp3、cxcl10、vcam
‑
1和icam
‑
1含量,rt
‑
pcr检测血管中m2型巨噬细胞特征标记物arg
‑
1、cd206、mrc1、fizz1、chi3l3、pparγ和il
‑
10的含量,elisa检测血浆中il
‑
1β和il
‑
10的表达,以及血管张力测定仪检测血管舒张功能。
52.(3)将hdgf
mac
‑
ko
apoe
ko
和hdgf
wt
apoe
ko
分别给予尾静脉注射腺病毒ad
‑
hdgf过表达hdgf进行补救实验,给予正常和高脂饮食喂养16周,重复上述动物检测实验,检测是否恢复hdgf后促进apoe
ko
小鼠as斑块的生成。
53.(4)人外周血单核细胞(peripheral blood mononuclear cell,pbmc)提取:将抗凝全血转入50ml离心管中,加入等体积pbs溶液稀释,轻轻混匀;取两支15ml离心管,先加入5ml蔗糖溶液,然后将血液轻轻加到两支离心管蔗糖溶液上层,避免两种溶液混合在一起;2000rpm,离心20min,用吸管将白色层吸取在另一干净15ml离心管中;加入pbs至10
‑
15ml,1500rpm,离心10min后弃上清,再加入培养基重复此步骤清洗;加入5
‑
10ml培养基重悬细胞,放入37℃孵箱培育。
54.(5)小鼠骨髓来源单核细胞(bone marrow derived monocyte,bmdm)提取:选取6
‑
8周c57bl/6小鼠,颈椎脱臼处死,75%酒精浸泡10min,于超净台中剪出小鼠大腿骨和小腿骨,去除肌肉组织;将腿骨浸泡在75%酒精2min后,转移到pbs中清洗,然后将腿骨的两端剪通,用1ml无菌注射器吸取rpmi
‑
1640完全培养基冲出骨髓;用移液枪将吹出来的细胞打散,然后通过40μm过滤网至大皿中,加入10倍体积红细胞裂解液静置10min溶解红细胞,2000rpm,离心10min,去上清,细胞用rpmi
‑
1640洗两遍,用含有10%血清和20ng/ml小鼠巨噬细胞集落刺激因子的完全培养基重悬细胞种入孔板中,3天后,洗掉未贴壁细胞,换上新的完全培养基,继续培养3天,培养至第7天的细胞即为m0细胞,可用于做实验。
55.(6)将本示例的步骤(4)和(5)中取得的细胞体外给予100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4刺激24h分别诱导成m1和m2型巨噬细胞,rt
‑
pcr和western blot检测细胞内hdgf的含量;通过hdgf sirna和ad
‑
hdgf建立缺失和过表达细胞模型,给予lps+ifnγ和il
‑
4刺激后,rt
‑
pcr和western blot检测m1型巨噬细胞特征标记物(il
‑
1β、il
‑
6、cox
‑
2、inos、gro1、mcp
‑
1、tnfα、nlrp3、vcam
‑
1和icam
‑
1)和m2型巨噬细胞特征标记物(arg
‑
1、mrc1、rctnla、chi3l3、pparγ和il
‑
10)的含量,elisa检测细胞上清液中炎症因子il
‑
1β和il
‑
10的含量;给予50μg/ml ox
‑
ldl刺激后,通过油红o染色检测细胞内脂质含量。
56.在本发明的又一些示例中,通过构建小鼠模型,反映hdgf促进巨噬细胞发生极化
的分子机制,
57.(1)将雄性hdgf
mac
‑
ko
apoe
ko
和hdgf
wt
apoe
ko
分别给予正常和高脂饮食喂养4、8、12、16周建立as动物模型模拟斑块发展不同时期,小鼠腹腔注射2
‑
dg(500mg/kg)抑制糖酵解通路,rt
‑
pcr和western blot检测斑块糖酵解酶hk1、pfkfb3、pdhk1、ldha的mrna和蛋白变化及相应酶的活性。
58.(2)高效液相色谱(lc
‑
ms)检测斑块中代谢组含量:将细胞培养液上清收集后迅速放入液氮中,复融后取250μl样品置于1.5ml ep管中,加入750μl甲醇溶液,混匀,4℃,10000rpm,离心10min,取上清液过滤后通过lc
‑
mc检测atp、adp和nad
+
等代谢组含量。
59.(3)氟脱氧葡萄糖正电子发射计算机断层扫描(
18
f
‑
fdg pet
‑
ct)成像分析斑块内糖摄取水平:实验小鼠检查前晚禁食(8
‑
12h),采用3%戊巴比妥麻醉实验动物,沿尾静脉注射氟标记的脱氧葡萄糖(
18
f
‑
fdg)(1mci/kg,1mci=37mbq)。180min后将实验动物仰卧位固定,进行pet
‑
ct扫描,然后注射欧乃派克10ml进行ct三维成像。在后处理工作站进行图像融合,重建每一层面的三维图像。
60.(4)seahorse检测细胞外酸化率(ecar):提取pbmc和bmdm两种巨噬细胞接种到seahorse xf细胞培养板中,通过hdgf sirna和ad
‑
hdgf建立缺失和过表达细胞模型,100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4刺激24h分别诱导m1和m2型巨噬细胞,使用安捷伦海马糖酵解检测试剂盒检测糖酵解水平,按照说明书分别加入葡萄糖、寡霉素和2
‑
dg。
61.(5)seahorse检测细胞内耗氧率(ocr):提取pbmc和bmdm两种巨噬细胞接种到seahorse xf细胞培养板中,通过hdgf sirna和ad
‑
hdgf建立缺失和过表达细胞模型,100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4刺激24h分别诱导m1和m2型巨噬细胞,使用安捷伦seahorse xf线粒体底物分析剂盒检测线粒体呼吸水平,按照说明书分别加入寡霉素、解偶联剂fccp和电子传递抑制剂抗霉素a和鱼藤酮。
62.(6)提取pbmc和bmdm两种巨噬细胞,通过hdgf sirna和ad
‑
hdgf建立缺失和过表达细胞模型,给予2
‑
dg(0.25μm)预处理,100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4刺激24h,rt
‑
pcr和western blot检测m1型巨噬细胞特征标记物(il
‑
1β、il
‑
6、cox
‑
2、inos、gro1、mcp
‑
1、tnfα、nlrp3、vcam
‑
1和icam
‑
1)和m2型巨噬细胞特征标记物(arg
‑
1、mrc1、rctnla、chi3l3、pparγ和il
‑
10)的含量,收集细胞进行代谢组学检测和rna
‑
seq测序,探索hdgf通过影响能量代谢重编程促使m1型巨噬细胞极化的具体机制。
63.在本发明的又一些示例中,通过构建小鼠模型,反映m1型巨噬细胞hdgf rna
‑
m6a修饰水平及其调控hdgf表达的分子机制
64.(1)mettl3
mac
‑
ko
apoe
ko
构建:通过胚胎干细胞技术,在体外构建一个在mettl3基因两端分别含有一个loxp位点的基因序列,然后将其转入胚胎干细胞内,重新植入到假孕小鼠的子宫内,使其重新发育成为一个完整的胚胎,最终培育出mettl3
fl/fl
小鼠。将mettl3
fl/fl
与巨噬细胞特异性cre工具鼠lysm
‑
cre进行交配,通过对自代小鼠基因鉴定筛选出mettl3
mac
‑
ko
小鼠。将mettl3
mac
‑
ko
和mettl3
fl/fl
小鼠分别与apoe
ko
小鼠杂交,获得mettl3
mac
‑
ko
apoe
ko
小鼠。
65.(2)取8周龄mettl3
mac
‑
ko
apoe
ko
和mettl3
wt
apoe
ko
小鼠,分别给予正常和高脂饮食喂养4、8、12、16周建立as动物模型模拟斑块发展不同时期,小鼠腹腔注射2
‑
dg(500mg/kg)抑
制糖酵解通路,在不同阶段通过elisa检测血浆中血脂含量,油红o染色检测斑块脂质含量,masson染色检测斑块胶原含量,he染色检测斑块面积、计算内膜/中膜比值,免疫荧光双染鉴定hdgf含量以及hdgf与巨噬细胞cd68的共定位,rt
‑
pcr检测血管中m1型巨噬细胞特征标记物il
‑
1β、il
‑
6、cox
‑
2、inos、gro1、mcp
‑
1、tnfα、nlrp3、vcam
‑
1和icam
‑
1含量,rt
‑
pcr检测血管中m2型巨噬细胞特征标记物arg
‑
1、mrc1、rctnla、chi3l3、pparγ和il
‑
10的含量,elisa检测血浆中il
‑
1β和il
‑
10的表达;rt
‑
pcr和western blot检测斑块糖酵解酶hk1、pfkfb3、pdhk1、ldha的mrna和蛋白变化及相应酶的活性,lc
‑
mc检测斑块中atp、adp和nad
+
等代谢产物含量,
18
f
‑
fdg pet
‑
ct成像分析斑块内糖摄取水平。
66.(3)将mettl3
mac
‑
ko
apoe
ko
和mettl3
wt
apoe
ko
分别给予尾静脉注射腺病毒ad
‑
mettl3过表达mettl3进行补救实验,给予正常和高脂饮食喂养16周,重复上述动物检测实验,检测恢复mettl3后是否通过影响hdgf的表达促进apoe
ko
小鼠as斑块的生成。
67.(4)提取pbmc和bmdm两种巨噬细胞,通过mettl3 sirna和ad
‑
mettl3建立缺失和过表达细胞模型,给予2
‑
dg(0.25μm)预处理,100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4刺激24h,mrna半衰期实验检测hdgf mrna的稳定性,及rna
‑
m6a修饰对hdgf表达的影响;rt
‑
pcr和western blot检测m1型巨噬细胞特征标记物(il
‑
1β、il
‑
6、cox
‑
2、inos、gro1、mcp
‑
1、tnfα、nlrp3、vcam
‑
1和icam
‑
1)和m2型巨噬细胞特征标记物(arg
‑
1、mrc1、rctnla、chi3l3、pparγ和il
‑
10)的含量,elisa检测细胞上清液中炎症因子il
‑
1β和il
‑
10的含量,以及seahorse检测细胞内ocr和ecar来分别反映氧化磷酸化和糖酵解水平。收集细胞进行merip
‑
seq,检测hdgf发生m6a修饰的水平及具体的修饰位点。
68.(5)提取pbmc和bmdm两种巨噬细胞,通过mettl3 sirna和ad
‑
mettl3建立缺失和过表达细胞模型,100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4刺激24h分别诱导m1和m2型巨噬细胞,通过rna结合蛋白免疫沉淀(rip)和串联质谱检测与hdgf rna
‑
m6a特异性结合的甲基化识别酶(readers)。
69.通过以上实验明确hdgf在as发生发展过程中表达量增加的具体机制,主要通过mettl3介导发生m6a修饰稳定其mrna,从而增加hdgf蛋白表达。
70.(1)merip
‑
seq检测hdgf发生m6a修饰的水平及位点:首先将细胞内的mrna提取出来,然后打断成约100个核苷酸(100nt)左右的片段,与m6a抗体进行孵育,免疫共沉淀将携带有m6a的rna片段富集起来,接着构建cdna库进行高通量测序。
71.(2)mettl3
mac
‑
ko
apoe
ko
和hdgf
mac
‑
ko
apoe
ko
构建:通过胚胎干细胞技术,在体外构建在mettl3基因两端分别含有一个loxp位点的基因序列,然后将其转入胚胎干细胞内,重新植入到假孕小鼠的子宫内,使其重新发育成为一个完整的胚胎,最终培育出mettl3
fl/fl
小鼠。将mettl3
fl/fl
与巨噬细胞特异性cre工具鼠lysm
‑
cre进行交配,通过对子代小鼠基因鉴定筛选出mettl3
mac
‑
ko
小鼠。将mettl3
mac
‑
ko
和mettl3
fl/fl
小鼠分别与apoe
ko
小鼠杂交,获得mettl3
mac
‑
ko
apoe
ko
小鼠。hdgf
mac
‑
ko
apoe
ko
小鼠构建同上。
72.通过本发明的上述示例分析与试验发现:apoe
ko
小鼠体内研究发现,在正常饮食apoe
ko
小鼠的血管中发现hdgf少量表达,而高脂as模型组小鼠血管hdgf表达明显增多;提取bmdm体外诱导成m1和m2型巨噬细胞,发现hdgf高表达于m1型巨噬细胞中,干扰hdgf表达后,m1型巨噬细胞分泌的促炎因子减少,而m2型巨噬细胞分泌的抗炎因子增多,这提示我们hdgf可能参与巨噬细胞极化过程。mdm体外实验发现,干扰hdgf表达后,m1型巨噬细胞的糖
酵解减弱,氧化磷酸化增强,同时lps+ifnγ引起的线粒体膜电位下降及糖摄取增多在干扰hdgf后均被显著抑制。3、我们成功构建了巨噬细胞特异性敲除hdgf的apoe
ko
小鼠(hdgf
mac
‑
ko
apoe
ko
),并给予16周高脂喂养。通过检测发现,高脂喂养hdgf
wt
apoe
ko
小鼠心脏主动脉根部脂质沉积和胸主动脉的斑块面积明显增加,而这一现象在hdgf
mac
‑
ko
apoe
ko
小鼠均被显著抑制。与对照组小鼠相比,as模型小鼠的血管中m6a水平显著升高;在体外培养bmdm发现,通过总体rna水平检测,m1型巨噬细胞的m6a水平显著高于m2型,同时mettl3表达量也相应增加;而干扰mettl3后,hdgf表达减少,同时m1型巨噬细胞分泌的促炎因子减少,m2型巨噬细胞分泌的抗炎因子增多,并逆转细胞内氧化磷酸化减弱和糖酵解增强的能量代谢重编程过程。5、在给予as经典刺激ox
‑
ldl后我们发现,干扰mettl3和hdgf可显著减少m1型巨噬细胞向泡沫细胞的转变。我们成功构建了巨噬细胞特异性敲除mettl3的apoe
ko
小鼠(mettl3
mac
‑
ko
apoe
ko
),并给予16周高脂喂养。通过检测发现,高脂喂养mettl3
wt
apoe
ko
小鼠心脏主动脉根部脂质沉积和胸主动脉的斑块面积明显增加,而这一现象在mettl3
mac
‑
ko
apoe
ko
小鼠均被显著抑制。同时,mettl3
mac
‑
ko
apoe
ko
显著降低高脂诱导的mettl3
wt
apoe
ko
小鼠血管组织中hdgf的蛋白和mrna的表达增多。以上结果表明m6a表观遗传学修饰介导hdgf的mrna稳定性增强促使其蛋白表达增加,hdgf通过调节能量代谢重编程促进m1型巨噬细胞极化。
73.通过对本发明的示例构建的小鼠模型进行分析,可以得到如图1~6所示的结果。下面结合试验结果进行具体分析。
74.如图1a和图1b所示,as模型中hdgf的表达。雄性apoe
ko
小鼠分别给予正常饮食(normal chow,nc)和高脂喂养(high fat diet,hfd)16周,取小鼠主动脉根部到胸主动脉处血管,研磨提取蛋白和mrna。通过检测发现,as模型小鼠主动脉hdgf的蛋白和mrna水平明显高于正常饮食组。
***
p<0.001与正常饮食组相比。如图1c所示,检测hdgf在巨噬细胞极化中的表达。提取小鼠骨髓来源巨噬细胞(bmdm)体外给予100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4分别作用24h诱导m1型和m2型巨噬细胞,检测hdgf的蛋白表达,发现m1型巨噬细胞中hdgf的蛋白表达要显著高于m2型。
***
p<0.001与lps+ifnγ组相比。如图1d所示,bmdm转染hdgf sirna(sihdgf)的干扰效率评估。通过western blot检测发现sihdgf能够显著抑制lps+ifnγ引起的hdgf高表达。
**
p<0.01,
***
p<0.001与对照组相比。如图1e,敲减hdgf对m1型巨噬细胞的影响。bmdm给予sihdgf 48h,100ng/ml lps+30ng/ml ifnγ作用24h,用rt
‑
pcr检测m1型巨噬细胞特异性标记蛋白的mrna水平。结果显示lps+ifnγ处理后,m1型特征性标记蛋白il
‑
1β、tnf
‑
α和cxcl10的mrna水平显著升高,而sihdgf能够显著逆转lps+ifnγ引起的il
‑
1β、tnf
‑
α和cxcl10变化,表明hdgf能够促进m1型巨噬细胞极化。
*
p<0.05,
**
p<0.01,
***
p<0.001与lps+ifnγ组相比。,如图1f所示,敲减hdgf对m2型巨噬细胞的影响。bmdm给予sihdgf 48h,10ng/ml il
‑
4作用24h,用rt
‑
pcr检测m2型巨噬细胞特异性标记蛋白的mrna水平。结果显示il
‑
4处理后,m2型特征性标记蛋白cd206、arg1和fizz1的mrna水平显著升高,而sihdgf能够进一步增强il
‑
4引起的il
‑
1β、tnf
‑
α和cxcl10变化,表明hdgf抑制m2型巨噬细胞极化。
**
p<0.01,
***
p<0.001与il
‑
4组相比。
75.如图2a,hdgf对m1型巨噬细胞氧化磷酸化水平的影响。bmdm给予sihdgf 48h,100ng/ml lps+30ng/ml ifnγ作用24h,通过seahorse实时检测细胞的耗氧率(ocr)。结果显示,lps+ifnγ处理后细胞的ocr显著降低,而sihdgf能有效逆转lps+ifnγ引起的ocr降低。
*
p<0.05,
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。如图2b,hdgf对m1型
巨噬细胞糖酵解水平的影响。bmdm给予sihdgf 48h,100ng/ml lps+30ng/ml ifnγ作用24h,通过seahorse实时检测胞外酸化率(ecar)。结果显示,lps+ifnγ处理后细胞内ecar水平显著升高,而sihdgf能有效逆转lps+ifnγ引起的ecar升高。
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。如图2c,hdgf对线粒体功能的影响。bmdm给予sihdgf 48h,100ng/ml lps+30ng/ml ifnγ作用24h,通过jc
‑
1荧光探针检测线粒体膜电位(mmp)的改变。结果显示,lps+ifnγ处理后细胞mmp水平显著下降,而sihdgf能有效逆转lps+ifnγ引起的mmp降低。标尺:100μm。
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。如图2d,hdgf对m1巨噬细胞葡萄糖摄取的影响。结果显示,lps+ifnγ处理后巨噬细胞糖摄取水平显著升高,而sihdgf能有效抑制lps+ifnγ引起的糖摄取水平升高。
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。
76.如图3a,巨噬细胞hdgf特异性敲除小鼠(hdgf
mac
‑
ko
)的构建。如图3b,巨噬细胞hdgf特异性敲除apoe
ko
小鼠(hdgf
mac
‑
ko
apoe
ko
)的杂交繁殖及动脉粥样硬化造模流程。如图3c,检测hdgf
mac
‑
ko
apoe
ko
小鼠造动脉粥样硬化模型后心脏主动脉根部脂质沉积。高脂喂养16周后,通过油红o染色检测脂质沉积,检测发现hdgf
mac
‑
ko
apoe
ko
显著抑制高脂喂养诱导的hdgf
wt
apoe
ko
心脏主动脉根部脂质沉积增加。标尺:500μm。
***
p<0.001与hdgf
wt
apoe
ko
+hfd相比。如图3d,检测hdgf
mac
‑
ko
apoe
ko
小鼠造动脉粥样硬化模型后胸主动脉斑块面积。高脂喂养16周后,通过he染色检测血管斑块面积,检测发现hdgf
mac
‑
ko
apoe
ko
显著抑制高脂喂养诱导的hdgf
wt
apoe
ko
胸主动脉斑块面积增加。标尺:100μm。
***
p<0.001与hdgf
wt
apoe
ko
+hfd相比。
77.如图4a,as模型中rna
‑
m6a修饰水平。雄性apoe
ko
小鼠分别给予正常饮食(normal chow,nc)和高脂(high fat diet,hfd)喂养16周,取小鼠主动脉根部到胸主动脉处血管,研磨提取rna。通过m6a rna methylation quantification kit检测斑块组织中rna总体m6a修饰水平,通过检测发现,as模型小鼠斑块的m6a水平显著高于正常饮食组。
**
p<0.01与正常饮食组相比。如图4b,as模型中rna
‑
m6a修饰相关酶的mrna水平。通过rt
‑
pcr检测发现,as模型组rna
‑
m6a修饰酶mettl3显著增加,而去甲基化酶没有明显的统计学差异。
*
p<0.05,
***
p<0.001与正常饮食组相比。如图4c,检测极化巨噬细胞中rna
‑
m6a修饰水平。提取bmdm体外给予100ng/ml lps+30ng/ml ifnγ和10ng/ml il
‑
4分别作用24h诱导m1型和m2型巨噬细胞,检测rna
‑
m6a修饰水平,结果显示m1型巨噬细胞的m6a修饰水平显著高于m2型。
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。如图4d,检测极化巨噬细胞中rna
‑
m6a修饰相关酶的mrna水平。通过rt
‑
pcr检测发现,m1型巨噬细胞中rna
‑
m6a修饰酶mettl3显著增加,而去甲基化酶没有明显的统计学差异。
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。如图4e,检测敲减mettl3对hdgf表达的影响。给予bmdm simettl3敲减mettl3后检测hdgf的蛋白表达,发现simettl3能够显著逆转lps+ifnγ引起的hdgf表达增加,表明mettl3可作为hdgf的上游调控因子。如图4f,检测mettl3对hdgf mrna稳定性的影响。给予bmdm lps+ifnγ刺激后发现hdgf mrna稳定性显著增加,而这一现象可被simettl3显著逆转,表明调节hdgf的mrna稳定性是mettl3增强hdgf蛋白表达的关键因素。
78.如图5a,检测mettl3对m1型巨噬细胞的影响。bmdm给予simettl3作用48h,100ng/ml lps+30ng/ml ifnγ作用24h,用rt
‑
pcr检测m1型巨噬细胞特异性标记蛋白的mrna水平。结果显示lps+ifnγ处理后,m1型特征性标记蛋白il
‑
1β、tnf
‑
α和cxcl10的mrna水平显著升高,而simettl3能够显著逆转lps+ifnγ引起的il
‑
1β、tnf
‑
α和cxcl10变化,表明mettl3参
与m1型巨噬细胞极化的调控过程。
**
p<0.01,
***
p<0.001与lps+ifnγ组相比。如图5b,检测mettl3对m2型巨噬细胞的影响。bmdm给予simettl3 48h,10ng/ml il
‑
4作用24h,用rt
‑
pcr检测m2型巨噬细胞特异性标记蛋白的mrna水平。结果显示il
‑
4处理后,m2型特征性标记蛋白cd206、arg1和fizz1的mrna水平显著升高,而simettl3能够进一步增加il
‑
4引起的il
‑
1β、tnf
‑
α和cxcl10变化,表明mettl3抑制m2型巨噬细胞极化。
***
p<0.001与对照组相比,
##
p<0.01,
###
p<0.001与il
‑
4组相比。如图5c,mettl3对m1型巨噬细胞氧化磷酸化水平的影响。bmdm给予sihdgf 48h,100ng/ml lps+30ng/ml ifnγ作用24h,通过seahorse实时检测细胞的耗氧率(ocr)。结果显示,lps+ifnγ处理后细胞的ocr显著降低,而simettl3能有效逆转lps+ifnγ引起的ocr降低。
**
p<0.01,
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。如图5d,检测mettl3对m1型巨噬细胞糖酵解水平的影响。bmdm给予simettl3 48h,100ng/ml lps+30ng/ml ifnγ作用24h,通过seahorse实时检测胞外酸化率(ecar)。结果显示,lps+ifnγ处理后细胞内ecar水平显著升高,而simettl3能有效逆转lps+ifnγ引起的ecar升高。
***
p<0.001与对照组相比,
###
p<0.001与lps+ifnγ组相比。如图5e,油红o检测mettl3和hdgf对m1型巨噬细胞泡沫化的影响。bmdm给予simettl3或sihdgf 48h,100ng/ml lps+30ng/ml ifnγ作用24h,然后100μg/ml ox
‑
ldl作用48h,油红o染色检测细胞内脂质沉积。结果显示,lps+ifnγ处理后细胞内红色脂质沉积显著增多,而sihdgf和simettl3能显著降低lps+ifnγ产生的影响,表明mettl3和hdgf均参与到m1型巨噬细胞泡沫化过程。标尺:50μm。
***
p<0.001与对照组相比,
#
p<0.05与ox
‑
ldl组相比。
79.如图6a,巨噬细胞mettl3特异性敲除小鼠(mettl3
mac
‑
ko
)的构建。如图6b,巨噬细胞mettl3特异性敲除apoe
ko
小鼠(mettl3
mac
‑
ko
apoe
ko
)的杂交繁殖及动脉粥样硬化造模流程。如图6c,检测mettl3
mac
‑
ko
apoe
ko
小鼠造动脉粥样硬化模型后心脏主动脉根部脂质沉积。高脂喂养16周后,通过油红o染色检测脂质沉积,检测发现mettl3
mac
‑
ko
apoe
ko
显著抑制高脂喂养诱导的mettl3
wt
apoe
ko
心脏主动脉根部脂质沉积增加。标尺:500μm。
***
p<0.001与mettl3
wt
apoe
ko
+hfd相比。如图6d,检测mettl3
mac
‑
ko
apoe
ko
小鼠造动脉粥样硬化模型后胸主动脉斑块面积。高脂喂养16周后,通过he染色检测血管斑块面积,检测发现mettl3
mac
‑
ko
apoe
ko
显著抑制高脂喂养诱导的mettl3
wt
apoe
ko
胸主动脉斑块面积增加。标尺:100μm。
***
p<0.001与mettl3
wt
apoe
ko
+hfd相比。如图6e,检测mettl3
mac
‑
ko
apoe
ko
小鼠造动脉粥样硬化模型后血管组织hdgf的蛋白表达。mettl3
wt
apoe
ko
小鼠高脂喂养后血管组织hdgf的蛋白表达增加,而mettl3
mac
‑
ko
apoe
ko
小鼠则显著下调hdgf的蛋白表达。
***
p<0.001与mettl3
wt
apoe
ko
+hfd相比。如图6f,检测mettl3
mac
‑
ko
apoe
ko
小鼠造动脉粥样硬化模型后血管组织hdgf的mrna表达。mettl3
wt
apoe
ko
小鼠高脂喂养后血管组织hdgf的mrna表达增加,而mettl3
mac
‑
ko
apoe
ko
小鼠则显著下调hdgf的mrna表达。
***
p<0.001与mettl3
wt
apoe
ko
+hfd相比。
80.需要说明的是,针对于上述小鼠模型中所述的“高脂喂养”,指的是,每日每只小鼠摄入胆固醇0.2克,而“正常组”,每只每日摄入胆固醇0克。
81.在本说明书的描述中,参考术语“一个实施例”、“示例”、“具体示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不一定指的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任何的一个或多个实施例或示例中以合适的方式结合。
82.以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1