一种无血清、无蛋白和无DMSO的细胞冻存液及其应用的制作方法
一种无血清、无蛋白和无dmso的细胞冻存液及其应用
技术领域
1.本发明涉及细胞冻存领域。更具体地,涉及一种无血清、无蛋白和无dmso的细胞冻存液及其应用。
背景技术:
2.目前,细胞治疗在临床上的应用越来越广泛。尤其,干细胞治疗在退行性、损伤性、遗传缺陷性等疾病的治疗中具有巨大的优势和广阔的发展前景(ella buzhor,lucy,leshansky,jacob blumenthal,et al.cell
‑
based therapy approaches:the hope for incurable diseases.regenerative medicine.(2014)9(5),649
–
672)。而高效安全的细胞制剂是细胞治疗中的关键因素。传统的细胞制剂由活细胞和电解质溶液(如勃脉力a)混合组成。在制备完成后,一般需要在12h内进行回输,超过12h细胞活率下降,将严重影响细胞的治疗效果。同时,细胞制剂在临床应用前无法得到无菌、支原体等指标的最终判定,因此,给细胞治疗带来了很大的不便和风险。
3.细胞冻存是细胞长期保存的重要手段。细胞冻存液通过冷冻保护剂在冻存过程中对细胞进行保护,以减少或防止冷冻冰晶对细胞造成的损伤。现有技术中的细胞冻存液通常包含培养基、胎牛血清和二甲基亚砜(dmso)等。胎牛血清含有动物源性物质,成分复杂,不能用于临床。dmso虽然是一种渗透性很强的细胞保护剂,但对细胞和组织有一定的毒性作用。有研究报道,dmso在细胞治疗中的毒性总发病率为1/70(bekkem a,selby g,chakrabarty jh:retrospective analysis of intravenous dmso toxicity in transplant patients.biology of blood and marrow transplantation 2013,19(2):s313.)。在临床应用中,部分患者在输注含dmso的细胞制剂后会出现皮疹,恶心,呕吐,低血压等不良反应,更有部分患者出现严重的肾功能衰竭和心血管紊乱(alessandrino ep,bernasconi p,caldera d,et al.adverse events occurring during bone marrow or peripheral blood progenitor cell infusion:analysis of 126cases.bone marrow transplant 1999;23:533
‑
7.)。由于血清和dmso潜在的风险,冷冻的细胞制剂复苏后回输前通常需要先洗涤细胞,以去除血清或dmso等不能用于临床的成分。虽然可以通过洗涤降低毒副作用发生率,但洗涤过程会导致细胞数量明显减少,尤其是干细胞类本身数量较少,进一步丢失可能会因为移植细胞量不足而导致治疗失败。此外,复苏后洗涤细胞不仅操作繁杂还会增加细胞污染的风险。
4.因此,需要提供一种新型的无血清和无dmso的细胞冻存液,不仅能有效、安全地保护细胞,还能在复苏后直接用于输注,为细胞治疗的临床应用起到积极意义。
技术实现要素:
5.本发明的一个目的在于提供一种无血清、无蛋白和无二甲基亚砜(dmso)的细胞冻存液,该细胞冻存液在冻存细胞时可长时间稳定维持细胞的活性和干性,复苏后的细胞可直接用于临床应用。
6.本发明的另一个目的在于提供上述细胞冻存液在冻存细胞中的应用。
7.为达到上述目的,本发明首先提供了一种无血清、无蛋白和无dmso的细胞冻存液,所述细胞冻存液包括以下组分:葡萄糖注射液、复方氨基酸注射液、甘油、磷酸二氢钾、磷酸氢二钠、氯化钠、蔗糖、羟乙基淀粉、三磷酸腺苷
‑
二钠氯化镁和水。
8.在本发明无血清、无蛋白和无dmso的细胞冻存液中,甘油作为渗透性保护剂和蔗糖、羟乙基淀粉作为非渗透性保护剂在细胞冻存过程中从细胞内和细胞外同时保护细胞免受冻存时冰晶的损伤,大大提高了细胞的活率;羟乙基淀粉使得细胞膜表面负电荷化,防止细胞聚集,也可使聚集细胞解聚,从而使细胞呈单个分离状态,有利于提高复苏后细胞的存活率,并保障输注时不堵塞器具;蔗糖还能在细胞表面形成保护膜,保护细胞膜的结构。葡萄糖、复方氨基酸以及无机盐成分磷酸二氢钾、磷酸氢二钠、氯化钠可保证细胞在深低温条件下的营养需求和细胞功能的保持;三磷酸腺苷
‑
二钠氯化镁对冻存复苏后的细胞可以直接提供能量,增加细胞复苏后的活率,维持细胞的正常代谢能力。
9.上述细胞冻存液中,所述葡萄糖注射液具体为5%葡萄糖注射液,在所述细胞冻存液中的体积含量为5~20%;优选地,体积含量为10%;本发明所述5%葡萄糖注射液具体含义为每500ml含25g葡萄糖。
10.上述细胞冻存液中,所述复方氨基酸注射液具体为复方氨基酸注射液(14aa),在所述细胞冻存液中的体积含量为5~20%;优选地,体积含量为10%。
11.在本发明具体的实施方式中,所述复方氨基酸注射液(14aa)的具体配方为:每1000ml含l
‑
异亮氨酸(c6h
13
no2)5.9g,l
‑
亮氨酸(c6h
13
no2)7.7g,l
‑
醋酸赖氨酸(c6h
14
n2o2·
c2h4o2)8.7g、l
‑
甲硫氨酸(c5h
11
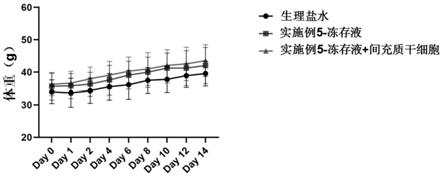
no2s)4.5g、l
‑
苯丙氨酸(c9h
11
no2)4.8g、l
‑
苏氨酸(c4h9no3)3.4g、l
‑
色氨酸(c11h12n2o2)1.3g、l
‑
缬氨酸(c5h
11
no2)5.6g、l
‑
丙氨酸(c3h7no2)6.0g、l
‑
精氨酸(c6h
14
n4o2)8.1g、l
‑
组氨酸(c6h9n3o2)2.4g、l
‑
脯氨酸(c5h9no2)9.5g、l
‑
丝氨酸(c3h7no3)5.0g、甘氨酸(c2h5no3)11.9g和亚硫酸氢钠(nahso3)0.5g。
12.上述细胞冻存液中,所述甘油在所述细胞冻存液中的体积含量为10~15%;优选地,体积含量为10%。
13.上述细胞冻存液中,所述磷酸二氢钾在所述细胞冻存液中的含量为50~200mg/l;优选地,含量为100mg/l。
14.上述细胞冻存液中,所述磷酸氢二钠在所述细胞冻存液中的含量为200~1000mg/l;优选地,含量为400mg/l。
15.上述细胞冻存液中,所述氯化钠在所述细胞冻存液中的含量为5~10g/l;优选地,含量为9g/l。
16.上述细胞冻存液中,所述蔗糖在所述细胞冻存液中的含量为5~20g/l;优选地,含量为10g/l。
17.上述细胞冻存液中,所述羟乙基淀粉在所述细胞冻存液中的含量为10~100g/l;优选地,含量为60g/l。
18.上述细胞冻存液中,所述三磷酸腺苷
‑
二钠氯化镁在所述细胞冻存液中的含量为50~500mg/l;优选地,含量为100mg/l。
19.在本发明具体的实施方式中,所述三磷酸腺苷
‑
二钠氯化镁的具体配方为三磷酸腺苷二钠100mg和氯化镁32mg;临用前将两者完全混合即可。
20.上述细胞冻存液中,所述细胞冻存液的余量为水;优选地,所述水为医用水。
21.上述细胞冻存液中,甘油、磷酸二氢钾、磷酸氢二钠、氯化钠、蔗糖、羟乙基淀粉、三磷酸腺苷
‑
二钠氯化镁均为药用级别原料。
22.在本发明具体的实施方式中,上述细胞冻存液的制备方法,包括以下步骤:
23.1)按上述细胞冻存液中各组分的含量将葡萄糖注射液、复方氨基酸注射液和甘油混合均匀,得到混合液i;
24.2)向步骤1)所得混合液i中依次加入磷酸二氢钾、磷酸氢二钠、氯化钠、蔗糖、羟乙基淀粉和三磷酸腺苷
‑
二钠氯化镁,得到混合液ii;
25.3)向步骤2)所得混合液ii中加水使各组分完全溶解,定容至所配体积,得到混合液iii;
26.4)采用0.2μm过滤器对步骤3)所得混合液iii进行无菌过滤,即得所述细胞冻存液。
27.上述制备好的细胞冻存液可置于2
‑
8℃医用冰箱冷藏。
28.本发明进一步提供了上述细胞冻存液在如下任一中的应用:
29.1)在冻存细胞中的应用或在制备冻存细胞的产品中的应用;
30.2)在维持冻存复苏后的细胞的活性中的应用或在制备维持冻存复苏后的细胞的活性的产品中的应用;
31.3)在维持冻存复苏后的细胞的干性中的应用或在制备维持冻存复苏后的细胞的干性的产品中的应用。
32.上述应用中,所述细胞选自间充质干细胞和t淋巴细胞中一种或者两种。
33.在本发明具体的实施方式中,所述间充质干细胞为人脐带间充质干细胞;所述t淋巴细胞为jurkat人急性t淋巴细胞白血病细胞。
34.本发明的有益效果如下:
35.1)本发明无血清、无蛋白和无dmso的细胞冻存液的成分明确,批次稳定,符合产业转化要求。
36.2)本发明无血清、无蛋白和无dmso的细胞冻存液不包含血清、不包含异源物质和不包含蛋白,避免了引入动物源性病原微生物的风险;同时,本发明无血清、无蛋白和无dmso的细胞冻存液不包含dmso,避免了dmso在临床上潜在的毒性风险,符合临床应用的安全性要求。
37.3)本发明无血清、无蛋白和无dmso的细胞冻存液在冻存细胞时,可长时间维持细胞的高活性和良好干性,冻存细胞时可直接置于
‑
80℃冻存,无需程序化冻存,若长期保存(>1年),可在
‑
80℃冷冻12h后将细胞转移至液氮保存,细胞随取随用,复苏后即可直接进行输注,极大地方便了临床的应用,并且临床应用安全可靠,符合临床应用的有效性要求。
附图说明
38.下面结合附图对本发明的具体实施方式作进一步详细的说明。
39.图1为分别利用实施例1
‑
5的无血清、无蛋白和无dmso的细胞冻存液、对比例1的对照含血清含dmso冻存液和对比例2的对照无血清无蛋白无dmso冻存液冻存人脐带间充质干细胞3天复苏后48h的细胞形态图。标尺:500μm。
40.图2为利用实施例5的无血清、无蛋白和无dmso的细胞冻存液、对比例1的对照含血清含dmso冻存液和对比例2的对照无血清无蛋白无dmso冻存液冻存人脐带间充质干细胞1年复苏后48h的细胞形态图。标尺:500μm。
41.图3为利用实施例5的无血清、无蛋白和无dmso的细胞冻存液冻存人脐带间充质干细胞1年复苏后72h的细胞表面标志物的流式分析。
42.图4为分别利用生理盐水,实施例5的无血清、无蛋白和无dmso的细胞冻存液,实施例5的无血清、无蛋白和无dmso的细胞冻存液和人脐带间充质干细胞的混悬液进行的单次给药毒性试验中小鼠体重的变化情况。
43.图5为分别利用生理盐水,实施例5的无血清、无蛋白和无dmso的细胞冻存液,实施例5的无血清、无蛋白和无dmso的细胞冻存液和人脐带间充质干细胞的混悬液进行的单次给药毒性试验中小鼠肺脏、肝脏和脾脏的比较情况。
具体实施方式
44.为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
45.下述实施例中的材料,如无特殊说明,均为本领域常用材料,均可从商业途径得到。下述实施例中的细胞培养条件如无特殊说明,均为37℃,5%co2。
46.本发明的实施例中所使用的仪器、试剂、细胞及抗体来源如下:
47.自动细胞计数分析仪,countstar;
48.人脐带间充质干细胞,北京全式金生物技术有限公司,货号为mc401;
49.jurkat人急性t淋巴细胞白血病细胞,atcc,货号为crl2898;
50.transstem
tm serum
‑
free,xeno
‑
free human mesenchymal stromal cell medium,北京全式金生物技术有限公司,货号为mm101;
51.tryple
tm express enzyme,thermo fisher公司,货号为12563029;
52.dmem/f12培养基,thermo fisher公司,货号为12400024;
53.rpmi 1640培养基,thermo fisher公司,货号为31870082;
54.胎牛血清,北京全式金生物技术有限公司,货号为fs201
‑
02;
55.dmso,chem cruz公司,货号为358801;
56.cd90
‑
fitc抗体,thermo fisher公司,货号为11
‑
0909
‑
41;
57.cd73
‑
fitc抗体,thermo fisher公司,货号为11
‑
0739
‑
41;
58.cd105
‑
pe抗体,thermo fisher公司,货号为12
‑
1057
‑
41;
59.cd34
‑
fitc抗体,thermo fisher公司,货号为11
‑
0349
‑
41;
60.cd45
‑
pe抗体,biolegend公司,货号为304007;
61.hla
‑
dr
‑
pe抗体,biolegend公司,货号为307605;
62.pe mouse igg1,κisotype ctrl抗体,biolegend公司,货号为400211;
63.fitc mouse igg1,κisotype ctrl抗体,biolegend公司,货号为400107;
64.ao/pi染料,北京百奥莱博科技有限公司,货号hr0426;
65.5%葡萄糖注射液,贵州天地药业有限责任公司,具体配方为:每500ml含25g葡萄
糖。
66.复方氨基酸注射液(14aa),四川国瑞药业有限责任公司,具体配方为:每1000ml含l
‑
异亮氨酸(c6h
13
no2)5.9g,l
‑
亮氨酸(c6h
13
no2)7.7g,l
‑
醋酸赖氨酸(c6h
14
n2o2·
c2h4o2)8.7g、l
‑
甲硫氨酸(c5h
11
no2s)4.5g、l
‑
苯丙氨酸(c9h
11
no2)4.8g、l
‑
苏氨酸(c4h9no3)3.4g、l
‑
色氨酸(c11h12n2o2)1.3g、l
‑
缬氨酸(c5h
11
no2)5.6g、l
‑
丙氨酸(c3h7no2)6.0g、l
‑
精氨酸(c6h
14
n4o2)8.1g、l
‑
组氨酸(c6h9n3o2)2.4g、l
‑
脯氨酸(c5h9no2)9.5g、l
‑
丝氨酸(c3h7no3)5.0g、甘氨酸(c2h5no3)11.9g和亚硫酸氢钠(nahso3)0.5g;
67.甘油、磷酸二氢钾、磷酸氢二钠、氯化钠、蔗糖和羟乙基淀粉均购买自西安天正药用辅料有限公司;
68.三磷酸腺苷
‑
二钠氯化镁,购买自长春精优药业,具体配方为:三磷酸腺苷二钠100mg和氯化镁32mg;临用前将两者完全混合即可。
69.下述实施例中,人脐带间充质干细胞的冻存方法包括以下步骤:
70.1)准备冻存的间充质干细胞生长密度超过80
‑
85%以上,pbs缓冲液清洗1
‑
2遍,加入预热的tryple
tm express enzyme,刚好铺满细胞培养瓶底面为宜,37℃消化5分钟,待细胞完全脱落;
71.2)加入新的间充质干细胞培养基transstem
tm serum
‑
free,xeno
‑
free human mesenchymal stromal cell medium终止消化,轻柔吹吸成单细胞悬液。取10μl单细胞悬液与10μl ao/pi染料混匀,进行细胞计数和活性检测,记录冻存前的细胞活率;
72.3)单细胞悬液放入离心机中,300
×
g离心5分钟,弃上清,收集细胞;
73.4)收集的细胞按照终密度为1
×
106/ml加入2
‑
8℃保存的下述实施例或对比例中的细胞冻存液,充分混匀后,分装到2ml的冻存管,密封标注;
74.5)分装好的冻存管可直接置于
‑
80℃冰箱冻存。若长期保存(>1年),可在
‑
80℃冷冻12h后将细胞转移至液氮保存。
75.下述实施例中,人脐带间充质干细胞的复苏方法包括以下步骤:
76.1)准备37℃水浴锅,准备15ml离心管,加入5
‑
10ml 37℃预热的dmem/f12;
77.2)从上述
‑
80℃冰箱或液氮的冻存管中取出细胞,迅速在37℃水浴锅中摇动融化,得到细胞悬液;
78.3)将冻存管中的细胞悬液逐滴转移至预先准备好的dmem/f12中,轻轻混匀,300
×
g离心5分钟,弃上清,收集细胞;
79.4)加入适量的完全培养基重悬收集的细胞,轻柔吹吸成单细胞悬液。取10μl单细胞悬液与10μl ao/pi染料混匀,进行细胞计数和活性检测,记录复苏后的细胞活率;
80.5)按照接种密度为1
×
104‑3×
104细胞/cm2接种到培养皿中,放入培养箱(37℃,5%co2)中进行培养;
81.6)24小时后观察细胞贴壁情况,换液。
82.下述实施例中,jurkat人急性t淋巴细胞白血病细胞的冻存方法包括以下步骤:
83.1)收集准备冻存的jurkat细胞,300
×
g离心5分钟,去除细胞培养基;
84.2)用pbs缓冲液清洗1遍,小心吹成单细胞悬液,300
×
g离心5分钟,去除pbs,收集细胞;
85.3)收集的细胞按照终密度为3
×
106/ml加入2
‑
8℃保存的下述实施例或对比例中
的细胞冻存液,充分混匀后,分装到2ml的冻存管,密封标注;
86.4)分装好的冻存管可直接置于
‑
80℃冰箱冻存。若长期保存(>1年),可在
‑
80℃冷冻12h后将细胞转移至液氮保存。
87.下述实施例中,jurkat人急性t淋巴细胞白血病细胞的复苏方法包括以下步骤:
88.1)准备37℃水浴锅,准备15ml离心管,加入5
‑
10ml 37℃预热的rpmi1640;
89.2)从上述
‑
80℃冰箱或液氮的冻存管中取出细胞,迅速在37℃水浴锅中摇动融化,得到细胞悬液;
90.3)将冻存管中的细胞悬液逐滴转移至预先准备好的rpmi 1640中,轻轻混匀,300
×
g离心5分钟,弃上清,收集细胞;
91.4)加入适量的rpmi 1640+10%胎牛血清完全培养基重悬收集的细胞,轻柔吹吸成单细胞悬液;取10μl单细胞悬液与10μl ao/pi染料混匀,进行细胞计数和活性检测,记录复苏后的细胞活率;
92.5)按照接种密度为1
×
105‑3×
105细胞/cm2接种到培养皿中,放入培养箱(37℃,5%co2)中进行培养;
93.6)24小时后观察细胞状态,换液。
94.上述方法中和下述实施例中,冻存前和复苏后的细胞活率检测方法为ao/pi染色法,较台盼蓝染色法更为准确。ao/pi染色法采用核酸特异性标记原理,ao(吖啶橙,小分子染料,488nm激发,525nm发射)标记活细胞核发绿色荧光,pi(碘化丙啶,大分子染料,535nm激发,600nm发射)标记死细胞核发红色荧光,根据活死细胞荧光不同直接排除杂质碎片的干扰,弥补了台盼蓝的不足。
95.ao/pi染色法包括以下步骤:
96.1)细胞悬液混合均匀后,取10μl细胞悬液与10μl ao/pi染料混匀,加入到计数板中;
97.2)避光反应30s后,操作自动细胞计数分析仪进行ao/pi计数;
98.3)从计数仪中读取细胞活率、总细胞数和活细胞数等结果。
99.实施例1一种无血清、无蛋白和无dmso的细胞冻存液
100.一种无血清、无蛋白和无dmso的细胞冻存液,所述细胞冻存液由以下含量的组分组成:
101.[0102][0103]
实施例2一种无血清、无蛋白和无dmso的细胞冻存液
[0104]
一种无血清、无蛋白和无dmso的细胞冻存液,所述细胞冻存液由以下含量的组分组成:
[0105][0106]
实施例3一种无血清、无蛋白和无dmso的细胞冻存液
[0107]
一种无血清、无蛋白和无dmso的细胞冻存液,所述细胞冻存液由以下含量的组分组成:
[0108][0109][0110]
实施例4一种无血清、无蛋白和无dmso的细胞冻存液
[0111]
一种无血清、无蛋白和无dmso的细胞冻存液,所述细胞冻存液由以下含量的组分组成:
[0112][0113]
实施例5一种无血清、无蛋白和无dmso的细胞冻存液
[0114]
一种无血清、无蛋白和无dmso的细胞冻存液,所述细胞冻存液由以下含量的组分组成:
[0115][0116]
上述实施例1
‑
5中的无血清、无蛋白和无dmso的细胞冻存液的制备方法,包括以下步骤:
[0117]
1)准备无菌无内毒素方瓶,按实施例1
‑
5中细胞冻存液中各组分的含量将5%葡萄糖注射液、复方氨基酸注射液(14aa)和甘油混合均匀,得到混合液i;
[0118]
2)向步骤1)所得混合液i中依次加入磷酸二氢钾、磷酸氢二钠、氯化钠、蔗糖、羟乙基淀粉和三磷酸腺苷
‑
二钠氯化镁,得到混合液ii;其中,临用时将三磷酸腺苷二钠100mg和氯化镁32mg完全混合,得到三磷酸腺苷
‑
二钠氯化镁;
[0119]
3)向步骤2)所得混合液ii中加医用水使各组分完全溶解,定容至所配体积,各组分的含量如实施例1
‑
5所述,得到混合液iii;
[0120]
4)采用0.2μm过滤器,对步骤3)所得混合液iii进行无菌过滤到无菌无内毒素的西林瓶中,盖上胶塞,用封口器密封瓶盖。同时抽样进行微生物检测、内毒素检测、支原体检测,结果均为阴性,判断为合格后得到细胞冻存液;
[0121]
5)将制备好的细胞冻存液置于2
‑
8℃医用冰箱冷藏。
[0122]
对比例1一种含血清和含dmso的常规型细胞冻存液(对照含血清含dmso冻存液)
[0123]
一种含血清和含dmso的常规型细胞冻存液,所述常规型细胞冻存液由基础培养基dmem/f12,胎牛血清和dmso组成;其中,dmem/f12在所述常规型细胞冻存液中的体积含量为80%,胎牛血清在所述常规型细胞冻存液中的体积含量为10%,dmso在所述常规型细胞冻存液中的体积含量为10%。
[0124]
对比例2一种无血清、无蛋白和无dmso的细胞冻存液(对照无血清无蛋白无dmso冻存液)
[0125]
一种无血清、无蛋白和无dmso的细胞冻存液,购自友康生物的gmp级细胞冻存液。
[0126]
试验例1人脐带间充质干细胞的冻存复苏的细胞活率对比(短时间)
[0127]
以人脐带间充质干细胞为受试细胞,分别以实施例1
‑
5的无血清、无蛋白和无dmso的细胞冻存液为受试冻存液,同时以对比例1的对照含血清含dmso冻存液和对比例2的对照无血清无蛋白无dmso冻存液作为对照冻存液,按照本发明中上述人脐带间充质干细胞的冻存方法和复苏方法对人脐带间充质干细胞冻存3天后复苏,测细胞活率,比较各个细胞冻存液对细胞的活性保持情况。
[0128]
不同细胞冻存液对人脐带间充质干细胞冻存复苏后的细胞活率结果如表1所示,实施例5的无血清、无蛋白和无dmso的细胞冻存液和对比例1的对照含血清含dmso冻存液冻存复苏后的细胞活率相当,也是最高的两组,活率分别为94.5%和94.8%,明显比对比例2的对照无血清无蛋白无dmso冻存液复苏后的细胞活率(84.7%)高。使用不同细胞冻存液对人脐带间充质干细胞冻存复苏后,细胞48h的形态图如图1,实施例1
‑
5和对比例1
‑
2的细胞冻存液冻存复苏后的细胞均正常贴壁,保持很好的间充质干细胞形态。
[0129]
表1不同细胞冻存液对人脐带间充质干细胞冻存复苏后的细胞活率
[0130] 实施例1实施例2实施例3实施例4实施例5对比例1对比例2细胞活率80.9%88.8%90.1%92.4%94.5%94.8%84.7%
[0131]
试验例2人脐带间充质干细胞的冻存复苏的细胞活率对比(长时间)
[0132]
以人脐带间充质干细胞为受试细胞,以实施例5的无血清、无蛋白和无dmso的细胞冻存液为受试冻存液,同时以对比例1的对照含血清含dmso冻存液和对比例2的对照无血清无蛋白无dmso冻存液作为对照冻存液,按照本发明中上述人脐带间充质干细胞的冻存方法和复苏方法对人脐带间充质干细胞冻存,分别在冻存3天、1个月、3个月、6个月和12个月后复苏,比较各个细胞冻存液不同冻存时间的细胞活率。
[0133]
不同细胞冻存液对人脐带间充质干细胞冻存不同时间复苏后的细胞活率结果如表2所示,实施例5的无血清、无蛋白和无dmso的细胞冻存液和对比例1的对照含血清含dmso冻存液在冻存一年内复苏后都能很好地保持细胞的活率在85%以上。对比例2的对照无血清无蛋白无dmso冻存液在冻存一年后复苏的细胞活率仅为71%。三种细胞冻存液冻存长时间(1年)后复苏的细胞形态如图2所示,显示细胞形态均正常,仍然保持间充质干细胞的长梭形。
[0134]
表2不同细胞冻存液对人脐带间充质干细胞冻存不同时间复苏后的细胞活率结果
[0135] 实施例5对比例1对比例23天92.5%96.7%82.5%1个月91.8%95%80.3%3个月90.6%94.2%79.1%6个月90%92.8%72.4%12个月88.5%91.9%71%
[0136]
试验例3人脐带间充质干细胞冻存复苏后细胞的干性检测
[0137]
以人脐带间充质干细胞为受试细胞,以实施例5的无血清、无蛋白和无dmso的细胞冻存液为受试冻存液,按照本发明中上述人脐带间充质干细胞的冻存方法和复苏方法对人脐带间充质干细胞进行冻存1年后再复苏,复苏72h后,对细胞表面标志物进行流式检测,步骤如下:
[0138]
1)显微镜下观察,细胞汇合度达到80%
‑
90%时,吸弃旧培养基。
[0139]
2)用1
×
pbs润洗细胞一次。
[0140]
3)每6孔板孔中加入500μl预热的tryple
tm express enzyme,37℃消化3
‑
5分钟,待细胞完全脱落。一次检测需要2孔细胞量。
[0141]
4)每6孔板孔加入2ml预热的完全培养基,轻柔吹吸成单细胞悬液。
[0142]
5)细胞计数后分装成8管,每管1
×
105‑2×
105个细胞,300
×
g离心5分钟,弃上清。
[0143]
6)按表3在每管中加入相应抗体,充分混匀。
[0144]
表3每管中加入的抗体
[0145]
序号10%fbs in 1
×
pbs抗体#1100μl0.1μl fitc mouse igg1,κisotype ctrl#2100μl1μl pe mouse igg1,κisotype ctrl#3100μl1μl cd90
‑
fitc#4100μl1μl cd73
‑
fitc#5100μl1μl cd105
‑
pe#6100μl1μl cd34
‑
fitc#7100μl1μl cd45
‑
pe#8100μl1μl hla
‑
dr
‑
pe
[0146]
7)避光室温孵育1h,每隔15min摇晃一次,避免细胞沉降。
[0147]
8)每管加1ml 1
×
pbs洗细胞2
‑
3遍。
[0148]
9)最后每管用200μl 1
×
pbs重悬。
[0149]
10)将样品管置于冰上进行流式细胞仪检测分析。
[0150]
对细胞表面标志物进行流式检测的结果如图3所示,使用实施例5的无血清、无蛋白和无dmso的细胞冻存液冻存复苏后的人脐带间充质干细胞仍然保持很好的干细胞表型(即干性),cd73的阳性细胞比率为96.37%,cd90的阳性细胞比率为99.8%,cd105的阳性细胞比率为99.7%,cd34的阳性细胞比率为0.06%,cd45的阳性细胞比率为0.00%,hla
‑
dr的阳性细胞比率为0.02%。因此,实施例5的无血清、无蛋白和无dmso的细胞冻存液保存了细胞的干性,可以应用于细胞治疗。
[0151]
试验例4 jurkat人急性t淋巴细胞白血病细胞的冻存复苏后的细胞活率对比
[0152]
除了检测各个细胞冻存液在冻存复苏人脐带间充质干细胞后的细胞活率外,本发明还检测了各个细胞冻存液在冻存复苏人淋巴细胞后的细胞活率表现。
[0153]
以jurkat人急性t淋巴细胞白血病细胞为受试细胞,以实施例1
‑
5的无血清、无蛋白和无dmso的细胞冻存液为受试冻存液,同时以对比例1的对照含血清含dmso冻存液和对比例2的对照无血清无蛋白无dmso冻存液作为对照冻存液,按照本发明中上述jurkat人急性t淋巴细胞白血病细胞的冻存方法和复苏方法对jurkat人急性t淋巴细胞白血病细胞冻存1个月后复苏,检测细胞活率,比较各个细胞冻存液对细胞的活性保持情况。
[0154]
不同细胞冻存液对jurkat人急性t淋巴细胞白血病细胞冻存复苏后的细胞活率结果如表4所示,实施例5的无血清、无蛋白和无dmso的细胞冻存液冻存复苏后的细胞活率最高,为97.3%,高于对比例1的对照含血清含dmso冻存液(95.9%)和对比例2的对照无血清无蛋白无dmso冻存液(90.5%)的细胞活率。
[0155]
表4不同细胞冻存液对jurkat人急性t淋巴细胞白血病细胞冻存复苏后的细胞活率
[0156] 实施例1实施例2实施例3实施例4实施例5对比例1对比例2细胞活率85.8%90.9%92.1%94.1%97.3%95.9%90.5%
[0157]
试验例5一种无血清、无蛋白和无dmso的细胞冻存液的临床前安全性检测
[0158]
临床用细胞冻存液还需满足另一个重要的因素,那就是安全。因此我们利用单次给药毒性试对细胞冻存液的安全性进行了临床前的检测。
[0159]
单次给药毒性试验,即急性毒性试验,是指在24小时内动物接受药物1
‑
2次(间歇时间为6
‑
8小时),观察给药后动物7
‑
14天内所产生的急性中毒反应。在试验中,连续观察动物的毒性反应及死亡情况,包括定性和定量两个方面。定性观察是观察服药后动物有哪些中毒表现,其毒性反应出现和消失的速度、涉及哪些组织和器官、最主要的毒性靶器官、损伤的性质及可逆程度、中毒死亡过程有哪些特征、死亡是原因可能是什么。定量观察就是观察药物毒性反应与剂量的关系。
[0160]
在单次给药毒性试验中,设置了3组,分别是生理盐水组(作为对照),实施例5
‑
冻存液组(即实施例5的无血清、无蛋白和无dmso的细胞冻存液)以及实施例5
‑
冻存液和人脐带间充质干细胞的混悬液组(即实施例5的无血清、无蛋白和无dmso的细胞冻存液和人脐带间充质干细胞的混悬液),以此更好地检测细胞冻存液在临床上的安全性。具体步骤如下:
[0161]
1、试验动物饲养
[0162]
单次给药毒性试验采用8
‑
9周龄km小鼠,每组雌雄各半共6只,体重差异<平均体重的20%;
[0163]
分笼饲养:给药前按3只/笼、雌雄分开饲养一周,适应环境。定期更换垫料、补充鼠粮和饮水,隔天观察或称重,保证小鼠饮食正常,如出现撕咬则再次分笼饲养。一周后,体重应略有增加,体重差异<平均体重的20%。
[0164]
2、试验方法和给药
[0165]
2.1实验分组:将18只小鼠按表5随机分成3组,进行给药,给药前停食4h,给药后再禁食2h;
[0166]
表5各组的给药剂量和动物数量
[0167][0168]
2.2动物称重:给药前分别对小鼠进行称重并记录,记为day0;
[0169]
2.3给药途径:尾静脉注射。用烧杯罩住小鼠,露出尾巴,用医用酒精棉球擦拭后,按给药剂量将试验样品分别注入小鼠尾静脉。
[0170]
3、观察时间和指标
[0171]
3.1体重记录:给药后分别在day1、day2、day4、day6、day8、day10、day12、day14进行再次称重并记录;
[0172]
3.2观察小鼠临床症状:给药后0.5h、1h、2h、4h、day1、day2、day4、day6、day8、day10、day12、day14分别观察小鼠临床症状(如外观、呼吸、行为、饮食、分泌物、排泄物等)、死亡情况(死亡时间、濒死前反应等);
[0173]
4、大体解剖:所有试验小鼠在观察期结束后处死并进行大体解剖,重点关注肺脏、肝脏和脾脏,比较体积、颜色、质地的改变,分别拍照并称重。
[0174]
5、数据分析及评价:根据所观察到的各种反应出现的时间、严重程度、持续时间等,判断受试物引起的毒性反应性质、严重程度、可恢复性以及安全范围;根据毒性可能涉及的部位,综合大体解剖和组织病理学检查的结果,初步判断毒性靶器官。
[0175]
单次给药毒性试验结果:
[0176]
1)给药后连续14天,3个组的小鼠体重变化如图4所示,均呈现缓慢正常的增长。
[0177]
2)给药后连续观察小鼠的临床症状,3个组的小鼠外观、呼吸、行为、饮食、分泌物、排泄物等均没有出现明显异常;
[0178]
3)观察期结束大体解剖中,3个组小鼠的各个脏器比较情况如图5所示,均没有明显的不良或毒性反应,尤其间充质干细胞富集的区域包括肺脏、肝脏和脾脏,体积、颜色、质量和质地均没有明显差别。
[0179]
因此,本发明的无血清、无蛋白和无dmso的细胞冻存液在临床上具有很高的安全性。
[0180]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1