一种防治组培苗老化的综合方法及应用
1.本发明属于植物组织培养技术领域,特别是涉及一种防治组培苗老化的综合方法及应用。
背景技术:
2.植物组织培养技术是植物研究与生产的重要手段。植物组织培养过程中,组培苗长期继代保存会出现生长势减弱、生长停滞或生长点坏死等老化现象,严重影响植物组织培养研究以及生产的正常进行,进而对组织培养产业造成较大的影响。
3.组培苗老化多数是因长时间无性繁殖导致的生理老化引起。组培苗老化的原因主要有:首先是遗传原因,植物在进化过程中形成了一定的衰老机制,植株个体都要经历由生到死的过程,这在有性繁殖和营养繁殖的植物中都会发生。在植物组织培养过程中也会出现这种遗传因素造成的衰老现象,当正常培养继代繁殖的植株出现不明原因的生长停止现象时往往是衰老造成的,一般情况下即使采用一些措施缓解衰老,效果也并不理想。组培中如果遇到遗传造成组培苗生长停滞老化现象,除了采用一些措施进行缓解外,更重要的是通过重新培养外植体进行继代繁殖,这是应对遗传因素造成组培苗衰老的有效方法;其次,逆境是造成组培苗衰老的主要原因。在组培中,继代时间过长会造成培养基中营养缺乏,有毒物质积累过多等都会导致植株过早衰老。在培养中不良的培养条件,如过高或过低的培养温度、不适的光照强度和光周期等因素也会加速组培苗的老化,因此,在组培过程中应注意培养条件的变化,使得组培苗始终保持在最佳的生长条件下,这样可以减缓组培苗的过早老化,使得组培苗的继代培养时间能够延长,在植物种质资源保存研究中尤为重要;第三,引起组培苗老化也受到激素水平的影响。在组培苗培养后期,随着植株的老化,植株内源激素的合成水平开始下降,如果不对培养基中激素水平进行调整,势必造成组培苗生长势减弱,提早进入衰老状态,因此,要想长时间继代培养,应该注意培养基中激素水平调节,适当增加一些生长素和分裂素用量。除了上述一些原因引起组培苗衰老外,还有一些其它因素也会造成组培苗的衰老,如外植体中微生物的活动,内生菌或病毒积累也会导致组培苗衰老加速,应经常对长时间继代材料进行脱菌脱毒处理,使之保持健壮状态。
技术实现要素:
4.本发明克服了植物组织培养研究中长期继代保存的组培苗出现的老化现象技术的缺陷,提供一种可以缓解组培苗老化、组培苗复壮的方法。
5.本发明的目的是解决长期继代保存的组培苗出现的老化现象。
6.为实现上述目的,本发明公开了一种防治组培苗老化的方法,其特征在于按如下的三种方法之一加以处理:(1)采用抗氧化剂:在培养基中加入50-100 mg/l vc(抗坏血酸);25-100 mg/l dtt(二硫苏糖醇);25-100 mg/l pvp(聚乙烯吡咯烷酮);1-10 mg/l agno3(硝酸银)作为抗氧化剂。在继代时,
将老化的组培苗茎尖剪下,接种到加有不同抗氧化剂的培养基上进行培养。每20-30 d剪取长约0.5-2 cm生长健壮的茎尖继代培养,继代培养3-5次,可有效缓解长期继代保存的组培苗生长势减弱、生长点坏死老化现象;(2)调节培养基渗透压:以10-20g/l 蔗糖和1/2倍ms无机盐调节培养基渗透压。在继代时,将老化的组培苗茎尖剪下,接种到调节渗透压的培养基上进行培养。每20-30 d剪取长约0.5-2 cm生长健壮的茎尖继代培养,继代培养3-5次,可促使老化组培苗继续生长;(3)添加外源植物激素:在培养基中单独添加0.5-1 mg/l iaa(吲哚乙酸)或5-10 mg/l ga3(赤霉素),或者在培养基中同时添加0.1-0.5 mg/l iaa(吲哚乙酸)和5-10 mg/l ga3(赤霉素),继代时,将老化组培苗接种到配制好的培养基上,每20-30 d剪取长约0.5-2 cm生长健壮的茎尖继代培养,继代培养2-3次,可促使老化组培苗继续生长。
7.本发明进一步公开了防治组培苗老化方法在有效缓解组培苗老化、提高组培苗复壮方面的应用。实验结果显示在添加vc(抗坏血酸)、dtt(二硫苏糖醇)、pvp(聚乙烯吡咯烷酮)和agno3(硝酸银)等4种抗氧化剂;调整培养基渗透压和蔗糖浓度;添加iaa(吲哚乙酸)、ga3(赤霉素)等外源植物激素等处理下花椰菜老化苗可以继续正常生长并复壮。
8.本发明更加详细的描述如下:方法1 采用抗氧化剂在培养基中加入50-100 mg/l vc(抗坏血酸);25-100 mg/l dtt(二硫苏糖醇);25-100 mg/l pvp(聚乙烯吡咯烷酮);1-10 mg/l agno3(硝酸银)作为抗氧化剂。在继代时,将老化的组培苗茎尖剪下,接种到加有不同抗氧化剂的培养基上进行培养。培养条件为20-25℃连续光照,光照强度为2000-3000 lx。每20-30 d剪取长约0.5-2 cm生长健壮的茎尖继代培养。继代培养3-5次,进而缓解长期继代保存的组培苗生长势减弱和生长点坏死老化现象;方法2 调节培养基渗透压以10-20g/l 蔗糖和1/2倍ms无机盐调节培养基渗透压,将老化的组培苗进行复壮培养;在继代时,将老化的组培苗茎尖剪下,接种到调节渗透压的培养基上进行培养。在继代时,将老化的组培苗茎尖剪下,接种到加有不同抗氧化剂的培养基上进行培养。培养条件为20-25℃连续光照,光照强度为2000-3000 lx。每20-30 d剪取长约0.5-2 cm生长健壮的茎尖继代培养。继代培养3-5次,进而缓解长期继代保存的组培苗生长势减弱和生长点坏死老化现象;方法3 添加外源植物激素在培养基中单独添加0.5-1 mg/l iaa(吲哚乙酸)或5-10 mg/l ga3(赤霉素),或者在培养基中同时添加0.1-0.5 mg/l iaa(吲哚乙酸)和5-10 mg/l ga3(赤霉素)。在继代时,将老化的组培苗茎尖剪下,接种到加有不同抗氧化剂的培养基上进行培养。培养条件为20-25℃连续光照,光照强度为2000-3000 lx。每20-30 d剪取长约0.5-2 cm生长健壮的茎尖继代培养,继代培养2-3次。之后将生长健壮的组培苗剪下,重新接种到正常的ms培养基上。进而缓解长期继代保存的组培苗生长势减弱和生长点坏死老化现象。
9.本发明ms培养基其组成是:kno
3 1900mg/l、nh4no
3 1650mg/l、cacl2•
2h2o 440mg/
l、mgs04•
7h2o370mg/l、kh2p04700mg/l、ki0.83mg/l、h3bo36.2mg/l、mns04•
4h2o22.3mg/l、zns04•
7h208.6mg/l、na2mn04•
2h2022.3mg/l、cus04•
5h200.025mg/l、cocl2•
6h200.025mg/l、fes04•
7h2027.8mg/l、na
2-edta
•
2h2037.3mg/l、甘氨酸2mg/l、烟酸0.5mg/l、盐酸吡多辛0.5mg/l、盐酸硫胺素0.5mg/l、肌醇100mg/l、琼脂粉7g/l、蔗糖30g/l。
10.本发明主要考察了一种长期继代保存组培苗老化现象的防治方法重点是解决植物组织培养中组培苗的老化现象,发明的难点在于使生长势衰弱的组培苗恢复到生长势旺盛的状态。
11.本发明公开的防治组培苗老化的方法及应用所具有的积极效果在于:(1)易于操作,通过添加物和改变培养基渗透压达到复壮的效果;(2)降低长期继代保存组培植物材料的成本;(3)复壮保持不易获取的老化珍贵组培植物材料。
具体实施方式
12.下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。本发明所用原料及试剂均有市售。
13.实施例1采用抗氧化剂防治花椰菜组培苗老化供试材料为继代保持3年的花椰菜组培苗,该组培苗生长势明显减弱,并出现生长点死亡的现象。选择生长势相近,植株大小一致的组培苗进行试验。
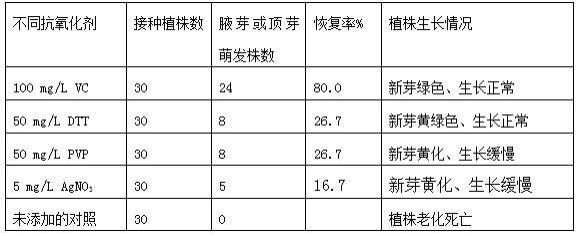
14.将vc(抗坏血酸)、dtt(二硫苏糖醇)、pvp(聚乙烯吡咯烷酮)和agno3(硝酸银)4种抗氧化剂分别配置成100mg/ml、50mg/ml、50mg/ml和5mg/ml的水溶液在超净台中采用抽滤灭菌的方法进行消毒处理,贮存在离心管中备用。试验采用ms培养基,附加30g/l蔗糖和7g/l的琼脂粉,灭菌前调节ph至5.8,高温灭菌后,待培养基冷却至60-70℃时,将4种抗氧化剂分别加入到培养基中,然后将培养基分装到100ml广口三角瓶中,每瓶加入培养基30ml。培养基中添加的抗氧化剂浓度分别为100mg/lvc、50mg/ldtt、50mg/lpvp、5mg/lagno3。将老化的花椰菜组培苗接种至加入抗氧化剂的ms培养基中,以未加抗氧化剂的ms培养基为对照。培养条件为25℃连续光照,光照强度为2000lx。30d后,观察植株腋芽和生长点的萌发与生长情况。
15.表1不同抗氧化剂对花椰菜老化组培苗生长的影响试验结果
结果显示在添加vc(抗坏血酸)、dtt(二硫苏糖醇)、pvp(聚乙烯吡咯烷酮)和agno3(硝酸银)等4种抗氧化剂之后花椰菜老化组培苗有新芽萌发并可以继续生长。
16.实施例2 调节培养基渗透压防治花椰菜组培苗老化供试材料与实施例1采用的材料相同。选择生长势相近,植株大小一致的组培苗进行试验。
17.试验采用ms为基本培养基,分别采用1、1/2、1/4倍数的ms无机盐浓度和10g/l、20g/l蔗糖浓度配制培养基。分别配制出ms+10 g/l蔗糖、ms+20 g/l蔗糖、1/2ms+10 g/l蔗糖、1/2ms+20 g/l蔗糖、1/4ms+10 g/l蔗糖和1/4ms+10 g/l蔗糖等配比的培养基。培养基统一使用7g/l的琼脂粉,灭菌前调节ph至5.8,高温灭菌后,将培养基分装到100ml广口三角瓶中,每瓶加入培养基30ml。之后,将老化的花椰菜组培苗接种至加入渗透压调节培养基中。培养条件为25℃连续光照,光照强度为2000 lx。30 d后,观察植株腋芽和生长点的萌发与生长情况。
18.表2渗透压与无机盐对花椰菜老化植株生长的影响试验结果结果显示通过降低培养基渗透压至1/2ms和改变蔗糖浓度,能促进花椰菜老化植
株继续生长,其中1/2ms+10 g/l蔗糖浓度条件下老化组培苗的复壮效果最佳,再生芽正常生长。
19.实施例3 添加外源植物激素防治花椰菜组培苗老化供试材料与实施例1采用的材料相同。选择生长势相近,植株大小一致的组培苗进行试验。
20.将iaa(吲哚乙酸)、ga3(赤霉素)先用少量无水乙醇进行预溶,之后加入无菌水分别配制成1 mg/ml的母液,在超净台中采用抽滤灭菌的方法进行消毒处理,加入到离心管中,之后在4℃条件下避光保存备用。试验采用ms培养基,附加30g/l蔗糖和7g/l的琼脂粉,灭菌前调节ph至5.8,高温灭菌后,待培养基冷却至60-70℃时,将植物外源激素加入到培养基中,然后将培养基分装到100ml广口三角瓶中,每瓶加入培养基30ml。加入培养基中的激素组合有0.5 mg/l iaa、1 mg/l iaa、5 mg/l ga3、10 mg/l ga3、20 mg/l ga3、10 mg/l ga3+0.5 mg/l iaa。将老化的组培苗接种到上面,培养条件为25 ℃连续光照,光照强度为2000 lx。30d后,观察植株腋芽和生长点的萌发与生长情况。
21.表3 不同激素对花椰菜老化植株生长的试验结果结果显示:通过分别添加一定浓度的iaa(吲哚乙酸)、ga3(赤霉素)等植物外源激素或混合使用,能促进花椰菜老化植株继续生长,使花椰菜老化苗复壮。
22.在详细说明的较佳实施例之后,熟悉该项技术人士可清楚地了解,在不脱离上述申请专利范围与精神下可进行各种变化与修改,凡依据本发明的技术实质对以上实施例所作任何简单修改、等同变化与修饰,均属于本发明技术方案的范围。且本发明亦不受说明书中所举实例实施方式的限制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1