富含瑞鲍迪苷E的甜菊植物体的制作方法
富含瑞鲍迪苷e的甜菊植物体
技术领域
1.本发明涉及瑞鲍迪苷e的含量高的甜菊植物体及其筛选方法等。
背景技术:
2.为了应对多样化的消费者需求,各种各样的饮料被开发销售。蔗糖等糖类是因提供甜味等目的而极普遍地调配至饮料中的成分,然而指出其因过度摄取而对健康造成影响,对于更低热量,且来自于天然的甜味剂的需求逐渐提高。例如专利文献1中公开有含有维生素、高甜度甜味剂及甜味改善组合物的功能性甜味剂组合物。
3.甜菊醇糖苷作为甜菊萃取物中所含的甜味成分被熟知。甜菊萃取物主要从甜菊的叶中萃取、提纯而得。甜菊为以南美巴拉圭为原产地的菊科多年生植物,学名称作stevia rebaudiana bertoni。由于甜菊含有具有砂糖的约300倍以上的甜味的成分,因此为了萃取该甜味成分作为天然甜味剂使用而被栽培。作为甜菊醇糖苷,报告有瑞鲍迪苷a(rebaudioside a,以下有时将“瑞鲍迪苷”(rebaudioside)简称为“reb”)、rebb、rebc、rebd、rebe、rebm等各种各样的糖苷的存在(专利文献2)。在各种各样的甜菊醇糖苷中,例如reba被评价为具有高甜度和优质甜味的甜味剂而被广泛使用。关于其他的甜菊醇糖苷,也不断地明确其特有的甜味及附带的味道。
4.在这样的情况下,已知有单位干燥叶含有5.33%或5.71%的rebe的甜菊植物体(专利文献3)。
5.专利文献
6.专利文献1:国际wo2007/070224
7.专利文献2:国际wo2010/038911
8.专利文献3:国际wo2018/102648
技术实现要素:
9.关于甜菊植物的基因信息,机体内现象的控制与怎样的基因有关等,未知的部分还很多。因此,追求进一步明确甜菊的基因信息。
10.本发明提供,在基因组碱基序列中具有特定的单核苷酸多态性(snp)的甜菊植物体,以及该植物体的制作方法及筛选方法。这样的甜菊植物体具有瑞鲍迪苷e的含量高的特征。
11.在一种方式中,本发明提供以下内容。
12.[1]一种甜菊植物体,其特征在于,具有以下(a)~(e)的遗传性状中的至少1种:
[0013]
(a)对于与序列号1的40位相当的位置的碱基为c的等位基因呈同型接合性或异型接合性;
[0014]
(b)对于与序列号2的21位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性;
[0015]
(c)对于与序列号3的28位相当的位置的碱基为t的等位基因呈同型接合性或异型
接合性;
[0016]
(d)对于与序列号4的59位相当的位置的碱基为c的等位基因呈同型接合性或异型接合性;
[0017]
(e)对于与序列号5的64位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性。
[0018]
[2]根据[1]所述的植物体,其特征在于,含有干燥叶的每单位质量0.07%以上的瑞鲍迪苷e。
[0019]
[3]根据[1]或[2]所述的植物体,其特征在于,为非转基因甜菊植物体。
[0020]
[4]根据[1]~[3]中任一项所述的植物体,其特征在于,包含实施变异诱发处理的甜菊植物体及其后代植物体。
[0021]
[5]一种种子、干燥叶、组织、组织培养物或细胞,其特征在于,为[1]~[4]中任一项所述的植物体的种子、干燥叶、组织、组织培养物或细胞。
[0022]
[6]根据[5]所述的组织、组织培养物或细胞,其特征在于,选自胚、分生组织细胞、花粉、叶、根、根尖、花瓣、原生质体、叶的切片及愈伤组织。
[0023]
[7]一种方法,其为特征为含有干燥叶每单位质量0.07%以上的瑞鲍迪苷e的富含瑞鲍迪苷e的甜菊植物体的制作方法,其特征在于,包含使[1]~[4]中任一项所述的甜菊植物体与第2甜菊植物体杂交的工序。
[0024]
[8]根据[7]所述的方法,其特征在于,第2植物体为[1]~[4]中任一项所述的甜菊植物体。
[0025]
[9]一种[1]~[4]中任一项所述的植物体、[5]所述的种子、干燥叶、组织、组织培养物或细胞的萃取物,其特征在于,含有瑞鲍迪苷e。
[0026]
[10]一种饮食品、甜味剂组合物、香料或医药品,其特征在于,含有[9]所述的萃取物。
[0027]
[11]一种含有瑞鲍迪苷e的萃取物的制造方法,其特征在于,包含从[1]~[4]中任一项所述的植物体、[5]所述的种子、干燥叶、组织、组织培养物或细胞中获得含有瑞鲍迪苷e的萃取物的工序。
[0028]
[12]一种瑞鲍迪苷e的制造方法,其特征在于,包含从[11]所述的含有瑞鲍迪苷e的萃取物中提纯瑞鲍迪苷e的工序。
[0029]
[13]一种饮食品、甜味剂组合物、香料或医药品的制造方法,其特征在于,包含提供[1]~[4]中任一项所述的植物体的萃取物、[5]所述的种子、干燥叶、组织、组织培养物或细胞的萃取物,或者[11]所述的萃取物的工序,及,
[0030]
将所述萃取物添加至饮食品、甜味剂组合物、香料或医药品的原料中的工序。
[0031]
[14]一种方法,其为[1]~[4]中任一项所述的甜菊植物体的筛选方法,其特征在于,包含从被检植物的基因组中,检测存在及/或不存在以下(a)~(e)的遗传性状中的至少1种的工序:
[0032]
(a)对于与序列号1的40位相当的位置的碱基为c的等位基因呈同型接合性或异型接合性;
[0033]
(b)对于与序列号2的21位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性;
[0034]
(c)对于与序列号3的28位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性;
[0035]
(d)对于与序列号4的59位相当的位置的碱基为c的等位基因呈同型接合性或异型接合性;
[0036]
(e)对于与序列号5的64位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性。
[0037]
[15]根据[14]所述的方法,其特征在于,进一步包含测定叶组织的瑞鲍迪苷e的含量的工序。
[0038]
[16]根据[14]或[15]所述的方法,其特征在于,通过筛选而得的植物体,含有干燥叶的每单位质量0.07%以上的瑞鲍迪苷e。
[0039]
根据本发明,可获得基因组碱基序列中具有特定的snp,且瑞鲍迪苷e的含量高的甜菊植物体,可提供制作这样的植物体的方法,从这样的植物体中获得的叶,及含有从这样的叶中获得的有用的甜菊醇糖苷的食物或饮料等。
附图说明
[0040]
图1为表示序列号16的碱基序列中的变异(a)的图。被框围起来的碱基为变异(a)涉及的碱基。
[0041]
图2为表示序列号20的碱基序列中的变异(b)的图。被框围起来的碱基为变异(b)涉及的碱基。
[0042]
图3为表示序列号24的碱基序列中的变异(c)的图。被框围起来的碱基为变异(c)涉及的碱基。
[0043]
图4为表示序列号28的碱基序列中的变异(d)的图。被框围起来的碱基为变异(d)涉及的碱基。
[0044]
图5为表示序列号32的碱基序列中的变异(e)的图。被框围起来的碱基为变异(e)涉及的碱基。
[0045]
图6表示实施例中的遗传性状(a)与平均rebe含量的关系。
[0046]
图7为表示通过dcaps法对甜菊植物体是否具有遗传性状(a)进行分析的结果的图。泳道1、泳道2及泳道3分别表示用限制酶rsai对相对于具有变异(a)的等位基因呈同型接合性的个体、相对于具有变异(a)的等位基因呈异型接合性的个体及相对于不具有变异(a)的等位基因呈同型接合性的个体的dna处理而得的样本的电泳图像。
具体实施方式
[0047]
以下对本发明进行详细说明。以下实施方式为用于说明本发明的例示,本发明并不仅限定于这些实施方式。只要不脱离该主旨,本发明可通过各种方式来实施。
[0048]
另外,本说明书中引用的所有文献及公开公报、专利公报以及其他专利文献,作为参考纳入本说明书。此外,本说明书包含2020年5月12日提出申请的作为本技术优先权主张的基础的日本专利申请(日本特愿2020-084130号)的说明书及附图中所述内容。
[0049]
1.甜菊植物体
[0050]
本发明提供一种甜菊植物体(以下,有时统称“本发明的植物体”或“本发明的甜菊
植物体”),其特征在于,由野生种的甜菊植物体派生且具有以下(a)~(e)的遗传性状中的至少1种(以下,有时将遗传性状(a)~(e)中的至少1种统称“本发明的遗传性状”)。
[0051]
(a)对于与序列号1的40位相当的位置的碱基为c的等位基因呈同型接合性或异型接合性(以下,有时称作“本发明的遗传性状a”)。
[0052]
(b)对于与序列号2的21位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性(以下,有时称作“本发明的遗传性状b”)。
[0053]
(c)对于与序列号3的28位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性(以下,有时称作“本发明的遗传性状c”)。
[0054]
(d)对于与序列号4的59位相当的位置的碱基为c的等位基因呈同型接合性或异型接合性(以下,有时称作“本发明的遗传性状d”)。
[0055]
(e)对于与序列号5的64位相当的位置的碱基为t的等位基因呈同型接合性或异型接合性(以下,有时称作“本发明的遗传性状e”)。
[0056]
在优选方式中,本发明的甜菊植物体具有本发明的遗传性状(a)。在更优选的方式中,本发明的甜菊植物体,具有本发明的遗传性状(a)中,对于与序列号1的40位相当的位置的碱基为c的等位基因呈同型接合性的遗传性状(以下,有时称作“本发明的遗传性状(a’)”。)。另外,有时将对于与序列号1的40位相当的位置的碱基为c的等位基因呈异型接合性的遗传性状称作本发明的遗传性状(a”)。
[0057]
作为本发明的遗传性状(b),优选为对于与序列号2的21位相当的位置的碱基为t的等位基因呈同型接合性的遗传性状(以下,有时称作“本发明的遗传性状(b’)”)。另外,有时将对于与序列号2的21位相当的位置的碱基为t的等位基因呈异型接合性的遗传性状称作本发明的遗传性状(b”)。
[0058]
作为本发明的遗传性状(c),优选为对于与序列号3的28位相当的位置的碱基为t的等位基因呈同型接合性的遗传性状(以下,有时称作“本发明的遗传性状(c’)”)。另外,有时将对于与序列号3的28位相当的位置的碱基为t的等位基因呈异型接合性的遗传性状称作本发明的遗传性状(c”)。
[0059]
作为本发明的遗传性状(d),优选为对于与序列号4的59位相当的位置的碱基为c的等位基因呈同型接合性的遗传性状(以下,有时称作“本发明的遗传性状(d’)”)。另外,有时将对于与序列号4的59位相当的位置的碱基为c的等位基因呈异型接合性的遗传性状称作本发明的遗传性状(d”)。
[0060]
作为本发明的遗传性状(e),优选为对于与序列号5的64位相当的位置的碱基为t的等位基因呈同型接合性的遗传性状(以下,有时称作“本发明的遗传性状(e’)”)。另外,有时将对于与序列号5的64位相当的位置的碱基为t的等位基因呈异型接合性的遗传性状称作本发明的遗传性状(e”)。
[0061]
在一部分方式中,本发明的植物体也可具有多种上述遗传性状。在该方式中,遗传性状的数量可为2~5种的任一种,即可为2、3、4或5种。遗传性状的组合并无特别限定,例如包含以下括号内的各组合:(a、b)、(a、c)、(a、d)、(a、e)、(b、c)、(b、d)、(b、e)、(c、d)、(c、e)、(d、e)、(a、b、c)、(a、b、d)、(a、b、e)、(a、c、d)、(a、c、e)、(a、d、e)、(b、c、d)、(b、c、e)、(b、d、e)、(c、d、e)、(a、b、c、d)、(a、b、c、e)、(a、b、d、e)、(a、c、d、e)、(b、c、d、e)、(a、b、c、d、e)、(a’、b)、(a’、c)、(a’、d)、(a’、e)、(a’、b、c)、(a’、b、d)、(a’、b、e)、(a’、c、d)、(a’、c、e)、(a’、d、
e)、(a’、b、c、d)、(a’、b、c、e)、(a’、b、d、e)、(a’、c、d、e)、(a’、b、c、d、e)、(a’、b’)、(a’、c’)、(a’、d’)、(a’、e’)、(b’、c’)、(b’、d’)、(b’、e’)、(c’、d’)、(c’、e’)、(d’、e’)、(a’、b’、c’)、(a’、b’、d’)、(a’、b’、e’)、(a’、c’、d’)、(a’、c’、e’)、(a’、d’、e’)、(b’、c’、d’)、(b’、c’、e’)、(b’、d’、e’)、(c’、d’、e’)、(a’、b’、c’、d’)、(a’、b’、c’、e’)、(a’、b’、d’、e’)、(a’、c’、d’、e’)、(b’、c’、d’、e’)、(a’、b’、c’、d’、e’)。上述中,例如(a、b)是指遗传性状(a)与遗传性状(b)的组合。
[0062]
在优选方式中,本发明的植物体具有遗传性状(a)。在更优选的方式中,本发明的植物体具有遗传性状(a’)。在其他优选方式中,本发明的植物体具有遗传性状(a),且具有遗传性状(b)~(e)中的至少1种,在更优选的方式中,本发明的植物体具有遗传性状(a),且具有遗传性状(b)~(e)全部。在其他优选方式中,本发明的植物体具有遗传性状(a),且具有遗传性状(b)~(d)中的至少1种,在更优选的方式中,本发明的植物体具有遗传性状(a),且具有遗传性状(b)~(d)全部。在其他优选方式中,本发明的植物体具有遗传性状(a’),且具有遗传性状(b)~(e)中的至少1种,在更优选的方式中,本发明的植物体具有遗传性状(a’),且具有遗传性状(b)~(e)全部。在其他优选方式中,本发明的植物体具有遗传性状(a’),且具有遗传性状(b)~(d)中的至少1种,在更优选的方式中,本发明的植物体具有遗传性状(a’),且具有遗传性状(b)~(d)全部。在其他优选方式中,本发明的植物体,具有遗传性状(a’),且具有遗传性状(b’)~(e’)中的至少1种,在更优选的方式中,本发明的植物体具有遗传性状(a’),且具有遗传性状(b’)~(e’)全部。在其他优选方式中,本发明的植物体具有遗传性状(a’),且具有遗传性状(b’)~(d’)中的至少1种,在更优选的方式中,本发明的植物体具有遗传性状(a’),且具有遗传性状(b’)~(d’)全部。
[0063]
所谓“与~相当的位置”,当在基因组中存在与标准序列(例如,序列号1~5等)相同的序列时,指在基因组中存在的该序列中的位置(例如,40位、21位、28位、59位、64位等),当在基因组中不存在与标准序列相同的序列时,指基因组中的与标准序列相当的序列中的与标准序列中的位置相当的位置。在基因组中是否存在与标准序列相同或与其相当的序列,例如可通过以下方法决定:通过可用pcr对标准序列进行扩增的引物对作为对象的甜菊植物的基因组dna进行扩增,并实施扩增产物的测序,实施所得序列和标准序列的比对分析。作为与标准序列相当的序列的非限定例,例如可列举相对于标准序列具有60%以上、70%以上、75%以上、80%以上、81%以上、82%以上、83%以上、84%以上、85%以上、86%以上、87%以上、88%以上、89%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、98.1%以上、98.4%以上、98.7%以上、99%以上、99.2%以上、99.5%以上或99.8%以上的序列一致性的碱基序列。基因组中的与标准序列相当的序列中的与标准序列中的位置相当的位置,可以考虑标准序列中的位置的前后的碱基序列等而决定。例如,可通过对标准序列和基因组中的与标准序列相当的序列的比对分析,决定基因组中的与标准序列相当的序列中的与标准序列中的位置相当的位置。
[0064]
例如,以本发明的遗传性状(a)的“与序列号1的40位相当的位置”为例,当甜菊植物体的基因组具有由与序列号1相同的碱基序列构成的部分时,“与序列号1的40位相当的位置”为自基因组中的由与序列号1相同的碱基序列构成的部分的5’侧开始的40位。另一方面,当甜菊植物体的基因组具有由与序列号1不同但是与其相当的碱基序列构成的部分时,由于基因组不具有由与序列号1相同的碱基序列构成的部分,因此“与序列号1的40位相当
的位置”并非一定符合自与序列号1相当的部分的5’侧开始的40位,而可考虑序列号1的40位的前后的碱基序列等,来确定涉及的甜菊植物的基因组中的“与序列号1的40位相当的位置”。例如,通过甜菊植物的基因组中的与序列号1相当的部分的碱基序列和序列号1的碱基序列的比对分析,可确定甜菊植物的基因组中的“与序列号1的40位相当的位置”。
[0065]
此处,有时将选自(a)与序列号1的40位相当的位置、(b)与序列号2的21位相当的位置、(c)与序列号3的28位相当的位置、(d)与序列号4的59位相当的位置、(e)与序列号5的64位相当的位置中的位置,总称为“本发明的多态部位”或“本发明的变异部位”。此外,有时将上述(a)~(e)的各位置称作“本发明的多态部位(a)”、“本发明的多态部位(b)”或“本发明的变异部位(a)”、“本发明的变异部位(b)”等。
[0066]“由与序列号1相当的碱基序列构成的部分”,是指例如,由相对于序列号1的碱基序列具有60%以上、70%以上、75%以上、80%以上、81%以上、82%以上、83%以上、84%以上、85%以上、86%以上、87%以上、88%以上、89%以上、90%以上、91%以上、92%以上、93%以上、94%以上、95%以上、96%以上、97%以上、98%以上、98.1%以上、98.4%以上、98.7%以上、99%以上、99.2%以上、99.5%以上或99.8%以上的序列一致性的碱基序列构成的部分。
[0067]
在一部分方式中,在“由与序列号1相当的碱基序列构成的部分”中包含可通过使用以下引物的pcr进行扩增的甜菊植物体的基因组的部分:与从序列号1的5’末端开始1~39位(即,从序列号1的5’末端至变异部位(a)的1碱基5’末端侧的碱基为止)的部分的互补序列杂交的正向引物和与从序列号1的3’末端侧开始1~163位(即,从序列号1的3’末端至变异部位(a)的1碱基3’末端侧的碱基为止)的部分杂交的反向引物。
[0068]
这里为了简洁,以本发明的遗传性状(a)为例进行了说明,但是对于本发明的遗传性状(b)~(e)也是同样的。
[0069]
特定的方式中,“由与序列号1相当的碱基序列构成的部分”例如,包含可通过使用以下引物的pcr进行扩增的甜菊植物体的基因组的部分:含有序列号6的碱基序列的正向引物,与含有序列号7的碱基序列的反向引物。
[0070]
特定的方式中,“由与序列号2相当的碱基序列构成的部分”例如,包含可通过使用以下引物的pcr进行扩增的甜菊植物体的基因组的部分:含有序列号8的碱基序列的正向引物,与含有序列号9的碱基序列的反向引物。
[0071]
特定的方式中,“由与序列号3相当的碱基序列构成的部分”例如,包含可通过使用以下引物的pcr进行扩增的甜菊植物体的基因组的部分:含有序列号10的碱基序列的正向引物,与含有序列号11的碱基序列的反向引物。
[0072]
特定的方式中,“由与序列号4相当的碱基序列构成的部分”例如,包含可通过使用以下引物的pcr进行扩增的甜菊植物体的基因组的部分:含有序列号12的碱基序列的正向引物,与含有序列号13的碱基序列的反向引物。
[0073]
特定的方式中,“由与序列号5相当的碱基序列构成的部分”例如,包含可通过使用以下引物的pcr进行扩增的甜菊植物体的基因组的部分:含有序列号14的碱基序列的正向引物,与含有序列号15的碱基序列的反向引物。
[0074]
特定的方式中,“与序列号1的40位相当的位置的碱基为c的等位基因”,包括序列号16、17、18或19的碱基序列。
[0075]
特定的方式中,“与序列号2的21位相当的位置的碱基为t的等位基因”,包括序列号20、21、22或23的碱基序列。
[0076]
特定的方式中,“与序列号3的28位相当的位置的碱基为t的等位基因”,包括序列号24、25、26或27的碱基序列。
[0077]
特定的方式中,“与序列号4的59位相当的位置的碱基为c的等位基因”,包括序列号28、29、30或31的碱基序列。
[0078]
特定的方式中,“与序列号5的64位相当的位置的碱基为t的等位基因”,包括序列号32、33、34或35的碱基序列。
[0079]
有时将选自(a)与序列号1的40位相当的位置上由t向c的变异、(b)与序列号2的21位相当的位置上由a向t的变异、(c)与序列号3的28位相当的位置上由c向t的变异、(d)与序列号4的59位相当的位置上由a向c的变异、(e)与序列号5的64位相当的位置上由c向t的变异中的变异总称为“本发明的多态”或“本发明的变异”。此外,有时将上述(a)~(e)的各变异称作“本发明的多态(a)”、“本发明的多态(b)”,或“本发明的变异(a)”、“本发明的变异(b)”等。
[0080]
上述遗传性状可通过以下方法进行检测:pcr法、taqman pcr法、测序法、微阵列法、invader法、tilling法、rad(random amplified polymorphic dna)法、限制酶片段长度多态性(rflp)法、pcr-sscp法、aflp(amplified fragment length polymorphism)法、sslp(simple sequence length polymorphism)法、caps(cleaved amplified polymorphic sequence)法、dcaps(derived cleaved amplified polymorphic sequence)法、等位基因特异性寡核苷酸(aso)法、arms法、变性梯度凝胶电泳(dgge)法、ccm(chemical cleavage of mismatch)法、dol法、maldi-tof/ms法、tdi法、锁式探针法、分子信标法、dash(dynamic allele specific hybridization)法、ucan法、eca法、pinpoint法、probe(primer oligo base extension)法、vset(very short extension)法、survivor assay、sniper assay、luminex assay、good法、lcx法、snapshot法、mass array法、pyrosequences法、snp-it法、熔解曲线分析法等,但检测方法并不限定于这些。
[0081]
特定的方式中,本发明的遗传性状可通过以下引物集及限制酶的组合来检测。
[0082]
候选植物体具有变异(a)时,例如,对候选植物体的基因组dna,使用具有序列号36所示的碱基序列的正向引物及具有序列号37所示的碱基序列的反向引物进行pcr扩增,通过限制酶rsai对所得pcr产物(约203bp长,例如,序列号38)实施处理时,仅获得约203bp长的条带(例如,序列号38)。另一方面,候选植物体不具有变异(a)(与序列号1的40位相当的位置的碱基为t)时,与上述同样地实施pcr扩增,通过限制酶rsai对所得pcr产物(约203bp长,例如,序列号39)实施处理时,可获得约40bp长的条带(例如,序列号40)与约163bp长的条带(例如,序列号41)。通过上述方法检测变异(a)的例子示于图7。泳道1、泳道2及泳道3分别负荷用限制酶rsai对相对于具有变异(a)的等位基因呈同型接合性的甜菊个体、相对于具有变异(a)的等位基因呈异型接合性的甜菊个体及相对于不具有变异(a)的等位基因呈同型接合性的甜菊个体的dna处理而得的样本。泳道1中确认未经酶分解的约203bp长的条带。泳道2中确认经酶分解而得的约40bp长的条带和约163bp长的条带,及未经酶分解的约203bp长的条带。从而,通过上述dcaps法,确认来自非分解物的约203bp长的条带时,可确定具有本发明的遗传性状(a)。未确认来自分解物的约40bp长的条带及/或约163bp长的条带,
而确认来自非分解物的约203bp长的条带时,可确定具有本发明的遗传性状(a’)。确认来自分解物的约40bp长的条带及/或约163bp长的条带,和来自非分解物的约203bp长的条带时,可确定具有本发明的遗传性状(a”)。
[0083]
候选植物体具有变异(b)时,例如,对候选植物体的基因组dna,使用具有序列号42所示的碱基序列的正向引物及具有序列号43所示的碱基序列的反向引物进行pcr扩增,通过限制酶acli对所得pcr产物(约364bp长,例如,序列号44)实施处理时,获得约18bp长的条带(例如,序列号46)和约346bp长的条带(例如,序列号47)。另一方面,候选植物体不具有变异(b)时,与上述同样地实施pcr扩增,通过限制酶acli对所得pcr产物(约364bp长,例如,序列号45)实施处理时,仅可获得约364bp长的条带(例如,序列号45)。从而,通过上述dcaps法,确认来自分解物的约18bp长的条带及/或约346bp长的条带时,可确定具有本发明的遗传性状(b)。确认来自分解物的约18bp长的条带及/或约346bp长的条带,但未确认来自非分解物的约364bp长的条带时,可确定具有本发明的遗传性状(b’)。确认来自分解物的约18bp长的条带及/或约346bp长的条带和来自非分解物的约364bp长的条带时,可确定具有本发明的遗传性状(b”)。
[0084]
候选植物体具有变异(c)时,例如,对候选植物体的基因组dna,使用具有序列号48所示的碱基序列的正向引物及具有序列号49所示的碱基序列的反向引物进行pcr扩增,通过限制酶alui对所得pcr产物(约353bp长,例如,序列号50)实施处理时,获得约19bp长的条带(例如,序列号52)和约334bp长的条带(例如,序列号53)。另一方面,候选植物体不具有变异(c)时,与上述同样地实施pcr扩增,通过限制酶alui对所得pcr产物(约353bp长,例如,序列号51)实施处理时,仅可获得约353bp长的条带(例如,序列号51)。从而,通过上述dcaps法,确认来自分解物的约19bp长的条带及/或约334bp长的条带时,可确定具有本发明的遗传性状(c)。确认来自分解物的约19bp长的条带及/或约334bp长的条带,但并未确认来自非分解物的约353bp长的条带时,可确认具有本发明的遗传性状(c’)。确认来自分解物的约19bp长的条带及/或约334bp长的条带和来自非分解物的约353bp长的条带时,可确定具有本发明的遗传性状(c”)。
[0085]
候选植物体具有变异(d)时,例如,对候选植物体的基因组dna,使用具有序列号54所示的碱基序列的正向引物及具有序列号55所示的碱基序列的反向引物进行pcr扩增,通过限制酶alui对所得pcr产物(约349bp长,例如,序列号56)实施处理时,获得约21bp长的条带(例如,序列号58)和约328bp长的条带(例如,序列号59)。另一方面,候选植物体不具有变异(d)时,与上述同样地实施pcr扩增,通过限制酶alui对所得pcr产物(约349bp长,例如,序列号57)实施处理时,仅可获得约349bp长的条带(例如,序列号57)。从而,通过上述dcaps法,确认来自分解物的约21bp长的条带及/或约328bp长的条带时可确定具有本发明的遗传性状(d)。确认来自分解物的约21bp长的条带及/或约328bp长的条带,但未确认来自非分解物的约349bp长的条带时,可确定具有本发明的遗传性状(d’)。确认来自分解物的约21bp长的条带及/或约328bp长的条带和来自非分解物的约349bp长的条带时,可确定具有本发明的遗传性状(d”)。
[0086]
候选植物体具有变异(e)时,例如,对候选植物体的基因组dna,使用具有序列号60所示的碱基序列的正向引物及具有序列号61所示的碱基序列的反向引物进行pcr扩增,通过限制酶alui对所得pcr产物(约349bp长,例如,序列号62)实施处理时,获得约21bp长的条
带(例如,序列号64)和约328bp长的条带(例如,序列号65)。另一方面,候选植物体不具有变异(e)时,与上述同样地实施pcr扩增,通过限制酶alui对所得pcr产物(约349bp长,例如,序列号63)实施处理时,仅可获得约349bp长的条带(例如,序列号63)。从而,通过上述dcaps法,确认来自分解物的约21bp长的条带及/或约328bp长的条带时,可确定具有本发明的遗传性状(e)。确认来自分解物的约21bp长的条带及/或约328bp长的条带,并未确认来自非分解物的约349bp长的条带时,可确定具有本发明的遗传性状(e’)。确认来自分解物的约21bp长的条带及/或约328bp长的条带和来自非分解物的约349bp长的条带时,可确定具有本发明的遗传性状(e”)。
[0087]
关于上述bp长,所谓“约”是指
±
5bp。限制酶处理可遵循使用的各限制酶的销售商推荐的条件实施。
[0088]
本发明的变异部位(a)~(e)在基因组上的相互位置接近173bp以内,为连锁不平衡的状态。从而,本发明的植物体只要具有遗传性状(a)~(e)的任一种,则有也具有遗传性状(a)~(e)的其他遗传性状的倾向。本发明的植物体只要具有遗传性状(a’)~(e’)的任一种,则有也具有遗传性状(a’)~(e’)的其他遗传性状的倾向。
[0089]
具有本发明的遗传性状的甜菊植物体,具有干燥叶的每单位质量含有0.07%以上的rebe的化学特征。
[0090]
已知rebe的甜味倍率高,例如与甜菊苷相比具有1.5倍以上的甜味倍率,味质良好。此外,称其溶解性高且稳定。含有rebe的甜味剂期待作为口感和味质良好的甜味剂。因此,期待富含rebe的甜菊植物体。
[0091]
本发明的遗传性状(a)~(e)的存在与本发明的化学特征的存在的关联性高。因此,具有本发明的遗传性状(a)~(e)中的至少1种的甜菊植物体,具有本发明的化学特征的可能性高,以本发明的遗传性状(a)~(e)中的至少1种为指标,可筛选具有本发明的化学特征的甜菊植物体。
[0092]
本发明的甜菊植物体中,所谓干燥叶的每单位质量的rebe的含量为0.07%以上,例如是指规定质量的干燥叶(例如,50mg)中含有0.07质量%以上的比例的rebe(例如,0.035mg以上)。该方式中的干燥叶的每单位质量的rebe的比例并无限定,例如,可为0.07%以上、0.10%以上、0.15%以上、0.49%以上、0.57%以上、0.62%以上、1.07%以上、1.57%以上、1.74%以上、2.07%以上、2.10%以上、2.57%以上、3.07%以上、3.57%以上、4.07%以上、4.57%以上、5.07%以上、5.57%以上、6.07%以上等。干燥叶的每单位质量的rebe的比例的上限并无特别限定,例如,可为20%、15%、10%、7%等。
[0093]
此处,干燥叶是指通过使本发明的甜菊植物体的新鲜叶干燥而将含水量降低至3~4重量%的叶。
[0094]
在一种方式中,本发明的植物体,相对于总甜菊醇糖苷(total steviol glycoside:tsg)的rebe的质量比为0.5%以上。例如,是指作为相对于从叶中获得的甜菊醇糖苷的总质量的比率,以rebe/tsg%对叶(例如,干燥叶或新鲜叶)中所含的rebe的合计质量进行表示时,rebe/tsg的值为0.5%以上。该方式中的rebe/tsg的值并无限定,例如,可为0.5%以上、1.5%以上、2.0%以上、2.4%以上、2.5%以上、3.0%以上、3.5%以上、4.0%以上、4.5%以上、5.0%以上、5.5%以上、6.0%以上、6.5%以上、7.0%以上、7.5%以上、8.0%以上、8.5%以上、9.0%以上、9.5%以上、10.0%以上、15.0%以上、20.0%以上、
22.4%以上、25.0%以上、25.5%以上、30.0%以上、33.5%以上、35.0%以上、40.0%以上、45.0%以上。相对于tsg的rebe的质量比的上限并无特别限定,例如,可为85%、75%、65%、55%等。
[0095]
tsg为可测定的甜菊醇糖苷的总称,不包含未知的甜菊醇糖苷或以低于检测极限的量存在的甜菊醇糖苷。tsg优选为选自reba、rebb、rebc、rebd、rebe、rebf、rebg、rebi、rebj、rebk、rebm、rebn、rebo、rebq、rebr、杜克苷a、甜叶悬钩子苷、甜菊单糖苷、甜菊双糖苷及甜菊苷中的2种以上的任意组合。例如,在特定的方式中,tsg由reba、rebb、rebc、rebd、rebe、rebf、rebg、rebm、rebn及甜菊苷构成。
[0096]
在一种方式中,本发明的植物体的rebe/甜菊苷的值为1以下。这是指,例如相对于叶(例如,干燥叶或新鲜叶)中所含的甜菊苷的质量,从叶中获得的rebe的质量的比例,rebe/甜菊苷为1以下。rebe/甜菊苷的值并无限定,例如可为1以下、0.95以下、0.90以下、0.85以下、0.65以下等。rebe/甜菊苷的下限并无特别限定,例如可为0.07以上、0.11以上、0.12以上、0.13以上、0.14以上、0.15以上、0.17以上、0.18以上、0.20以上、0.22以上、0.25以上、0.27以上、0.28以上、0.30以上、0.32以上、0.35以上、0.38以上、0.37以上、0.50以上等。
[0097]
rebe、甜菊苷等甜菊醇糖苷可通过使本发明的植物体的新鲜叶或干燥叶与适当的溶剂(水等水性溶剂或醇、醚及丙酮等有机溶剂)反应,以萃取液的状态进行萃取。萃取条件等可参考ohta et al.,j.appl.glycosci.,vol.57,no.3,199-209(2010)或wo2010/038911中所述的方法、后述实施例中所述的方法。
[0098]
进一步,相对于如此而得的萃取液,可通过使用乙酸乙酯以及其他有机溶剂:水的梯度、高效液相色谱法(high performance liquid chromatography:hplc)、气相色谱法、飞行时间型质量分析(time-of-flight mass spectrometry:tof-ms)、超高效液相色谱法(ultra(high)performance liquid chromatography:uplc)等公知的方法来提纯各种甜菊醇糖苷,例如rebe。
[0099]
rebe、甜菊苷等甜菊醇糖苷的含量可通过上述的ohta et al.或wo2010/038911中所述的方法、后述的实施例中所述的方法来测定。具体而言,可从本发明的甜菊植物体中采集新鲜叶作为样本,并通过实施lc-ms/ms等来测定。
[0100]
本发明的植物体可为通过转基因的方法而得的植物体或其后代(以下,有时称作“转基因植物体”),也可为通过非转基因的方法而得的植物体或其后代(以下,有时称作“非转基因植物体”)。作为“非转基因的方法”的示例,除了杂交或自体受精等以外,可列举不导入外来基因而诱导宿主细胞(或宿主植物体)的基因变异的方法。作为那样的方法可列举使植物细胞的诱变剂产生作用的方法。作为那样的诱变剂,可列举甲磺酸乙酯(ems)及叠氮化钠等。例如,ems可以0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%等浓度对植物细胞进行处理。处理时间为1~48小时、2~36小时、3~30小时、4~28小时、5~26小时、6~24小时。处理流程自身为公知的,可通过使经过吸水过程的吸水种子在以上述浓度含有诱变剂的处理液中浸渍上述处理时间来实施。
[0101]
或者,作为非转基因的方法的示例,也可为使x射线、γ射线、紫外线等放射线或光线照射植物细胞的方法。此时,将用适当的紫外线的照射量(紫外线灯强度、距离、时间)进行照射后的细胞以选择培养基等培养后,可选择具有目标性状的细胞、愈伤组织、植物体。
此时的照射强度为0.01~100gr、0.03~75gr、0.05~50gr、0.07~25gr、0.09~20gr、0.1~15gr、0.1~10gr、0.5~10gr、1~10gr,照射距离为1cm~200m、5cm~100m、7cm~75m、9cm~50m、10cm~30m、10cm~20m、10cm~10m,照射时间为1分钟~2年、2分钟~1年、3分钟~0.5年、4分钟~1个月、5分钟~2周、10分钟~1周。照射的强度、距离及时间根据放射线的种类或作为照射对象的状态(细胞、愈伤组织、植物体)而不同,只要为本领域技术人员则可进行适当调整。
[0102]
此外,细胞融合、花药培养(单倍体培养)、远系杂交(单倍体培养)等方法也是公知的。
[0103]
一般而言,植物细胞由于有时在培养期间伴随变异,因此为了维持更稳定的性状优选恢复为植物个体。
[0104]
以本发明的植物体为宿主,事后进行转基因(例如通过基因组编辑等)而得的植物体(例如,以本发明的植物体为宿主实施转基因,进一步附加了其他性状的植物体)也不从本发明的范围中排除。
[0105]
本发明的植物体不仅包含植物体整体,还可包含植物器官(例如叶、花瓣、茎、根、种子等)、植物组织(例如表皮、韧皮部、软组织、木质部、维管束、栅状组织、海绵状组织等)或各种形态的植物细胞(例如,悬浊培养细胞)、原生质体、叶的切片、愈伤组织等。此外,叶可为干燥叶。
[0106]
此外,本发明的植物体还可包含组织培养物或植物培养细胞。这是因为通过培养这样的组织培养物或植物培养细胞,可再生植物体。
[0107]
作为本发明的植物体的可再生的方式的示例,可列举胚、分生组织细胞、花粉、叶、根、根尖、花瓣、原生质体、叶的切片及愈伤组织等,但并不限定于此。
[0108]
2.本发明的植物体的制作方法
[0109]
本发明在其他实施方式中,提供一种甜菊植物体的制作方法(以下,有时称作“本发明的制作方法”),其特征在于,包含使本发明的甜菊植物体与第2甜菊植物体杂交的工序。通过该方法制作的甜菊植物体,可具有与本发明的植物体相同的表现型和遗传性状。
[0110]
通过本发明的制作方法而得的植物体中的rebe的量、相对于甜菊苷的rebe的量、相对于tsg量的rebe的量、各特征(化学特征及/或遗传性状)的组合等如本发明的植物体的项目中所述。
[0111]
在一种方式中,通过本发明的制作方法而得的植物体,具有本发明的植物体项目中所述的各特征(化学特征及/或遗传性状)的组合等。
[0112]
在本发明的制作方法中,所谓“使其杂交”是指通过使本发明的植物体(第一代(s1))和第2植物体(s1)交配获得其子植物体(根据本发明的制作方法制作的植物体(第二代(s2)))。作为杂交方法,优选回交。所谓“回交”是使在本发明的植物体和第2植物体之间诞生的子植物体(s2)进一步与本发明的植物体(即,具有本发明的遗传性状的植物体)(s1)杂交,制作具有本发明的遗传性状的植物体的方法。本发明的制作方法中使用的第2植物体(s1)与本发明的植物体具有相同的表现型和遗传性状时实质上为回交。
[0113]
杂交优选持续实施二代以上,遗传性状为异型接合性等时,有时通过一代也可获得具有期望的遗传性状的组合的植物体。
[0114]
或者,本发明的植物体也可通过自体受精进行制作。自体受精可通过使本发明的
植物体的雄蕊的花粉向本发明的植物体的雌蕊自花传粉来实施。
[0115]
根据本发明的制作方法制作的植物体的表现型及遗传性状与本发明的植物体相同,因此通过使根据本发明的制作方法制作的植物体进一步与第3甜菊植物体杂交,也可制作与本发明的植物体具有相同表现型的甜菊植物体。
[0116]
作为其他方式,本发明的植物体也可通过对上述组织培养物或植物培养细胞进行培养而再生植物体的方式制作。关于培养条件,与野生型甜菊植物的组织培养物或植物培养细胞的培养条件相同,是公知的(protocols for in vitro cultures and secondary metabolite analysis of aromatic and medicinal plants,method in molecular biology,vol.1391,pp113-123)。
[0117]
进一步作为其他方式,本发明的植物体可通过向甜菊植物体的基因组中导入本发明的变异来制作。变异的导入可通过转基因的方法来实施,也可通过非转基因的方法来实施。关于非转基因的手法,如本发明的植物体的项目中所述。
[0118]
3.本发明的植物体的筛选方法
[0119]
本发明的植物体及与本发明的植物体具有相同表现型及/或遗传性状的植物体,可通过从该植物体的组织中检测本发明的遗传性状来筛选。此处,所谓“筛选”是指,对本发明的植物体和其以外的植物体进行识别,并选择本发明的植物体。
[0120]
从而,本发明在其他侧面,提供一种甜菊植物体的筛选方法(以下,有时称“本发明的筛选方法”),其特征在于,包含从被检植物体的基因组中检测存在及/或不存在本发明的遗传性状(a)~(e)中的至少1种的工序。
[0121]
在一种方式中,作为检测对象的遗传性状为遗传性状(a)~(e)中的至少1种。在优选方式中,作为检测对象的遗传性状为遗传性状(a),更优选为遗传性状(a’)。在其他优选方式中,作为检测对象的遗传性状为遗传性状(a)与遗传性状(b)~(e)中的至少1种,更优选为遗传性状(a)与遗传性状(b)~(e)全部。在其他优选方式中,作为检测对象的遗传性状为遗传性状(a)与遗传性状(b)~(d)中的至少1种,更优选为遗传性状(a)与遗传性状(b)~(d)全部。在其他优选方式中,作为检测对象的遗传性状为遗传性状(a’)与遗传性状(b)~(e)中的至少1种,更优选为遗传性状(a’)与遗传性状(b)~(e)全部。在其他优选方式中,作为检测对象的遗传性状为遗传性状(a’)与遗传性状(b)~(d)中的至少1种,更优选为遗传性状(a’)与遗传性状(b)~(d)全部。在其他优选方式中,作为检测对象的遗传性状为遗传性状(a’)与遗传性状(b’)~(e’)中的至少1种,更优选为遗传性状(a’)与遗传性状(b’)~(e’)全部。在其他优选方式中,作为检测对象的遗传性状为遗传性状(a’)与遗传性状(b’)~(d’)中的至少1种,更优选为遗传性状(a’)与遗传性状(b’)~(d’)全部。另外,如上所述,本发明的遗传性状(a)~(e)涉及的变异呈连锁不平衡的状态,因此通过检测这些遗传性状的任一种,可推断是否存在其他遗传性状。
[0122]
本发明的筛选方法也可进一步包含将检出存在上述中的至少1种的遗传性状的植物体从被检植物体中选出的工序。
[0123]
本发明的遗传性状的存在,例如可通过检测出以下结果来确定:
[0124]
(i)存在与序列号1的40位相当的位置的碱基为c的等位基因(例如,包含序列号16、17、18或19的碱基序列的等位基因,以下有时称作“等位基因a”),
[0125]
(ii)存在与序列号2的21位相当的位置的碱基为t的等位基因(例如,包含序列号
20、21、22或23的碱基序列的等位基因,以下有时称作“等位基因b”)
[0126]
(iii)存在与序列号3的28位相当的位置的碱基为t的等位基因(例如,包含序列号24、25、26或27的碱基序列的等位基因,以下有时称作“等位基因c”)
[0127]
(iv)存在与序列号4的59位相当的位置的碱基为c的等位基因(例如,包含序列号28、29、30或31的碱基序列的等位基因,以下有时称作“等位基因d”),及/或
[0128]
(v)存在与序列号5的64位相当的位置的碱基为t的等位基因(例如,包含序列号32、33、34或35的碱基序列的等位基因,以下有时称作“等位基因e”)。
[0129]
不存在本发明的遗传性状,例如可通过检测出以下结果来确定:
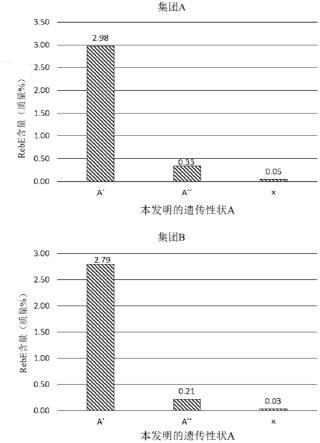
[0130]
(i)仅存在与序列号1的40位相当的位置的碱基为t的等位基因(例如,包含序列号1、66、67或68的碱基序列的等位基因,以下有时称作“等位基因a”),
[0131]
(ii)仅存在与序列号2的21位相当的位置的碱基为a的等位基因(例如,包含序列号2、69、70或71的碱基序列的等位基因,以下有时称作“等位基因b”),
[0132]
(iii)仅存在与序列号3的28位相当的位置的碱基为c的等位基因(例如,包含序列号3、72、73或74的碱基序列的等位基因,以下有时称作“等位基因c”),
[0133]
(iv)仅存在与序列号4的59位相当的位置的碱基为a的等位基因(例如,包含序列号4、75、76或77的碱基序列的等位基因,以下有时称作“等位基因d”),及/或
[0134]
(v)仅存在与序列号5的64位相当的位置的碱基为c的等位基因(例如,包含序列号5、78、79或80的碱基序列的等位基因,以下有时称作“等位基因e”)。
[0135]
本发明的遗传性状(a’)的存在,例如可通过仅存在等位基因a来确定。遗传性状(a”)的存在,例如可通过存在等位基因a和等位基因a两者来确定。
[0136]
本发明的遗传性状(b’)的存在,例如可通过仅存在等位基因b来确定。遗传性状(b”)的存在,例如可通过存在等位基因b和等位基因b两者来确定。
[0137]
本发明的遗传性状(c’)的存在,例如可通过仅存在等位基因c来确定。遗传性状(c”)的存在,例如可通过存在等位基因c和等位基因c两者来确定。
[0138]
本发明的遗传性状(d’)的存在,例如可通过仅存在等位基因d来确定。遗传性状(d”)的存在,例如可通过存在等位基因d和等位基因d两者来确定。
[0139]
本发明的遗传性状(e’)的存在,例如可通过仅存在等位基因e来确定。遗传性状(e”)的存在,例如可通过存在等位基因e和等位基因e两者来确定。
[0140]
不存在本发明的遗传性状(a’),例如可通过存在等位基因a来确定。不存在遗传性状(a”),例如可通过仅存在等位基因a或等位基因a的任一种来确定。
[0141]
不存在本发明的遗传性状(b’),例如可通过存在等位基因b来确定。不存在遗传性状(b”),例如可通过仅存在等位基因b或等位基因b的任一种来确定。
[0142]
不存在本发明的遗传性状(c’),例如可通过存在等位基因c来确定。不存在遗传性状(c”),例如可通过仅存在等位基因c或等位基因c的任一种来确定。
[0143]
不存在本发明的遗传性状(d’),例如可通过存在等位基因d来确定。不存在遗传性状(d”),例如可通过仅存在等位基因d或等位基因d的任一种来确定。
[0144]
不存在本发明的遗传性状(e’),例如可通过存在等位基因e来确定。不存在遗传性状(e”),例如可通过仅存在等位基因e或等位基因e的任一种来确定。
[0145]
作为本发明的遗传性状的检测方法的具体例,可列举pcr法、taqman pcr法、测序
法、微阵列法、invader法、tilling法、rad法、rflp法、pcr-sscp法、aflp法、sslp法、caps法、dcaps法、aso法、arms法、dgge法、ccm法、dol法、maldi-tof/ms法、tdi法、锁式探针法、分子信标法、dash法、ucan法、eca法、pinpoint法、probe法、vset法、survivor assay、sniper assay、luminex assay、good法、lcx法、snapshot法、mass array法、pyrosequences法、snp-it法、熔解曲线分析等,但并不限定于这些。
[0146]
在pcr法的情况下,优选制作3’末端部分具有与本发明的变异部位互补的序列的引物。若使用这样设计的引物,当作为模板的样本具有本发明的变异时,由于引物完全与模板杂交,发生聚合酶延伸反应,模板不具有所述变异时,由于引物的3’末端的核苷酸与模板产生不匹配,不发生延伸反应。从而,使用这样的引物实施pcr扩增,通过琼脂糖凝胶电泳等对扩增产物进行分析,若能确认一定大小的扩增产物,则作为样本的模板具有变异,扩增产物不存在时,可判断模板不具有变异。
[0147]
或者,使本发明的变异部位不和引物序列重复,且设计可使本发明的基因变异pcr扩增的引物序列,通过对扩增的核苷酸片段的碱基序列测序,可检测本发明的遗传性状。
[0148]
关于pcr及琼脂糖凝胶电泳,参考以下:sambrook,fritsch and maniatis,“molecular cloning:a laboratory manual”2nd edition(1989),cold spring harbor laboratory press。
[0149]
所谓taqman pcr法是利用基于经荧光标记的等位基因特异性寡核苷酸和taq dna聚合酶的pcr反应的方法(livak,k.j.genet.anal.14,143(1999);morris t.et al.,j.clin.microbiol.34,2933(1996))。
[0150]
所谓测序法是通过pcr使包含变异的区域扩增,使用dye terminator等对dna序列进行测序,分析变异的有无的方法(sambrook,fritsch and maniatis,“molecular cloning:a laboratory manual”2nd edition(1989),cold spring harbor laboratory press)。
[0151]
dna微阵列为核苷酸探针的一端在支持体上固定为阵列的物质,包含dna芯片、基因芯片、微芯片、珠阵列等。通过使用包含与本发明的变异部位互补的序列的探针可详尽地检测本发明的多态的有无。作为dna芯片等dna微阵列测定可列举基因芯片测定(affymetrix公司;参考美国专利第6,045,996号,同第5,925,525号及同第5,858,659号)。基因芯片技术为利用贴附于芯片上的寡核苷酸探针的小型化高密度微阵列的技术。
[0152]
所谓invader法为组合:对于snp等变异的各自的等位基因呈特异性的2种reporter探针及1种invader探针向模板dna的杂交,和基于具有识别dna的结构并切断的特殊的核酸内切酶活性的cleavase酶的dna的切断的方法(livak,k.j.biomol.eng.14,143-149(1999);morris t.et al.,j.clin.microbiol.34,2933(1996);lyamichev,v.et al.,science,260,778-783(1993)等)。
[0153]
所谓tilling(targeting induced local lesions in genomes)法为通过pcr扩增和celi核酸酶处理对导入变异的变异体集团的基因组中的变异不匹配进行筛选的方法。
[0154]
在一种方式中,本发明的遗传性状(a)例如,可通过使用以下引物集与限制酶的dcaps法进行检测。
[0155]
·
引物集:
[0156]
一种引物集,其含有:包含从序列号36的3’末端起连续15~39个碱基长的序列的
正向引物,和包含与从序列号1或16的41位起,位于3’侧的任意的连续15个碱基以上的序列互补的序列(例如,序列号37)的反向引物,或一种引物集,其含有:包含从序列号81或82的3’末端起连续15~20个碱基长的序列的正向引物,和包含与从序列号83或84的22位起,位于3’侧的任意的连续15个碱基以上的序列互补的序列(例如,序列号85)的反向引物。
[0157]
·
限制酶:
[0158]
与基于序列号36的引物集对应的限制酶包含rsai,与基于序列号81的引物集对应的限制酶包含tsp45i,与基于序列号82的引物集对应的限制酶包含acii。
[0159]
在一种方式中,本发明的遗传性状(b)例如,可通过使用以下引物集与限制酶的dcaps法进行检测。
[0160]
·
引物集:
[0161]
一种引物集,其含有:包含从序列号42、86或87的3’末端起连续15~20个碱基长的序列的正向引物,和包含与从序列号2或20的22位起,位于3’侧的任意的连续15个碱基以上的序列互补的序列(例如,序列号43)的反向引物。
[0162]
·
限制酶:
[0163]
与基于序列号42的引物集对应的限制酶包含acli,与基于序列号86的引物集对应的限制酶包含alui,与基于序列号87的引物集对应的限制酶包含paci。
[0164]
在一种方式中,本发明的遗传性状(c)例如,可通过使用以下引物集与限制酶的dcaps法进行检测。
[0165]
·
引物集:
[0166]
一种引物集,其含有:包含从序列号48、88或89的3’末端起连续15~20个碱基长的序列的正向引物,和包含与从序列号50或51的22位起,位于3’侧的任意的连续15个碱基以上的序列互补的序列(例如,序列号49)的反向引物。
[0167]
·
限制酶:
[0168]
与基于序列号48的引物集对应的限制酶包含alui,与基于序列号88的引物集对应的限制酶包含bgli,与基于序列号89的引物集对应的限制酶包含scai。
[0169]
在一种方式中,本发明的遗传性状(d)例如,可通过使用以下引物集与限制酶的dcaps法进行检测。
[0170]
·
引物集:
[0171]
一种引物集,其含有:包含从序列号54、90或91的3’末端起连续15~21个碱基长的序列的正向引物,和包含与从序列号56或57的23位起,位于3’侧的任意的连续15个碱基以上的序列互补的序列(例如,序列号55)的反向引物。
[0172]
.限制酶:
[0173]
与基于序列号54的引物集对应的限制酶包含alui,与基于序列号90的引物集对应的限制酶包含mboi,与基于序列号91的引物集对应的限制酶包含bglii。
[0174]
在一种方式中,本发明的遗传性状(e)例如,可通过使用以下引物集与限制酶的dcaps法进行检测。
[0175]
·
引物集:
[0176]
一种引物集,其含有:包含从序列号60、92或93的3’末端起连续15~22个碱基长的序列的正向引物,和包含与从序列号62或63的24起,位于3’侧的任意的连续15个碱基以上
的序列互补的序列(例如,序列号61)的反向引物。
[0177]
·
限制酶:
[0178]
与基于序列号60的引物集对应的限制酶包含alui,与基于序列号92的引物集对应的限制酶包含mboi,与基于序列号93的引物集对应的限制酶包含bglii。
[0179]
引物的序列可在满足上述条件的范围内进行最优化。关于引物设计的最优化,参考例如sambrook and russell,“molecular cloning:a laboratory manual”3rd edition(2001),cold spring harbor laboratory press等。上述各引物可为15~50个碱基长、18~48个碱基长、20~45个碱基长、30~40个碱基长等。与各引物集对应的限制酶,也包含与上述酶识别相同序列,在相同位置切断的其他酶,或上述酶的同裂限制酶。此外,也可基于本发明的遗传性状,设计上述以外的引物集,并选择与其对应的限制酶。
[0180]
在特定的方式中,本发明的遗传性状(a)~(e)例如,可通过使用具有以下序列的引物集与限制酶的dcaps法进行检测。
[0181]
[表1]
[0182]
表1用干检删遗传性状(a)的引物集和限制酶的组台的示例
[0183]
正向引物反向引物限制酶序列号36序列号37rsai序列号81序列号85tsp45i序列号82序列号85acii
[0184]
[表2]
[0185]
表2用于检测遗传性状(b)的引物集和限制酶的组合的示例
[0186]
正向引物反向引物限制酶序列号42序列号43acli序列号86序列号43alui序列号87序列号43paci
[0187]
[表3]
[0188]
表3用于检测遗传性状(c)的引物集和限制酶的组合的示例
[0189]
正向引物反向引物限制酶序列号48序列号49alui序列号88序列号49bgli序列号89序列号49scai
[0190]
[表4]
[0191]
表4用于检测遗传性状(d)的引物集和限制酶的组合的示例
[0192]
正向引物反向引物限制酶序列号54序列号55alui序列号90序列号55mboi序列号91序列号55bglii
[0193]
[表5]
[0194]
表5用于检测遗传性状(e)的引物集和限制酶的组合的示例
[0195]
正向引物反向引物限制酶序列号60序列号61alui序列号92序列号61mboi序列号93序列号61bglii
[0196]
另外,上述引物集与限制酶的组合仅为一个示例,只要为本领域技术人员,可寻找可检测本发明的遗传性状的其他引物集与限制酶的组合。
[0197]
本发明的筛选方法可进一步包含测定被检甜菊植物体的组织(例如叶)的rebe的含量的工序。含量的测定,如本发明的植物体的项目所述。此外,在该方式中,从检测出本发明的遗传性状的被检甜菊植物体中,选择rebe的含量高的个体,使其与其他甜菊植物体交配,对于所得子植物体,也可适用本发明的筛选方法。从而,本发明的筛选方法包含从被检甜菊植物体的基因组中,检测本发明的遗传性状的工序,进一步可包含以下1个以上的工序。
[0198]
(i)测定检测出本发明的遗传性状的被检甜菊植物组织(例如叶)的rebe的含量的工序,
[0199]
(ii)在检测出本发明的遗传性状的被检甜菊植物体中,选择rebe的含量高的个体的工序,
[0200]
(iii)使所选rebe的含量高的个体与其他甜菊植物体交配的工序,
[0201]
(iv)从通过交配而得的子植物体的基因组中,检测本发明的遗传性状的工序,
[0202]
(v)测定检测出本发明的遗传性状的子植物组织的rebe的含量的工序,
[0203]
(vi)在检测出本发明的遗传性状的子植物体中,选择rebe的含量高的个体的工序。
[0204]
此外,本发明的筛选方法可包含以下1个以上的工序。
[0205]
(i’)测定检测出本发明的遗传性状的被检甜菊植物组织(例如叶)的甜菊苷或tsg的含量的工序,
[0206]
(ii’)在检测出本发明的遗传性状的被检甜菊植物体中,选择rebe/甜菊苷或相对于tsg的rebe的质量比高的个体的工序,
[0207]
(iii’)使所选rebe/甜菊苷或相对于tsg的rebe的质量比高的个体与其他甜菊植物体交配的工序,
[0208]
(iv’)从通过交配而得的子植物体的基因组中,检测本发明的遗传性状的工序,
[0209]
(v’)测定检测出本发明的遗传性状的子植物组织的甜菊苷或tsg的含量的工序,
[0210]
(vi’)在检测出本发明的遗传性状的子植物体中,选择rebe/甜菊苷或相对于tsg的rebe的质量比高的个体的工序。
[0211]
所选择的rebe的含量、rebe/甜菊苷或相对于tsg的rebe的质量比高的个体,例如,可为检测出本发明的遗传性状的被检甜菊植物体中,rebe的含量、rebe/甜菊苷或相对于tsg的rebe的质量比高达排名前50%为止、排名前40%为止、排名前30%为止、排名前20%为止、排名前10%为止、排名前5%为止、排名前4%为止、排名前3%为止、排名前2%为止或排名前1%为止的个体等。此外,进行交配的其他甜菊植物体,可含也可不含本发明的遗传性状。上述方式中,工序(iii)~(vi)或工序(iii’)~(vi’)可重复数次。如此,可筛选rebe的含量、rebe/甜菊苷或相对于tsg的rebe的质量比更高的甜菊植物体。
[0212]
在本发明的筛选方法中,被检甜菊植物体可为天然植物体,也可为非转基因植物体。关于非转基因植物体,如本发明的植物体的项目中所述。
[0213]
在本发明的筛选方法中,被检甜菊植物体也可包含经变异诱发处理的甜菊植物及其后代植物。关于变异的诱发,如本发明的植物体的项目中所述,包含基于诱变剂的处理、基于放射线或光线的照射的处理等。
[0214]
通过本发明的筛选方法而得的植物体中的rebe的量、甜菊苷的量、相对于tsg量的rebe的量等,如本发明的植物体的项目中所述。
[0215]
此外,本发明提供上述所述的引物集及其组合,例如,上述表1~5所述的引物集及这些引物集彼此的组合。本发明进一步提供,可通过pcr对具有选自序列号1~5、16、20、24、28及32中的碱基序列的区域进行扩增的引物集,例如,包含序列号6的碱基序列的正向引物与包含序列号7的碱基序列的反向引物的引物集、包含序列号8的碱基序列的正向引物与包含序列号9的碱基序列的反向引物的引物集、包含序列号10的碱基序列的正向引物与包含序列号11的碱基序列的反向引物的引物集、包含序列号12的碱基序列的正向引物与包含序列号13的碱基序列的反向引物的引物集、包含序列号14的碱基序列的正向引物与包含序列号15的碱基序列的反向引物的引物集等。
[0216]
进一步,本发明提供可检测存在及/或不存在本发明的遗传性状的探针(以下,有时称“本发明的探针”)。本发明的探针可具有适合各种检测存在及/或不存在本发明的遗传性状的方法(例如,taqman pcr法等realtime pcr法)的结构。例如,本发明的探针可包含与包含本发明的变异部位的基因组的部分具有互补性的碱基序列。作为所述探针的非限定例,可列举包含与选自序列号17~19、21~23、25~27、29~31、33~35、66~80中的碱基序列具有互补性的序列的探针。这些序列中,序列号17~19、21~23、25~27、29~31、33~35对于包含本发明的变异的等位基因呈特异性,序列号66~80对于不含本发明的变异的等位基因呈特异性。此外,序列号17~19对于等位基因a呈特异性,序列号21~23对于等位基因b呈特异性,序列号25~27对于等位基因c呈特异性,序列号29~31对于等位基因d呈特异性,序列号33~35对于等位基因e呈特异性。另一方面,序列号66~68对于等位基因a呈特异性,序列号69~71对于等位基因b呈特异性,序列号72~74对于等位基因c呈特异性,序列号75~77对于等位基因d呈特异性,序列号78~80对于等位基因e呈特异性。本发明的遗传性状(a)~(e)的存在可通过仅检测出包含本发明的变异的等位基因,或检测出包含本发明的变异的等位基因和不包含本发明的变异的等位基因两者来检测,本发明的遗传性状(a)~(e)的不存在可通过仅检测出不包含本发明的变异的等位基因来检测。本发明的遗传性状(a’)~(e’)的存在可通过仅检测出包含本发明的变异的等位基因来检测,本发明的遗传性状(a’)~(e’)的不存在可通过检测出不包含本发明的变异的等位基因来检测。本发明的探针优选具有标记。作为涉及的标记的非限定例,可列举荧光标记、发光标记、放射性标记、色素、酶、淬灭剂(quencher)、与可以检测的标记结合的部分等。在特定方式中,本发明的探针具有包含与选自序列号17~19、21~23、25~27、29~31、33~35、66~80中的碱基序列互补的碱基序列的多核苷酸和标记。
[0217]
本发明进一步提供包含上述引物集及与其对应的限制酶的试剂盒。在特定的方式中,本发明的试剂盒包含上述表1~5所述的引物集及与其对应的限制酶。
[0218]
此外,本发明提供一种试剂盒,其包含可通过pcr对具有选自上述序列号1~5、16、
20、24、28及32中的碱基序列的区域进行扩增的引物集及与其对应的上述本发明的探针。
[0219]
这些引物集、探针及试剂盒可用于检测本发明的遗传性状,用于本发明的筛选方法等。此外,在这些引物集及试剂盒中可包含:包含与本发明的遗传性状的检测或本发明的筛选方法相关的说明的指示,例如,使用说明书或包含与使用方法相关的信息的网站信息(例如,url、二维码),记录有与使用方法相关的信息的媒体(例如,软盘、cd、dvd、蓝光光盘、存储卡、usb存储器)等。
[0220]
在一部分方式中,本发明提供一种本发明的甜菊植物体的筛选试剂盒,其特征在于,包含用于检测存在及/或不存在遗传性状(a)~(e)中的至少1种的试剂。试剂可包含caps法、dcaps法或taqman pcr法中使用的引物及/或探针。在特定的方式中,用于检测存在及/或不存在遗传性状(a)~(e)中的至少1种的试剂包含:用于通过dcaps法检测上述遗传性状(a)~(e)中的至少1种的引物集和限制酶的组合,例如表1~5所述的引物集与限制酶的组合,或者可用于taqman pcr法等的对本发明的变异部位(例如,包含选自序列号16~35中的序列的部位)进行扩增的引物集和具有与遗传性状(a)~(e)中的至少1种涉及的部位(例如,包含选自序列号17~19、21~23、25~27、29~31、33~35中的序列的部位)互补的碱基序列的探针的组合。
[0221]
4.来自植物体的含有rebe的萃取物的制造方法、该萃取物及使用该萃取物的制品
[0222]
在本发明的进一步的方式中,提供一种含有rebe的萃取物的制造方法(以下,有时称“本发明的含有rebe的萃取物的制造方法”),其特征在于,包含从本发明的植物体、通过本发明的筛选方法选择的甜菊植物体或通过本发明的制作方法制造的甜菊植物体或该植物体的种子、叶(例如,干燥叶或新鲜叶)、组织、组织培养物或细胞中获得含有rebe的萃取物的工序。
[0223]
进一步,提供一种含有从本发明的植物体、通过本发明的筛选方法选择的甜菊植物体或通过本发明的制作方法制造的甜菊植物体或该植物体的种子、叶(例如,干燥叶或新鲜叶)、组织、组织培养物或细胞中获得的含有rebe的萃取物(以下,有时称作“本发明的含有rebe的萃取物”)。本发明的含有rebe的萃取物优选为通过本发明的含有rebe的萃取物的制造方法制造的萃取物。此外,进一步提供一种rebe的制造方法(以下,有时称作“本发明的rebe的制造方法”),其特征在于,包含从本发明的含有rebe的萃取物中提纯rebe的工序。本发明的rebe的制造方法也可进一步包含从本发明的植物体、通过本发明的筛选方法选择的甜菊植物体或通过本发明的制作方法制造的甜菊植物体中获得含有rebe的萃取物的工序。
[0224]
含有rebe的萃取物例如可通过使本发明的植物体的新鲜叶或干燥叶与适当的溶剂(水等水性溶剂或醇、醚及丙酮等有机溶剂)反应来获得。萃取条件等可参考上述ohta et al.或wo2010/038911中所述的方法或后述的实施例中所述的方法。
[0225]
此外,可通过用乙酸乙酯及其他有机溶剂:水的梯度、高效液相色谱法(high performance liquid chromatography:hplc)、气相色谱法、飞行时间型质量分析(time-of-flight mass spectrometry:tof-ms)、超高效液相色谱法(ultra(high)performance liquid chromatography:uplc)等公知的方法对含有rebe的萃取物进行提纯。
[0226]
本发明的含有rebe的萃取物与从不具有本发明的遗传性状的甜菊种中获得的含有rebe的萃取物相比,以更高含量含有rebe。
[0227]
本发明的含有rebe的萃取物,与来自不具有本发明的遗传性状的甜菊植物体的含
有rebe的萃取物相比,可以高100%、105%以上、109%以上、150%以上、200%以上、210%以上、290%以上、400%以上、600%以上、800%以上、1000%以上、1200%以上、1300%以上、1400%以上、1500%以上、1600%以上、1700%以上、1800%以上、1900%以上、2000%以上、2100%以上、2200%以上、2300%以上、2400%以上、2500%以上、2600%以上、2700%以上、2800%以上、2900%以上、3000%以上、3100%以上、3200%以上、3300%以上、3400%以上、3500%以上、3600%以上、3700%以上、3800%以上、3900%以上、4000%以上、4100%以上、4200%以上、4300%以上、4400%以上、4500%以上、4600%以上、4700%以上、4800%以上、4900%以上、5000%以上的高含量含有rebe。上限并无特别限制,例如可为21000%以下、18000%以下等。此处,本发明的含有rebe的萃取物与从不具有本发明的遗传性状的甜菊植物体中获得的含有rebe的萃取物可以相同方法获得。
[0228]
通过将如此获得的本发明的含有rebe的萃取物及/或通过本发明的rebe的制造方法获得的rebe与其他成分混合,可制造提高了rebe的含量的新型饮食品、甜味剂组合物、香料或医药品。于是,本发明,作为其他实施方式,提供一种饮食品、甜味剂组合物、香料或医药品的制造方法,其特征在于,包含提供本发明的含有rebe的萃取物及/或通过本发明的rebe的制造方法获得的rebe的工序,及将所述萃取物及/或rebe添加至饮食品、甜味剂组合物、香料或医药品的原料中的工序。
[0229]
进一步,本发明提供一种通过所述制造方法获得的提高了rebe的含量的新型饮食品、甜味剂组合物、香料或医药品。此处,饮食品是指饮料及食品。从而,在某种实施方式中,本发明提供一种新型饮料、食品、甜味剂组合物、香料或医药品,还提供一种该饮料、食品、甜味剂组合物、香料或医药品的制造方法。
[0230]
5.本发明的植物体涉及的碱基序列
[0231]
本发明在其他方式中,提供本发明的植物体涉及的碱基序列。
[0232]
具有遗传性状(a)的甜菊植物体涉及的碱基序列包含选自序列号16~19的碱基序列或由其构成。具有遗传性状(b)的甜菊植物体涉及的碱基序列包含选自序列号20~23的碱基序列或由其构成。具有遗传性状(c)的甜菊植物体涉及的碱基序列包含选自序列号24~27的碱基序列或由其构成。具有遗传性状(d)的甜菊植物体涉及的碱基序列包含选自序列号28~31的碱基序列或由其构成。具有遗传性状(e)的甜菊植物体涉及的碱基序列包含选自序列号32~35的碱基序列或由其构成。
[0233]
实施例
[0234]
以下对本发明涉及的实施例进行记载,但本发明并不限定于这些具体的方式。
[0235]
[实施例1]高rebe甜菊植物的制作
[0236]
本发明者等为了获得富含rebd的甜菊植物体,重复甜菊植物体的选择与交配。在这个过程中,注意到富含rebe的甜菊植物体的存在。具体的步骤如下所示。
[0237]
1.试验系统的制作
[0238]
对野生型甜菊种子(市售品种)实施甲磺酸乙酯(ems)处理,将其播种至三得利国际研究中心内的温室中,并栽培。从长成的各个体中采集适量的新鲜叶作为样本,通过lc-ms/ms(岛津lcms8050)对rebd的浓度进行定量。具体而言,通过冷冻干燥对0.25g的新鲜叶进行干燥,将干燥粉碎物0.05g投入100倍量(5ml)的纯水中。通过20分钟超声波处理进行萃取,离心分离并过滤后,将用32%乙腈进行60倍稀释后的液体作为样本液。通过lcms8050的
mrm模式对该样本液1ml实施lc-ms/ms分析,对rebd的浓度进行定量,选择其浓度为2%以上的个体进行交配,获得种子。这样的选拔重复4代,获得杂交种第4代(s4代)的集团a及b。
[0239]
2.各个体中所含的甜菊醇糖苷的测定
[0240]
从集团a及b的各个体中采集适量新鲜叶作为样本,与上述1.同样通过lc-ms/ms分析,对reba、rebb、rebc、rebd、rebe、rebf、rebg、rebm、rebn及甜菊苷(stv)的浓度(相对于干燥叶的质量%)进行定量,将其合计作为tsg浓度。结果示于下表。另外,表中的各值为甜菊植物体一个个体的测定值。
[0241]
[表6]
[0242]
表6集集团a中的糖苷浓度
[0243][0244]
如上述结果所示,集团a中的s41-1~s41-73,以干燥叶为基础含有超过0.10质量%的量的rebe,即富含rebe。其中,s41-1~s41-22,以干燥叶为基础含有超过0.62质量%的量的rebe,即特别富含rebe。
[0245]
[表7]
[0246]
表7集团b中的糖苷浓度
[0247][0248]
如上述结果所示,集团b中的s42-1~s42-78,以干燥叶为基础含有超过0.06质量%的量的rebe,即富含rebe。进一步,其中,s42-1~s42-29,以干燥叶为基础含有超过0.49质量%的量的rebe,即特别富含rebe。
[0249]
[实施例2]高rebe甜菊植物体特有的遗传性状的检测
[0250]
从实施例1试验的一部分的个体的新鲜叶中提取基因组dna,通过测序仪(hiseq 2500,illumina)实施遗传性状的分析。
[0251]
结果,在rebe含量高的系统中可见检测出遗传性状(a)~(e)的倾向。于是,为了提高遗传性状的检测效率,制作用于检测遗传性状(a)的dcaps引物,通过dcaps法对剩余个体是否具有这些遗传性状进行评价。另外,关于遗传性状(b)~(e),变异部位与遗传性状(a)的变异部位在基因组上的位置相近,认为呈连锁不平衡的状态,因此省略基于dcaps法的研究。
[0252]
dcaps引物及限制酶使用以下引物及限制酶。
[0253]
[表8]
[0254]
表8dcaps引物的序列及限制酶
[0255][0256]
基于dcaps法的遗传性状的检测如以下方式实施。首先,从实施例1试验的各个体的新鲜叶中提取基因组dna,使用与各遗传性状对应的上述dcaps引物实施pcr,向pcr产物中添加上述限制酶,于37℃下进行酶促反应。通过微芯片型电泳装置labchip gx touch ht(perkinelmer)实施限制酶处理物的电泳,根据所得条带的带型判定有无遗传性状。具体而言,仅确认非分解物的条带的个体判定为a’,确认分解产物和非分解物两者的条带的个体判定为a”,仅确认分解产物的条带的个体判定为
×
。a’和a”评价为具有遗传性状(a),将
×
评价为无遗传性状(a)。尤其,a’评价为具有遗传性状(a’)。
[0257]
如下表所示,在集团a、b两者中,在rebe含量多的甜菊植物体中,存在具有遗传性状(a)的倾向。另一方面,rebe含量少的甜菊植物体(集团a中为0.10质量%以下。集团b中为0.06质量%以下。)存在无遗传性状(a)的倾向。此外,rebe含量特别多的甜菊植物体(s41-1~s41-22的rebe含量为2.10%以上,s42-1~s42-29的rebe含量为1.74%以上)具有遗传性状(a’)。
[0258]
[表9]
[0259]
表9集团a巾的遗传性状
[0260][0261]
[表10]
[0262]
表10集团b中的遗传性状
[0263][0264]
由上述结果明确了,具有本发明的遗传性状的系统有rebe含量高的倾向(集团a中平均约1.13%,最大4.16%。集团b中平均约1.17%,最大3.52%)。具有本发明的遗传性状(a’)的系统,rebe含量尤其高(集团a中平均约2.98%,最大4.16%。集团b中平均约2.79%,最大3.52%)。
[0265]
具有本发明的遗传性状的系统,有相对于tsg的rebe的质量比高的倾向(集团a中最小2.4%,最大45.8%。集团b中最小1.5%,最大39.3%),具有本发明的遗传性状(a’)的系统,有相对于tsg的rebe的质量比特别高的倾向(集团a中最小25.5%,最大45.8%。集团b中最小22.4%,最大39.3%)。
[0266]
具有本发明的遗传性状的系统,相对于甜菊苷的rebe含量为1以下(集团a中为0.11~0.85。集团b中为0.07~0.65),具有本发明的遗传性状(a’)的系统,相对于甜菊苷的rebe含量为0.07~0.85(集团a中为0.35~0.85。集团b中为0.29~0.65)。
[0267]
工业实用性
[0268]
根据本发明可更有效地提供rebe等有用的甜菊醇糖苷,从而可促进含有这样的甜菊醇糖苷的上乘味道的饮料、食品、甜味剂组合物、香料或医药品等的提供。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1