杂合的CENH3单子叶植物及其用于单倍体诱导和同时基因组编辑的方法与流程
杂合的cenh3单子叶植物及其用于单倍体诱导和同时基因组编辑的方法
1.相关申请的交叉引用
2.本技术要求于2020年6月9日提交的u.s.s.n.63/036,902和2020年6月9日提交的u.s.s.n.63/036,910的权益和优先权,其各自的全部内容通过引用纳入本文。
3.关于联邦资助的研究的声明
4.这项发明是在国家科学基金会授予的1444514的政府资助下完成的。政府对这项发明享有一定的权利。
5.对序列表的引用
6.根据37c.f.r
§
1.52(e)(5),创建于2021年6月7日,大小为20,835字节的命名为“uga_2020_139_03_pct_st25.txt”的文本文件提交的序列表通过引用纳入本文。
技术领域
7.本发明的领域大体涉及单倍体诱导物植物系及其用于产生遗传修饰的加倍单倍体植物的方法。
背景技术:
8.世界各地的育种公司每年都会产生数以万计的玉米单倍体品系,作为创造新的近交系的先决条件,这些近交系最终会被用于创造杂交种以供销售。通过化学处理将诱导的单倍体加倍,并立即测试农性能。使这项技术成为可能的是,发现了一种名为stock 6的玉米近交系,该近交系在作为雄性杂交时诱导单倍体(coe,et al.,the american naturalist,93(873):381
–
82(1959))。该杂交后代中约有3%为母体基因组的单倍体。该品系现已被改良并选择用于改良的单倍体形成,其范围为3-20%(hu et al.,genetics,202(4):1267-76(2016);prigge et al.,genetics,190(2):781-93(2012))。所有玉米单倍体诱导应用都可追溯到这一原始发现和由此衍生的育种系。关于这一主题的相关文献已经过大量综述(chaikam et al.,tag.theoretical and applied genetics.theoretische und angewandte genetik,132(12):3227-43(2019);comai和tan,trends in genetics.doi:10.1016/j.tig.2019.07.005(2019);kalinowska et al.,tag.theoretical and applied genetics.theoretische und angewandte genetik,132(3):593-605(2019))。负责基于stock 6的单倍体诱导的基因(母系或matl)是一种主要在花粉中表达的patatin样磷脂酶(kelliher et al.,nature,542(7639):105-9(2017);liu et al.,molecular plant,10(3):520-22(2017);gilles et al.,the embo journal,36(6):707-17(2017))。其作用机制尚不清楚,但可能涉及受精过程中膜特性的变化,该变化导致父系基因型的突然丢失。matl中的突变也会在水稻中诱导单倍体(yao et al.,nature plants,4(8):530-33(2018)),表明这种单倍体诱导方法可广泛用于单子叶作物物种。
9.单倍体诱导本身具有广泛的意义。同样重要的是随后证明matl可用于“无形”地将crispr/cas9盒传递到任何近交背景中(kelliher et al.,nature biotechnology,37(3):
287-92(2019)),并编辑超过3%的单倍体后代中的基因。然后,产生的单倍体可以加倍,以快速、无gmo的方式产生具有纯合突变的近交系。任何其他编辑基因的方法都需要转化和再生;一种严重依赖基因型的过程。通过使用不依赖基因型的单倍体诱导物,可以避免这个瓶颈。然而,该方法很麻烦,因为它需要在另一个位点开始基因编辑之前在matl中产生突变。含有matl突变的品系也不健康,难以繁殖。此外,由于matl作用的机制尚不清楚,尚不清楚cas9如何能够进入母体基因组。由于机理未知,因此很难改进该技术。
10.诱导单倍体的另一种方法是着丝粒介导的单倍体诱导(ravi和chan(ravi,et al.,genetics,186(2):461-71(2010),ravi,et al.,plos genet.,7(6):e1002121(2011)doi:10.1371/journal.pgen.1002121,ravi et al.,nature,464(7288):615-18(2011))发现,当补充有被称为“gfp-tailswap”的cenh3的修饰版本时,cenh3-/-拟南芥无效突变体可以高频率的诱导父系单倍体(约25%)。gfp-tailswap是一种复杂的转基因,在组蛋白尾部有取代,在n末端添加了大的gfp部分。其他形式的尾互换涉及来自不同物种的cenh3基因,具有或不具有gfp(britt和kuppu,frontiers in plant science,7(april):357,(2016)),以及赋予cenh3单个氨基酸变化的点突变,这些形式也可以以较低的频率诱导单倍体(karimi-ashtiyani et al.,pnas,112(36):11211-16(2015);kuppu et al.,plos genetics,11(9):e1005494(2015),kalinowska et al.,tag.theoretical and applied genetics.theoretische und angewandte genetik,132(3):593
–
605(2019))。
11.着丝粒介导的单倍体诱导也在其他几个双子叶植物物种中成功了(kalinowska et al.,tag.theoretical and applied genetics.theoretische und angewandte genetik,132(3):593-605(2019))。单子叶植物的结果有限且不可靠(kelliher et al.,frontiers in plant science,7(march):414(2016)),这导致人们普遍认为,对于单子叶植物,将使用母系系统,而对于双子叶植物,则使用着丝粒介导的单倍体诱导(kalinowska et al.,tag.theoretical and applied genetics.theoretische und angewandte genetik,132(3):593-605(2019))。
12.因此,仍然需要用于在单子叶植物中的单倍体诱导的改进的组合物和方法,和由其形成的单倍体,任选地与用于相对于背景基因组诱导一个或多个突变的同时基因编辑相结合。
技术实现要素:
13.提供了着丝粒组蛋白3(cenh3)杂合的单子叶植物及其在靶标植物中有效的着丝粒介导的单倍体诱导方法中的用途。单子叶单倍体诱导物植物通常由只有一个cenh3等位基因的二倍体植物细胞组成,所述cenh3等位基因是全功能的。二倍体植物细胞还可以包括例如一个编码非功能性cenh3蛋白的cenh3等位基因。在一些实施方案中,编码非功能性cenh3蛋白的等位基因是蛋白无效等位基因、rna无效等位基因或其组合。在一些实施方案中,第一个二倍体染色体上的内源性cenh3基因座突变,或部分或完全缺失。在一些实施方案中,突变是引入终止密码子的移码突变,导致基因表达截短的非功能性蛋白质。通常,第二(即另一条)二倍体染色体上的内源cenh3基因座是完整的。功能性cenh3蛋白可以是野生型cenh3蛋白。
14.典型地,该植物缺乏编码野生型cenh3、cenh3蛋白变体和融合蛋白的染色体整合
或染色体外转基因。因此,典型地,植物缺乏编码cenh3绿色荧光蛋白(gfp)融合蛋白例如gfp-tailswap的构建体。在一些实施方案中,cenh3无效单独使用或与利用单倍体的其他技术结合使用,例如合成单性生殖,或将工程化染色体从一个品系转移到另一个品系。
15.单子叶单倍体诱导物植物还可以任选地包括基因编辑机器,例如定点核酸酶和任选地由单子叶植物细胞稳定表达的指导rna。典型地,表达基因编辑机器(例如核酸酶和任选地指导rna)的构建体由单子叶植物稳定表达。在一些实施方案中,定点核酸酶是基于crispr的系统、转录激活因子样效应物核酸酶(talen)或锌指核酸酶(zfn),其可以作为胞苷脱氨酶或腺嘌呤脱氨酶融合蛋白部署。在一些实施方案中,编码核酸酶的异源核酸构建体被整合到单倍体诱导物植物的基因组中。
16.在一些实施方案中,单子叶单倍体诱导物植物的基因组包括供体核酸序列,该供体核酸序列通过同源定向修复(hdr)及随后的核酸酶切割被引入靶标植物的基因组中。
17.还提供了由单倍体诱导物植物形成的卵子和精子细胞,该单倍体诱导物植物缺少一个编码功能性cenh3蛋白的等位基因,并表达基因编辑机器。在一些实施方案中,相对于由cenh3纯合植物形成的相应卵细胞,卵细胞具有不超过约12.5%的功能性cenh3蛋白。在一些实施方案中,相对于由cenh3纯合植物形成的相应精细胞,精细胞具有不超过约25%的功能性cenh3蛋白。
18.还提供了诱导形成靶标单倍体单子叶植物的方法。所述方法通常包括用来自单子叶单倍体诱导物植物的花粉对亲本单子叶靶标植物授粉或用来自亲本单子叶靶标植物的花粉对单子叶单倍体诱导物植物授粉。当携带cenh3(即无效)等位基因的卵子或花粉(含稀释量的cenh3)通过来自野生型系的花粉受精时,诱导单倍体。接下来,选择通过授粉产生的单倍体后代。
19.还提供了修饰单子叶靶标植物基因组的方法。所述方法通常包括诱导表达基因编辑机器的靶标单倍体单子叶植物的形成、用单子叶靶标植物的基因组而不是单子叶单倍体诱导物植物的基因组选择单倍体后代,并且其中所述单倍体后代的基因组已通过定点核酸酶和任选地至少一种由所述单子叶单倍体诱导物植物递送的指导rna修饰。
20.任何方法都可以进一步包括额外的步骤,例如,所选单倍体后代的染色体加倍。染色体加倍可以是自发的或由例如染色体加倍剂诱导的,所述染色体加倍剂任选地选自秋水仙碱、拿草特、dithipyr、氟乐灵或另一种抗微管剂。
21.单子叶单倍体诱导物植物可以是例如玉米、小麦、水稻、高粱、大麦、燕麦、黑小麦、黑麦、珍珠稷、龙爪稷、黍、谷子、香蕉、竹子、甘蔗、柳枝稷、芒草、芦笋、洋葱、大蒜、香葱或山药。在优选实施方案中,单倍体诱导物植物是玉米。
附图说明
22.图1a-1c说明了通过crispr/cas9的玉米cenh3无效突变的产生。图1a是玉米中基因组编辑载体构建示意图。ubi-cas9包括由玉米多泛素启动子驱动的密码子优化的cas9。grna-immunecenh3包括靶向cenh3第四外显子的grna和由2.1kb的cenh3天然启动子驱动的不可切割的immunecenh3基因。tailswapcenh3基于immunecenh3,但包括修饰的n末端尾部和gfp标签。图1b是cenh3基因的基因组结构的示意图。外显子用方框显示。还显示了sgrna的原间隔区邻近基序(pam)和20bp靶序列(seq id no:16),其与sgrna的互补序列/杂交片
段(seq id no:17)对齐。图1c是来自杂合系的序列的色谱图,显示了cenh3无效突变(seq id no:18-19)中的移码。图示了pam、缺失和终止密码子。
23.图2a-2f说明了确认植物为单倍体的测定结果。图2a和2b是显示二倍体和单倍体的流式细胞分析的图。二倍体植物(2a)在2n和4n处显示出峰值,其中4n是分化组织中核内复制的结果。单倍体植物具有1n和2n峰(2b)。图2c和2d是染色体扩散的图像。玉米二倍体有20条染色体(2c),而单倍体有10条染色体(2d)。图2e和2f是植物的图像:单倍体植物具有较短的体型(stature)(2e),并且在没有施加花药的情况下是不育的(2f)。
24.图3a和3b是非整倍体的分子核型图。对于两个图,染色体在顶部显示为首尾相连。图3a显示了gl8杂交产生的非整倍体。非整倍体_1为3号染色体的三体,非整倍体_2为2号和4号染色体的单体,和10号染色体的三体。图3b显示了gl1杂交产生的非整倍体。非整倍体_3和非整倍体_4是7号染色体的单体,非整倍体_5是3号、6号和7号染色体的单体,非整倍体_6为除1号染色体外的所有染色体的单体,非整倍体_7是9号染色体的单体。每个样本的覆盖率都归一化为每个杂交的相关二倍体的覆盖率。
25.图4a是一个流程图,显示了在玉米中创建tailswap-cenh3诱导物系的失败策略。将immunecenh3与gfp-tailswap构建体的玉米版本和cenh3的其他几个变体互换,以观察该品系是否会诱导单倍体。这些cenh3变体均未补充无效(“失败”)。图4b是显示cenh3在雌配子发育过程中的分布的流程图。在雌配子体中,先于卵子的形成,有三次细胞分裂。携带cenh3无效的卵子可以具有不超过12.5%的cenh3蛋白。
26.图5a-5d说明了cenh3无效在同时单倍体诱导和基因编辑中的应用。图5a是用于同时单倍体诱导和基因编辑的crispr构建体的质粒图。显示了构建体的成分。图5b和5c是野生型(wt)(5b)和幼穗表型(fea2)(5c)表型的照片(改编自taguchi-shiobara,et al.,genes dev.15:2755
–
2766(2001),其中首次描述了fea2突变表型)。图5d是使用cenh3单倍体诱导物获得的fea2编辑单倍体植株的幼穗表型照片。
27.发明详述
28.i.定义
29.术语“约”旨在描述在大约+/-10%的范围内高于或低于规定值的值。范围旨在通过上下文清楚地限定,并且没有暗示进一步限制。本文提供的任何和所有实例或示例性语言(例如,“诸如(such as)”)的使用仅仅是为了更好地阐明说明书,并且除非另有说明,否则不会对说明书的范围造成限制。
30.术语“植物”以其最广义使用。它包括但不限于任何木本、观赏性或装饰性作物或谷物的物种,以及水果或蔬菜植物。它也指大量的植物细胞,所述植物细胞在很大程度上分化成一种结构,这种结构存在于植物发育的任何阶段。此类结构包括但不限于果实、嫩枝、茎、叶、花瓣等。
31.术语“植物组织”包括植物的分化和未分化的组织,包括存在于根、嫩枝、叶、花粉、种子和肿块中的分化和未分化的组织,以及培养物中的细胞(例如单细胞、原生质体、胚、愈伤组织等)。植物组织可以在植物、器官培养物、组织培养物或细胞培养物中。本文使用的术语“植物部分”是指植物结构、植物器官或植物组织。
32.术语“植物材料”是指叶、茎、根、花或花部分、果实、花粉、卵细胞、合子、种子、插条、细胞或组织培养物,或植物的任何其他部分或产物。
33.术语“植物器官”是指植物的明显的、结构清晰和分化的部分,如根、茎、叶、花蕾或胚。
34.术语“植物细胞”是指植物的结构和生理单位,包括原生质体和细胞壁。植物细胞可以是分离的单个细胞或培养的细胞的形式,或者作为更高组织单位,例如植物组织、植物器官或整个植物的一部分。
35.术语“植物细胞培养物”是指植物单位的培养物,例如原生质体、细胞培养物细胞、植物组织中的细胞、花粉、花粉管、胚珠、胚囊、合子和处于不同发育阶段的胚。
36.术语“转基因植物”是指含有重组遗传物质的植物或树木,这种重组遗传物质通常在这类植物或树木中不存在,并且已经通过人类操作引入到所述植物(或植物的祖先)中。因此,从通过转化引入重组dna的植物细胞中生长出来的植物是转基因植物,该植物的所有后代都含有引入的转基因(无论是有性生产的还是无性生产的)。应当理解,术语转基因植物包括整个植物或树木以及植物或树木的部分,例如谷粒、种子、花、叶、根、果实、花粉、茎等。
37.术语“构建体”是指具有一个或多个分离的多核苷酸序列的重组遗传分子。用于宿主生物中转基因表达的基因构建体在5'-3'方向包括启动子序列;编码目标基因的序列;以及终止序列。该构建体还可以包括选择性标记基因和其他表达调控元件。
38.术语“基因”是指通过其模板或信使rna编码特定肽、多肽或蛋白质的氨基酸特征序列的dna序列。术语“基因”也指编码rna产物的dna序列。参考基因组dna如本文使用的术语基因包括间插的非编码区以及调控区,并且可以包括5’和3’端。
39.术语“直系同源基因”或“直系同源”是指具有相似核酸序列的基因,因为它们被物种形成事件分离。
40.术语“多肽”通常指具有超过约10个氨基酸的肽和蛋白质。多肽可以是“外源的”,这意味着它们是“异源的”,即对所利用的宿主细胞是外来的,例如由细菌细胞产生的人多肽。
41.术语“分离的”是指目标化合物(例如,核酸),其在不同于该化合物自然存在的环境中,例如,通过将肽浓缩至在自然界中不存在的浓度而与其自然环境分离。“分离的”意在包括样品中的化合物,这些样品实质上富集了目标化合物和/或其中目标化合物被部分或大体上纯化。分离的核酸至少60%不含,优选75%不含,最优选90%不含其他相关组分。“分离的”核酸分子或多核苷酸是这样一种核酸分子,它从至少一种通常与天然来源相关的污染核酸分子鉴定和分离。例如,分离的核酸可以不与与其天然相关的所有组分相关联。分离的核酸分子与其自然界中发现的形式或环境不同。
42.术语“基因座”是指沿着染色体或dna序列的特定位置。根据上下文,基因座可以是基因、标记、染色体带或一个或多个核苷酸的特定序列。
43.术语“等位基因”是指基因的两种或多种替代形式之一。
44.术语“载体”是指复制子,如质粒、噬菌体或粘粒,其中可以插入另一个dna片段,从而实现插入片段的复制。载体可以是表达载体。
45.术语“表达载体”是指包含一个或多个表达控制序列的载体。
46.术语“表达控制序列”是指控制和调节另一dna序列的转录和/或翻译的dna序列。例如,适用于原核生物的控制序列包括启动子、任选的操纵基因序列、核糖体结合位点等。
已知真核细胞利用启动子、聚腺苷酸化信号和增强子。
47.术语“启动子”是指通常位于基因或蛋白质编码序列上游(5')的调控核酸序列,该核酸序列与各种元件一起负责调控基因或蛋白质的编码序列的表达。适用于本公开的构建体的启动子在用于表达所公开的多核苷酸的植物和宿主生物中具有功能。许多植物启动子是众所周知的。这些包括组成型启动子、诱导型启动子,组织和细胞特异性启动子和发育调控启动子。例如,在美国专利号6,717,034中描述了示例性启动子和融合启动子,其全部内容通过引用纳入本文。
48.当核酸序列或多核苷酸与另一核酸序列形成功能关系时,其“可操作地连接”。例如,如果前序列或分泌前导的dna表达为参与多肽分泌的前蛋白,则其可与多肽的dna操作地连接;如果启动子或增强子影响编码序列的转录,则其可操作地连接到编码序列;或者如果核糖体结合位点被定位以促进翻译,则其可操作地连接到编码序列。通常,“可操作地连接”意味着所连接的dna序列是连续的,在分泌前导的情况下,是连续的并且在阅读框中。连接可以通过在方便的限制位点连接来完成。如果不存在这样的位点,则根据常规实践使用合成寡核苷酸连接物或接头。
49.术语“转化的”、“转基因”、“转染的”和“重组的”是指宿主生物体,如细菌或植物,其中引入了异源核酸分子。核酸分子可以稳定地整合到宿主的基因组中,或者核酸分子也可以作为染色体外分子存在。这种染色体外分子可以自主复制。转化的细胞、组织或植物被理解为不仅包括转化过程的最终产物,还包括其转基因后代。“非转化的”、“非转基因的”或“非重组的”宿主是指不含异源核酸分子的野生型生物体,例如细菌或植物。
50.关于核酸的术语“内源性”是指通常存在于宿主中的核酸。
51.术语“异源”指的是出现在通常不存在的地方的元件。例如,启动子可以连接到异源核酸序列,例如,通常不会发现可操作地连接到启动子的序列。当本文用于描述启动子元件时,异源是指在序列、种类或数量与通常在天然启动子中发现的不同的启动子元件。例如,启动子序列中的异源控制元件可以是添加以增强启动子控制的不同启动子的控制/调控元件,或者是相同启动子的附加控制元件。因此,术语“异源”也可以包括“外源”和“非天然”元件。
52.如本文所用,“同源”是指源自同一物种。例如,同源性状是从共同祖先衍生的生物体的任何特征。同源序列可以是直系同源的或旁系同源的。如果同源序列被物种形成事件分离,则它们是直系同源的:当一个物种分化为两个单独的物种时,产生的物种中单个基因的不同拷贝被称为直系同源的。直系同源物,或直系同源基因,是不同物种中彼此相似的基因,因为它们起源于共同的祖先。如果同源序列被基因复制事件分开,则它们是旁系同源的:如果生物体中的基因被复制为占据同一基因组中的两个不同位置,则这两个拷贝是旁系同源的。
53.如本文所用,“多肽”通常指具有超过约10个氨基酸的肽和蛋白质。多肽可以是“外源的”,这意味着它们是“异源的”,即对所利用的宿主细胞是外来的,例如由细菌细胞产生的人多肽。
54.如本文所用,“栽培种”是指栽培的品种。
55.如本文所用,“种质”指一种或多种表型特征,或编码所述一种或多种表型特征的一个或多个基因,能够在世代之间传播。
56.如本文所用,术语“祖先”是指植物从其衍生的任何物种、品种、栽培种或种质。
57.如本文所用,术语“衍生物种、种质或品种”是指使用所述物种、品种、栽培种或种质、使用有性杂交、重组dna技术、组织培养、诱变或任何一种或多种所述程序的组合的标准程序生产的任何植物物种、种质和品种。
58.如本文所用,术语“渐渗”、“渐渗入的”和“渐渗中”指的是天然和人工过程两者,其中一个物种、品种或栽培种的基因通过杂交这些物种而移入另一物种、品种或栽培种的基因组。该过程可以任选地通过回交给回归亲本来完成。
59.如本文所用,“植物部分”或“植物的一部分”包括但不限于插条、细胞、原生质体、细胞组织培养物、愈伤组织(愈伤组织)、细胞丛、胚、雄蕊、花粉、花药、雌蕊、胚珠、花、种子、花瓣、叶、茎和根。
60.如本文所用,“杂交种”通常来源于单个物种内不同品种、种质、种群、品种或栽培种之间、物种内不同亚种之间或属内不同物种之间的一个或多个杂交系。典型地,亚种之间的杂交系被称为“种内杂交”,而属内不同物种之间的杂交种则称为“种间杂交”61.除非本文中另有说明,否则本文中值范围的引用仅旨在作为单独引用落在该范围内的每个单独值的速记方法,并且每个单独值被并入说明书中,如同其在本文中被单独引用一样。
62.术语“约”的使用旨在描述在约+/-10%范围内高于或低于规定值的值;在其他形式中,这些值的范围可以在约+/-5%的范围内高于或低于规定值;在其他形式中,这些值的范围可以在约+/-2%的范围内高于或低于规定值;在其他形式中,该值的范围可以在约+/-1%的范围内高于或低于规定值。上述范围旨在通过上下文明确,不暗示进一步的限制。
63.公开了材料、组合物和成分,其可用于、可与之结合使用、可用于制备或是所公开的方法的产物和组合物。本文公开了这些和其他材料,并且应当理解,当公开了这些材料的组合、子集、相互作用、组等时,虽然可能没有明确公开这些化合物的各种单独和集体组合和排列的具体参考,但本文中具体设想和描述了每一种。例如,如果公开并讨论了配体,并且讨论了可以对包括配体在内的多个分子进行的多个修饰,则除非特别相反地指出,否则可以特别考虑配体的每个组合和排列以及可能的修饰。因此,如果公开了一类分子a、b和c以及一类分子d、e和f以及组合分子a-d的实例,则即使没有单独列举每一种,也可以单独和集体地设想每一种。因此,在该实例中,组合a-e、a-f、b-d、b-e、b-f、c-d、c-e和c-f中的每一个都是具体设想的,并且应该被认为是从a、b和c;d、e和f;以及示例组合a-d的公开中公开的。同样,这些的任何子集或组合也被具体地设想和公开。因此,例如,a-e、b-f和c-e的亚组是具体设想的,并且应该被认为是从a、b和c;d、e和f;以及示例组合a-d的公开中公开的。此外,如上所述设想和公开的材料、组合物、成分等中的每一种也可以具体地和独立地包括或排除在此类材料的任何组、亚组、列表、集合等中。
64.这些概念适用于本技术的所有方面,包括但不限于制造和使用所公开组合物的方法中的步骤。因此,如果存在可以执行的各种额外步骤,应当理解,这些额外步骤中的每一个都可以用所公开的方法的任何特定实施方案或实施方案的组合来执行,并且每个这样的组合都是具体设想的并且应当被认为是公开的。
65.本文所述的所有方法都可以以任何合适的顺序执行,除非上下文另有指示或明确矛盾。本文中提供的任何和所有实例或示例性语言(例如,“诸如”)的使用仅旨在更好地说
明实施方案,并且除非另有要求,否则不对实施方案的范围构成限制。说明书中的任何语言都不应被解释为将任何未要求保护的元素指示为本发明的实施所必需的。
66.ii.植物
67.单倍体植物被广泛用于加速新近交系的生产。单倍体诱导包括暂时的二倍体状态,随后丢失一个有贡献的基因组。该机制还使得以基因型独立的方式引入基因编辑机器而无需稳定地转化靶标系成为可能。
68.所公开的方法利用着丝粒组蛋白h3基因的简单无效突变。以下实施例中给出的结果表明,杂合的cenh3无效植物在作为雌性杂交时产生单倍体的频率为5%,在作为雄性杂交时产生的频率为0.5%。单倍体诱导的机制涉及合子中染色体的顺序丢失。所公开的植物及其使用方法也使得以简单、快速和无gmo的方式将基因编辑机器引入任何品系成为可能。
69.玉米基因命名法规定,突变体等位基因以正常或斜体小字体表达,其中第一个字母是小写的(例如cenh3),野生型基因以正常或斜体字体表达,其中第一个字母为大写的(例如cenh3),表达的蛋白产物以所有字母大写(cenh3)书写。由于以下所述实验是在玉米中进行的,因此本文大体遵循玉米命名法。然而,应当理解,本文所述的组合物和方法也适用于其他单子叶植物中的相应基因,因此也公开了这些基因,因此该命名法的使用不应被解释为将所公开的组合物和方法仅限于玉米。
70.所公开的单倍体诱导方法通常包括单倍体诱导物系和待诱导产生单倍体的靶标系之间的杂交。
71.所公开的基因编辑方法通常包括包括基因编辑机器的单倍体诱导物系和待诱导产生单倍体的靶标系之间的杂交,所产生的单倍体也是基因修饰的靶标。选择体内单倍体诱导过程,通过将其包含在单倍体诱导亲本中,将编辑机器引入靶标种质中。通常,编辑机器作为转基因稳定整合。通过远缘杂交或从头单倍体诱导,可以在各种单子叶植物中进行同时编辑加单倍体诱导。
72.通常,本文公开的杂交中使用的一种或多种植物和/或由此产生的后代是非天然存在的植物。“非天然存在的植物”是指在没有人类干预的情况下不会在自然界中发生的植物。非天然存在的植物包括转基因植物以及通过非转基因手段如植物育种产生的植物。
73.a.靶标系
74.待诱导靶标系通常是单子叶植物。单子叶植物包括被子植物(开花植物,种子被保护在容器内)的一个大分支。它们是具有平行脉叶的草本植物,与双子叶植物不同,胚只有一个子叶,而双子叶植物(双子叶的植物)的胚具有两个子叶。在一些实施方案中,靶标系是选自玉米、小麦、水稻、高粱、大麦、燕麦、黑小麦、黑麦、珍珠稷、龙爪稷、黍、谷子、香蕉、竹子、甘蔗、柳枝稷、芒草、芦笋、洋葱、大蒜、香葱或山药的单子叶植物。
75.靶标系通常是一个具有单倍体植株的系,通常是为了加速新近交系的生产。在一些实施方案中,靶标系是已经进行了广泛育种的优良近交系,但需要进行遗传修饰以改进该系,例如,使其抵抗疾病或害虫挑战或更好地适应不同环境。
76.b.诱导系
77.提供了任选地表达基因编辑机器的单倍体诱导物植物系。诱导物系也是单子叶植物,例如玉米、小麦、水稻、高粱、大麦、燕麦、黑小麦、黑麦、珍珠稷、龙爪稷、黍、谷子、香蕉、竹子、甘蔗、柳枝稷、芒草、芦笋、洋葱、大蒜、香葱或山药。
ttcggtcggt ctccagggca gcgaaccccc gctgatgcga atcggcctgc gacgccatct ggtgctactc ctagaaccac ggccaccaga tcgagggata cgcctcaagg ggcaccgagc caatcaaaac agcagccgag gcggcgcagg tttaggccgg gggtggtggc gctacgcgag atcaggaatt tgcagaagac gtggaatcta ttgatccctt tcgctccgtt tgtcagactt gttcgggaga tcactcattt ctactcgaaa gaagtaaacc gatggacccc tgaagcttta gttgcgattc aagaggcagc ggaaactcat atgatagaaa tgtttgaaga tgcatatctc tgtgcaattc atgcaaaacg tgttaccctt atgcaaaaag atatccatct agcaaggcga ataggaggaa gaagacattg gtga(seq id no:29,香蕉,kp878235.1)
93.cenh3基因在所有植物、真菌和动物中都是保守的,在某些昆虫谱系中有少量例外。它在定义功能性着丝粒的边界以及启动和组织动粒方面起着至关重要的作用(cheeseman和desai,nature reviews molecular cell biology,9:33-46(2008))。cenh3野生型可以是单子叶诱导物植物,例如,玉米、小麦、水稻、高粱、大麦、燕麦、黑小麦、黑麦、珍珠稷、龙爪稷、黍、谷子、香蕉、竹子、甘蔗、柳枝稷、芒草、芦笋、洋葱、大蒜、香葱或山药的cenh3。在一些实施方案中,野生型cenh3具有seq id no:20、22、24、26或28中任一项的氨基酸序列,或与之具有至少75%、80%、85%、90%、95%或更多序列同一性的氨基酸序列;由seq id no:21、23、25、27或29中任一项的核酸编码,所述核酸与其具有至少75%、80%、85%、90%、95%或更多序列同一性;是前述序列的同源物,例如直系同源物或旁系同源物;或其任意组合。
94.无效等位基因是由基因突变引起的非功能性等位基因。这种突变可能导致相关基因产物的完全缺乏或功能不正常的产物;无论哪种情况,该等位基因都被认为是非功能性的。例如,cenh3蛋白与dna结合,并招募形成介导植物细胞中染色体分离的动粒的所有覆盖蛋白。非功能性cenh3不会促进植物细胞中着丝粒的形成、动粒的形成和/或染色体分离。编码无功能性蛋白的无效物与cenh3变体(如gfp-tailswap)或产生改变的或部分缺失的cenh3蛋白的变体区分开来。参见,例如,kuppu,et al.,“a variety of changes,including crispr/cas9-mediated deletions,in cenh3 lead to haploid induction on outcrossing”,plant biotechnol j,2020,doi:10.1111/pbi.13365,其全部内容通过引用具体纳入本文。gfp-tailswap和变体形式可以替代天然cenh3,并保留足够的功能来组织动粒,即使不完全。无效等位基因是导致功能完全丧失的一种特殊类型的突变。
95.不产生rna转录物的突变体等位基因称为rna无效(通过northern印迹、总rna测序或缺失等位基因的dna测序显示),而不产生蛋白质的等位基因则称为蛋白质无效(通过蛋白质印迹显示)。无效通常由移码突变引起。遗传密码是以核苷酸的三联体读取的,因此任何序列都可以在三个框中读取,其中只有一个是正确的。导致核苷酸少量缺失或添加的突变会将阅读框移码到无意义的蛋白质,并经常导致蛋白质翻译过早停止。导致过早停止的移码突变,特别是当大多数预测蛋白缺失时,通常被解释为无效等位基因。例如,导致cenh3的n末端尾部终止密码子的移码突变编码严重截短的蛋白质,该蛋白质缺乏与dna或其他组蛋白结合的能力(图1c)。当纯合时,基因无效或无定形等位基因在纯合时具有与杂合时相同的表型,具有会破坏所述基因座的缺陷。遗传无效等位基因可能是蛋白质无效和rna无效两者,但也可能表达正常水平的因突变而无功能的基因产物。cenh3无效等位基因可以是整个基因座的缺失或其中一个或多个核苷酸的突变,导致缺乏cenh3基因产物或功能不正常的产物的产生。cenh3无效等位基因可以是rna无效、蛋白质无效或两者兼而有之。
96.所公开的cenh3无效的无效等位基因通常可与gfp尾交换构建体和几个cenh3变体区分,例如美国专利号8,618,354、美国公开申请号2018/0116141、美国公开申请号2019/0343060和wo 2017/004375中所描述的那些,其产生具有功能的cenh3变体蛋白质,尽管相对于野生型cenh3等位基因在功能或水平上降低或改变。
97.在一些实施方案中,携带cenh3无效的精子具有不超过25%的正常量的功能性(例如,野生型)cenh3蛋白,而携带cenh3无效的卵子具有超过12.5%的功能性的(例如野生型)cenh3蛋白。
98.在一些实施方案中,杂合的cenh3无效诱导物系不包括表达突变或变体cenh3的重组基因。因此,在一些实施方案中,无效不由非内源性cenh3表达补充。在一些实施方案中,cenh3的数量减少单独诱导着丝粒介导的单倍体诱导。
99.在一些实施方案中,杂合cenh3无效诱导物系中唯一的功能性cenh3由杂合cenh3无效的内源性野生型等位基因表达。
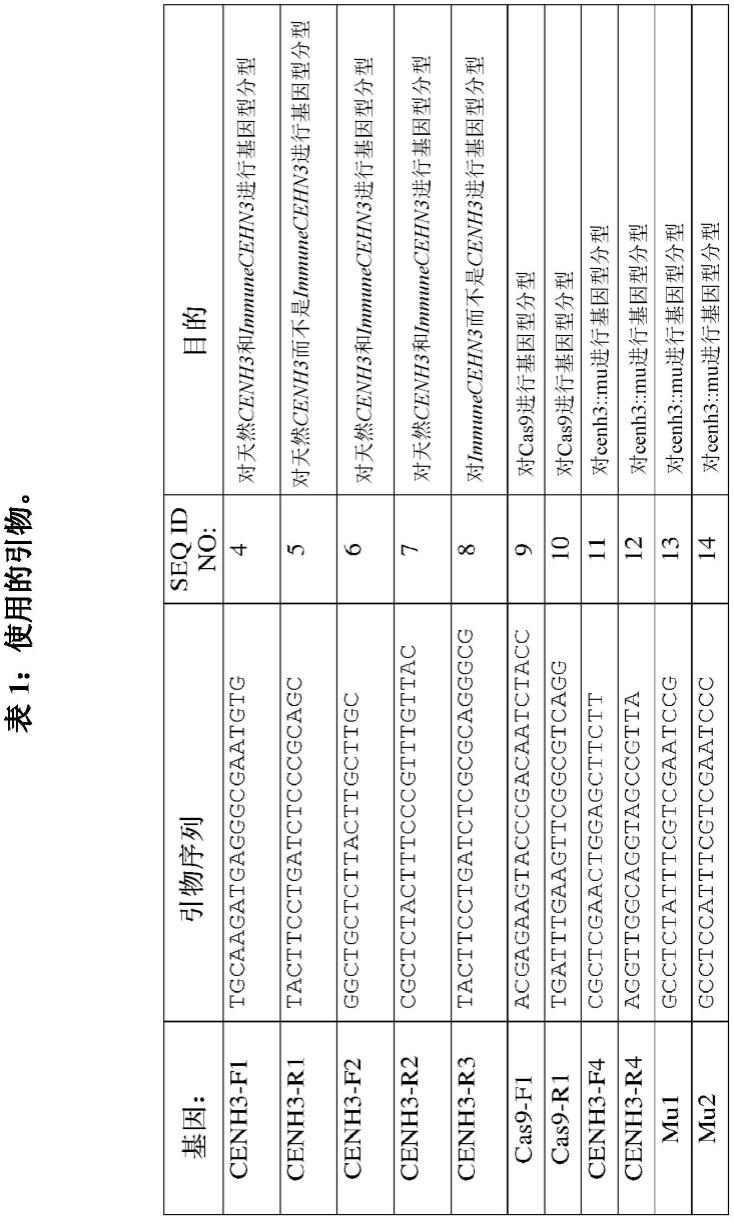
100.下面描述用于制备cenh3无效的非限制性方法。简言之,将含有cas9的转基因系与含有靶向cenh3第一外显子的指导rna以及在指导rna位点上含有五个沉默的核苷酸变化的完整的cenh3全长基因组克隆的另一个转基因系杂交(图1a-1c;不可切割的基因称为immunecenh3)。当将含有这些构建体的系杂交在一起时,cas9突变了天然的cenh3,而cenh3功能被immunecenh3基因覆盖。因此,在一些实施方案中,无效等位基因在第一外显子中具有一个或多个突变,该突变消除了功能蛋白从无效等位的表达。在一些实施方案中,无效是由编码n末端尾部的序列中的突变引起的,该突变去除了与dna或其他组蛋白相互作用的所有cenh3蛋白序列。
101.在每一次细胞分裂时,cenh3在s期的复制dna链之间自然平均分裂,随后在g2期补充(lermontova et al.,the plant journal:for cell and molecular biology,68(1):40
–
50(2006)))。这不可能发生在对cenh3无效的单倍体细胞中,并且细胞周期必须以正常存在的一半的cenh3进行。在雄配子体(花粉)中,精子形成之前有两次细胞分裂,而在雌配子体中,卵子形成之前有三次细胞分裂。携带cenh3无效的精子具有不超过正常量的25%的cenh3量,携带cenh33无效的卵子具有不超过正常量12.5%的cenh3量(图4b)。结果还表明,携带cenh3无效的雄性后代的0.5%是单倍体,雌性后代的5.0%是单倍体。因此,诱导物可以用作杂交的雄性或雌性。雌性诱导物产生更高百分比的单倍体,因此,在一些实施方案中,单倍体诱导物优选为雌性,但可替代地,所述方法可以使用单倍体诱导物作为雄性进行。
102.2.标记
103.单倍体诱导物可以具有标记,可以帮助识别单倍体种子。例如,单倍体诱导物可以具有显性紫色色素基因(例如,r1-nj)。单倍体个体的种子具有紫色糊粉,但胚乳(盾片)中缺乏紫色色素,表明种系不含单倍体诱导物染色体。具有黄色胚乳和紫色糊粉的种子被种植出来,并长成幼苗。使用秋水仙碱或其他方法使这些幼苗的染色体数目加倍,如下所详述。染色体加倍的单倍体在温室中生长和/或移植到田间,染色体加倍的植物自授粉以产生加倍的单倍体种子,如本文其他地方更详细讨论的。
104.3.基因编辑机器
105.诱导物系还任选地包括基因编辑机器。例如,诱导物植物可以将完成靶标植物基
因组编辑所需的机器编码到其dna中。
106.靶向诱变(也称为基因编辑)是作物育种的一项非常重要的技术。现在有许多方法可以编辑特定的基因靶点,包括crispr、talen、大范围核酸酶和锌指。内切核酸酶可以设计成靶向几乎任何序列。内切核酸酶可以使用如下方法构建,例如但不限于svitashev,et al.,plant physiology,169:931-945(2015),lee,et al.,plant biotechnology,17(2):362-372(2019)),sander et al.,nature met,8(1):67-69,(2011),cermak et al.,nucl acids res,39(17):7879(2011)描述的那些;nucl acids res,39:e82.doi:10.1093/nar/gkr218,2011),和liang et al.,et al.,j genet genom,41(2):63-68,(2014)描述了修正方案。用于驱动内切核酸酶表达的启动子可以是在整个发育过程中或特别在卵细胞中或在早期胚发育过程中表达的,并且可以是内源性或外源性的。启动子35s(camv d35s)或衍生物(例如,双35s)zmub1(玉米)apx(水稻)oscc1(水稻)eif5(水稻)r1g1b(水稻)pgd1(水稻)act1(水稻)scp1(水稻)的实例。
107.基因编辑机器构建体可以包括选择性标记(例如,除草剂抗性),以在整个植物转化和随后的回交期间帮助转基因的恢复。在一些情况下,将一种或多种(例如,两种或多种,或三种或多种)内切核酸酶和/或crispr指导rna结合到单个构建体中,以靶向一个或多个dna序列。
108.将编辑机器引入植物的一种方法是在植物组织上使用基于农杆菌的方法(例如由ishida et al.,nature biotechnol,146:745-750(1996)描述的方法)或粒子轰击(例如由gordon-kamm et al.,plant cell online,2(7):603-618(1990)描述的法)。结合发育调节基因的新方法已经被设计出来,使得无需大量组织培养转化植物成为可能。参见,例如,lowe,et al.,the plant cell,28:1998-2015(2016)。在转化中,编码编辑机器的dna(例如cas9和指导rna)被引入植物愈伤组织、种子或胚性组织中。然后,任选地在选择性标记的帮助下,恢复稳定转化的植物(事件)。
109.备选地,首先用基因编辑机器对可转化的系进行转化,然后将所得品系与单倍体诱导系杂交。产生的对于cenh3本身杂合的f1成为单倍体诱导物。不需要额外的回交。在这种情况下,f1单倍体诱导物系含有内切核酸酶转基因。接下来,携带(例如编码、表达等)基因编辑机器的诱导物系可以由第二待编辑植物授粉。从授粉事件中产生后代(例如胚或种子);其中至少一个将是单倍体种子。这种单倍体种子将只含有第二株植物的染色体;诱导物植物的染色体已经消失(已被消除、丢失或降解),但在此之前,诱导物植物的细胞染色体允许基因编辑机器得以表达。
110.或者,在不希望被理论束缚的情况下,诱导物植物在通过花粉管授粉时递送已经表达的编辑机器。或者,在单倍体诱导系是杂交中的雌性的情况下,单倍体诱导植物的卵细胞含有编辑机器,该机器在与“野生型”或非单倍体诱导花粉粒受精时存在,可能已经表达。通过这些途径中的任何一种,通过杂交获得的单倍体后代也已进行基因组编辑。在玉米的情况下,单个雄性植株可以进行多次杂交,含有cenh3无效和基因编辑机器的f1可以通过进行多次单独的杂交来编辑多个品系。
111.基因编辑机器通常包括在靶细胞基因组中诱导单链或双链断裂的一个或多个元件。例如,编辑机器可以是任何dna修饰酶,但优选是定点核酸酶。定点核酸酶优选基于crispr,但也可以是大范围核酸酶、转录激活因子样效应物核酸酶(talen)或锌指核酸酶。
例如,核酸酶可以是cas9或cfp1/cas12a。在一个方面,核酸酶被设计为切割dna,目的是在靶位点产生小的缺失或重复。由此产生的小的缺失和重复可以敲除基因功能。
112.在另一方面,dna修饰酶是定点的碱基编辑酶,例如cas9胞苷脱氨酶或cas9腺嘌呤脱氨酶,其中cas9可以使其一种或两种核酸酶活性失活,即dcas9。
113.在又一个实施方案中,基因编辑机器可以与额外的修复模板组合,使得切割之后是同源定向修复(hdr),导致靶位点处dna的修饰或替换。在这种情况下,单倍体诱导物的目的是作为一种手段,将基因编辑机器从可转化系快速转移到任何其他系中,而无需经过组织培养阶段或重复回交。
114.可以使用的基因编辑机器将在下面进行更详细的讨论。
115.a.链断裂诱导元件
116.i.crispr/cas
117.在优选实施方案中,在靶细胞基因组中诱导单链或双链断裂的元件是crispr/cas系统。与其他动物模型系统一样,靶细胞内cas9和sgrna的表达足以修饰植物基因组(deepa,et al.,front.plant sci.,9:985(2018),doi:10.3389/fpls.2018.00985。虽然cas9是常用的,但任何基于crispr/cas的系统,例如cfp1/cas12a都可以以类似的方式使用(tang,et al.,genome biology,19(84)(2018),doi/10.1186/s13059-018-1458-5)。广泛使用的rna聚合酶ii启动子(如35s或zmub1)通常用于表达cas基因,但在卵细胞中表达的启动子可能更适用于当前的应用。植物特异性rna聚合酶iii启动子[atu6(拟南芥);tau6(小麦);osu6或osu3(水稻)]已用于在植物系统中表达sgrna。其他实施方案可能涉及由其他启动子驱动的多重指导rna系统(lowder,et al.,plant physiol.,169(2):971-985(2015),he,etal.,j genet genomics,20;44(9):469-472(2017))。cas基因可能是完全功能性的,并被设计为产生双链断裂,所述双链断裂通过非同源末端连接(nhej)修复,导致敲除基因功能的突变。或者,cas基因可以部分失活以导致单链缺口(例如ncas9),或完全失活(例如dcas9)结合而不切割,但简单地将另一种酶如腺嘌呤或胞苷脱氨酶引导至所需位点(eid,et al.,biochem j,475(11):1955-1964(2018))。有几种商业上可用的载体用于在植物系统中表达cas9或cas9变体和grna,并且包括具有植物rna聚合酶iii启动子的空grna骨架和grna支架,技术人员可以将目标grna插入grna支架中。基于crispr的系统也可以调整为通过同源性定向修复来改变基因,如下所述。一个限制是crispr应用使用包括短原间隔区相邻基序(pam位点)的序列。
[0118]
诱导物植物的基因组可以包括编码cas酶的一种或多种核酸和指导rna作为crispr系统的组分。诱导物植物的基因组可以任选地包括供体多核苷酸序列,以在靶位点(例如,由cas9诱导的单或双链断裂位点)处或附近重组到靶细胞的基因组中。
[0119]
制备用于使用crispr/cas系统进行基因组编辑的组合物的方法在例如wo 2013/176772、wo 2014/018423、cong,science,15:339(6121):819-823(2013),和jinek,et al.,science,337(6096):816-21(2012)中进行了详细描述。
[0120]
一般来说,“crispr系统”统指参与crispr相关(“cas”)基因表达或指导其活性的转录物和其他元件,包括cas蛋白或编码cas基因的序列、tracr(反式激活crispr)序列(例如tracrrna或活化的部分tracrrna)、tracr-mate序列(在内源性crispr系统的上下文中包含“直接重复”和tracrrna处理的部分直接重复)、引导序列(在内源crispr系统上下文中也
称为“间隔区”)或来自crispr基因座的其他序列和转录物。可操作地连接到引导序列(例如,直接重复-间隔区-直接重复)的一个或多个tracr mate序列也可以被称为加工前的pre-crrna(pre-crispr rna)或被核酸酶加工后的crrna。
[0121]
在一些实施方案中,如cong,science,15:339(6121):819-823(2013)和jinek,et al.,science,337(6096):816-21(2012)中所述,tracrrna和crrna连接并形成嵌合crrna-tracrrna杂交体,其中成熟的crrna通过合成茎环与部分tracrrna融合,以模拟天然crrna:tracrrna双链体。单个融合的crrna-tracrrna构建体在本文中也称为指导rna或grna(或单指导rna(sgrna))。在sgrna中,crrna部分可以被识别为“靶序列”,tracrrna通常被称为“支架”。
[0122]
在一些实施方案中,crispr系统的一个或多个元件源自i型、ii型或iii型crispr系统。在一些实施方案中,crispr系统的一个或多个元件源自包括内源性crispr系统的特定生物体,例如酿脓链球菌(streptococcus pyogenes)。
[0123]
通常,crispr系统的特征在于促进在靶序列位点形成crispr复合体的元件(在内源性crispr系统的上下文中也称为原间隔区)。在crispr复合体的形成的上下文中,“靶序列”指的是引导序列被设计为与其具有互补性的序列,其中靶序列和引导序列之间的杂交促进crispr复合体的形成。靶序列可以是任何多核苷酸,例如dna或rna多核苷酸。在一些实施方案中,靶序列位于细胞的细胞核或细胞质中。
[0124]
在靶核酸中,每个原间隔区与原间隔区邻近基序(pam)相关,其识别对单个crispr系统是特异的。在酿脓链球菌crispr/cas系统中,pam是核苷酸序列ngg。在嗜热链球菌(streptococcus thermophiles)crispr/cas系统中,pam的核苷酸序列为nnagaaw。tracrrna双链体通过crrna的间隔区和原间隔区dna之间的异源双链体形成将cas导向由原间隔区和必需pam组成的dna靶点。
[0125]
一旦确定了所需的dna靶序列,就有许多资源可用于帮助从业者确定合适的靶位点。参见例如crispr.u-psud.fr/,一种工具,旨在帮助科学家在广泛的物种中找到crispr靶向位点,并生成合适的crrna序列。
[0126]
在一些实施方案中,将驱动crispr系统的一个或多个元件表达的一种或多种多核苷酸引入诱导物植物的基因组中,使得crispr系统元件的表达指导在一个或更多个靶位点形成crispr复合体。例如,cas酶和连接到tracr-mate序列的一个或多个引导序列,以及tracr序列可以各自可操作地连接到单独表达构建体(例如sgrna)上的单独调控元件。或者,由相同或不同的调控元件表达的两个或多个元件可以组合在单个构建体中,其中一个或更多个额外的构建体提供不包括在第一构建体中的crispr系统的任何组分。组合在单个构建体中的crispr系统元件可以以任何合适的方向布置,例如一个元件相对于第二个元件位于5’(“上游”)或3’(“下游”)。一个元件的编码序列可以位于第二元件的编码序列的相同或相反的链上,并且以相同或相反方向定向。在一些实施方案中,单个启动子驱动编码crispr酶的转录物和一个或多个引导序列、tracr mate序列(任选地可操作地连接到引导序列)和嵌入一个或更多个内含子序列内的tracr序列(例如,每个在不同的内含子中,两个或更多在至少一个内含子中或全部在单个内含子中)的表达。在一些实施方案中,crispr酶、引导序列、tracr mate序列和tracr序列可操作地连接到同一启动子并从其表达。
[0127]
在一些实施方案中,构建体包括可操作地连接到编码crispr酶例如cas蛋白的酶
编码序列的调控元件。
[0128]
cas蛋白的非限制性实例包括cas1、caslb、cas2、cas3、cas4、cas5、cas6、cas7、cas8、cas9(也称为csnl和csxl2)、caslo、csyl、csy2、csy3、csel、cse2、cscl、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmrl、cmr3、cmr4、cmr5、cmr6、csbl、csb2、csb3、csxl7、csxl4、csxlo、csxl6、csax、csx3、csxl、csxl5、csfl、csf2、csf3、csf4及其同源物,或其修饰版本。在一些实施方案中,未修饰的crispr酶具有dna切割活性,例如cas9。在一些实施方案中,crispr酶在靶序列的位置(例如在靶序列内和/或靶序列的互补序列内)引导一条或两条链的切割。
[0129]
在一些实施方案中,构建体编码crispr酶,该crispr酶相对于相应的野生型酶突变,使得突变的crispr酶缺乏切割含有靶序列的靶多核苷酸的一条或两条链的能力。例如,酿脓链球菌cas9的ruvc i催化结构域中的天冬氨酸-丙氨酸取代(d10a)将cas9从切割两条链的核酸酶转化为切口酶(切割一条链)。使cas9成为切口酶的突变的其他实例包括但不限于h840a、n854a和n863a。作为进一步的实例,可以突变cas9的两个或多个催化结构域(ruvc i、ruvc ii和ruvc iii)以产生基本上缺乏所有dna切割活性的突变的cas9。在一些实施方案中,d10a突变与h840a、n854a或n863a突变中的一个或多个组合以产生基本上缺乏所有dna切割活性的cas9酶。在一些实施方案中,当突变酶的dna切割活性相对于其非突变形式小于约25%、10%、5%》、1%》、0.1%》、0.01%或更低时,crispr酶被认为基本上缺乏所有dna切割活性。
[0130]
在一些实施方案中,编码crispr酶的酶编码序列被密码子优化以在特定细胞中表达。各种物种对特定氨基酸的某些密码子表现出特殊的偏好。密码子偏倚(生物体之间密码子使用的差异)通常与信使rna(mrna)的翻译效率相关,而信使rna的翻译效率又被认为取决于被翻译密码子的性质和特定转移rna(trna)分子的可用性等。
[0131]
细胞中所选trna的优势通常是肽合成中最常用的密码子的反映。因此,基于密码子优化,可以为给定生物体中的最佳基因表达定制基因。例如,在“密码子用法数据库”中,可以容易地获得密码子用法表,这些表可以通过多种方式进行调整。参见nakamura,y.,et al.,nucl.acids res.,28:292(2000)。用于在特定宿主细胞中表达的特定序列的密码子优化的计算机算法,例如gene forge(aptagen;jacobus,pa),也是可用的。在一些实施方案中,编码crispr酶的序列中的一个或多个密码子(例如,1、2、3、4、5、10、15、20、25、50或更多,或所有密码子)对应于特定氨基酸的最常用密码子。
[0132]
虽然不同工程化crispr系统的具体情况可能有所不同,但总体方法是相似的。对使用crispr技术靶向dna序列(使用许多可用的在线工具之一鉴定)感兴趣的从业者可以将包含靶序列的短dna片段插入到指导rna表达构建体中。sgrna表达构建体包含靶序列(约20个核苷酸)、tracrrna序列的一种形式(支架)以及合适的启动子和靶细胞中适当处理所需的元件。在一些实施方案中,通过将多个表达盒与rna聚合酶iii启动子链接在一起,或通过工程化长rna,从一个构建体表达多个指导rna,所述长rna包括trna或核酶自切割位点,核酶自切割位点释放多个功能性sgrna,其靶向一个或多个基因(cermak,et al.,plant cell,29(6):1196-1217(2017),he,et al.,j genet genomics,44(9):469-472(2017))。载体可商购(例如,参见addgene)。许多系统依赖于定制的互补寡聚体,这些寡聚体退火形成双链dna,然后克隆到sgrna表达质粒中。sgrna和来自细胞中相同或不同构建体的适当cas
酶的共表达导致在所需靶位点的单链或双链断裂(取决于cas酶活性)。crispr/cas基因编辑方法与cenh3单倍体诱导系统完全兼容,这两种技术可以有用地结合起来,以促进基因型独立的基因编辑。
[0133]
ii.锌指核酸酶
[0134]
在一些实施方案中,在靶标植物基因组中诱导单链或双链断裂的元件是核酸构建体或编码锌指核酸酶(zfn)的构建体。zfn通常是融合蛋白,其包含源自锌指蛋白的dna结合结构域,所述锌指蛋白连接至切割结构域,例如iis型酶fok i(miller,et al.,nature biotechnology,25:778-785(2007))。fok i催化dna在一条链上自识别位点的9个核苷酸和另一条链上自识别位点的13个核苷酸处的双链断裂。另请参见u.s.pat.no.5,356,802;5,436,150和5,487,994;以及li et al.proc.,natl.acad.sci.usa 89(1992):4275-4279;li et al.proc.natl.acad.sci.usa,90:2764-2768(1993);kim et al.proc.natl.acad.sci.usa.91:883-887(1994a);kim et al.j.biol.chem.269:31,978-31,982(1994b)。这些酶中的一种或多种(或其酶功能片段)可用作切割结构域的来源。
[0135]
在国际公开wo 07/014275中描述了示例性的iis型限制酶。另外的限制酶还含有可分离的结合和切割结构域。例如,参见roberts et al.nucleic acids res.,31:418-420(2003)。在某些实施方案中,切割结构域包括一个或多个工程化切割半结构域(也称为二聚化结构域突变体),其最小化或防止同二聚化,如美国公开申请号2005/0064474、2006/0188987和2008/0131962中所述。在某些实施方案中,切割半结构域是野生型fok i切割半结构域的突变体。在一些实施方案中,切割半结构域被修饰以包括核或其他定位信号、肽标签或其他结合结构域。
[0136]
原则上,dna结合结构域可以设计为靶向任何目标基因组位置,可以是cys2his2锌指的串联阵列,每个锌指通常识别靶dna序列中的三到四个核苷酸。通过将多个锌指连接在一起(数量不同:在已发表的研究中,每个单体使用了三到六个锌指),zfn对可以设计为与18-36个核苷酸长的基因组序列结合。
[0137]
另一种锌指,称为cys2cys2锌指,结合在一系列dna结合蛋白中发现的2对半胱氨酸之间的锌。
[0138]
zfn的dna结合结构域可以由两到六个锌指组成。每个锌指基序通常被认为识别并结合三碱基对序列,因此,包含更多锌指的蛋白质靶向更长的序列,因此可能对靶位点具有更大的特异性和亲和力。锌指结合结构域可以被“工程化”以结合到预定的核苷酸序列。例如,参见beerli et al.nature biotechnol.20:135-141(2002);pabo et al.ann.rev.biochem.70:313-340(2001);isalan et al.,nature biotechnol.19:656-660(2001);segal et al.curr.opin.biotechnol.12:632-637(2001);choo et al.,curr.opin.struct.biol.10:41 1-416(2000。
[0139]
标准zfn将切割结构域融合到每个锌指结构域的c末端。为了允许两个切割结构域二聚化和切割dna,两个单独的zfn必须以其c末端相隔一定距离(通常为5至7bp)结合dna的相反链。单链切割和双链切割都是可能的,双链切割可以作为两个不同的单链切割事件的结果发生。锌指诱导的双链断裂的修复通常通过非同源末端连接(nhej)发生,并导致敲除基因功能的突变。锌指核酸酶系统也可以与含有供体分子的第二构建体组合,以通过同源性定向修复插入新的dna序列,如下所述。另参见shukla,et al.,nature,459,437-441
(2009)。
[0140]
另请参见u.s.pat.nos.6,140,081;6,453,242;6,534,261;6,610,512;6,746,838;6,866,997;7,067,617;u.s.公开申请号2002/0165356;2004/0197892;2007/0154989;2007/0213269;以及国际专利申请公开号wo98/53059和wo 2003/016496,获得进一步的设计考虑。
[0141]
锌指核酸酶的优势是可以靶向任何位点,并且不受cas9靶向所需pam位点的限制。锌指核酸酶方法与cenh3单倍体诱导系统完全兼容,这两种技术可以有用地结合,以促进基因型独立的基因编辑。
[0142]
iii.转录激活因子样效应物核酸酶
[0143]
在一些实施方案中,在靶标植物基因组中诱导单链或双链断裂的元件是编码转录激活因子样效应物核酸酶(talen)的一个或多个核酸构建体。talen具有与zfn相似的总体结构,主要区别在于dna结合结构域来自tal效应蛋白,转录因子来自植物病原菌。talen的dna结合结构域是氨基酸重复序列的串联阵列,每个重复序列长约34个残基。这些重复彼此非常相似;通常它们主要在两个位置(氨基酸12和13,称为重复可变二残基,或rvd)不同。每个rvd指定优先结合四种可能的核苷酸之一,这意味着每个talen重复序列结合单个碱基对,尽管已知nn rvd除了结合鸟嘌呤外还结合腺嘌呤。与锌指系统一样,rvd连接在一起以赋予独特靶位点特异性,并融合到切割结构域,如foki(cermak,et al.,nucleic acids research,39(12)(2011),page e82,doi/10.1093/nar/gkr218)。
[0144]
talen诱导的双链断裂的修复通常通过非同源末端连接(nhej)发生,并导致敲除基因功能的突变。talen还可以与hdr的供体模板组合,如下所述。talen方法的优势是,可以靶向任何位点,并且不受cas靶向所需pam位点的限制。talen方法与cenh3单倍体诱导系统完全兼容,这两种技术可以有用地结合起来,以促进基因型独立的基因编辑。
[0145]
另参见cermak,et al,nucl.acids res.1-11(2011),us公开申请号2011/0145940,miller et al.,nature biotechnol 29:143(2011)以了解进一步的talen设计考虑。
[0146]
b.改变dna序列的基因
[0147]
本文所述的基因组编辑系统的核酸酶活性切割靶dna以在靶dna中产生单链或双链断裂。双链断裂可由细胞以至少两种方式之一修复:非同源末端连接(nhej)和同源定向修复(hdr)。在非同源末端连接中,双链断裂通过断裂末端彼此直接连接来修复。因此,没有新的核酸材料插入位点,尽管在修复过程中可能会丢失或获得一些核酸材料,从而导致可能敲除基因功能的少量缺失或插入。在同源性定向修复中,与切割的靶dna序列具有同源性的供体多核苷酸被用作修复切割的靶标dna序列的模板,导致遗传信息从供体多核苷酸转移到靶dna。因此,可以将新的核酸材料插入/复制到位点中。
[0148]
因此,在一些实施方案中,诱导物植物任选地包括供体多核苷酸,例如作为诱导物植物基因组的片段。同源定向修复导致的靶标植物dna的修饰可用于诱导基因纠正、基因替换、基因标记、转基因插入、核苷酸缺失、基因破坏、基因突变等。
[0149]
在该申请中,供体多核苷酸序列通常包括与靶dna序列同源的序列区域,称为同源臂。同源臂之间的序列可以是引入新特征的天然或工程化序列,如标签、启动子基序、表达的蛋白质基序或其他感兴趣的序列。在hdr期间,同源臂用于指导双链断裂的修复,导致新
haploids,"in maize plant cell culture protocols,methods in molecular biology,volume 877,pp.161-172,2012)和其他技术,其包括例如秋水仙碱、拿草特、dithipyr、氟乐灵或另一种已知的抗微管剂或其他有丝分裂抑制剂的使用。然后,该品系可直接用于下游育种项目。
[0162]
易用性应使其在与基于单倍体构建的其他技术结合时特别通用。一个这样的应用是合成单性生殖,其中植物被设计成跳过减数分裂并产生二倍体配子;当这些品系与单倍体诱导物杂交时,得到的后代在基因型上与亲本相同(marimuthu,et al.,science,331(6019):876(2011))。另一个应用是染色体工程化领域,其中利用单倍体诱导物将小的、工程化的或完全合成的染色体从一个系快速移动到另一个系(birchler,et al.,current opinion in plant biology,19:76-80(2014))。
[0163]
b.单子叶植物中的基因编辑
[0164]
1.基因编辑方法
[0165]
还提供了同时单倍体诱导和基因编辑的方法。所公开的方法通常包括待诱导系和单倍体诱导系之间的杂交。如上所述,单倍体诱导物通常是杂合的cenh3无效植物,并且还编码单独的crispr/cas9、锌指、talen类型的基因编辑机器,或与允许hdr和基因替换或修饰的碱基编辑酶和/或供体分子组合。
[0166]
在同时编辑加单倍体诱导的情况下,无需组织培养就可以快速、经济高效地生产编辑的作物和优良品系。接受编辑的品系可以是优良种质,在单倍体诱导过程中,编辑机器本身将被清除。同时,产生编辑的加倍单倍体系。
[0167]
基因编辑机器是通过诱导物系递送的。构成基因编辑机器的dna、rna和蛋白质由诱导物系编码并存在于诱导物系中。典型地,基因编辑机器例如通过轰击或农杆菌介导的转化稳定地插入诱导物中。表达编辑机器的转基因单倍体诱导物系可以用作种间或属间远缘杂交中的花粉供体或受体,用于单倍体诱导和同时基因组编辑。
[0168]
将单倍体诱导物(作为雄性或雌性)与靶标系杂交以产生单倍体后代。受精后,编辑机器在消除诱导物染色体之前或期间对非诱导物靶标基因进行编辑。其结果是单倍体胚或植物或种子,其中只包含来自非诱导物亲本的染色体组,其中该染色体组包含已编辑的dna序列。
[0169]
用于内切核酸酶构建体中的启动子通常导致受精前、第一对细胞分裂或其组合期间的内切核酸酶表达。通过使用单倍体诱导物作为雌性,如果在授粉前和细胞发育的第一阶段,内切核酸酶在卵中表达,则在授粉时,内切核酸酶可以立即开始突变靶标序列,并在单倍体诱导物基因组从细胞中丢失之前继续突变靶序列。在有丝分裂的第一阶段,在单倍体诱导物基因组被消除之前,靶向内切核酸酶在靶标系的dna中诱导靶向dna链断裂。这些断裂由njeh修复以产生小的插入或缺失,或由hdr纠正,具体取决于基因编辑应用。
[0170]
单倍体后代基因组可在筛选后代突变之前或之后加倍。一旦这些单倍体个体的基因组加倍,这些个体就可以长大并自花授粉,产生加倍的单倍体种子。可以产生不同的突变,并且可以评估突变事件以确定获得的突变是否具有期望的结果。所公开的方法可以在育种者计划用作育种亲本的所有(或许多)单子叶植物系上进行。如果育种者使用在所有靶标基因座上都具有理想突变的系培育群体,则群体不会分离出理想突变。因此,通过不必选择所需突变的存在,育种工作得以简化。
[0171]
该方法可以产生具有靶标突变的加倍单倍体个体,而无需将期望的靶标突变回交到靶标系中的时间和费用。cenh3单倍体诱导物是基因显性的。当cenh3无效杂交到任何系时,产生的f1本身就成为单倍体诱导物。含有cenh3无效和基因编辑机器的f1个体可以杂交到数百甚至数千个优良系,特别是当诱导物储备系用作雄性时。在一些实施方案中,在不到一年的时间内产生来自多个优良品系的加倍单倍体个体,它们均具有靶向突变。
[0172]
在一些实施方案中,诱导物系可通过包括例如多个内切核酸酶转基因和/或grna和/或供体序列等来靶向2、3、4、5或更多个突变。
[0173]
恢复的加倍单倍体个体可能没有所有期望的突变。在一些实施方案中,在需要多个突变的情况下,可以将具有单个突变的加倍单倍体后代杂交在一起,并且可以筛选f2后代中对于所有所需突变都是纯合的个体。
[0174]
如果将诱导物用作雄性,则恢复的后代将具有靶标系的细胞质。如果需要诱导物的细胞质(例如获得雄性不育细胞质),单倍体诱导物可以用作雌性。如果需要靶标系的细胞质,则可以在靶标系的非突变版本(作为雌性)和靶标系的突变版本(作为雄性)之间进行杂交。
[0175]
2.基因编辑的类型
[0176]
如上所介绍的,合适的基因编辑系统包括但不限于导致突变或碱基编辑的那些,以及通过hdr的靶向序列插入。据信,任何形式的稳定基因编辑过程,无论是通过crispr/cas9、锌指或talen,都可以与cenh3无效组合,以修饰靶标系的基因组。通过使用一种cas9核酸酶和多种grna,可以同时靶向和改变一个以上的位点。
[0177]
当活性cas蛋白靶向某个基因座且未提供供体模板时,一种可能的结果是nhej修复过程中产生的小缺失或插入。如果正确选择了靶标位置,则突变可以在编码序列中产生移码,并取消基因的功能,或者改变启动子以改变表达模式。如果目的是敲除表达,则多个grna经常被靶向编码序列的几个区域。如果多个grna靶向启动子,则可能导致基因表达的显著和有用的变化(rodriguez,et al.,cell,171(2):470-80(2017))。
[0178]
dna序列的靶向诱变也可以通过将一个dna碱基直接转化为另一个而不需要双链断裂(dsb)来实现。例如,胞苷脱氨酶apobec1、腺嘌呤脱氨酶和其他增强成分如尿嘧啶dna糖基化酶(udg)可与cas9(a840h)切口酶或核酸酶失活的死亡cas9(dca9)融合,以指导编辑dna序列,而不引入双链dna断裂(komor et al.,nature,533:420-424(2016)doi:10.1038/nature17946;gaudelli et al.,nature,551:464-471(2017)doi:10.1038/nature24644;komor et al.,science advances,3(8)eaao4774(2017),doi:10.1126/sciadv.aao4774)。这种碱基编辑机器也可以通过单倍体诱导系递送,以直接在其他品种中诱导靶标序列中的碱基编辑。
[0179]
hdr是修复染色体中dsb的一种备选方法,是一种工程化植物基因组的机制,有助于更细微的dna序列修饰,包括dna校正、靶向敲入或替换,或任何类型的期望突变。hdr发生在细胞分裂期间(ceccaldi,et al.,trends cell biol,26(1):52-64(2016).doi:10.1016/j.tcb.2015.07.009),并且在幼胚的快速细胞分裂期间可能特别活跃。为了支持这一点,下面给出的数据表明hdr可能是通过实施例2的同时单倍体诱导和传递基因编辑产生的植物突变的原因。
[0180]
因此,据信,体内单倍体诱导系统不仅可用于引入蛋白质、rna或dna以切割或转换
靶序列,还可与适当的修复模板一起用于将精确的序列改变引入基因编辑靶向的区域。
[0181]
模板dna可以插入到携带基因组编辑机器(如crispr-cas9系统)的诱导物系基因组中,无论是在相同的转基因基因座中还是在不同的基因座中。当cas9-sgrna和模板dna都存在于诱导的单倍体胚中时,靶序列的切割将导致以同源转基因dna序列作为模板修复染色体断裂。
[0182]
如果所提供的模板含有侧翼为与dsb两侧序列任一个同源的序列的转基因,则可以将转基因引入dsb(同源臂,参见shukla et al.,nature,459:437-441,(2009))。将转基因事件(例如插入目标基因)杂交到单倍体诱导系中。内切核酸酶基因可用于靶向非转基因系中转基因的相对位置。待插入的转基因事件需要在两侧侧翼有与靶位点侧翼dna同源的dna序列。当单倍体诱导物与靶标系杂交时,内切核酸酶将在靶位点引起双链断裂。如果通过hdr使用单倍体诱导物储备系的dna(和转基因)作为模板修复靶标系的dna,则靶标系dna通过将转基因序列置于双链断裂位点来“修复”双链断裂。因此,所公开的方法可用于将转基因置于靶标系中而不必回交。
[0183]
可以通过以下编号的段落进一步理解所公开的组合物和方法。
[0184]
1.着丝粒组蛋白3(cenh3)杂合的单子叶单倍体诱导物植物,其包含二倍体植物细胞,所述二倍体植物细胞包含仅一个编码功能性cenh3蛋白的等位基因。
[0185]
2.段落1所述的单子叶植物,其中所述二倍体植物细胞包含一个编码非功能性cenh3蛋白的cenh3等位基因。
[0186]
3.段落2所述的单子叶植物,其中所述编码非功能性cenh3蛋白的等位基因是蛋白无效等位基因。
[0187]
4.段落2或3所述的单子叶植物,其中所述编码非功能性cenh3蛋白的等位基因是rna无效等位基因。
[0188]
5.段落1-4中任一项所述的单子叶植物,其中所述编码非功能性cenh3蛋白的等位基因是由移码突变引起的,所述移码突变产生消除功能的终止密码子。
[0189]
6.段落1-5中任一项所述的单子叶植物,其中第一二倍体染色体上的内源性cenh3基因座部分或完全缺失。
[0190]
7.段落1-6中任一项所述的单子叶植物,其中第二二倍体染色体上的内源性cenh3基因座是完整的。
[0191]
8.段落1-7中任一项所述的单子叶植物,其中所述功能性cenh3蛋白是野生型cenh3蛋白。
[0192]
9.段落1-8中任一项所述的单子叶植物,其中所述植物缺乏编码野生型cenh3的染色体整合或染色体外转基因。
[0193]
10.段落1-9中任一项所述的单子叶植物,其中所述植物缺乏编码cenh3变体或融合蛋白的染色体整合或染色体外转基因。
[0194]
11.段落10所述的单子叶植物,其中所述植物缺乏的融合蛋白包括绿色荧光蛋白。
[0195]
12.段落10或11所述的单子叶植物,其中所述植物缺乏的融合蛋白是gfp-tailswap。
[0196]
13.段落1-12中任一项所述的单子叶植物,其中所述精子或卵子具有比cenh3纯合野生型植物的精子或卵子少的cenh3,任选地,其中所述精子或卵子相比于野生型植物精子
或卵子具有低于50%的cenh3,优选地,其中所述精子或卵子相比于野生型植物精子或卵子具有在约50%至10%之间,例如50%、25%,或12.5%的cenh3。
[0197]
14.段落1-13中任一项所述的单子叶植物,其中所述植物是玉米、小麦、水稻、高粱、大麦、燕麦、黑小麦、黑麦、珍珠稷、龙爪稷、黍、谷子、香蕉、竹子、甘蔗、柳枝稷、芒草、芦笋、洋葱、大蒜、香葱或山药。
[0198]
15.段落14所述的单子叶植物,其中所述植物是玉米。
[0199]
16.段落1-15中任一项所述的单子叶植物,进一步包含由单子叶植物的细胞表达的外源定点核酸酶。
[0200]
17.段落16所述的单子叶植物,其中所述二倍体植物细胞包含一个编码非功能性cenh3蛋白的cenh3等位基因。
[0201]
18.段落17所述的单子叶植物,其中所述编码非功能性cenh3蛋白的等位基因是蛋白无效等位基因。
[0202]
19.段落17或18所述的单子叶植物,其中所述编码非功能性cenh3蛋白的等位基因是rna无效等位基因。
[0203]
20.段落16-19中任一项所述的单子叶植物,其中所述编码非功能性cenh3蛋白的等位基因是由移码突变引起的,所述移码突变产生消除功能的终止密码子。
[0204]
21.段落16-20中任一项所述的单子叶植物,其中第一二倍体染色体上的内源性cenh3基因座部分或完全缺失。
[0205]
22.段落16-21中任一项所述的单子叶植物,其中第二二倍体染色体上的内源性cenh3基因座是完整的。
[0206]
23.段落16-22中任一项所述的单子叶植物,其中所述功能性cenh3蛋白是野生型cenh3蛋白。
[0207]
24.段落16-23中任一项所述的单子叶植物,其中所述植物缺乏编码野生型cenh3的染色体整合或染色体外转基因。
[0208]
25.段落16-24中任一项所述的单子叶植物,其中所述植物缺乏编码cenh3变体或融合蛋白的染色体整合或染色体外转基因。
[0209]
26.段落25所述的单子叶植物,其中所述植物缺乏的融合蛋白包括绿色荧光蛋白。
[0210]
27.段落25或26所述的单子叶植物,其中所述植物缺乏的融合蛋白是gfp-tailswap。
[0211]
28.段落16-27中任一项所述的单子叶植物,其中所述精子或卵子具有比cenh3纯合野生型植物的精子或卵子少的cenh3,任选地,其中所述精子或卵子相比于野生型植物精子或卵子具有低于50%的cenh3,优选地,其中所述精子或卵子相比于野生型植物精子或卵子具有在约50%至10%之间,例如50%、25%,或12.5%的cenh3。
[0212]
29.段落26-28中任一项所述的单子叶植物,其中所述定点核酸酶由所述单子叶植物的细胞稳定表达。
[0213]
30.如段落29所述的单子叶植物,其中所述定点核酸酶是大范围核酸酶(mn)、锌指核酸酶(zfn)、转录激活因子样效应物核酸酶(talen)或基于crispr的核酸酶,任选地其中,所述核酸酶选自cas9核酸酶、cfp1核酸酶、dcas9-foki、dcpf1-foki、嵌合cas9-胞苷脱氨酶、嵌合cas9-腺嘌呤脱氨酶、嵌合fen1-foki和mega-tal、切口酶cas9(ncas9)、嵌合dcas9
非-foki核酸酶、dcpf1非-foki核酸酶、嵌合cpf1-胞苷脱氨酶和cpf1-腺嘌呤脱氨酶。
[0214]
31.段落29或30所述的单子叶植物,其中所述植物的基因组包含编码核酸酶的异源核酸构建体。
[0215]
32.段落16-31中任一项所述的单子叶植物,进一步包含由所述单子叶植物的细胞表达的指导rna。
[0216]
33.段落29或30所述的单子叶植物,其中所述植物的基因组包含编码grna的异源核酸构建体。
[0217]
34.段落16-33中任一项所述的单子叶植物,其中所述植物的基因组包含供体核酸序列,所述供体核酸序列将通过重组在由所述核酸酶诱导的切割位点处而引入。
[0218]
35.段落16-34中任一项所述的单子叶植物,其中所述植物是玉米、小麦、水稻、高粱、大麦、燕麦、黑小麦、黑麦、珍珠稷、龙爪稷、黍、谷子、香蕉、竹子、甘蔗、柳枝稷、芒草、芦笋、洋葱、大蒜、香葱或山药。
[0219]
36.由段落1-15中任一项所述的植物形成的卵细胞,所述卵细胞缺乏一个编码功能性cenh3蛋白的等位基因,并且相对于由cenh3纯合植物形成的相应卵细胞,包含不超过约12.5%的功能性cenh3蛋白。
[0220]
37.由段落1-15中任一项所述的植物形成的精细胞,所述精细胞缺乏一个编码功能性cenh3蛋白的等位基因,并且相对于由cenh3纯合植物形成的相应卵细胞,包含不超过约25%的功能性cenh3蛋白。
[0221]
38.由段落16-35中任一项所述的植物形成的卵细胞,所述卵细胞缺乏一个编码功能性cenh3蛋白的等位基因,并且相对于由cenh3纯合植物形成的相应卵细胞,包含不超过约12.5%的功能性cenh3蛋白。
[0222]
39.由段落16-35中任一项所述的植物形成的精细胞,所述精细胞缺乏一个编码功能性cenh3蛋白的等位基因,并且相对于由cenh3纯合植物形成的相应卵细胞,包含不超过约25%的功能性cenh3蛋白。
[0223]
40.诱导靶标单倍体单子叶植物形成的方法,包括用来自段落1-15中任一项所述的单子叶单倍体诱导物植物的花粉授粉亲本单子叶靶标植物;以及选择通过授粉产生的至少一个单倍体后代。
[0224]
41.诱导靶标单倍体单子叶植物形成的方法,包括用来自亲本单子叶靶标植物的花粉授粉段落1-15中任一项所述的单子叶单倍体诱导物植物;以及选择通过授粉产生的至少一个单倍体后代。
[0225]
42.段落40或41所述的方法,进一步包括所选单倍体后代的染色体加倍。
[0226]
43.段落42所述的方法,其中所述染色体加倍是自发的或由染色体加倍剂诱导的,所述染色体加倍剂任选地选自秋水仙碱、拿草特、dithipyr、氟乐灵或另一种抗微管剂。
[0227]
44.段落40-43中任一项所述的方法,其中所述单子叶靶标植物选自玉米、小麦、水稻、高粱、大麦、燕麦、黑小麦、黑麦、珍珠稷、龙爪稷、黍、谷子、香蕉、竹子、甘蔗、柳枝稷、芒草、芦笋、洋葱、大蒜、香葱或山药。
[0228]
45.修饰单子叶靶标植物基因组的方法,其包括:
[0229]
诱导靶标单倍体单子叶植物的形成,包括用来自段落16-35中任一项所述的单子叶单倍体诱导物植物的花粉对亲本单子叶靶标植物授粉,以及
tailswap序列。
[0247]
这三个构建体由genscript(www.genscript.com)合成,并克隆到二元载体ptf101.1中(paz,et al.,euphytica 136,167-179(2004))。为了产生cenh3突变,将携带ubi-cas9的转基因系与携带grna-immunecenh3的系杂交。
[0248]
dna提取、基因型分型和序列分析
[0249]
对于标准的叶片基因型分型,使用ctab方案制备基因组dna(clarke,cold spring harbor protocols vol.2009 db.prot5177-pdb.prot5177(2009))。在种子发芽后收集胚乳组织,可以区分有光泽表型。用钳子取出胚和果皮,用研钵和杵将胚乳磨成粉末。用ibi植物基因组dna迷你试剂盒(ibi scientific ib47231)提取胚乳dna。
[0250]
为了鉴定转基因系中immunecenh3和cas9的存在,使用引物cenh3-f2和cenh3-r3扩增immunecenh3,使用引物cas9-f1和cas9-r1扩增cas9(表1)。为了鉴定cas9植物中的原始cenh3突变,使用phusion高保真pcr试剂盒(new england biolabs,ipswich,ma)用表1中的引物cenh3-f1和cenh3-r1(seq id no:4-14,按表中出现的降序排列)进行pcr。
[0251][0252]
pcr产物直接进行sanger测序或使用topo ta克隆试剂盒(thermo fisher#k457501)克隆,然后进行sanger测序。
[0253]
在缺乏immunecenh3的系中,通过pcr和限制性酶切将cenh3无效等位基因与天然cenh3等位基因区分开来。使用引物cenh3-f2和cenh3-r2通过pcr扩增496bp的pcr产物。当用限制性内切酶alwni(new england biolabs)酶切该产物时,野生型等位基因被切割成大小为284bp和212bp的两个片段,而突变的cenh3等位基因未被切割。
[0254]
使用引物cenh3-f4、cenh3-r4和mumix(表1中两个引物mu1和mu2的1:1混合)对cenh3-mu1015598等位基因进行评分。野生型等位基因用cenh3-f4和cenh3-r4扩增,而mu等位基因则用cenh3-f4和mumix扩增。
[0255]
倍性评价
[0256]
将+/cenh3杂交后代在室内光照下生长10-13天,并向幼苗喷水以鉴定有光泽表型。随后通过流式细胞术分析所有有光泽的植物。对于每个个体,收集约1g快速冷冻的叶或根,并将其切碎至1.5ml预冷冻的细胞核提取缓冲液(2mm edta、15mm tris-hcl ph 7.5、20mm nacl、80mm kcl、0.5mm精胺、15mm 2-巯基乙醇、0.1mm pmsf、0.1%triton x-100)中。切碎后,混合物通过40μm细胞过滤器过滤两次。用4,6-二脒基-2-苯基吲哚对细胞核进行染色,并将其上样至由佐治亚大学ctegd细胞计数共享资源实验室拥有的流式细胞仪中。
[0257]
染色体扩散
[0258]
染色体分析如(dawe,et al.,cell 173,839
–
850.e18(2018))所述进行。简而言之,从单倍体和二倍体植物中收集根尖,在一氧化二氮室中孵育三小时,并用90%乙酸固定。用刀片切割根尖,并在37℃的酶溶液(1%果胶酶y-23,2%纤维素酶onozuka r-10)中消化50分钟。根部切片在乙醇中洗涤,然后浸入90%乙酸中。使用金属镐压碎根尖,将10μl细胞悬浮液滴到显微镜载玻片上。使用prolong gold和dapi(thermo fisher cat#p36931)干燥载玻片并用玻璃盖玻片封固。载玻片在zeiss axio imager.m1荧光显微镜上成像,所述显微镜带有63x plan apo chromat油物镜,以及用于分析数据的slidebook软件(intelligent imaging innovations,denver,co,usa)。
[0259]
单倍体和非整倍体的粗略测序(skim sequencing)
[0260]
对于每个样品,12ng/μl dna用diagenode bioruptor在100μl体积中以30秒的开关间隔在高设置下超声处理7分钟,产生平均长度约500bp的片段。使用kapa hyperprep试剂盒(kk8502)和kapa单索引连接物(kk8700)制备dna测序文库。将600ng超声处理的dna用作每个样品的输入,并使用3个pcr循环来扩增文库。使用cutadapt版本1.9.1(martin等人,embnet.journal vol.17 10(2011))对150nt illumina测序读段进行连接物修整和质量过滤,参数如下:
“‑
q 20-aagatcggaagagc-e.05-o 1-m 50”(seq id no:15)。在单末端模式下,使用默认参数,使用bwa mem版本0.7.15将读段与zm-b73-reference-nam-5.0比对(li,&durbin,bioinformations vol.251754-1760(2009))。使用igvtools 2.3.98版(thorvaldsd
ó
ttir,et al.,brief.bioinform.14,178
–
192(2013))可视化读段覆盖率,覆盖率以25mb间隔计算。
[0261]
结果
[0262]
加倍单倍体育种被广泛用于加速新近交系的生产(kalinowska,et al.,theor.appl.genet.132,593
–
605(2019))。在整个玉米育种行业中使用的一种常见方法,涉及利用干扰受精的突变体产生单倍体(kelliher,et al.,nature 542,105
–
109(2017),liu,et al.,mol.plant 10,520
–
522(2017),gilles,et al.,embo j.36,707
–
717(2017),yao,et al.,nat plants 4,530
–
533(2018),zhong,et al.,nat plants 6,466
–
472(2020))。simon chan及其同事开创了一种完全不同的诱导单倍体的方法,他们发现将拟南芥系与结构改变的着丝粒组蛋白h3(cenh3)杂交产生单倍体和非整倍体,频率高达25-45%(ravi和chan,nature 464,615-618(2010))。cenh3是一种组蛋白变体,它定义着丝粒位置
并招募覆盖的动粒蛋白(cheeseman&desai,nat.rev.mol.cell biol.9,33
–
46(2008),black&bassett,curr.opin.cell biol.20,91
–
100(2008))。最初的研究涉及一种称为gfp尾交换的构建体,其中cenh3的n末端尾部用gfp标签修饰,但是cenh3点突变和小缺失也可以以类似的频率诱导单倍体(karimi-ashtiyani,et al.,proc.natl.acad.sci.u.s.a.112,11211
–
11216(2015),kuppu,et al.,plos genet.11,e1005494(2015),kuppu,et al.,plant biotechnol.j.(2020)doi:10.1111/pbi.13365)。除拟南芥外,着丝粒介导的单倍体诱导已被证明不太有效,通常产生《1%的单倍体(kalinowska,et al.,theor.appl.genet.132,593
–
605(2019))。
[0263]
本研究旨在研究着丝粒介导的玉米单倍体诱导机制,最初使用gfp-tailswap方法。然而,这种方法由于需要天然cenh3突变体和补充突变体的功能性gfp-tailswap转基因而变得很复杂。另一组已经显示了使用由罗伯逊突变体(mu)插入基因的5'utr引起的现有玉米突变体(cenh3-mu1015598)的一些成功(kelliher,et al.,front.plant sci.7,414(2016),feng,et al.,plant j.(2019)doi:10.1111/tpj.14606))。他们将gfp-tailswap杂交到cenh3-mu1015598背景中,当作为雄性杂交时观察到平均0.86%的单倍体,而当作为雌性杂交时没有单倍体(kelliher,et al.,front.plant sci.7,414(2016))。获得了cenh3-mu1015598,并对三株杂合植株进行了自交。基因型分型显示,两个穗分离出低频率的纯合子突变体,这些突变体生长到各种成熟状态(表2)。
[0264]
表2:cenh3-mu1015598突变体不是无效的*。
[0265][0266]
*wt表示野生型,het表示+/cenh3-mu1015598杂合子,hom表示cenh3-mu1015598/cenh3-mu1015598纯合子。注意,前两株植物产生了纯合的cenh3-mu1015598后代。
[0267]
纯合突变体的恢复表明,cenh3-mu1015598不是无效的,并且先前的结果可能被低水平的野生型cenh3表达所混淆。cenh3-mu1015598等位基因的可变外显率可以通过以下事实来解释:当mu元件插入5'utr区域时,mu元件可以促进低水平的表达(barkan&martienssen,proc.natl.acad.sci.u.s.a.88,3502
–
3506(1991))。
[0268]
为了克服针对真实无效cenh3等位基因的选择,使用双构建体crispr/cas9方法创建了cenh3无效基因。用由泛素启动子驱动的表达cas9的简单构建体转化一个系。第二种是用表达靶向天然cenh3基因第四外显子的grna和包含全长天然cenh3基因的“immunecenh3”基因的构建体转化的,该全长天然cenh3基因在grna靶区具有五个沉默的核苷酸变化(图1a,1b)。两个系杂交后,cas9在天然cenh3基因中产生突变,但转基因未受影响。选择了具有单核苷酸缺失的cenh3等位基因,该等位基因在cenh3的n末端尾部产生立即终止密码子(图1c)。在存在immunecenh3的情况下,cenh3突变分离为简单的孟德尔隐性性状(表3)。
[0269]
表3:immunecenh3和tailswapcenh3背景中cenh3的分离*。
[0270][0271]
*括号中的数字显示了每种基因型的植物数量。
[0272]
然后用tailswapcenh3(拟南芥gfp-tailswap构建体的接近的复制品)创建转基因,并将其与cenh3突变杂交。未获得含有tailswapcenh3和cenh3纯合的植物(表3),表明转基因不互补真实的无效(图4a)。
[0273]
在这些研究过程中,发现在没有immunecenh3的情况下,有时会传递cenh3。通过与野生型系杂交,获得了简单的分离的cenh3系,该系缺少两个原始转基因。在+/cenh3系的自交后代中,有163+/+个野生型个体、55+/cenh33杂合子和零个cenh3/cenh3纯合子,这表明该突变体是纯合致死的,并且通过配子体传递很差。+/cenh3杂合子与野生型植物之间也进行了交互杂交。孟德尔性状通常传递给50%的测交后代,但观察到,通过雄性杂交时,只有12.1%的后代接受了cenh3,当通过雌性杂交时,有25%的后代接受cenh3(表4)。
[0274]
表4:通过雄性和雌性杂交传递cenh3*。
[0275][0276]
*wt表示野生型,het表示+/cenh3杂合子,hom表示cenh3/cenh3纯合子。
[0277]
传递减少的原因可能是精子和卵子携带在多细胞单倍体配子体中。两次单倍体细胞分裂先于精子的形成,三次单倍体细胞分化先于卵子的形成。具有cenh3等位基因的配子体必须使用从孢子体阶段携带的cenh3,同时在每个细胞周期中对其进行自然稀释(lermontova,et al.,plant cell 18,2443
–
2451(2006))。在这个模型下,相对于cenh3杂合亲本,cenh3精子将具有约为正常水平的1/4的cenh3含量,而携带cenh3的卵子将具有约1/8的cenh3含量(图4b)。假设没有剂量补偿,相对于正常纯合野生型亲本,这些值将额外减少1/2。因此,携带cenh3的精子和卵子可能具有较小的着丝粒。
[0278]
为了测试+/cenh3杂合子突变体是否能够诱导单倍体,将cenh3杂合子与测试品系在两个方向上杂交。在第一次测试中,野生型和+/cenh3植物被杂交到5号染色体上隐性
glossy8(gl8)突变的纯合系,该突变导致幼苗叶片具有发光的外观(xu,et al.,plant physiology vol.115 501
–
510(1997))。观察到,当+/cenh3杂合子作为雄性杂交时,0.5%的后代是有光泽的,而当+/cenh3植物作为雌性杂交时,5.0%的后代是单倍体(表5)。
[0279]
[0280]
流式细胞仪分析显示,所有有光泽的植物都是单倍体(图2a-2b),这一解释通过对三种植物的根尖细胞中的染色体进行计数得到了证实(图2c-2d)。当生长到成熟时,单倍体植株是短而不育的(chase,bot.rev.35,117
–
168(1969))(fig.2e-2f)。此外,还观察到了两种具有矮化表型的无光泽植物,这些植物被认为是非整倍体。这两种植物与六个单倍体一起进行了粗略测序。虽然单倍体表现出一致的序列覆盖率,但矮化植株没有;一个是3号染色体的三体,另一个是2号和4号染色体的单体,10号染色体的三体(图3a-3b)。
[0281]
第二组测试使用具有相似表型但在第7号染色体上突变的glossy1(gl1)进行(sturaro,et al.,plant physiol.138,478
–
489(2005))。在这些杂交中,还对发芽率进行了评分,这是一种核型异常的间接测量,通常用于对拟南芥单倍体诱导物的功效进行评分(kuppu,et al.,plos genet.11,e1005494(2015),ravi,et al.,nature communications vol.5(2014),maheshwari,et al.,plos genet.11,e1004970(2015))。在+/cenh3杂合子为雌性的杂交中,5.2%的后代表现出有光泽表型,并且通过流式细胞仪测量为单倍体。另外3.3%的后代表现出有光泽表型,但dna含量高于单倍体预期的dna含量,并被评分为非整倍体(表6)。
[0282][0283]
不同的杂交在发芽率(65-91%)、单倍体频率(1.2-8.9%)和非整倍体频率(2.1-5.1%)方面差异很大(表6)。来自五个非整倍体植物的序列数据证实,除一个外,所有植物都缺失了第7号染色体,有时还伴随着其他染色体的缺失。一种看起来有两个完整拷贝的7号染色体的有光泽植物可能有一个小的中间缺失,这是粗略测序无法检测到的(片段非整
倍体在拟南芥gfp-tailswap杂交中很常见(tan,et al.,elife 4,(2015)))。gl1测试的结果更符合在拟南芥中观察到的结果,其中任何给定的与gfp-tailswap的杂交通常产生相似比例的单倍体和非整倍体(ravi和chan,nature 464,615-618(2010),ravi,et al.,nature communications vol.5(2014),maheshwari,et al.,plos genet.11,e1004970(2015)).
[0284]
如果cenh3稀释是单倍体诱导的基本机制,那么只有携带来自+/cenh3亲本的cenh3突变的配子才能诱导单倍体。不幸的是,由于单倍体诱导物的基因组丢失,无法对幼苗是否存在cenh3等位基因进行评分。然而,来自拟南芥gfp-tailswap杂交的数据表明,当幼苗是单倍体时,胚乳很少显示出完全的单亲本基因组消除(ravi,et al.,nature communications vol.5(2014))。如果玉米也是如此,胚乳的基因型可以用来确定幼苗的原始基因型。对一组由+/cenh3 x gl8杂交产生的11个单倍体植株的残余胚乳进行了基因型分型。结果表明,所有11个都是cenh3等位基因杂合的,有力地支持了单倍体诱导是cenh33配子中低cenh3水平的结果的解释。
[0285]
着丝粒介导的单倍体诱导的一个显著要素是,它仅在后代子集中有效。在一些个体中,单倍体诱导物亲本的所有染色体都丢失了,而在另一个更大的子集中,没有发生染色体丢失。相对较小的非整倍体类别代表“部分单倍体诱导”事件,其中一些染色体丢失,但其他染色体存活。gl8杂交比gl1杂交产生更多真正的单倍体的事实,可能与前者在夏季进行而后者在冬季进行的事实有关。选择方案也可能发挥了作用。使用高频率产生单体的玉米r-x1缺失系的研究表明,一些染色体以比其他染色体更高的频率恢复为单体
28
。5号染色体(具有gl8)的单体很少被恢复,而7号染色体(具有gl1)的单体则更为常见(更常见17倍)(weber,use of maize monosomics for gene localization and dosage studies.在the maize handbook(eds.freeling,m.&walbot,v.)中350
–
358(springer new york,1994)))。事实上,来自gl1杂交的五个测序非整倍体中的两个为仅7号染色体的单体(表6)。这些数据可能表明,gl8测试者有利于单倍体的恢复,而gl1测试者恢复更广泛的倍性。
[0286]
据信,所有关于着丝粒介导的单倍体诱导的先前文献都描述了无效等位基因与cenh3变体或产生改变的或部分缺失形式的cenh3的等位基因的互补(ravi和chan,nature 464,615
–
618(2010),karimi-ashtiyani,et al.,proc.natl.acad.sci.u.s.a.112,11211
–
11216(2015),kuppu,et al.,plant biotechnol.j.(2020)doi:10.1111/pbi.13365,maheshwari,et al.,plos genet.11,e1004970(2015),ishii,et al.,annu.rev.plant biol.67,421
–
438(2016))。这些数据用于支持最初的解释,即与其它可能的机制相比(wang&dawe,molecular plant vol.11 398
–
406(2018),karimi-ashtiyani,et al.,proc.natl.acad.sci.u.s.a.112,11211
–
11216(2015),ravi,et al.,plos genet.7,e1002121(2011),wang,et al.,plant methods 15,42(2019),sanei,et al.,proc.natl.acad.sci.u.s.a.108,e498
–
505(2011),tan,et al.,elife 4,(2015)),单倍体诱导是由两种结构不同的cenh3形式之间的竞争引起的,并且通过不正确组装的监控机制最终拒绝改变的着丝粒(ravi和chan,nature 464,615
–
618(2010),britt和kuppu,front.plant sci.7,357(2016),kalinowska,et al.,theor.appl.genet.132,593
–
605(2019),kuppu,et al.,plant biotechnol.j.(2020)doi:10.1111/pbi.13365,maheshwari,et al.,plos genet.11,e1004970(2015),copenhaver,&preuss,nat.biotechnol.28,423
–
424(2010))。
[0287]
相反,本文中的数据使用n末端尾部的cenh3突变实现了高水平的单倍体诱导,该突变去除了与dna或其他组蛋白相互作用的所有序列。因此,仅cenh3的数量减少可以诱导着丝粒介导的单倍体诱导。cenh3无效方法的主要优点是植物生长旺盛,过程简单。任何与cenh3杂交的系都会成为单倍体诱导物。易用性应使其在与基于单倍体构建的其他技术相结合时特别通用,例如合成单性生殖(marimuthu,et al.,science,331(6019):876(2011),wang,et al.,abiotech,1:15
–
20(2020)),工程化染色体从一个系转移到另一个系(birchler,et al.,current opinion in plant biology,19:76-80(2014)),和基因型独立的基因编辑(kelliher,et al.,nat.biotechnol.37,287
–
292(2019))。
[0288]
实施例2:同时基因编辑的单倍体诱导
[0289]
材料和方法
[0290]
cenh3单倍体诱导物的使用涉及同时的单倍体诱导和基因编辑。在该用途的实例中,首先将cenh3无效与包含crispr构建体(表达cas9和一个或多个指导rna两者)的系杂交。该杂交系(同时含有cenh3和crispr组分)然后作为雌性与雄性野生型玉米系杂交。据信,受精后,大约5%的后代将是单倍体,其中大约一半将接受表达cas9和指导rna的crispr构建体。crispr组分在早期合子分裂中表达,在那里可以催化父本基因组的基因组上的基因编辑。在单倍体诱导过程中,母本的基因组将迅速丢失,去除crispr组分,只留下父本基因组,其中一部分将进行持续的基因编辑。
[0291]
为了测试单倍体诱导和同时的基因编辑,设计了实验,将cenh3无效与表达cas9(从泛素启动子)和八个指导rna的crispr构建体杂交,八个指导rna靶向控制植物发育的四个基因:扁化穗-2(fasciated ear-2)(fea2)、扁化穗-3(fea3)、紧凑型植物-2(ct2)和粗穗矮秆-1(td1)。crispr构建体首先通过农杆菌介导的转化引入到称为b104的近交系中。然后将转基因b104系与杂合的cenh3无效植物杂交。从该杂交后代中,将同时具有crispr构建体和cenh3的植物与称为luteus-1的隐性突变的纯合玉米系杂交,以鉴定单倍体。
[0292]
结果
[0293]
在总共192株植物中,有7株被证明是单倍体。共有40个二倍体植物和所有7个单倍体植物进行了基因型分型(通过扩增子sanger测序),以便在每个指导rna位点进行编辑。总体编辑频率较低,在40株二倍体植物中总共进行了5次编辑。然而,重要的是,其中一个单倍体植株在fea2基因上进行编辑。单倍体植株中的编辑赋予了与该突变体的已知隐性表型一致的扁化穗表型(taguchi-shiobara,et al.,genes dev.15:2755
–
2766(2001))。单倍体中1/7的编辑频率与二倍体中5/40的编辑频率大致匹配,这表明,在该小型的早期实验中,编辑在单倍体和二倍体中大致一样有效。
[0294]
更值得注意的事实是,单个编辑属于非标准类型。虽然二倍体中的编辑与非同源末端连接(nhej)的切割和修复一致,但单倍体植株包含两侧各有短的同源区域的插入。这种类型的编辑可能表明错误的同源定向修复(hdr)(xue和greene,trends in genetics,doi:10.1016/j.tig.2021.02.008.(2021))。这些数据提供了理由相信hdr在早期合子分裂期间是活跃的,并且在单倍体诱导物系的染色体丢失之前,在两个基因组都存在的短暂时间内可以发生切割和修复。hdr是许多crispr应用的重要修复形式,涉及用新序列替换启动子或基因(zhang et al.,nat plants,5:778-794(2019))。
[0295]
这些实验的结果如图5a-5d和表7和8所示。图5a是用于同时单倍体诱导和基因编
辑的crispr构建体的质粒图。显示了构建体的成分。
[0296]
[0297][0298]
二倍体植物中的编辑位于grna区域内,与nhej的切割和修复一致。单倍体植株中的编辑是81bp的插入,提示错误的hdr修复,可能是由微同源性的侧翼区域介导的。注释指出了以下特征:指导rna靶区域、pam位点;缺失的碱基(虚线);复制的区域;同源侧翼复制。wt=野生型。
[0299]
用不同的构建体(针对zmgb1)进行的非常小的实验在单倍体中没有检测到编辑,在二倍体中只有少数编辑。
[0300]
除非另有定义,本文使用的所有技术和科学术语具有与所公开的发明所属领域的技术人员通常理解的相同的含义。本文引用的出版物和引用的材料通过引用具体纳入。
[0301]
本领域技术人员将认识到或能够仅使用常规实验来确定本文描述的本发明的具体实施方案的许多等同方案。此类等同方案旨在包含在以下权利要求中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1