脱落酸作为负调控因子在调控植物体内5-羟色胺合成中的应用
1.本发明涉及植物基因工程技术领域,尤其涉及脱落酸作为负调控因子在调控植物 体内5-羟色胺合成中的应用。
背景技术:
2.前期水稻根部蛋白质组学研究表明,5-羟色胺合成基因ost5h敲除可以促进栓质 的沉积。主要表现为两个方面:第一,ost5h基因敲除造成5-羟色胺合成受阻可以促 进次级代谢物质合成基因的表达,这些芳香类次级代谢化合物中就包含有栓质芳香部 的成分,例如p-香豆酸(p-coumaric acid),阿魏酸(ferulic acid);第二,ost5h基因 的缺失也会促进糖酵解途径,其中多个蛋白质表现出上调。糖类作为主要的能源物 质,正常情况下进入tca循环而产能,但是ost5h基因缺失突变中,tca途径被抑 制而脂肪合成途径上调。脂肪类化合物中就包含栓质脂肪部的成分。我们从gc-ms 测定中也证实了敲除ost5h基因促进栓质的合成。芳香部以及脂肪部均表现出上升 的趋势,从而促进其复合物栓质的沉积。所以,在水稻根部中ost5h作为负向调控 因子,抑制栓质的沉积,两者存在拮抗关系。相关研究结果已经在前期专利申请(申 请号:202010914857.x)中进行了详细阐述;表明5-羟色胺抑制栓质合成。
3.aba作为一种抗逆激素已经得到广泛认可,它能够在多种逆境胁迫反应中发挥 调控作用,降低逆境胁迫对植物的损伤。例如高盐胁迫下,aba大量诱导合成, aba可以通过调控气孔开闭,减少水分散失,同时也可以通过诱导抗逆相关基因的 表达,提高植物抗逆性。
4.目前,还未有关于aba是否参与5羟色胺调控途径的研究。
技术实现要素:
5.本发明提供了脱落酸作为负调控因子在调控植物体内5-羟色胺合成中的应用,首 次发现脱落酸与5-羟色胺之间的关系,并进一步地发现脱落酸通过抑制植物体内 ost5h合成基因的表达来负调控植物体内5-羟色胺的浓度,从而促进植物的栓质化, 提高植物的抗盐性,可为保水抗旱型水稻种植资源的培育奠定基础。
6.具体技术方案如下:
7.本发明提供了脱落酸作为负调控因子在调控植物体内5-羟色胺合成中的应用,所 述植物为水稻或拟南芥。
8.进一步地,所述脱落酸通过抑制植物体内ost5h合成基因的表达来负调控植物体 内5-羟色胺的浓度。
9.更进一步地,所述脱落酸为内源脱落酸或外源脱落酸。
10.本发明还提供一种降低植物体内5-羟色胺含量的方法,包括:向植株的根部外源 施加脱落酸;所述植株为水稻或拟南芥;所述脱落酸的浓度为0.1~10μm。
11.与现有技术相比,本发明具有以下有益效果:
12.本发明发现脱落酸与5-羟色胺之间的关系,并进一步发现脱落酸通过抑制植物体 内ost5h合成基因的表达来负调控植物体内5-羟色胺的浓度,从而促进植物的栓质 化,提高植物的抗盐性,可为保水抗旱型水稻种植资源的培育奠定基础。
附图说明
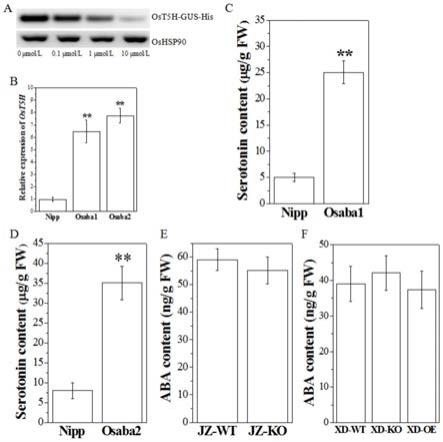
13.图1为实施例1中aba负向调控5羟色胺合成基因ost5h表达的试验结果;
14.其中,a为外源添加5羟色胺对转基因植株ost5hpro::ost5h-gus-his和 oshsp900中ost5h基因表达量的影响结果;b为基因ost5h在野生型植株nipp与 osaba1突变体、osaba2突变体中的表达量结果;c为野生型植株nipp与osaba1突 变体中5羟色胺的浓度;d为野生型植株nipp与osaba2突变体中5羟色胺的含量比 较结果;e为jz-wt植株和jz-ko植株中5羟色胺的含量比较结果;f为xd-wt植 株、xd-ko植株和xd-oe植株中5羟色胺的含量比较结果。
15.图2为不同植株中5羟色胺及aba的测定结果;
16.其中,a为野生型nipp与osaba1突变体中5羟色胺含量测定的液相图谱;b为 野生型nipp与osaba2突变体中5羟色胺含量测定的液相图谱;在锡稻1#背景下, ost5h突变体xd-ko以及ost5h过表达植株xd-oe中aba含量测定的液相-质谱 图;在锡稻1#背景下,ost5h突变体xd-ko以及ost5h过表达植株xd-oe中aba 含量测定的液相-质谱图。
17.图3为在锡稻1#背景下,ost5h敲除突变体xd-ko以及ost5h过表达植株 xd-oe中aba合成通路上各基因的表达量。
18.图4为拟南芥中5羟色胺减弱栓质形成的数据结果;
19.其中,a为拟南芥添加外源5羟色胺后栓质区域变化情况;b为添加外源5羟色 胺后根部栓质化覆盖区域占比,suberized表示完全栓质化,patchy表示不连续栓质 化,non-suberized表示未栓质化;c为拟南芥经aba处理,再经5羟色胺后,栓质区 域变化情况;d为拟南芥经aba处理,再经5羟色胺后,根部栓质化覆盖区域占比, suberized表示完全栓质化,patchy表示不连续栓质化,non-suberized表示未栓质化; e-f为在添加不同浓度5羟色胺且含有75mm nacl的1/2ms培养基中培养的拟南芥 种子的照片、根长浓度结果和生物量结果。
具体实施方式
20.下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施 例,但本发明的保护范围不仅限于此。
21.下列实施例采用的野生型水稻材料为嘉浙b(简称jz-wt),并通过辐射诱变获得 5羟色胺缺失的突变体嘉浙lm(简称jz-ko),该突变体在5羟色胺合成基因ost5h 中缺少一个碱基“g”,导致移码突变;另外,在野生型粳稻品种锡稻一号xi1(简称 xd-wt)的基础上,通过crispr获得5羟色胺合成基因ost5h的沉默品系ost5h-ko (简称xd-ko),过表达品系ost5h-oe(简称xd-oe)。其中,制备突变体嘉浙lm 的方法来自γ射线诱变;制备5羟色胺合成基因ost5h的敲除品系ost5h-ko,过表 达品系ost5h-oe是通过将相应的dna片段连接进载体pcambia1301之中,并通 过农杆菌介导转化水稻愈伤组织获得(制备过程均采用现有技术手段)。
22.下列实施例中所涉及的分子生物学和生物化学方法均为已知的技术,主要参考由 ausubel编写的current protocols in molecular biology,以及green mr和sambrook j 编写的molecular cloning:a laboratory mannual,4th ed.。实施例中所用的实验材料如 无特殊说明均为市售产品。
23.下列实施例中涉及的western印迹法,具体方法为:将研磨均匀的幼苗根部组织 加入至蛋白质提取液中(50mm tris
–
hcl,ph 7.4;2mm edta;2%triton x-100;1mmpmsf;5%mercaptoethanol;20mm naf).取上清,进行sds-page,进行蛋白分离, 湿转,将蛋白转移至pvdf膜,经一抗,二抗孵育之后进行曝光。
24.栓质层染色方法:各种水稻材料的根部切片,滴上荧光黄溶液(0.01%(w/v),用 高温处理1h(70℃),清洗,并用带有gfp过滤器的外荧光显微镜观察。
25.aba方法测定如下:称取0.1g经液氮研磨的粉末,加入1ml甲醇,同时混有稳 定同位素aba-d6作为内标,涡旋震荡,12.000g离心十分钟,取上清。真空旋转离 心直至干燥,加入100μl50%甲醇溶解,取上清。经hplc-ms测定。
26.实施例1
27.1、aba负向调控5羟色胺合成,aba-|5羟色胺
28.为了探究aba与5羟色胺合成酶基因ost5h之间的上下游关系,构建了转基因 植株ost5hpro::ost5h-gus-his。
29.具体构建方法为:构建ost5h启动子(启动子序列如seq id no.2所示)驱动下 的报告基因gus并进行转基因。截取基因ost5h上游2500bp作为启动子区域,通过 pcr的方法扩增获得并连接进载体pcambia1300,形成ost5hpro::ost5h-gus-his 载体,以gus作为报告基因,并以农杆菌转化法将片段转入水稻植株内,并筛选获得 阳性且纯合植株。
30.在水培液中加入不同浓度的aba,依次为0,0.1,1,10μm,对转基因植株 ost5hpro::ost5h-gus-his(简称ost5h-gus-his)处理12小时(以oshsp90作为 内参)。经水培液处理12小时后,提取根部组织蛋白并通过western bloting实验,观 察ost5h的表达是否受到aba处理影响。
31.具体方法如下:取经液氮研磨的根部组织粉末0.1g,加入1ml提取缓冲液(50mmtris-hcl,2mm edta,2%triton x-100,1mm pmsf,20mm naf,5%β-巯基乙醇), 12000g离心10min,取上清即为蛋白粗提取物。蛋白质浓度定量根据thermo scientific 的bca protein assay kit进行测定。sds-page电泳胶的配置:10%分离胶5ml: 1.7ml 30%聚丙烯酰胺,1.3ml1.5m tris-hcl(ph8.8),10%sds 50μl,10%过硫酸铵 50μl,2μl temed加水至5ml。2ml浓缩胶:0.33ml 30%聚丙烯酰胺,0.25ml1 mtris-hcl(ph6.8),10%sds 20ul,10%过硫酸铵20ul,2ul temed,加水至5ml。 蛋白质加入上样缓冲液,100℃煮沸,上样。100v恒定电压下,待样品压缩至一根线, 切换电压至120v进入分离胶。电泳结束前开始准备转膜。剪取适当大小的pvdf 膜,甲醇活化:甲醇10ml浸泡5min,之后加入40ml水,慢慢加入,摇床快速 摇。之后pvdf膜移至转膜缓冲液中,浸泡15min。5
×
转膜缓冲液母液:tris,1.51%; 甘氨酸7.2%。工作转膜缓冲液:20ml母液加20ml甲醇加水至100ml。滤纸在 转膜缓冲液中浸透。依次按照滤纸-pvdf膜-胶-滤纸叠放,每次注意去除气泡,进行 半干转,15v,1-2小时。转膜结束后,ttbs缓冲液(tris:0.242%;nacl:0.8%; hcl:1.48ml,调节ph至7.6;每100ml加100ultween-20)冲洗几次。5%的ttbs 脱脂奶粉进行过夜封闭。之后一抗
进行过夜孵育,二抗孵育1小时。显影主依据 thermo scientific公司的超敏发光液supersignal west dura kit,a液和b液按照1: 1比例混合,现配现用。
32.如图1a所示,ost5h的表达量受到aba的影响而降低,5羟色胺合成基因ost5h 被大大抑制,这种抑制效果伴随着aba浓度升高而变得更加显著。
33.在野生型植株日本晴(nipp)以及aba合成突变体osaba1及osaba2根部组织 rna,并通过定量pcr比较基因ost5h在aba缺陷突变体中的表达量。方法如下: 取0.1g经液氮研磨的植株根部粉末,rna提取方法根据天根rna提取试剂盒;反转 录方法是根据takara反转录试剂盒;rt-pcr定量配方:1μlcdna为模板,10ml 2
×
sybgreen缓冲液,前后引物各0.5μl,补水至20μl。rt-pcr定量方法:94℃充 分变性2min,进入两步法35个循环:变性,94℃,30秒;复性及延伸,60℃,1min。 如图1b所示,从osaba1和osaba2也可以观察到由于aba的缺失对基因ost5h的 抑制效果降低,从而表现出较高的表达水平。
34.同时也比较了野生型及aba突变体中,基因ost5h产物5羟色胺含量。方法 如下:1克叶片,茎秆或者根部组织在液氮中充分研磨至粉末,加入9ml甲醇。10℃ 下,180rpm摇床混匀,充分浸提30min。13,500
×
g,10℃离心15min,可以抽出8 ml的上清液,按照1:4的比例,加入2ml蒸馏水,混匀。c18固相萃取小柱用三 倍柱床体积的甲醇活化,之后用蒸馏水冲洗。将已加水的样品过小柱,流出液回收; 再用10ml 80%的甲醇冲洗,冲洗出来的溶液也回收,与之前的流出液合并。最后, 旋转蒸发,加入500μl 50%的甲醇溶解待测。5羟色胺的含量通过高效液相色谱 (hplc)来测定。分离柱为c18小柱,流动相为10%甲醇。0.3%三氟乙酸,流速 控制在0.8ml/min。流动相分离30分钟之后,用100%甲醇冲洗5min,再用流动 相跑平基线10min,以保证柱子中的其余杂质冲洗干净。检测器波长设置为280nm。
35.如图1c-f和图2a-b所示,从化合物含量测定上,也可进一步证实,无论是突 变体osaba1还是osaba2,aba的缺失促进5羟色胺含量上升。另外一方面,图2c-d 中ost5h突变体jz-ko或是xd-ko,甚至是过表达植株xd-oe均没有表现出aba 含量上的差异,暗示着5羟色胺的缺失或者过量均不会对aba的含量产生影响。从 上述结果中可以观察到aba对5羟色胺的抑制作用,然而在突变体jz-ko(在嘉浙b 背景下ost5h基因因γ射线诱变获得)或者xd-ko(在锡稻1#背景下ost5h基因通 过crispr定点编辑获得),亦或是过表达植株xd-oe(在锡稻1#背景下过表达ost5h 基因)之中,均不影响aba含量。
36.此外,我们通过提取了水稻xd-wt,xd-ko,xd-oe根部的rna进行aba合 成通路上基因的表达分析。方法如下:取0.1g经液氮研磨的植株根部粉末,rna提 取方法根据天根rna提取试剂盒;反转录方法是根据takara反转录试剂盒;rt-pcr 定量配方:1μlcdna为模板,10ml2
×
sybgreen缓冲液,前后引物各0.5μl,补水 至20μl。rt-pcr定量方法:94℃充分变性2min,进入两步法35个循环:变性,94℃, 30秒;复性及延伸,60℃,1min。
37.本实验定量pcr所用引物
38.primer nameforward sequence(5
’‑3’
)reverse sequence(5
’‑3’
)ost5h-os12g0268000caccatcggcgacttcttcccagctccgtcatcacccactccosaba1-os04g0448900ataccacatcctggaagagttaccttcgttgtcggtaatcosaba2-os03g0810800gtttctagtgtcattggagggtcatagggagatacgcagttcaosaba3-os06g0670000gatagacctggaacttgggaaactaacaaggttgggacggaatosaba4-os01g0128300ggatggcgtcgtctcagattggggtgtcgggagtccaggata
osaao3-os07g0282300agatcatgtcggaagaagtcaggatgtagaggctgggtaaaosnecd1-os02g070400ccgttcgtgacgtacttccggaaccaccgcatctccgactosnecd2-os12g0435200tttggtgtaagtggtccgttgcgcgagaagttcggcctgtttosnecd3-os03g0645900tggtgttcaagctccaggagatgctcgccgtactcgaacttggtgagosnecd4-os07g0154100cagcaaccgtgccaaccaacgagccgaacagcagaagcosnecd5-os12g0617400tccacgacttcgccatcaccgcctcctcccacgcattccaca
[0039] 如图3所示,aba合成相关基因的表达量不受5羟色胺的含量的变化而变化。
[0040]
综上所述,aba对5羟色胺合成起到抑制作用,即aba-|5羟色胺。
[0041]
实施例2双子叶植物拟南芥也同样存在“aba-|5羟色胺”调控机制
[0042]
在双子叶植物中,由于目前并没有克隆到5羟色胺合成基因,我们采用直接外源 添加5羟色胺的处理方式。
[0043]
将拟南芥种于含有1μm aba的ms培养基上,之后移栽于含有不同浓度5羟色 胺的ms培养基上,浓度依次:0,20,150,250μm,之后进行根部栓质染色。拟南 芥根部的栓质染色方法为:取5天大小的整株拟南芥,经荧光黄fluorol yellow 088 (0.01%w/v)在70℃条件下染色30分钟,之后用蒸馏水冲洗两次,甲苯胺蓝anilineblue(0.5%w/v)室温下染色30分钟,之后用蒸馏水冲洗两次。用gfp激发光波长观 察栓质情况,分成三种不同程度的栓质沉积状态:未栓质化(non-suberized),不连续 栓质化(patchy),完全栓质化(suberized)。结果如图4所示,从图4a-b中可以观察 到,随着5羟色胺浓度增加,根部栓质逐渐减弱。当浓度达到250μm时,几乎观察 不到栓质沉积(图4a-b)。栓质化的区域(suberized)逐渐减少,而未栓化的区域逐 渐增多(non-suberized)。另一方面,从图4c-d中可以观察到,尽管aba处理可以 促进栓质化的形成,但在此之后再添加5羟色胺则可以弱化栓质的形成,尤其是不连 续栓质化(patchy)比例上升。
[0044]
另外,在含有75mm nacl的1/2ms培养基中,添加不同浓度的5羟色胺,浓度 依次:0,50,100,150,200μm。5羟色胺对栓质的抑制作用,也可以进一步从盐胁 迫实验中反映出来。从图4e中可以发现,将经过3天春化的拟南芥种子点在培养基 上,随着5羟色胺浓度的升高,拟南芥植株表现得更加敏感,同时无论是根长还是植 株生物量都有显著抑制(图4f-g)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1