9-菲酚在稻瘟病防治中的应用
1.本发明属于生物技术领域,具体涉及9-菲酚在稻瘟病防治中的应用。
背景技术:
2.水稻(oryza sativa l.)是重要的粮食作物之一,在粮食生产中占据非常重要的地位,全球近50%的人口以此为主粮,它的安全生产对于保障社会稳定和经济发展至关重要。与其他作物一样,水稻在种植生长发育期间,不可避免地会受到一系列病原菌的侵害,严重影响着水稻的产量及稻米的品质,其中由稻瘟病菌(magnaporthe oryzae)引起的稻瘟病是水稻最严重的病害之一,是世界水稻生产的重大难题,每年可使水稻减产10%~30%,该病害在所有水稻种植区和水稻不同生长期均可发生,具有分布广、危害大的特点,导致水稻严重减产,威胁我国乃至全球粮食生产安全。因此,对稻瘟病菌防治的研究具有重要的经济价值和社会效益。
3.稻瘟菌对水稻的侵染过程主要包括:(1)分生孢子随风雨传播,并粘附在水稻叶片表面;(2)分生孢子萌发,形成芽管;(3)芽管分化形成附着胞;(4)附着胞分化形成侵染钉;(5)侵染钉穿透寄主细胞,并在寄主细胞内形成侵染菌丝,在细胞间进行扩展。稻瘟菌主要靠分生孢子侵染水稻地上部分组织,当分生孢子接触寄主表皮后,萌发形成发芽管,发芽管又特异性分化产生附着胞,附着胞形成侵染钉穿透寄主表皮继而持续进入寄主细胞中,致使寄主植物在5-7d左右出现症状。其中,稻瘟菌成功侵染水稻的关键过程在于形成高度特化的侵染结构——附着胞。附着胞成熟后产生的膨压,能使侵染钉穿透水稻角质层,从而成功侵染水稻细胞。当稻瘟菌不能形成完整的附着胞时,其致病力显著减弱。
4.目前,防治稻瘟病的主要方法是选育抗性品种、药剂防治和田间管理,其中抗病品种多是在“基因对基因”学说基础上的垂直抗性品种,这些品种容易丧失抗病性。化学防治具有经济、高效、方便、迅速等优点,一直是稻瘟病综合治理体系中不可缺少的部分。稻瘟病的防治是全球研究的热点问题。化学防治在病虫害综合防治中占有重要地位,其具有收效迅速,方法简便,急救性强,且不受地域性和季节性限制的特点。
5.9-菲酚(9-phenanthrol,cas编号484-17-3)是一种稠环芳香烃类化合物,红色固体,在临床中常用作ca
2+
激活的非选择性阳离子通道(transient receptor cation channel subfamily m member4,trpm4)抑制剂,用于治疗心肌缺血等症状。目前,9-菲酚在农业生产中的应用未见到报道。
技术实现要素:
6.针对以上技术问题,本发明提供9-菲酚在稻瘟病防治中的应用。
7.本发明提供9-菲酚在制备防控稻瘟病菌药物中的用途。
8.进一步地,所述的9-菲酚在制备抑制稻瘟病菌菌丝生长、孢子萌发药物中的用途。
9.进一步地,所述的9-菲酚在制备干扰稻瘟病菌附着胞形成的药物中的用途。
10.优选地,所述的9-菲酚的浓度为5ug/m-30ug/m。
11.本发明还保护利用9-菲酚防控稻瘟病的方法,包括以下步骤:将9-菲酚溶解在二甲基亚砜中,配置成5000ug/ml的母液,用移液器吸取9-菲酚母液加入到已冷却至55℃的pda培养基中,调制9-菲酚的浓度为5ug/ml-30ug/ml;然后将孢子悬浮液均匀喷洒水稻叶片,使叶片上沾满液滴。
12.与现有技术相比,本发明的有益效果如下:本发明研究发现,9-菲酚对稻瘟病菌生长有抑制作用,可干扰分生孢子形成附着胞,对孢子附着胞的形成具有显著延缓作用,对稻瘟病具有明显的抑制作用,因此,在稻瘟病防控及药物开发方面具有很好的应用价值。
附图说明
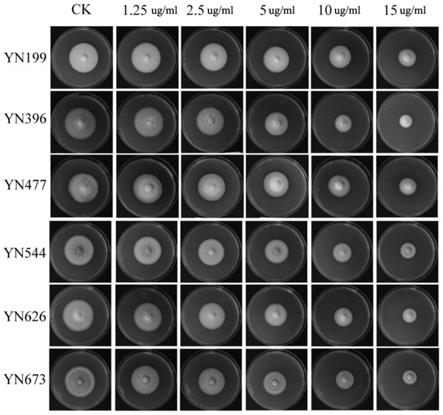
13.图1为不同浓度9-菲酚对稻瘟菌菌丝生长的影响;
14.图2为不同浓度9-菲酚对不同稻瘟菌菌株的抑制率图;
15.图3为不同浓度9-菲酚对稻瘟菌分生孢子萌发的影响;
16.图4为不同浓度9-菲酚对稻瘟菌附着胞形成的影响;
17.图5为不同浓度9-菲酚对稻瘟菌致病力的影响;
18.图6为不同浓度9-菲酚对病斑稻瘟菌生物量的影响。
具体实施方式
19.实施例1 9-菲酚对稻瘟病菌菌丝生长的影响
20.一种利用9-菲酚抑制稻瘟病菌菌丝生长的方法,包括以下步骤:
21.s1:将9-菲酚溶解在二甲基亚砜中,配置成母液(5000ug/ml),将加入pda培养基中使9-菲酚的终浓度分别为1.25μg/ml,2.5μg/ml,5μg/ml,10μg/ml和15μg/ml,控制pda培养基的温度为55℃;同时设置未加入9-菲酚的pda培养基作为空白对照组。
22.上述pda培养基的制备方法:
23.(1)取称量纸在天平中称取蔗糖10g,琼脂粉15g;
24.(2)将马铃薯去皮并清洗干净,称量200g去皮马铃薯后并在干净的纱布上用小刀切成约1cm左右的立方块;
25.(3)量取1000ml蒸馏水,将蒸馏水和200g去皮马铃薯块一起加入锅中,待水沸腾后再煮20-30min,然后在1l的烧杯中用4层干净的纱布过滤马铃薯渣;
26.(4)向过滤后的液体中加入10g蔗糖,用玻璃棒搅拌均匀后将滤液倒入锅中,边搅拌边加入琼脂粉15g,注意快速搅拌,避免琼脂结块沾锅底;
27.(5)当液体煮至透明时停止加热倒入1l的烧杯中,加蒸馏水定容至1000ml,自然ph,分装在锥形瓶中,不能超过锥形瓶容积的三分之一,之后在高压蒸汽灭菌锅中121℃灭菌20min,得pda培养基。
28.将9-菲酚加入pda培养基中的具体方法:用移液器吸取9-菲酚加入到已冷却至55℃的pda培养基中,使最终培养基中的9-菲酚浓度分别为1.25μg/ml,2.5μg/ml,5μg/ml,10μg/ml和15μg/ml,将培养基混匀后倒入无菌培养皿中,尽量避免倒板过程中出现气泡影响实验结果,得到不同9-菲酚浓度的pda培养基。
29.s2:培养供试菌稻瘟病菌;
30.上述培养供试菌稻瘟病菌的具体方法如下
31.2.1在灭好菌的超净工作台中,点燃酒精灯,将高压蒸汽灭菌过的pda培养基冷却到55℃左右;
32.2.2在直径90mm的培养皿中,每皿约倒22ml培养基,尽量保证倒入过程中没有气泡;
33.2.3等到培养基完全凝固后,从冰箱里取出供试稻瘟病菌的滤纸片;
34.2.4将镊子放在酒精灯外的烧,待镊子冷却后用镊子夹取保存有稻瘟病菌的滤纸片放于pda培养基上;
35.2.5最后使用封口膜将培养皿密封,并倒置放在28℃恒温培养箱中培养供试菌株。
36.s3:供试菌稻瘟病菌在培养7天后使用无菌打孔器在供试菌稻瘟病菌上切取菌块,菌块直径为6mm,放入含9-菲酚的pda培养基和空白对照pda培养基中;
37.s4:将放入菌块的含9-菲酚的pda培养基和空白对照pda培养基放入恒温培养箱中培养,恒温培养箱的温度为28℃,培养时间为7天。用游标卡尺分别测量菌落直径,计算出实验组和空白对照组的菌丝生长速率和抑制率。
38.计算公式如下
39.抑制率=(对照菌株生长直径-0.7)-(处理菌株生长直径-0.7))/(处理菌株生长直径-0.7)(注:0.7代表所接菌块直径)
40.实验组准备不同浓度的9-菲酚pda培养基分别为1.25ug/ml,2.5ug/ml,5ug/ml,10ug/ml和15ug/ml,分别接种稻瘟病菌菌块,7天后统计菌落直径计算出9-菲酚抑制稻瘟病菌的抑制率,结果如图1所示:
41.结果:通过在含有9-菲酚的培养基中接种7株不同稻瘟菌,结果表明不同浓度的9-菲酚对稻瘟菌菌丝生长均有影响,且随着浓度的增加,抑制率显著增加(图1、图2)。
42.实施例2 9-菲酚对稻瘟病菌孢子形成和附着胞形成的影响
43.实施步骤:
44.s1将放入菌块的含9-菲酚的pda培养基和空白对照pda培养基放入恒温培养箱中培养7天后,使用无菌打孔器在稻瘟病菌上切取菌块,菌块直径为6mm,挑取三个菌块放置于pdb培养基中,
45.所述pdb培养基的制备方法:
46.(1)取称量纸在天平中称取蔗糖10g;
47.(2)将马铃薯去皮并清洗干净,称量200g去皮马铃薯后并在干净的纱布上用小刀切成约1cm左右的立方块;
48.(3)量取1000ml蒸馏水,将蒸馏水和200g去皮马铃薯块一起加入锅中,待水沸腾后再煮20-30min,然后在1l的烧杯中用4层干净的纱布过滤马铃薯渣;
49.(4)向过滤后的液体中加入10g蔗糖,用玻璃棒搅拌均匀后,倒入1l的烧杯中,加蒸馏水定容至1000ml,自然ph,分装在锥形瓶中,不能超过锥形瓶容积的三分之一,之后在高压蒸汽灭菌锅中121℃灭菌20min,得pdb培养基。
50.s2:将菌块放入pdb培养基放置于120rpm,28℃摇床培养4-5天后,分别吸取400μl菌丝悬浮液于燕麦培养基中,使菌液分布均匀。将其放置于28℃培养箱中培养6d左右,使用无菌棉签刮菌丝,再放置于光照培养箱中明暗交替(12h光照,12h黑暗)培养5d左右,用0.1%吐温水清洗孢子,配置分生孢子悬浮液,并调节孢子浓度至105/ml;将9-菲酚母液分
别加入分生孢子悬浮液至终浓度为1μg/ml,10μg/ml和20μg/ml,将混有9-菲酚的分生孢子悬浮液滴到疏水拨片上,28℃黑暗保湿12h后,显微镜观察附着胞形成情况;
51.s3:制作水琼脂培养基,将玻璃纸放在水琼脂上;将用燕麦培养基培养的孢子用无菌水清洗,过滤,均匀涂抹在玻璃纸上并做好标记,在2h、4h、6h、8h分别观察孢子萌发及附着胞形成情况。每次观察50个孢子,共观察3次。
52.所述燕麦培养基的制备方法:
53.(1)取称量纸在天平中称取燕麦40g,琼脂粉15g;
54.(2)向称量好的燕麦中加入适量水浸泡10分钟左右,用破壁机均匀打碎;
55.(3)将打碎均匀的燕麦倒入1l的烧杯中;
56.(4)将15克琼脂粉加入到装有燕麦的1l烧杯中,加蒸馏水定容至1000ml,自然ph,分装在蓝盖瓶中,不能超过蓝盖瓶容积的三分之一,之后在高压蒸汽灭菌锅中121℃灭菌30min,得燕麦培养基。
57.结果:孢子萌发及附着胞形成情况结果如图3和图4:通过对分生孢子悬浮液添加不同浓度9-菲酚后,结果表明:10ug/ml 9-菲酚对稻瘟菌分生孢子萌发和附着胞形成具有抑制作用,20ug/ml时,分生孢子萌发和附着胞形成均受到明显抑制(如图3和图4)。
58.实施例3 9-菲酚对稻瘟菌致病性的影响
59.实验步骤如下:
60.将9-菲酚母液加入到稻瘟菌分生孢子悬浮液终,至终浓度为10ug/ml和30ug/ml,将孢子悬浮液均匀喷洒水稻叶片,使叶片上沾满液滴,28℃黑暗保湿培养24h,再移至温室,接种后7d进行稻瘟菌病害调查并通过荧光定量方法统计菌丝生物量,具体公式2ct
(os-ubq)-ct(mo-pot2)。
61.结果:使用添加含有9-菲酚的分生孢子悬浮液接种水稻,接种后7天观察水稻发病情况,结果表明添加10ug/ml的9-菲酚处理分生孢子悬浮液接种水稻后,水稻叶片上病斑显著减少,接种添加了30ug/ml的9-菲酚处理分生孢子悬浮液后,水稻叶片只能看到零星的小的病斑(图5)。通过统计病斑处菌丝生物量发现,不同浓度9-菲酚处理的孢子悬浮液形成的病斑的菌丝生物量显著降低(图6)。说明9-菲酚通过抑制分生孢子萌发和附着胞形成降低了水稻稻瘟病的发生。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1