多花黄精微块茎黑暗节能离体繁殖方法
1.本发明属于植物组织培养技术领域,具体涉及多花黄精微块茎黑暗节能离体繁殖方法。
背景技术:
2.多花黄精(polygonatum cyrtonema hua)为百合科(liliaceae)黄精属(polygonatum)多年生宿根草本植物,以根茎入药。作为我国的传统中药,黄精药用历史已有2000多年,具有益气、补肾、补肺、健脾的作用。多花黄精繁殖方法分为根状茎繁殖和种子繁殖。繁殖周期较长,一般5年左右达到收获期。种子发芽时间较长,发芽率为60%-70%,种子寿命为2年,种子繁殖周期较长,一般在5年左右;生产栽培中一般采用根状茎繁殖,即“块茎种子”繁殖,一般于晚秋或早春3月下旬前后选1-2年生健壮、无病虫害的植株根茎进行播种,块茎种子可以提早收获,如3-4年但在田间,根茎繁殖效率低,且易传播土传病害。因此,迫切需要开发一种方便、高效的块茎繁殖方法,该方法通常用于马铃薯,用于黄精的大规模种植。
3.目前,黄精的组织培养和快繁方法主要是离体组织培养系统,包括外植体消毒、不定芽诱导增殖、生根育苗。例如刘建东等以多花黄精种子萌发的初生根茎为外植体,研究了细胞分裂素不同种类对丛生芽诱导、增殖效率的影响,结果表明一定浓度的6-ba、naa和iaa组合可有效促进多花黄精丛生芽的诱导和增殖。程强强等人,以多花黄精根茎组织块为材料,研究得出生长素naa较iba更有利于不定芽的诱导,tdz与naa组合使用不定芽诱导率最高。采用这种方法,黄精组培周期一般为8个月左右,所得到的幼苗块茎少而小,生长能力低,形态和植物结构不规则,移栽后成活率低。不定芽诱导是许多植物离体培养的主要快速繁殖方法。由于不定芽的数量与腋芽的数量无关,其增殖率高于丛生芽发生型,但同时突变率也高于在叶或叶原基的腋基部的顶端或茎的横向位置已发育为原基的固定芽。总之,现有研究只局限于利用不同激素组合对芽体增殖和单个根茎芽生根的培养,所得到的种根茎小,后期种苗的生长速度慢,且变异率无法有效控制,育苗周期至少2年,成本高,无法满足优质黄精种苗的规模化生产。
4.有关patatin蛋白家族的研究,自20世纪80年代以来已有许多报道。patatin蛋白家族属于多基因家族,统称为patatin like蛋白家族(简称plp)。patatin like蛋白家族中各成员之间的结构和功能相似。patatin最早由mignery等从马铃薯块茎中分离,鉴定并克隆了块茎贮存蛋白基因patatin,它编码的蛋白质占块茎储藏蛋白的40%。因其表达具有高度的块茎特异性,引起了科学界的广泛关注。roshal等和migne等先后对其进行了更进一步的研究分析,认为该基因的表达可以作为块茎发育的生化指标。离体培养试验表明,patatin蛋白基因可以被短日照和高蔗糖浓度等诱导表达,这与试管块茎诱导条件相一致。与自然条件下一样,该基因具有块茎特异性,只在块茎形成的葡甸茎和块茎中表达。已有研究表明,在马铃薯中patatin发生在块茎形态建成早期,与块茎的形成有关,在黄精中patatin蛋白家族还未有研究。在本发明中,研究了patatin并将其用于组织培养中块茎形
态发生鉴定指标。
技术实现要素:
5.本发明的目的在于针对上述问题,提供一种打破顶端优势,促使变异率低的固定腋芽膨大直接形成微块茎组织培养方法,建立了多花黄精微块茎黑暗节能离体繁殖方法,在黑暗条件下该方法的可行性,节约电能的同时,提升黄精快繁效率,促进生产。同时为地下莲作植物多极性生长提供参考。
6.为实现上述目的,本发明提供以下技术方案:一种多花黄精微块茎黑暗节能离体繁殖方法,包括以下步骤:(1) 多花黄精无菌体系的建立:多花黄精果实除去腐烂部分并以洗涤剂清洗剥出种子,300mg/lga3+300mg/l kt激素处理,浸泡24h,加75vol%酒精震荡1min,用无菌水清洗3次,再加0.1wt%升汞消毒15min,再以无菌水清洗3次,用无菌滤纸吸干水分,获得无菌种子;(2)多花黄精种子萌发:种子纵切接入ms+0.2mg/l 6-ba+0.2mg/l2-4d+2mg/l ga3+2wt%蔗糖 + 0.6wt%琼脂培养基,光照2000~2400lx,温度25
±
1℃,光周期光照/黑暗12h/12h,第10d开始萌发,一个月后初生根茎形成;(3)多花黄精诱导丛生芽:将初生根茎接入ms+1mg/l 6-ba+0.5mg/l naa+2wt%蔗糖 + 0.6wt%琼脂培养基,光照2000~2400lx,温度25
±
1℃,光周期(光照/黑暗):12h/12h,进行丛生芽诱导;(4)多花黄精生根壮苗:将初生根茎或丛生芽接入1/2ms+1mg/l naa + 0.6wt%琼脂培养基,光照2000~2400lx,温度25
±
1℃,光周期(光照/黑暗):12h/12h,进行生根培养。
7.(5)多花黄精微块茎诱导:将生根培养2个月的黄精组培苗接入微块茎诱导培养基中,在光照1500~2000lx,温度25℃,光周期光照/黑暗:6h/18h;5d后转入完全黑暗条件下,温度25
±
1℃培养15d,侧芽膨大为微块茎,获得多花黄精微块茎组培苗;所述微块茎诱导培养基为:ms + 5mg/l naa + 0.5mg/l 6-ba + 8wt%蔗糖 + 0.6wt%琼脂。
8.(6)块茎移栽:步骤(5)获得的多花黄精微块茎组培苗,无需更换培养基置于室温状态炼苗1个进行移栽;移栽前三天将培养瓶盖松开,前一天将培养瓶口全部打开,移栽时,将组培苗从培养瓶中取出,用水把组培苗携带的培养基等附着物清洗净,然后将组培苗栽植到培养基质土中,一个月后观察其成活率。
9.上述方法在多花黄精繁育中的应用。
10.本发明的优点在于:(1)本发明的方法通过优化植物生长调节剂和黄精外植体体外培养,降低外植体顶端优势,从休眠状态释放侧芽的生长潜力,诱导块茎形成。未去除顶端芽,而是通过将顶端转化为微型块茎,从而成功地抑制顶端优势,导致顶端优势向微型块茎化的转变。
11.(2)本发明的方法中莲座型植物外植体可形成多个块茎,每个块茎均起源于叶片基部的腋芽。与不定器官发生不同,新发育的块茎起源于内在侧芽,没有愈伤组织形成。所有内在芽均可形成微块茎,即在体外的根茎块茎,避免愈伤组织起源的不定芽形成。
12.(3)本发明的方法为块茎植物黄精开发了一种有效的微块茎形成途径。内在芽转化为微块茎为植物组织培养领域的直接器官发生提供了新模式,有助于更容易地储存、移植和块茎播种。在没有愈伤组织形成的情况下,可以获得更高的遗传稳定性,从而能够大规
模地基于遗传稳定的块茎繁殖。
附图说明
13.图1不同光照条件下15d体外培养的多花黄精固定芽的块茎化。a、e为对照;b-d为在明/暗12h/12h光周期,5d,10d,15d培养的小苗;f-h为5d、15d在黑暗中培养的苗(明/暗:0h/24h);h:放大图显示由原始腋芽转化形成的块茎。
14.图2不同光培养的黄精块茎鲜重变化。全黑暗:明/暗:0h/24h;光周期:明/暗:12h/12h、光1500~2000lx;弱光条件下:光周期明/暗:12h/12h,光照150~200lx。
15.图3系列照片显示多花黄精块茎的体外形态发生。a为对照(ck)植株在光周期12h(光/暗)培养40天后生根的植株;b-d:分别在黑暗条件下培养后26、73和150天,侧芽到块茎的形成和发育;叶子在黑暗条件下退化,不会对块茎发育产生负面影响。
16.图4多花黄精块茎在黑暗条件下培养的系列照片显示块茎上形成了不定。a-c分别是培养25、55和75天后的同一块茎。
17.图5多花黄精块茎形态发生。a:新生块茎的正面;b:新生块茎的纵切面;c:新生块茎基部的纵切面;d:新生块茎的基部;e:新生块茎的中部;f:新生块茎芽端的共聚焦明场图;g:与f相同的部分,用dapi染色;h:新生块茎中部的共聚焦明场图像;i:与h中相同的部分,用dapi染色。
18.图6对多花黄精根切片的观察。a:诱导的新生的块茎反面;b:膨大的根部;c:膨大根中部的切片部位;d:c所示部位的横切面;e:根膨大下部的切片部位;f:在e中的位置处的横切面;g:根尖部分的共聚焦明场图像,根的纵向截面;h:根横截面的共聚焦明场图像;i:根毛区横截面的共聚焦明场图像图7多花黄精体外培养小苗顶芽去除后侧芽的增殖情况。a:多芽点块茎;b:去除顶芽后的块茎;c:摘除顶芽后在诱导块茎培养基中培养20天后形成微块茎丛。
19.图8多花黄精的顶端和侧芽的块茎化。a:微块茎化的初始阶段显示从优势芽到块茎的顶端芽转变,顶端下方的侧芽开始伸长;b:微块茎化的后期显示顶芽和侧芽的扩大,内在芽被诱导形成微块茎而没有愈伤组织。
20.图9移栽2个月后发育良好的多花黄精块茎。a:不掉叶的块茎;b:显示叶子脱落位置的近距离视图;c:部分叶子脱落后结节的块茎。
21.图10pc-plp基因在黑暗条件下不同培养时间新生块茎中的相对表达量。以无块茎的基部茎部为对照组(ck);纵坐标为基因相对表达量,横坐标为不同培养天数。不同字母(a、b、c、d)表示不同培养时间下新生块茎中pc-plp基因差异显著(p<0.05),相同字母表示不同培养时间下新生块茎中pc-plp基因差异不显著(p>0.05)。
22.图11不同光照条件下培养10d新生块茎中pc-plp基因的相对表达量。以无块茎的基部茎部为对照组(ck);纵坐标为基因相对表达量,横坐标为不同光照条件;dark:全黑暗;photoperiod:光周期12h/12h光照/黑暗。不同字母表示不同培养时间下新生块茎中pc-plp基因差异显著(p<0.05),相同字母表示不同培养时间下新生块茎中pc-plp基因差异不显著(p>0.05)。
23.图12内生微块茎(a和b)与不定芽途径(c和d)。a:离体块茎萌发阶段的微块茎丛;b:附着在移栽植株上的小块茎;c:离体共发育叶原基不定芽丛;d:不定芽产生
的移栽的苗。
24.图 13 从芽到芽和从芽到块茎形态发生之间的器官发生差异。a:愈伤组织的间接芽增殖; b: 直接芽-芽-芽繁殖; c:莲座植物中的混合芽-芽小苗繁殖; d:腋生(内在)芽到块茎繁殖,在莲座丛植物中具有块茎。
具体实施方式
25.为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
26.实施例11. 材料方法本研究以福建省三明市道地多花黄精组培苗为起始材料,进行后续培养基的优化及rna的提取,实验所用材料取样均三次重复,将所取样品迅速放于液氮速冻于-80℃冰箱保存备用。
27.1.1 诱导多花黄精侧芽形成块茎:(1) 多花黄精无菌体系的建立:多花黄精果实除去腐烂部分并以洗涤剂清洗剥出种子,300mg/lga3+300mg/l kt激素处理,浸泡24h,加75vol%酒精震荡1min,用无菌水清洗3次,再加0.1wt%升汞消毒15min,再以无菌水清洗3次,用无菌滤纸吸干水分,获得无菌种子;(2)多花黄精种子萌发:种子纵切接入ms+0.2mg/l 6-ba+0.2mg/l2-4d+2mg/l ga3+2wt%蔗糖 + 0.6wt%琼脂培养基,光照2000~2400lx,温度25
±
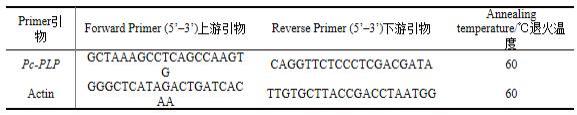
1℃,光周期光照/黑暗12h/12h,第10d开始萌发,一个月后初生根茎形成;(3)多花黄精诱导丛生芽:将初生根茎接入ms+1mg/l 6-ba+0.5mg/l naa+2wt%蔗糖 + 0.6wt%琼脂培养基,光照2000~2400lx,温度25
±
1℃,光周期(光照/黑暗):12h/12h,进行丛生芽诱导。
28.(4)多花黄精生根壮苗:将初生根茎或丛生芽接入1/2ms+1mg/l naa + 0.6wt%琼脂培养基,光照2000~2400lx,温度25
±
1℃,光周期(光照/黑暗):12h/12h,进行生根培养。
29.(5)将生根培养2个月的黄精组培苗接入培养基(ms + 5mg/l naa + 0.5mg/l 6-ba + 8wt%蔗糖 + 0.6wt%琼脂),光照1500~2000lx,温度25
±
1℃,光周期(光照/黑暗):6h/18h;在上述条件培养5d后,将组培苗完全黑暗或转入正常光周期(12h/12h)条件均可,温度25
±
1℃,侧芽在15d膨大为直径5mm的块茎,将培养5d、10d、15d的多花黄精组培苗取样备用。
30.在离体培养 15 天后,多花黄精的侧芽在正常光周期和黑暗条件下都膨胀形成块茎(图 1 a-d):在明/暗12h/12h光周期,5d、10d、15d培养的小苗; e-h):5d、15d在黑暗中培养的苗(明/暗:0h/24h)。
31.(6)将步骤(1)取样的多花黄精组培苗分别置于全黑暗、光周期(12h/12h,光照1500~2000lx)、弱光周期(12h/12h,光照150~200lx)(ms + 5mg/l naa + 0.5mg/l 6-ba + 8wt%蔗糖 + 0.6wt%琼脂),温度25
±
1℃,条件下培养,分别在10d、20d、30d称取块茎鲜重,观察不同光处理对多花黄精块茎增殖的影响。
32.在块茎增殖过程中,相同培养时间,完全黑暗培养的块茎鲜重比光照条件下的块茎鲜重增加更多。黑暗条件培养有利于黄精块茎的增殖(图 2)。
33.同时发现黄精组培苗在黑暗培养条件下叶片变黄,块茎长期培养(培养至150天)后继续增殖,新块茎上的其他休眠芽也可膨大形成块茎(图3),说明在该培养基(ms + 5mg/l naa + 0.5mg/l 6-ba + 8wt%蔗糖 + 0.6wt%琼脂)条件下,侧芽的生长能力得到释放,顶芽和侧芽可分别生长膨大,并可形成块茎,该培养基具有明显膨大块茎的作用。多花黄精在块茎持续培养(培养25、55、75天)过程中,腋芽、根均有膨大表型(图4)。
34.为进一步研究其细胞形态发生,探究其形态发育情况,我们将多花黄精组培苗侧芽膨大形成的块茎进行切片和dapi染色观察。
35.通过对多花黄精腋芽膨大产生的块茎进行切片观察发现,多花黄精腋芽膨大部位木质部与韧皮部彼此间隔交互呈辐射状排列,为辐射维管束(radial vascular bundlel);根部膨大部位维管束类型为周韧维管束(amphicribral vascular bundle),木质部位于中间,韧皮部围绕于木质部四周,无形成层,常见于蕨类某些植物与百合科、禾本科、蓼科的某些植物(图5和图6)。根据维管束类型的不同可以发现,多花黄精腋芽形成的块茎具有明显茎的特征,与马铃薯等块根类作物不同,块茎上存在多个芽点,均有发育成新的块茎的潜能,相对于不定芽诱导,固定芽直接膨大形成块茎的效率将会更高更快。通过对多花黄精块茎芽端和中部的dapi染色结果可以发现,黄精块茎组织内部维管束四散分布,芽点处细胞分裂相明显,分裂旺盛。
36.1.2 为进一步研究腋芽形成块茎的机制,将步骤(2)形成的多花黄精微块茎去除顶芽后进行培养(ms + 5mg/l naa + 0.5mg/l 6-ba + 8wt%蔗糖 + 0.6wt%琼脂,光照1500~2000lx,温度25
±
1℃,光周期(光照/黑暗):12h/12h),拍照观察多花黄精侧芽发育情况。
37.将黄精组培苗的块茎顶芽去除,发现20天内侧芽全部膨大形成块茎,未出现新的顶端优势形成(图 7)。 在不切断顶芽的情况下,顶芽和侧芽都能同时发育形成块茎(图8)。
38.在微块茎化过程中,离体培养的种苗可在较短的时间(15d)内形成明显的块茎,几乎所有的侧芽均可形成块茎,块茎总数取决于叶片数,一般情况下,每株植株约3 株。块茎可进一步继代培养,每个块茎可再形成 3 个或更多块茎(图 3 和 9)。 在田间,可以生产更多的块茎丛(图 12 a 和 b)。作为比较,在不定芽途径中,如果有块茎存在,块茎繁殖过程是间接的形态发生,愈伤组织发生在植株基部,叶原基和不定芽在表皮组织上共同发育,必须采取更多的培养步骤为继代培养选择真正的分枝芽以获得个体植株(图 12c 和 d)。
39.本发明诱导形成的丛生芽,部分通过愈伤组织表现出不定特征,但在优化的培养条件下,芽独特地起源于内在芽位置,没有经过愈伤组织阶段。顶端微块茎形成后,所有的侧向微块茎均起源于腋原基。因此,本发明并没有去除顶端芽,而是通过将顶端转化为微型块茎,从而成功地抑制顶端优势,导致顶端优势向微型块茎化的转变(图8和13)。已知顶芽发育时,侧芽处于休眠状态,一般没有任何形态发生;然而,当通过去除顶芽或通过化学处理去除顶端优势时,侧芽,主要是在芽的腋窝位置,即茎和叶之间的分枝原基,可能会发育。因此,我们的内生芽直接形成块茎系统,可以使顶芽和侧芽同时发育到块茎化的程度(图13)。
40.在马铃薯等许多块茎植物中已经实现了微块茎的发生,主要涉及黑暗条件和适当的培养基(lian,1995),可在体外诱导匍匐茎形成块茎(lian,1995),已成功应用于世界范围的马铃薯种植园。p. cyrtonema 微块茎化与马铃薯块茎化在培养条件和块茎化方面有
所不同,事实上,在植物中还没有发现包括顶芽和腋芽在内的内在芽的微块茎化。
41.1.3总 rna 的提取及 cdna 的合成总rna的提取根据多花黄精诱导块茎过程中不同光处理下不同天数的新生块茎进行取样:光周期培养10d的新生块茎;全黑暗培养10d的新生块茎;全黑暗条件下培养第5d、10d、15d、20d的新生块茎。
42.总 rna 的提取参考 trizol(invitroigen 公司)试剂盒的说明书提取样品的总 rna,并用 thermo 超微量核酸检测仪测定 rna 浓度,通过1wt%琼脂糖凝胶电泳检测 rna 的纯度,用all supermix(transgen biotech公司)试剂盒逆转录成 cdna 用于实时荧光定量qrt-pcr 分析。
43.1.4 patatin引物合成与qrt-pcr定量验证在 pfam数据库(http://pfam.xfam.org/)下载patatin的隐马氏模型,根据多花黄精全长转录组数据及patatin基因隐马氏模型(pf01734),筛选出4个patatin-like protein(plp)基因,选取其中差异表达最高的一个基因a21014918a_transcript_10497(pc-plp)进行qrt-pcr相关分析验证。
44.运用罗氏 lightcycler 480 仪器,通过qrt-pcr检测pc-plp 基因在多花黄精不同发育天数新生块茎中的表达情况。根据实时荧光定量 pcr 引物设计原则,利用primer3网站(https://primer3.ut.ee/)在线设计pc-plp基因qrt-pcr引物,以及内参基因 actin的特异性引物(表 1)。采用 sybr premix ex taqtm kit
ꢀⅱ
(takara)进行qrt-pcr 反应,反应体系为20 μl:sybrⅱ酶 10 μl,ddh2o 7.4 μl,cdna 1 μl,上下游引物各 0.8 μl。反应条件为:95 ℃预变性 30 s;95 ℃变性 10 s,60 ℃退火 30 s,72 ℃延伸 15 s,45 次循环。数据分析采用 2-δδct法获得pc-plp基因的相对表达量,计算公式为: 基因相对表达量 = 2-δδct。其 中,δδct 计算公式为: δδct = δct( 实验组)-δct( 对照组) ,实验组或对照组的 δct 计算公式为: δct = ct (目的基因)-ct( 内参基因)。采用 spss 19.0 对pc-plp 基因的表达分别进行差异显著性分析,用 grappad prism 8.0.2 进行绘图。
45.表 1多花黄精plp及内参基因定量的qrt-pcr引物序列与非块茎组织(ck)即同一植株的茎相比,不同光照处理下p. cyrtonema新形成的块茎中pc-plp基因的定量分析表明,pc-plp在新生块茎中的表达量更高(图 10)。 随着时间的推移,pc-plp的表达下降,pc-plp基因的表达在5d达到高峰。推测其块茎表型在10d左右达到高峰存在关联,pc-plp基因在块茎起始阶段高表达。全黑暗培养条件下pc-plp的表达水平高于光周期下(图 11)。
46.1.5 工厂化节能模式高投资成本是影响大规模工厂生产最重要的因素之一。在组培过程中,节能一直是种植者关注的主要问题。在对黄精块茎诱导增殖过程的研究中,我们发现与正常光周期
培养相比,暗培养更有利于块茎的形成(图7),从而降低了能量消耗。 利用本工作获得的黑暗培养条件,每个培养周期可节省两个月的光照期电力。
47.总之,在植物体外器官发生中,直接形态发生和间接形态发生之间存在差异:直接形态发生缺乏愈伤组织形成,间接形态发生去分化,器官从愈伤组织细胞发育而来,这些愈伤组织细胞被认为涉及更多突变,导致遗传不稳定。 本发明中所有内在芽均可形成微块茎,即在体外的根茎块茎,避免愈伤组织起源的不定芽形成。 因此,本工作为块茎植物黄精开发了一种有效的微块茎形成途径。块茎技术的内在芽转化为植物组织培养领域的直接器官发生提供了新模式,从而能够大规模地基于遗传稳定的块茎繁殖。
48.需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1