一种视网膜色素变性小鼠模型及其构建方法
1.本发明涉及基因工程领域,涉及一种视网膜色素变性小鼠模型及其构建方法。
背景技术:
2.视网膜色素变性(retinitis pigmentosa,rp)是一种由于基因突变引起视网膜光感受器细胞渐进性凋亡的遗传性眼病。该病主要表现为视力进行性下降、视野缩窄、夜盲、眼底色素沉着以及视网膜电图(erg)异常。据统计,全世界视网膜色素变性的群体发病率约为1/4000,已经成为主要的致盲疾病。按照遗传方式的不同分为三类,即常染色体显性遗传(autosomal dominant rp,adrp),常染色体隐性遗传(autosomal recessive rp,arrp)和性染色体连锁隐性遗传(x-linked rp,xlrp)。在常染色体显性遗传rp(autosomal dominant retinitis pigmentosa,adrp)中,视紫红质(rhodopsin,rho)基因突变率较高,大约占adrp发病率的25%~30%。rho基因位于3q22.1,由5个外显子构成,编码348个氨基酸。rho基因突变引起视紫红质蛋白发生功能异常,最终导致感光细胞发生凋亡。因此这些突变位点也成为了基因治疗过程中的重要靶点。构建由于rho基因突变所导致的adrp疾病模型具有重要意义。
3.因为小鼠基因组与人类基因组的差别,目前已报道的视网膜色素变性小鼠模型与病人的基因差别很大,这样导致现有的基于视网膜色素变性小鼠模型研发的基因编辑的方法无法直接用于病人临床治疗,这些严重影响了基因编辑用于视网膜色素变性疾病的治疗。
技术实现要素:
4.有鉴于此,本发明的目的在于研发一种视网膜色素变性小鼠模型,该发明涉及的视网膜色素变性小鼠疾病模型在对应基因组位点带有病人特异的突变片段,为对应的药物和基因治疗方法的研发提供有力支撑。
5.为了实现上述发明目的,本发明研发一种视网膜色素变性小鼠疾病模型,以视网膜色素变性病人rho基因为基础,利用crispr/cas9将病人的75nt dna片段敲入到小鼠基因组中对应位点,该片段含有致病突变,从而构建t17m基因敲入小鼠疾病模型,所述致病突变由核酸水平命名为c.c50t,所述致病突变由蛋白质水平命名为p.t17m。
6.优选的,突变型rho基因对应的蛋白质序列如seq id no.1所示。
7.优选的,t17m基因敲入小鼠rho部分基因序列如seq id no.3所示。
8.优选的,上述一种视网膜色素变性小鼠模型的构建方法,用crispr/cas9构建基因敲入小鼠包括如下步骤,
9.(1)设计两条特定的sgrna序列;
10.(2)在小鼠rho基因外显子1上引入错义突变rho,p.t17m,设计基因敲入的修复模板,修复模板序列如seq id no.2;
11.(3)采用显微注射的方式将体外转录的cas9 mrna,sgrna和修复模板注射入
c57bl/6j小鼠受精卵中,crispr/cas9基因编辑系统在小鼠受精卵中进行基因切割,诱发同源重组修复,受精卵发育为胚胎;
12.(4)基因编辑后的胚胎立即转入假孕母鼠子宫中,生产后得到基因敲入小鼠。
13.优选的,两条特定的sgrna序列包括sgrna1和sgrna2,分别靶向基因组特定位点,画线序列为pam,所述sgrna1和sgrna2的序列如下:
14.sgrna1:cggctctcgaggctgccccacgg;
15.sgrna2:cttctccaacgtcacaggcgtgg。
16.优选的,crispr/cas9基因编辑系统与基因组的靶位点进行结合,cas9发挥切割活性,产生dna双链断裂,从而诱发dna损伤修复,细胞通过同源重组修复dna,将修复模板定点敲入到小鼠rho基因中。
17.优选的,设计195nt的修复模板,所述修复模板包含75nt的患者dna序列和致病突变rho,p.t17m,通过与野生型小鼠rho基因序列进行对比,所述修复模板包含bstxi酶切位点5
’‑
ccannnnnntgg-3’,而野生型小鼠rho基因序列中无,因此该酶切位点可用作基因型鉴定。
18.优选的,所述修复模板序列如seq id no.2所示;
19.t17m基因敲入小鼠rho部分基因序列如seq id no.3所示。
20.优选的,小鼠鉴定的步骤包括:
21.假孕母鼠产仔后,即为f0代小鼠;
22.取f0代小鼠的尾巴和脚趾,提取全基因组,进行pcr扩增和测序,f0代阳性小鼠与野生型小鼠进行杂交,获得f1代小鼠,取小鼠的尾巴和脚趾,提取全基因组,pcr扩增后利用bstxi酶切验证或者进行基因测序鉴定。
23.本发明中,t17m基因敲入小鼠视网膜的结构和功能都出现明显异常,这与临床病人表征相同。因此该发明为视网膜色素变性临床治疗性药物和基因治疗方法的研发提供有力支撑。
附图说明
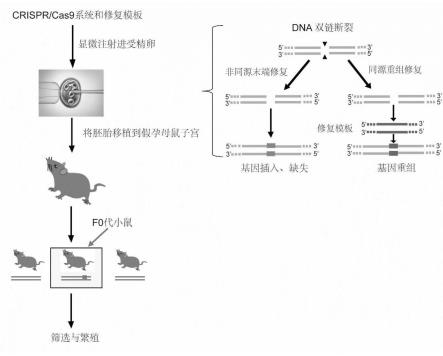
24.图1为一种视网膜色素变性小鼠模型的构建图;
25.图2为t17m基因敲入小鼠鉴定结果图;
26.图3为t17m基因敲入小鼠视网膜结构(oct和免疫组化)鉴定结果;
27.图4为t17m基因敲入小鼠视网膜功能(erg)鉴定结果;
28.图5为t17m基因敲入小鼠眼底和血管造影图。
具体实施方式
29.为更进一步阐述本发明为实现预定发明目的所采取的技术手段及功效,以下结合附图及较佳实施例,对依据本发明的具体实施方式、结构、特征及其功效,详细说明如后。
30.本发明的参照图1至5所示,本发明所述的一种视网膜色素变性转基因小鼠模型,以视网膜色素变性病人rho基因为基础,利用crispr/cas9将病人的75dna片段敲入到小鼠基因组中,该片段含有rho,p.t17m致病突变,从而构建t17m基因敲入小鼠疾病模型。其中t17m是rho基因上的一个突变位点。
31.t17m基因敲入小鼠模型rho基因对应的蛋白质序列如seq id no.1所示:
32.mngtegpnfyvpfsnamgvvrspfeqpqyylaepwqfsmlaaymfllivlgfpinfltlyvtvqhkklrtplnyillnlavadlfmvfggftttlytslhgyfvfgptgcnlegffatlggeialwslvvlaieryvvvckpmsnfrfgenhaimgvvftwimalacaapplvgwsryipegmqcscgidyytlkpevnnesfviymfvvhftipmiviffcygqlvftvkeaaaqqqesattqkaekevtrmviimvifflicwlpyasvafyifthqgsnfgpifmtlpaffaksssiynpviyimlnkqfrncmlttlccgknplgdddasatasktetsqvapa*.突变氨基酸下标有下划线。
33.上述一种视网膜色素变性转基因小鼠模型的构建方法,包括如下步骤:
34.(1)设计两条特定的sgrna序列。
35.两条特定的sgrna序列包括sgrna1和sgrna2,分别靶向基因组特定位点,crispr/cas9的sgrna1和sgrna2的序列如下:
36.sgrna1:cggctctcgaggctgccccacgg;
37.sgrna2:cttctccaacgtcacaggcgtgg。
38.(2)在小鼠rho基因外显子1上引入错义突变(rho,p.t17m),设计基因敲入的修复模板序列,
39.所述修复模板序列如seq id no.2所示:
[0040]5’‑
gggagccgtcagtggctgagctcgccaagcagccttggtctctgtctacgaagagcccgtgggtcagccacaagggccacagccatgaatggcacagaaggccctaacttctacgtgcccttctccaatgcgatgggcgtggtgcggagccccttcgagcagccgcagtactacctggcggaaccatggcagttc-3’,在小鼠rho基因外显子1上引入错义突变(rho,p.t17m),该突变位点标有下划线,通过与野生型小鼠rho基因序列对比分析,发现该修复模板包含bstxi酶切位点5
’‑
ccannnnnntgg-3’,而野生型小鼠rho基因序列中没有,因此该酶切位点可用来做基因型鉴定。
[0041]
(3)t7启动子序列通过pcr扩增插入到cas9(利用的spcas9,编码序列来自https://www.addgene.org/42230/)的编码区以及sgrna序列之前,用作体外转录模板。采用显微注射的方式将体外转录的cas9 mrna,sgrna和修复模板注射入c57bl/6j受精卵中,crispr/cas9系统显微注射进小鼠受精卵中进行基因切割,诱发同源重组修复。
[0042]
crispr/cas9基因编辑系统与基因组的靶位点进行结合,cas9发挥切割活性,产生dna双链断裂,从而诱发dna损伤修复,细胞通过同源重组修复dna,将修复模板定点敲入到小鼠rho基因中。
[0043]
(4)基因编辑后的受精卵发育为胚胎,转入假孕母鼠子宫中,待生产后得到基因敲入小鼠。
[0044]
t17m基因敲入小鼠rho基因部分序列如seq id no.3所示:
[0045]
gcgttagtatgatatctcgcggatgctgaatcagcctctggcttagggagagaaggtcactttataagggtctggggggggtcagtgcctggagttgcgctgtgggagccgtcagtggctgagctcgccaagcagccttggtctctgtctacgaagagcccgtgggtcagccacaagggccacagccatgaatggcacagaaggccctaacttctacgtgcccttctccaatgcgatgggcgtggtgcggagccccttcgagcagccgcagtactacctggcggaaccatggcagttctccatgctggcagcgtacatgttcctgctcatcgtgctgggcttccccatcaacttcctcacgctctacgtcaccgtacagcacaagaagctgcgcacacccctcaactacatcctgctcaacttggccgtggctgacctcttcatggtcttcggaggattc,文中dna序列(大写)为人类的75ntdna片段,突变位点(rho,p.t17m)标有下划线。
[0046]
在本发明中,小鼠繁殖并进行后代鉴定的步骤包括:
[0047]
假孕母鼠产仔后,即为f0代小鼠;取小鼠的尾巴和脚趾,pcr扩增后利用bstxi酶切验证或者进行基因测序鉴定。f0代阳性小鼠与野生型小鼠进行杂交,获得f1代小鼠,取f1代小鼠的尾巴和脚趾,提取全基因组,进行pcr扩增,bstxi酶切验证或者进行基因测序鉴定。f1代小鼠继续配种以获得更多的疾病小鼠。
[0048]
由本发明的参照图2所示,设计了sgrna1和sgrna2分别靶向目的序列以及195nt的修复模板,其中sgrna1和sgrna2分别靶向目的序列如图2a所示。所述修复模板包含75nt的人类dna序列和致病突变(rho,p.t17m)。对小鼠受精卵进行编辑并发育为胚胎。然后将基因编辑后的胚胎移植到假孕的母鼠子宫内,生产后得到基因敲入小鼠(如图1)。在设计修复模板时,由于该模板包含了75nt的人类dna序列,因此与野生型小鼠rho基因序列做对比,发现该修复模板包含bstxi酶切位点(5
’‑
ccannnnnntgg-3’),因此基因敲入小鼠rho基因序列中包含该酶切位点,而野生型(wt)小鼠rho基因序列中无。通过pcr扩增并进行bstxi酶切后,琼脂糖凝胶电泳出现两个条带的说明是基因敲入小鼠,只有一个条带的代表是野生型小鼠,从而进行鉴定(图2b)。通过sanger测序也可进行基因型鉴定(图2c)。
[0049]
由本发明的参照图3所示,进一步观察基因敲入小鼠视网膜的结构变化。oct(optical coherence tomography,即光学相干断层扫描技术)显示野生型(wt)小鼠视网膜结构清晰,而基因敲入小鼠视网膜感光细胞层明显变薄,尤其是外核层(图3a、b)。进一步做苏木素-伊红染色如图3c,与wt小鼠相比,基因敲入小鼠视网膜结构异常,最明显的是外核层变薄至几乎消失。
[0050]
由上可知,由本发明的参照图4所示,由上可知,t17m基因敲入小鼠视网膜结构变化明显,对小鼠视网膜的电生理功能进行了评估。视网膜电图是光刺激视网膜时从相应部位记录到的视网膜总电生理反应。在暗适应视网膜电图检测视杆细胞反应时(a、e),与wt相比,b波波幅明显减小(n=10,p《0.0001);在暗适应混合反应时,正常的野生型小鼠依次有一个负相较小的a波和一个较大的正相b波,t17m基因敲入小鼠的a波和b波波幅(b、d、e)明显减小,差异显著(n=10,p《0.0001);在检查视锥细胞功能时(c、d、e),与wt相比,a波(n=10,p》0.05)无明显差异,b波波幅明显减小(n=10,p《0.01),这提示t17m基因敲入小鼠视网膜中有大量视杆细胞凋亡,但是视锥细胞还保留了部分功能。t17m基因敲入小鼠视网膜的功能明显降低与oct检测到的视网膜外核层变薄结果是一致的。
[0051]
由本发明的参照图5所示,通过眼底视网膜检测和血管造影(如图5,箭头指示)可以观察到t17m基因敲入小鼠视网膜眼底出现明显视网膜色素变性,视网膜动脉逐渐变细,并且出现串珠样改变。
[0052]
综上可知,t17m基因敲入小鼠视网膜的结构和功能出现明显异常,这与临床病人表征相同,说明成功构建了t17m基因敲入小鼠疾病模型。
[0053]
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明,任何本领域技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容做出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简介修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1