一种苦荞的遗传转化方法
1.本发明涉及植物组织培养及遗传转化,具体涉及一种苦荞的遗传转化方法。
背景技术:
2.苦荞,为双子叶蓼科荞麦属植物,因其具有丰富的营养价值和药理效应而被称为“五谷之王”。苦荞不仅脂肪、蛋白质、维生素及矿物质含量均高于小麦和大米,还具有降血脂、降血糖及抗衰老的功效,其加工后的各类产品备受消费者青睐。苦荞性喜冷凉耐贫瘠,多种植于我国西南高寒山区,对当地的发展起着重要的作用。
3.我国苦荞种质资源丰富,但种植分散且规模小,存在品种退化、产量低等问题。而且,苦荞在遗传背景上不适合杂交育种,突变育种周期很长,难以满足当前日益迫切的育种需求。随着现代生物科技的迅猛发展,以基因编辑为代表的现代生物技术手段已成为用于作物改良的有效选择。因此,建立稳定的苦荞遗传转化再生体系技术平台,已成为支撑苦荞前沿领域研究的关键环节。尽管目前国内外对于苦荞再生体系和遗传转化方面取得了一定进展,但由于苦荞存在基因型复杂、再生植株存活率低等问题,使其遗传转化体系仍不成熟,转基因株系的获取非常困难。
4.受限于苦荞组培效率的低下,苦荞的遗传转化体系迟迟未能建立。因此亟需建立一种稳定、高效的苦荞遗传转化体系,可为深入开展苦荞生物学基础研究和分子辅助育种研究提供有效途径。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供一种苦荞的遗传转化方法,以至少达到培养流程简单、组培苗植株表型一致性高、能稳定地保持母体的优良特性。
6.本发明的目的是通过以下技术方案来实现的:
7.一种苦荞的遗传转化方法,包括以下步骤:
8.(1)无菌苗的制备:将灭菌的苦荞种子接种至ms培养基中进行培养,得到无菌苗;
9.(2)农杆菌的培养:将农杆菌接种于农杆菌活化培养基上活化,得到农杆菌侵染液;
10.(3)外植体制备:将所述无菌苗用无菌刀片在子叶连接处向下2-5mm处平切,去除下胚轴区域及真叶部分,得到子叶节外植体;
11.(4)侵染与共培养:将所述子叶节外植体放入所述农杆菌侵染液中浸染,将侵染后的外植体吸干水分,放入共培养培养基中暗培养,得到共培养子叶节外植体;
12.(5)不定芽诱导培养:将所述共培养子叶节外植体接种至不定芽诱导培养基上培养,得到继代培养丛芽;
13.(6)生根培养:将所述继代培养丛芽分成单株,接种至生根培养基中培养,得到苦荞转基因植株。
14.进一步的,步骤(1)中,所述ms培养基的成分为:蔗糖25-35g/l、ms粉4-5g/l、琼脂
粉6-8g/l;调节所述ms培养基的ph值为5.6-6.0,所述培养的条件为20-25℃、光照强度5000-6000lx、光照14-16h/d,时间10-15d。
15.进一步的,步骤(1)中,步骤(1)中,所述灭菌的具体方法为将苦荞种子依次用70%酒精浸泡30s、无菌水清洗2-3次、0.1%升汞消毒8min、无菌水清洗6-8次,然后去除表面水分。
16.进一步的,步骤(2)中,所述农杆菌为lba4404;所述农杆菌载体为pchf3-yfp;所述农杆菌活化培养基的组分包括牛肉膏4-6g/l、蛋白胨4-6g/l、酵母膏0.5-2g/l、蔗糖4-6g/l、七水硫酸镁0.2-0.8g/l,调节所述农杆菌活化培养基的ph值为7.0-7.5。
17.进一步的,步骤(2)中,所述农杆菌制备成农杆菌菌液后接种于农杆菌活化培养基上活化,所述农杆菌菌液的od
600
为0.4-0.6。
18.进一步的,步骤(4)中,所述共培养培养基的组分包括蔗糖30g/l、ms粉4.74g/l、琼脂粉7g/l、乙酰丁香酮100mg/l;调节所述共培养培养基ph值为5.6-6.0,所述培养的条件为22℃下暗培养2-3d。
19.进一步的,步骤(5)中,所述不定芽诱导培养基的组分包括蔗糖25-35g/l、ms粉4-5g/l、琼脂粉6-8g/l、6-苄氨基嘌呤0.5-2.5mg/l;调节所述不定芽诱导培养基的ph为5.6-6.0,所述培养的条件为20-25℃,光照强度5000-6000lx,光照14-16h/d,培养15-25d。
20.进一步的,所述不定芽诱导培养基的组分还包括卡那霉素50mg/l、特美汀50mg/l。
21.进一步的,步骤(5)中,在不定芽诱导培养基上期间,每隔14-16天继代培养一次。
22.进一步的,步骤(6)中,所述生根培养基的组分包括蔗糖25-35g/l、ms粉4-5g/l、琼脂粉6-8g/l、吲哚丁酸1-2mg/l;调节所述生根培养基的ph=5.6-6.0,所述培养的条件为20-25℃,光照强度5000-6000lx,光照14-16h/d,培养15-25d。
23.进一步的,所述生根培养基还包括卡那霉素40-60mg/l、特美汀40-60mg/l。
24.本发明的有益效果是:
25.1、本发明利用子叶节为起始外植体,通过直接器官发生途径建立一种快速有效的再生体系,不经由愈伤组织的诱导及分化,简化了培养流程,在短时间内便可获得苦荞再生植株。
26.2、本发明通过优化苦荞子叶节不定芽诱导的培养基,极大程度地提高苦荞子叶节的再生效率。
27.3、本发明通过实验探究优化转化过程中的处理方式和培养条件,得到转基因阳性株系,顺利建立稳定的农杆菌介导的苦荞遗传转化体系。
28.4、本发明方法培养的组培苗植株表型一致性高,稳定地保持母体的优良特性。
附图说明
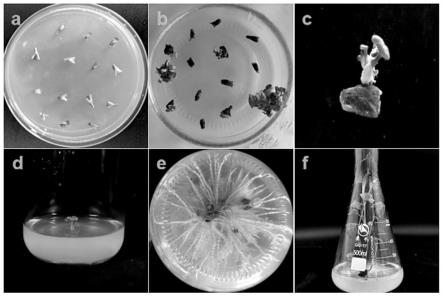
29.图1为本发明从子叶节到转基因植株的全程图;
30.图2为实施例1中不同浓度激素对子叶节出芽率的影响;
31.图3为实施例2中经不同条件处理下农杆菌转化后的出芽率;
32.图4为实施例3中苦荞再生植株的pcr产物凝胶电泳图,m-d2000 marker;1-质粒;2-ddh2o;3-10转化后再生单株;
33.图5为实施例3中苦荞pcr产物测序结果比对分析;
34.图6为实施例4中转基因苦荞和野生型苦荞叶片的荧光观察图;
35.图7为对比例1中上下胚轴外植体在不定芽诱导培养基中的生长情况;
36.图8为对比例1中上下胚轴在不同芽诱导培养基中的膨化率;
37.图9为对比例2中毛状根外植体在愈伤诱导培养基中的20天的生长情况;
38.图10为对比例2中毛状根在不同愈伤培养基中的膨化率。
具体实施方式
39.下面结合附图进一步详细描述本发明的技术方案,但本发明的保护范围不局限于以下所述。
40.实施例1
41.子叶节不定芽的诱导
42.无菌苗的制备:挑选颗粒饱满、无虫眼的苦荞种子,42℃去离子水浸泡30min,用干净镊子剥皮,消毒接种至ms培养基中;其中,消毒方式在超净工作台用70%乙醇浸泡30s,无菌水清洗3次,再用0.1%升汞浸泡8min,无菌水清洗7次。将消毒干净的种子放在无菌滤纸上吸干水分,放入ms培养基中,每瓶放10-13颗,暗培2-3d,再光培10-15d,ms培养基成分为蔗糖30g/l、ms粉4.74g/l、琼脂粉7g/l;
43.外植体制备:选取步骤1中培养15d无污染、健康的无菌苗,用无菌刀片在子叶连接处向下2mm处平切,去除下胚轴区域及真叶部分,得到子叶节外植体;
44.不定芽诱导培养:将子叶节接种至不同激素浓度的不定芽诱导培养基上,光照强度5000lx,光照16h/d,培养20d;期间,每隔15d继代培养1次。
45.统计出芽率并确定最佳不定芽诱导培养基,培养基激素配比及出芽率(芽诱导率)见表1和说明书附图2。由表1可以看出,j2培养基的出芽率最高,为94.44%。
46.表1不同激素配比的再生培养基对出芽率的影响
[0047][0048]
实施例2
[0049]
外植体的遗传转化
[0050]
将带有植物表达载体pchf3-yfp的农杆菌lba4404放入yeb培养液中培养(50mg/l利福平和50mg/l卡那霉素),所用yeb培养基其成分为牛肉膏5g/l、蛋白胨5g/l、酵母膏1g/l、蔗糖5g/l、七水硫酸镁0.5g/l,naoh调至ph=7.0-7.5;待od
600
至0.6~0.8时,离心10min,弃上清液,用重悬液重悬至od
600
值分别为0.3、0.5、0.7,侵染步骤1处理的外植体时间分别为8min、12min、16min,期间不时轻轻晃动,将侵染后的外植体吸干水分,放入垫有一张无菌滤纸的共培养培养基中,暗培养2-3d;所述共培养培养基中含有100mg/l的乙酰丁香酮。
[0051]
不定芽诱导培养:选取共培养2-3d的子叶节外植体;将子叶节接种至不定芽诱导培养基上,所述不定芽培养培养基以ms基础培养基,并添加6-苄氨基嘌呤(6-ba)1mg/l,光照强度5000lx,光照16h/d,培养20d,;期间,每隔15d继代培养1次;
[0052]
统计经农杆菌转化后的出芽率并确定最佳处理条件,出芽率见图3。由图3可以看出,在od
600
值为0.5,侵染时间为16min条件下的出芽率最高,为28.57%。
[0053]
生根培养:将第(5)步继代培养伸长的丛芽分成单株,接种至生根培养基中,进行生根诱导,最终得到苦荞转基因植株;所述生根培养基ms培养基作为基础培养基,并添加iba1.5mg/l,光照强度5000-6000lx,光照16h/d,培养时间为15-25d。
[0054]
实施例3
[0055]
转基因植株的dna提取、筛选标记基因pcr扩增及产物测序
[0056]
将生根获得的苗,取适量苦荞叶片置于研钵中,加入液氮充分研磨。加入400μl缓冲液fp1和6μl的rnasea(10mg/l),旋涡振荡1min,室温放置10min。加入130μl缓冲液fp2,充分混匀,旋涡振荡1min。12000rpm(~13400
×
g)离心5min,将上清转移至新的离心管中。向上清液中加入0.7倍体积的异丙醇,充分混匀,此时会出现絮状基因组dna。12000rpm(~13400
×
g)离心2min,弃上清,保留沉淀。加入600μl70%乙醇,涡旋振荡5sec,12000rpm(~13400
×
g)离心2min,弃上清。再次加入600μl70%乙醇,涡旋振荡5sec,12000rpm(~13400
×
g)离心2min,弃上清。开盖倒置,室温5-10min,彻底晾干残余的乙醇。加入适量洗脱缓冲液te,65℃水浴10-60min溶解dna,期间颠倒混匀数次助溶,最终得到dna溶液。取2μldna电泳检查dna的质量,于-20℃保存。
[0057]
以获得的独立单株的dna样品作为模板,以筛选标记eyfp设计的引物进行pcr扩增。
[0058]
扩增引物:eyfp-f:catcctggtcgagctggacg
[0059]
eyfp-r:ggtcttgtagttgccgtcgtc
[0060]
扩增条件:98℃预变性3min,98℃变性30s,58℃退火30s,72℃延伸20s,32-33循环,72℃终延伸5min。
[0061]
目标片段:296bp
[0062]
将pcr产物跑琼脂糖凝胶电泳,电泳图见图4。由电泳图可以看出,有3株为转化阳性株,再生株阳性率37.5%。
[0063]
pcr产物测序结果比对分析见图5,由图5可以看出,pcr产物的测序结果与eyfp基因序列完全匹配。
[0064]
实施例4
[0065]
转基因苦荞和野生型苦荞叶片的荧光观察
[0066]
利用激光共聚焦显微镜对转化后的苦荞叶片和野生型苦荞叶片进行观察,
[0067]
在eyfp通道(515nm)激发下,能够观察到有明显的荧光;空白对照无荧光,见图6。结果表明转入的外源基因已整合到苦荞叶片基因组中。
[0068]
由图3可知,经最佳条件下农杆菌侵染后子叶节出芽率为28.57%,由图4可知,再生株阳性率为37.5%,转基因效率为10.71%。
[0069]
对比例1
[0070]
以苦荞的上下胚轴为外植体,进行遗传转化,具体方法如下:
[0071]
(1)无菌苗的制备:将消毒苦荞种子接种至ms培养基中进行培养,得到无菌苗;
[0072]
(2)外植体制备:将所述无菌苗上胚轴和下胚轴用无菌刀片切割成0.5cm的小段,得到上胚轴和下胚轴外植体;
[0073]
(3)农杆菌的培养:;将带有植物表达载体pchf3-yfp质粒的农杆菌lba4404放入yeb培养液中培养(50mg/l利福平和50mg/l卡那霉素),所用yeb培养基其成分为牛肉膏5g/l、蛋白胨5g/l、酵母膏1g/l、蔗糖5g/l、七水硫酸镁0.5g/l,naoh调至ph=7.0-7.5;
[0074]
(4)侵染与共培养:待农杆菌od
600
至0.6~0.8时,离心10min,弃上清液,用重悬液重悬至od
600
值分别为0.3、0.45、0.6,侵染步骤2处理的外植体时间分别为10min、20min、30min,期间不时轻轻晃动,将侵染后的外植体吸干水分,放入垫有一张无菌滤纸的共培养培养基中,暗培养2-3d;所述共培养培养基中含有100mg/l的乙酰丁香酮,得到共培养上胚轴和下胚轴外植体;
[0075]
(5)不定芽诱导培养:将所述共培养上胚轴和下胚轴外植体接种至不定芽诱导培养基上培养,每隔15d继代一次。
[0076]
实验结果:以上胚轴和下胚轴作为外植体在j1-j10芽诱导培养基上只能形成愈伤组织,始终未分化出芽,具体见图7。
[0077]
对比例2
[0078]
以苦荞的毛状根为外植体,进行遗传转化,具体方法如下:
[0079]
(1)无菌苗的制备:将消毒苦荞种子接种至ms培养基中进行培养,得到无菌苗;
[0080]
(2)农杆菌的培养:将带有植物表达载体pchf3-yfp质粒的农杆菌a4放入ty培养液中培养(50mg/l利福平和50mg/l卡那霉素),所用ty培养基其成分为蛋白胨5g/l、酵母膏3g/l、1m无菌cacl210ml/l;
[0081]
(3)外植体制备:将所述无菌苗用无菌剪刀修剪,保留子叶和下胚轴,得到外植体;
[0082]
(4)侵染与共培养:将所述外植体放入所述发根农杆菌侵染液中浸染,将侵染后的外植体吸干水分,放入共培养培养基中暗培养,得到共培养外植体;
[0083]
(5)毛状根诱导培养:将所述共培养外植体接种至毛状根诱导培养基上培养,15天继代一次,得到毛状根;
[0084]
(6)将所述毛状根切割成1.5-2cm的小段,放入愈伤诱导培养基上培养,每个瓶子放5个外植体;
[0085]
采用的愈伤诱导培养基的激素配比如下表所示:
[0086][0087][0088]
实验结果:以毛状根作为外植体在l1-l8愈伤诱导培养基上,20d形成了少量愈伤组织,分化速度缓慢,具体见图9。
[0089]
以上所述仅是本发明的优选实施方式,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1