一种四倍体翘嘴鲌的生产方法
1.本发明属于鲌亚科鱼类育种技术领域,具体涉及一种四倍体翘嘴鲌的生产方法。
背景技术:
2.翘嘴鲌(cultert alburnus),隶属鲤形目,鲤科,鲌亚科,鲌属。翘嘴鲌分布于黑龙江、长江至珠江等水系的干、支流及其附属湖泊中,是长江中下游、黑龙江流域等地的名贵经济鱼类。翘嘴鲌肉质洁白细嫩,味道鲜美,营养价值较高,市场供不应求。
3.性腺发育会影响了鱼的生长和肉质,降低了鱼的商品质量。随着翘嘴鲌养殖面积的扩增,逃逸到自然界中的概率极大增加,可能会给自然界中的鱼类种质资源造成污染。三倍体鱼因染色体组成不平衡,性腺不能发育成熟,因而较二倍体鱼生长更快、商品价值更高,更受消费者欢迎。从细胞遗传学角度来看,三倍体是非偶数染色体组,故阻碍了生殖细胞正常的减数分裂,结果常常导致性腺不能发育。不育的三倍体经济鱼类因为没有性成熟阶段性腺发育的能量损耗,所以有以下优点:1.避免了性腺发育阶段和产卵季节鱼肉质量下降并延长了上市时间;2.避免了性腺发育阶段的生长停滞和死亡率增加;3.缩短了养殖周期,减少了养殖成本并可养成大型个体。除少数种类外,自然界绝大部分鱼类是以二倍体形式存在的,并以两性融合的方式繁殖后代,需要人工诱导才能产生三倍体。与植物相比,脊椎动物的多倍体事件比较稀少。多倍化事件是物种适应性进化的重要动力。含有多套亚基因组的多倍体常具有更强的环境适应性优势。鱼类染色体具有较大的可塑性,易于加倍,这是人工诱导多倍体技术方法的理论基础。用人工的方法获得三倍体可通过两条途径。一条是直接途径,即用物理或化学的方法对受精卵进行处理,阻碍第二极体外排。物理方法和化学方法诱导三倍体,因外界应激和胁迫,会导致受精卵坏死率高、出苗率低、幼鱼畸形率高及三倍化比率偏低等现象,使得三倍体鱼的生产规模受到很大限制。另一条是间接途径,即首先诱导获得四倍体,待四倍体个体性成熟后再与二倍体个体自然交配,获得三倍体。从理论上讲,第二条途径有其优越之处,一旦获得四倍体个体后,就不需要再进行物理或化学诱导,避免了诱导过程对胚胎的损伤。如果能建立稳定的四倍体品系,获得三倍体就变成一件非常容易的事情了。但目前人工诱导的三倍体绝大部分是采用第一条途径获得的,这是因为阻止第二极体外排的方法比较成熟。四倍体的诱导是阻止第一次卵裂,这比诱导三倍体要困难得多,成功率很低,目前只在少数鱼类如虹鳟和鲫,获得过性成熟的四倍体。研究多倍体诱导技术,建立遗传稳定、纯度极高的四倍体鱼系,对推动三倍体养殖产业的发展,具有重要的现实意义和重大的应用价值。
4.人工诱导多倍体的方法主要有:物理学方法,化学方法和生物学方法。物理学方法主要有静水压法,温度休克法和电休克法等,应用较多的是温度休克法和静水压法。无论采用哪一种方法诱导,都必须严格控制处理的起始时间和持续时间。如:以水晶彩鲫为例,受精卵的压力敏感期仅仅在受精后4~5分钟,在此之前为卵子启动期,施加压力会破坏卵子的激动和修整过程,造成发育受阻;其后为压力不应期,此时第二次减数分裂趋于明朗,压力对保留第二极体体失去作用。因此,为了获得三倍体水晶彩鲫,静水压诱导只能在受精后
4~5分钟进行。美洲红点鲑和胡子鲶的三倍体诱导结果表明,诱导处理的起始时间和持续时间不同会导致不同的结果。
5.迄今为止,有关鲌亚科四倍体鱼类的生产方法等方面的研究尚未见研究报道。由于种属差异,将已报道的海水鱼类、甲壳类和大多数淡水鱼类四倍体诱导的技术参数用于翘嘴鲌四倍体诱导时,四倍体翘嘴鲌诱导率极低,难以满足生产的需要。因此亟需建立适合四倍体翘嘴鲌的生产方法。
技术实现要素:
6.为了解决直接获得三倍体鱼类存在的技术问题,本发明提供了一种适用于四倍体翘嘴鲌的生产方法,该方法能有效诱导翘嘴鲌受精卵染色体加倍产生四倍体,使其与二倍体个体自然交配,更容易产生三倍体。
7.本发明提供的四倍体翘嘴鲌的生产方法具体包括以下步骤:
8.(1)翘嘴鲌人工授精:采集翘嘴鲌成熟的卵和精液,将卵子置于干燥容器中,缓慢加入精液,干法受精,缓慢操作使精卵混合均匀,然后加入养殖用水,缓慢摇晃完成精卵授精过程,获得受精卵;
9.(2)四倍体翘嘴鲌诱导:将步骤(1)得到的受精卵放入静水压力器仓内,进行静水压力处理,将静水压力处理后的受精卵进行温度休克及细胞松弛素b水溶液联合诱导处理,取出后移入细胞松弛素b水溶液中进行化学诱导,最终将授精卵转移到养殖水中孵化。
10.进一步地限定,步骤(1)所述精液和卵的体积比为1000μl∶100ml。
11.进一步地限定,步骤(1)所述干燥容器的温度为23~25℃。
12.进一步地限定,步骤(1)所述养殖用水的温度为23-25℃,添加量为卵量体积的10倍。
13.进一步地限定,步骤(2)所述静水压力处理是在授精35min后。
14.进一步地限定,步骤(2)所述静水压力处理,压力为1200psi,处理时间为3min。
15.进一步地限定,步骤(2)所述温度休克及细胞松弛素b水溶液联合诱导处理是将受精卵浸入温度为-2-2℃,浓度为1.5mg/l的细胞松弛素b水溶液中。
16.进一步地限定,步骤(2)所述温度休克及细胞松弛素b水溶液联合诱导处理的时间为10min。
17.进一步地限定,步骤(2)所述化学诱导处理是将受精卵移入23-25℃的1.5mg/l的细胞松弛素b水溶液中孵化1h。
18.进一步地限定,步骤(2)所述养殖水中孵化,养殖水水温恒定在23-25℃。
19.本发明的有益效果:
20.本发明建立了采用静水压力处理、温度休克及化学物质联合诱导处理与化学物质诱导处理结合的四倍体翘嘴鲌的生产方法,首次确定了翘嘴鲌受精卵第一次卵裂的技术参数及四倍体诱导的最佳生产条件。本发明建立的四倍体翘嘴鲌诱导方法操作流程清晰、实用性强,可成功诱导产生四倍体翘嘴鲌,四倍体翘嘴鲌的诱导效率可达23%。本发明提供的四倍体翘嘴鲌生产方法适合于人工诱导四倍体翘嘴鲌的生产,为翘嘴鲌多倍体育种开辟了新的技术途径。
21.本发明通过对获得的四倍体进行体长、体重、红细胞面积及体积、dna含量、染色体
数的测定及精巢组织的观察,发现利用本发明所述四倍体翘嘴鲌生产方法获得的四倍体翘嘴鲌相比于二倍体翘嘴鲌体长和体重均有显著增长,红细胞的面积及体积均有显著增长,染色体的倍数增加,细胞内dna的含量也相应增高,细胞的体积与染色体的倍数成正比,精巢组织结构更加致密,数据差异符合倍性关系,证明本发明所述的四倍体翘嘴鲌生产方法能够获得四倍体翘嘴鲌。
22.此外,本发明的鉴定过程确定了相同养殖条件下,二倍体翘嘴鲌和四倍体翘嘴鲌体长比和体重比;四倍体翘嘴鲌红细胞体积及红细胞核体积范围;确定了二倍体翘嘴鲌和四倍体翘嘴鲌dna相对含量的比值,确定了四倍体翘嘴鲌dna的绝对含量;确定了四倍体翘嘴鲌染色体数目;确定了二倍体和四倍体翘嘴鲌性腺切片的差异,为四倍体翘嘴鲌的快速鉴定提供了数据支撑。
附图说明
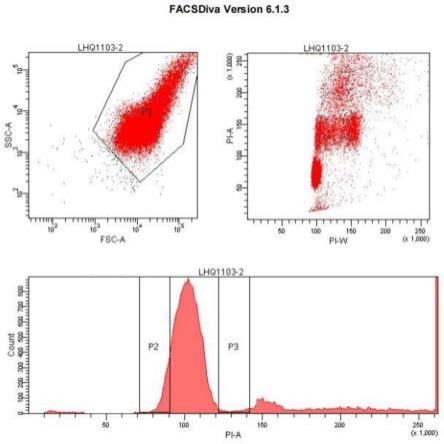
23.图1为二倍体翘嘴鲌dna相对含量图;
24.图2为四倍体翘嘴鲌dna相对含量图;
25.图3为二倍体翘嘴鲌染色体中期分裂相图;
26.图4为四倍体翘嘴鲌染色体中期分裂相图;
27.图5为4龄二倍体翘嘴鲌精巢组织切片图(40x);
28.图6为4龄四倍体翘嘴鲌性腺组织切片图(40x)。
具体实施方式
29.为了使本发明的目的、技术方案及优点更加清楚明白,下面结合具体的实施方式及说明书附图对本发明进行进一步详细说明。下述实施例中所使用的实验方法如无特殊说明均为常规方法,所用材料、试剂、方法和仪器,未经特殊说明,均为本领域常规材料、试剂、方法和仪器,本领域技术人员均可通过商业渠道获得。
30.本发明对不同诱导条件获得四倍体翘嘴鲌的比例进行比较,优化得到了适用于四倍体翘嘴鲌的生产方法,在所有对比例中,翘嘴鲌人工授精的方法如下:
31.选择性成熟的翘嘴鲌,采集成熟卵和精液,卵子置于23-25℃的干燥容器中,缓慢加入精液,精液和卵的体积比为1000μl∶100ml,干法受精,缓慢操作使精卵混合混匀,然后加入10倍于卵量体积的温度23-25℃养殖用水,养殖用水符合渔业水质标准(gb11607-1989),缓慢摇晃完成精卵授精过程。
32.一、四倍体翘嘴鲌诱导方法的确定
33.(1)四倍化起始时间的确定:
34.对比例1:精卵受精后30min,静水压力1000psi,作用时间为4min,转入养殖水完成孵化。
35.对比例2:精卵受精后35min,静水压力1000psi,作用时间为4min,转入养殖水完成孵化。
36.对比例3:精卵受精后40min,静水压力1000psi,作用时间为4min,转入养殖水完成孵化。
37.对比例4:精卵受精后45min,静水压力1000psi,作用时间为4-5min,转入养殖水完
成孵化。
38.对比例5:精卵受精后50min,静水压力1000psi,作用时间为4-5min,转入养殖水完成孵化。
39.对上述对比例获得的四倍体比例进行统计,对比例1四倍化比例为2%,对比例2四倍化比例为8%,对比例3四倍化比例为5%,对比例4四倍化比例为0%,对比例5四倍化比例为0%,对比例2四倍化比例最高,因此确定诱导四倍化起始时间为受精后35min。
40.(2)静水压力处理时间的确定:
41.对比例6:受精后35min,静水压力1000psi,作用时间为2min,转入养殖水完成孵化化。
42.对比例7:受精后35min,静水压力1000psi,作用时间为3min,转入养殖水完成孵化。
43.对比例2:受精后35min,静水压力1000psi,作用时间为4min,转入养殖水完成孵化。
44.对比例8:受精后35min,静水压力1000psi,作用时间为5min,转入养殖水完成孵化。
45.对上述对比例获得的四倍体比例进行统计,发现对比例7四倍化比例为12%,在几个对比例中四倍化比例最高,因此将静水压力处理的时间确定为3min。
46.(3)静水压力处理过程中压力的确定:
47.对比例9:受精后35min,静水压力500psi,作用时间为3min,转入养殖水完成孵化。
48.对比例10:受精后35min,静水压力800psi,作用时间为3min,转入养殖水完成孵化。
49.对比例7:受精后35min,静水压力1000psi,作用时间为3min,转入养殖水完成孵化。
50.对比例11:受精后35min,静水压力1200psi,作用时间为3min,转入养殖水完成孵化。
51.对比例12:受精后35min,静水压力1500psi,作用时间为3min,转入养殖水完成孵化。
52.对比例13:受精后35min,静水压力2000psi,作用时间为3min,转入养殖水完成孵化。
53.对上述对比例获得的四倍体比例进行统计,各对比例中四倍化比例最高的是对比例11,四倍化比例为15%,因此,确定诱导条件为精卵受精后35min,于静水压力1200psi下,处理3min,转入养殖水完成孵化。
54.(4)是否进行化学诱导及化学诱导处理时间、诱导剂浓度的确定:
55.对比例11:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵不进行化学物质诱导处理,转入养殖水完成孵化。
56.对比例14:受精35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行化学物质诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为23℃,处理时间为10min,然后转入养殖水完成孵化。
57.对比例15:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受
精卵进行化学物质诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为23℃,处理时间为20min,然后转入养殖水完成孵化。
58.对比例16:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行化学物质诱导处理,受精卵浸入3.0mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为23℃,处理时间为10min,然后转入养殖水完成孵化。
59.对上述对比例获得的四倍体比例进行统计,各对比例中对比例14生产的四倍化比例最高,四倍化比例为17%,因此确定化学诱导处理为将静水压力处理后的受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为23℃,处理时间为10min,然后转入养殖水完成孵化。
60.(5)是否进行温度休克及化学物质联合诱导处理的确定:
61.对比例14:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行化学物质诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为23℃,处理时间为10min,然后转入养殖水完成孵化。
62.对比例17:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行温度休克及化学物质联合诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为-2-2℃,处理时间为10min,然后转入养殖水完成孵化。
63.对比例18:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行温度休克及化学物质联合诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为-2-2℃,处理时间为20min,然后转入养殖水完成孵化。
64.对比例19:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行化学物质诱导处理,受精卵浸入受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为23℃,处理时间为20min,然后转入养殖水完成孵化。
65.对上述对比例获得的四倍体比例进行统计,各对比例中对比例17生产的四倍化比例最高,四倍化比例为18%。因此,确定将静水压力处理后的受精卵进行温度休克及化学物质联合诱导处理,温度休克及化学物质联合诱导处理是将静水压力处理后的受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为-2-2℃,处理时间为10min,然后转入养殖水完成孵化。
66.(6)温度休克及化学物质联合诱导处理后是否进行化学物质诱导处理及化学物质诱导处理时间的确定:
67.对比例17:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行温度休克及化学物质联合诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为-2-2℃,处理时间为10min,然后转入养殖水完成孵化。
68.对比例20:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行温度休克及化学物质联合诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为-2-2℃,处理时间为10min,然后进行化学物质诱导处理,将受精卵移入23-25℃的1.5mg/l的细胞松弛素b水溶液中孵化1h;最后,受精卵转移到养殖水中,温度恒定在23-25℃,完成孵化。
69.对比例21:受精后35min,静水压力1200psi,作用时间为3min,静水压力处理后,受精卵进行温度休克及化学物质联合诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处
理,细胞松弛素b水溶液温度为-2-2℃,处理时间为10min,;然后进行化学物质诱导处理,将受精卵移入23-25℃的1.5mg/l的细胞松弛素b水溶液中孵化2h;最后,受精卵转移到养殖水中,温度恒定在23-25℃,完成孵化。
70.对上述对比例获得的四倍体比例进行统计,各对比例中对比例20生产的四倍化比例最高,四倍化比例为23%。
71.综合上述各对比例的四倍体比例,最终确定生产四倍体翘嘴鲌生产方法:
72.(1)翘嘴鲌人工授精:
73.选择性成熟的翘嘴鲌,采集成熟卵和精液,卵子置于23-25℃的干燥容器中,缓慢加入精液,精液和卵的体积比为1000μl∶100ml,干法受精,缓慢操作使精卵混合混匀,然后加入10倍于卵量体积的温度23-25℃养殖用水,养殖用水符合渔业水质标准(gb11607-1989),缓慢摇晃完成精卵授精过程。
74.(2)四倍体翘嘴鲌诱导:
75.精卵授精后35min时,受精卵放入静水压力器仓内进行静水压力处理,压力为1200psi,处理时间为3min;静水压力处理后,受精卵进行温度休克及化学物质联合诱导处理,受精卵浸入1.5mg/l的细胞松弛素b水溶液处理,细胞松弛素b水溶液温度为-2-2℃,处理时间为10min;然后进行化学物质诱导处理,将受精卵移入23-25℃的1.5mg/l的细胞松弛素b水溶液中孵化1h;最后,受精卵转移到养殖水中,温度恒定在23-25℃,完成孵化。
76.二、四倍体翘嘴鲌的鉴定
77.(1)生长参数鉴定
78.对相同养殖条件下的二倍体翘嘴鲌和利用本发明所述四倍体翘嘴鲌生产方法获得的四倍体翘嘴鲌的体长和体重进行测量,实验样本由2-6龄5个年龄组组成,体重和体长参数见表1。
79.由表1的数据可知,二倍体翘嘴鲌和四倍体翘嘴鲌体长和体重差异显著(p﹤0.05)。2龄二倍体翘嘴鲌和四倍体翘嘴鲌体长比为1:1.53,体重比为1:1.42,4龄二倍体翘嘴鲌和四倍体翘嘴鲌体长比为1:1.71,体重比为1:1.68。可见相同养殖条件下,四倍体翘嘴鲌在体长和体重性状上显著优于二倍体,生长速度增长更快,个体更大。
80.表1二倍体(2n)翘嘴鲌和四倍体(4n)翘嘴鲌体长和体重参数
[0081][0082]
(2)红细胞体积鉴定
[0083]
一般认为细胞大小与染色体和dna含量有关,在单个细胞中,因四倍体染色体数目多于二倍体,所以为了维持核质比例的恒定,四倍体细胞体积一般要大于二倍体。对相同养殖条件下的二倍体翘嘴鲌和利用本发明所述四倍体翘嘴鲌生产方法获得的四倍体翘嘴鲌
的红细胞及细胞核各项参数进行测定,测定方法为采集二倍体翘嘴鲌和四倍体翘嘴鲌的血液,制备血涂片,he染色,光学显微镜下观察。二倍体翘嘴鲌和四倍体翘嘴鲌的红细胞及细胞核各项参数结果见表2。
[0084]
由表2可以看出,四倍体翘嘴鲌各项数值均显著高于二倍体翘嘴鲌。四倍体翘嘴鲌红细胞长径、短径、红细胞面积、红细胞体积分别为二倍体翘嘴鲌的1.76倍、1.65倍、1.72倍和1.72倍,四倍体翘嘴鲌红细胞核长径、短径、核面积以及红细胞核体积分别为二倍体的1.81倍、1.79倍、1.84倍、1.79倍,二倍体翘嘴鲌和四倍体翘嘴鲌各项参数均有显著性差异(p﹤0.05)。其中,二倍体翘嘴鲌红细胞体积范围在70.23
±
12.26μm3之间,红细胞核体积范围在56.67
±
6.14μm3之间;四倍体翘嘴鲌红细胞体积范围在130.62
±
9.57μm3之间,红细胞核体积范围在101.44
±
24.12μm3之间;二倍体翘嘴鲌与四倍体翘嘴鲌红细胞体积比值为1:1.86,红细胞核体积比值为1:1.79。
[0085]
表2二倍体(2n)翘嘴鲌和四倍体(2n)翘嘴鲌的红细胞及细胞核参数
[0086][0087][0088]
(3)dna含量鉴定
[0089]
对相同养殖条件下的二倍体翘嘴鲌和利用本发明所述四倍体翘嘴鲌生产方法获得的四倍体翘嘴鲌的dna含量进行测定。测定方法为对二倍体翘嘴鲌和四倍体翘嘴鲌进行尾静脉取血,血液:0.75%生理盐水=1:4比例充分混合,用淋巴细胞分离液分离淋巴细胞,pi避光4℃染色30min,采用partec倍性测定仪400目过滤后上机进行倍性鉴定。检测100个样本(二倍体翘嘴鲌和四倍体翘嘴鲌各50个),利用已知dna含量的鸡血做对照。采用流式细胞术分析二倍体翘嘴鲌及本方法生产的四倍体翘嘴鲌dna的相对含量确定倍性,流式分析实验结果见图1和图2。二倍体翘嘴鲌、四倍体翘嘴鲌和鸡的dna含量见表3,由表3可知二倍体翘嘴鲌dna相对含量为55.43
±
11.52,四倍体翘嘴鲌dna相对含量为112.03
±
11.37,四倍体翘嘴鲌的dna含量为二倍体翘嘴鲌的2.02倍。已知鸡红细胞dna含量2.3pg/n-1
,则二倍体体细胞绝对dna含量为2.25pg.n-1
,四倍体翘嘴鲌体细胞绝对dna含量为4.55pg.n-1
。
[0090]
表3二倍体(2n)翘嘴鲌、四倍体(4n)翘嘴鲌和鸡的dna含量
[0091][0092]
(4)染色体计数鉴定
[0093]
对相同养殖条件下的二倍体翘嘴鲌和利用本发明所述四倍体翘嘴鲌生产方法获得的四倍体翘嘴鲌的染色体中期分裂相进行观察,方法为采用肾细胞体内培养法制备染色体中期分裂相,giemsa染色,显微镜下观察。结果见图3和图4,计数结果表明,二倍体翘嘴鲌染色体数目为2n=48,四倍体翘嘴鲌的染色体数目为4n=96,四倍体翘嘴鲌的染色体数目为二倍体翘嘴鲌的2.0倍,染色体数目符合倍性关系。
[0094]
(5)性腺组织切片鉴定
[0095]
对相同养殖条件下的二倍体翘嘴鲌和利用本发明所述四倍体翘嘴鲌生产方法获得的四倍体翘嘴鲌的性腺组织切片进行观察,方法为将性腺组织固定在4%多聚甲醛中,用梯度乙醇溶液脱水,从二甲苯中清除并包埋在石蜡中,制备5-6μm厚的切片并用苏木精-伊红(h&e)染色,显微观察。性腺组织切片图见图5和图6,由图可知4龄四倍体翘嘴鲌精巢切片与二倍体翘嘴鲌精巢切片对比,精巢组织结构致密,内含有大量分化的生殖细胞,细胞及线粒体数量正常,二者未见显著性差异。
[0096]
综合上述鉴定方法发现:利用本发明所述四倍体翘嘴鲌生产方法获得的四倍体翘嘴鲌相比于二倍体翘嘴鲌体长和体重均有显著增长,红细胞的面积及体积均有显著增长,染色体的倍数增加,细胞内dna的含量也相应增高,细胞的体积与染色体的倍数成正比,精巢组织结构更加致密,数据差异符合倍性关系。
[0097]
本发明四倍体翘嘴鲌的鉴定方法中,生长参数鉴定可以作为初筛方法,红细胞测定法可以作为大批量鉴定倍性的首选方法,鉴定的准确性可以通过染色体计数、dna含量、组织切片鉴定的方法加以完善,这样就能对大批量的鱼进行快速、有效的倍性鉴定。本发明为四倍体翘嘴鲌性别控制和多倍体育种开辟了新的技术途径。
[0098]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明精神和范围内,都可以做各种的改动与修饰,因此,本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1