一种酸性干粉消毒剂及其制备方法与应用
1.本发明涉及畜禽养殖消毒剂技术领域,更具体地说,本发明涉及一种酸性干粉消毒剂及其制备方法与应用。
背景技术:
2.在养殖生产过程中,仔猪腹泻是仔猪养育阶段最常见也是最棘手的一类病症,在猪场中该类病症占到仔猪发病的70%,由其导致的死亡占到仔猪死亡总数的近50%,给养猪业造成了重大经济损失。引起仔猪腹泻的致病原主要由沙门氏菌、大肠杆菌、流行性腹泻病毒、传染性胃肠炎病毒、轮状病毒等。生物安全防控成为防止非洲猪瘟最主要的措施,消毒是保证猪场生物安全必不可少的重要手段之一,是预防动物疫病最简单、廉价、有效、常用的技术措施。
3.为了减低仔猪腹泻率和防控非洲猪瘟,养殖户一般采取的防治措施主要有:
4.(1)清洗栏舍,在上一批母猪和仔猪转出后,对栏舍进行彻底清洗、消毒、干燥。
5.(2)清洗母猪,在母猪进产房前将母猪身上赃物冲洗干净,然后用0.1%高锰酸钾水清洗一遍,干燥后上产房。
6.(3)做好环境控制,主要包括温度和湿度控制,如冬季加强保温防冻,防止冷风侵袭、圈舍潮湿。
7.(4)对猪舍环境进行消毒,定期带猪消毒,对新生仔猪进行清洁或洗澡、擦拭等。
8.上述传统的防治措施虽然能够在一定程度上减少仔猪的腹泻率,提高仔猪的存活率,但是在实际养殖生产过程中存在以下不足:
9.(1)防治措施步骤繁琐,对于规模化养殖来说,存在工作量大、人工成本高的问题,在有效性方面仍有所欠缺。
10.(2)养殖业常使用液体干粉消毒剂,大部分为化学制剂,长期使用会导致致病菌产生耐药性。
11.(3)液体消毒液易挥发,消毒时效短,需频繁消毒,成本高。
12.(4)液体消毒剂易腐蚀栏舍和养殖器具,增加畜舍湿度,加速各类细菌的繁殖,不利于冬春季封闭栏舍时带畜使用,还会刺激动物和饲养人员。
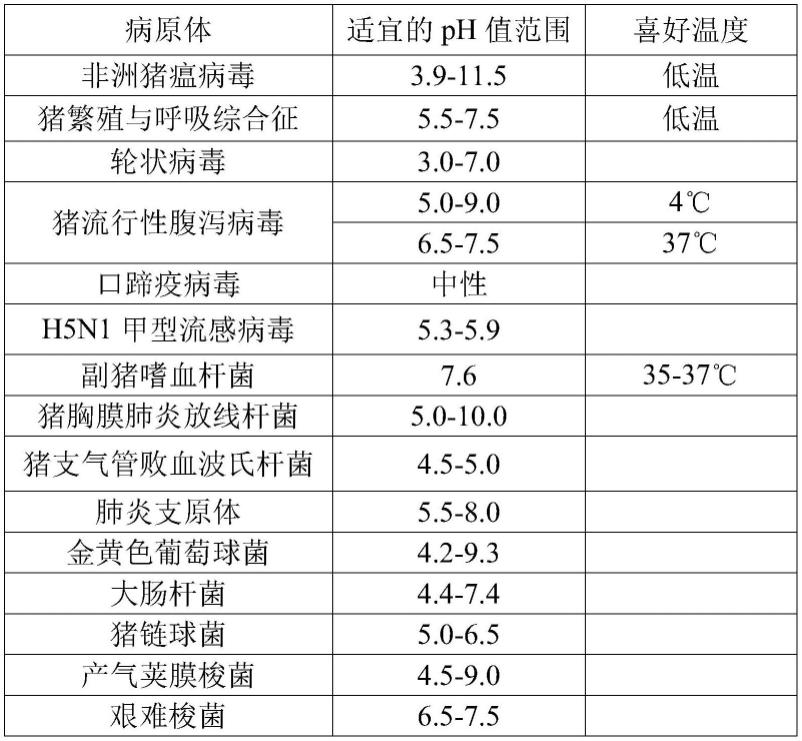
13.干粉消毒剂具有使用方便、直接喷洒,降低湿度、干燥环境,以及抑菌杀菌的作用。目前有关干粉消毒剂的研究越来越多,其主要成分是蒙脱石、沸石粉、高岭土、硅藻土等天然矿物质,但这些干粉消毒剂主要为中性或碱性,而大多数细菌、病毒能够在ph 4.0-8.0间存活,如非洲猪瘟病毒适宜ph3.9-11.5,猪流行性腹泻病毒适宜ph 6.5-7.5(37℃),大肠杆菌适宜ph为 4.4-7.4,因此这些中性或碱性的干粉消毒剂对于细菌、病毒的时效性、灭杀效果是有限的。
14.因此,有必要研究一种酸性干粉消毒剂,提高对细菌、病毒的灭杀效果。
技术实现要素:
15.本发明的第一个目的在于提供一种酸性干粉消毒剂,可提供持续性的酸性条件,提高灭杀效果;本发明的第二个目的在于提供酸性干粉消毒剂的制备方法,降低制备成本;本发明的第三个目的在于提供所述酸性干粉消毒剂的应用。
16.鉴于此,本发明的技术方案如下:
17.一种酸性干粉消毒剂,按质量百分比包括:苯甲酸钠0.1-0.3%,柠檬酸 0.1-0.3%,植物精油0.02-0.038%,抑菌除臭剂0.05-0.1%,二甲酸钾5.0-20.0%,吸附剂79.262-94.73%。
18.在本发明的一个实施例中,按消毒剂质量总占比计,所述植物精油包括百里香酚精油0.016-0.03%,香芹酚精油0.002-0.004%,肉桂醛精油 0.002-0.004%。
19.优选地,所述吸附剂为多孔性轻质活性土。
20.优选地,所述抑菌除臭剂为丝兰皂苷。
21.本发明提供以上所述酸性消毒剂的制备方法,按比例将各组分混合,搅拌均匀即得。
22.本发明提供以上所述酸性干粉消毒剂在制备灭杀细菌和/或病毒制剂中的应用,能够在段时间内实现细菌和/或病毒的灭杀;灭杀细菌制剂包括灭杀大肠杆菌制剂、灭杀沙门氏菌制剂、灭杀金黄色葡萄球菌制剂;灭杀病毒制剂包括灭杀猪流行性腹泻病毒制剂及非洲猪瘟病毒制剂。
23.相对于现有技术,本发明的有益效果包括但不限于:
24.1.本发明提供的酸性干粉消毒剂通过柠檬酸和二甲酸钾的结合,酸性强且可稀释性强,作用时间久,可有效降低消毒接触面的ph值,具有较强的细菌病毒杀灭效果。
25.2.本发明提供的酸性干粉消毒剂对非洲猪瘟病毒和猪流行性腹泻病毒有灭活作用;包含的植物精油及非刺激性成分,应用于畜禽养殖环境时安全无毒,无抗药性,无残留,成本低廉,性能稳定,使用简单,可干湿两用,用于养殖场环境、车辆、器具消毒以及干燥和伤口清洁;同时还可以改善潮湿环境并能够吸附氨气,具有良好的干燥作用。
具体实施方式
26.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
27.本发明的目的在于,解决现有技术干粉消毒剂偏中性或碱性,对于偏酸性环境下能够存活的细菌或病毒的灭杀效果较差,以及消毒剂稳定性及灭杀持久性差等缺陷。经研究,部分病原体适宜生存的环境ph值范围如表1所示。
28.表1:主要病原体在环境适宜生存的ph值
[0029][0030]
因此,本发明的一个实施例中采用如下质量分数的组分:苯甲酸钠 0.1-0.3%,柠檬酸0.1-0.3%,百里香酚精油0.016-0.03%,香芹酚精油 0.002-0.004%,肉桂醛精油0.002-0.004%,丝兰皂苷0.05-0.1%,二甲酸钾 5.0-20.0%,多孔性轻质活性土79.262-94.73%。其中,柠檬酸和二甲酸钾为控制ph值为酸性的主要成分,苯甲酸钠在酸性条件下体现杀菌、抑菌效果;百里香酚、香芹酚及肉桂醛精油作为植物性抑菌精油,可与苯甲酸钠协同杀菌;多孔性轻质活性土作为吸附剂可改善潮湿环境并能够吸附氨气,此外丝兰皂苷具备抑菌除臭的能力,既可以与杀菌成分协同作用,也能够作为吸附剂除去氨气。
[0031]
以下是本发明作为优选的实施例,用于解释本发明提出的技术方案并验证技术效果。
[0032]
实施例1
[0033]
按重量份比,称取苯甲酸钠0.1%,柠檬酸0.1%,百里香酚精油0.016%,香芹酚精油0.002%,肉桂醛精油0.002%,丝兰皂苷0.05%,二甲酸钾5.0%,多孔性轻质活性土94.73%,混合搅拌均匀,即得干粉消毒剂。
[0034]
实施例2
[0035]
按重量份比,称取苯甲酸钠0.3%,柠檬酸0.3%,百里香酚精油0.022%,香芹酚精油0.004%,肉桂醛精油0.004%,丝兰皂苷0.1%,二甲酸钾12.5%,多孔性轻质活性土86.77%,混合搅拌均匀,即得干粉消毒剂。
[0036]
实施例3
[0037]
按重量份比,称取苯甲酸钠0.2%,柠檬酸0.2%,百里香酚精油0.03%,香芹酚精
油0.003%,肉桂醛精油0.003%,丝兰皂苷0.054%,二甲酸钾15%,多孔性轻质活性土84.51%,混合搅拌均匀,即得干粉消毒剂。
[0038]
实施例4
[0039]
按重量份比,称取苯甲酸钠0.1%,柠檬酸0.1%,百里香酚精油0.016%,香芹酚精油0.002%,肉桂醛精油0.002%,丝兰皂苷0.05%,二甲酸钾20%,多孔性轻质活性土79.73%,混合搅拌均匀,即得干粉消毒剂。
[0040]
对比例1
[0041]
按重量份比,称取苯甲酸钠0.3%,二甲酸钾12.5%,多孔性轻质活性土 87.2%,混合搅拌均匀,即得干粉消毒剂。
[0042]
对比例2
[0043]
按重量份比,称取苯甲酸钠0.3%,柠檬酸0.3%,二甲酸钾12.5%,多孔性轻质活性土86.9%,混合搅拌均匀,即得干粉消毒剂。
[0044]
对比例3
[0045]
按重量份比,称取苯甲酸钠0.3%,柠檬酸0.3%,二甲酸钾12.5%,丝兰皂苷0.1%,多孔性轻质活性土86.8%,混合搅拌均匀,即得干粉消毒剂。
[0046]
对比例4
[0047]
按重量份比,称取百里香酚精油0.022%,香芹酚精油0.004%,肉桂醛精油0.004%,丝兰皂苷0.1%,多孔性轻质活性99.87%,混合搅拌均匀,即得干粉消毒剂。
[0048]
实验例1干粉消毒剂ph值的测定
[0049]
称取5.00g
±
0.01g干粉消毒剂试样,置于烧杯中,分别加入50ml、100ml、250ml、500ml不含二氧化碳的水,即稀释倍数分别为10倍、20 倍、50倍、100倍,搅拌1min后,静置5min,用已经校对好的酸度计测定悬浮液ph值。取平行测定结果的算术平均值为测定结果。
[0050]
如表2所示,实施例1、实施例2的干粉消毒剂稀释50倍以内,其ph《3.9,实施例3、实施例4的干粉消毒剂稀释100倍以内,其ph《3.9。说明随着二甲酸钾的比例越高,干粉消毒剂的稀释倍数越小,其水溶液的ph值越低。
[0051]
表2:干粉消毒剂的ph值检测
[0052][0053][0054]
实验例2干粉消毒剂的ph稳定性测试
[0055]
将干粉消毒剂分别加入水、猪粪便、土壤中,搅拌1min后,静置5min。每天用已经校对好的酸度计测定ph值,连续检测6天。
[0056]
如表3所示,干粉消毒剂分别与水、粪便、土壤混合后,其ph值均较稳定,且干粉消毒剂能有效降低粪便、土壤的ph值,使其变为酸性。
[0057]
表3:干粉消毒剂的ph稳定性检测
[0058][0059][0060]
实验例3干粉消毒剂的稳定性检测
[0061]
称取干粉消毒剂,放入烧杯中,敞口置于室温中,每天称取干粉消毒剂的重量,并记录温度和湿度,连续记录15天。
[0062]
如表4显示,干粉消毒剂的重量变化较小,说明干粉消毒剂性质稳定,在环境中能够稳定保存。
[0063]
表4:干粉消毒剂稳定性检测
[0064][0065]
实验例4干粉消毒剂的系水力检测
[0066]
选择直径9cm的漏斗,将滤纸折叠好后,贴着漏斗壁放置,将漏斗放在 50ml的量筒上。称取干粉消毒剂10g,分别倒入铺有滤纸的漏斗里,将30ml 的超纯水缓慢加入到干粉消毒剂上,让水缓慢通过干粉消毒剂和滤纸,持续 30min左右,保证水全部加完后,连续3min内没有水珠从滤纸下滴出为准。从过滤后的水量,计算出系水量。
[0067]
如表5所示,实施例1的干粉消毒剂的系水量为12.0ml,实施例1的干粉消毒剂的系水量为12.5ml。说明干粉消毒剂系水量为自身重量的1.2倍。
[0068]
表5:干粉消毒剂系水力检测
[0069][0070]
实验例4干粉消毒剂对细菌的杀灭效果
[0071]
分别取培养好的大肠杆菌、沙门氏菌、金黄色葡萄球菌菌种,用无菌生理盐水洗下菌苔,制成为0.5麦氏单位(1~1.5
×
108cfu/ml)细菌悬浊液,摇匀备用。将菌悬浊液分别按
100ml/瓶倒入锥形瓶中,其中1瓶为空白对照瓶,试验组分别加入干粉消毒剂10g。搅拌均匀后(表面会稍有液体分层) 静置作用1h、2h、3h、4h后摇匀,分别取100μl涂布在tsa培养基上,培养24h~48h后,进行细菌计数。同时设置平皿对照组,即平皿中只加培养基,不加细菌菌液和干粉消毒剂。
[0072]
如表6,实施例1-4的干粉消毒剂作用1h后,对大肠杆菌有杀灭作用。对比例1-4在缺少部分组分的情况下,杀灭作用降低。
[0073]
如表7,实施例1-4的干粉消毒剂作用1h后,对沙门氏菌有杀灭作用。对比例1-4在缺少部分组分的情况下,杀灭作用降低。
[0074]
如表8,实施例1-4的干粉消毒剂作用3h后,对金黄色葡萄球菌有杀灭作用。对比例1-4在缺少部分组分的情况下,杀灭作用降低。
[0075]
表6:干粉消毒剂对大肠杆菌的抑菌效果
[0076][0077][0078]
表7:干粉消毒剂对沙门氏菌的抑菌效果
[0079]
[0080]
表8:干粉消毒剂对金黄色葡萄球菌的抑菌效果
[0081][0082][0083]
从表6-8中记载的灭菌效果看来,对比例1在缺少柠檬酸、植物精油及丝兰皂苷的情况下明显下降,对比例2缺少植物精油及丝兰皂苷,对比例3缺少植物精油,以及对比例4在缺少苯甲酸钠、柠檬酸、二甲酸钾的情况下,灭菌效果均下降,说明只有在各组分存在的情况下灭菌效果最优,由此可以判断上述各成分之间存在的协同作用。
[0084]
实验例5干粉消毒剂对猪流行性腹泻病毒的杀灭效果
[0085]
试样为实施例1-4的干粉消毒剂。
[0086]
猪流行性腹泻病毒(pedv)流行毒株(lnly-2018株)由中国农业科学院哈尔滨兽医研究所分离、鉴定和保存。
[0087]
非洲绿猴肾细胞(vero e6)购自美国典型培养物保藏中心(atcc),由中国农业科学院哈尔滨兽医研究所保存,vero e6细胞用含10%胎牛血清1640培养基于37℃、5%co2培养箱中培养。
[0088]
1.液体干粉消毒剂对细胞的毒性试验
[0089]
用灭菌去离水将干粉消毒剂分别稀释100倍、50倍、20倍、10倍,配制成1%、2%、5%和10%四个使用浓度,用一次性滤膜(0.22μm)过滤,分别取10μl加入到96孔板培养的vero e6细胞中,每个浓度重复6孔,37℃、5%co2培养箱中48h后,用1640培养基轻轻洗三遍后,每孔加入100μl不含血清的 1640培养基,随后每孔加入10μl cell counting kit-8(cck-8)溶液,在37℃、 5%co2培养箱内孵育4h,用酶标仪测定在450nm处的吸光度。
[0090]
结果表明随着干粉消毒剂浓度的增加,细胞活性逐渐降低,但细胞活性均在75%以上,说明四种浓度的干粉消毒剂对vero e6细胞无毒性。
[0091]
2.液体干粉消毒剂对病毒的杀灭试验
[0092]
用灭菌去离水将干粉消毒剂分别稀释50倍、25倍、10倍、5倍,即配制成2%、4%、10%和20%四个浓度,用一次性滤膜(0.22μm)过滤,将105tcid
50
的病毒液分别与四个浓度等体积混匀(干粉消毒剂使用浓度分别为1%、2%、 5%和10%),在室温分别作用5min、15min和30min后,分别加入到96孔板培养的vero e6细胞中,每孔100μl,重复5孔;同时,用
等量的未用干粉消毒剂处理的105tcid
50
病毒液感染细胞,做阳性对照;用只加维持液的细胞,做空白对照即阴性对照;37℃、5%co2培养箱内孵育0.5h后,弃掉,用含终浓度10μg/ml胰酶的1640培养液(维持液)轻轻洗三遍,随后每孔加入100μl维持液,在37℃、5%co2培养箱培养至48h。弃掉维持液,用pbs 轻轻洗三遍,细胞用4%多聚甲醛,4℃固定0.5h,弃掉固定液、用pbs轻轻洗三遍;用0.2%triton x-100室温透膜20min,弃掉透膜液、用pbs 轻轻洗三遍,风干;加入5%脱脂乳,37℃封闭2h,弃掉封闭液、用pbs 轻轻洗三遍,风干;加入pedv高免血清(1:200),37℃作用1h,弃掉、用pbs轻轻洗三遍,风干;加入fitc标记的山羊抗猪igg二抗(1: 1000),37℃作用1h,弃掉、用pbs轻轻洗三遍,风干;加入dapi(1: 1000)染核,37℃作用20min,弃掉、用pbs轻轻洗一遍,最后每孔加入 100μlpbs,在倒置荧光显微镜下观察荧光。
[0093]
结果判定标准:在阳性对照组孔内细胞荧光阳性率90%以上,阴性对照组孔内无荧光信号成立前提条件下,若实验组孔内无荧光信号证明病毒被干粉消毒剂完全灭活;若实验组孔内有明显荧光信号证明病毒未被干粉消毒剂完全灭活。
[0094]
如表9所示,在室温作用条件下,5%干粉消毒剂溶液稀释20倍,作用 5min能够完全灭活猪流行性腹泻病毒。
[0095]
表9:在室温条件下实施例1-4溶液与pedv作用后荧光观察结果
[0096][0097]
与实施例1-4的干粉消毒剂对比而言,将对比例1-4所述干粉消毒剂使用浓度5%的情况下,即稀释20倍,与pedv作用后荧光观察结果,结果如表 10所示。
[0098]
表10:在室温条件下对比例溶液与pedv作用后荧光观察结果
[0099][0100]
对比例1-4分别在缺少组分的情况下,液体干粉消毒剂结果与实验例4 结果类似,可以进一步证实各组分同时存在下对于灭活猪流行性腹泻病毒的协同效应。
[0101]
3.干粉消毒剂对病毒的杀灭试验
[0102]
称取干粉0.5g于若干个50ml离心管中,与1ml病毒液(107tcid
50
)在室温分别作用5min、15min、30min,随后加入适量1640培养基,配成终浓度为1%、2%和5%的悬液,混匀后室温静置10min,取适量用0.22μm滤膜过滤,分别取250μl(1%)、125μl(2%)、50μl(5%)接种于vero e6细胞单层(24孔板)。同时,用未用药物处理的病毒液、只有药物的悬液及培养基接种,用作阳性对照、药物对照和空白对照。37℃、5%co2培养箱作用0.5-1h 后,弃掉,用含终浓度10μg/ml胰酶的1640培养液(维持液)轻轻洗三遍,随后每孔加入300μl维持液,在37℃、5%co2培养箱培养至48h。逐日观察细胞病变。48h后弃掉维持液,用pbs轻轻洗三遍,细胞用4%多聚甲醛,4℃固定0.5h,弃掉固定液、用pbs轻轻洗三遍;用0.2%triton x-100室温透膜 20min,弃掉透膜液、用pbs轻轻洗三遍,风干;加入5%脱脂乳,37℃封闭 2h,弃掉封闭液、用pbs轻轻洗三遍,风干;加入pedv高免血清(1:200), 37℃作用1h,弃掉、用pbs轻轻洗三遍,风干;加入fitc标记的山羊抗猪 igg二抗(1:1000),37℃作用1h,弃掉、用pbs轻轻洗三遍,风干;加入 dapi(1:1000)染核,37℃作用20min,弃掉、用pbs轻轻洗一遍,最后每孔加入300μlpbs,在倒置荧光显微镜下观察荧光。
[0103]
结果判定标准:在阳性对照组孔内细胞荧光阳性率90%以上,阴性对照组孔内无荧光信号成立前提条件下,若实验组孔内无荧光信号证明病毒被干粉消毒剂完全灭活;若实验组孔内有明显荧光信号证明病毒未被干粉消毒剂完全灭活。
[0104]
如表11所示,未经药物处理的病毒液接种vero e6细胞后出现明显的细胞病变,但干粉与病毒液作用后接种的vero e6细胞无肉眼可见的细胞病变,只接种药物的细胞和空白对照细胞的形态正常,局部出现脱落现象。只在干粉与病毒液作用5min、15min后配制的1%终浓度溶液接种的细胞中观察到极少数微弱的荧光。说明干粉在室温下5min,具有杀灭猪流行性腹泻病毒的作用。
[0105]
表11:在室温条件下实施例1-4与pedv作用后荧光观察结果
[0106][0107][0108]
与实施例1-4的干粉消毒剂对比而言,将对比例1-4所述干粉消毒剂同样使用浓度1%的情况下,即稀释100倍,与pedv作用后荧光观察结果,结果如表12所示。
[0109]
表12:在室温条件下对比例干粉与pedv作用后荧光观察结果
[0110][0111]
对比例1-4分别在缺少组分的情况下,干粉消毒剂结果与实验例4结果类似,可以进一步证实各组分同时存在下对于灭活猪流行性腹泻病毒的协同效应。
[0112]
实验例6干粉消毒剂对非洲猪瘟病毒的杀灭效果
[0113]
试样为实施例1-4的干粉消毒剂。
[0114]
以高致病性非洲猪瘟病毒pig/hlj/2018株为骨架,构建携带gfp标签感染性克隆病毒株由中国农业科学院哈尔滨兽医研究所国家非洲猪瘟专业实验室鉴定和保存。
[0115]
猪原代肺泡巨噬细胞(pams)分离于30-40天spf猪,spf猪来源于哈尔滨兽医研究所试验动物基地,pams用含10%胎牛血清1640培养基于5%co2中37℃进行培养。
[0116]
1.中和剂的配制
[0117]
按照0.5%胰蛋白胨、0.25%酵母提取物、1%d-葡萄糖、0.1%巯基乙酸钠、0.6%硫代硫酸钠、0.25%亚硫酸氢钠、0.7%卵磷脂、0.5%吐温80 的成份,使用pbs溶液配制,完全溶解高压后备用。
[0118]
2.干粉消毒剂对细胞的毒性试验
[0119]
干粉消毒剂均匀喷撒在平皿中纸片上,室温作用15min后,用镊子夹起纸片,尽量将纸片上干粉干粉消毒剂抖落,将纸片加入细胞维持液中浸泡 10min,然后旋涡震荡15s,8000rpm离心3min,将上清接种到pams细胞上, 37℃5%co2温箱中培养96小时,每24小时观察细胞状态,确定干粉消毒剂是否对细胞有毒性。
[0120]
结果显示,pams细胞形态正常,干粉消毒剂对pams细胞无毒性。
[0121]
3.干粉消毒剂对病毒杀灭试验
[0122]
每个滤纸片加入1
×
106copies/ml浓度asfv,其中1片接毒纸片直接加入细胞维持液中作为阳性对照,同时设未加毒的作为阴性对照,其余已加病毒纸片在距离2-3cm均匀喷撒干粉消毒剂,室温分别作用5min、15min和30min 后,将所有纸片放入中和液中浸泡10min,再放入细胞维持液中浸泡10min,然后旋涡震荡15秒,8000rpm离心3min,取上清加入已长满单层pams细胞培养板中,每个浓度复4孔,37℃5%co2温箱中培养,毎24小时观察细胞状态及病毒复制产生荧光情况,观察96小时后统计试验结果。
[0123]
结果判定标准:在阳性对照组,孔内细胞荧光阳性率90%以上,阴性对照组孔内无荧光信号成立前提条件下,若实验组孔内无荧光信号证明病毒被干粉消毒剂完全灭活;若实验组孔内有明显荧光信号证明病毒未被干粉消毒剂完全灭活。
[0124]
如表13所示,在25℃作用条件下,10%干粉消毒剂采用喷粉方式,作用 15min能完全灭活非洲猪瘟病毒。对比例1-4分别在缺少组分的情况下,干粉消毒剂结果对于灭活非洲猪瘟病毒效果显著降低,可以证实各组分之间的协同效应。
[0125]
表13:改良剂喷粉方式与asfv作用后荧光观察结果
[0126][0127][0128]
实验例7
[0129]
以猪场为例,干粉消毒剂使用方法如表14所示。
[0130]
表14:干粉消毒剂使用方法
[0131]
[0132][0133]
最后应说明的几点是,虽然上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明的基础上,以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1