弥补OsLOX3敲除水稻株抗瘟性降低及验证方法和应用
弥补oslox3敲除水稻株抗瘟性降低及验证方法和应用
技术领域
1.本发明涉及农业生物基因工程技术领域,具体来说是一种弥补oslox3敲除水稻株抗瘟性降低的方法及其应用。
背景技术:
2.植物激素等活性小分子物质在调控植物生长发育和环境胁迫响应中具有重要作用,是植物应对环境刺激时首先响应的“看门狗”,可使植物将有限资源分配到响应最具生命威胁的胁迫中,使各种胁迫响应得以权衡,从而将复杂过程有序化,茉莉酸(ja)作为多个植物激素中的核心组分,参与多个植物激素信号共同调节植物生长发育和胁迫响应,例如ja能够从多方面增强水稻对植物病原真菌、细菌和病毒的抗性。有研究表明oslox3主要参与亚麻酸转化为13-hydroperoxide,而亚麻酸是茉莉酸的合成前体。因此oslox3不仅参与茉莉酸合成还参与病原菌侵染时的防御响应。为了阐明oslox3敲除水稻株的抗性以及oslox3在ja合成和防御响应中的作用,进一步揭示oslox3介导的ja合成和抗瘟性的调控机制,利用crispr/cas9介导的基因编辑技术将水稻中的oslox3基因敲除获得oslox3敲除水稻株,已有大量研究表明,oslox3作为防御相关基因,敲除后会导致水稻抗性降低,但其水稻品质却明显改善,主要表现在oslox3敲除水稻株中亚麻酸和亚油酸含量较高,而且oslox3敲除水稻株发芽率显著提高,同时转录组分析发现oslox3敲除水稻株中芳香族氨基酸的生物合成/代谢/催化过程中的基因下调,意味着oslox3敲除水稻株中苯丙氨酸等一类芳香族氨基酸含量降低,而这类氨基酸在植物抗性中发挥重要作用。
3.本发明提出了一种弥补oslox3敲除水稻株抗性降低的方法及验证方法,即外源喷施苯丙氨酸(phe)。虽然外源苯丙氨酸处理植物提高抗性的方法很多,并且都能有效减轻植物病害的发病程度,但对于苯丙氨酸处理水稻,特别处理oslox3敲除转基因水稻提高其抗瘟性的方法还没有报道。
技术实现要素:
4.本发明的目的是提供一种弥补oslox3敲除水稻株抗瘟性降低的方法及其应用,以解决背景技术中存在的问题。
5.为实现上述目的,本发明采用的技术方案是:弥补oslox3敲除水稻株抗瘟性降低的方法,步骤包括:
6.(1)生长至三叶一心期的oslox3敲除水稻株,按100株水稻喷施15~20ml浓度为100ppm的外源苯丙氨酸溶液,24h取样测定亚麻酸和亚油酸含量;
7.(2)生长至三叶一心期的oslox3敲除水稻株感染稻瘟菌36~48h时,按100株水稻喷施15~20ml浓度为100ppm的外源苯丙氨酸溶液;
8.(3)步骤(2)喷施后于接种稻瘟菌的36h、48h、72h和96h时取样,测定ja响应基因、防御基因、sa信号基因、活性氧基因和pod基因相对表达量;
9.(4)步骤(2)喷施后于接种稻瘟菌168h后进行病害调查。
10.进一步的,步骤(2)中,所述感染稻瘟菌的时间为48h。
11.进一步的,步骤(2)中,所述稻瘟菌的菌株为95234i-1b。
12.进一步的,所述稻瘟菌的菌株孢子悬浮液的浓度为1
×
105个/ml。
13.稻瘟病菌培养以及孢子悬浮液制备:稻瘟菌菌株于pda固体培养基上活化,置于28℃恒温培养箱中活化培养4~5天,用打孔器取活化好的菌丝块于pda培养基上28℃恒温培养箱进行继代培养,培养4~5天;再用打孔器打取pda培养基边缘活力好的菌块于pdb液体培养基中,置于28℃恒温摇床中培养3~4天,用移液器吸取500ul菌丝培养液于西梅汁培养基上进行产孢,涂布棒涂抹均匀后置于28℃恒温光照培养箱中黑暗培养3~4天后再光照/黑暗交替12h培养5~6天,待西梅汁培养基上的菌丝由白转黑时,刮去表面菌丝,无菌水沖洗孢子,制成孢子悬浮液,在显微镜下用血球计数板将悬浮液孢子浓度调整为1
×
105个/ml。
14.进一步的,步骤(1)和(2)中,外源苯丙氨酸溶液为含有0.1%吐温的苯丙氨酸水溶液。
15.进一步的,ja响应基因为osbhlh35、防御基因为ospr1a、sa信号基因为oswrky45、活性氧基因为osrbohb和pod基因为ospox1。
16.本发明中,oslox3敲除水稻株利用crispr/cas9介导的基因编辑技术构建获得,选择野生型水稻ilmibyeo作为对照,ilmibyeo水稻株是一个能被稻瘟菌株为95234i-1b侵染的抗病水稻株。
17.本发明方法中,oslox3敲除水稻株实验组和ilmibyeo水稻株对照组,36h喷施外源苯丙氨酸后取样的时间点为接种稻瘟菌后的36h,48h,72h;48h喷施外源苯丙氨酸后取样的时间点为接种稻瘟菌后的48h,72h,96h。实验组和对照组均是喷施外源苯丙氨酸后进行病害调查的时间为接种稻瘟菌后的168h。
18.苯丙氨酸(phe)作为是蛋白质生物合成的主要组成部分,也是众多苯丙类化合物的主要组成部分,在植物中,苯丙氨酸的生物合成是从石草酸盐途径的最终产物(螯合物)通过螯合物突变酶转化为预苯酸盐开始的。苯丙氨酸是主要的酚前体,酚类化合物已被证明是植物抵御真菌感染的重要因素,植物积累酚类化合物可能是被动防御的一种手段,也可能是对病原体攻击的系统性反应系统诱导防御系统中,反应的强度部分是由于主要前体l-苯丙氨酸(phe)的供应,研究表明,系统施用酚类前体可以增强植物对病虫害的抵抗力,从而促进酚类物质的生产。
19.本发明把外源喷施苯丙氨酸处理水稻提高水稻抗瘟性的方法精细化,根据稻瘟病菌侵染oslox3敲除水稻株和野生型水稻ilmibyeo的侵染进程,我们利用稻瘟病菌株接种生长14天时的oslox3敲除水稻株和野生型水稻ilmibyeo的叶片,分别于接种36h和48h时外源喷施100ppm苯丙氨酸,于接种168h时进行稻瘟病病害调查,同时统计病情指数,100ppm苯丙氨酸有效提高oslox3敲除水稻株对稻瘟菌的抗性,其中以苯丙氨酸处理稻瘟病菌接种48h时的水稻对其稻瘟病控制效果最佳,进一步明确了苯丙氨酸有效控制水稻稻瘟病的关键时间点,不仅可以弥补生产上具有优良农艺性状的水稻地方品种因抗性基因失效造成抗病性降低而面临被生产上淘汰的难题,还可以为水稻种质资源利用与保护提供重要的措施。除此之外,苯丙氨酸是植物自身代谢过程产生的,其适量的苯丙氨酸对植物本身不具有毒性,不会造成残留及环境污染做到了农田生态环境安全和消费者安全。
20.本发明的有益技术效果是:
21.本发明方法为喷施外源苯丙氨酸水溶液,苯丙氨酸是蛋白质生物合成的主要组成部分,也是众多苯丙类化合物的主要组成部分,苯丙氨酸是主要的酚前体,酚类化合物已被证明是植物抵御真菌感染的重要因素,植物积累酚类化合物是被动防御的一种手段,也是对病原体攻击的系统性反应系统诱导防御系统中,反应的强度部分是由于主要前体l-苯丙氨酸的供应。外源苯丙氨酸水溶液组成成分中吐温-20的作用是为了使外源苯丙氨酸更好的附着于水稻叶片。
22.本发明还提供了外源苯丙氨酸的处理方法,实验验证,经外源苯丙氨酸分别对接种稻瘟菌36h和48h的水稻进行处理后,168h进行统计,48h喷外源苯丙氨酸的病斑长度和真菌相对生长量都小于36h喷施,本发明方法弥补oslox3敲除水稻株抗瘟性降低的方法使得防治时间更为精确,并且做到安全有效,为水稻种质资源利用与保护提供重要的措施。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
24.图1是实施例2中实验组和对照组亚麻酸含量结果图;
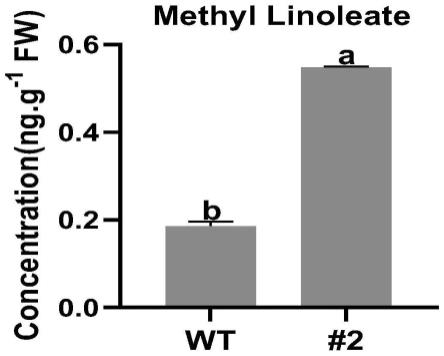
25.图2是实施例2中实验组和对照组亚油酸含量结果图;
26.图3是实施例3中实验组和对照组侵染稻瘟菌后不同时间点的表型观察结果图;
27.图4是实施例3中实验组和对照组侵染稻瘟菌后168h的病害调查结果图;
28.图5是实施例3中实验组和对照组30-40天剑叶叶鞘侵染稻瘟菌后的菌丝侵染过程图;
29.图6是实施例4中实验组和对照组侵染稻瘟菌后防御基因、(ja、sa和aba等)植物激素合成及信号基因的表达结果图;
30.图7是实施例5中实验组和对照组致伤接种稻瘟菌36h和48h时分别用外源苯丙氨酸处理后168h的表型观察结果图;
31.图8实施例5中实验组和对照组致伤接种稻瘟菌36h和48h时分别用外源苯丙氨酸处理后168h的病斑长度测量结果图;
32.图9实施例5中实验组和对照组致伤接种稻瘟菌36h和48h时分别用外源苯丙氨酸处理后168h的真菌相对表达结果图;
33.图10实施例5中实验组和对照组30-40天剑叶叶鞘接种稻瘟菌36h和48h时分别用外源苯丙氨酸处理后的菌丝侵染结果图;
34.图11实施例6中实验组和对照组接种稻瘟菌36h和48h时分别用外源苯丙氨酸处理后,防御基因、(ja、sa和aba等)植物激素合成及信号基因的表达结果图。
具体实施方式
35.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于
本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.实施例1
37.弥补oslox3敲除水稻株抗瘟性降低的方法,敲除oslox3基因的水稻株生长至三叶一心期(14天),水稻株感染稻瘟菌36h或48h时,效果更好的为48h时,按100株水稻喷施20ml浓度为100ppm的外源苯丙氨酸溶液,外源苯丙氨酸溶液为含有0.1%吐温的苯丙氨酸水溶液。选择野生型水稻ilmibyeo作为对照。
38.用于喷施的稻瘟菌的菌株为95234i-1b,稻瘟菌菌株于pda固体培养基上活化,置于28℃恒温培养箱中活化培养4天,用打孔器取活化好的菌丝块于pda培养基上28℃恒温培养箱进行继代培养,培养4天;再用打孔器打取pda培养基边缘活力好的菌块于pdb液体培养基中,置于28℃恒温摇床中培养3天,用移液器吸取500ul菌丝培养液于西梅汁培养基上进行产孢,涂布棒涂抹均匀后置于28℃恒温光照培养箱中黑暗培养3天后再光照/黑暗交替12h培养5天,待西梅汁培养基上的菌丝由白转黑时,刮去表面菌丝,无菌水沖洗孢子,制成孢子悬浮液,在显微镜下用血球计数板将悬浮液孢子浓度调整为1
×
105个/ml。
39.实施例中,任何涉及有关水稻育苗、稻瘟病菌株产孢、病害调查以及发病率统计的方法,均为本领域常规处理方法。
40.实施例2
41.oslox3敲除水稻株生理指标分析,以野生型水稻ilmibyeo作为对照。
42.外源苯丙氨酸处理oslox3敲除水稻株,测定亚麻酸和亚油酸的含量:
43.对生长14天的水稻幼苗喷施浓度为100μmol/l的外源苯丙氨酸,喷施24h后取样研磨,后称取适量样品(0.1-1g,本实施例为0.5g)于干净的进口ep管中,后用于萃取纯化,提取液用cp-sil 88(100m
×
0.25mm
×
0.25μm,agilent,usa)气相色谱柱去除杂质,取上清,进样进行lc-ms分析;样品采用agilent气相色谱系统(agilent 6890;agilent technologies,usa)进行分离。
44.采用美国aiglent公司的四极杆质谱检测系统(agilent 5977;agilent technologies,usa)进行质谱分析,采用电子轰击离子源(ei),分析物在单通道扫描(sim)模式下进行检测。数据处理,利用软件quant-my-way处理质谱数据,提取色谱峰面积及保留时间。根据标准曲线,计算样品中测得亚麻酸和亚油酸含量。
45.测定亚麻酸和亚油酸的含量见参照图1和图2,图1和图2显示,oslox3敲除株系的亚麻酸和亚油酸含量显著高于野生型,说明oslox3敲除后导致了亚麻酸的积累。
46.实施例3
47.分析oslox3敲除水稻株的抗瘟性及相关基因的表达分析,以野生型水稻ilmibyeo作为对照。
48.oslox3敲除水稻株的抗瘟性鉴定,稻瘟菌孢子悬浮液(悬浮液的制备参照实施例1)用喷雾器将孢子悬浮液接种在三叶一心期的水稻幼苗叶片上,持续喷施,直至水稻叶片上菌液呈水雾状且不往下滴落即可,于168h进行病害统计,调查及病情指数统计参照许志刚(2002),病情指数=100
×
∑(各级病叶数
×
各级代表值)/(调查总叶数
×
最高级代表值)。除此之外,还对生长30-40天的水稻叶鞘采用注射的方法(注射器规格为1ml)进行稻瘟菌接种,用活/死细胞试剂盒(abbkin,kat1001)对菌丝进行染色,观察接菌后24h、36h、48h
菌丝的侵染情况。
49.结果见参照图3、4、5,图3显示,oslox3敲除株在接种稻瘟菌48h的时候开始出现褐色坏死斑点,而野生型在72h的时候才开始出现,野生型和敲除株在96h的时候在褐色坏死、斑周围出现了黄色晕圈。144h的时候出现连片的坏死斑,168h的病害统计结果中,敲除株系的发病程度高于野生型(图4所示)。
50.从菌丝侵染结果显示(图5),野生型和敲除株系在24h的时候还是粗的无致病性的初生菌丝并未向临近细胞扩展,36h的时候开始长出有致病性的细的次生菌丝并向临近细胞扩展,48h的时候长出大量次生菌丝,但是敲除株系#2的次生菌丝明显多于野生型。
51.实施例4
52.生长至三叶一心期的水稻幼苗,于接菌0h、24h、36h、48h、72h、96h进行取样,用于检测防御基因、(ja、sa和aba等)植物激素合成及信号基因在oslox3敲除水稻株中的表达分析:
53.(1)rna的提取:genstar(北京康润诚润生物科技有限公司)试剂盒提取水稻总rna,操作方法见试剂盒说明书。
54.(2)cdna逆转录
55.表1 cdna反转录成分
[0056][0057]
根据上表先将除rna以外的总体系配好后分装于pcr管,再加入目的rna,轻轻混匀,置于pcr仪中先42℃,孵育15min,再85℃加热5s,使rt/ri和gdna remover失活,所得cdna置于4℃冰箱以备后续使用。
[0058]
(3)根据ja合成/响应、sa合成/受体及防御相关基因的核酸序列设计引物,引物名称及序列见表2。
[0059]
表2引物序列
[0060][0061]
(4)采用transstart top green qpcr supermix-aq131(北京全式金生物技术有限公司)试剂盒进行实时荧光定量pcr(qrt-pcr),反应体系如表3。
[0062]
表3 qrt-pcr反应体系
[0063][0064][0065]
按照上表将体系配好,轻轻混匀后分装到96孔pcr板中,每个孔19.5μl,最后加入cdna 0.5μl,用1500rpm离心1min后取出,用cfx96定量pcr仪中进行qrt-pcr,反应程序见表4。
[0066]
表4 qrt-pcr反应的条件
[0067][0068]
(5)目的基因的qrt-pcr数据分析
[0069]
qrt-pcr数据处理,用2
‑△△
ct
法对以上基因的表达水平进行计算分析,基因的相对表达量=2-(ct1-actinct1)-(ct2-actinct2)
,所有数据采用ibm spss modeler 17.0进行处理,运用primer8.0作图。
[0070]
(6)结果分析
[0071]
基因表达结果见参照图6,图6显示,ja响应基因osbhlh35在稻瘟菌侵染野生型和敲除株系0h-96h的相对表达量都是野生型高于敲除株系,并且在36h的时候极显著上调并达到最大值,48h后呈下调趋势;
[0072]
防御相关基因ospr1a在野生型中的表达量都显著高于敲除株系,并且在24h、36h、48h的时候,在野生型中的表达量都较高,72h的时候开始极显著下调,48h、72h、96h的时候在敲除株系中几乎不表达;
[0073]
sa信号相关基因oswrky45在野生型中的表达量显著高于敲除株系并且在36h的时候表达量最高,72h和96h的时候在敲除株系中几乎不表达。
[0074]
活性氧相关基因osrbohb在敲除株系中的表达量都显著高于野生型,并且在96h的时候极显著上调并达到最高;
[0075]
pod相关基因ospox1在野生型中的表达量都显著高于敲除株系,72h的时候开始上调,96h的时候表达量达到最高。
[0076]
实施例5
[0077]
对生长40天的的水稻叶片进行致伤接种,孢子悬浮液浓度为1
×
105个/ml,伤口直径为5mm,接种后的水稻叶片进行黑暗保温(28℃)保湿(湿度在95%以上)处理24h,分别在接种36h和48h的时候在伤口部位接苯丙氨酸,于144hpi时测量病斑的长宽、选取水稻叶片发病的单个病斑,采用ctab法提取水稻叶片的dna,检测病斑真菌相对生物量相关基因引物序列见表5。
[0078]
除此之外,对生长35天的水稻叶鞘采用注射的方法进行稻瘟菌接种,分别于接种稻瘟菌36h和48h注射浓度为100ppm的苯丙氨酸,36h注射苯丙氨酸后观察接菌36h、48h、72h的菌丝侵染情况,48h注射苯丙氨酸后观察接菌48h、72h、96h的菌丝侵染侵染情况。
[0079]
表5 rt-pcr引物列表
[0080][0081]
(1)按表3配制pcr 20.0μl反应体系:反应液配制在冰上进行,先配制master mix,然后再分装。
[0082]
(2)qrt-pcr的反应程序见表4。
[0083]
(3)目的基因的qrt-pcr数据分析
[0084]
qrt-pcr数据处理,用2
‑△△
ct
法对mopot2基因的表达水平进行计算分析,基因的相对表达量=2-(ct1-actinct1)-(ct2-actinct2)
。数据采用ibm spss modeler 17.0进行处理,运用primer8.0作图。
[0085]
(4)结果分析
[0086]
叶片致伤接菌结果见参照图7、8、9,图中显示,稻瘟菌接种48h时喷施苯丙氨酸的病斑长度显著高于36h喷施外源茉莉酸,(图7,图8),真菌相对表达量在36h喷施苯丙氨酸的时候较高,并且无论是36h还是48h喷施苯丙氨酸,都是敲除株系发病程度高于野生型(图9),说明在接种48h喷施外源苯丙氨酸的诱抗效果较好。
[0087]
菌丝侵染结果见参照图10,图10显示,虽然在接种36h的时候野生型和敲除株系都开始长出少量次生菌丝(有致病性)并向临近细胞扩展,但基本都还是粗的初生菌丝(无致病性),说明此时水稻防御相应还未被激活,在此时喷施浓度为100ppm的苯丙氨酸,48h的时候还留有大量的初生菌丝,并且敲除株系中的菌丝扩展程度高于在野生型中的扩展程度,72h的时候开始长出大量的次生菌丝,说明此时苯丙氨酸已不在发挥作用;在接种稻瘟菌48h的时候已经开始出现大量的次生菌丝,说明此时水稻防御响应已经激活,在此时喷施浓度为100ppm的苯丙氨酸能更大程度的提升水稻的防御能力,因此在72h和96h的时候都还留有很多初生菌丝。
[0088]
实施例6
[0089]
在接种稻瘟菌36h和48h分别喷施外源苯丙氨酸,36h喷施外源苯丙氨酸后于接菌36h、48h、72h取样;48h喷施外源苯丙氨酸后于接菌48h、72h、96h取样,用于检测防御基因、(ja、sa和aba等)植物激素合成及信号基因在oslox3敲除水稻株中的表达分析,rna提取以及相关基因表达分析方法参照实施例4,基因表达结果见参照图11,图11显示,osbhlh35、ospr1a、oswrky45、ospox1这几个基因在36h喷施外源苯丙氨酸后的相对表达量都是在接菌48h的时候最高;而48h喷施外源苯丙氨酸后的表达量在接菌72h达到最高;与接菌后未处理外源苯丙氨酸的基因表达结果(实施例4中图6)相比都有所提高,并且48h喷施外源苯丙氨酸的表达量提高较为显著,仍然是敲除株系#2表达量低于野生型wt,而活性氧相关基因
osrbohb的表达结果与其他基因相反。
[0090]
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应该理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1