一种干细胞冻存液及干细胞冻存方法与流程
1.本发明涉及干细胞冻存的技术领域,具体而言,涉及一种干细胞冻存液及干细胞冻存方法。
背景技术:
2.干细胞,是一种多功能细胞,具有多向分化潜能、自我更新能力的细胞,是处于细胞系起源顶端的最原始细胞,在体内能够分化产生某种特定组织类型的细胞。在成体的器官中,干细胞可以通过不断分裂来修复组织。
3.而组织器官的损伤和功能衰竭一直以来是人类健康所面临的一大难题,完美地修复或替代因疾病、战伤、意外事故或遗传因素所造成的组织、器官或肢体的伤残一直是人类的梦想,也是难以攻克的医学高峰。目前的治疗方案均难以完全修复受损的组织、器官或使其功能得以长期恢复。
4.干细胞是对疾病进行基因治疗的理想载体。造血干细胞具有自我更新、多向分化重建长期造血、采集和体外处理容易等特点。因此是基因治疗最理想的载体细胞之一,以此为基础的基因治疗,在重症免疫缺陷、遗传性疾病、恶性肿瘤、造血干细胞保护、aids等领域具有广阔的应用前景。
5.但是,干细胞在使用前,需要提前准备好并冻存处理,冻存是将细胞放在低温环境,减缓细胞代谢,以达到长期储存的一种技术。其原理是将细胞置于-196℃液氮中超低温保存,可以使细胞暂时脱离生长状态而将细胞特性保存起来,在需要的时候通过复苏细胞即可使用。细胞冻存时向细胞悬液中加入保护剂,可使溶液冰点降低,在缓慢冻结的条件下,细胞内水分渗透出细胞外,减少细胞内冰晶形成,从而避免细胞在冰冻过程中的损伤。
6.目前,干细胞冻存主要是采取-196℃液氮超低温条件下保存,细胞在超低温条件下,代谢功能停滞,细胞可长时间保存,当需要用细胞时,取出冻存的细胞在37℃水浴中快速解冻,即可恢复细胞的活性及功能。但是现有的干细胞冻存方法中,大多数细胞冻存液都是含有动物血清的,浓度范围从5%到90%不一。动物血清除了可以为细胞提供营养之外,在低温长期存储时还有稳定细胞膜、调整渗透压和避免自由基形成的作用。因此在干细胞冻存液中也有应用。但是对于临床使用的干细胞而言,动物血清的存在并不一定合适。首先,动物血清存在携带传播病原体及其他致病因素的风险;其次,由于血清的组分非常复杂、来源和生产批次存在差异可能会造成不良或不一致的影响;第三,血清中富含各种细胞因子、激素和其他活性成分,容易对干细胞的生物特性产生干扰和影响。
7.且用以往的细胞冻存液及冻存方法冻存干细胞时,干细胞易受到冰晶损伤,复苏后细胞活率低,细胞增殖数量不足,细胞易老化,效率低下,冻存质量不高、细胞复苏后活性差以及成活率不高等问题。
技术实现要素:
8.本发明的目的在于提供一种干细胞冻存液,其普适性更好,且干细胞不易受到冰
晶损伤,复苏后细胞活率高,细胞增殖数量好,细胞不易老化。
9.本发明的另一目的在于提供一种干细胞冻存方法,其冻存效率高,冻存质量好,细胞复苏后活性好以及成活率高。
10.本发明解决其技术问题是采用以下技术方案来实现的。
11.本发明提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基75-85份、二甲基亚砜8-12份以及其他成分5-10份,上述无血清培养基为x-vivo 20。
12.进一步的,在本发明的一些实施例中,上述其他成分包括hepes4-4.8mm/l、糖类7-8g/l、成纤维细胞生长因子8-9.5ng/ml、人寡肽-115-19ng/ml、脯氨酸85-93mg/l、磺基水杨酸1-4g/l、不饱和脂肪酸65-75mg/l、胆固醇200-215mg/l和亚硒酸盐4.8-5.1μg/l。
13.进一步的,在本发明的一些实施例中,上述其他成分还包括谷胱甘肽3-4mg/l。
14.进一步的,在本发明的一些实施例中,上述其他成分还包括乙酰胺3-10g/l。
15.本发明还提出一种干细胞冻存方法,采用如上所述的干细胞冻存液对干细胞进行冻存。
16.进一步的,在本发明的一些实施例中,上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为1.0
×
10
6-2.0
×
107/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。
17.进一步的,在本发明的一些实施例中,上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。
18.进一步的,在本发明的一些实施例中,上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室10-15min,降温至3-5℃,然后再将冻存管转移至冰箱冷冻室25-30min,降温至-1
‑‑
10℃,再在低温冰箱中放置60-80min降温至-30
‑‑
35℃,再在气态氮环境中放置25-35min降温到-90
‑‑
100℃,最后转移至液氮中封存。
19.进一步的,在本发明的一些实施例中,上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。
20.进一步的,在本发明的一些实施例中,上述干细胞为神经干细胞、肿瘤干细胞或者间充质干细胞中的一种。
21.本发明提供的干细胞冻存液具有以下有益效果:
22.这种干细胞冻存液不采用动物血清,可以很好的避免动物血清存在携带传播病原体及其他致病因素的风险,避免由于血清的组分非常复杂、来源和生产批次存在差异可能会造成不良或不一致的影响,也避免血清中富含各种细胞因子、激素和其他活性成分,容易对干细胞的生物特性产生干扰和影响,确保干细胞冻存复苏后细胞活率高,细胞增殖数量好,细胞不易老化;且采用血清培养基普适性更好,二甲基亚砜的加入也使得干细胞不易受到冰晶损伤。
23.本发明提供的干细胞冻存方法具有以下有益效果:
24.采用这种干细胞冻存液冻存干细胞,其冻存效率高,冻存质量好,细胞复苏后活性好以及成活率高。
具体实施方式
25.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中
的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
26.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本发明。
27.本发明提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基75-85份、二甲基亚砜8-12份以及其他成分5-10份,上述无血清培养基为x-vivo 20。
28.这种干细胞冻存液不采用动物血清,可以很好的避免动物血清存在携带传播病原体及其他致病因素的风险,避免由于血清的组分非常复杂、来源和生产批次存在差异可能会造成不良或不一致的影响,也避免血清中富含各种细胞因子、激素和其他活性成分,容易对干细胞的生物特性产生干扰和影响,确保干细胞冻存复苏后细胞活率高,细胞增殖数量好,细胞不易老化;且采用血清培养基普适性更好,二甲基亚砜的加入也使得干细胞不易受到冰晶损伤。
29.进一步的,在本发明的一些实施例中,上述其他成分包括hepes4-4.8mm/l、糖类7-8g/l、成纤维细胞生长因子8-9.5ng/ml、人寡肽-115-19ng/ml、脯氨酸85-93mg/l、磺基水杨酸1-4g/l、不饱和脂肪酸65-75mg/l、胆固醇200-215mg/l和亚硒酸盐4.8-5.1μg/l。
30.添加hepes可以给干细胞提供较强的缓冲能力,为干细胞提供相对稳定的环境ph值,进一步确保复苏后细胞活率;添加糖类可以给复活后的干细胞提供营养物质,进一步确保复活后干细胞的存活率;添加成纤维细胞生长因子作为细胞活性成分,进一步确保干细胞冻存、复活后的活性等;添加寡肽-1对细胞活性增殖性起到辅助作用;添加脯氨酸有助于细胞分散及活力保护,确保干细胞均匀冻存的同时,也确保干细胞的复活后的活力;添加磺基水杨酸,由于其是非渗透性冷冻保护剂,其本身不能渗透到细胞内,可以降低培养基中自由水的含量,进而减少细胞内冰晶形成,从而减低细胞破损,确保干细胞冻存复苏后细胞活率高;添加不饱和脂肪酸不饱和脂肪酸构成体内脂肪的一种脂肪酸,亦为人体必需的脂肪酸,保护细胞冷冻及复苏后的活性;添加胆固醇可以提供细胞必须成份,加入体外保存和培养的培养基中,对维持细胞状态和活性起到重要作用。
31.进一步的,在本发明的一些实施例中,上述其他成分还包括谷胱甘肽3-4mg/l。
32.添加谷胱甘肽作为抗氧化剂,可以确保干细胞冻存的稳定性,避免干细胞冻存过程中被有害物质氧化损坏。
33.进一步的,在本发明的一些实施例中,上述其他成分还包括乙酰胺3-10g/l。
34.添加乙酰胺渗透性冷冻保护剂,其与二甲基亚砜组合,一方面与细胞外溶液中的水分子结合,发生水合作用,弱化水的结晶过程,进而减少冰晶形成;另一方面,在细胞冷冻悬液完成凝固之前,渗透到细胞内,并在细胞内外产生一定的摩尔浓度,降低细胞内外未结冰溶液中电解质的浓度,从而保护细胞免受高浓度电解质的损伤,同时,可以防止细胞内水分过度外渗,避免细胞过分脱水皱缩。
35.本发明还提出一种干细胞冻存方法,采用如上所述的干细胞冻存液对干细胞进行冻存。采用这种干细胞冻存液冻存干细胞,其冻存效率高,冻存质量好,细胞复苏后活性好以及成活率高。
36.进一步的,在本发明的一些实施例中,上述干细胞在冻存前需采用上述干细胞冻
存液对重悬,将上述干细胞冻存液中的干细胞密度控制为1.0
×
10
6-2.0
×
107/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。将干细胞密度控制为1.0
×
10
6-2.0
×
107/ml,冻存更加稳定。
37.进一步的,在本发明的一些实施例中,上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。这样的温度冻存确保干细胞处于休眠状态。
38.进一步的,在本发明的一些实施例中,上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室10-15min,降温至3-5℃,然后再将冻存管转移至冰箱冷冻室25-30min,降温至-1
‑‑
10℃,再在低温冰箱中放置60-80min降温至-30
‑‑
35℃,再在气态氮环境中放置25-35min降温到-90
‑‑
100℃,最后转移至液氮中封存。采用这种程序降温确保干细胞温和的进入休眠状态,避免干细胞损坏,进一步确保干细胞复活的活率。
39.进一步的,在本发明的一些实施例中,上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。这样的温度环境下临时保存避免干细胞冻存前损坏。
40.进一步的,在本发明的一些实施例中,上述干细胞为神经干细胞、肿瘤干细胞或者间充质干细胞中的一种。
41.以下结合实施例对本发明的特征和性能作进一步的详细描述。
42.实施例1
43.本实施例提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基75ml、二甲基亚砜8ml份以及其他成分5ml,上述无血清培养基为x-vivo 20。
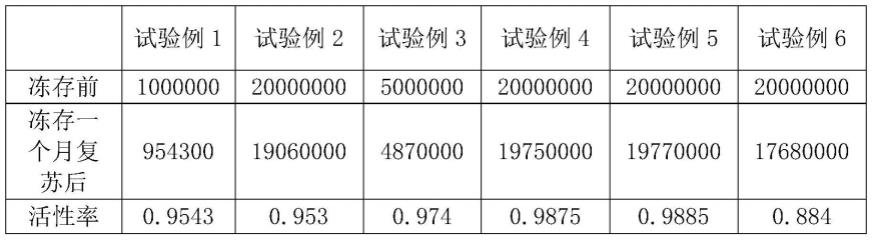
44.上述其他成分包括hepes 4mm/l、糖类7g/l、成纤维细胞生长因子8ng/ml、人寡肽-1 15ng/ml、脯氨酸85mg/l、磺基水杨酸1g/l、不饱和脂肪酸65mg/l、胆固醇200mg/l、亚硒酸盐4.8μg/l。
45.实施例2
46.本实施例提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基85ml、二甲基亚砜12ml以及其他成分10ml,上述无血清培养基为x-vivo 20。
47.上述其他成分包括hepes4.8mm/l、糖类8g/l、成纤维细胞生长因子9.5ng/ml、人寡肽-1 19ng/ml、脯氨酸93mg/l、磺基水杨酸4g/l、不饱和脂肪酸75mg/l、胆固醇215mg/l、亚硒酸盐5.1μg/l。
48.实施例3
49.本实施例提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基80ml、二甲基亚砜10ml以及其他成分7ml,上述无血清培养基为x-vivo 20。
50.上述其他成分包括hepes 4.5mm/l、糖类7.5g/l、成纤维细胞生长因子9ng/ml、人寡肽-1 17ng/ml、脯氨酸90mg/l、磺基水杨酸3g/l、不饱和脂肪酸70mg/l、胆固醇210mg/l、亚硒酸盐5.0μg/l和谷胱甘肽3mg/l。
51.实施例4
52.本实施例提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基78ml、二甲基亚砜9ml份以及其他成分6ml,上述无血清培养基为x-vivo 20。
53.上述其他成分包括hepes 4.2mm/l、糖类7g/l、成纤维细胞生长因子8.5ng/ml、人寡肽-1 18ng/ml、脯氨酸86mg/l、磺基水杨酸2g/l、不饱和脂肪酸68mg/l、胆固醇205mg/l、亚硒酸盐5.1μg/l、谷胱甘肽4mg/l和乙酰胺10g/l。
54.实施例5
55.本实施例提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基82ml、二甲基亚砜11ml以及其他成分9ml,上述无血清培养基为x-vivo 20。
56.上述其他成分包括hepes 4.5mm/l、糖类7g/l、成纤维细胞生长因子8.5ng/ml、人寡肽-1 18ng/ml、脯氨酸90mg/l、磺基水杨酸3g/l、不饱和脂肪酸68mg/l、胆固醇205mg/l和亚硒酸盐5.1μg/l、谷胱甘肽3.5mg/l和乙酰胺3g/l。
57.实施例5
58.本实施例提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基85ml、二甲基亚砜12ml以及其他成分8ml,上述无血清培养基为x-vivo 20。
59.上述其他成分包括hepes 4.6mm/l、糖类8g/l、成纤维细胞生长因子8ng/ml、人寡肽-1 16ng/ml、脯氨酸88mg/l、磺基水杨酸2g/l、不饱和脂肪酸68mg/l、胆固醇205mg/l和亚硒酸盐4.9μg/l、谷胱甘肽3.5mg/l和乙酰胺6g/l。
60.对比例1
61.本实施例提出一种干细胞冻存液,其包括如下体积份的各组分:无血清培养基85ml、二甲基亚砜12ml、人血白蛋白15ml和氯化钠2ml。
62.试验例1
63.本试验例提出神经干细胞、肿瘤干细胞和间充质干细胞的冻存方法,。
64.其采用如上所述的干细胞冻存液对干细胞进行冻存。上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为1.0
×
10
6-2.0
×
107/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室10-15min,降温至3-5℃,然后再将冻存管转移至冰箱冷冻室25-30min,降温至-1
‑‑
10℃,再在低温冰箱中放置60-80min降温至-30
‑‑
35℃,再在气态氮环境中放置25-35min降温到-90
‑‑
100℃,最后转移至液氮中封存。
65.试验例1
66.本试验例提出神经干细胞的冻存方法。其采用实施例1的干细胞冻存液对干细胞进行冻存。上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为1.0
×
106,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室10min,降温至3℃,然后再将冻存管转移至冰箱冷冻室25min,降温至-1℃,再在低温冰箱中放置60min降温至-30℃,再在气态氮环境中放置25min降温到-90℃,最后转移至液氮中封存。
67.试验例2
68.本试验例提出肿瘤干细胞的冻存方法。其采用实施例2的干细胞冻存液对干细胞进行冻存。上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为2.0
×
107/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。上述含
有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室15min,降温至5℃,然后再将冻存管转移至冰箱冷冻室30min,降温至-10℃,再在低温冰箱中放置80min降温至-35℃,再在气态氮环境中放置35min降温到-100℃,最后转移至液氮中封存。
69.试验例3
70.本试验例提出间充质干细胞的冻存方法。其采用实施例3所述的干细胞冻存液对干细胞进行冻存。上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为5.0
×
106/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室13min,降温至4℃,然后再将冻存管转移至冰箱冷冻室27min,降温至-5℃,再在低温冰箱中放置70min降温至-33℃,再在气态氮环境中放置30min降温到-95℃,最后转移至液氮中封存。
71.试验例4
72.本试验例提出神经干细胞的冻存方法。其采用实施例4所述的干细胞冻存液对干细胞进行冻存。上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为2.0
×
107/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室11min,降温至4℃,然后再将冻存管转移至冰箱冷冻室26min,降温至-2℃,再在低温冰箱中放置65min降温至-32℃,再在气态氮环境中放置26min降温到-98℃,最后转移至液氮中封存。
73.试验例5
74.本试验例提出神经干细胞的冻存方法。其采用实施例5所述的干细胞冻存液对干细胞进行冻存。上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为2.0
×
107/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室13min,降温至4℃,然后再将冻存管转移至冰箱冷冻室27min,降温至-5℃,再在低温冰箱中放置70min降温至-33℃,再在气态氮环境中放置30min降温到-95℃,最后转移至液氮中封存。
75.试验例6
76.本试验例提出神经干细胞的冻存方法。其采用对比例1所述的干细胞冻存液对干细胞进行冻存。上述干细胞在冻存前需采用上述干细胞冻存液对重悬,将上述干细胞冻存液中的干细胞密度控制为2.0
×
107/ml,然后将含有干细胞的冻存液混合均匀,再分装到冻存管进行冻存。上述含有干细胞的冻存液分装到冻存管后放置到4℃的环境下临时保存。上述含有干细胞的冻存液分装到冻存管后程序降温至-100℃后放入液氮中冻存。上述程序降温至-100℃具体为先将冻存管放置冰箱冷藏室11min,降温至4℃,然后再将冻存管转移至冰箱冷冻室26min,降温至-2℃,再在低温冰箱中放置65min降温至-32℃,再在气态氮环境
中放置26min降温到-98℃,最后转移至液氮中封存。
77.将上述试验例1-6中的干细胞冻存1个月后复苏,检测干细胞的活性如下表1所示:
78.表1
[0079][0080]
由此可知本发明提供的干细胞冻存液及冻存方法冻存的活性率更好,添加谷胱甘肽和乙酰胺可以进一步提高冻存干细胞复活后的活性。
[0081]
综上所述,本发明提供的干细胞冻存液具有以下有益效果:
[0082]
这种干细胞冻存液不采用动物血清,可以很好的避免动物血清存在携带传播病原体及其他致病因素的风险,避免由于血清的组分非常复杂、来源和生产批次存在差异可能会造成不良或不一致的影响,也避免血清中富含各种细胞因子、激素和其他活性成分,容易对干细胞的生物特性产生干扰和影响,确保干细胞冻存复苏后细胞活率高,细胞增殖数量好,细胞不易老化;且采用血清培养基普适性更好,二甲基亚砜的加入也使得干细胞不易受到冰晶损伤。
[0083]
本发明提供的干细胞冻存方法具有以下有益效果:
[0084]
采用这种干细胞冻存液冻存干细胞,其冻存效率高,冻存质量好,细胞复苏后活性好以及成活率高。
[0085]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1