一种腺病毒诱导肺纤维化急性加重动物模型的建立方法与流程
本发明属于生物医药动物模型领域,具体公开了一种腺病毒诱导肺纤维化急性加重动物模型的建立方法。
背景技术:
1、特发性肺纤维化(ipf)是一种病因不明的、慢性进展性疾病,诊断后平均生存期仅为2-3年。部分患者在病程中可能会发生急性加重(ae),表现为短期内呼吸困难急性加重伴肺功能恶化,耗氧量明显增加,出现弥漫性肺损伤(dad),进而导致患者病程快速恶化,甚至死亡。目前对于稳定期ipf的治疗仍主要以抗纤维化、减缓肺功能下降为主,而当发生ae时,尚无有效的治疗方法。更为重要的是,ae-ipf的病因和发病机制目前仍不清楚。在病理组织学上,ae-ipf表现为dad、大量炎症细胞渗出、急性非特性炎症改变和基质胶原产生。研究发现感染、药物毒性、手术或操作、误吸等多种因素都可以诱发ae发生,而免疫相关的肺损伤和肺泡上皮细胞的凋亡可能是ae-ipf发病的重要机制之一。因此,建立合理的ae-ipf动物模型对研究其机制具有重要意义。
2、近年来报道了多种ae-ipf动物模型,其中较常见的为首先,采用博来霉素(blm)或异硫氰酸荧光素(fitc)或转基因方法等诱导建立小鼠肺纤维化模型;在此基础上,再予以病毒、细菌或其他物理性、化学性物质等进行刺激,诱发ae发生。但现文献报道的造模方法存在很多争议,主要集中在诱发ae的给药方式、给药时间及次数及试剂的选择上,不同ae-ipf的动物模型差异很大。
3、在给药方式上,目前文献报道有滴鼻、经口咽吸入、气管内注射,器管切开给药、皮下注射等;滴鼻及经口咽吸入可能存在药物不能完全进入肺部、药物损失和因个体差异大导致造模效果不统一等问题;气管内注射与实验人员经验有关,经验不足可能误入食管;器管切开则损伤大,小鼠感染率、死亡率高;皮下注射则可能存在吸收问题。
4、在给药时间及给药次数上,目前主要存在的问题是给药时间过早,如在博来霉素用药后未满14天即再次给药诱导ae,此时小鼠模型尚处于急性炎症期,并非纤维化表现明显阶段,再次给药不能准确的模仿临床实际情况。部分方案采用多次给药的方法,操作繁琐、复杂,且易导致小鼠死亡率增加,并且不能体现出某个因素“激发”ae,这与临床上ipf患者发生ae时的“突然”性和迅速进展情况存在差异。
5、由于ae发病原因多种多样,文献报道诱发动物模型ae的刺激剂亦种类繁多,如细菌和具有复制活性的病毒、理化试剂等,细菌和有复制活性的病毒存在实验室要求条件高、易感染等风险;理化试剂则与临床实际情况存在较大差异。
技术实现思路
1、为解决上述问题,本发明公开了一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,具有准确、高效、安全、易行的优点。
2、本发明的技术方案如下:
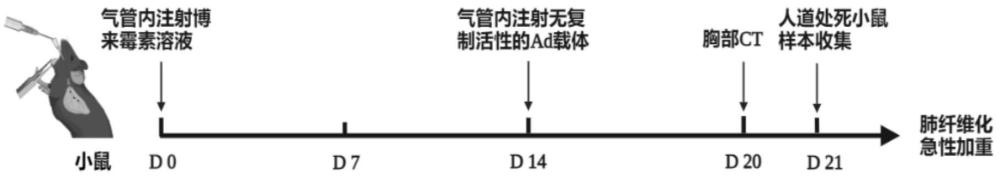
3、一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,至少包括以下步骤:在博来霉素建立小鼠肺纤维化模型的基础上,通过气管给药无复制活性的腺病毒载体ad诱发急性加重症状ae,形成腺病毒诱导肺纤维化急性加重动物模型ae-ipf。目前复制缺陷腺病毒(ad)载体,即腺病毒空载体是指不携带任何外源性dna或rna的病毒载体,被广泛用于基因转染和基因治疗研究中。虽然ad空载体可能会引起一些急性炎症反应和肺损伤发生,在正常小鼠,空载病毒体并不会引起肺纤维化等慢性疾病,仅仅可以引起轻微的炎症反应发生。本技术人发现在博来霉素建立小鼠肺纤维化模型的基础上再施加一定剂量的复制缺陷腺病毒(ad)载体却可以诱发肺纤维化小鼠发生急性肺损伤,出现急性加重的表现,这样,相比使用其他有活性的病毒诱导剂,降低了感染风险和实验难度。
4、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,所述气管给药为使用小鼠肺内雾化给药装置插入小鼠气管内内给于无复制活性的ad载体溶液。使用气管注射给药,不仅确保了给药的准确性,亦能减少对小鼠不必要的伤害和外界环境污染
5、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,所述无复制活性的ad载体溶液为将一定量的无复制活性的ad溶解于磷酸盐缓冲液中制成的。
6、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,所述无复制活性的ad载体溶液为将0.5-2×108pfu的无复制活性的ad载体溶解于25-100μl磷酸盐缓冲液中制成的。优选的,为将1×108pfu的无复制活性的ad载体溶解于50μl磷酸盐缓冲液中。
7、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,所述博来霉素建立小鼠肺纤维化模型中,博来霉素用量为3-5mg/kg,优选的,为5mg/kg。
8、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,所述小鼠为6-8周c57bl/6j雄性小鼠。
9、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,博来霉素建立小鼠肺纤维化模型包括以下步骤:
10、经气管注射博来霉素诱导小鼠肺纤维化:
11、①第0天称量小鼠体重,耳标标记;雾化吸入异氟烷充分麻醉小鼠,注意保温;
12、②小鼠麻醉成功后,呈仰卧位置于鼠板,铁丝固定上门齿,胶带固定四肢;
13、③调节鼠板至适当角度,小鼠头面向上,用镊子轻柔地牵拉出小鼠舌部偏向一侧;
14、④左手执小鼠喉镜插入小鼠咽喉部,压住舌根、轻轻上抬,充分暴露声门,可见声门规律张合;将小鼠肺内雾化给药装置轻柔插入声门,并注射相应体积博来霉素溶液;
15、⑤造模后,可观察到小鼠呼吸频率增快,小鼠胸廓起伏明显,将小鼠移至耳边可闻及湿啰音;
16、⑥助手接触固定,将小鼠俯卧位放置回笼中;观察小鼠清醒后状态;
17、⑦每日观察小鼠活动、呼吸频率、进食、毛色变化、生存情况,并隔日测量小鼠体重,做好记录。
18、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,所述气管给药无复制活性的腺病毒载体ad的时间为给予博来霉素之后的小鼠肺纤维化期。
19、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法,包括以下步骤:
20、经气管注射无复制活性的ad载体溶液诱导博来霉素小鼠肺纤维化急性加重:
21、1)博来霉素给药后第14天再次雾化吸入异氟烷充分麻醉小鼠,观察麻醉效果及有无不良反应;
22、2)小鼠麻醉成功后,经气管内注射无复制活性的ad载体溶液;
23、3)造模后,观察小鼠呼吸频率是否增快、小鼠的生存状态和死亡率;
24、4)助手接触固定,将小鼠俯卧位放置回笼中;观察小鼠清醒后状态;
25、5)每日观察小鼠活动、呼吸频率、进食、毛色变化、生存情况,并隔日测量小鼠体重,做好记录;
26、6)在第20天,小鼠行胸部ct检查,第21天,采用颈髓离断方法处死小鼠,收取血液、肺组织及肺泡灌洗液等样本,评估造模效果。
27、进一步的,上述一种腺病毒诱导肺纤维化急性加重动物模型的建立方法在研制治疗/预防特发性肺纤维化疾病的药物中的应用。
28、本发明具有以下有益效果:
29、本方案采用目前较公认的博来霉素建立小鼠肺纤维化模型,针对给药方式,本发明采用小鼠喉镜直视下气管内注射给药,不仅能确保给药的可靠性、准确性,亦可以减少对小鼠伤害,提高生存率和人道主义保护,给药时间选择在第14天(小鼠肺纤维化期),并且是单次给药,高度模拟临床实际,并且减轻小鼠痛苦,创造性的选择灭活腺病毒,既能模拟ipf病人可能在病毒感染后诱发ae,又能减少环境污染和毒副作用,降低实验人员感染的风险。
- 还没有人留言评论。精彩留言会获得点赞!