一种锌螯合肽凝胶及其制备方法与流程
本发明涉及食品加工技术领域,更具体地说,涉及一种锌螯合肽凝胶及其制备方法。
背景技术:
锌是人体中重要的微量元素,人体中含锌的酶(如输氧的碳酸酐酶、骨骼生长所需的碱性磷酸酶)和被锌激活的酶达70多种。锌参与核酸蛋白质的代谢过程,能促进皮肤、骨骼和性器官的正常发育,维持消化和代谢活动。
随着人类对蛋白、多肽类产品需求的日益增加,研究已经报道过许多多肽具有抗血栓、抗氧化、降血压、促进骨生成等功能。部分多肽在水溶液中呈现分散均一的溶液状态,而在一定条件存在下可自组装形成凝胶。凝胶具有优异的自适应性,被广泛应用于可伤口敷料、骨损伤添加物等医学领域,在凝胶的基础上引入离子交联、共价交联或互传聚合物等网络结构,既保证了其力学强度,又赋予其延展性能,使凝胶在环境中的应用多种多样。研究报道,自组装多肽凝胶由于其良好的生物相容性、可逆性和可降解性等特点,被广泛应用于组织工程、药物递送和细胞培养等领域。通常可通过自身组装成凝胶的多肽类型有氨基酸配对型多肽、β-发夹型多肽、fluorenylmethoxycarbonyl(fmoc)肽和两亲性多肽等,但这些能够自组装成凝胶的肽段序列较长。而研究较为广泛的工程肽基凝胶是在一些天然多肽中引入一些辅助粒子,使其在外加物质的诱导下形成凝胶,并可能具有特定功能。上述这些研究中,还未见可以携带(螯合)大量的锌离子的自组装多肽凝胶,也就是在开发富含锌离子的生物活性肽凝胶方面,此前并未见报道。
所述贝类活性肽可能兼具锌离子螯合能力,螯合体可形成含水量较高的凝胶,因而可开发新型的锌离子补充剂。自组装定义为一种能自发地将其自身排列为有序的纳米结构,在锌离子的螯合作用中,多肽可以组装形成规则有序的纳米结构,其可以为开发新型食品提供技术和产品制备方法。
技术实现要素:
为了达到上述目的,本发明的目的之一是提供一种贝类活性肽在螯合锌离子中的应用,所述贝类活性肽p-2-cg(来源于水产中,如牡蛎、贻贝、扇贝等贝类),其氨基酸序列如seqidno.1所示,是ile-glu-glu-leu-glu-glu-glu-leu-glu-ala-glu-arg,可用于与锌离子螯合,锌离子可以与所述贝类活性肽p-2-cg的第七位氨基酸螯合,螯合体组装成树枝状的网络结构,所述锌离子与所述贝类活性肽p-2-cg螯合的摩尔比为(1.25±0.27)∶1。
本发明还提供了一种贝类活性肽在制备补充锌的食品或保健品中的应用,所述贝类活性肽的氨基酸序列如seqidno.1所示。
本发明的另一个目的是提供一种锌螯合肽凝胶,ph5.0,包括组分:贝类活性肽p-2-cg9mmol/l,zncl26~9mmol/l,h3bo3125mmol/l;所述贝类活性肽p-2-cg的氨基酸序列如seqidno.1所示。
所述锌螯合肽凝胶的制备方法,包括步骤:
s1、在20~25℃、将贝类活性肽p-2-cg溶于ph5.0的水中,配置成溶液a;所述贝类活性肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在20~25℃、将步骤s1所述溶液a和溶液b混匀,静置4~6h,得锌螯合肽凝胶;所述溶液bph5.0,包含zncl2,h3bo3,水;所述凝胶包括组分:贝类活性肽p-2-cg9mmol/l,zncl26~9mmol/l,h3bo3125mmol/l;所述锌螯合肽凝胶可以作为锌补充剂,作为补充锌的食品或保健品用于补充锌;所述制备方法还可以包括溶液的配制、贝类活性肽p-2-cg的合成等前处理步骤。
优选方式下,使用hcl溶液调节步骤s1所述水的ph为5;使用hcl调节步骤s2所述溶液b的ph为5.0。
优选方式下,所述锌螯合肽凝胶的制备方法,包括步骤:
s1、在20~25℃、将贝类活性肽p-2-cg溶于ph5.0的水中,配置成所述贝类活性肽浓度为18mmol/l的溶液a;所述可与锌离子螯合的贝类活性肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在20~25℃、将溶液a和溶液b等体积混匀,静置4~6h,得锌螯合肽凝胶;所述溶液bph5.0,包含zncl212~18mmol/l,h3bo3250mmol/l,水;所述锌螯合肽凝胶包括组分:p-2-cg9mmol/l,zncl26~9mmol/l,h3bo3125mmol/l;所述锌螯合肽凝胶可以作为锌补充剂,作为补充锌的食品或保健品用于补充锌。
优选方式下,使用hcl溶液调节步骤s1所述水的ph为5.0;使用hcl调节步骤s2所述溶液b的ph为5.0。
优选方式下,所述锌螯合肽凝胶的制备方法,包括步骤:
s1、在25℃,使用hcl溶液调节水的ph为5.0,将贝类活性肽p-2-cg溶于ph5.0的水中,配置成18mmol/l的溶液a;所述可自组装的锌螯合肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在25℃、将溶液a和溶液b等体积混匀,静置6h,得锌螯合肽凝胶;所述溶液b组分:zncl218mmol/l,h3bo3250mmol/l,使用hcl调节ph5,余量为水;所述锌螯合肽凝胶包括组分:p-2-cg9mmol/l,zncl29mmol/l,h3bo3125mmol/l。
本发明的另一个目的是提供一种补充锌的食品或保健品,在制备时加入所述锌螯合肽凝胶。
与现有技术相比,本发明包含以下有益效果:
1、本发明首次证明了锌离子可以诱导一条贝类活性肽的螯合作用,并自组装形成具有纤维状结构的凝胶。
2、本发明提出了在锌离子浓度在6~9mmol/l,h3bo3浓度为125mmol/l的体系中,贝类活性肽的浓度为9mmol/l的条件下,可以形成凝胶。
3、首次将贝类活性肽应用于凝胶食品的开发中,为开发新型食品提供技术和产品制备方法。
本发明突破了国内外现存的多肽凝胶的研究思路和方法,提供一种可与锌离子螯合的锌螯合肽凝胶的制备方法。所述锌螯合肽凝胶可用于开发新型的锌离子补充剂。本发明操作简单,条件可控性强,其最大优势在于可以高效制备锌螯合肽凝胶,使用的贝类活性肽具有抗血栓及促成骨功能,且螯合了大量的微量元素锌,为开发新型食品提供技术和产品制备方法。
附图说明
图1为本发明实施例1的贝类活性肽的液相质谱图;
图2为本发明实施例1的锌离子与贝类活性肽的螯合比;
图3为本发明实施例1的锌离子与贝类活性肽的摩尔结合比;
图4为本发明实施例2中贝类活性肽的3d结构;
图5为本发明实施例2中锌离子与贝类活性肽结合后氢键的分析效果图;
图6为本发明实施例2中锌离子与贝类活性肽结合后疏水相互作用的分析效果图;
图7为本发明实施例2中锌离子与贝类活性肽结合后离子相互作用的分析效果图;
图8为本发明实施例2中贝类活性肽在水溶液中的一级质谱图;
图9为本发明实施例2中锌离子与贝类活性肽的螯合物的二级质谱图;
图10为本发明实施例3、4锌螯合肽凝胶的动静态光散射的衰减函数曲线图;
图11为本发明对比例1、2、3锌螯合肽混合物的动静态光散射的衰减函数曲线图;
图12为本发明实施例4锌螯合肽凝胶的透射电子显微镜负染图(tem);
图13为本发明对比例1锌螯合肽混合物的透射电子显微镜负染图(tem);
图14为本发明对比例3锌螯合肽混合物的透射电子显微镜负染图(tem);
图15为本发明实施例3锌螯合肽凝胶的小瓶倒置图;
图16为本发明实施例4锌螯合肽凝胶的小瓶倒置图;
图17为本发明对比例1锌螯合肽混合物的小瓶倒置图;
图18为本发明对比例2锌螯合肽混合物的小瓶倒置图;
图19为本发明对比例3锌螯合肽混合物的小瓶倒置图。
具体实施方式
为使本发明实施方式的目的、技术方案和优点更加清楚,下面将对本发明实施方式中的技术方案进行清楚、完整地描述。以下结合具体实方式对本发明作进一步说明,但本发明的实施和保护范围不限于此。对于未特别注明的工艺参数,可参照常规条件或制造商建议进行。
本发明利用一种已研究报道过具有抗血栓及促成骨功能的贝类活性肽,进行了锌离子螯合能力的探究,结果可知,锌离子与肽的摩尔结合比为1.25±0.27∶1。并证明一定浓度的锌离子可以与肽螯合并自组装成凝胶,在锌离子与肽的摩尔比为1时,组装效果最好。
本发明将锌离子螯合贝类活性肽组装成的凝胶结构作以表征,并对锌离子的螯合位点作以解析。
s1、选取一种已研究报道过具有抗血栓及促成骨功能的贝类活性肽,用超纯水配置以下几种溶液,使得各溶液分别含配置不同摩尔浓度的氯化锌(zncl2),以及1mmol/l的肽,室温螯合反应12h。
s2、选取一定截留分子量的透析袋对螯合液进行透析,利用原子火焰吸收光谱测定锌离子含量。
s3、本发明在贝类活性肽的功能活性基础上,同时具备螯合锌离子的能力,根据等温量热滴定的实验方法探究贝类活性肽与锌离子的摩尔结合比。
s4、本发明利用核磁共振来解析肽的结构,并利用分子对接实验来预测锌离子与肽的螯合位点。
s5、本发明利用离子肼质谱实验来解析锌离子与肽链内氨基酸螯合的位点。
s6、根据本发明的一个方面,在一定浓度的锌离子螯合条件下,贝类活性肽能够形成凝胶。
在优选实施方式中,上述水溶液还含有h3bo3等添加物。
s7、本发明利用正置倒置小瓶实验、动静态光散射实验、透射电子显微镜实验来进行贝类活性肽自组装特性的表征。
优选方式下,步骤s1所述氯化锌(zncl2)的摩尔浓度分别为(0.2-20mmol/l)
优选方式下,步骤s2所述具体透析步骤为:将螯合12h的螯合液装入截留分子量为1000da的透析袋,以ph6~7的水透析48h,每6h换一次水,以除去游离的锌离子。
优选方式下,步骤s3所述,利用等温量热滴定仪(itc),将20mmol/l的zncl2装入滴定针,将0.5mmol/l肽装入反应池,以与反应池同等体积的超纯水放入参比池中,滴定对照组将20mmol/l的zncl2装入滴定针,将超纯水装入反应池,将滴定曲线扣除背景后,得到s型滴定曲线,将曲线拟合后计算肽与锌离子的摩尔结合比。
优选方式下,步骤s4所述,利用brukeravanceiii700mhz核磁共振谱仪在298k的温度条件下,样品溶于500ul含有10%氘代水的pbs缓冲溶液中,通过收集和分析1d1h,2d1h-1htocsy,1h-1hcosy和2d1h-13chsqc,对样品主链和侧链的1h和13c化学位移进行了归属。收集和分析2d1h-1hroesy(混合时间200ms),进一步确认化学位移的归属,并生成用于结构计算的空间距离约束。核磁共振所有图谱使用nmrpipe的软件进行处理,并使用nmrview软件进行分析,解析出多肽的结构,并利用discoverystudio软件进行预测锌离子与肽的螯合位点的预测,所选对接模块为“cdocker_energy”。
优选方式下,步骤s5所述,以80%的甲醇水稀释样品浓度至1-100pm,经过离子肼质谱检测肽及锌离子与肽的螯合物,对其主要质谱峰以20-30的能量值进行二级粒子碎裂,根据碎裂质量数解析锌离子与肽链内氨基酸螯合的位点。
优选方式下,步骤s6所述,分别在3,6,9,12mmol/lzncl2,125mmol/lh3bo3的体系中,肽的浓度为9mmol/l的条件下,探究凝胶形成的情况。上述凝胶在20~25℃的温度条件下,在ph为5.0的体系中,锌离子浓度为9mmol/l的情况下凝胶的黏度较好。
发明将研究报道过具有抗血栓及促成骨功能的贝类活性肽进行了锌离子螯合能力的测定,随着锌离子浓度的增加,锌离子与肽的螯合比升高,1mmol/l的贝类活性肽与约1.25±0.27mmol/l的zncl2螯合。经核磁共振及discoverystudio软件预测出贝类活性肽与锌离子的结合位点,此条肽的第七位氨基酸“glu”与锌离子具有氢键(h-bonds);疏水相互作用(hydrophobicity)及离子相互作用(ionizability)。经离子肼质谱按照粒子碎裂规律解析其质量数也与以上预测相符。本专利表明锌离子浓度为6~9mmol/l的情况下,9mmol/l的锌螯合肽凝胶的黏度较好,可以形成树枝状的凝胶,且在9mmol/lzncl2存在的条件下形成的树枝状结构更为致密。
一种锌螯合肽凝胶的制备方法,包括步骤:
在20~25℃,将贝类活性肽p-2-cg溶于ph5.0的水中,配置成18mmol/l的肽溶液(溶液a);配置溶液b,由以下组分组成:zncl212~18mmol/l,h3bo3250mmol/l,余量为水,调节ph至5.0;将溶液a和溶液b等体积混匀,静置4~6h,即可形成锌螯合肽凝胶。
由于所述贝类活性肽本身无自组装能力,与锌离子螯合后具有良好的凝胶构象,同时具备螯合锌的能力,可开发新型的锌离子补充剂。本发明操作简单,条件可控性强,其最大优势在于可以高效制备锌螯合活性肽凝胶,该贝类活性肽抗血栓及促成骨功能,且螯合了大量的微量元素锌,为开发新型食品提供技术和产品制备方法。
实施例1
本实施例的目的是证明所述贝类活性肽能与锌离子结合,并测定其结合量。
s1、本发明通过固相合成法得到一种已研究报道过具有抗血栓及促成骨功能的贝类活性肽,其氨基酸序列如seqidno.1所示,为ile-glu-glu-leu-glu-glu-glu-leu-glu-ala-glu-arg,图1为贝类活性肽的液相质谱图,此肽分子量为1489da。在室温20℃的条件下,用超纯水配置以下几种溶液,摩尔浓度分别为0.2,1,2,4,8,12,16和20mmol/l氯化锌(zncl2),使每份溶液中的肽浓度为1mmol/l,室温静置螯合反应12h。
s2、将螯合12h后的螯合液装入截留分子量为1000da的透析袋,两侧用透析夹夹住,对螯合液进行透析,以ph6.0~7.0的水透析48h,每6h换一次水,以除去游离的锌离子。利用原子火焰吸收光谱测定锌离子含量。图2为锌离子与贝类活性肽的最大螯合比,即锌离子与贝类活性肽的最大螯合摩尔比约为2.5。
s3、利用等温量热滴定仪itc,将20mmol/l的zncl2溶液装入滴定针,将0.5mmol/l贝类活性肽水溶液装入反应池,以与反应池同等体积的超纯水放入参比池中,滴定对照组将20mmol/lzncl2溶液装入滴定针,将超纯水装入反应池,将滴定曲线扣除背景后,得到s型滴定曲线,将曲线拟合后计算贝类活性肽与锌离子的摩尔结合比。图3为锌离子与肽的摩尔结合比。锌离子可以与肽螯合,摩尔比为1.25±0.27(锌离子与肽的摩尔比)。
实施例2
本实施例的目的是揭示所述贝类活性肽与锌离子的结合位点。
s1、利用核磁共振来解析所述贝类活性肽的结构,利用brukeravanceiii700mhz核磁共振谱仪在298k的温度条件下,将5mg贝类活性肽粉末溶于500μl含有10%的氘代水中,通过收集和分析1d1h,2d1h-1htocsy,1h-1hcosy和2d1h-13chsqc,对样品主链和侧链的1h和13c化学位移进行了归属。核磁共振所有图谱使用nmrpipe的软件进行处理,并使用nmrview软件进行分析,解析出所述可自组装贝类活性肽的结构,如图4所示,可以明显的看见结构中含有α螺旋区域。并利用discoverystudio软件进行锌离子与所述贝类活性肽的螯合位点的预测,所选对接模块为“cdocker_energy”。预测结果如图5、6、7所示,分别为锌离子与贝类活性肽的第七位氨基酸“glu”结合后的氢键、疏水相互作用以及离子相互作用的效果图。
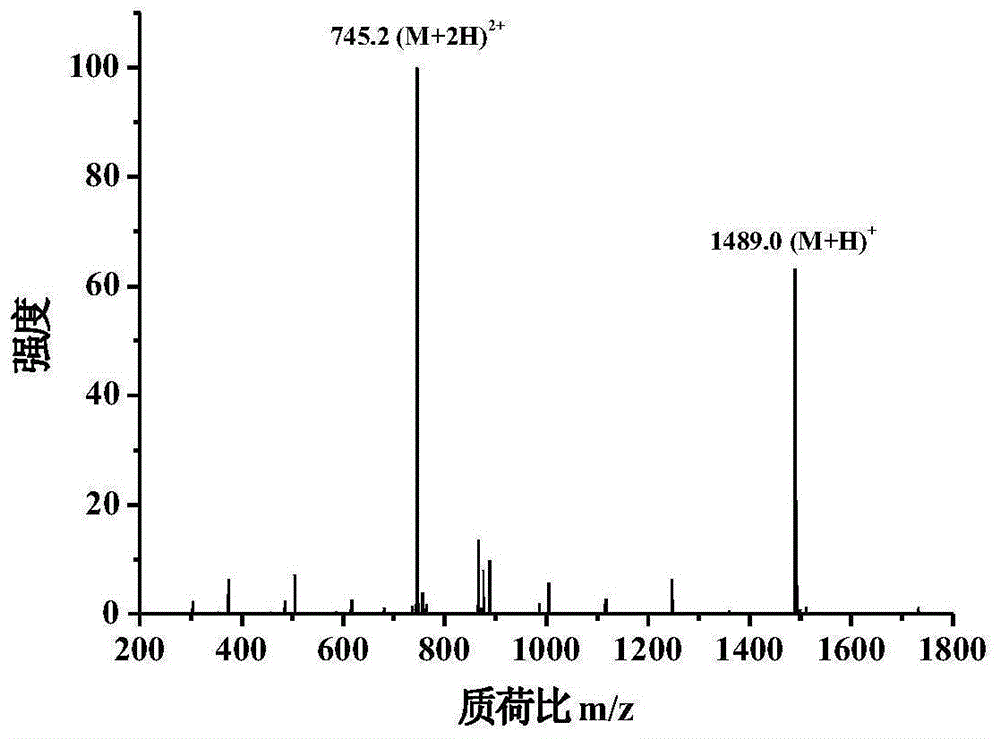
s2、本发明利用离子肼质谱实验来解析锌离子与所述贝类活性肽链内氨基酸螯合的位点。以80%的甲醇水稀释样品浓度至1~100pm,经过离子肼质谱检测所述贝类活性肽及锌离子与所述贝类活性肽的螯合物,对其主要质谱峰以20~30的能量值进行二级粒子碎裂,根据碎裂质量数解析锌离子与肽链内氨基酸螯合的位点,结果如图8、9所示,图8为肽在水溶液中的一级质谱图,图9为锌离子与所述贝类活性肽的螯合物的二级质谱图,由此可分析出锌离子与贝类活性肽的结合位点在第七位氨基酸“glu”上。
结果可知,锌离子可以与所述贝类活性肽螯合,且螯合位点在第七位氨基酸“glu”上。
实施例3
一种锌螯合肽凝胶的制备方法,包括步骤:
s1、在20℃、使用hcl将水的ph调至5.0,将贝类活性肽p-2-cg溶于ph5.0的水中,配置成所述贝类活性肽浓度为18mmol/l的溶液a;所述贝类活性肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在20℃、将溶液a和溶液b等体积混匀,静置4h,得锌螯合肽凝胶;所述溶液b组分:zncl212mmol/l,h3bo3250mmol/l,使用hcl溶液调节ph至5.0,余量为水;所述锌螯合肽凝胶组分包括:p-2-cg9mmol/l,zncl26mmol/l,h3bo3125mmol/l。
本实施例还可以包括前处理步骤,配制溶液b、固相合成法合成贝类活性肽p-2-cg。
螯合后,将装有本实施例制得的锌螯合肽凝胶的小瓶倒置,如图15所示,观察形成凝胶形成且黏度较好贴在小瓶底部,倒置未脱落。
实施例4
一种锌螯合肽凝胶的制备方法:
s1、在25℃,使用hcl溶液调节水的ph为5.0,将贝类活性肽p-2-cg溶于ph5.0的水中,配置成18mmol/l的溶液a;所述可自组装的锌螯合肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在25℃、将溶液a和溶液b等体积混匀,静置6h,得锌螯合肽凝胶;所述溶液b的组分:zncl218mmol/l,h3bo3250mmol/l,使用hcl调节ph至5.0,余量为水;所述锌螯合肽凝胶包括组分:p-2-cg9mmol/l,zncl29mmol/l,h3bo3125mmol/l。
本实施例还可以包括前处理步骤,配制溶液b、固相合成法合成贝类活性肽p-2-cg。
螯合后,将装有本实施例制得的锌螯合肽凝胶的小瓶倒置,如图16所示,观察形成凝胶形成且黏度较好贴在小瓶底部,倒置未脱落。
对比例1
s1、在25℃、将贝类活性肽p-2-cg溶于ph5.0的水中,配置成18mmol/l的溶液a;所述可与锌离子螯合的贝类活性肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在25℃、将溶液a和溶液b等体积混匀,静置4h,得锌螯合肽混合液;所述溶液b的组分:zncl26mmol/l,h3bo3250mmol/l,使用hcl调节ph至5.0,余量为水;所述锌螯合肽混合液包括组分:p-2-cg9mmol/l,zncl23mmol/l,h3bo3125mmol/l,余量为水。螯合后,将装有凝胶的小瓶倒置,如图17所示,观察形成凝胶未形成且黏度较差,倒置脱落。
对比例2
s1、在25℃、将贝类活性肽p-2-cg溶于ph5.0的水中,配置成18mmol/l的溶液a;所述可与锌离子螯合的贝类活性肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在25℃、将溶液a和溶液b等体积混匀,静置4h,得锌螯合肽混合液;所述溶液b的组分:zncl224mmol/l,h3bo3250mmol/l,使用hcl调节ph至5.0,余量为水;所述锌螯合肽混合液包括组分:p-2-cg9mmol/l,zncl212mmol/l,h3bo3125mmol/l,余量为水。螯合后,将装有凝胶的小瓶倒置,如图18所示,观察形成凝胶未形成且黏度较差,倒置脱落。
对比例3
s1、在25℃、将贝类活性肽p-2-cg溶于ph5.0的水中,配置成18mmol/l的溶液a;所述可与锌离子螯合的贝类活性肽p-2-cg的氨基酸序列如seqidno.1所示;
s2、在25℃、将溶液a和溶液b等体积混匀,静置4h,得锌螯合肽混合液;所述溶液b的组分:h3bo3250mmol/l,使用hcl调节ph至5.0,余量为水;所述锌螯合肽混合液包括组分:p-2-cg9mmol/l,h3bo3125mmol/l,余量为水。螯合后,将装有凝胶的小瓶倒置,如图19所示,观察形成凝胶未形成且黏度较差,倒置脱落。
取实施例3、实施例4步骤s2获得的锌螯合肽凝胶,使用动静态光散射进行锌离子螯合肽组装现象的分析:取200μl所述待测试样放置在微量测量管中,测量角度为100°,测量时间为3600s,每个实验重复三次以得到平均值。使用软件画出衰减函数曲线后结果如图10所示,9mmol/l的类活性肽p-2-cg与6~9mmol/lzncl2,螯合后形成的凝胶衰减曲线较为平滑,粘度较大。
取对比例1、对比例2、对比例3步骤s2获得的锌螯合肽混合液,使用动静态光散射进行锌离子螯合肽组装现象的分析:取200μl所述待测试样放置在微量测量管中,测量角度为100°,测量时间为3600s,每个实验重复三次以得到平均值。使用软件画出衰减函数曲线后结果如图11所示9mmol/l的类活性肽p-2-cg与3,12mmol/lzncl2,螯合后形成的体系衰减曲线较为急剧,粘度较小。
取实施例4步骤s2获得的锌螯合肽凝胶,使用透射电子显微镜进行锌离子螯合肽外观形貌的分析:取10μl所述待测试样滴落在附有超薄碳膜的铜网上,5分钟后用滤纸吸干;滴落10μl醋酸双氧铀(2%)于铜网上并保持5分钟后用滤纸吸干;放置在透射电子显微镜上,使用80kv的电压观测样品形貌。在不同的区域观察相同的样本,以避免实验误差,结果如图12所示,凝胶纤维在电镜观察下可见纤维状网络结构,自组装形成的凝胶致密。
取对比例1、对比例3步骤s2获得的锌螯合肽混合液,使用透射电子显微镜进行锌离子螯合肽外观形貌的分析:取10μl所述待测试样滴落在附有超薄碳膜的铜网上,5分钟后用滤纸吸干;滴落10μl醋酸双氧铀(2%)于铜网上并保持5分钟后用滤纸吸干;放置在透射电子显微镜上,使用80kv的电压观测样品形貌。在不同的区域观察相同的样本,以避免实验误差,结果如图13、14所示,所形成的凝胶网络较为松散不可自组装形成凝胶。
序列表
<110>大连工业大学
<120>一种锌螯合肽凝胶及其制备方法
<130>zr201025lq
<160>1
<170>siposequencelisting1.0
<210>1
<211>12
<212>prt
<213>长牡蛎(crassostreagigas)
<400>1
ileglugluleugluglugluleuglualagluarg
1510
- 还没有人留言评论。精彩留言会获得点赞!