一种复合发酵菌剂及其在制备发酵乳中的应用
本发明涉及发酵乳技术领域,具体涉及一种复合发酵菌剂及其在制备发酵乳中的应用。
背景技术:
乳酸菌是存在于人体肠道中的一种普遍的生理菌群,它可以在人体肠道内定居并形成保护膜,以防止恶劣的胃肠道(git)微环境对细菌的影响。同时,乳酸菌产生的短链脂肪酸和乳酸已被证明在维持肠道内环境平衡方面起着重要作用。此外,乳酸菌还可以提高发酵食品的营养价值,降低肠道感染和血清胆固醇水平。与其它益生菌相比,乳酸菌在胃肠道环境中对酸和胆盐的抵抗力更强。为此,包括双歧杆菌、乳酸杆菌在内的乳酸菌在发酵食品工业中较为流行,而与一些优秀益生菌共培养发酵的模式在目前的发酵乳制品中更为常见,例如保加利亚乳杆菌(lactobacillusbulgaricus)、嗜热链球菌(streptococcusthermophilus)和嗜酸乳杆菌(lactobacillusacidophilus)常常共培养以制备发酵乳。然而,共培养时不同菌株之间如何相互作用仍存在许多问题。
长期以来,人们认识到细菌群体之间通过群体感应中细胞外信号分子的交换存在着一种特殊的相互作用模式,以此来调控许多重要的生理功能(如生物发光、运动性、次生代谢产物的产生和生物膜的形成)。其中最常见的信号分子是自身诱导物-2(ai-2)。ai-2是一种新的呋喃葡萄糖基硼酸双酯,被认为是种间交流的“通用”信号分子,它是由许多革兰氏阴性和革兰氏阳性细菌基因组中的s-核糖基同型半胱氨酸裂解酶基因产物(s-ribosylhomocysteinase,luxs)扩增出来的。luxs基因是ai-2信号分子合成的标志性基因。
近年来,乳酸菌中与群体感应相关的细胞间通讯受到越来越多的关注,特别是在共培养条件下。乳酸菌的主要代谢产物是氨基酸、胞外多糖和乳酸。一些研究还发现,在共培养条件下,群体感应影响细菌代谢物的类型和丰度。而与群体感应相关的细菌代谢是氨基酸代谢。但是,氨基酸代谢产物的种类和丰度是否会影响ai-2信号分子的合成、氨基酸代谢产物是否会影响发酵乳品质的影响,还未见报道。
技术实现要素:
本发明所要解决的第一个技术问题是针对现有技术的现状而提供一种能高产ai-2信号分子、促进乳酸菌共培养的复合发酵菌剂。
本发明所要解决的第二个技术问题是针对现有技术的现状而提供上述的复合发酵菌剂在制备发酵乳中的应用。
本发明解决上述第一个技术问题所采用的技术方案为:一种复合发酵菌剂,其特征在于:包括l-丙氨酸、保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌。
优选地,按照质量份包括1份保加利亚乳杆菌、1份嗜热链球菌、1份嗜酸乳杆菌。
本发明解决上述第二个技术问题所采用的技术方案为:如上述的复合发酵菌剂在制备发酵乳中的应用。
优选地,包括发酵乳的制备方法,发酵乳的制备方法包括以下步骤:
将上述的复合发酵菌剂中的保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌分别活化后离心取上清液,并将上清液的od调为0.05~1.05;
取保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌的上清液按体积比1:1:1的比例混合得到混合液,每100ml混合液添加1g丙氨酸;
在每100ml巴氏杀菌的纯牛奶中接入6ml上述添加丙氨酸后的混合液,将发酵柜温度设置为42℃,发酵时间为6h,再将发酵柜温度调至4℃后熟18h。
与现有技术相比,本发明的优点在于:复合发酵菌剂包括l-丙氨酸、保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌,通过添加l-丙氨酸,有利于三种乳酸菌(保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌)在共培养时高产ai-2信号分子,促进保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌的共培养。
本发明提供的复合发酵菌剂在发酵乳制备中的应用,通过在制备发酵乳时添加l-丙氨酸、保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌,三种菌相互协调,有利于提高发酵乳的内聚性、改善发酵乳的风味。
附图说明
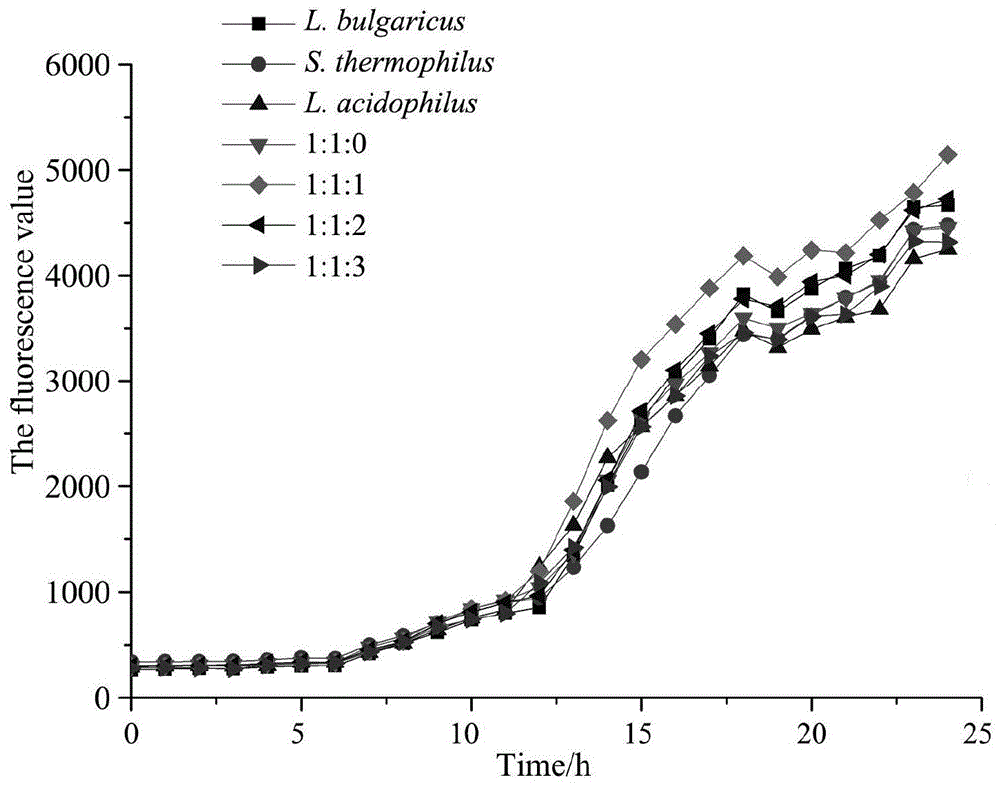
图1为本发明实施例中不同培养条件下的荧光值;
图2为胃肠液培养前后内参基因的表达稳定性分析(图2的图a为dp3d基因的熔融峰,图b为ldhd基因的熔融峰,图c为gapdh基因的熔融峰,图d为grya基因的熔融峰);
图3为嗜酸乳杆菌、保加利亚乳杆菌、嗜热链球菌应用自身引物荧光定量pcr后的结果图(图3的a、b、c分别为嗜酸乳杆菌、保加利亚乳杆菌、嗜热链球菌应用自身引物进行荧光定量pcr的结果图);
图4为嗜酸乳杆菌的luxs基因引物、保加利亚乳杆菌的luxs基因引物、嗜热链球菌的luxs基因引物分别添加到其它两种菌后的荧光定量pcr结果图(图4的a为嗜热链球菌的luxs基因引物加到保加利亚乳杆菌的cdna,b为嗜热链球菌的luxs基因引物加到嗜酸乳杆菌的cdna,c为保加利亚乳杆菌的luxs基因引物加到嗜酸乳杆菌的cdna,d为保加利亚乳杆菌的luxs基因引物加到嗜热链球菌的cdna,e为嗜酸乳杆菌的luxs基因引物加到保加利亚乳杆菌的cdna,f为嗜酸乳杆菌的luxs基因引物加到嗜热链球菌的cdna);
图5为本发明实施例中luxs基因在三种菌共培养条件下的表达;
图6为本发明实施例中共培养条件下代谢物之间的相关性分析图;
图7为本发明实施例中共培养条件下代谢物的浓度;
图8为本发明实施例中共培养条件下代谢物的主成分分析图;
图9为本发明实施例中sam和sah的合成途径;
图10为本发明实施例中共培养条件下代谢物的vip分析图;
图11为本发明实施例中共培养条件下sam、sah和l-丙氨酸的色谱图(图11-1是嗜酸乳杆菌组,图11-2是保加利亚乳杆菌:嗜热链球菌:嗜酸乳杆菌1:1:0组,图11-3是保加利亚乳杆菌:嗜热链球菌:嗜酸乳杆菌1:1:1组);
图12为本发明实施例中添加l-丙氨酸后共培养条件的荧光值;
图13为本发明实施例中添加l-丙氨酸后luxs基因在共培养条件下的表达;
图14为本发明实施例中复合l-丙氨酸发酵乳在发酵过程中的活菌数变化;
图15为本发明实施例中复合l-丙氨酸发酵乳在发酵过程中的ph值;
图16为本发明实施例中复合l-丙氨酸发酵乳的电子舌分析。
具体实施方式
以下结合实施例对本发明作进一步详细描述。
本实施例提供一种复合发酵菌剂,包括l-丙氨酸、保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌。按照质量份包括1份保加利亚乳杆菌、1份嗜热链球菌、1份嗜酸乳杆菌。
本实施例还提供上述的复合发酵菌剂在发酵乳制备中的应用。具体地,上述应用包括发酵乳的制备方法,发酵乳的制备方法包括以下步骤:
将上述的复合发酵菌剂中的保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌分别活化后离心取上清液,并将上清液的od调为0.05~1.05;
取保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌的上清液按体积比1:1:1的比例混合得到混合液,每100ml混合液添加1g丙氨酸;
在每100ml巴氏杀菌的纯牛奶中接入6ml上述添加丙氨酸后的混合液,将发酵柜温度设置为42℃,发酵时间为6h,再将发酵柜温度调至4℃后熟18h。
本实施例能高产信号分子的共培养条件的筛选通过如下方法进行。
1、ai-2信号分子的生物检测
将保加利亚乳杆菌(bncc336436,购自北京北纳创联生物技术研究院)、嗜热链球菌(abt-t,购自中国工业微生物菌种保藏中心)和嗜酸乳杆菌(cicc6074,购自中国工业微生物菌种保藏中心)分别接种至mrs培养基中,均在37℃条件中培养12h,取培养后的菌液离心(6000rpm/min,10min,4℃),用0.9%生理盐水洗菌体3次,调节菌液光密度od600达到1±0.05后分别以1%体积的接种量接种至新鲜的mrs培养基中,在37℃条件中培养12h后离心取上清液,并通过0.22μm的无菌滤膜过滤,除去上清液中残留的乳酸菌,作为待测样品用于接下来的实验。
将活化3代后的哈氏弧菌bb170按照1:100的比例接种到ab培养基中在30℃120rpm/min条件中培养到od600吸光值在0.8左右,按照1:5000的比例稀释到新鲜ab培养基中并混匀。将保加利亚乳杆菌的无菌上清液,嗜热链球菌的无菌上清液,嗜酸乳杆菌的无菌上清液,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌的无菌上清液体积比按照1:1:0、1:1:1、1:1:2和1:1:3,也就是共6组上清液均添加1%体积的量与上述哈氏弧菌bb170稀释液混匀,30℃继续培养。每隔1h加样在96孔板上,每孔加样200μl,每样加5个孔作为平行,使用酶标仪的化学发光模式测定其荧光强度。
由图1可知,各组的信号分子强度在12小时后出现差异,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:1时信号分子强度最高。
2、定量逆转录pcr检测luxs信号分子基因
2.1内参基因的选择
以胃肠液处理前后的嗜酸乳杆菌cicc6074为研究对象,应用荧光定量pcr技术对dp3d(dnapolymeraseⅲ,deltasubunit)、ldhd(l-lactatedehydrogenase)、gapdh(glyceraldehyde-3-phosphatedehydrogenase)和grya(gryacds)的表达稳定性进行评估。
在ncbi数据库和geneious软件中获得dp3d、ldhd、gapdh和grya的基因序列,利用primerpremier6软件设计相应引物,并通过blast分析验证引物的特异性。设计引物时所遵循的选择标准是:引物长度为18-25bp,gc含量在50%左右,tm在55℃左右。引物设计结果如表1所示。
表1
将嗜酸乳杆菌cicc6074活化后扩大培养,再经过胃肠液培养,将培养前后的菌液分别取样按现有技术中的方法提取rna后合成cdna。qpcr体系按照北京全式金生物技术有限公司的荧光定量试剂盒,操作步骤对应目录号aq141。将各基因同时扩增,实验使用roche
表2
2.2内参基因的选择结果
4个候选内参基因的稳定性通过
因此,dp3d可以作为实时荧光定量pcr检测的内参基因。
2.3目的基因的引物的设计
在ncbi数据库和geneious软件中分别获得保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌的目的基因luxs的基因序列,参见序列表,利用primerpremier6软件设计相应引物,引物设计结果如表3所示:
表3
2.4目的基因的引物特异性验证
为了验证目的基因引物的特异性,将嗜酸乳杆菌的luxs基因引物加到嗜酸乳杆菌cdna中,荧光定量pcr后的熔融峰为单峰,参见图3a。而将嗜酸乳杆菌的luxs基因引物分别加到保加利亚乳杆菌的cdna和嗜热链球菌的cdna中,熔融峰均为双峰,参见图4e、图4f。由此可见,嗜酸乳杆菌的luxs基因引物具有特异性,只能用于检测嗜酸乳杆菌的luxs基因表达,而不能检测保加利亚乳杆菌的luxs基因表达和嗜热链球菌的luxs基因表达。
同样以此方法验证保加利亚乳杆菌的luxs基因引物的特异性。具体地,参见图3b,保加利亚乳杆菌的luxs基因引物加到保加利亚乳杆菌cdna中,荧光定量pcr后的熔融峰为单峰。参见图4c、图4d,将保加利亚乳杆菌的luxs基因引物分别加到嗜酸乳杆菌的cdna和嗜热链球菌的cdna中,熔融峰均为双峰。由此可见,保加利亚乳杆菌的luxs基因引物具有特异性,只能用于检测保加利亚乳杆菌的luxs基因表达,而不能用于检测嗜酸乳杆菌的luxs基因表达和嗜热链球菌的luxs基因表达。
参见图3c,嗜热链球菌的luxs基因引物加到嗜热链球菌cdna中,荧光定量pcr后的熔融峰为单峰。参见图4a、图4b,将嗜热链球菌的luxs基因引物分别加到保加利亚乳杆菌的cdna和嗜酸乳杆菌的cdna中,熔融峰均为双峰。由此可见,嗜热链球菌的luxs基因引物具有特异性,只能用于检测嗜热链球菌的luxs基因表达,而不能检测保加利亚乳杆菌的luxs基因表达和嗜酸乳杆菌的luxs基因表达。
2.5保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌共培养时luxs基因的表达量检测
将保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌(三种菌按体积比1:1:1)均按1%的接种量接种于mrs培养基中进行共培养(也就是每100mlmrs培养基分别接种1ml保加利亚乳杆菌、1ml嗜热链球菌和1ml嗜酸乳杆菌),37℃培养18h。然后,收集细胞,用magen试剂盒(magenbiotechco.,ltd.,中国广州)提取rna。然后,将提取的rna用试剂盒(transcriptall-inonefirst-strandcdnasynthesissupermixforqpcr,transgenbiotech,beijing,中国北京)反转录,以dp3d(dnapolymeraseⅲ,deltasubunit)为内参基因进行实时聚合酶链反应分析,内参基因的特异性引物上游引物(5‘-gaatgtgggcgttaagcaaacc-3’)、下游引物(5‘-tgcacgttcctcatcactatcg-3’)。嗜酸乳杆菌、保加利亚乳杆菌和嗜热链球菌的luxs基因的特异性引物参见上述表3。
使用纯化的cdna和基因特异性引物与试剂盒(transstarttipgreenqpcrsupermix,transgenbiotech,中国北京)一式三份进行实时荧光定量pcr分析。最后用2-△△ct法对luxs信号分子基因进行分析。
由图5可知,在保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:1条件下,嗜酸乳杆菌中luxs基因的表达量具有显著增加的趋势。保加利亚乳杆菌和嗜热链球菌中luxs基因的表达量也有所增加。
综合图1和5来看,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌接种比例在1:1:1时是高产信号分子的共培养条件。
3、代谢组学分析
本实施例中代谢物的检测方法如下。
冻干细菌样本,具体是将保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌活化后调od600为0.05~1.05,分为3组(只有嗜酸乳杆菌,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌体积比1:1:0,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌体积比1:1:1)分别按照1%体积的接种量接种至mrs肉汤中过夜培养,分别取样离心后弃菌液,用双蒸水冲洗培养液后冻干备用。将3组的细菌样品(10mg)分别悬浮在1.5ml预冷甲醇中,进行3次冻融循环,然后在冰浴中超声15min(周期:脉冲1min,暂停1min)。将等量(10μl)与10μl(20mm)的nem溶液在含有10mm抗坏血酸、10mm乙二胺四乙酸和7%二甲基亚砜的磷酸盐缓冲液(0.1m,ph7.0)中旋转混合1min。加入10μltbbt溶液(二甲基亚砜中0.23m),然后加入含有20mmtcep和1mm抗坏血酸的87.5μl硼酸盐缓冲液(0.2m,ph8.8)。搅拌后静置2min,加入33μl5-aiqc溶液,55℃孵育10min。将混合物降温至室温,加入2μl甲酸,溶液经0.22μm膜过滤后进行超高效液相色谱-质谱联用(uplcms/ms)分析。
uplc-ms/ms由安捷伦1290uplc和安捷伦6470三重四极杆质谱仪组成,该质谱仪配备了电喷雾电离(esi)源(美国安捷伦科技公司)。将带有5-aiqc标签的样品(1μl)分别注入温度设置为50℃的uplc色谱柱(agilentzorbaxrrhdeclipsexdbc18色谱柱,2.1×100mm,1.8μm颗粒)上。水和甲醇含量为0.1%(v/v)的甲酸分别用作两个流动相a和b,流速为0.5ml/min。采用了优化的梯度洗脱方案:1%b(0-2分钟),1-3.8%b(2-4分钟),3.8-14%b(4-7.3分钟),14-22%b(7.3-10.7分钟),22-24%b(10.7-14.7分钟),24-30%b(14.7-16分钟),30-60%b(16-16.3分钟),60-70%b(16.3-17.3分钟),70-95%b(17.3-17.31分钟)和95%b(17.31-20分钟)。对于喷雾器,使用n2在50psi的压力下以正离子模式进行电喷雾电离,流量分别为10l/min和315℃。鞘气温度为350℃,流速为10l/min。毛细管设置为4000v。多反应监测(mrm)已用于定量筛选碎片离子。
数据采集和分析都在masshunter软件(versionb.08.00,agilent,usa)中完成,与标准品比对保留时间和mrm离子对来定性,使用外标法定量,浓度以干重计。
由图6、7、8、9、10和11可知,l-丙氨酸是差异代谢物,并且通过kegg代谢通路可知,l-丙氨酸、l-苏氨酸、l-赖氨酸、l-天冬氨酸、l-谷氨酰胺、l-脯氨酸和l-丝氨酸促进了sah(s-腺苷-同型半胱氨酸)和sam(腺苷甲硫氨酸)的合成。sam经甲基转运变为sah,进一步水解为srh和腺嘌呤。luxs蛋白酶则通过催化作用使srh裂解产生同型半胱氨酸和dpd,dpd是ai-2信号分子的前体分子。促进sah和sam的合成,相当于促进ai-2信号分子的合成。也就是说l-丙氨酸、l-苏氨酸、l-赖氨酸、l-天冬氨酸、l-谷氨酰胺、l-脯氨酸和l-丝氨酸对ai-2信号分子合成具有促进作用。
综上,与只有嗜酸乳杆菌,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:0组相比,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:1组中检测出的l-丙氨酸、sah和sam的浓度最高。即,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌以1:1:1体积配比是有利于ai-2信号分子高产的培养条件。
4、筛选出的l-丙氨酸对ai-2信号分子及发酵乳品质的影响
4.1l-丙氨酸对ai-2信号分子的影响
按照只有嗜酸乳杆菌,
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:0,
只有保加利亚乳杆菌,
嗜热链球菌和嗜酸乳杆菌1:1:1,
嗜酸乳杆菌+添加1%l-丙氨酸,
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:0+1%l-丙氨酸,
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:1+1%l-丙氨酸,
嗜酸乳杆菌+2%l-丙氨酸,
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:0+2%l-丙氨酸,
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:1+2%l-丙氨酸,
嗜酸乳杆菌+3%l-丙氨酸,
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:0+3%l-丙氨酸
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:1+3%l-丙氨进行酸分组,分别进行培养,按照上述信号分子生物检测,实验结果参见图12。
将l-丙氨酸以1%、2%和3%(也就是每100ml培养基分别添加1g、2g、3g丙氨酸)的添加量添加至共培养条件中(保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌体积比1:1:1)培养,并按照luxs基因的检测方法进行检测。实验结果参见图13。
由图12和13可知,当l-丙氨酸以1%的添加量共同培养(保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌体积比1:1:1)时,可以增加共培养体系中信号分子的强度。luxs基因的表达量在15小时时最高。
4.2复合l-丙氨酸发酵乳在发酵过程中的活菌数和ph变化
保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌活化后将od调为1±0.05。巴氏杀菌的纯牛奶中接入6%体积比的发酵剂(发酵剂中的保加利亚乳杆菌、嗜热链球菌、嗜酸乳杆菌分别以1:1:0、1:1:1、1:1:1+1%l-丙氨酸),也就是每100ml牛奶接入6ml发酵剂,将发酵柜温度设置为42℃,6h后成凝固状,再将发酵柜温度调至4℃后熟18h制得成品。在发酵的同时每2小时取样测ph。
制备好的发酵乳取100μl加入到900μl的无菌水中,充分混合均匀后,为了比较准确的计数,按1:10梯度稀释到菌落数在30~300范围内。取100μl均匀涂布于mrs琼脂培养基上。于37℃培养48h后计数。
由图14和15可知,在酸奶发酵过程中,保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:0组的活菌数大于1:1:1组和1:1:1+1%l-丙氨酸组,但是在后熟过程中,1:1:1组的活菌数最多,其次是1:1:1+1%l-丙氨酸组。说明共培养条件在后熟过程中对菌株起到了保护作用,但是l-丙氨酸的添加并未起到保护作用。
4.3复合l-丙氨酸发酵乳的电子舌分析
将制备的发酵乳均质化并倒入用于电子舌的专用的玻璃杯中。使用具有ag/agcl作为参比电极的astreeii电子舌系统,在室温下进行数据采集。在数据采集之前,需要对电子舌系统进行被动激活,校准,诊断和其他步骤,以确保所收集的数据可靠和稳定。酸奶均质化后,将25ml酸奶直接倒入电子舌专用烧杯中进行测试。使用超纯水作为清洁溶剂。选择五个重复并选择三个稳定数据用于分析。
由图16可知,pc1的方差贡献率为79.09%,pc2的方差贡献率为14.38%,累计贡献率为94.95%,可反映样本的大部分信息。不同组发酵乳在两个分量中的位置比较分散,表明发酵乳的分化良好,存在差异性。
4.4复合l-丙氨酸发酵乳的质构分析
使用质构分析仪对酸奶进行测定,主要包括硬度、胶粘性、黏性和内聚性4个指标。硬度指的是探头第一次穿过样品时所受到的压力值。胶粘性主要是模拟人体将半固体样品咀嚼成吞咽时的状态所需要的能量。黏性是指探头与样品接触后离开时为克服两者表面间吸引力所需要的力。样品经第一次压缩变形后,受到第二次压缩时表现出来的抵抗力即样品的内聚性,并设置圆柱形探针:高度70mm,下落65mm,下降速度3mm/s,速度500pps,接触力5g力;返回距离70mm,返回速度10mm/s。每次测试后应清洁量杯和探头。实验结果参见表3。
表3
由表3可知,与保加利亚乳杆菌、嗜热链球菌和嗜酸乳杆菌1:1:0组相比,1:1:1组发酵乳的硬度下降,但胶粘性、黏性和内聚性均有所提高。与1:1:1组相比,添加了l-丙氨酸后发酵乳的内聚性提高,但是硬度、胶粘性和黏性均有所下降。表明共培养条件以及l-丙氨酸的添加都会直接影响发酵乳的品质。
4.5gc-ms测定复合l-丙氨酸发酵乳的风味物质
仪器
7890b-7000c气相色谱-质谱联用仪,美国安捷伦科技有限公司;全自动固相微萃取进样系统,德国gerstel公司;50·30μmdvb/car/pdms固相微萃取头,美国supelco公司;vocol毛细管柱(60m×0.32mm×1.8mm),德国cnw公司
gcms分析-顶空进样
固相微萃取条件:挥发性成分的萃取过程如下:样品首先在60℃下震荡平衡15min,再将预先老化20min的spme萃取头深入到样品顶空处吸附20min,此过程中温度仍为60℃并持续震荡。吸附完成后,将萃取头插入到gc进样口,在210℃温度下解吸7min。
色谱条件
gc条件
进样采用不分流模式,柱温箱起始温度35℃保持3min,以3℃·min-1,升温至40℃保持1min,再以5℃·min-1升温至200℃保持12min。载气为高纯氦气,流速为1.6ml·min-1;进样口温度210℃。
ms条件
ei离子源;电子能量70ev;灯丝发射电流为200μa,离子源温度为230℃;扫描质量范围,50~500u。
将获得的结果用gc-ms工作站自带nist1.1标准库进行检索,确定化学成分,用面积归一法对样品中各组分进行相对定量。实验结果参见表4。
表4
由表4可知,在1:1:0组中检测到24种风味化合物,在1:1:1组中检测到18种,在1:1:1+1%l-丙氨酸组中检测到24种。1:1:0组发酵乳中的主要香味成分是己酸、丁酸和d-柠檬烯,1:1:1组发酵乳中的主要香味成分是d-柠檬烯、二甲基砜和戊酸,1:1:1+1%l-丙氨酸组发酵乳中的主要香味成分是苯甲醇-α-[1-(乙基甲基氨基)乙基]、环戊酮2-(1-甲基丙基)、对异丙苯、苯甲醛和9,11-十八碳二烯酸甲酯,即1:1:1+1%l-丙氨酸组发酵乳中的主要香味成分的种类更多。不同组间风味物质种类及含量的差异可能是嗜酸乳杆菌和l-丙氨酸的添加影响了乳酸菌的碳水化合物代谢,导致发酵乳中与风味相关的蛋白质合成有差异。
综上,添加l-丙氨酸对发酵乳品质的影响主要是:添加了l-丙氨酸后发酵乳的内聚性提高,同时香味成分的种类较多。
序列表
<110>宁波大学
<120>一种复合发酵菌剂及其在制备发酵乳中的应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>480
<212>dna
<213>lactobacillusbulgaricus
<400>1
atggctaaagtagaaagttttgaattggaccacactaaagttaaggcaccttacgtccgc60
ctgatcaccgttgaagaaggccctaagggcgacaagatctccaacttcgacctccgcctg120
gtgcagcctaacgaaaacgccatcccaactggcggcctgcacaccattgaacacctcctg180
gccagcctcctgcgcgaccgcttagacggcgtcatcgactgctccccattcggctgccgg240
accggtttccacttgattacctggggtgaacacagcaccactgaagtagccaaggccctg300
cgcgactccctcaaggcaatcagagacgacatcacttgggaagacgtgcctggtaccacc360
atcgaaagctgcggcaactaccgcgaccactccctcttcagcgcccaggaatggtgcaac420
gatatcttgaagaagggcatcagcgacgacccatttgaccgccacgtggttgaagactag480
<210>2
<211>483
<212>dna
<213>streptococcusthermophiles
<400>2
atgccaaaagacgttactgttgaaagttttgaacttgatcacaccattgtaaaagcacct60
tatgtccgtcttatttcagaggaagttggacctaaaggagatatcatcacaaactttgat120
atccgtttgattcaacctaatgaaaatagtattgatacaggtggtcttcatactatcgaa180
cacctactcgctaaactgatccgtcaacgtatcgatggccttattgattgctcaccattt240
ggttgccgtacaggtttccatatgatcatgtggggaaaacaagatcctacggaaattgcc300
aaagttatcaaatctagtcttgaagctattgcaaacgaaattacttgggaagatgttcca360
ggaactactattgaatcttgtggtaactataaggatcacagccttcattcagctaaggaa420
tgggctaaacttatccttgaacaaggcatctcagaccaagccttcgaacgtcataccgtc480
taa483
<210>3
<211>474
<212>dna
<213>lactobacillusacidophilus
<400>3
atggcaaaagttgaaagttttacattagaccacactaaagttaaggcaccttacgttcgt60
ttaattactgttgaagaaggtcctaaaggcgacaagatttctaactatgacttacgttta120
gttcaaccgaacgaaaatgcaattcctaccggcggattgcatactattgaacacttactt180
gccagcttacttcgtgaccgtcttgatggtgtaatcgattgttcaccatttggttgccga240
acaggattccacctaatcgtttggggtgaacattcaactactgaagttgctaaagcattg300
aagtcttcattagaggaaattcgtgacacaattacttgggaagatgtaccaggtacaact360
attaagacttgtggtaactaccgtgatcactcattgttcaccgcaaaagaatggtgtcgt420
gatattcttgaaaaaggaattagtgatgacccattcgaaagaaatgtgatttaa474
- 还没有人留言评论。精彩留言会获得点赞!