一种菊粉益生菌微胶囊的制备方法
1.本发明涉及食品生物技术领域,特别涉及一种益生菌微胶囊的制备方法。
背景技术:
2.益生菌是具有生物活性的有益微生物,在服用足够数量后会改善宿主肠道的微生态平衡,进而对宿主身体健康产生有益影响。近几年来,益生菌产业快速发展,现已应用于医药、食品、保健品等多个领域。在医药领域,益生菌主要用于治疗腹泻、便秘和阴道炎等疾病;在食品行业,益生菌被广泛应用于发酵风味食品,如传统的酸奶、乳酸菌饮料、泡菜、食醋等;在保健食品行业,益生菌被制成片剂、胶囊剂、颗粒剂、粉剂等以期达到多种保健功能。
3.菊粉是植物中储备性多糖,主要来源于植物,在自然界中分布十分广泛,已发现有36000多种。菊粉是十分理想的功能性配料,是一种天然的水溶性膳食纤维,几乎不能被胃酸水解和消化,只有在结肠被有益微生物利用,从而改善肠道微生态环境,是良好的益生元。有研究表明,双歧杆菌的增殖程度取决于人体大肠中初始双歧杆菌的数量,当初始双歧杆菌数量减少时,使用菊粉后增殖效果明显,当初始双歧杆菌的数量多时,使用菊粉后效果并不明显。其次,摄入菊粉后能增强胃肠道蠕动,提高肠胃功能,增加消化和食欲,提高机体免疫力。此外,菊粉还有降低血糖、促进矿物质吸收、治疗肥胖症等功能。
4.海藻酸钠是一种天然高分子生物材料,通常从褐藻类的海带或马尾藻中提取,能够和多数多价阳离子发生交联反应,形成凝胶或发生沉淀反应。海藻酸盐不仅具有良好的生物相容性和降解性,还具备优异的成凝胶性和成膜性,目前已被美国食品药品管理局批准使用。由于海藻酸盐是一种无毒、无刺激性、生物相容性良好的生物材料,因此人们制备基于海藻酸盐的生物微胶囊,将其作为植入人体的免疫隔离装置,在人体内发挥治疗作用。壳聚糖是一种价格便宜并且性质优良的天然高分子材料,其具有良好的生物相容性、可降解性和成膜性,这些性质使其成为制备微胶囊良好的壁材,同时海藻酸钠和壳聚糖一同作为壁材可以起到控制芯材释放的作用。
5.益生菌要想发挥其健康作用、产生益生功能,在被人体摄入时必须保持足够的生物活性,摄入的益生菌活细胞数量需要达到106cfu/g,世界食品组织提出的官方标准是最低106~107cfu/g。益生菌中使用最广泛的为乳杆菌类、链球菌类和双歧杆菌类等,它们在保存中极易受到外界环境的影响而失活,如何保持菌种活性、延长保质期,成为此类产品公认的技术难题。
技术实现要素:
6.本发明的目的在于提供一种菊粉益生菌微胶囊的制备方法,本发明的制备工艺简单,成本低廉,材料广泛,易于储存及运输,菊粉益生菌微胶囊具有成膜性能好、稳定性能强、益生菌生存率高,缓释效能好等优点,适用于多种益生菌的包埋和缓控释放,具有良好的应用前景。
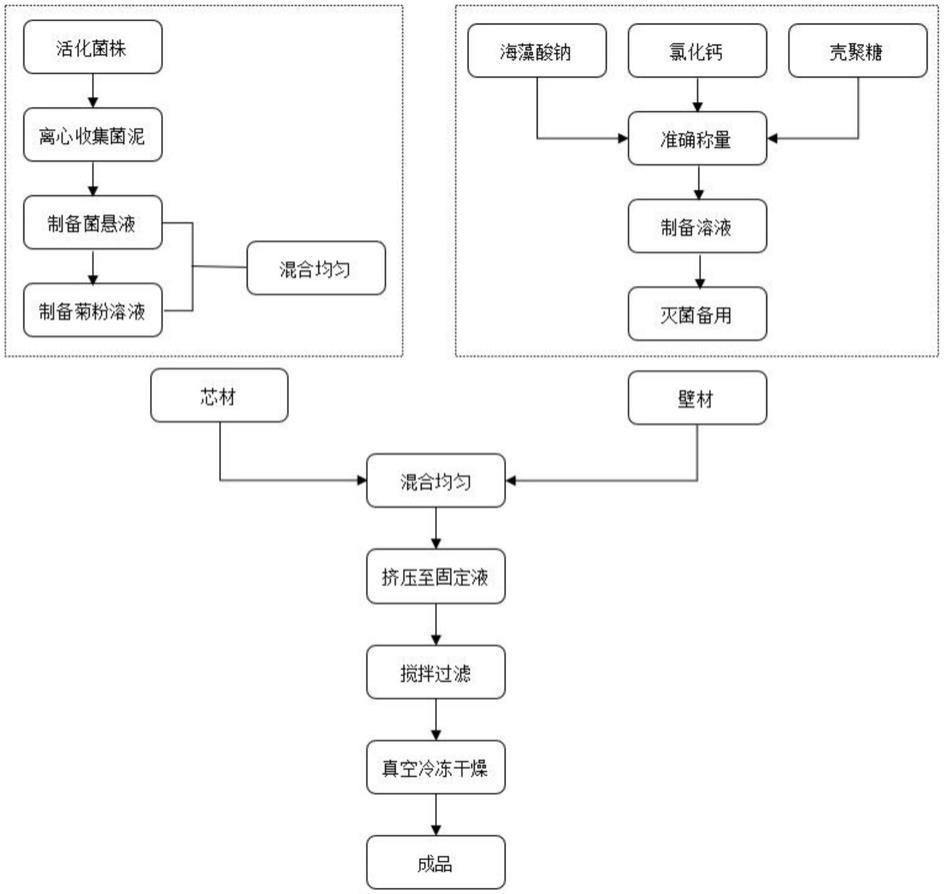
7.为此,本发明提供了一种菊粉益生菌微胶囊的制备方法,包括微胶囊壁材和微胶囊芯材,所述微胶囊壁由海藻酸钠、氯化钙和壳聚糖制备而成,所述微胶囊芯材由菊粉和益生菌制备而成。
8.一种菊粉益生菌微胶囊的制备方法,包括以下步骤:
9.(1)制备活化益生菌菌种:将一种或多种益生菌菌粉接种至121
±
1℃灭菌15-20min冷却后的mrs液体培养基中,在37℃恒温培养18-20h,进行初次活化;
10.(2)按质量浓度3%-5%的比例将初次活化的益生菌培养液接入121
±
1℃灭菌15-20min冷却后的mrs液体培养基,在37℃恒温培养18-20h,进行二次活化;
11.(3)按质量浓度3%的比例将二次活化的益生菌培养液接入mrs液体培养基,在37℃恒温培养14-18h,达到对数期后,4000r/min离心并用生理盐水洗涤,收集浓缩菌液;
12.(4)配制菊粉溶液:将菊粉溶解于蒸馏水中,混合均匀,经121
±
1℃灭菌15-20min冷却备用;
13.(5)配制海藻酸钠溶液:将海藻酸钠溶于蒸馏水中,混合均匀,经121
±
1℃灭菌15-20min冷却备用;
14.(6)配制芯材混合液:将步骤(3)浓缩菌液和步骤(4)菊粉溶液混合,得到菊粉益生菌混合液,加入到步骤(5)海藻酸钠溶液中混合均匀得到芯材混合液;
15.(7)配制氯化钙溶液:将氯化钙溶于蒸馏水中,混合均匀后,用一次性针式过滤器进行过滤除菌,得到无菌氯化钙溶液;
16.(8)配制壳聚糖溶液:向壳聚糖粉末中加入浓度为1%的冰乙酸,混合均匀后,调节ph至4.5-5,经121
±
1℃灭菌15-20min冷却备用;
17.(9)将步骤(6)制备的芯材混合液置于注射容器中,挤压滴入步骤(7)氯化钙溶液中,进行成膜反应形成海藻酸钙凝胶珠,用磁力搅拌器200r/min转速搅拌,30-90min后,过滤得海藻酸钙凝胶珠,用蒸馏水反复冲洗2-3次,洗除未反应的氯化钙;
18.(4)将步骤(4)制备的海藻酸钙凝胶珠在壳聚糖溶液中,进行成膜反应形成胶囊外膜,用磁力搅拌器200r/min转速搅拌,30-90min后,过滤得双层微胶囊,用蒸馏水反复冲洗2-3次,洗除未反应的壳聚糖,得湿微胶囊。将湿微胶囊置于-80℃的低温冰箱中预冻后,置于真空冷冻干燥机中,-80℃冷冻24h干燥,制得微胶囊粉末。
19.任选的,所述步骤(1)中,所述益生菌包含乳杆菌类、链球菌类、双歧杆菌类和其他益生菌中的一种或其任意混合物。
20.优选的,所述步骤(3)中,浓缩菌液的浓度≥108cfu/ml。
21.优选的,所述步骤(4)中,菊粉溶液质量分数为2%-2.5%。
22.优选的,所述步骤(5)中,海藻酸钠溶液质量分数为2%-2.5%。
23.优选的,所述步骤(6)中,浓缩菌液和菊粉溶液体积比为1:1,浓缩菌液和海藻酸钠质量比为1:3。
24.优选的,所述步骤(7)中,氯化钙溶液质量分数为2.5%-3%,一次性针式过滤器规格为:mce滤膜,0.22μm。
25.优选的,所述步骤(8)中,壳聚糖溶液质量分数为2%-2.5%。
26.优选的,所述步骤(9)中,注射容器针头内径0.5mm。
27.所述微胶囊的制备方法制备得到的菊粉益生菌微胶囊,直径为4-8mm,包埋率≥
75%,活菌数为10
6-107cfu/g;经冷冻干燥后益生菌存活率可达45%-60%。
附图说明
28.附图:本发明的工艺流程图。
具体实施方式
29.下面结合实施例1和实施例2,对本发明作进一步地详细说明,但本发明的实施方式不限于此。
30.实施例1
31.本实施例1为一种添加菊粉芯材的鼠李糖乳杆菌微胶囊的制备方法,包括以下步骤:
32.(1)菌株的活化:将鼠李糖乳杆菌菌粉接种至121
±
1℃灭菌15-20min冷却后的mrs液体培养基中,在37℃恒温培养18-20h,进行初次活化。
33.(2)扩大培养:按质量浓度3%-5%的比例将初次活化的鼠李糖乳杆菌培养液接入121
±
1℃灭菌15-20min冷却后的mrs液体培养基,在37℃恒温培养18-20h,进行二次活化,得鼠李糖乳杆菌培养物。
34.(3)制备浓缩菌液:按质量浓度3%的比例将二次活化的鼠李糖乳杆菌培养液接入mrs液体培养基,在37℃恒温培养14-18h,达到对数期后,4000r/min离心并用0.85%生理盐水洗涤,收集浓缩菌液;经稀释涂布计数得到活菌菌密度为1.7
×
108cfu/ml以上。
35.(4)芯材的制备:将经121
±
1℃灭菌15-20min冷却后的2.5%的菊粉溶液和鼠李糖乳杆菌菌悬液以1:1(体积)的比例混合。
36.(5)壁材的制备:配制质量分数为2%的海藻酸钠溶液、质量分数为2%的壳聚糖溶液(用1%的冰乙酸溶液溶解)经121
±
1℃灭菌15-20min冷却备用,配制质量分数为3%的氯化钙溶液,用一次性针式过滤器(mce膜,0.22μm,直径为13mm)进行过滤除菌,得到无菌氯化钙溶液。
37.(6)微胶囊的制备:
①
将芯材与步骤(5)海藻酸钠溶液按照体积比1:75比例混合均匀,得到芯材混合液;
②
将芯材混合液置于50ml注射容器中,挤压滴入步骤(5)氯化钙溶液中,进行成膜反应形成海藻酸钙凝胶珠,用磁力搅拌器200r/min转速搅拌,30-90min后,滤纸过滤得海藻酸钙凝胶珠,用蒸馏水反复冲洗2-3次,洗除未反应的氯化钙;
③
将制备的海藻酸钙凝胶珠放入步骤(5)壳聚糖溶液中,进行成膜反应形成胶囊外膜,用磁力搅拌器200r/min转速搅拌,30-90min后,用无菌脱脂棉纱布过滤得微胶囊,用蒸馏水反复冲洗2-3次,洗除未反应的壳聚糖,得湿微胶囊。
38.(7)冷冻干燥:将湿微胶囊置于-80℃的低温冰箱中预冻后,置于真空冷冻干燥机中,-80℃冷冻24h干燥,制得平均直径为4.5mm的微胶囊。
39.采用本实施例1的方法制备得到的益生菌微胶囊进行如下所述的性能测定。
40.(1)包埋产率测定:称取1g湿胶囊于烧杯中,加入9mlph值为7.25的解囊液,37℃、180r/min振荡2h以确保菌体完全崩解。解囊完成后从中移取进行梯度稀释,采用琼脂培养
基进行活菌计数,以未包埋的菌液作为对照。结果表明,鼠李糖乳杆菌微胶囊包埋率为76.68%。
41.(2)微胶囊人工胃液耐受性测定:称取本发明冻干微胶囊1g,将其分散于9ml、ph为1.5的人工模拟胃液中,于37℃恒温贮藏,分别于1h、2h和3h后取出,用0.85%生理盐水冲洗,加入9ml解囊液中进行解囊,解囊完成后从中移取进行梯度稀释,采用琼脂培养基进行活菌计数。以未包埋的菌液作为对照。结果表明微胶囊中的鼠李糖乳杆菌在人工胃液中的存活率随着处理时间的延长而逐渐降低,在人工胃液中处理3h后微胶囊中鼠李糖乳杆菌的菌体存活率仍可达到75%左右;而对于没有经过微胶囊化的鼠李糖乳杆菌,在人工胃液中处理相同时间后,菌体存活率仅有35%。
42.(3)微胶囊肠液溶解性测定:将经过人工胃液处理3h后未溶解的微胶囊转移至人工肠液中,37℃、180r/min振荡2h,每隔20min测定其在600nm波长处的透光率来分析鼠李糖乳杆菌在人工肠液中的释放情况。结果表明微胶囊在人工肠液中处理90min后基本崩解完全。
43.(4)抗真空冷冻性测定:分别称取在冻干前后的1g本发明益生菌微胶囊加入到9mlph为7.25解囊液中,在温度37℃、180r/min条件下震荡2h以确保菌体完全崩解,然后进行菌落计数。结果表明,鼠李糖乳杆菌微胶囊经冷冻干燥后存活率较高,可达53%以上。
44.实施例2
45.本实施例2为一种添加菊粉芯材的双岐杆菌微胶囊的制备方法,包括以下步骤:
46.(1)菌株的活化:将双岐杆菌菌粉接种至121
±
1℃灭菌15-20min冷却后的mrs液体培养基中,在37℃恒温培养18-20h,进行初次活化。
47.(2)扩大培养:按质量浓度3%-5%的比例将初次活化的双岐杆菌培养液接入121
±
1℃灭菌15-20min冷却后的mrs液体培养基,在37℃恒温培养18-20h,进行二次活化,得双岐杆菌培养物。
48.(3)制备浓缩菌液:按质量浓度3%的比例将二次活化的双岐杆菌培养液接入mrs液体培养基,在37℃恒温培养14-18h,达到对数期后,4000r/min离心并用0.85%生理盐水洗涤,收集浓缩菌液;经稀释涂布计数得到活菌菌密度为8.6
×
108cfu/ml以上。
49.(4)芯材的制备:将经121
±
1℃灭菌15-20min冷却后的2.5%的菊粉溶液和双岐杆菌菌悬液以1:1(体积)的比例混合。
50.(5)壁材的制备:配制质量分数为2.5%的海藻酸钠溶液、质量分数为2%的壳聚糖溶液(用1%的冰乙酸溶液溶解)经121
±
1℃灭菌15-20min冷却备用,配制质量分数为3%的氯化钙溶液,用一次性针式过滤器(mce膜,0.22μm,直径为13mm)进行过滤除菌,得到无菌氯化钙溶液。
51.(6)微胶囊的制备:
①
将芯材与步骤(5)海藻酸钠溶液按照体积比1:70比例混合均匀,得到芯材混合液;
②
将芯材混合液置于50ml注射容器中,挤压滴入步骤(5)氯化钙溶液中,进行成膜反应形成海藻酸钙凝胶珠,用磁力搅拌器200r/min转速搅拌,30-90min后,滤纸过滤得海藻酸钙凝胶珠,用蒸馏水反复冲洗2-3次,洗除未反应的氯化钙;
③
将制备的海藻酸钙凝胶珠放入步骤(5)壳聚糖溶液中,进行成膜反应形成胶囊
外膜,用磁力搅拌器200r/min转速搅拌,30-90min后,用无菌脱脂棉纱布过滤得微胶囊,用蒸馏水反复冲洗2-3次,洗除未反应的壳聚糖,得湿微胶囊。
52.(7)冷冻干燥:将湿微胶囊置于-80℃的低温冰箱中预冻后,置于真空冷冻干燥机中,-80℃冷冻24h干燥,制得平均直径为5mm的微胶囊。
53.采用本实施例2的方法制备得到的益生菌微胶囊进行如下所述的性能测定。
54.(1)包埋产率测定:称取1g湿胶囊于烧杯中,加入9mlph值为7.25的解囊液,37℃、180r/min振荡2h以确保菌体完全崩解。解囊完成后从中移取进行梯度稀释,采用琼脂培养基进行活菌计数,以未包埋的菌液作为对照。结果表明,双岐杆菌微胶囊包埋率为79.35%。
55.(2)微胶囊人工胃液耐受性测定:称取本发明冻干微胶囊1g,将其分散于9ml、ph为1.5的人工模拟胃液中,于37℃恒温贮藏,分别于1h、2h和3h后取出,用0.85%生理盐水冲洗,加入9ml解囊液中进行解囊,解囊完成后从中移取进行梯度稀释,采用琼脂培养基进行活菌计数。以未包埋的菌液作为对照。结果表明微胶囊中的双岐杆菌在人工胃液中的存活率随着处理时间的延长而逐渐降低,在人工胃液中处理3h后微胶囊中鼠李糖乳杆菌的菌体存活率仍可达到77%左右。而对于没有经过微胶囊化的鼠李糖乳杆菌,在人工胃液中处理相同时间后,菌体存活率仅有36.5%。
56.(3)微胶囊肠液溶解性测定:将经过人工胃液处理3h后未溶解的微胶囊转移至人工肠液中,37℃、180r/min振荡2h,每隔20min测定其在600nm波长处的透光率来分析鼠李糖乳杆菌在人工肠液中的释放情况。结果表明微胶囊在人工肠液中处理100min后基本崩解完全。
57.(4)抗真空冷冻性测定:分别称取在冻干前后1g本发明益生菌微胶囊加入到9mlph为7.25解囊液中,在温度37℃、180r/min条件下震荡2h以确保菌体完全崩解,然后进行菌落计数。结果表明,鼠李糖乳杆菌微胶囊经冷冻干燥后存活率较高,可达57.5%以上。
58.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述实施例的限制,其他的任何未背离本发明的精神实质与原理下的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1