猪笼草消化液蛋白酶降低乳清蛋白致敏性的应用及方法与流程
1.本发明属于生物学和免疫学领域,特别涉及生物学酶解技术降低牛乳中乳清蛋白致敏性的方法。
技术背景
2.牛乳蛋白过敏是一种由牛乳中的蛋白质引起的不良免疫反应,会使患者产生湿疹、腹泻和胃肠出血等症状,严重者甚至导致休克和死亡;最新的流行病学调查显示,我国2岁以下婴幼儿过敏的比例约为2.69%,常用的降低牛乳致敏性的方法包括物理法(加热处理、加压处理、辐照处理、超声波处理)、化学法(糖基化、其他化学修饰)和生物法(酶解、酶交联、发酵);酶解技术在致敏性降低的同时又能极大地保证产品感官品质和营养价值;甚至在酶解过程中产生了一些功能性多肽;并且其工艺简单、条件温和、安全性高、技术成熟;是目前使用最为普遍的方法。
3.酶解法降低乳清蛋白致敏性的首要问题一般是酶种类的选择;目前常用的酶有植物源蛋白酶(菠萝蛋白酶、木瓜蛋白酶和无花果蛋白酶)、动物源蛋白酶(胃蛋白酶、胰蛋白酶和糜蛋白酶)和微生物源蛋白酶(碱性蛋白酶和枯草杆菌蛋白酶);微生物源蛋白酶普遍存在的问题是安全性有待进一步确认,有些国家甚至不将其用于人类食品;动物源的蛋白酶由于动物生长周期长、动物屠宰受限制以及动物疾病传播等因素,成本高效率低;相比之下,植物源蛋白酶安全性高、环保性强且资源丰富,适合广泛开发并应用于酶解牛乳乳清蛋白,以期降低其致敏性。
4.猪笼草作为一种常见的食虫植物,首先其消化液会储存大量由捕虫囊分泌并释放的蛋白酶,且消化液中的共生菌也会分泌一些促进其中昆虫降解的酶类物质,其次没有关于用猪笼草消化液中的蛋白酶降低牛乳致敏性的研究;所以,利用猪笼草消化液中的蛋白酶来开发低致敏乳清蛋白具有广阔的研究空间和现实的研究意义。
技术实现要素:
5.本发明的目的是利用猪笼草消化液中的新型植物源蛋白酶,分别酶解分离乳清蛋白、浓缩乳清蛋白,对其酶解后产物进行分子量和igg免疫反应性评估,实现降低不同牛乳乳清蛋白致敏性的技术。
6.本发明是通过以下技术方案实现的。
7.本发明提出了猪笼草消化液蛋白酶降低乳清蛋白致敏性的应用及方法,包括酶解条件初探和致敏性评估。
8.本发明中猪笼草消化液蛋白酶在降低乳清蛋白致敏性中的应用,乳清致敏原为牛乳乳清蛋白中α-乳白蛋白或β-乳球蛋白;
9.优选的,猪笼草消化液蛋白酶与乳清蛋白发生酶解反应;酶解条件为:猪笼草消化液在乳清蛋白溶液中的体积分数为5
±
0.1%,ph为5
±
0.5或11
±
0.5,反应时间为2
±
0.1h,温度为50
±
5℃。
10.本发明中猪笼草消化液蛋白酶降低乳清蛋白致敏性的应用及方法,包括以下步骤:
11.s1:乳清粉溶液的制备:分别称取分离乳清蛋白粉或浓缩乳清蛋白粉,以蒸馏水配成质量分数为5
±
0.5%的乳清蛋白溶液,分别吸取乳清蛋白溶液20ml于离心管中;
12.s2:猪笼草消化液的制备:从猪笼草植物上选取中等生长时间的捕虫囊,倾倒并混合其中的消化液,通过静置沉降其中的杂质,取上清;
13.s3:分离乳清蛋白溶液或浓缩乳清蛋白溶液的酶解:吸取s2中猪笼草消化液放入s1存放乳清蛋白溶液的离心管内,消化液体积分数为5
±
0.1%,以获得不同条件下酶解产物。
14.优选的,在s3中酶解溶液ph为5
±
0.5或11
±
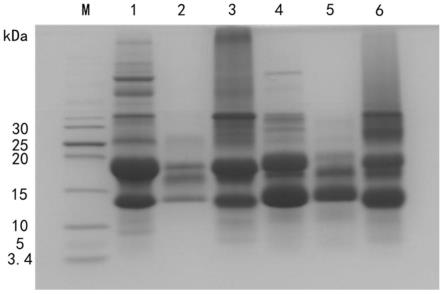
0.5,酶解时间为2
±
0.1h,温度设置为50
±
5℃。
15.本发明采用酶解技术,对不同乳清蛋白中蛋白进行特异性切割,将过敏原蛋白切割成小分子肽段,断裂表位中的肽键或破坏表位的结构。
16.本发明有以下优点:源于猪笼草消化液中的新型植物蛋白酶能够破坏不同种类乳清蛋白中的表位;致敏性评估首次系统评价酶解降低乳清致敏性的效果,目标准确,评价致敏性全面,确保酶解技术的精准实施。
附图说明
17.图1为不同ph条件下猪笼草消化液中蛋白酶对wpi和wpc的酶解效果图(注:m为未预染小分子标准蛋白marker;泳道1为分离乳清蛋白溶液(wpi);泳道2为ph5
±
0.5条件下猪笼草消化液对wpi的酶解液(wpi-5);泳道3为ph11
±
0.5条件下猪笼草消化液对wpi的酶解液(wpi-11);泳道4为浓缩乳清蛋白溶液(wpc);泳道5为ph5
±
0.5条件下猪笼草消化液对wpc的酶解液(wpc-5);泳道6为ph11
±
0.5条件下猪笼草消化液对wpc的酶解液(wpc-11))。
18.图2为酶解wpc-5、wpi-5和未酶解wpi、wpc对兔抗α-乳白蛋白igg的结合能力变化图。
19.图3为酶解wpc-5、wpi-5和未酶解wpi、wpc对兔抗β-乳球蛋白igg的结合能力变化图。
20.图4为酶解wpc-5、wpi-5和未酶解wpi、wpc中不同肽段对兔抗α-乳白蛋白igg的结合能力图(注:从左到右样品依次为wpi、wpi-5、wpc、wpc-5;左边为western blot相应的电泳对照,右边为western blot结果)。
21.图5为酶解wpc-5、wpi-5和未酶解wpi、wpc中不同肽段对兔抗β-乳球蛋白igg的结合能力图(注:从左到右样品依次为wpi、wpi-5、wpc、wpc-5;左边为western blot相应的电泳对照,右边为western blot结果)。
22.具体实施方式及结果
23.本发明的目的是利用猪笼草消化液中的新型植物源蛋白酶,分别酶解分离乳清蛋白(wpi)、浓缩乳清蛋白(wpc),对其酶解后产物进行分子量和igg免疫反应性评估,实现降低不同牛乳乳清蛋白致敏性的技术。
24.本发明通过以下实施例进一步说明,但本发明并不受其限制。
25.实施例1。
26.选取猪笼草消化液对wpi进行酶解,通过tricine-sds-page、间接竞争elisa和western blot等技术手段对酶解产物进行系统性评价。
27.具体实施过程包括如下步骤。
28.1.wpi酶解产物制备方案:
29.(1)乳清粉溶液的制备:称取分离乳清蛋白粉,以蒸馏水配成质量分数为5
±
0.5%的wpi溶液,吸取该溶液20ml于离心管中;
30.(2)猪笼草消化液的制备:从猪笼草植物上选取中等生长时间的捕虫囊,倾倒并混合其中的消化液,通过静置沉降其中的杂质,取上清;
31.(3)wpi的酶解:吸取步骤2中猪笼草消化液放入步骤1中存放wpi溶液的离心管内,猪笼草消化液体积分数为5
±
0.1%。
32.通过选取步骤3中的两份wpi的酶解溶液,ph分别为5
±
0.5或11
±
0.5,时间为2
±
0.1h,温度为50
±
5℃,以获得wpi在不同条件下的酶解产物。
33.2.tricine-sds-page分析:对wpi溶液、ph5
±
0.5或ph11
±
0.5条件下的酶解样品进行对比,如图1:
34.其中,wpi溶液在10~15kda和15~20kda分子量范围处有较浓的条带,分别对应于wpi中的主要过敏原α-乳白蛋白(14.2kda)和β-乳球蛋白(18.3kda)。
35.在酶解条件为ph5
±
0.5的情况下,20kda以上的肽段几乎全部被水解掉,在15~20kda的分子量区间段,虽然有部分残留,但是条带颜色均很浅,可推测牛乳主要过敏原β-乳球蛋白大部分被破坏;在10~15kda的分子量区间段只出现了一条颜色较淡的小条带,可推测牛乳主要过敏原α-乳白蛋白也很大程度上被破坏。
36.在酶解条件为ph11
±
0.5的情况下,30kda以上的区间出现了条带加深的现象,原因可能是碱性条件下蛋白彼此之间或蛋白和某些亚基之间发生交联;但14~18kda左右的肽段几乎没有被降解,因此可能对α-乳白蛋白和β-乳球蛋白没有太大的降解作用;基于此,免疫反应性的检测均以ph5
±
0.5下酶解产物的igg结合能力为检测对象。
37.3.elisa检测:通过间接竞争elisa方法来评价酶解产物的igg结合能力,如图2和图3:
38.其中,分别采用兔抗α-乳白蛋白和兔抗β-乳球蛋白的多克隆抗体igg进行检测,经过酶解后wpi的α-乳白蛋白和β-乳球蛋白的igg结合能力均有一定程度的降低;且β-乳球蛋白的igg结合能力较α-乳白蛋白下降更明显,通过对图2和图3的结果进行拟合,得到猪笼草消化液中的蛋白酶处理wpi的ic50值分别如表1所示;
39.表1wpi及其酶解产物对兔抗α-乳白蛋白和β-乳球蛋白igg结合能力的ic50拟合值
[0040][0041]
经过酶解,wpi对兔抗α-乳白蛋白igg的结合能力降低到未酶解时的12.23倍,对兔抗β-乳球蛋白igg的结合能力降低到未酶解时的221.66倍。
[0042]
4.western blot检测:分别采用兔抗α-乳白蛋白和兔抗β-乳球蛋白的多克隆抗体igg,通过western blot反映酶解后不同分子量的肽段的免疫反应性;
[0043]
经过猪笼草消化液中酶作用的wpi的较未酶解样品显色区域少,说明酶解产生的不同肽段的igg结合能力较弱甚至没有,结果如图4和图5所示。
[0044]
实施例2。
[0045]
选取猪笼草消化液对wpc进行酶解。
[0046]
1.wpc酶解产物制备方案:
[0047]
(1)乳清粉溶液的制备:称取浓缩乳清蛋白粉,以蒸馏水配成质量分数为5
±
0.5%的wpc溶液,吸取该溶液20ml于离心管中;
[0048]
(2)猪笼草消化液的制备:从猪笼草植物上选取中等生长时间的捕虫囊,倾倒并混合其中的消化液,通过静置沉降其中的杂质,取上清;
[0049]
(3)wpc的酶解:吸取步骤2中猪笼草消化液放入步骤存放wpc溶液的离心管内,猪笼草消化液体积分数为5
±
0.1%。
[0050]
通过选取步骤3的两份wpc的酶解溶液,ph分别为5
±
0.5或和11
±
0.5,时间为2
±
0.1h,温度为50
±
5℃,以获得wpc在不同条件下的酶解产物。
[0051]
2.tricine-sds-page分析:对wpc溶液、ph5
±
0.5或和ph11
±
0.5条件下的酶解样品进行对比,如图1:
[0052]
其中,wpc溶液在10~15kda和15~20kda分子量范围处有较浓的条带,分别对应于wpc中的主要过敏原α-乳白蛋白(14.2kda)和β-乳球蛋白(18.3kda)。
[0053]
在酶解条件为ph5
±
0.5的情况下,20kda以上的肽段几乎全部被水解掉,在15~20kda的分子量区间段,虽然有部分残留,但是大量蛋白已经被酶解;其中残留肽段位于靠近15kda的部分,可推测牛乳主要过敏原β-乳球蛋白可能会被部分破坏掉;虽然在10~15kda的分子量区间段出现了较浓的蛋白条带,但相较于wpc溶液,该区域条带面积明显减小,可推测牛乳主要过敏原α-乳白蛋白在一定程度上被破坏。
[0054]
在酶解条件为ph11
±
0.5的情况下,25kda以上的区间出现了条带颜色加深和出现新条带的现象,原因可能是碱性条件下蛋白彼此之间或蛋白和某些亚基之间发生交联;14~18kda左右的肽段几乎没有被降解,因此可能对α-乳白蛋白和β-乳球蛋白没有太大的降解作用;基于此,免疫反应性的检测均以ph5
±
0.5下酶解产物的igg结合能力为检测对象
[0055]
3.elisa检测:通过间接竞争elisa方法来评价酶解产物的igg结合能力,如图2和图3;
[0056]
其中,分别采用兔抗α-乳白蛋白和兔抗β-乳球蛋白的多克隆抗体igg进行检测,经过酶解后wpc的α-乳白蛋白和β-乳球蛋白的igg结合能力均有一定程度的降低;且β-乳球蛋白的igg结合能力较α-乳白蛋白下降更明显;
[0057]
通过对图2和图3的结果进行拟合,得到猪笼草消化液中的蛋白酶处理wpc的ic50值分别如表2所示;
[0058]
表2wpc及其酶解产物对兔抗α-乳白蛋白和β-乳球蛋白igg结合能力的ic50拟合值
[0059][0060]
经过酶解,wpc对兔抗α-乳白蛋白igg的结合能力降低到未酶解时的3.51倍,wpc对
兔抗β-乳球蛋白igg的结合能力降低到未酶解时的58.81倍。
[0061]
western blot检测:分别采用兔抗α-乳白蛋白和兔抗β-乳球蛋白的多克隆抗体igg,通过western blot反映酶解后不同分子量的肽段的免疫反应性;
[0062]
经过猪笼草消化液中酶作用的wpc的较未酶解样品显色区域少,说明酶解产生的不同肽段的igg结合能力较弱甚至没有,结果如图4和图5所示。
[0063]
乳清蛋白在食品工业中应用广泛,主要包括wpi和wpc等不同种类;二者的主要区别是在于制作工艺、蛋白含量和其他物质含量的不同;成本较低的wpc可以凭借其功能特性应用于冷冻食品、焙烤食品、发酵乳制品和肉类食品,在其生产过程中改善感官品质和理化性质;wpi凭借其营养价值的优势,可以用于健身人群补充蛋白;经过猪笼草消化液中所含酶的作用,wpi和wpc都能被酶解,致敏性均显著降低;其中,wpi中过敏原蛋白的破坏程度较wpc稍微高一些,对igg结合能力降低得也多一些,但其对wpc致敏性降低的影响也是显而易见的。
[0064]
基于此,本发明利用猪笼草消化液中所含的蛋白酶对wpi和wpc酶解,并成功实现二者致敏性降低,应用价值广阔。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1