无蔗糖的发酵乳及其制备方法与流程
1.本发明属于生物发酵技术领域,具体地,本发明涉及无蔗糖的发酵乳及其制备方法。
背景技术:
2.羊乳是继牛乳、水牛乳之后的第三大乳类资源,被称为“奶中之王”,具有风味特别、营养丰富、功能独特、不含过敏原(牛乳中的乳糖)、易于消化吸收等特点。羊乳是目前发现的最接近人乳的一类乳源,具有极高的营养价值和有益人体健康功效。目前,国际上对于羊乳研究开发的产品较多,而国内主要为羊奶粉为主。以羊乳为原料生产酸羊乳,是目前羊乳制品发展的一个重要方向。酸羊乳是以鲜羊乳或羊乳粉为原料,经均质、灭菌、接入乳酸菌后,经生物发酵而制成的一种含活性乳酸菌的发酵乳制品。其营养优于原乳,保健价值高,风味独特。在酸乳中,由于乳酸菌的发酵作用,使其营养成分比鲜奶更完善,更易于消化吸收。
3.然而,发酵乳制品中的高蔗糖添加限制了消费者的接受程度,尤其是具有肥胖、糖尿病等慢性疾病人群不宜食用。目前,高糖食品中蔗糖替代和功能化已成为新兴的研究热点,蔗糖替代物主要为功能性低聚糖类益生元。
4.功能性低聚糖是由2~10个单糖通过糖苷键连接形成直链或支链的低度聚合糖,它们在人体胃与小肠内不被消化吸收而直接进入大肠被肠道益生菌所利用。研究表明功能性低聚糖能降低小鼠血清甘油三酯和胆固醇水平,促进肠道双歧杆菌和乳酸杆菌的增殖,抑制有害菌群的生长,调节肠道微生态平衡,促进钙、镁、锌、铁等矿物质吸收,改善骨质矿物质密度,有效防止骨质疏松,改善脂质代谢,降低血脂和胆固醇,降血压和血内毒素,保护肝脏,提高免疫力,抑制、预防肿瘤,润肠通便等功能。
5.此外,益生菌发酵过程中可降解代谢乳品中的蛋白质生成生物活性肽(bioactive peptides,bp),在提高乳蛋白消化吸收性能的同时,赋予发酵乳制品新的有益人体健康的功能活性。作为新型功能性食品的潜在来源,生物活性肽等生物活性化合物引起了众多研究者的兴趣。
6.生物活性肽是一种对身体功能有积极影响并可能影响健康的特定氨基酸片段,由几个至十几个氨基酸通过共价键(也称为酰胺键或肽键)连接而成的有机物质。生物活性肽在预防或治疗慢性疾病方面发挥积极重要作用。根据生物活性的差异可以分为:抗高血压肽、抗氧化肽、抗血栓肽、降胆固醇肽、降血压肽、抗菌肽、免疫调节肽、细胞调节肽、矿物质结合肽等。生物活性肽可以是天然来源的,也可以是蛋白质片段中的特定氨基酸序列,其在亲本蛋白质的序列中是无活性的,但是通过如发酵、酶解、超高压等技术释放后可以呈现出不同的活性。
技术实现要素:
7.本发明的目的在于提供一种无蔗糖的发酵乳及其制备方法,以使发酵乳适合过度
肥胖、高血压和糖尿病等人群食用。
8.第一方面,本公开提供了一种无蔗糖的发酵乳,所述发酵乳的原料包括生乳和/或复原乳、低聚糖和益生菌。
9.在一些实施方式中,所述低聚糖选自水苏糖、低聚果糖、低聚木糖和魔芋寡糖及其组合。
10.在一些实施方式中,所述低聚糖选自水苏糖、低聚果糖、低聚木糖和魔芋寡糖中的至少两种。
11.在一些实施方式中,以每100ml所述生乳和/或复原乳计,所述低聚糖的用量为3-5g。
12.在一些实施方式中,所述益生菌选自植物乳杆菌和/或长双歧杆菌。
13.在一些实施方式中,所述益生菌选自植物乳杆菌和长双歧杆菌。在一些实施方式中,植物乳杆菌与长双歧杆菌的比例可以为任意比例。本领域技术人员可以根据实际的生产需要来选择。例如,二者的比例可以1:100-100:1。
14.在一些实施方式中,所述益生菌为益生菌冻干粉先经活化,再经生乳和/或复原乳培养而获得。在一些实施方式中,所述益生菌可以先在mrs液体培养基中活化至少一次,例如两次或三次,再在生乳和/或复原乳中活化至少一次,例如两次或三次,获得活化后的益生菌。
15.在一些实施方式中,所述生乳选自生牛乳、生羊乳和生骆驼乳;所述复原乳选自复原羊乳、复原牛乳和复原骆驼乳。
16.在一些实施方式中,所述生乳为生羊乳;所述复原乳为复原羊乳。
17.第二方面,本公开提供了上述的发酵乳的制备方法,所述制备方法包括以下步骤:
18.将所述生乳和/或复原乳与所述低聚糖混合灭菌后,接种所述益生菌,获得所述原料;
19.将所述原料进行发酵,获得所述发酵乳。
20.在一些实施方式中,所述发酵条件为37-42℃发酵12-18h。
21.在一些实施方式中,所述制备方法还包括发酵后的后熟。
22.在一些实施方式中,所述后熟为0~4℃冷藏10~20h。
23.在一些实施方式中,所述发酵乳中菌落数不少于108cfu/ml。在一些实施方式中,所述发酵乳中菌落数为109~10
12
cfu/ml。
24.本发明提供的无蔗糖的发酵乳,添加的糖类为低聚糖,不但适合蔗糖食用受限的人群,例如过度肥胖、高血压和糖尿病人群食用。
25.本发明提供的无蔗糖的发酵乳不仅保留了羊奶中丰富的营养物质,易于吸收,口感纯正,还含有大量的血管紧张素转化酶(ace)抑制肽、黄嘌呤氧化酶(xod)抑制肽和抗氧化活性肽,能够抗氧化、抗衰老,且对于心血管疾病、高尿酸血症、以及阿尔兹海默症预防有预防的作用。
26.本发明提供的无蔗糖的发酵乳中ace抑制肽的抑制率达到60~85%。
27.本发明提供的无蔗糖的发酵乳中xod抑制肽的抑制率达到50~70%。
28.本发明提供的无蔗糖的发酵乳中抗氧化活性肽dpph自由基清除率达到40~50%。
附图说明
29.图1显示了发酵羊乳的制备工艺流程图。
30.图2显示了对比例1和实施例3-7制备的发酵羊乳中植物乳杆菌的菌落数。
31.图3显示了对比例1和实施例2-7制备的发酵羊乳中长双歧杆菌的菌落数。
32.图4显示了对比例1和实施例3-7制备的发酵羊乳中的总菌落数。
33.图5显示了对比例1和实施例1-7制备的发酵羊乳中ace抑制肽的抑制率。
34.图6显示了对比例1和实施例1-7制备的发酵羊乳中xod抑制肽的抑制率。
35.图7显示了对比例1和实施例1-7制备的发酵羊乳中抗氧化活性肽的dpph自由基清除率。
具体实施方式
36.下面通过实施例对本发明作进一步说明,应该理解的是,本发明的实施例仅是用于说明本发明,而不是本发明的限制,在本发明的构思前提下对本发明的简单改进都属于本发明要求保护的范围。
37.定义
38.除非另外定义,否则在此使用的所有术语(包括技术和科学术语)具有本领域技术人员通常所理解的含义。应注意,这里使用的术语应解释为具有与本说明书的上下文相一致的含义,而不应以理想化或过于刻板的方式来解释。
39.本文所使用的表述“约”是如本领域的普通技术人员所理解的,并且根据其使用的背景而在一定范围内变化。如果本领域的普通技术人员根据其使用的上下文对该术语的使用不了解,则“约”将意味着特定值至多加上或减去10%。
40.本文所使用的术语“生乳”是指从符合国家有关要求的健康奶畜乳房中,挤出的无任何成分改变的,未添加外源物质,未经过加工的常乳。
41.本文所使用的术语“复原乳”又称“还原乳”或“还原奶”,是指把生乳浓缩、干燥成为浓缩乳或乳粉,再添加适量水,制成与原乳中水、固体物比例相当的乳液。
42.本文所使用的术语“低聚糖”是指包含3-10个单糖残基的糖类聚合物。
43.本文所使用的术语“益生菌(probiotics)”是指进入体内并给健康带来良好效果的菌,具体地,到达肠道并可以在肠黏膜上生长的益生菌会产生乳酸,使肠道环境呈酸性;不能抵抗酸性环境的有害细菌,其数量会减少,而在酸性环境中生长良好的有益菌会更多地增殖,使肠道环境变得健康。上述益生菌可以为包括乳杆菌属(lactobacillus)、乳球菌属(lactococcus)、肠球菌属(enterococcus)、链球菌属(streptococcus)、双歧杆菌属(bifidobacterium)等,但不限于此;上述益生菌可以制备成包括上述菌株的,发酵乳、颗粒、粉末等形态。
44.本发明意外地发现,将发酵乳原料中常用的蔗糖替换为低聚糖,例如水苏糖、低聚果糖、低聚木糖和魔芋寡糖后,产生了大量的对人体健康有益的生物活性肽,例如血管紧张素转化酶(ace)抑制肽、黄嘌呤氧化酶(xod)抑制肽和抗氧化活性肽,其在本发明的发酵乳中的含量显著高于以蔗糖为原料的发酵乳。由于本发明的无蔗糖的发酵乳含有大量的生物活性肽,能够抗氧化、抗衰老,且对于心血管疾病、高尿酸血症、以及阿尔兹海默症预防有预防的作用。
45.下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。在以下说明中,省略了对公知技术的描述,以避免不必要地混淆本公开的概念。这样的技术在许多出版物,例如《分子克隆实验指南(第四版)》(冷泉港实验室科学出版社)中进行了描述。
46.实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
47.实施例
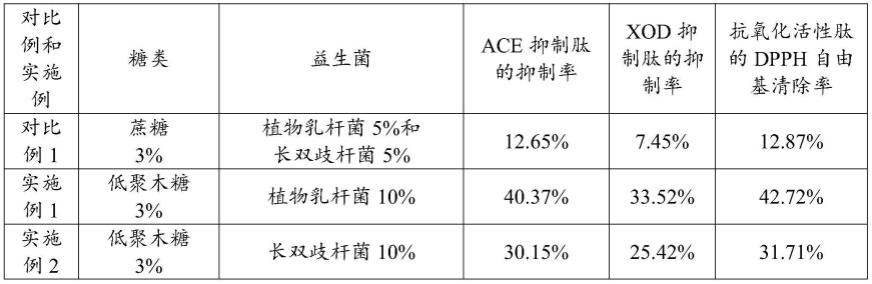
48.对比例1
49.一种含蔗糖的发酵羊乳,包括羊奶复原乳及羊奶复原乳质量3%的蔗糖和接种量为10%的益生菌,在37℃之间恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h。如图1所示,其制备方法如下:
50.1、分别取适量植物乳杆菌、长双歧杆菌冻干菌粉,分别接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,分别得到经mrs活化好的植物乳杆菌的第三代菌种和长双歧杆菌的第三代菌种;其中,前两次均在37℃条件下培养24h,第三次均在37℃培养条件下培养18h。
51.2、按每100ml灭菌羊奶复原乳中各接种5ml的比例,将上述的两个第三代菌种分别接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,分别得到经羊奶复原乳活化的植物乳杆菌和经羊奶复原乳活化的长双歧杆菌。
52.3、将14g羊奶粉和3g蔗糖溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种5ml的比例,分别接入经羊奶复原乳活化的植物乳杆菌、长双歧杆菌,在35℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
53.4、所得发酵羊乳中植物乳杆菌与长双歧杆菌的菌落数分别为8.97
×
108cfu/ml(图2)、7.12
×
108cfu/ml(图3),总菌落数为7.52
×
109cfu/ml(图4)。
54.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收集上清液。
55.6、采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为12.65%,具体方法如下:
56.用0.1mol/l硼酸盐缓冲液(含有0.3mol/l的nacl,ph为8.3),将hhl(hip-his-leu)配成5mmol/l的溶液,样品组为200μl的hhl溶液和80μl的发酵乳上清液混合液,阳性与阴性对照组为200μl的hhl溶液和80μl0.1mol/l硼酸盐缓冲液的混合液,三组的混合液于37℃下保温3min后,阳性对照组加入250μl1mol/lhcl。向三组混合液中加入20μlace溶液(溶解于去离子水中,活力为0.1u/ml),样品组和阴性对照组在37℃下保温30min,加入250μl1mol/lhcl终止反应。向三组混合液加入1.7ml乙酸乙酯,经15s振荡混匀后,静置5min,用移液管吸取1.0ml的乙酸乙酯层,真空冷冻干燥后,加入1.0ml去离子水,混匀后在228nm处测定吸光值,按下列公式计算ace抑制肽的抑制率:
57.抑制率(%)=(a
b-aa)/(a
b-ac)
×
100%
58.式中:aa为样品组吸光值;
59.ab为阴性对照组吸光值;
60.ac为阳性对照组吸光值。
61.7、采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为7.45%,具体方法如下:
62.用0.2mol/l磷酸缓冲液(ph7.4)将黄嘌呤配成0.48mmol/l的溶液,样品组为50μl的发酵乳上清液与50μl黄嘌呤氧化酶溶液(溶解于0.2mol/l磷酸缓冲液中,活力为0.02u/ml)的混合液,样品空白组为50μl的发酵乳上清液与50μl0.2mol/l磷酸缓冲液的混合液,阴性对照组为50μl的去离子水与50μl黄嘌呤氧化酶溶液的混合液,阴性空白组为50μl的去离子水与50μl0.2mol/l磷酸缓冲液的混合液。四组混合液振荡30s于25℃下保温5min后,加入150μl黄嘌呤溶液,振荡30s于25℃下保温25min。四组反应液在290nm处测定吸光值,按照下列公式计算清除率:
63.抑制率(%)=(1-(a
a-a
a0
)/(a
b-a
b0
))
×
100%
64.式中:aa为样品组吸光值;
65.a
a0
为样品空白组吸光值;
66.ab为阴性对照组吸光值;
67.a
b0
为阴性空白组吸光值。
68.8、采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为12.87%,具体方法如下:
69.使用1mol/lnaoh溶液将发酵乳上清液ph调至8.3,取1.0ml调节ph后的发酵乳上清液于8000~10000rpm离心8~10min所得上清液即为待测样品。以95%乙醇为溶剂配制0.1mmol/ldpph乙醇溶液。样品组为1ml待测样品与4ml dpph乙醇溶液混合液,对照组为1ml待测样品与4ml95%乙醇混合液,空白组为1ml95%乙醇与4mldpph乙醇溶液混合液。三组混合液经15s振荡混匀后置于暗处反应30min,并于517nm处测定吸光值,按照下列公式计算清除率:
70.清除率(%)=(1-(a
a-ab)/a0)
×
100%
71.式中:aa样品组吸光值;
72.ab为对照组吸光值;
73.a0为空白组吸光值。
74.实施例1
75.一种含低聚糖类益生元的无蔗糖添加的功能性发酵羊乳,包括羊奶复原乳及羊奶复原乳质量3%的低聚木糖和接种量为10%的植物乳杆菌,在37℃之间恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h。其制备方法如下:
76.1、取适量植物乳杆菌冻干菌粉接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,得到经mrs活化好的第三代菌种;其中,前两次均在37℃培养条件下培养24h,第三次在37℃培养条件下培养18h。
77.2、按每100ml灭菌羊奶复原乳中接种5ml的比例,将第三代菌种接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,得到经羊奶复原乳活化的植物乳杆菌。
78.3、将14g羊奶粉和3g低聚木糖溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种10ml的比例,接入经羊奶复原乳活化的植物乳杆菌,在35℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
79.4、所得发酵羊乳中植物乳杆菌的菌落数为6.52
×
108cfu/ml。
80.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收集上清液。
81.6、按照对比例1的步骤6的方法,采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为40.37%。
82.7、按照对比例1的步骤7的方法,采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为33.52%。
83.8、按照对比例1的步骤8的方法,采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为42.72%。
84.实施例2
85.一种含低聚糖类益生元的无蔗糖添加的功能性发酵羊乳,包括羊奶复原乳及羊奶复原乳质量3%的低聚木糖和接种量为10%的长双歧杆菌,在37℃之间恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h。其制备方法如下:
86.1、取适量长双歧杆菌冻干菌粉接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,得到经mrs活化好的第三代菌种;其中,前两次均在37℃培养条件下培养24h,第三次在37℃培养条件下培养18h。
87.2、按每100ml灭菌羊奶复原乳中接种5ml的比例,将第三代菌种接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,得到经羊奶复原乳活化的长双歧杆菌。
88.3、将14g羊奶粉和3g低聚木糖溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种10ml的比例,接入经羊奶复原乳活化的长双歧杆菌,在35℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
89.4、所得发酵羊乳中长双歧杆菌的菌落数为4.31
×
108cfu/ml(图3)。
90.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收集上清液。
91.6、按照对比例1的步骤6的方法,采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为30.15%。
92.7、按照对比例1的步骤7的方法,采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为25.42%。
93.8、按照对比例1的步骤8的方法,采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为31.71%。
94.实施例3
95.一种含低聚糖类益生元的无蔗糖添加的功能性发酵羊乳,包括羊奶复原乳及羊奶复原乳质量分数3%的低聚果糖和接种量为10%的益生菌,在37℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h。其制备方法如下:
96.1、分别取适量植物乳杆菌、长双歧杆菌冻干菌粉,分别接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,分别得到经mrs活化好的第三代菌种;其中,前两次均在37℃培养条件下培养24h,第三次在37℃培养条件下培养18h。
97.2、按每100ml灭菌羊奶复原乳中各接种5ml的比例,将上述的两种第三代菌种分别接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,分别得到经羊奶复原乳活化的植物乳杆菌、长双歧杆菌。
98.3、将14g羊奶粉和3g低聚果糖溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种5ml的比例,分别接入经羊奶复原乳活化的植物乳杆菌、长双歧杆菌,在35℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
99.4、所得发酵羊乳中植物乳杆菌与长双歧杆菌的菌落数分别为3.60
×
108cfu/ml(图2)、3.00
×
108cfu/ml(图3),总菌落数为4.20
×
109cfu/ml(图4)。
100.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收集上清液。
101.6、按照对比例1的步骤6的方法,采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为65.11%。
102.7、按照对比例1的步骤7的方法,采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为50.94%。
103.8、按照对比例1的步骤8的方法,采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为41.31%。
104.实施例4
105.一种含低聚糖类益生元的无蔗糖添加的功能性发酵羊乳,包括羊奶复原乳及羊奶复原乳质量分数5%的水苏糖和接种量为10%的益生菌,在37℃之间恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h。其制备方法如下:
106.1、分别取适量植物乳杆菌、长双歧杆菌冻干菌粉,分别接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,分别得到经mrs活化好的第三代菌种;其中,前两次均在37℃培养条件下培养24h,第三次在37℃培养条件下培养18h。
107.2、按每100ml灭菌羊奶复原乳中各接种5ml的比例,将上述的两种第三代菌种分别接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,得到经羊奶复原乳活化的植物乳杆菌、长双歧杆菌。
108.3、将14g羊奶粉和5g水苏糖溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种5ml的比例,分别接入经羊奶复原乳活化的植物乳杆菌、长双歧杆菌,在35℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
109.4、所得发酵羊乳中植物乳杆菌与长双歧杆菌的菌落数分别为4.12
×
108cfu/ml(图2)、3.00
×
108cfu/ml(图3),总菌落数为4.54
×
109cfu/ml(图4)。
110.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收
集上清液。
111.6、按照对比例1的步骤6的方法,采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为71.40%。
112.7、按照对比例1的步骤7的方法,采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为58.90%。
113.8、按照对比例1的步骤8的方法,采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为45.50%。
114.实施例5
115.一种含低聚糖类益生元的无蔗糖添加的功能性发酵羊乳,包括羊奶复原乳及羊奶复原乳质量分数3%的魔芋寡糖和接种量为10%的益生菌,在37℃恒温发酵18h,发酵完成后在0~4℃冷藏后熟10~20h。其制备方法如下:
116.1、分别取适量植物乳杆菌、长双歧杆菌冻干菌粉,分别接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,分别得到经mrs活化好的第三代菌种;其中,前两次均在37℃培养条件下培养24h,第三次在37℃培养条件下培养18h。
117.2、按每100ml灭菌羊奶复原乳中各接种5ml的比例,将上述的两种第三代菌种分别接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,分别得到经羊奶复原乳活化的植物乳杆菌、长双歧杆菌。
118.3、将14g羊奶粉和3g魔芋寡糖溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种5ml的比例,分别接入经羊奶复原乳活化的植物乳杆菌、长双歧杆菌,在35℃恒温发酵18h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
119.4、所得发酵羊乳中植物乳杆菌与长双歧杆菌的菌落数分别为3.10
×
108cfu/ml(图2)、2.50
×
108cfu/ml(图3),总菌落数为2.80
×
109cfu/ml(图4)。
120.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收集上清液。
121.6、按照对比例1的步骤6的方法,采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为85.42%。
122.7、按照对比例1的步骤7的方法,采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为70.49%。
123.8、按照对比例1的步骤8的方法,采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为49.82%。
124.实施例6
125.一种含低聚糖类益生元的无蔗糖添加的功能性发酵羊乳,包括羊奶复原乳及羊奶复原乳质量分数3%的低聚木糖和接种量为10%的益生菌,在37℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h。其制备方法如下:
126.1、分别取适量植物乳杆菌、长双歧杆菌冻干菌粉,分别接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,分别得到经mrs活化好的第三代菌种;其中,前两次均在37℃培养条件下培养24h,第
三次在37℃培养条件下培养18h。
127.2、按每100ml灭菌羊奶复原乳中各接种5ml的比例,将上述的两种第三代菌种分别接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,分别得到经羊奶复原乳活化的植物乳杆菌、长双歧杆菌。
128.3、将14g羊奶粉和3g低聚木糖溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种10ml的比例,接入经羊奶复原乳活化的植物乳杆菌、长双歧杆菌,在35℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
129.4、所得发酵羊乳中植物乳杆菌与长双歧杆菌的菌落数分别为4.90
×
108cfu/ml(图2)、4.60
×
108cfu/ml(图3),总菌落数为5.10
×
109cfu/ml(图4)。
130.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收集上清液。
131.6、按照对比例1的步骤6的方法,采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为79.70%。
132.7、按照对比例1的步骤7的方法,采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为59.91%。
133.8、按照对比例1的步骤8的方法,采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为41.52%。
134.实施例7
135.一种含蔗糖的发酵羊乳,包括羊奶复原乳及羊奶复原乳质量3%的低聚木糖与魔芋寡糖混合物(1:1=w/w)和接种量为10%的益生菌,在37℃之间恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h。其制备方法如下:
136.1、分别取适量植物乳杆菌、长双歧杆菌冻干菌粉,分别接种于mrs液体培养基的厌氧管中,充分混匀后在37℃活化三次,每次均按100mlmrs液体培养基中接种5ml的比例进行转接,分别得到经mrs活化好的第三代菌种;其中,前两次均在37℃培养条件下培养24h,第三次在37℃培养条件下培养18h。
137.2、按每100ml灭菌羊奶复原乳中接种5ml的比例,将上述的两种第三代菌种分别接种于装有灭菌羊奶复原乳的厌氧管中,充分混匀后在37℃培养条件下活化三次,每次10h,分别得到经羊奶复原乳活化的植物乳杆菌、长双歧杆菌。
138.3、将14g羊奶粉和3g低聚木糖与魔芋寡糖混合物(1:1=w/w)溶解于100ml的水中并混合均匀,在90~95℃灭菌10~15min,冷却至40~42℃后,按每100ml接种10ml的比例,接入经羊奶复原乳活化的植物乳杆菌、长双歧杆菌,在35℃恒温发酵12h,发酵完成后在0~4℃冷藏后熟10~20h得到发酵羊乳。
139.4、所得发酵羊乳中植物乳杆菌与长双歧杆菌的菌落数分别为9.41
×
108cfu/ml(图2)、8.27
×
108cfu/ml(图3),总菌落数为8.47
×
109cfu/ml(图4)。
140.5、取5~10ml发酵羊乳在4~8℃以8000~10000rpm离心10~15min,离心结束后收集上清液。
141.6、按照对比例1的步骤6的方法,采用紫外分光光度法检测发酵上清液中ace抑制肽的抑制率为82.12%。
142.7、按照对比例1的步骤7的方法,采用紫外分光光度法检测发酵乳上清液中xod抑制肽的抑制率为63.41%。
143.8、按照对比例1的步骤8的方法,采用紫外分光光度法检测发酵乳上清液中抗氧化活性肽的dpph自由基清除率为50.65%。
144.对比例和实施例获得的发酵羊乳进行检测结果详见表1和图5-7。
145.表1对比例和实施例获得的发酵羊乳进行检测结果
[0146][0147][0148]
由表1可知,本发明的发酵羊乳中的血管紧张素转化酶(ace)抑制肽、黄嘌呤氧化酶(xod)抑制肽和抗氧化活性肽显著高于添加蔗糖的发酵羊乳,具有抗氧化、降血压及降尿酸等潜在有益人体健康功效,且对于心血管疾病、高尿酸血症、以及阿尔兹海默症预防有预防的作用,有利于蔗糖食用受限的人群,例如过度肥胖、高血压和糖尿病人群食用。
[0149]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1