基于不确定性的放疗治疗计划的方法和系统与流程
本发明涉及放疗领域,特别是涉及放疗治疗计划。
发明背景
在放疗中,目的通常是要向靶标(例如肿瘤)传递足够高的剂量,同时尽可能不伤害周围正常组织。具体而言,重要的是要最小化接近靶标的敏感器官的剂量。治疗计划,例如利用治疗计划系统(TPS)创建的治疗计划,限定了为了达到这些治疗目标,每期放疗如何进行。更具体地说,在逆向治疗计划中,使用最优化算法寻找一组治疗参数,所述参数将在接受治疗者(subject)体内产生最密切匹配所需剂量的剂量分布。
放疗治疗计划基于医学图像,例如三维CT图像。为了充当治疗计划的基础,这些图像必须被分割。图像分割是指在图像中定义或重建不同的内部结构或其他关注区域(regions of interest,ROI)的过程。这些可以是例如图像中可识别的具体的内部器官。分割的ROI在三维图像中经常表现为实体或半透明的物体,以便治疗计划系统的使用者看得见,并且还可能可操控。
在放射治疗计划领域中,关注区域可以是例如风险靶体积或器官(OAR)。所述ROI可以利用各种工具,例如在CT层面中画轮廓的工具,在图像中人工勾画和分割。或者,可以使用自动或半自动方法。例如,这样的方法可以采用包含已经分割的结构的结构模型或图集,将其转移到新的尚末分割的医学图像中并自动调整以便与患者的几何形态相对应。这种自动分割的结构然后人工评价并认可或修改。
精确分割的ROI对于得到高质量治疗计划是关键的。然而,关于所勾画的ROI轮廓与所述区域真实位置相对应的程度,将始终有一定程度的不确定性。这种不确定性程度对于ROI轮廓的不同部分可能是不同的。例如,与ROI边界在图像中由于高对比度而容易与周围组织区分的部分相比,在ROI轮廓中位于低对比度区域(即周围组织的密度与ROI密度相似的区域)的某个部分的真实位置可能是更不确定的。
除轮廓不确定性以外,关于定义关注区域的其他不确定性可由肿瘤医师鉴定,例如特定区域是否实际上包含疾病的不确定性、或关于区域中组织的生物学反应的不确定性。
在肿瘤和其他结构的定义中有巨大的观察者间变异性,使得由一个肿瘤医师定义的区域的体积和其他性质可以明显不同于另一个肿瘤医师所定义的那些。这些差异不一定是由于肿瘤医师的能力或经验水平不同,而经常是其他因素例如图像质量不足的结果(即由于图像质量低不可能精准定义ROI)。
关于器官位置和移动、患者摆位误差等的不确定性传统上通过运用ROI裕度来处理。结果,治疗计划以扩大的体积为基准,确保了靶标的足够剂量覆盖度和/或充分不伤害风险器官。然而,这是一种近似法,可能导致治疗计划中高于必要的剂量被传递到健康组织。基于概率法的更先进方法也建议了在优化放疗治疗计划期间将关于患者摆位和器官移动的不确定性纳入考虑。这样的方法通常包括考虑许多概率或高或低的情况,例如通过不同的靶体积变化限定的情况。
然而,在治疗计划期间,仍有关于不确定性的很多参数没有以适当的方式加以考虑。
本发明的目的是克服或至少缓和上述缺点,特别是提供将能够产生更优治疗计划的治疗计划系统。
技术实现要素:
根据本发明的一个方面,提供了根据接受治疗者的内部图像产生所述接受治疗者的放射治疗计划的方法。优选地,所述方法包括检索所述图像中与关注区域相关的至少一个不确定性度量,其中所述至少一个不确定性度量反映了关于定义所述关注区域的不确定性程度,和至少部分地根据所述至少一个不确定性度量产生所述放射治疗计划。
根据本发明的另一个方面,提供了计算机程序产品。优选地,所述计算机程序产品包含计算机可读指令,当在计算机上执行所述指令时,将引起所述计算机执行所述产生放射治疗计划的方法。
根据本发明的又一个方面,提供了计算机系统。优选地,所述计算机系统包含与存储了计算机程序的至少一个存储器连接的处理器,所述计算机程序包含用于产生所述放射治疗计划的计算机可读指令,其中所述处理器被构造成执行所述计算机可读指令。
于是,本发明通过将关于ROI定义的不确定性的信息纳入所述治疗计划过程中,实现了上文限定的目的。这将使所述治疗计划系统能够确定更优的治疗计划,因为所有必要的权衡都可以考虑到相关的ROI定义不确定性来评定。
根据一些实施方式,所述不确定性度量是指关注区域的轮廓或部分轮廓的位置的不确定性。于是,关于ROI勾画的不确定性,其经常可以是显著的,被纳入优化治疗计划的过程中。所述不确定性度量可以由关注区域中与普通轮廓宽度相比具有更大宽度的轮廓或部分轮廓来定义。由此,所述不确定性度量可以使用合适的工具容易地定义和/或在所述图像中清晰显现。
根据一些实施方式,所述不确定性度量是指关于所述关注区域内组织的性质的不确定性。于是,对放射治疗具有重要性的关于所述组织性质的不确定性被纳入优化治疗计划的过程。这样的性质可能例如与该区域内组织的类型有关。根据一些实施方式,所述组织的性质与肿瘤性细胞的存在与否有关。因此,可以利用在某个区域中存在疾病的概率(即风险)来确定更优的治疗计划。根据一些实施方式,所述组织的性质与生物学反应有关。因此,可以评估(或以某种其他方式鉴定)生物学反应的不确定性,即由于存在肿瘤性细胞、或由于来自治疗的放射而出现某些不良的患者效应(或缺乏所述效应)的概率,并运用在所述治疗计划过程中。
根据一些实施方式,产生放射治疗计划的步骤包括确定是否治疗关注区域或一部分关注区域。于是,可以确定完全不治疗某些靶区域或部分靶区域的治疗计划。这可以是使用各种区域特异性不确定性(例如与疾病和/或预期生物学反应的存在有关)作为治疗计划系统的输入数据、并在其中确定有些特定的不能接受的放射诱导不良效应的风险超过与不治疗特定的靶区域或部分靶区域牵涉的风险的结果。
根据一些实施方式,所述不确定性度量是基于下列的一种或多种:专家意见,图像数据,测量数据,统计数据和模拟。于是,不确定性不一定必须由专家评估和建议,而是可以用其他方式确定。然而,以自动方式确定的不确定性度量将通常在用于治疗计划过程之前由专家评价和认可。
根据一些实施方式,放射治疗计划至少部分地根据下述产生:与第一关注区域相关的不确定性度量、关于所述第一关注区域定义的第一治疗目标或约束和至少部分与所述第一治疗目标或约束冲突的第二治疗目标或约束。因此,治疗计划是基于冲突性治疗目标之间的折衷,其中关于与至少一个所述治疗目标有关而定义的区域的特定不确定性被纳入考虑。于是,鉴于区域定义不确定性和鉴于冲突性治疗目标二者来评定权衡。
根据一些实施方式,产生放射治疗计划包括最大化满足对关注区域定义的一个或多个临床目标的概率的步骤,其中所述概率至少部分依赖于不确定性度量。放射治疗的临床目标通常由临床医生、例如肿瘤医师确定。通过采用旨在最大化满足这些目标的概率的治疗计划过程,任何定义的不确定性度量被有效纳入所述过程中,产生概率尽可能高以满足肿瘤医师指示的所有目标的治疗计划。替代或附加地,可以对满足与一个或多个ROI相关的一些临床目标的概率施加约束。因而,在治疗计划过程中,改为可优化易受这些约束影响的其他治疗目标。例如,如果使用的约束定义了满足特定目标的某种最低可接受概率(其中所述概率依赖于所定义的ROI定义不确定性),所述治疗计划系统可以确定相对于其他治疗目标的最佳可能的治疗计划,然而仍然满足预先定义的对所述最低可接受概率的约束。
通过考虑详细说明和附图,本发明的其他方面将变得显而易见。这些只是为了说明优选实施方式,不应被解释为限制本发明。
附图说明
图1是本发明方法的流程图。
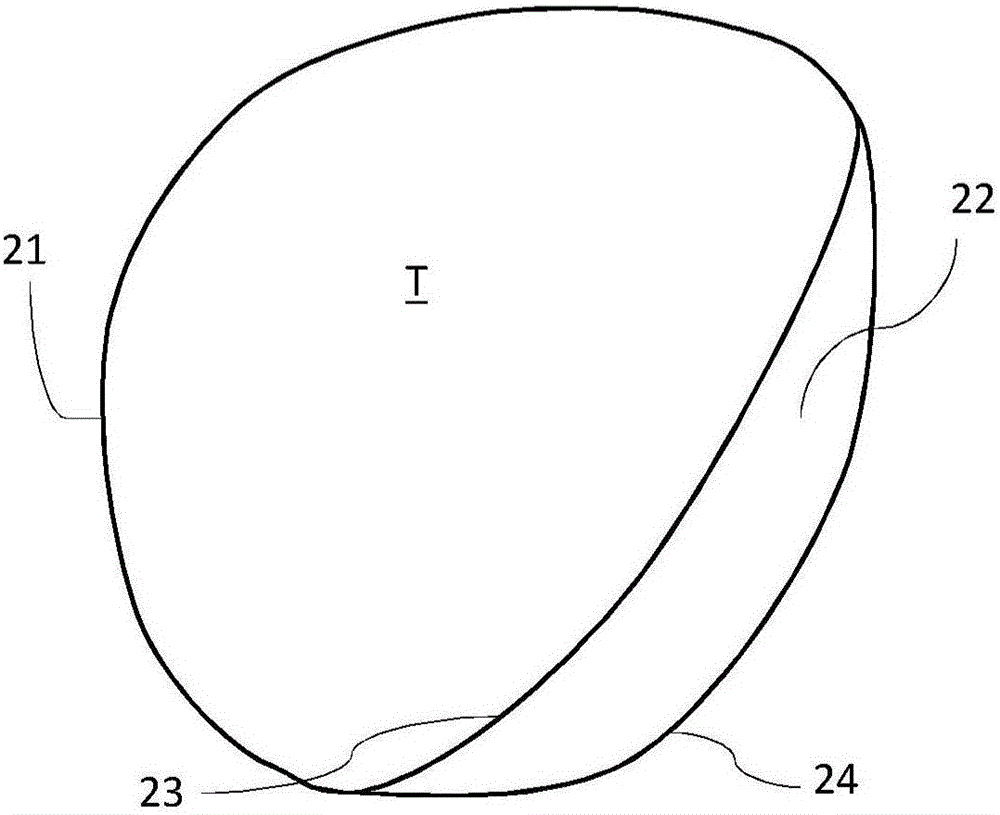
图2是靶区域的示意图,对部分靶轮廓定义了不确定性度量。
图3是三个分开的靶区域和风险器官区域的示意图,所述区域具有定义的不确定性度量,所述度量指示了定义每个区域的不确定性。
图4A示意性地图示了具有不确定性度量的靶区域,被定义为具有连续变动的疾病存在概率的区域。
图4B示意性地图示了基于所定义的不确定性在治疗计划期间所确定的待治疗区域。
图5示意性地图示了对转移到相应的PTV的CTV所定义的不确定性度量。
图6是根据本发明的示例实施方式的计算机系统示意图。
具体实施方式
在图2-5中,显示了诊断患者图像的二维横截面(即表现CT扫描的单个层面)。这仅仅为了说明性目的和便于理解本发明,要强调所述诊断图像通常包括定义接受治疗者的三维表示的很多层面。因此,图中显示的关注区域可以被认为是在患者的3D图像中定义的体积的横剖面视图。为了计算剂量,患者的3D表示可以离散化为许多三维像素。
图1是显示本发明的方法的不同步骤的流程图。
在步骤11中,检索接受治疗者的内部图像(即显示身体的内部形态的图像)。这可以是来自计算机断层(CT)扫描的三维图像,而且其他成像模式或模式的组合也是可能的,例如,核磁共振成像(MRI)。
在步骤12中,检索关于与所述图像中关注区域的定义有关的某个方面的至少一个不确定性度量。例如,所述不确定性度量可以与疾病的存在、生物学反应或ROI轮廓的位置有关。例如,不确定性度量可以定义可能的轮廓位置的范围。不确定性度量可以是预先定义的,例如由肿瘤医师在例如勾画过程期间人工定义的,和/或作为在反复治疗计划过程期间的反馈输入的。
在步骤13中,所述治疗计划是将一种或多种所述不确定性度量纳入考虑产生的。所述治疗计划使用治疗计划系统产生,所述治疗计划系统除所述不确定性度量之外,还采用许多其他参数来优化治疗计划,例如如下面论述的基于剂量或基于生物学的治疗目标或约束。
治疗计划可以被优化以供用于使用任何种类的方式包括光子、质子或电子的任何种类的放射治疗设备。所述治疗计划可以是调强放射治疗(IMRT)计划或任何其他放射治疗计划,例如三维适形放射治疗(3DCRT)计划或容积弧形调强治疗(VMAT)计划。
在逆向治疗计划中通常的方法是最小化(或最大化)由经常受某些计划约束影响的所有优化函数组成的目的函数。所述目标函数可以是所有优化函数fi的加权总和,即,
其中所述优化函数的权重wi对应于比率,一个优化函数值以该比率减少折衷了第二个优化函数值增加,后者与另一个可能冲突的治疗目标相关。有可能使用三维像素比权重反映ROI中不同三维像素的相对剂量目标重要性。
与包含j个三维像素的ROI相关的优化函数fi的简单例子是:
其中dj是三维像素j中的剂量,dref是参考剂量,和Δvj是三维像素j在所述ROI中的相对体积。剂量dj是通过优化确定的治疗参数的函数。通过乘以所述相对体积Δvj和除以所述参考剂量dref的平方进行的归一化具有下述效果:忽视目标权重,将所有ROI不管体积和参考剂量水平如何,都认为是同样重要的。利用如(2)中定义的优化函数,相对于所述参考剂量来说剂量不足和剂量过度二者都同样被罚。这只是一个例子,并可以使用很多其他优化函数代替或附加于该函数。这种的例子是最小或最大剂量优化函数、基于优化函数的最小或最大剂量-体积直方图(DVH)、或基于放射生物学的优化函数。
当优化目标函数以达到治疗计划时,可以采用各种不同的优化技术。例如,可以使用基于梯度的方法,例如基于顺序二次规划算法,或启发式方法,例如模拟退火的方法。所述优化可以是基于积分通量的,其需要随后转化成机器参数,或基于直接优化机器参数的直接机器参数优化(DMPO),或两者相结合。利用优化的常规逆向治疗计划是本领域公知的并因此将不在本文中进一步详细描述。
所述不确定性度量纳入治疗计划过程可以用各种不同的方式进行,这将主要参考图3和4在下文论述。通过使用图1中说明的本发明方法,优化的治疗计划将依赖于与不同区域相关的不确定性度量和覆盖(或不伤害)这些区域的成本(即必要的权衡的程度)二者。
图2图示了具有靶轮廓21的靶体积T的2D图像。不确定性度量已经分配给靶轮廓21的特定部分,在这种情况下产生加宽的“近似”轮廓22,其具有内边界23和外边界24。这种近似轮廓表明所述靶边界的真实位置是不确定的但是(至少具有高概率)在被近似轮廓22覆盖的区域内的某处。因此,所述近似轮廓反映了靶定义的不确定性。所述近似轮廓22的特征,例如宽度,可以是使用者定义的,例如由肿瘤医师在勾画程序期间,或以其他方式定义,例如基于图像信息自动定义,如下文进一步描述。
近似轮廓22的内边界23当与靶轮廓的剩余部分21相结合时定义了可能的最小靶区域。相应地,近似轮廓22的外边界24当与所述靶轮廓的剩余部分21相结合时定义了可能的最大靶区域。如果能实现,剂量应该传递到所述较大的靶区域,因为有可能疾病存在于整个区域中。然而,如果不用不可接受的方式向风险器官增加剂量就不可能覆盖所述较大的靶区域的话,所述靶区域的覆盖度可能不得不折衷。于是,由近似轮廓22定义的区域指出了靶覆盖度中应该主要做出必要牺牲的地方。例如,如果有可能只覆盖由所述近似轮廓定义的区域的内半部,依赖于所述靶的真实轮廓的位置,仍然有机会(虽然降低)将治愈全部疾病。
因此,通过使用关于不确定性的信息,即所述近似轮廓的扩展,作为优化的输入数据,可以在以前尚不可用于治疗计划系统的附加信息的基础上,确定治疗计划。
图3图示了接受治疗者的2D图像表示,所述图像包含靶区域T1、T2、T3和风险器官O。在这个例子中的靶区域T1表示临床靶体积(CTV),其中所述轮廓的一部分的精确位置是不确定的。所述不确定性程度以与对图2中图示的靶同样的方式确定,即使用具有内轮廓边界33和外轮廓边界34的宽近似轮廓32,所述真实的靶边界位于其中某处。确定关于CTV轮廓某个部分的位置的不确定性程度的不确定性度量可以被想象关于在接近所述CTV边界的区域中疾病存在的不确定性,即特定的区域或三维像素包含疾病的概率。如果将由靶T1的内轮廓边界33定义的最小可能CTV视为肿瘤细胞存在概率很高(即接近100%)的区域R1,并将靶T1的外轮廓边界34外面的区域视为肿瘤细胞存在概率很低(即接近0%)的区域,那么在所述近似轮廓区域32内部,所述肿瘤存在概率可以被认为在0和1之间变化。因此,根据相对于所述近似轮廓边界的三维像素位置,所述近似轮廓区域32中每个三维像素可以给出特定的疾病存在概率。所述近似轮廓区域可以划分成预定量的区域,其中每个区域根据与所述近似轮廓的内和外边界33、34的距离赋值特定的疾病存在概率。根据图3中图示的实施方式,所述靶T1的近似轮廓区域被分成两个区域R2、R3,其中内R2和外R3区域分别被赋值60%和20%的疾病存在概率。通过将所述近似轮廓模拟为具有不同疾病存在概率的离散区域,所述不确定性信息可以容易地纳入治疗计划优化中,如下文将进一步描述的。
与关注区域的定义有关的不确定性度量可以,例如基于关于所述区域内组织的性质的不确定性,例如关于组织类型和/或关于生物学反应的不确定性,直接分配给区域。例如,疾病(例如肿瘤性细胞)存在的概率可以分配给特定的区域,例如疑似转移的区域(即可能有疾病但没有证实的区域)。替代或附加地,基于预期的生物学反应中的不确定性的概率可以分配给区域。例如,这种概率,当针对包含疾病的靶区域进行确定时,可以是由于所述疾病发生的某种特定的不良患者效应的评估风险,例如如果不治疗的话患者不存活的风险。相应地,当针对风险器官进行确定时,关于生物学反应的不确定性可以与由于接受了规定量的放射剂量而发生某种特定的不良效应的评估风险有关。
关于组织性质的不确定性度量可以基于专家意见,例如由肿瘤医师评估,或基于测量数据,例如基于活检或PET扫描,或基于计算机模拟和/或来自其他患者的统计数据,等等。
在图3中,特定的肿瘤存在概率已经分配给靶区域T2和T3,其在这种情况下表示其中可能存在转移的区域。根据这个例子,并且如该图中的指示,靶区域T2具有10%的疾病存在概率,而靶区域T3具有30%的疾病存在概率,所述概率例如由肿瘤医师评估。在所述图中指示的概率因此表示在所述相应的区域内至少一个三维像素包含疾病的概率。在另一种示例性实施方式中,假定证实了在区域T2和T3中存在疾病,则对T2和T3区域的不确定性度量可以基于预期的生物学反应。因此,根据这样一种实施方式,对区域T2和T3定义的概率可以是某种不想要的患者效应的概率,所述效应例如,如果所述区域不治疗的话,患者不存活。因此,例如,对区域T2定义的不确定性度量将相当于即使区域T2不治疗的话,所述患者存活概率为90%。
在与图3有关的以下例子中,对区域T2和T3定义的概率被描述为疾病存在的概率,但是要理解这些种类的概率同样可以反映关于如上所述的生物学反应的不确定性(即没有特别考虑肿瘤性细胞的存在与否)。
风险器官O的轮廓也具有实际位置不确定的一部分,由比较宽的近似轮廓段35定义。与考虑不确定的靶区域T1中肿瘤存在概率类似,所述风险器官O的近似轮廓35反映了实际上包含所述风险器官特定的组织细胞的三维像素的概率。因此,在风险器官O的近似轮廓区域35内的三维像素被分配了实际上包含OAR组织的三维像素的概率。在图3中图示的简化例子中,所述不确定性利用单个恒定概率(40%)模拟,导致一个区域R4中具有100%概率而另一个区域R5具有40%概率。
所述不确定性度量,在这个例子中以疾病存在或OAR组织存在的概率的形式,用作治疗计划系统的输入数据。纳入区域特定的概率的一个显然的方法将是定义用于所述优化算法中的一组相应区域或三维像素特定的重要性权重,使得区域中更“确定”的三维像素在所述优化中给出更高的权重。然而,这种方法通常将是不合适的。例如,考虑到靶区域,在这样一个目标函数的基础上优化的治疗计划仍将把剂量传递到所述不确定区域的所有部分,虽然剂量水平降低。这通常将不是满意的结果,因为为了实现肿瘤控制,包含疾病的所有部分必须接受一定量的剂量。也就是说,靶中可能满足所述临床目标的所有部分应该被处方剂量覆盖。因此,对于存在关于疾病存在的不确定性并且在不违反其他重要治疗目的下不可能满足所述临床目标的靶的部分,宁愿完全不传递剂量。因此,下面论述纳入所述不确定性信息的其他通常更有利的方法。
作为简单例子,可以确定许多不同治疗计划,其中在不同的情况中考虑包括不同的特定不确定性度量的不同区域组合。例如,可以基于与所述靶内覆盖区域相关的不确定性度量、和在所述各个区域中靶目标的实现(例如与最小处方剂量有关)、考虑到各种其他冲突性的优化目标或约束的实现,例如与不伤害风险器官有关,来评价不同的候选治疗计划。因此,例如,产生达到肿瘤控制的最高概率(如基于所述不确定性度量所确定的)同时也不超过对风险器官的特定剂量耐受水平的计划,是自动选择的。
下面,参考图3和4,更详细地描述在所述治疗计划过程中如何纳入ROI定义不确定性的三个实施例。
例子1–离散区域:
考虑具有包含疾病的概率p1,...,pn的区域R1,...,Rn的ROI。对i>1,每个区域Ri,在j<i的区域Rj满足临床目标之前区域Ri中没有满足临床目标的效益的意义上,依赖于所有j<i的区域Rj。
对于图3中的靶T1,这些区域是R1、R2和R3,其中R1是有100%包含疾病概率的区域,R2是有60%包含疾病概率的区域,和R3是有20%包含疾病概率的区域。因此,p1=1,p2=0.6,和p3=0.2。所述区域之间的依赖性意味着考虑到靶T1的临床目标,应该首先朝着满足区域R1中的目标努力,然后是区域R1∪R2,和然后是R1∪R2∪R3。这意味着如果目标是向靶T1传递50Gy的剂量,则除非区域R1∪R2接受了50Gy,否则向区域R3传递50Gy没有效益,并且除非区域R1接受了50Gy,否则向区域R2传递50Gy没有效益。如对技术人员将是显而易见的,在另一种实施方式中,将有可能把不同的区域视为相互独立的。
在具有依赖性区域R1,...,Rn的给定ROI中满足临床目标(例如给靶区域的最小剂量)的概率可以根据下面所述计算:
依次考虑区域R1,R1∪R2,R1∪R2∪R3,…,。如果这些全部满足临床目标,那么满足临床目标的概率是1。否则,让J表示这些中没有满足临床目标的第一个的指数,即区域中没有满足临床目标。在这个区域中有疾病的概率是它的构成部分的最小概率,即min{p1,...,pj}=pj,其中所述等式是由于所述区域以概率的降序排序。因此,将没有满足临床目标的概率是pj。
因此,作为参考图3的实施例,假定在靶T1的区域R1中满足了临床目标,但在区域R1∪R2中没有满足(因此在区域R1∪R2∪R3中也没有)。那么R1∪R2是没有满足临床目标的第一个区域,其意味着对于靶T1有p2=0.6的没有满足临床目标的概率。此外,如图3中示出的所有靶T1、T2和T3全部是相互独立的。例如,假定靶T2没有满足临床目标,但靶T3满足了临床目标。那么没有满足靶T2的临床目标的概率有0.1(因为在靶T2中有疾病的概率有10%)而靶T3没有满足临床目标的概率为0。那么治愈所有肿瘤的总概率是:(1–0.6)×(1–0.1)×(1–0)=0.36。
类似地,可以计算各个OAR、例如图3中的区域O满足所述目标的概率。
所述优化然后应该找到就这些概率而言表现最佳的计划。例如可以争取最大化所有概率的乘积(即满足所有临床目标的概率)。或者,可以对一种或多种所述概率施加约束而优化一些其他目标(例如,与最大剂量、监视器单元(MU)的数量等有关的治疗目标)。
使用如上所述的优化,所述权衡将依赖于各个区域的不确定性度量,以及达到所述不同区域的剂量覆盖度/不伤害的成本。例如,参考图3,假定有可能在靶区域T1的区域R1以及靶区域T3中满足临床目标(如上文所例示的,导致满足所述靶临床目标的概率为0.36),同时对于OAR O的两个区域R4和R5都满足临床目标(即导致满足所述OAR临床目标的概率为1)。这将导致满足所有临床目标的概率为0.36×1=0.36。现在,假定满足了区域R4而不是区域R5中的OAR临床目标(导致满足所述OAR临床目标的概率为1–0.4=0.6),有可能不仅在区域R1和靶T3中而且在区域R2中满足所述靶临床目标(导致满足所述靶临床目标的概率为(1–0.2)×(1–0.1)×(1–0)=0.72)。这将导致满足所有临床目标的概率为0.72×0.6=0.432。
因此,使用将剂量开给区域R1、R2和T3而不是区域R3和T2的治疗计划,满足所有临床目标的概率被最大化,表明计划将剂量给靶区域R3和T2不是有益的,因为这在不伤害风险器官O方面是过于昂贵的。
通过考虑所有可利用的不确定性信息,治疗计划系统将在具体情况下鉴别最有益的权衡,产生更好的治疗计划,例如得到达到总体肿瘤覆盖度但没有正常组织并发症的最高可能概率。
例子2–连续和不分层的区域:
考虑靶区域R内每个点具有在(0,1]区间内的包含疾病的定义概率。优化的目的是最大化治愈所述疾病的概率。
可按三维像素分开的目标(例如,给每个三维像素的剂量应该超过60Gy的目标),在有病的所有三维像素中满足所述目标(向有病的所有三维像素传递超过60Gy的剂量)的概率可以按下式计算
其中I是属于没有满足所述目标的区域R中的所有三维像素集(R中的三维像素具有低于60Gy的剂量)和pi是三维像素i包含疾病的概率。如果集I为空,则概率是1。
所述优化的目标是传递将这种概率最大化的剂量,其与以使得组I中三维像素包含疾病的概率尽可能低这种方式传递剂量相同。
治疗连贯的靶体积可能是理想的。这可以通过对要治疗的体积的形状引入约束使得所述治疗的靶体积始终是连贯的体积。
图4A图示了靶体积的2D图像表示,所述靶体积包含已知存在疾病的内区域41和外“不确定的”区域42,反映了靶定义不确定性。因此,与上述实施例类似,区域42可以对应于近似轮廓,例如由专家定义的。内区域41内部的三维像素被认为包含疾病的概率为100%,同时区域41和42外部的三维像素被认为包含疾病的概率为0%。因此,在外区域42之内的每个三维像素包含疾病的概率从0至1。三维像素的所述概率可以依赖于在外区域42内的三维像素的位置。例如,沿着法线43到内区域41的表面,所述概率可以从在外区域42的内边界处的三维像素的1线性或指数性降低到在外区域42的外边界处的三维像素的0。显然,在外区域42内的概率变化可以用很多其他方式定义,例如根据专家做出的评价。例如,可以定义不同地连续概率变化的多个区域。
在如上所述的方法中使用方程(3),所述治疗靶体积被最大化。图4B图示了使用这种方法得到的示例性靶体积44。如图所示,所述治疗体积可以具有一定程度的不规则性。然而,出于与上文根据实施例1所讨论的类似的原因,对所述靶体积的形状施加约束可能是有利的,因为如果更接近所述靶中心的邻近区域没有被治疗的话,通常对治疗远距离区域将没有效用。
例子3–不可分目标:
如前所述,考虑一个区域R,在其之内每个三维像素具有在(0,1]区间内的包含疾病的规定概率(如果所述区域与靶相关),或者,如果所述区域与OAR相关,则具有所述区域特异性的某种其他组织类型。在下面,所述区域R以与靶区域相关为例。因此,赋值三维像素的所述概率反映了所述真实靶体积包含所述三维像素的概率,因此,所述概率从已知包含疾病的区域中的三维像素的100%降低到已知不包含疾病的区域中的三维像素的0%。考虑所有可能的靶体积并且对于它们的每一个,考虑它是真实靶体积的相应概率(这些靶体积是非零的,因为离散化为三维像素)。具有100%概率的三维像素将包含在所有这些靶体积中。给出一个计划,让S是在满足临床目标的所有靶体积中的指标集,并且让pi是靶体积i∈S是真实靶体积的概率。那么,所述优化的目标是最大化在所述真实靶体积中满足临床目标的概率,其意味着最大化
这通过寻找产生区域S的剂量分布来实现,所述区域S指示了以尽可能的概率包含所述真实靶体积的靶体积集。当使用不可按三维像素分开的目标时,例如当使用基于DVH的优化函数(即目标要求ROI的X%接受至少Y Gy)时,可应用这种方法。
所有上述实施方式仅仅是在治疗计划过程中如何纳入ROI定义不确定性的例子,并且很多替代方法是设想得到的,这对本领域技术人员将是显而易见的。
如上所述,有可能以各种不同的方式定义ROI定义不确定性。例如,同样如上所论述,亚区域和相应的不确定性度量可以是人工定义、修改和/或认可的,例如由专家使用者(例如肿瘤医师)在人工或自动分割程序期间或之后人工定义、修改和/或认可。所述区域和/或相应的不确定性度量可以使用任何合适的用户界面在图像中直接定义,所述用户界面例如包含用于定义指示不同的不确定性程度的轮廓段(例如不同的轮廓宽度)的工具。
使用者也可以向轮廓的特定部分赋值不确定性的数值度量,所述数值度量例如定义所述轮廓段每侧的置信区间。各种种类的数值不确定性度量,例如由专家赋值的,可以,可能与图像信息结合,用于定义与上文论述的亚区域对应并在图3中图示的多个亚区域,或用于定义如上所述和在图4A中例示的特定区域内连续变化的不确定性。
图3中图示的近似轮廓区域可以被分成较小亚区域的大得多的集,具有不同赋值的概率,以便提供治疗计划的更好基础(虽然也使所述治疗计划过程有更多的计算要求)。区域的数量和相应的赋值概率可以根据预定标准自动确定。例如,可以使用固定的预定的亚区域数量,或者亚区域数量可以依赖于近似轮廓段的扩展(例如宽度)。特定的三维像素的不确定性度量于是将依赖于所述预定标准和从所述三维像素到所述近似轮廓的内和外边界的相对距离。或者,可以采用定义亚区域和相应的不确定性度量的其他方法,例如基于分析图像强度数据的方法。例如,定义的轮廓的所有部分可以基于在各个轮廓部分附近的区域中的对比度来赋值不确定性度量。因此,在低对比度区域内的轮廓段自动赋值相对更高的不确定性。这种自动赋值的不确定性度量有利地被评定和认可,或者如有必要的话,由专家修改。
不确定性度量可以用各种方式在图像中显现,例如与ROI相关的元素使用不同的尺寸、颜色、透明度等。不确定性信息,例如关于特定的区域是否包含疾病,还可以从测量数据(例如基于活检或PET扫描等)、计算机模拟、来自其他患者的统计数据或以任何其他方式确定。
本发明的方法可以与任何以前使用的方法相结合来产生更稳健的治疗计划,例如基于概率法的方法以将摆位不确定性纳入考虑。此外,本发明的方法可以用于任何区域,例如已经使用安全裕度扩大的区域。裕度通常应用于靶体积(生成“计划靶体积”(PTV)),以便补偿在治疗期间可能的摆位不确定性或靶移动。例如,如果已经对临床靶体积(CTV)的区域赋值了特定的不确定性度量,并向所述CTV施加了统一的裕度,定义PTV,那么可以对所述PTV的相应区域赋值相同的不确定性度量并如上所述用于所述治疗计划过程。图5显示了这样的PTV51,其中CTV53的近似轮廓段52被转到所述PTV的相应近似轮廓段54。
图6示意性地示出了本发明的计算机系统61的例子。所述系统包括与存储器63连接的处理器62。此外,所述系统可以包括显示装置64(例如用于显示具有定义的ROI和相应的不确定性度量的患者图像、图形用户界面、和与治疗计划相关的其他信息)、数据输入装置65(例如键盘、鼠标或任何其他合适的数据输入装置)和读/写数据装置66(例如光驱动器、USB接口、或任何其他合适的数据读/写装置)。处理器62可以是任何种类的,例如一个或多个中央处理器(CPU)或任何种类的并行处理器系统,例如基于一个或多个图形处理单元(GPU)。存储器63可以是适合于储存和检索信息的任何种类的易失性或非易失性存储器,例如硬盘驱动器。存储器63具有在其上存储的计算机程序67。计算机程序67包含计算机可读指令用于进行基于不确定性的优化,其中所述计算机可读指令可以转移到处理器62并由所述处理器执行。当由处理器62执行时,所述计算机可读指令将执行如图1所示的方法,以在定义ROI的不确定性基础上确定治疗计划。所确定的治疗计划可以与患者图像、ROI、不确定性度量和任何其他治疗计划相关信息一起存储在存储器63上。计算机程序67也可以储存在非临时性计算机可读介质68例如USB驱动器、光学数据载体例如CD-ROM、或任何其他合适的便携式信息存储装置上,使得计算机程序67可以载入存储器63和/或转移到不同的计算系统。参考图6描述的系统仅仅是例子,并且本发明的计算机系统不一定包括全部所说明的组件,和/或可以包含没有说明的其他组件。
本发明已经参考许多示例性实施方式进行了描述。要理解这些实施方式仅仅是说明本发明的原理和应用。因此要理解可以对所述说明性实施方式做出许多修改,而且在不背离如权利要求限定的本发明的精神和范围下可以设计出其他安排。
- 还没有人留言评论。精彩留言会获得点赞!