利伐斯的明透皮组合物及其使用方法与流程
本申请根据35U.S.C.§119(e)要求2014年4月8日提交的美国临时专利申请序列号第61/976,697号的申请日的优先权;该申请的披露内容通过引用并入本文。
背景技术:
乙酰胆碱是与记忆相关的重要的神经递质。在患有痴呆(例如,阿尔茨海默病)的受试者中胆碱能神经传递的缺陷已经导致胆碱酯酶抑制剂作为该疾病症状的一线治疗的发展。这些药剂的临床益处包括认知改善、稳定或低于预期的认知、功能和行为的衰退。
胆碱酯酶抑制剂的常见作用机制是通过抑制分解代谢酶乙酰胆碱酯酶增加可用的乙酰胆碱。现在认识到胆碱酯酶抑制剂,包括多奈哌齐、加兰他敏和利伐斯的明,在阿尔茨海默病患者的许多脑区域中降低乙酰胆碱酯酶活性。在乙酰胆碱酯酶抑制和观察到的认知改善之间也存在显著相关性。作为一类,目前批准的胆碱酯酶抑制剂(多奈哌齐、加兰他敏、利伐斯的明和他克林)在阿尔茨海默病患者中提供重要的益处,并且这些药物在痴呆的管理中提供显著的进步。
利伐斯的明,即(S)-3-[1-(二甲基氨基)乙基]苯基N-乙基-N-甲基氨基甲酸酯(商品名)抑制乙酰胆碱酯酶和丁酰胆碱酯酶二者。通过抑制胆碱酯酶介导的乙酰胆碱降解,利伐斯的明提高了脑中乙酰胆碱的持久性,包括在低乙酰胆碱水平与与阿尔茨海默病和帕金森病相关的记忆问题(痴呆)相关的脑区域中。
技术实现要素:
本发明提供了利伐斯的明透皮组合物。各方面的该透皮组合物均包含:活性剂层,该活性剂层包含利伐斯的明和溶解度调节剂,例如交联的丙烯酸聚合物。本发明还提供了使用该透皮组合物的方法和含有该透皮组合物的试剂盒。
附图说明
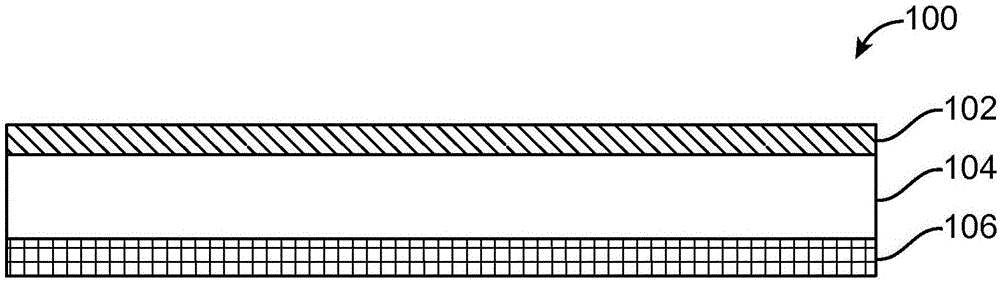
图1示出根据本发明的一个实施方案的利伐斯的明透皮组合物。
图2示出根据本发明的一个实施方案的利伐斯的明透皮组合物。
图3示出根据本发明的一个实施方案的利伐斯的明透皮组合物。
图4示出活性剂层的涂层重量不同的示例性双层透皮组合物的利伐斯的明通量特征的图。
图5示出在活性剂层中具有不同量的交联的丙烯酸聚合物的示例性双层透皮组合物以及在活性剂层中没有交联的丙烯酸聚合物的贴剂的利伐斯的明通量特征的图。
图6示出根据本发明的示例性双层透皮组合物的利伐斯的明通量特征的图。
图7示出根据本发明的示例性双层透皮组合物的利伐斯的明通量特征的图,该透皮组合物在活性剂层中具有5%交联的丙烯酸聚合物且在皮肤粘合剂层中具有不同的压敏粘合剂。
图8示出根据本发明的示例性三层透皮组合物的利伐斯的明通量特征的图,该透皮组合物具有不包含交联的丙烯酸聚合物的第一活性剂层、包含交联的丙烯酸聚合物的第二活性剂层、和皮肤粘合剂层。所示的四个实施例在第一活性剂层中没有交联的丙烯酸聚合物,在第二活性剂层中具有不同量的交联的丙烯酸聚合物。
图9示出比较根据本发明的含膜和不含膜的示例性透皮组合物的利伐斯的明的通量特征的图。
图10示出比较根据本发明的含膜和不含膜的示例性透皮组合物的利伐斯的明通量特征的图。
图11A至11D示出在小型猪试验中观察到的结果的图,如下文实验部分所详述。
图12示出比较在小型猪试验中用两种局部制剂(一种具有卡波姆,一种不具有卡波姆)观察到的结果的图,如下文实验部分所详述。
具体实施方案
本发明提供了利伐斯的明透皮组合物。各方面的该透皮组合物均包含:活性剂层,该活性剂层包含利伐斯的明和溶解度调节剂,例如交联的丙烯酸聚合物。本发明还提供了使用该透皮组合物的方法和含有该透皮组合物的试剂盒。
在更加详细地描述本发明之前,应理解,本发明不限于所述的特定实施方案,所述的实施方案当然可以变化。还应理解,本文中使用的术语仅仅是为了描述特定的实施方案,而不是意在进行限制,本发明的范围将仅由所附权利要求限定。
当提供数值范围时,应理解,除非在文中另有明确指出,该范围的上限和下限之间的每一个居间值(至下限单位的十分之一)以及该指定范围内的任何其他指定值或居间值都包括在本发明中。这些较小范围的上限和下限可独立地包括在该较小范围内并且也包括在本发明内,受到该指定范围中的任何具体排除的限制。当该指定范围包括上限和下限中的一者或二者时,本发明也包括排除所包括的上限和下限中一者或二者的范围。
本文中提到的某些范围的数值之前有术语“约”。本文中使用的术语“约”为在其后的准确数值以及接近或近似于该术语之后的数值的数值提供了文字支持。在确定一个数值是否接近或近似于具体提及的数值时,接近或近似的未提及数值可以是在其出现的上下文中提供了基本上相等于明确提及的数值的数值。
除非另外定义,本文中使用的所有科技术语具有本发明所属技术领域的普通技术人员的通常理解相同的含义。尽管与本文所述相似或等同的任何方法和材料也能够用在本发明的实施或测试中,但是现在描述代表性的示例性方法和材料。
本说明书中引用的所有出版物和专利均通过引用的方式结合于本文,就如同具体地和单独地说明了以引用方式结合的每一篇出版物或专利并且其以引用方式结合于本文以披露和描述与所引用的出版物相关的方法和/或材料。任一出版物的引用是出于其在申请日之前的披露内容,并且不应被解释为承认本发明由于在先发明而晚于该出版物。而且,所提供的公开日可以不同于实际公开日,实际公开日可能需要单独确认。
应注意,如本文和所附权利要求中使用的,除非上下文中另外明确指出,单数形式“一个”、“一种”和“该”包括复数对象。还应注意,权利要求可被撰写为排除任意可选的要素。由此,这种描述意在起到使用与权利要求要素的引用相关的如“唯一”、“仅仅”等这样的排除性术语或使用“否定性”限制的前置基础的作用。
如本领域技术人员在阅读本文公开内容之后显而易见的,本文中所描述和举例说明的每一单独实施方案都具有单独的组分和特征,这些单独的组分和特征可容易地与其他多个实施方案中的任一个的特征分离或组合,而不背离本发明的范围或精神。可以以所述事件的次序或逻辑上可能的任意其他次序实施任意所述方法。
在进一步描述本发明的各种实施方案中,首先更加详细地描述了该透皮组合物的各方面,接着详细描述了使用该透皮递送系统的实施方案并评述了包括该透皮递送系统的试剂盒。
利伐斯的明透皮组合物
如上所述,本文提供了利伐斯的明透皮组合物。该透皮组合物包括包含利伐斯的明和交联的丙烯酸聚合物的活性剂层。在某些方面,利伐斯的明以10%w/w或更多(例如,20%w/w或更多)的量存在。在一些情况下,该透皮组合物还包括背衬层和可剥离的释放衬垫。
本发明的透皮组合物是一种被配置为当局部施加于受试者的皮肤表面时向受试者透皮递送活性剂特别是利伐斯的明的制剂。本发明的组合物包括含利伐斯的明的活性剂层,其中含利伐斯的明的活性剂层被配制为当将该组合物局部施加于受试者时向所述受试者提供治疗有效量的利伐斯的明的多天递送。多天递送意指该层被配制为当将该组合物施加于受试者的皮肤部位时,在1天或更长,诸如2天或更长,例如,3天或更长,诸如4天或更长,诸如5天或更长,诸如6天或更长,包括7天或更长,诸如10天或更长,在一些情况下为14天或更短,诸如10天或更短的时间期间内向所述受试者提供治疗有效量。治疗有效量意指当在预期的施加时间内(例如施加的7天内)将该组合物施加于受试者的皮肤部位时,该组合物提供具有所需治疗活性的全身量(systemic amount)的利伐斯的明。在一些实施方案中,该组合物在一周的时间内(即,7天或168小时)提供目标剂量的活性剂递送、即、4.0mg/天或更大,包括在一周的时间内9.5mg/天或更大,例如在一周的时间内13.3mg/天或更大,其中,在一些情况下,目标剂量为在一周内30mg/天或更小,诸如20mg/天或更小。
根据本发明某些实施方案的透皮组合物在一个延长的时间期间表现出利伐斯的明的治疗上足够的通量。在一个延长的时间期间内的利伐斯的明的治疗上足够的通量可以定义为,在第一天的平均递送通量不应大于来自使用(wear)的最后一天的平均每日通量的固定标准,例如第1天和第3天或第1天和第7天。固定标准可以在5倍到1倍内变化,例如4倍到1.25倍,其中在一些情况下,固定标准为3倍,或2倍或1.5倍。观察到基本上是该通量的延长的时间期间可以变化,并且在一些情况中为24小时或更长,例如48小时或更长,包括72小时或更长,例如96小时或更长,包括120小时或更长,诸如144小时或更长,例如168小时或更长,包括240小时或更长。尽管实际通量可以不同,但在一些情况下(例如,利用下文中实验部分所述的皮肤渗透试验所确定的),该组合物提供的皮肤渗透速率为1μg/cm2/小时或更大,诸如4μg/cm2/小时或更大,例如5μg/cm2/小时或更大,包括6μg/cm2/小时或更大,其中,在一些情况下,通量为40μg/cm2/小时或更小,诸如20μg/cm2/小时或更小。
在某些方面,例如在延长的时间(例如,2至10天,包括5天或更多天,例如7天或更多天)期间内,治疗通量的范围为1至40μg/cm2/小时,诸如1至20μg/cm2/小时,诸如2至20μg/cm2/小时,诸如2至15μg/cm2/小时,包括5至15μg/cm2/小时。
如本文所述的透皮组合物提供所需的Cmin/Cmax。Cmin/Cmax是指在使用期(wear period)(例如,3天或更多天,诸如5天或更多天,包括7天或更多天)内利伐斯的明的最小血浆(plasma)水平与最大血浆水平之比,并且是在使用期内从局部制剂消耗的利伐斯的明的量度。如果Cmin/Cmax低,可以得出结论,即局部制剂(topical formulation)在使用期间内不保留药物施用,并且血液浓度在使用期间内持续降低。在一些情况下,局部制剂提供0.4或更高,诸如0.5或更高的Cmin/Cmax,其中在一些情况下Cmin/Cmax为1.0或更低,诸如0.75或更低,例如0.6或更低。
透皮组合物的尺寸(即,面积)可以变化。在某些实施方案中,根据活性剂的所需透皮通量率(flux rate)和目标剂量来选择该组合物的尺寸。例如,如果透皮通量为40μg/cm2/小时且目标剂量为12mg/天,则选择面积为5至15cm2范围的透皮组合物。或者例如,如果透皮通量为20μg/cm2/小时且目标剂量为6mg/天,则选择面积为5至15cm2范围的透皮贴剂。在某些方面中,当施加于范围为10至200cm2,例如20至150cm2,包括40至140cm2,例如60cm2的皮肤部位时,组合物的尺寸选择成能够覆盖皮肤的面积。根据某些实施方案,活性剂层的尺寸为5至75cm2,诸如15至60cm2,例如10至50cm2,包括20至50cm2,例如20至40cm2,包括35cm2。
组合物的含利伐斯的明的活性剂层的涂层重量可以变化。在一些情况下,活性剂层的涂层重量为2.5mg/cm2至100mg/cm2,诸如2.5mg/cm2至50mg/cm2,诸如5mg/cm2至20mg/cm2,例如7.5mg/cm2至15mg/cm2,包括9mg/cm2至12mg/cm2的涂层重量。由于制造中的困难和成本随着较厚的活性剂层增加而较厚的层可使药物的消耗较少从而在使用期间具有较小的减少通量,因此在一些情况下,采用代表这些参数的平衡(balance)的涂层重量,例如,涂层重量为10至90mg/cm2,诸如20至70mg/cm2,且包括25至50mg/cm2。
根据本发明某些实施方案的透皮组合物的一个方面在于其储存稳定。储存稳定意指该组合物可储存延长的时间期间而不会发生显著降解和/或利伐斯的明活性的显著降低。在某些实施方案中,当保持在如WHO技术报告序列第953(2009)号中所定义的25℃和60%RH时,本发明的组合物在6个月或更长,例如1年或更长,包括18个月或更长,2年或更长,例如3年或更长等的时间内是稳定的。在一些情况下,在约60℃下储存至少一个月之后,该组合物中利伐斯的明的量与该组合物中利伐斯的明的初始量之比为50%或更大,60%或更大,诸如70%或更大,包括80%或更大,或更大,包括90%或更大,95%或更大,98%或更大,包括99%或更大,在一些情况下,达到100%或更大,这解释为涂层配药中的实验误差和变化。
在一些情况下,透皮组合物被配置为单层组合物。“单层”是指透皮递送装置仅包括单层的含活性剂的基质,并且不包括用于压敏粘合剂、透皮活性剂层等的单独的不同层。同样,本发明的单层透皮递送装置不进一步包括与压敏粘合剂分离的单独的活性剂储存器(即,活性剂储存器)。因此,本发明的单层透皮组合物可以在单一基质中包括实施本发明方法所需的一定量的透皮组合物的每种组分,如下文更详细描述。例如,在一些实施方案中,感兴趣的单层透皮组合物包括利伐斯的明的单层基质和粘合剂。根据一些实施方案,本发明的组合物包括背衬和含利伐斯的明的活性剂层。该组合物可以进一步包括释放衬垫。例如,图1示出了根据本发明的一个实施方案的透皮组合物100,其中组合物100包括背衬102、含利伐斯的明的活性剂层104和释放衬垫106。
在某些方面,本发明的组合物包括背衬、含利伐斯的明的活性剂层和粘合剂层。这样的组合物可以进一步包括释放衬垫。例如,图2示出了根据本发明的一个实施方案的透皮组合物200,其中组合物200包括背衬202、含利伐斯的明的活性剂层204、皮肤粘合剂层206和释放衬垫208。该组合物可以包括膜(未示出),例如在活性剂层204和皮肤粘合剂层206之间,在活性剂层204内,和/或在皮肤粘合剂层206内。在两层粘合剂彼此接触的实施方案中,多孔材料例如非织物、织物、纸,膜或其它局部良好耐受的多孔材料可以包括在粘合剂层之间,以使冷流最小化并提供额外的机械强度。
根据某些实施方案,本发明的组合物是三层组合物。在某些方面中,三层组合物包括背衬、包含交联的丙烯酸聚合物的第一含利伐斯的明的活性剂层、可包含或可不包含交联的丙烯酸聚合物的第二含利伐斯的明的活性剂层、和粘合剂层。这样的组合物可以进一步包括释放衬垫。例如,图3示出了根据本发明的一个实施方案的透皮组合物300,其中组合物300包括背衬302、包括交联的丙烯酸聚合物的第一含利伐斯的明的活性剂层304、不包括交联的丙烯酸聚合物的第二含利伐斯的明的活性剂层306、皮肤粘合剂层308、和释放衬垫310。组合物可包括膜(未示出),例如在第一含利伐斯的明的活性剂层304和第二含利伐斯的明的活性剂层306之间,在第二含利伐斯的明的活性剂层306和皮肤粘合剂层308之间,在第一含利伐斯的明的活性剂层304内,在第二含利伐斯的明的活性剂层306内,和/或在皮肤粘合剂层308内。现在对这些层和其它组分进行更详细的描述。
本发明的透皮组合物可以包括两层或更多层,其中该组合物包括含交联的丙烯酸聚合物的活性剂层和不包括交联的丙烯酸聚合物的皮肤粘合剂层。在使用中,这种组合物的皮肤粘合剂层是直接接触受试者皮肤部位表面的层。因为某些交联的丙烯酸聚合物表现出可能影响来自含交联的丙烯酸聚合物的活性剂层的利伐斯的明的通量的吸湿性能,所以在某些方面,皮肤粘合剂层减少或防止由活性剂层中交联的丙烯酸聚合物导致的水分摄取,例如来自局部施用该组合物的受试者的皮肤部位的水分(例如汗液)。根据某些实施方案,基于受试者之间的不同皮肤水分水平例如以不同速率产生皮肤水分(例如汗液)的受试者,皮肤粘合剂层减少或消除利伐斯的明通量的潜在变化性。因此,皮肤粘合剂层至少起到促进透皮组合物粘附到受试者皮肤部位和减少或防止由活性剂层中交联的丙烯酸聚合物导致的水分摄取的双重作用。
第一活性剂层
如上所述,本发明的透皮组合物包括含利伐斯的明的活性剂层,例如存在于背衬的表面上。利伐斯的明是具有经验式C14H22N2O2的、乙酰胆碱酯酶和丁酰胆碱酯酶的抑制剂。利伐斯的明化学上已知为(S)-3-[1-(二甲基氨基)乙基]苯基N-乙基-N-甲基氨基甲酸酯,并具有下式:
感兴趣的活性剂层包括以10%至75%w/w,诸如15%至50%w/w,包括20%至40%w/w,例如30%w/w的量存在的利伐斯的明。在某些方面,利伐斯的明以5%w/w或更多,10%w/w或更多,15%w/w或更多,20%w/w或更多,25%w/w或更多,30%w/w或更多,35%w/w或更多,40%w/w或更多或45%w/w或更多的量存在于活性剂层中。根据某些实施方案,利伐斯的明以50%w/w或更少,45%w/w或更少,40%w/w或更少,35%w/w或更少,30%w/w或更少,25%w/w或更少,20%w/w或更少,或15%w/w或更少的量存在于活性剂层中。
利伐斯的明可以作为游离碱或盐存在于活性剂层中。根据某些方面,利伐斯的明作为盐存在。感兴趣的利伐斯的明盐包括但不限于利伐斯的明酒石酸盐,利伐斯的明盐酸盐等。
在某些实施方案中,例如为了在延长的使用期间提供更好的皮肤粘附,背衬可以由多个层组成。特别地,可以含有或可以不含有活性剂的粘合剂层可以与背衬接触。在某些情况下,背衬具有比活性剂储存器更大的表面积,例如大5%或更多,例如10%或更多,包括15%或更多。在这样的实施方案中,可以保持最少活性剂的粘合剂,例如聚异丁烯基粘合剂与背衬的整个表面积接触。此外,在该实施方案中,具有最小活性剂含量的该粘合剂层的中心部分可以与活性剂粘合剂层或分离两个粘合剂层的另一背衬层接触。
如上所述,第一活性剂层包括溶解度调节剂。溶解度调节剂可以是溶解度增强剂。在一些情况下,溶解度调节剂进一步用作“冷流减速剂(cold flow reducer)”,使得其即便不是抑制也能阻碍活性剂从活性剂层例如其粘合剂中释放。在一些情况下,溶解度调节剂例如增强剂是聚合的溶解度调节剂,例如交联的丙烯酸聚合物。交联的丙烯酸聚合物包括包含一种或多种丙烯酸单体的交联聚合物。在某些方面,交联聚合物的10%或更多、20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、90%或更多、95%或更多的单体是丙烯酸单体。根据某些实施方案,交联聚合物的95%或更少、90%或更少、80%或更少、70%或更少、60%或更少、50%或更少、40%或更少、30%或更少、20%或更少或10%或更少的单体是丙烯酸单体。
交联的丙烯酸聚合物可以变化。在某些方面,交联的丙烯酸聚合物是包括任何所需比例的丙烯酸单体和非丙烯酸单体的共聚物。在其它方面,交联的丙烯酸聚合物是交联的丙烯酸均聚物,其中聚合物包括丙烯酸单体并且不包括非丙烯酸单体。这种聚合物具有以下通式:
感兴趣的交联丙烯酸聚合物包括卡波姆(carbomer)聚合物,其是高分子量、交联的非线性聚丙烯酸聚合物。感兴趣的卡波姆聚合物包括但不限于市售聚合物(Lubrizol Corp.,Wickliffe,OH)。用于本发明的组合物的活性剂层中的聚合物包括例如934P、974P、71G、971P、980、981、5984、ETD 2020、Ultrez 10、934、940、941、1342或其任意组合。
根据某些实施方案,交联的丙烯酸聚合物是与蔗糖的烯丙基醚交联的丙烯酸均聚物。在某些方面中,与蔗糖的烯丙基醚交联的丙烯酸均聚物可以具有每个蔗糖分子平均4至6个烯丙基。例如,交联的丙烯酸聚合物可以是974P聚合物。
在其它方面,交联的丙烯酸聚合物是与季戊四醇的烯丙基醚交联的丙烯酸均聚物。可存在于本发明的透皮组合物的活性剂层中的与季戊四醇的烯丙基醚交联的此类丙烯酸均聚物包括但不限于974P聚合物。
根据某些实施方案,交联的丙烯酸聚合物是与二乙烯基乙二醇交联的丙烯酸均聚物。例如,可存在于第一活性剂层中的与二乙烯基乙二醇交联的丙烯酸聚合物包括但不限于AA-1聚卡波非聚合物(Lubrizol Corp.,Wickliffe,OH)。
尽管交联的丙烯酸聚合物的分子量可以变化,但在一些情况下,分子量的范围为1,000至100,000,000,例如3,000至10,000,000,包括10,000至5,000,000。
在某些方面,交联的丙烯酸聚合物以1%至30%w/w,诸如1%至20%w/w,诸如1%至10%w/w、诸如2%至8%w/w,包括3%至7%w/w,例如4%至6%w/w的量存在于第一活性剂层中。根据某些实施方案,交联的丙烯酸聚合物以2%w/w或更多、3%w/w或更多、4%w/w或更多、5%w/w或更多、6%w/w或更多、7%w/w或更多、8%w/w或更多、9%w/w或更多、10%w/w或更多、11%w/w或更多、12%w/w或更多、13%w/w或更多、14%w/w或更多、或15%w/w或更多的量存在于活性剂层中。在某些方面中,交联的丙烯酸聚合物以10%w/w或更少、9%w/w或更少、8%w/w或更少、7%w/w或更少、6%w/w或更少、5%w/w或更少、4%w/w或更少、3%w/w或更少或2%w/w或更少的量存在于活性剂层中。
活性剂层可以包括另外的组分。例如,除了交联的丙烯酸聚合物之外,活性剂层还可以包括一种或多种聚合物组分。感兴趣的非交联丙烯酸聚合物包括但不限于甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物。根据某些实施方案,活性剂层包括以2%至30%w/w、5%至25%w/w、10%至20%w/w、包括15%w/w的量存在的甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物。在某些方面中,甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物是具有下式的B共聚物:
活性剂层可以进一步包括压敏粘合剂。术语“压敏粘合剂”意指当施加压力以使粘合剂与表面粘合时形成结合的粘合剂。在一些情况下,粘合剂是其中无需溶剂、水、或热来活化粘合剂的粘合剂。对于压敏粘合剂而言,结合强度(bond strength)的程度与用于向表面施加粘合剂的压力的量成正比。
感兴趣的压敏粘合剂包括存在于有机溶剂中的丙烯酸酯共聚物。感兴趣的丙烯酸酯共聚物包括各种单体的共聚物,所述单体可以是“软”单体、“硬”单体和可选择地“功能性”单体。感兴趣的还有包括这样的共聚物的共混物。丙烯酸酯共聚物可由包括二聚物(即由两个单体制成)、三聚物(即由三个单体制成)、或四聚物(即由四个单体制成)的共聚物,或由甚至更多数量的单体制成的共聚物组成。丙烯酸酯共聚物可包括交联的和非交联的聚合物。可通过已知方法交联聚合物以提供所需的聚合物。
用于制造丙烯酸酯共聚物的单体包括至少两种或更多种选自以下的示例性组分:丙烯酸、丙烯酸烷基酯、甲基丙烯酸酯、可共聚的二次单体。感兴趣的单体(“软”单体和“硬”单体)包括但不限于丙烯酸甲氧基乙基酯、丙烯酸乙酯、丙烯酸丁酯、甲基丙烯酸丁酯、丙烯酸己酯、甲基丙烯酸己酯、丙烯酸2-乙基丁基酯、甲基丙烯酸2-乙基丁基酯、丙烯酸异辛酯、甲基丙烯酸异辛酯、丙烯酸2-乙基己基酯、甲基丙烯酸2-乙基己基酯、丙烯酸癸酯、甲基丙烯酸癸酯、丙烯酸十二烷基酯、甲基丙烯酸十二烷基酯、丙烯酸十三烷基酯、甲基丙烯酸十三烷基酯、丙烯腈、丙烯酸甲氧基乙基酯、甲基丙烯酸甲氧基乙基酯等。在Satas,“Acrylic Adhesives(丙烯酸粘合剂)”,Handbook of Pressure-Sensitive Adhesive Technology(压敏粘合剂技术手册),第2版,第396-456页(D.Satas编著),Van Nostrand Reinhold,New York(1989)中描述了丙烯酸粘合剂单体的其他实例。
在某些方面,压敏粘合剂是共聚物,例如丙烯酸酯共聚物。感兴趣的基于丙烯酸酯共聚物的压敏粘合剂包括但不限于和压敏粘合剂。根据某些实施方案,活性剂层包括选自以下的基于丙烯酸酯共聚物的压敏粘合剂:87-2353、387-2353、87-900A,87-9301、87-4098、87-2510、387-2510、87-2287、387-2287、87-4287、87-2516、387-2516、87-2074、87-235A、87-2852、87-2051、387-2051、87-2052、387-2052、87-2054、387-2054、87-2194、87-2196、GMS 3083、GMS 3253、GMS 788、GMS 9073或其任意组合。例如根据需要,还可以包括聚异丁烯(PIB)、硅树脂(silicone)和苯乙烯-异戊二烯-苯乙烯(SIS)(例如,SIS聚合物)。
根据某些实施方案,当活性剂层包含压敏粘合剂时,压敏粘合剂以5%至80%w/w(例如,5至75%w/w)、诸如20%至80%w/w、诸如25%至75%w/w,例如40%至60%、包括45%至55%,例如49%w/w至51%w/w的量存在。
在某些方面中,活性剂层包括抗氧化剂。在活性剂层中可以使用任何合适的抗氧化剂。根据某些实施方案,活性剂层包括选自维生素E或其它生育酚类似物的抗氧化剂,包括生育酚乙酸酯或TPGS、柠檬酸、抗坏血酸、亚硫酸钠、抗坏血酸棕榈酸酯、焦亚硫酸钠、没食子酸烷基酯或其任意组合。抗氧化剂可以以任何所需量存在,包括0.01%至5.0%,诸如0.05%至3%,包括0.075%至1%,例如0.1%。
在某些方面中,例如如上所述的包括交联的丙烯酸的第一活性剂层包括基本上很少的水(如果有的话)。“基本上很少”是指2.5%(w/w)或更少,诸如1.5%(w/w)或更少,1.0%(w/w)或更少,0.5%(w/w)或更少,0.25%(w/w)或更少,包括没有溶剂,例如水。根据某些实施方案,活性剂层不包括任何水,即,粘合剂层包括0%的水。粘合剂层
如上所述,本发明的透皮组合物除了活性剂层之外还可以包括一个或多个层。例如,组合物可以包括粘合剂层,例如,其设置在活性剂层的与背衬相反的一侧上。根据某些实施方案,当本发明的透皮组合物包括粘合剂层时,粘合剂层的涂层重量可以为0.5mg/cm2至8mg/cm2,诸如1mg/cm2至7mg/cm2,诸如1.5mg/cm2至6mg/cm2,包括2mg/cm2至5mg/cm2,诸如2.5mg/cm2至4mg/cm2,例如3mg/cm2。粘合剂层的尺寸与活性剂层的尺寸相比可以相同或不同。例如,粘合剂层的尺寸(cm2)可以与活性剂层相同、比活性剂层大或小。根据某些实施方案,粘合剂层的尺寸为5至75cm2,诸如10至50cm2,例如20至40cm2。
粘合剂层可以由任何合适的组分制成。在某些方面中,粘合剂层包括压敏粘合剂。压敏粘合剂可以以50%至100%,诸如75%至100%,诸如85%至100%,诸如90%至100%,包括95%至100%,例如99%至100%(例如98.9%或99.9%)的量存在(应注意的是,这些百分比是在例如通过蒸发除去溶剂之后的百分比)。
在某些方面,压敏粘合剂是聚合物粘合剂,诸如丙烯酸酯共聚物粘合剂。在本发明的组合物中使用的丙烯酸酯共聚物粘合剂包括但不限于和压敏粘合剂。当粘合剂层包括基于丙烯酸酯共聚物的压敏粘合剂时,丙烯酸酯共聚物可以缺少侧基官能团(例如,共聚物不包括-COOH官能团和/或-OH官能团)。缺少侧链官能团的压敏粘合剂的非限制性实例包括87-900A、87-9301、87-4098、GMS 3083、GMS 3253和其组合。
当粘合剂层包括基于丙烯酸酯共聚物的压敏粘合剂时,丙烯酸酯共聚物可以包括侧基官能团(例如,共聚物包括-COOH官能团和/或-OH官能团)。包括侧基官能团的压敏粘合剂的非限制性实例包括87-2510、387-2510、87-2287、387-2287、87-4287、87-2516、387-2516、87-2074、87-235A、87-2353、387-2353,87-2852、87-2051、387-2051、87-2052、387-2052、87-2054、387-2054、87-2194、87-2196、GMS 788和GMS 9073。
在某些方面中,粘合剂层包括基于硅氧烷的压敏粘合剂(例如,包括硅氧烷的压敏粘合剂)。感兴趣的基于硅氧烷的压敏粘合剂包括但不限于通过硅烷醇封端的聚二甲基硅氧烷(PDMS)与硅酸酯树脂(silicate resin)的缩合反应制备的粘合剂。然后可以用三甲基甲硅烷氧基封端残余的硅烷醇官能团,得到化学稳定的胺相容性粘合剂。这种粘合剂可以具有下式:
这种基于硅氧烷的压敏粘合剂的非限制性实例包括以商品名BIO-PSA(DowMidland,MI)出售的市售粘合剂,并且包括BIO-PSA 7-4301、BIO-PSA 7-4302、BIO-PSA 7-4101、BIO-PSA 7-4201、BIO-PSA 7-4102和BIO-PSA 7-4202。在某些方面,粘合剂层的压敏粘合剂是包括聚丁烯(例如聚异丁烯(PIB))的粘合剂。这种粘合剂可以进一步包括增粘剂。例如,可以包括在本发明的透皮组合物的粘合剂层中的粘合剂是包括聚异丁烯的粘合剂。
粘合剂层可以包括任何合适的压敏粘合剂,其单独或与任何其它压敏粘合剂组合。例如,粘合剂层可以包括选自9301和BIO-PSA 7-4302的单一种类的压敏粘合剂。在其它方面,粘合剂层可以包括压敏粘合剂的组合(例如,共混物),其包括上述基于丙烯酸酯共聚物和/或基于硅氧烷的压敏粘合剂中的两种或更多种的任意组合。
根据某些实施方案,粘合剂层包括抗氧化剂。在粘合剂层中可以使用任何合适的抗氧化剂。在某些方面,活性剂层包括选自维生素E类似物的抗氧化剂,包括TPGS的生育酚乙酸酯、柠檬酸、抗坏血酸、亚硫酸钠、抗坏血酸棕榈酸酯、焦亚硫酸钠、没食子酸烷基酯或其任意组合。抗氧化剂可以以任何所需的量存在,包括0.01%至0.5%,诸如0.05%至0.25%,包括0.075%至0.2%,例如0.1%。
可以包括在粘合剂层中的附加组分包括例如油。粘合剂层中的油的量可以变化,并且在某些方面中,选择油的量以实现具有期望粘性的粘合剂层。根据某些实施方案,油以0.1%至5%w/w,例如0.5%至2.5%w/w,包括0.75%至1.5%w/w,例如1%w/w的量存在。感兴趣的油包括但不限于硅油(例如,Q7-9120硅油(DowMidland,MI))。
本发明的透皮组合物中的任何层可以含有经皮吸收增强剂。经皮吸收增强剂可以促进受试者的皮肤对利伐斯的明的吸收。经皮吸收增强剂也可以称为经皮渗透增强剂,因为其不仅可以促进利伐斯的明的经皮吸收,而且可以促进利伐斯的明通过受试者皮肤的经皮渗透。
经皮吸收增强剂可包括但不限于以下:脂族醇,例如但不限于具有12至22个碳原子饱和或不饱和的高级醇,如油醇和月桂醇;脂肪酸,例如但不限于亚油酸、油酸、亚麻酸、硬脂酸、异硬脂酸和棕榈酸;脂肪酸酯,例如但不限于肉豆蔻酸异丙酯、己二酸二异丙酯、棕榈酸异丙酯;醇胺,例如但不限于三乙醇胺、三乙醇胺盐酸盐和二异丙醇胺;多羟基醇烷基醚,例如但不限于多羟基醇如甘油、乙二醇、丙二醇、1,3-丁二醇、二甘油、聚甘油、二甘醇、聚乙二醇、一缩二丙二醇、聚丙二醇、脱水山梨糖醇、山梨醇、异山梨醇、甲基葡糖苷、寡糖和还原性低聚糖的烷基醚,其中在多羟基醇烷基醚中的烷基部分的碳原子数优选为6至20;聚氧乙烯烷基醚,例如但不限于这样的聚氧乙烯烷基醚,即其中烷基部分的碳原子数为6至20且聚氧乙烯链的重复单元(例如,-O-CH2CH2-)的数目为1至9,例如但不限于聚氧乙烯月桂基醚、聚氧乙烯十六烷基醚、聚氧乙烯硬脂基醚和聚氧乙烯油烯基醚;甘油酯(即,甘油的脂肪酸酯),例如但不限于具有6至18个碳原子的脂肪酸的甘油酯,其中甘油酯可为单甘油酯(即,通过酯键共价结合到一个脂肪酸链的甘油分子)、甘油二酯(即,通过酯键共价结合到两个脂肪酸链的甘油分子)、甘油三酯(即,通过酯键共价结合到三个脂肪酸链的甘油分子)或其组合,其中形成甘油酯的脂肪酸组分包括但不限于辛酸、癸酸、十二烷酸、十四烷酸、十六烷酸、十八烷酸(即,硬脂酸)和油酸;多羟基醇的中链脂肪酸酯;乳酸烷基酯;二元酸烷基酯;酰化氨基酸;吡咯烷酮;吡咯烷酮衍生物;以及它们的组合。
其他类型的经皮吸收增强剂包括但不限于乳酸、酒石酸、1,2,6-己三醇、苄醇、羊毛脂、氢氧化钾(KOH)和三(羟甲基)氨基甲烷。
经皮吸收增强剂的具体实例包括但不限于甘油单油酸酯(GMO)、脱水山梨醇单月桂酸酯(SML)、脱水山梨糖醇单油酸酯(SMO)、月桂醇聚醚-4(LTH)以及它们的组合。
在某些情况下,层(例如活性剂层和/或粘合剂层)含有的经皮吸收增强剂的量为2%至25%(w/w),如5%至20%(w/w),并包括5%至15%(w/w)。在某些情况下,层含有的经皮吸收增强剂的量为约5%(w/w),约10%(w/w),约15%(w/w),或约20%(w/w)。
在某些方面,本发明的透皮组合物不包括经皮吸收增强剂或经皮渗透增强剂。
第二活性剂层
在某些方面,本发明的透皮组合物包括第二含利伐斯的明的活性剂层,例如存在于第一活性剂层和背衬之间。第二活性剂层可以包括上面描述的关于第一活性剂层的任何特征。例如,第二活性剂层可以包括如上所述的任何聚合物组分(例如,一种或多种交联的丙烯酸聚合物,一种或多种共聚物(例如甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物),压敏粘合剂聚合物),抗氧化剂等。
在某些方面,本发明的利伐斯的明透皮组合物是三层组合物,其包括包含交联的丙烯酸聚合物的第一活性剂层、粘合剂层和可以包含或可以不包含交联的丙烯酸聚合物的第二活性剂层,其中第二活性剂层设置在第一活性剂层的与粘合剂层相反的一侧上,例如在背衬和第一活性剂层之间。第二活性剂层的涂层重量可以变化。在某些方面,第二活性剂层的涂层重量为2.5mg/cm2至25mg/cm2。根据某些实施方案,第二活性剂层不包括交联的丙烯酸聚合物。
根据某些实施方案,第二活性剂层不包括水,即第二活性剂层包括0%的水。
膜或支撑层
根据某些实施方案,本发明的透皮组合物包括一层或多层膜。当组合物包括一层膜时,该膜可以设置在组合物的两层之间,在组合物的层内(例如,在活性剂层内或在粘合剂层内),或者以任何其它期望的配置设置。例如,当透皮组合物是包括第一活性剂层和粘合剂层的双层组合物时,膜可以设置在第一活性剂层和粘合剂层之间。还例如,当透皮组合物是包括第一活性剂层、第二活性剂层和粘合剂层的三层组合物时,膜可以设置在第一活性剂层和第二活性剂层之间,在第一活性剂层和粘合剂层之间,或二者。
在某些方面,本发明的透皮组合物中包括膜导致更高地控制释放活性剂和/或减少或消除在不存在膜时组合物显示的任何“冷流”。冷流是某些压敏粘合剂的一种性质,其中在储存期间或当组合物施用于患者时,粘合剂迁移出透皮组合物(例如贴剂)的边缘。过度的冷流可导致过度粘附到其中储存组合物的任何包装的内表面,在从包装中取出组合物期间释放衬垫的分离,组合物周围的粘合剂在施用组合物的患者皮肤上的沉积,和/或类似情况。
当在本发明的透皮组合物中使用一层或多层膜时,膜可以由任何合适的材料制成。在某些方面,膜由选自以下的材料制成:单层聚丙烯(例如,PP单层聚丙烯膜),聚乙烯(例如PE聚乙烯膜),含乙酸乙烯酯的材料(例如3MTM CoTranTM乙酸乙烯酯膜,例如3MTM CoTranTM 9707膜、3MTM CoTranTM 9726膜等),非织物或织物片,或其任意组合。
背衬
如上所述,感兴趣的透皮组合物可以包括背衬(即,支撑层)。在某种程度上背衬可以是柔性的,使得它能够与受试者的期望的局部部位紧密接触。背衬可由不吸收活性剂并且不允许活性剂从支撑层那侧释放的材料制成。背衬可以包括但不限于无纺布、织布、膜(包括薄片(sheet))、多孔体、泡沫体、纸、通过将膜层压到无纺布或织布上获得的复合材料以及它们的组合。背衬层还可以层叠至另一粘合剂层,例如PIB粘合剂层可以用作闭塞层。
无纺布可以包括但不限于以下:聚烯烃树脂,例如聚乙烯和聚丙烯;聚酯树脂,例如聚对苯二甲酸乙二酯、聚对苯二甲酸丁二酯和聚萘二甲酸乙二酯;人造丝(rayon)、聚酰胺、聚酯醚、聚氨酯、聚丙烯酸类树脂(polyacrylic resin)、聚乙烯醇、苯乙烯-异戊二烯-苯乙烯共聚物和苯乙烯-乙烯-丙烯-苯乙烯共聚物;以及它们的组合。织布可以包括但不限于:棉、人造丝、聚丙烯酸类树脂、聚酯树脂、聚乙烯醇以及它们的组合。膜可以包括但不限于以下:聚烯烃树脂例如聚乙烯和聚丙烯;聚丙烯酸类树脂例如聚甲基丙烯酸甲酯和聚甲基丙烯酸乙酯;聚酯树脂例如聚对苯二甲酸乙二酯、聚对苯二甲酸丁二酯和聚萘二甲酸乙二酯;以及赛璐玢(cellophane)、聚乙烯醇、乙烯-乙烯醇共聚物、聚氯乙烯、聚苯乙烯、聚氨酯、聚丙烯腈、氟树脂、苯乙烯-异戊二烯-苯乙烯共聚物、苯乙烯-丁二烯橡胶、聚丁二烯、乙烯-乙酸乙烯酯共聚物、聚酰胺和聚砜;以及它们的组合。纸可以包括但不限于浸渍纸、涂覆纸、双胶纸(wood free paper)、牛皮纸(Kraft paper)、日本纸、玻璃纸(glassine paper)、合成纸以及它们的组合。复合材料可以包括但不限于通过将上述膜层压在上述无纺布或织物上获得的复合材料。
背衬的尺寸可以变化,并且在一些情况下,背衬的尺寸被设置为覆盖所需的局部靶位点。在一些实施方式中,背衬的长度范围为2至100cm,例如4至60cm且宽度范围为2至100cm,例如4至60cm。
在一些实施方式中,背衬层不溶于水。不溶于水意指可将背衬层浸于水中1天或更长、例如1周或更长、包括1个月或更长时间,并且表现出很微量的溶解(如果有的话),例如,观察不到的溶解。
释放衬垫
如上所述,在一些实施方案中,本发明的透皮组合物包括释放衬垫。在某些方面中,当期望活性剂层与受试者的皮肤表面直接接触时,释放衬垫可直接设置在活性剂层上并在使用前除去(参见例如图1)。在其它方面中,当在组合物(例如,粘合剂层)中存在一个或多个附加层时,释放衬垫可以直接设置在粘合剂层上并在使用之前除去(参见例如图2)。
释放衬垫有利于保护透皮组合物的活性剂层和/或任何附加层(例如,粘合剂层,如果存在的话)。在某些方面,可通过用硅氧烷处理来处理聚乙烯涂覆的双胶纸、聚烯烃涂覆的玻璃纸、聚对苯二甲酸乙二酯(聚酯)膜、聚丙烯膜等的一侧来制备释放衬垫。
粘合剂覆盖物
可选地,当施加于皮肤时一个或多个粘合剂覆盖物可以用于增加组合物的粘合性。粘合剂覆盖物可以包括存在于背衬材料(例如多孔的、非多孔的、闭塞的或透气的背衬材料)上的一层粘合剂。选择粘合剂覆盖物的尺寸以提供所需的功能性,其中在一些情况下,选择该尺寸使得当施加在活性剂制剂上方时粘合剂覆盖物超出活性剂制剂的一个或多个侧延伸一定的距离。在一些情况下,粘合剂覆盖物的面积超出活性剂层的面积5%或更多,例如10%或更多,包括20%或更多。在使用期间,粘合剂覆盖物可以由患者、由照顾者施用,或可被统一在试剂盒中。
使用方法
如上所述,提供了使用本发明的透皮组合物的方法。根据某些实施方案,该方法包括以在延长的时间期间内足以达到利伐斯的明的治疗通量的方式向受试者的皮肤部位施用本文所述的任何透皮组合物。在某些方面,例如在延长的时间期间(例如,2至10天,包括5天或更多天,例如7天或更多天)内,治疗通量范围为1至40μg/cm2/小时,诸如1至20μg/cm2/小时,诸如2至20μg/cm2/小时,诸如2至15μg/cm2/小时,包括5至15μg/cm2/小时。
使用该透皮组合物的方法包括向受试者施用有效量的利伐斯的明,以便治疗受试者的所关注的目标病症,例如下文中实用性部分所描述的。“治疗(treating/treatment)”意指至少抑制或减轻与受试者所患病症相关的症状,其中抑制或减轻以广泛的含义使用,其是指至少降低与接受治疗的病症相关的参数(例如症状)的量级。因此,治疗还包括该病症被完全抑制的情形,例如防止其发生或使其停止,例如终止,使得受试者不再经历该病症。因此,治疗包括预防病症和控制病症两者。
在该方法的实践中,可向受试者局部施用本文中公开的透皮组合物,即,可将该透皮组合物施用于任何方便的局部部位(例如,皮肤部位)。感兴趣的局部部位包括粘膜部位和角质化的皮肤部位两者,并且因此包括但不限于:手臂、躯干(例如胸部或背部)、腿、头部、口、鼻、眼、直肠、阴道等。在施加后被局部组合物覆盖的表面积足以提供所需量的药剂施用,并且在一些实施方式中,表面积的范围为1至400cm2,诸如1至300cm2,诸如1至200cm2,诸如10至180cm2(例如20至50cm2),并且包括100至150cm2,例如,140cm2。
可使透皮组合物在其所施加的局部部位处保持一段所需的时间,例如,以递送所需量的活性剂递送。在一些情况下,组合物在所施加的部位处保持的时间为24小时或更长,诸如48小时或更长,包括72小时或更长,例如96小时或更长,包括120小时或更长,诸如144小时或更长,例如168小时或更长,包括240小时或更长。在某些方面中,本发明的透皮组合物保持在其已施用的局部部位持续2至10天(例如7天)的延长的时间期间。
在本发明的方法的实践中,可以在给定的时间期间(例如接受治疗的疾病症状的过程)内单次或多次施加给定剂量的透皮组合物,其中当给定时间内施用多种组合物时,给药方案可以是每天、每周、每两周、每月等。
在将透皮活性剂组合物施加于皮肤部位持续一段所期望的时间(即,在一段时间内足以将目标剂量的利伐斯的明递送至受试者的时间)后,可从皮肤部位除去该组合物。可以将新的透皮组合物施加于相同或不同的皮肤部位。可以将该新的透皮组合物施加于不同的皮肤部位,以减少在之前施加部位处可能发生的皮肤刺激和/或皮肤敏感。
在某些实施方式中,本发明的方法包括诊断步骤。利用任何方便的方案,个体可以诊断为需要本发明的方法。另外,个体可以是已知需要本发明的方法,例如,他们正患有记忆问题,诸如痴呆,包括与阿尔茨海默病或帕金森病相关的痴呆。可以利用任何方便的诊断方案进行目标病症的诊断和评估。
本发明的方法可以进一步包括评估包括透皮施用利伐斯的明的治疗方案的效力。可以利用任何方便的方案进行治疗效力的评估,并且在某些实施方案中,该评估包括评估受试者的记忆力或与例如阿尔茨海默病或帕金森病相关的其它症状的方案。
在一些情况下,透皮组合物可与特异于感兴趣的目标病症的一种或多种另外的疗法联合施用。因此,透皮组合物可以单独用于治疗目标疾病,或者可替代地,象在阿尔茨海默病的情况下,透皮组合物例如可用作常规的胆碱酯酶抑制剂和/或美金刚疗法的辅助物。象在帕金森病的情况下,透皮组合物例如可用作常规L-DOPA治疗的辅助物。
可向多种不同类型的受试者施用本发明的透皮组合物。感兴趣的受试者包括但不限于:人类和非人的哺乳动物,包括食肉动物(例如狗和猫)、啮齿目动物(例如,小鼠、豚鼠和大鼠)、兔形目动物(例如,家兔)和灵长目动物(例如,人、黑猩猩和猴子)。在某些实施方式中,受试者(例如患者)是人。
实用性
发现本发明的透皮组合物适用于受试者会从透皮施用利伐斯的明中受益的任何应用。发现利伐斯的明可用于治疗多种不同的疾病病症,诸如但不限于:与失忆相关的疾病,例如痴呆,包括与阿尔茨海默病相关的痴呆,与帕金森病相关的痴呆等。治疗意指至少达到与患者所患病症相关的症状的改善,其中改善以广泛的含义使用,其是指至少减少与接受治疗的病症相关的参数(例如症状)的量级。因此,治疗还包括病理状态或者至少是与其相关的症状被完全抑制的情况,例如防止其发生或使其停止,例如终止,使得受试者不再经受该病症,或者至少不再经受表征该病症的症状。
试剂盒
还提供了用于实施本文所述的某些方法的试剂盒。在某些方面中,该试剂盒包括本文其他内容中所述的一种或多种任意的透皮组合物。根据某些方面,该试剂盒包括两种或更多种本发明的透皮组合物。在包括两种或更多种组合物的给定试剂盒中,组合物可被单独包装或存在于常用容器中,其中所述包装和/或容器可以是无菌的,例如是无菌袋。
在某些实施方式中,该试剂盒可以进一步包括用于实施本发明的方法或获得所述方法的手段(例如,引导使用者到达提供该说明的网页的网站URL)的说明,其中这些说明可以被印刷在基体上,该基体可以是以下的一种或多种:包装插页(package insert)、包装、试剂容器等。在本发明的试剂盒中,一种或多种组分存在于相同的或不同的容器中,这可能是便利的或需要的。
以下的实施例以举例说明的方式提供,而不是以限制的方式提供。具体而言,以下的实施例是用于实施本发明的方面的具体实施方案。该实施例仅用于举例说明目的,而不是意在以任何方式限制本发明的范围。
实施例
I.材料和方法
A.包括含利伐斯的明的活性剂层和粘合剂层的透皮组合物的制备
为了制备活性剂层,在容器中称取利伐斯的明、赋形剂和调节涂层混合物的有机溶剂,并混合,得到均匀的活性剂层溶液。(例如,将维生素E、卡波姆(例如Carbopol 974P)、利伐斯的明、乙酸乙酯加入到合适的容器中,然后充分混合。当得到的混合物均匀时,将预溶解于乙酸乙酯中的Plastoid B和粘合剂加入到混合物中产生溶液)。将溶液倾倒在释放衬垫的释放涂层侧上,并使用刮涂机(自动刮涂机2)浇铸。设定涂层条的规格以获得目标涂层厚度。将具有浇铸粘合剂混合物的释放衬垫在烘箱(BINDER,FEP 115-VL)中于75℃下干燥12分钟,以获得一片活性剂层,并与背衬层压。然后除去释放衬垫以将粘合剂侧与如下所述制备的粘合剂层层压。
对于皮肤粘合剂层的制备,将维生素E和压敏粘合剂(例如,Duro-tak 9301,Bio-PSA4302)加入容器中,随后加入乙酸乙酯以达到所需的固体含量重量%(例如20%-50%,诸如30%-40%)。混合后,将混合物倾倒在释放衬垫的释放涂层侧上,使用刮涂机以所需的涂层重量和厚度浇铸,并在烘箱中于75℃干燥(其中合适的范围为70℃±5℃)12分钟,得到一片皮肤粘合剂层。
在制备活性剂层和皮肤粘合剂层的片材时,将活性剂层的粘合剂侧和皮肤粘合剂层层压在一起,并以所需尺寸(cm2)对透皮组合物冲切(punch)。
基于重量(mg/cm2)制备具体实施例中提供的组合物。为了方便起见,假定密度为1.0g/cm3,制剂可以以厚度基础(μm)表示。
B.透皮通量试验
对于透皮通量测试,将人类尸体皮肤的表皮分离并冲切成所需的尺寸。将制备的表皮置于10mL垂直型Frantz池(Frantz cell)上,施加以所需尺寸冲切的透皮贴剂,并仔细检查针孔或气泡。将含有0.01%庆大霉素作为抗生素的磷酸盐缓冲液(TAKARA BIO,PBS片剂,pH 7.5)作为受体溶液装入Frantz池中。在每个取样时间,从垂直型Frantz池中取出全部10mL受体溶液,并用新的10mL受体溶液替换。在AGILENT 1200LC系统上使用XDB-C18柱(柱尺寸4.6mm×50mm,粒径:5μm)通过HPLC分析收集的样品的一部分。注入20μL样品并在215nm波长下进行检测。流动相包含75mM的2:1:1的比例的(NH4)2HPO4(pH=7.00)、乙腈和MeOH。
II.具体实施例
A.各种透皮组合物的通量
1.活性剂层涂层重量对利伐斯的明通量的影响
使用活性剂层涂层重量为12mg/cm2、18mg/cm2和24mg/cm2的制剂评价活性剂层涂层重量对利伐斯的明通量的影响。这些组合物的具体组成示于下表1中。
表1-图4所示的透皮组合物
图4中所示的结果表明,在第7天时活性剂层厚度与利伐斯的明持续释放之间正相关。
2.交联的丙烯酸聚合物对利伐斯的明的通量的影响
使用活性剂层涂层重量为12mg/cm2的制剂,评价交联的丙烯酸聚合物的存在和量对利伐斯的明的通量的影响。具体地,将包括3%w/w Carbopol、5%Carbopol和7%Carbopol的透皮组合物的通量与活性剂层或粘合剂层中不包括交联的丙烯酸聚合物的组合物(由Novartis(Basel,CH)销售的1日贴剂)进行比较。这些组合物的具体组成示于下表2中。(当药物负载量XX mg/cm2固定时,粘合剂的干燥厚度随着药物负载量wt%越高而变得越薄(越低,mg/cm2)。药物负载量mg/cm2是干粘合剂厚度(mg/cm2)*药物负载量wt%)
表2-图5所示的透皮组合物
如图5所示,交联的丙烯酸聚合物在活性剂层中的存在意外地导致组合物与1日贴剂相比具有显著改变的通量分布,1日贴剂在活性剂层(或粘合剂层)中不包括交联的丙烯酸聚合物。图5中的图形表明,通量特征受活性剂层中交联的丙烯酸聚合物的量的影响,并且交联的丙烯酸聚合物导致利伐斯的明在第7天比第1天更持续释放。不包括交联的丙烯酸聚合物的组合物在7天的研究过程中显示出通量的显著降低。
3.具有不同的交联的丙烯酸聚合物的组合物的利伐斯的明的通量
评价了根据本发明的三种示例性组合物的通量特征。在该实施例中,组合物包括以5%w/w的量存在的不同的交联的丙烯酸聚合物。这些组合物的具体组成示于下表3中。
表3–图6所示的透皮组合物
如图6所示,每种制剂表现出7天的持续通量,而贴剂在第1天后显示显著降低的通量。
4.具有不同皮肤粘合剂层的组合物的利伐斯的明的通量
评价了根据本发明的六种示例性组合物的通量特征。在该实施例中,组合物包括具有以5%w/w的量存在的交联的丙烯酸聚合物的活性剂层和不同的皮肤粘合剂层。这些组合物的具体组成示于下表4中。
表4-图7所示的透皮组合物
如图7所示,具有PIB-Panalane作为皮肤粘合剂的组合物显示出较大的初始通量,而具有Duro-Tak 2353的组合物在7天时间内显示出最低的通量。具有Duro-tak 2287、Duro-tak 9301和BIO-PSA 4302作为皮肤粘合剂的组合物的通量是相当的。
5.具有三层的组合物的利伐斯的明的通量
评价了根据本发明的具有三层的四种示例性组合物的通量特征–所述三层为:第一活性剂层,其包括交联的丙烯酸聚合物;第二活性剂层,其不包括交联的丙烯酸聚合物;和皮肤粘合剂层。这些组合物的具体组成显示在下表5中。
表5-图8所示的三层透皮组合物
如图8所示,三层制剂表现出7天的持续通量,而贴剂在第1天后显示出显著降低的通量。
6.具有一层或多层膜的三层组合物的利伐斯的明的通量
评价了根据本发明的具有三层和设置在特定层之间的一层或多层膜的示例性组合物的通量特征–所述三层为:第一活性剂层,其不包括交联的丙烯酸聚合物;第二活性剂层,其包括交联的丙烯酸聚合物;和皮肤粘合剂层。这些组合物的具体组成示于下表6中。如表6所示,组合物21在第一活性剂层和第二活性剂层之间、或者在第二活性剂层和皮肤粘合剂层之间不包括膜。组合物22在第一活性剂层和第二活性剂层之间以及在第二活性剂层和皮肤粘合剂层之间包括膜。组合物23在第一活性剂层和第二活性剂层之间包括膜,但在第二活性剂层和皮肤粘合剂层之间不包括膜。组合物24在第一活性剂层和第二活性剂层之间不包括膜,而是在第二活性剂层和皮肤粘合剂层之间包括膜。
表6-图9所示的三层透皮组合物
如图9所示,具有设置在特定层之间的一层或多层膜的三层制剂显示出7天的持续通量,而贴剂在第1天后显示显著降低的通量。
7.包含乙烯乙酸乙烯酯/乙酸乙烯酯膜的制剂的利伐斯的明的通量
评价了具有两层的示例性组合物的通量特征–所述两层为:第一活性剂层,其包括交联的丙烯酸聚合物,和皮肤粘合剂层。两种组合物(组合物26和27)包括设置在两层之间的乙烯乙酸乙烯酯/乙酸乙烯酯膜(CoTranTM 9726膜或CoTranTM 9707膜)。这些组合物的具体组成示于下表7中。
表7-图10所示的乙烯-乙酸乙烯酯/乙酸乙烯酯膜组合物
如图10所示,包括设置在活性剂层和粘合剂层之间的乙烯乙酸乙烯酯/乙酸乙烯酯膜的组合物表现出7天的持续通量,而贴剂在第1天后显示出显著降低的通量。
8.小型猪研究
A.测试的制剂
如下表8所概述制备四种不同的制剂。
B.方案
约6个月龄的哥根廷小型猪用于该研究(每种制剂的n=5)。在该研究中,在第1天开始时(t=0)将测试局部制剂施用于小型猪的皮肤,并在第7天结束时(t=168小时)除去。总贴剂使用期为168小时。血液样品收集时间是在局部制剂施用后t=0、0.5、1、2、4、8、12、24、48、72、96、120、168、172、176、180、192、216、240小时。
C.结果
观察到的结果在图11A至图11D中图示。
观察在7天贴剂使用期期间的Cmin/Cmax(=利伐斯的明的最小血浆水平比利伐斯的明的最大血浆水平,其代表耗损)。结果提供在下表9中。
表9
应注意的是,如果Cmin/max较低,则意味着局部制剂在使用期间不保持药物施用,并且血液浓度持续减少局部制剂的使用时间。在一些情况下,选择比为0.4或更大作为期望的Cmin/Cmax值。制剂2和制剂4满足该标准。
对于制剂2和制剂4观察到的结果在图12中图示并进行比较。从图12和下表10中可以看出,制剂2和制剂4的PK曲线是相当的,而具有卡波姆(Carbopol 974P)的制剂4更薄(=更容易制造)。因此,制剂4优于制剂2。
表10
尽管有所附的条款(clause),本文所阐述的公开内容还由以下条款限定:
1.一种透皮组合物,所述组合物包含:活性剂层,其包含以10%w/w或更多的量存在的利伐斯的明和溶解度调节剂;和背衬。
2.根据条款1所述的组合物,其中利伐斯的明以10%至75%w/w的量存在。
3.根据条款1或条款2所述的组合物,其中所述溶解度调节剂是溶解度增强剂。
4.根据条款1至3中任一项所述的组合物,其中所述溶解度调节剂是聚合物溶解度调节剂。
5.根据条款1至4中任一项所述的组合物,其中所述聚合物溶解度调节剂是交联的丙烯酸聚合物。
6.根据条款5所述的组合物,其中所述交联的丙烯酸聚合物以1%至30%w/w的量存在。
7.根据条款6所述的组合物,其中所述交联的丙烯酸聚合物以1%至6%w/w的量存在。
8.根据条款5至7中任一项所述的组合物,其中所述交联的丙烯酸聚合物是交联的丙烯酸均聚物。
9.根据条款5至8中任一项所述的组合物,其中所述交联的丙烯酸聚合物与蔗糖、季戊四醇或二乙烯基乙二醇的烯丙基醚交联。
10.根据条款9所述的组合物,其中所述交联的丙烯酸聚合物是与每蔗糖分子平均具有4至6个烯丙基的蔗糖的烯丙基醚交联的丙烯酸均聚物。
11.根据条款9所述的组合物,其中所述交联的丙烯酸聚合物是与烯丙基季戊四醇交联的丙烯酸均聚物。
12.根据条款9所述的组合物,其中所述交联的丙烯酸聚合物是与二乙烯基乙二醇交联的丙烯酸均聚物。
13.根据前述条款中任一项所述的组合物,其中所述活性剂层包含甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物。
14.根据条款13所述的组合物,其中所述甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物以5%至20%w/w的量存在。
15.根据前述条款中任一项所述的组合物,其中所述活性剂层包含压敏粘合剂。
16.根据条款12所述的组合物,其中所述压敏粘合剂以5%至90%的量存在。
17.根据条款15至16中任一项所述的组合物,其中所述压敏粘合剂是丙烯酸酯共聚物。
18.根据前述条款中任一项所述的组合物,其中所述活性剂层包含抗氧化剂。
19.根据前述条款中任一项所述的组合物,其中活性剂层的涂层重量为10至90mg/cm2。
20.根据条款19所述的组合物,其中所述活性剂层的涂层重量为20至70mg/cm2。
21.根据条款20所述的组合物,其中所述活性剂层的涂层重量为25至50mg/cm2。
22.根据前述条款中任一项所述的组合物,其中所述局部制剂具有15至60cm2的表面积。
23.根据前述条款中任一项所述的组合物,其中所述局部制剂具有20至50cm2的表面积。
24.根据前述条款中任一项所述的组合物,其中所述局部制剂被配置为单层局部制剂。
25.根据条款1至23中任一项所述的组合物,其中所述透皮组合物包含设置在所述活性剂层的与所述背衬相反的一侧上的粘合剂层。
26.根据条款25所述的组合物,其中所述粘合剂层包含压敏粘合剂。
27.根据条款26所述的组合物,其中所述粘合剂层包含以75%至100%的量存在的压敏粘合剂。
28.根据条款26或27所述的组合物,其中所述粘合剂层包含丙烯酸酯共聚物压敏粘合剂。
29.根据条款28所述的组合物,其中所述丙烯酸酯共聚物不包含侧基官能团。
30.根据条款28所述的组合物,其中所述丙烯酸酯共聚物包含侧基官能团。
31.根据条款26或27所述的组合物,其中所述粘合剂层的压敏粘合剂是硅氧烷粘合剂。
32.根据条款26或27所述的组合物,其中所述粘合剂层的压敏粘合剂包含聚异丁烯。
33.根据条款25至32中任一项所述的组合物,其中所述粘合剂层包含抗氧化剂。
34.根据条款25至33中任一项所述的组合物,其中所述粘合剂层的涂层重量为2mg/cm2至5mg/cm2。
35.根据条款25至34中任一项所述的组合物,其中所述组合物包含设置在所述第一活性剂层和所述粘合剂层之间的膜。
36.根据条款1至23或条款25至35中任一项所述的组合物,其中所述组合物包含设置在所述背衬和所述活性剂层之间的第二活性剂层。
37.根据条款36所述的组合物,其中所述第二活性剂层不包含交联的丙烯酸聚合物。
38.根据条款36或37所述的组合物,其中所述第二活性剂层包含以10%至75%w/w的量存在的利伐斯的明。
39.根据条款36至38中任一项所述的组合物,其中所述第二活性剂层包含甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物。
40.根据条款39所述的组合物,其中甲基丙烯酸丁酯和甲基丙烯酸甲酯的共聚物以5%至20%w/w的量存在。
41.根据条款36至40中任一项所述的组合物,其中所述第二活性剂层包含压敏粘合剂。
42.根据条款41所述的组合物,其中所述压敏粘合剂以25%至75%的量存在。
43.根据条款41至42中任一项所述的组合物,其中所述压敏粘合剂是丙烯酸酯共聚物。
44.根据条款36至43中任一项所述的组合物,其中所述第二活性剂层包含抗氧化剂。
45.根据条款36至44中任一项所述的组合物,其中所述第二活性剂层的涂层重量为2.5mg/cm2至25mg/cm2。
46.根据条款36至45中任一项所述的组合物,其中所述组合物包含设置在所述第一活性剂层和所述第二活性剂层之间的膜。
47.根据条款36至46中任一项所述的组合物,其中所述组合物包含粘合剂层,并且其中所述组合物包含:设置在所述第一活性剂层和所述第二活性剂层之间的膜,设置在所述第一活性剂层和所述粘合剂层之间的膜,或两者。
48.根据前述条款中任一项所述的组合物,其中所述组合物包含释放衬垫。
49.根据前述条款中任一项所述的组合物,其中当施用于受试者的皮肤部位时,所述组合物在5天或更长的时间期间内提供1至20μg/cm2/小时的通量。
50.根据前述条款中任一项所述的组合物,其中当施用于受试者的皮肤部位时,所述组合物在5天或更长的时间期间内提供0.4或更大的Cmin/Cmax。
51.一种方法,包括:
以在延长的时间段内以足以达到利伐斯的明的治疗通量的方式向受试者的皮肤部位施用根据条款1至50中任一项所述的透皮组合物。
52.根据条款51所述的方法,其中所述治疗通量为1至20μg/cm2/小时。
53.根据条款51或52所述的方法,其中所述延长的时间期间为2至10天。
54.根据条款50至53中任一项所述的方法,其中所述受试者患有痴呆。
55.根据条款54所述的方法,其中所述痴呆与阿尔茨海默病或帕金森病相关。
56.一种试剂盒,其包含两种或更多种根据条款1至50中任一项所述的透皮组合物。
尽管为了清楚理解的目的,前述内容通过说明和实施例的方式描述了本发明,但在本发明的教导下对于本领域普通技术人员来说显而易见的是,在不背离所附权利要求的精神和范围下可对本发明进行某些变化和修改。
因此,前文仅仅是举例说明了本发明的原理。应该理解,尽管本文中没有明确描述或示出,本领域技术人员也能够做出不同的安排以实施本发明的原理,并且这些不同的安排也包括在本发明的精神和范围内。此外,本文中的所有实施例和附条件的语言表述原则上均意在帮助读者理解本发明的原理和发明人为了促进本领域贡献的思想,并且被解释为不限制这样的具体提及的实施例和条件。此外,本文中提及本发明的原理、方面和实施方式的所有陈述以及其具体实施例均意在包括其结构和功能等同物。另外。这样的等同物意在包括目前已知的等同物和未来开发的等同物,即,所开发的实现相同功能的任意要素,而不论其结构如何。因此,并不意在将本发明的范围限制为本文中所示出和描述的示例性实施方式。相反,本发明的范围和精神由所附权利要求呈现。
- 还没有人留言评论。精彩留言会获得点赞!