工程化的γδT细胞的制作方法
背景
t淋巴细胞的抗原识别可通过高度多样性的异二聚体受体,t细胞受体(tcr)来实现。血液和淋巴器官中大约95%的人t细胞表达异二聚体αβtcr受体(αβt细胞谱系)。血液和淋巴器官中大约5%的人t细胞表达异二聚体γδtcr受体(γδt细胞谱系)。这些t细胞亚群可分别称为“αβ”和“γδ”t细胞。αβ和γδt细胞的功能不同。αβt细胞驱动mhc限制性过继免疫并且γδt细胞桥接先天和非mhc限制性过继免疫。当抗原呈递细胞(apc)在i/ii类mhc的背景下呈递抗原时,随后发生αβt细胞的活化。树突状细胞是天然t细胞的已知最强的活化剂。两种信号对于完全αβt细胞活化是必要的:a)由mhc-肽与tcr-cd3复合物的相互作用产生的信号;和b)由t细胞上的cd28和apc上的b7家族的成员的相互作用产生的信号(共刺激信号)。与αβt细胞相比,γδt细胞能够直接识别抗原,并且不需要mhc-肽与tcr-cd3复合物的相互作用。因此,据称γδt细胞不是mhc限制性的。在内源性t细胞中,缺乏共刺激信号导致克隆无反应性。
内源性γδt细胞直接识别抗原的能力使γδt细胞成为有吸引力的治疗工具。然而,操纵和引导内源性γδt细胞的困难限制临床上患者源性的γδt细胞的治疗有用性。
概述
在一些实施方案中,本公开提供一种工程化的γδt细胞,其中所述工程化的γδt细胞被工程化以表达一个、两个或更多个不同的肿瘤识别部分,其中每个肿瘤识别部分识别肿瘤抗原。肿瘤识别部分可被设计成识别相同肿瘤抗原的不同表位、不同肿瘤的抗原、肿瘤抗原和活化或失活共刺激/免疫调节受体、与mhc分子复合的抗原、或归巢受体。在一些情况下,本公开提供一种使用工程化的γδt细胞治疗癌症的方法。工程化的γδt细胞可被设计为与受试者同种异体,并且工程化的γδt细胞可以是肿瘤特异性同种异体γδt细胞。在一些情况下,工程化的γδt细胞缺乏人hla基因座。hla基因座可选自由以下组成的组:hla-a、hla-b、hla-c、hla-dp、hla-dm、hla-doa、hla-dob、hla-dq和hla-dr,并且工程化的γδt细胞可被设计成缺乏来自两种或更多种hla基因座的基因表达。在一些情况下,至少一个工程化的肿瘤识别部分是工程化的t细胞受体。t细胞受体可以是人t细胞受体、小鼠t细胞受体、大鼠t细胞受体或嵌合t细胞受体。工程化的t细胞受体可以是工程化的αβtcr,并且两种不同的工程化的αβtcr可被设计成识别相同抗原的不同表位。在其他情况下,工程化的t细胞受体是工程化的γδtcr。在一些实施方案中,工程化的γδt细胞被设计成浸润实体肿瘤。工程化的γδt细胞可被设计成识别在肿瘤细胞内细胞内或细胞外表达的肿瘤抗原。在细胞外表达的肿瘤抗原的情况下,工程化的γδt细胞可被构造成识别为与mhc分子复合的肽的抗原。在一些情况下,肿瘤抗原是淋巴瘤抗原、白血病抗原、多发性骨髓瘤抗原、乳腺癌抗原、前列腺癌抗原、膀胱癌抗原、结肠和直肠癌抗原、脑癌抗原、胃癌抗原、头颈癌抗原、肾癌抗原、肺癌抗原、胰腺癌抗原、肉瘤抗原、间皮瘤抗原、卵巢癌抗原或黑素瘤抗原。在一些情况下,工程化的γδt细胞源自vδ1+t细胞、vδ2+t细胞或vδ3+t细胞、或vδ1+、vδ2+或vδ3+t细胞的混合物。工程化的γδt细胞可源自cd3+t细胞或cd3-t细胞。工程化的γδt细胞可被设计成识别相同抗原的不同表位。
在一些情况下,两个或更多个不同的肿瘤识别部分由不同的多核苷酸序列编码,并且每个不同的多核苷酸序列被工程化以识别相同抗原的不同表位。在一些情况下,从肿瘤细胞克隆至少一个肿瘤识别部分。在其他情况下,至少一个肿瘤识别部分是合成工程化的。在一些情况下,至少一个肿瘤识别部分是识别肿瘤抗原的抗体片段或其抗原结合片段。肿瘤识别部分可以是工程化的免疫球蛋白轻链、工程化的免疫球蛋白重链或其任何片段。在一些情况下,工程化的γδt细胞还表达迁移和归巢受体。归巢分子可将工程化的γδt细胞粘附至实体肿瘤。在一些情况下,工程化的γδt细胞被进一步工程化以缺乏至少一种免疫检查点基因,并且所述免疫检查点基因可以是ctla-4基因、pd-1基因、lag3基因、ceacam-1基因或另一种基因。在一些情况下,肿瘤抗原选自cd19、cd30、cd22、cd37、cd38、cd56、cd33、cd30、cd138、cd123、cd79b、cd70、cd75、ca6、gd2、甲胎蛋白(afp)、癌胚抗原(cea)、ceacam5、ca-125、muc-16、5t4、napi2b、ror1、ror2、5t4、plif、her2/neu、egfrviii、gpmnb、liv-1、糖脂f77、成纤维细胞活化蛋白、psma、steap-1、steap-2、间皮素、c-met、cspg4、结合素-4、vegfr2、psca、叶酸盐结合蛋白/受体、slc44a4、cripto、ctag1b、axl、il-13r、il-3r、sltrk6、gp100、mart1、酪氨酸酶、ssx2、ssx4、nyeso-1、上皮肿瘤抗原(eta)、magea家族基因(如mage3a.mage4a)、kklc1、突变ras、βraf、p53、mhci类链相关分子a(mica)、mhci类链相关分子b(micb)、hpv或cmv。在其他情况下,至少一个肿瘤识别部分是被设计成识别本文所述的抗原、部分或任何抗原的片段的嵌合抗原受体(car)。
在其他实施方案中,工程化的γδt细胞被工程化以表达抗原识别部分,其中所述抗原识别部分识别与自身免疫性疾病相关的抗原。此类细胞可被工程化以表达一个、两个或更多个抗原识别部分,其中每个抗原识别部分识别相同自身免疫抗原的不同表位。在一些情况下,肿瘤识别部分识别不同的抗原、抗原和活化或失活共刺激/免疫调节受体、与mhc分子复合的抗原、或与自身免疫性疾病相关的归巢受体。
在替代实施方案中,工程化的γδt细胞被工程化以表达抗原识别部分,其中所述抗原识别部分识别致病性抗原。此类细胞可被工程化以表达两个或更多个抗原识别部分,其中每个抗原识别部分识别相同致病性抗原的不同表位。在一些情况下,肿瘤识别部分识别不同的抗原、抗原和活化或失活共刺激/免疫调节受体、与mhc分子复合的抗原、或与致病性抗原相关的归巢受体。
致病性抗原可以是细菌分子或病毒分子,如细菌蛋白或病毒蛋白。
在其他情况下,本公开提供一种γδt细胞群体,其中所述γδt细胞群体的扩增用刺激γδt细胞群体以在少于24小时内约1次细胞分裂的平均速率扩增的试剂活化。在一些情况下,扩增的γδt细胞群体包含一定百分比的δ1t细胞、δ2t细胞或δ3t细胞,并且前述扩增的γδt细胞中的任一种的百分比可以大于5%。在一些情况下,γδt细胞群体中所述百分比的δ1、δ2或δ3t细胞在体外或体内以在少于24小时内约1次细胞分裂的平均速率扩增。在一些情况下,γδt细胞群体还包含一定量的工程化的γδt细胞,其中所述工程化的γδt细胞被工程化以表达抗原识别部分。工程化的γδt细胞可被设计成也缺乏人hla基因座。刺激γδt细胞群体扩增的试剂可以是抗体,并且所述抗体可选自由以下组成的组:5a6.e9、b1、ts8.2、15d、b6、b3、ts-1、γ3.20、7a5、immu510、r9.12和11f2抗体。在一些情况下,抗体被固定在表面上。
在一些情况下,本公开涉及γδt细胞的活化表位。在一些情况下,所述活化表位刺激γδt细胞群体以在少于24小时或支持γδt细胞群体的快速扩增的另一合适的时间段内1次细胞分裂的平均速率扩增。在一些情况下,活化表位是δtcr(如δ1、δ2或δ3tcr)的氨基酸序列。在一些情况下,活化表位是由选自由以下组成的组的抗体中的任一种结合的表位:5a6.e9、b1、ts8.2、15d、b6、b3、ts-1、γ3.20、7a5、immu510、r9.12和11f2抗体。活化表位可包含来自vδ1基因区段和jδ1、jδ2、jδ3或jδ4基因区段的氨基序列。在一些情况下,活化表位是构象表位,并且在其他情况下,活化表位是线性表位。
在一些情况下,本公开提供一种确定γδt细胞受体的表位的方法,所述方法包括(a)从所述γδt细胞受体制备表位文库;(b)使所述表位文库与抗体接触;以及(c)鉴别所述表位文库中由所述抗体结合的至少一个表位的氨基酸序列。抗体可选自由以下组成的组:5a6.e9、b1、ts8.2、15d、b6、b3、ts-1、γ3.20、7a5、immu510、r9.12、11f2抗体。在一些情况下,抗体被连接至固体载体上。t细胞受体的表位可对应于t细胞受体中的连续或不连续的氨基酸序列。表位文库可包括长度在约10个氨基酸至约30个氨基酸、长度在约10个氨基酸至约20个氨基酸、长度在约5个氨基酸至约12个氨基酸范围内的片段。在一些情况下,抗体被标记。标记可以是放射性分子、发光分子、荧光分子、酶或生物素。在一些情况下,表位文库包括从合成设计的cdna翻译的肽,其中所述合成设计的cdna包含多种合成设计的γtcr和多种合成设计的δtcr的区段。在其他情况下,表位文库包括从自来源于人pbmcs或从人恶性或正常上皮组织分离的淋巴细胞的人δγt细胞提取的总rna扩增的肽。合成设计的cdna文库可包括多个vδ1、vδ2和vδ3基因区段,在其jδ区域不同,并且所述文库可包括多个vγ2、vγ3、vγ4、vγ5、vγ8、vγ9、vγ10、δ1、δ2和δ3基因区段。
在一些实施方案中,本公开提供一种治疗有需要的受试者的方法,所述方法包括向所述受试者施用本文所述的工程化的γδt细胞。本公开的另外方面和优点对于本领域的技术人员将从以下详细描述变得显而易见,其中仅示出和描述本公开的说明性实施方案。如将认识到,本公开能够具有其他和不同的实施方案,并且其若干细节能够进行修改,所有修改都不脱离本公开内容。因此,附图和描述应被视为在本质上是说明性的而不是限制性的。
以引用的方式并入
本说明书中提及的所有出版物、专利和专利申请都以引用的方式并入本文,所述引用的程度就如同已特定地和个别地指示将各个别出版物、专利或专利申请以引用的方式并入一般。
附图简述
本发明的新颖特征在所附权利要求中具体地阐述。通过参考阐述其中利用本发明的原理的说明性实施方案和附图(还有本文中的“图(figure)”和“图(fig.)”)的以下详细描述,将获得本发明的特征和优点的更好理解,其中:
图1示意性地示出工程化的γδt细胞。图a示出表达一个肿瘤识别部分的工程化γδt细胞。图b示出表达两个肿瘤识别部分的工程化的γδt细胞。
图2示意性地示出用于治疗受试者的方法。
图3示意性地示出用于向受试者施用工程化的γδt细胞群体的方法。
图4描绘示出从转移至肝脏的结肠腺癌(til1)和肾脏肿瘤(til2)分离并且已经显示表达ccr4和ccr7的γδl和γδ2淋巴细胞的生长的图。
图5描绘示出含血清和无血清培养基中γδt细胞生长的图。
图6描绘示出使用5a6.e9、b1、ts8.2、15d、b3、b6、ts-1、γ3.20、immu510或11f2的抗γδtcr抗体阻断实验的图。
图7描绘示出使用5a6.e9、b1、ts8.2、15d、b3、b6、ts-1、γ3.20、immu510或11f2的抗γδtcr抗体阻断实验的图。
图8描绘使用抗tcrvδ1ts-1抗体的竞争实验
图9描绘使用抗tcrvδ1ts8-2抗体的竞争实验
图10描绘示出来自pbmc的δ1t细胞的活化和扩增的图。
图11描绘示出来自pbmc的δ2t细胞的活化和扩增的图。
图12描绘示出来自pbmc的δ1t细胞的倍数扩增的图。
图13描绘示出来自pbmc的δ2t细胞的倍数扩增的图。
详述
虽然本文已经示出和描述了本发明的各种实施方案,但是对于本领域的技术人员将显而易见的是,此类实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域的技术人员可想到许多变化、改变和替代。应了解,可采用本文描述的本发明的实施方案的各种替代方案。
综述
在人中,γδt细胞是提供先天和适应性免疫响应之间的联系的t细胞的亚群。这些细胞经历v-(d)-j区段重排以产生抗原特异性γδt细胞受体(γδtcr)和γδt细胞,并且可经由通过γδtcr或其他非tcr蛋白识别抗原而直接活化,从而独立地或一起起作用来活化γδt细胞效应子功能。γδt细胞代表哺乳动物中的总体t细胞群体的一小部分,外周血和淋巴器官中的t细胞的大约1%-5%,并且它们似乎主要存在于富含上皮细胞的区室,像皮肤、肝、消化道、呼吸道和生殖道。与识别与主要组织相容性复合分子(mhc)结合的抗原的αβtcr不同,γδtcr可直接识别细菌抗原、病毒抗原、由病变细胞表达的应激抗原、以及呈完整蛋白质或非肽化合物形式的肿瘤抗原。
γδt细胞识别广谱抗原的能力可通过γδt细胞的遗传工程化增强。γδt细胞可被工程化以提供通用同种异体疗法,所述疗法在体内识别所选择的抗原。本文描述已被工程化以表达包含偶联至跨膜结构域和/或细胞内t细胞活化结构域的至少一个肿瘤识别部分(如αβtcr或γδtcr)的表达盒的γδt细胞。活化结构域可源自t细胞的αβtcr或γδtcr机器。例如,活化结构域可源自cd28、cd2、ctla-4、icos、jamal、pd-1、41-bb、cd27、cd30、ox40、nkg2d、hvem或cd46分子。γδt细胞可被工程化以表达识别相同抗原的不同表位的两种或更多种不同的tcr、不同的抗体或抗原结合片段。当施用至受试者时,工程化的αβtcr、γδtcr、抗体或嵌合抗原受体car与抗原的接合在体内有效地提供具有显著细胞毒性的γδt细胞。tcr可源自人t细胞、小鼠t细胞、大鼠t细胞、人源化小鼠、人源化大鼠、免疫的哺乳动物,或源自噬菌体或酵母文库。抗体、car或任何抗原结合片段可源自人b细胞、小鼠b细胞、大鼠b细胞、骆驼b细胞、美洲驼b细胞、免疫的哺乳动物,或源自噬菌体或酵母文库。由工程化的γδt细胞表达的肿瘤识别部分可识别由病变细胞细胞内或细胞外表达的抗原。例如,细胞可感染癌症引起的病毒,如人乳头状瘤病毒(hpv),并且患病细胞可细胞内表达一种或多种hpv抗原。患病细胞可将细胞内表达的hpv抗原加工成更小的片段,从而使抗原肽与mhci类分子偶联并转运至细胞表面。工程化的γδt细胞的肿瘤识别部分可被设计成识别各种抗原片段或由病变细胞细胞内表达并呈递在与mhci类或ii类分子复合的细胞表面上的表位。或者,工程化的γδt细胞的肿瘤识别部分可被设计成识别在肿瘤细胞表面上表达的外源抗原或在与mhc类分子复合的细胞表面上展示的衍生肽。
本文提供一种工程化的γδt细胞以及使用所述γδt细胞作为治疗产品的方法,所述治疗产品具有靶向患病细胞上的所选择抗原的有效和选择性能力。αβ或γδtcr的多核苷酸或蛋白质序列可用标准技术从一种或多种已经与肿瘤抗原、细菌抗原、病毒抗原或应激抗原接合的αβ或γδt细胞进行克隆。或者,αβ或γδtcr的多核苷酸序列可在计算机程序产品上经由计算机模拟设计。包含工程化的γδtcr的表达盒可用例如寡核苷酸合成技术来合成。高通量筛选技术可用于表征工程化tcr与肿瘤抗原的结合。包含αβ或γδtcr、跨膜结构域和活化结构域的表达盒的工程化增加γδt细胞的活性和细胞毒性性质,从而提供具有有效细胞毒性的工程化的γδt细胞。
工程化的γδt细胞可源自从血液、脐带血、干细胞、肿瘤或肿瘤浸润性淋巴细胞(til)分离的未工程化的t细胞。分离的t细胞可源自哺乳动物,例如人。分离的t细胞群体中的一个或多个细胞可被工程化以从表达盒表达多核苷酸,所述多核苷酸包含(例如)与t细胞活化或失活结构域偶联的肿瘤识别部分。肿瘤识别部分被设计成识别靶肿瘤抗原、肿瘤细胞失活或t细胞失活结构域。肿瘤识别部分被设计成识别靶肿瘤抗原、活化或失活共刺激/免疫调节受体或归巢受体。肿瘤抗原可以是例如源自在与主要组织相容性复合物(mhc)的复合物中的细胞表面上表达的细胞内或细胞外蛋白质的肽。在一些情况下,肿瘤识别部分是αβtcr,并且抗原是由与mhc复合的肿瘤细胞呈递的肽。抗原可以是源自处于不良应激的细胞(如癌细胞)或源自在细胞内复制的病原体(如病毒或细胞内细菌)或源自细胞已经通过从细胞外液内吞而内化的病原体或其产物的分子。在一些情况下,工程化的γδt细胞被设计成表达两个或更多个不同的肿瘤识别部分,并且每个肿瘤识别部分被设计成识别相同抗原的不同表位。通用的工程化的γδt细胞可表达能够识别具有不同mhc单倍型的抗原的肿瘤识别部分。肿瘤识别部分可包含识别肽-mhc复合物的tcr(αβ或γδtcr)或抗体。例如,对于给定抗原,不同的肿瘤识别部分(tcr或抗体)可识别与不同hla单倍型复合的相同或不同的抗原衍生的肽。
当施用至受试者时,工程化的γδt细胞可减弱或杀死表达靶抗原的细胞。可将工程化的γδt细胞引入需要治疗疾病的人中。在优选的实施方案中,将细胞施用至患有癌症的人,并且在此类情况下,细胞被工程化以识别肿瘤抗原或其他疾病相关抗原。图1示意性地示出γδt细胞。图a示出表达一个肿瘤识别部分的工程化γδt细胞。图b示出表达两个肿瘤识别部分的工程化的γδt细胞。
由表达盒编码的识别部分如嵌合抗原受体(car)可以是全抗体、抗体片段、单链可变片段(scfv)、单结构域抗体(sdab)、fab、f(ab)2、fc、抗体上的轻链或重链、抗体的可变区或恒定区、或其结合细胞表面肿瘤抗原(一种源自在细胞表面上表达的肿瘤抗原的作为与mhc的复合物的肽(肽-mhc复合物))、或双特异性构建体(包含针对两种不同抗原、相同抗原的不同表位或肿瘤抗原的两种不同抗体)、或肿瘤抗原和共刺激/活化分子、免疫调节分子或归巢受体的任何组合。抗体可源自例如人b细胞、小鼠b细胞、大鼠b细胞或源自杂交瘤细胞系。小鼠杂交瘤细胞系可源自免疫的野生型或人源化小鼠、大鼠b细胞、从免疫的野生型或人源化大鼠分离的大鼠杂交瘤细胞、或源自来源于人、小鼠、大鼠、骆驼或美洲驼的抗体文库。工程化的肿瘤识别部分可以是识别细胞表面抗原或肽mhc-抗原复合物的car。工程化的肿瘤识别部分可以是工程化的αβtcr,其识别与mhci类或ii类复合的肿瘤特异性抗原。识别部分也可以是以非mhc限制性方式识别肿瘤特异性抗原的γδtcr。肿瘤识别部分可以是识别细胞表面抗原、肽-mhc复合物、碳水化合物或脂质的工程化的tcr或car。
一个、两个或更多个肿瘤识别部分可被设计成识别相同或不同的抗原。一个、两个或更多个肿瘤识别部分可被设计成识别相同或不同抗原的不同表位。在一些情况下,肿瘤识别部分是由工程化至γδt细胞的基因组中的表达盒表达的αβtcr受体。在一些情况下,由工程化的γδt细胞表达的工程化的αβtcr被设计成识别源自由肿瘤细胞或另一种患病细胞在细胞内或细胞外或在细胞表面上表达的抗原的肽或肽聚体(如9聚体)。细胞内抗原可例如通过在感染的细胞内复制的病毒和细菌或通过受试者自身的蛋白质来产生。受试者的细胞可将抗原加工成肽,并且将所述肽与mhci类或ii类分子复合呈递。本公开的工程化的γδt细胞可被设计成识别各种不同的细胞内抗原的各种不同表位。细胞外或外源性抗原如细菌、寄生虫、病毒或甚至癌细胞可被抗原呈递细胞吞噬,加工成更小的片段,并且与mhcii类分子复合呈递。本公开的工程化的γδt细胞可被设计成识别各种不同的细胞外抗原的各种不同表位。在一些情况下,肿瘤识别部分是向细胞提供新的抗原识别的γδtcr受体。表达盒可包括例如表达抗体或配体的car,其整合至γδt细胞的基因组中并由所述γδt细胞表达。在一些情况下,肿瘤识别部分可以是双特异性构建体,其包含例如本文所述的抗体、tcr、抗原结合片段或其任何组合。γδt细胞可从肿瘤浸润性淋巴细胞(til)工程化和/或由表达盒编码的肿瘤识别部分可从til中分离。从til工程化的γδt细胞可以是有效迁移、归巢且与肿瘤微环境相互作用的肿瘤特异性同种异体细胞。工程化的γδt细胞可从分离自特定肿瘤的til工程化,所述肿瘤如乳腺癌、前列腺癌、膀胱癌、结肠和直肠癌、脑癌、胃癌、头颈癌、肾癌、肺癌、胰腺癌、肉瘤、间皮瘤、卵巢癌抗原或黑素瘤。肿瘤识别部分可源自合成文库,或者肿瘤识别部分可源自从例如淋巴瘤、白血病、多发性骨髓瘤、乳腺癌、前列腺癌、膀胱癌、结肠和直肠癌、脑癌、胃癌、头颈癌、肾癌、肺癌、胰腺癌、肉瘤、间皮瘤、卵巢癌抗原或黑素瘤分离的b细胞、t细胞。在一些情况下,肿瘤识别部分源自从癌症分离的肿瘤浸润性淋巴细胞。
工程化的γδt细胞还可包含t细胞共刺激/活化结构域。t细胞活化结构域可源自αβt细胞和/或γδt细胞。例如,工程化的αβtcr可被设计成与γδ共刺激/活化结构域或与αβ共刺激/活化结构域连接。αβ共刺激/活化结构域的非限制性实例包括cd28、cd2、ctla4、icos、pd-1、4-1bb(cd137)、ox40、cd27、hvem。γδ共刺激/活化结构域的非限制性实例包括cd28、cd2、icos、jamal、cd27、cd30、ox40、nkg2d、cd46。肿瘤识别部分可连接至t细胞活化结构域或任何其他合适的活化结构域。t细胞活化结构域可以是cd3ζ结构域、cd28结构域或另一种合适的活化结构域,包括cd2、icos、4-1bb(cd137)、ox40(cd134)、cd27、cd30、cd46、cd70、cd80、cd86、dap、cd122、ctla4、cd152、pd-1、jamal、nkg2d、cd314和/或fcerig。跨膜结构域可包括例如cd28、cd4、cd3e、cd16和免疫球蛋白的相关结构域。
本文公开的本发明优选提供表达编码识别分子的表达盒的工程化的γδt细胞。在一些情况下,将对应于表达盒的核酸序列克隆并且稳定地引入到工程化的γδt细胞的基因组中。包含表达盒的核酸序列(其可包括肿瘤识别部分和相关活化结构域)可合成工程化且可稳定地引入到工程化的γδt细胞的基因组中。两个或更多个不同的肿瘤识别部分可由相同或不同的表达盒表达。
可使用各种技术来工程化此类细胞。例如,克隆或合成工程化的dna可被插入、置换或除去以通过使用工程化的核酸酶的基因组编辑方法产生工程化的γδt细胞,所述核酸酶如:a)crispr/cas系统;b)转录活化子样效应子核酸酶(talen);c)锌指核酸酶(zfn);d)以及工程化的大范围核酸酶归巢内切核酸酶。睡美人转座子系统也可用于转移包含肿瘤识别部分的密码的核酸以产生工程化的γδt细胞。本领域中已知的各种其他多核苷酸递送方法可适用于γδt细胞的工程化,如转染、电穿孔、转导、脂转染、纳米工程化物质如有机改性的二氧化硅(ormosil)、病毒递送方法(包括腺病毒、逆转录病毒、慢病毒、腺相关病毒)或另一种合适的方法。
在一些情况下,识别部分源自单一或多种物种,例如,识别部分的多核苷酸序列可源自例如人(智人)、小鼠(例如小家鼠(musmusculus))、大鼠(例如褐家鼠(rattusnorvegicus)或黑家鼠(rattusrattus))、骆驼(例如单峰驼(camelusdromedarius)或双峰驼(camelusbactrianus))或源自美洲驼(骆马(lamavicugna)),或者识别部分的多核苷酸序列可以是两者的嵌合组合。肿瘤识别部分优选源自人,但在一些情况下,其可源自小鼠或其他物种,优选哺乳动物。在一些情况下,肿瘤识别部分是嵌合tcr受体或嵌合car。在一些情况下,源自非人物种的肿瘤识别部分的多核苷酸序列被工程化以增加其与来自人物种的多核苷酸序列的相似性,从而“人源化”所述肿瘤识别部分。在一些情况下,诸如小鼠和大鼠的物种被“人源化”以提供例如人源化抗体和tcr。
肿瘤识别部分优选地从工程化的γδt细胞中的表达盒组成型地表达。在一些情况下,肿瘤识别部分处于诱导型表达系统的表达下,所述系统如四环素调节的t-rextm哺乳动物表达系统、合适的tet-on/tet-off表达系统或另一种合适的系统。在一种具体情况下,工程化的γδt细胞源自人vδ1+t细胞、人vδ2+t细胞、人vδ3+t细胞、人cd3+t细胞或人cd3-t细胞。
本公开提供从表达盒表达肿瘤识别部分的可体内检测和靶向受试者中的特异性抗原的方法和工程化的γδt细胞。受试者可以是需要用治疗剂治疗的受试者,所述治疗剂能够以有效和选择性的方式识别且杀死或减弱表达特定抗原的细胞。在优选的情况下,抗原与癌症相关。抗原可以是谱系特异性肿瘤抗原。在一个实施方案中,抗原是肿瘤抗原,如cd19、cd30、cd22、cd37、cd38、cd56、cd33、cd30、cd138、cd123、cd79b、cd70、cd75、ca6、gd2、甲胎蛋白(afp)、癌胚抗原(cea)、ceacam5、ca-125、muc-16、5t4、napi2b、ror1、ror2、5t4、plif、her2/neu、egfrviii、gpmnb、liv-1、糖脂f77、成纤维细胞活化蛋白、psma、steap-1、steap-2、间皮素、c-met、cspg4、结合素-4、vegfr2、psca、叶酸盐结合蛋白/受体、slc44a4、cripto、ctag1b、axl、il-13r、il-3r、sltrk6、gp100、mart1、酪氨酸酶、ssx2、ssx4、nyeso-1、上皮肿瘤抗原(eta)、magea家族基因(如mage3a.mage4a)、kklc1、突变ras、βraf、p53、mhci类链相关分子a(mica)、mhci类链相关分子b(micb)、hpv或cmv。
本公开的工程化的γδt细胞可以是相对于受试者的mhc基因座自体或同种异体的。例如,自体和同种异体骨髓移植(bmt)用作一些病状(特别是血液恶性肿瘤)的疗法。然而,急性移植物抗宿主疾病(gvhd)和宿主抗移植物疾病(hvgd)对于同种异体bmt而言仍然是bmt的最重要的并发症。
供体t细胞和宿主抗原呈递细胞(apc)对于诱导gvhd是至关重要的。因为γδt细胞不能识别来自宿主的mhc分子,所以通过本发明的工程化的γδt细胞进行的抗原识别可能不会引发gvhd。本公开的工程化的γδt细胞可被设计成施用至非自体受试者而不引发移植物抗宿主疾病。此外,工程化的γδt细胞可被设计成缺乏来自一个或多个mhc基因座的基因表达。或者,γδt细胞可被工程化以缺乏一个或多个mhc基因座(基因座)。可通过基因编辑技术如锌指核酸酶(zfn)、转录活化子样效应子核酸酶(talen)、crispr和工程化的大范围核酸酶或通过β2m缺失来实现工程化的γδt细胞中mhc基因座的缺失或基因表达的破坏。在一些情况下,本公开的工程化的γδt细胞被工程化以缺乏或破坏多个mhc基因座的基因表达。在其他情况下,工程化的γδt细胞被工程化以缺乏或破坏至少一个mhci类基因座、至少一个mhcii类基因座或两者中的基因表达。一个或多个mhc基因座的缺失可提供工程化的γδt细胞,所述γδt细胞是具有任何mhc单倍型的任何受试者的通用供体而不会引发宿主抗移植物疾病,从而提供可在宿主内繁殖、存留、扩增和起作用而不被宿主的免疫系统靶向的工程化的γδt细胞。
本文描述的教义和组合物可用于各种各样的应用中。在优选的实施方案中,肿瘤抗原是乳腺癌抗原、前列腺癌抗原、膀胱癌抗原、结肠和直肠癌抗原、脑癌抗原、胃癌抗原、头颈癌抗原、肾癌抗原、肺癌抗原、胰腺癌抗原、肉瘤抗原、间皮瘤抗原、卵巢癌抗原或黑素瘤抗原。在此类情况下,肿瘤识别部分可以是工程化的αβtcr或被设计成识别源自细胞内或细胞外肿瘤抗原的呈递在与i类或ii类mhc复合的肿瘤细胞表面上的表位的抗体。工程化的αβtcr可识别由肿瘤或apc呈递的细胞内肿瘤抗原,例如在hla-a、hla-b或hla-c复合物的背景下,或在hla-dp、hla-dq、hla-dr、hla-dm、hla-do或其他hla分子的背景下。
在一些情况下,抗原是自身抗原。自身抗原可以是例如免疫球蛋白、t细胞受体、细胞内肿瘤抗原、细胞外肿瘤抗原、mhc分子或与病状相关的细胞外部分。例如,人hladr2的细胞表达与全身性红斑狼疮和多发性硬化相关,并且人hladr4的细胞表达与类风湿性关节炎和糖尿病相关。
在其他情况下,抗原是外来抗原。外来抗原可以是例如病毒、细菌、原生动物或过敏原如花粉或食物。外来抗原可与例如感染性疾病、自身免疫性疾病或组织损伤相关。
本公开的工程化的γδt细胞可被设计成归巢至受试者体内的特定身体位置,并且因此靶向特定组织、器官或身体部位处的抗原。内源性t细胞具有影响其迁移模式的转运配体和受体的不同谱系。本公开的工程化的γδt细胞可被设计成从包含肿瘤识别部分的表达盒或从单独的表达盒表达一种或多种引导工程化的γδt细胞迁移至特定组织、器官或身体部位的转运配体或受体。
本公开的工程化的γδt细胞可以是肿瘤特异性同种异体细胞。例如,工程化的γδt细胞可源自为从肿瘤分离的肿瘤浸润性淋巴细胞(til)的非工程化的γδt细胞。不同的til可从不同的肿瘤类型分离。编码肿瘤识别部分和活化结构域或另一种工程化特征的表达盒可插入到从各种肿瘤分离的til的基因组中。此类γδt细胞可浸润实体肿瘤,减弱且杀死表达一种或多种靶抗原的肿瘤细胞,并且它们可为各种恶性肿瘤提供有效的治疗。肿瘤特异性同种异体γδt细胞可被工程化以表达至少一个识别所选择的表位的肿瘤识别部分。在一些情况下,肿瘤特异性同种异体γδt细胞被设计成表达至少两个不同的肿瘤识别部分,并且每个不同的肿瘤识别部分被设计成识别相同抗原的不同表位、不同抗原、抗原和活化或失活共刺激/免疫调节受体、与mhc分子复合的抗原或归巢受体。
在一些情况下,本公开的工程化的γδt细胞被设计成表达tcrδ和tcrγ受体链的特异性等位基因。工程化γδt细胞的tcrδ和tcrγ受体链的特异性等位基因可引导工程化的γδt细胞迁移或归巢至受试者体内的一个或多个身体位置。例如,在人中,表达vδ1+tcr的γδt细胞主要限于且归巢至皮肤、气道、消化道和泌尿生殖道以及若干内部器官的上皮或上皮相关/粘膜组织。表达vδ3+tcr的人γδt细胞在肝脏中富集。本公开的工程化的γδt细胞可组成型地活化。在野生型t细胞中,tcr作为几种蛋白质的复合物存在,所述蛋白质包括cd3蛋白,如cd3εγ、cd3εδ和ζ链(cd3ζ同二聚体)。ζ链上的许多基于免疫受体酪氨酸的活化基序(itam)可被磷酸化以在t淋巴细胞上产生活化信号。不同于当分别识别与mhci类或ii类分子相关的特异性抗原时变得活化的a/βtcrcd8和cd4细胞,γδt细胞通过以非mhc限制性方式直接识别抗原而变得活化。此类抗原包括由肿瘤细胞表达的抗原,如mhci类链相关分子a和b(mica和micb)、cd1、nkg2a、ulbp1-3、脂质和磷酸抗原。本公开的工程化的γδt细胞可被工程化为组成型活性的。在一些情况下,本公开的工程化的γδt细胞被工程化以包含肿瘤识别部分和活化部分。活化部分可以是tcr-cd3复合物中的蛋白质。在一些情况下,本公开的工程化的γδt细胞组成型地表达遗传修饰的cd3ζ基因,其中cd3ζ基因的基于免疫受体酪氨酸的活化基序被修饰成包含yxxl/i基序中的酪氨酸基因的磷酸化模拟物(phosphomimetic)。各种t细胞活化结构域和跨膜结构域如cd3ζ、cd28、cd2、icos、4-1bb(cd137)、ox40(cd134)、cd27、cd70、cd80、cd86、dap、cd122、fcerig、cd4、cd3e、jamal、nkg2d或cd16可被工程化以例如包含磷酸化模拟物或另一种核酸突变。
本文进一步公开本公开的工程化的γδt细胞的体外(离体)扩增的方法。在一些情况下,工程化的γδt细胞可离体扩增而无需通过抗原呈递细胞或氨基磷酸酯刺激。本公开的抗原反应性工程化的t细胞可离体和体内扩增。在一些情况下,本公开的工程化的γδt细胞的活性群体可离体扩增而无需抗原呈递细胞、抗原肽、非肽分子或小分子化合物如氨基磷酸酯的抗原刺激,但使用某些抗体、细胞因子、有丝分裂原或融合蛋白,如il-17fc融合体、micafc融合体和cd70fc融合体。可用于扩增γδt细胞群体的抗体的实例包括抗cd3、抗cd27、抗cd30、抗cd70、抗ox40、抗nkg2d或抗cd2抗体,细胞因子的实例包括il-2、il-15、il-12或il-21、il-18、il-9、il-7、il-33,并且有丝分裂原的实例包括cd70(人cd27的配体)、植物血凝素(pha)、伴刀豆球蛋白a(cona)、商陆促分裂原(pwm)、蛋白质花生凝集素(pna)、大豆凝集素(sba)、兵豆凝集素(lca)、豌豆凝集素(psa)、蜗牛凝集素(hpa)、蚕豆凝集素(vga)或能够刺激t细胞增殖的另一合适的有丝分裂原。在一些情况下,工程化的γδt细胞群体可在少于60天、少于48天、36天、少于24天、少于12天或少于6天内扩增。
本文进一步公开一种用本公开的工程化的γδt细胞治疗各种病状的方法。本公开的工程化的γδt细胞可用于治疗需要治疗病状的受试者。病状可以是癌症,如膀胱癌、乳腺癌、肺癌、前列腺癌、肝癌、皮肤癌、结肠和直肠癌、淋巴瘤、白血病、多发性骨髓瘤、卵巢癌、肉瘤、头颈癌、间皮瘤、脑癌、肉瘤或另一种癌症。病状可以是感染性疾病、自身免疫性病症、移植或败血症。本文还公开一种用于向受试者提供工程化的γδt细胞的方法。在一些情况下,可将工程化的γδt细胞施用至患有病状的受试者。在一些情况下,可在手术过程(如骨髓移植)中向受试者施用工程化的γδt细胞。本公开进一步提供一种用于在不共同施用调节性细胞因子如il-2的情况下向受试者施用工程化的γδt细胞的方法。在一些情况下,γδt细胞被工程化以表达一种或多种细胞因子或激素,所述细胞因子或激素可在离体扩增和体内施用时增强γδt细胞增殖、存活和功能,如il-2、il-7、il-15、il-21、il-12、il-18、il-9。γδt细胞可被工程化以从包含识别部分的相同或不同的表达盒表达一种或多种细胞因子或激素。细胞因子包括趋化因子、干扰素、白细胞介素和肿瘤坏死因子。细胞因子的非限制性实例包括il-2、il-7、il-15、il-21、il-12、il-18、il-9、促红细胞生成素(epo)、g-csf、gm-csf、促血小板生成素(tpo)以及干扰素(ifn)亚家族的成员。
在一些情况下,可将工程化的γδt细胞作为组合疗法施用至受试者。在一些情况下,组合疗法包括:a)本公开的工程化的γδt细胞;和b)免疫检查点疗法。
工程化的γδt细胞
可使用本领域中已知的各种方法产生工程化的γδt细胞。工程化的γδt细胞可被设计成稳定地表达特定肿瘤识别部分。编码包含肿瘤识别或另一类型的识别部分的表达盒的多核苷酸可通过转座子/转座酶系统或基于病毒的基因转移系统(如慢病毒或逆转录病毒系统)或另一种合适的方法(如转染、电穿孔、转导、脂转染、磷酸钙(capo4)、纳米工程化物质如有机改性的二氧化硅)、病毒递送方法(包括腺病毒、逆转录病毒、慢病毒、腺相关病毒)或另一合适的方法稳定地引入到γδt细胞中。可通过将包含抗原特异性tcr的遗传密码的多核苷酸稳定地插入到γδt细胞的基因组中来将抗原特异性tcr(αβ或γδ)引入工程化的γδt细胞。可通过将多核苷酸稳定地插入到γδt细胞的基因组中来将编码具有肿瘤识别部分的car的多核苷酸引入到工程化的γδt细胞中。在一些情况下,工程化的肿瘤识别部分是工程化的t细胞受体,并且并入工程化的γδt细胞的基因组中的表达盒包含编码工程化的tcrα(tcrα)基因、工程化的tcrβ(tcrβ)基因、tcrδ(tcrδ)基因或工程化的tcrγ(tcrγ)基因的多核苷酸。在一些情况下,并入到工程化的γδt细胞的基因组中的表达盒包含编码抗体片段或其抗原结合部分的多核苷酸。在一些情况下,抗体片段或其抗原结合片段是编码全抗体、抗体片段、单链可变片段(scfv)、单结构域抗体(sdab)、fab、f(ab)2、fc、抗体上的轻链或重链、抗体的可变区或恒定区、或其结合作为嵌合抗原受体(car)构建体的一部分的细胞表面肿瘤抗原、或双特异性构建体(包含car和t细胞受体(tcr))或具有针对不同抗原的抗体的car的任何组合的多核苷酸。在一些情况下,多核苷酸源自人或源自另一物种。可修饰源自非人物种的抗体片段或抗原结合片段多核苷酸以增加它们与人中天然产生的抗体变体的相似性,并且抗体片段或抗原结合片段可部分或完全人源化。抗体片段或抗原结合片段多核苷酸也可以是嵌合的,例如小鼠-人抗体嵌合体。表达car的工程化的γδt细胞也可被工程化以表达由肿瘤识别部分识别的抗原的配体。
可使用本领域中已知的各种技术来将包含肿瘤识别部分的遗传密码的克隆或合成工程化的核酸引入到工程化的γδt细胞的基因组内的特定位置中。如分别由wo201409370、wo2003087341、wo2014134412和wo2011090804(其各自以引用的方式整体并入本文)描述的来自微生物成簇规律间隔的短回文重复序列(crispr)系统的rna引导的cas9核酸酶、锌指核酸酶(zfn)、转录活化子样效应子核酸酶(talen)和大范围核酸酶技术可用于提供γδt细胞中的有效基因组工程化。本文所述的技术也可用于将表达盒插入到同时提供一种基因的敲除和另一种基因的敲入的基因组位置中。例如,可将包含本公开的表达盒的多核苷酸插入到编码mhc基因的基因组区域中。这种工程化可同时提供一种或多种基因(例如包含在表达盒中的基因)的敲入和另一种基因(例如mhc基因座)的敲除。
在一种情况下,将包含编码肿瘤识别部分的核酸的睡美人转座子引入到正被工程化的细胞γδt细胞中。与野生型睡美人相比提供增强的整合的突变型睡美人转座酶,如us7,985,739(其以引用的方式整体并入本文)中描述的转座酶可用于在工程化的γδt细胞中引入多核苷酸。
在一些情况下,使用病毒方法来将包含肿瘤识别部分的多核苷酸引入到工程化的γδt细胞的基因组中。许多病毒方法已被用于人基因疗法,如wo1993020221(其整体并入本文)中描述的方法。可用于工程化γδt细胞的病毒方法的非限制性实例包括逆转录病毒、腺病毒、慢病毒、单纯疱疹病毒、痘苗病毒、痘病毒或腺病毒相关的病毒方法。
含有肿瘤识别部分的遗传密码的多核苷酸可包含影响工程化的γδt细胞的生长、增殖、活化状态的突变或其他转基因或对肿瘤细胞具有特异性的抗原(如睾丸特异性癌抗原)。本公开的γδt细胞可被工程化以表达包含与抗原识别部分连接的活化结构域(如tcr-cd3复合物中的分子或共刺激因子)的多核苷酸。工程化的γδt细胞可表达为t淋巴细胞活化结构域的细胞内信号传导结构域。γδt细胞可被工程化以表达细胞内活化结构域基因或细胞内信号传导结构域。细胞内信号传导结构域基因可以是例如cd3ζ、cd28、cd2、icos、jamal、cd27、cd30、ox40、nkg2d、cd4、ox40/cd134、4-1bb/cd137、fcεriγ、ilrb/cd122、il-2rg/cd132、dap分子、cd70、细胞因子受体、cd40或其任何组合。在一些情况下,工程化的γδt细胞也被工程化以表达细胞因子、抗原、细胞受体或其他免疫调节分子。
可基于待治疗的疾病选择待由工程化的γδt细胞表达的适当肿瘤识别部分。例如,在一些情况下,肿瘤识别部分是tcr。在一些情况下,肿瘤识别部分是在癌细胞上表达的配体的受体。合适的受体的非限制性实例包括nkg2d、nkg2a、nkg2c、nkg2f、llt1、aicl、cd26、nkrp1、nkp30、nkp44、nkp46、cd244(2b4)、dnam-1以及nkp80。在一些情况下,肿瘤识别部分可包括配体,例如,il-13配体或肿瘤抗原的配体模拟物,如il13r的il-13模拟物。
γδt细胞可被工程化以表达包含源自nkg2d、nkg2a、nkg2c、nkg2f、llt1、aicl、cd26、nkrp1、nkp30、nkp44、nkp46、cd244(2b4)、dnam-1和nkp80的配体结合结构域,或抗肿瘤抗体如抗her2neu或抗egfr,以及从cd3-ζ、dap10、cd28、4ibb和cd40l获得的信号传导结构域的嵌合肿瘤识别部分。在一些实例中,嵌合受体结合mica、micb、her2neu、egfr、间皮素、cd38、cd20、cd19、psa、ron、cd30、cd22、cd37、cd38、cd56、cd33、cd30、cd138、cd123、cd79b、cd70、cd75、ca6、gd2、甲胎蛋白(afp)、癌胚抗原(cea)、ceacam5、ca-125、muc-16、5t4、napi2b、ror1、ror2、5t4、plif、her2/neu、egfrviii、gpmnb、liv-1、糖脂f77、成纤维细胞活化蛋白、psma、steap-1、steap-2、c-met、cspg4、结合素-4、vegfr2、psca、叶酸盐结合蛋白/受体、slc44a4、cripto、ctag1b、axl、il-13r、il-3r、sltrk6、gp100、mart1、酪氨酸酶、ssx2、ssx4、nyeso-1、上皮肿瘤抗原(eta)、magea家族基因(如mage3a.mage4a)、kklc1、突变ras、βraf、p53、mhci类链相关分子a(mica)、mhci类链相关分子b(micb)、hpv、cmv。
两个或更多个肿瘤识别部分可在γδt细胞中从自工程化的γδt细胞稳定表达的遗传上不同的、基本上不同的或基本上相同的αβtcr多核苷酸或者从稳定地并入工程化的γδt细胞中的遗传上不同的αβtcr多核苷酸表达。在遗传上不同的αβtcr的情况下,可利用识别与相同病状相关的不同抗原的αβtcr。在一个优选的实施方案中,γδt细胞被工程化以从人或小鼠来源、在不同mhc单倍型的背景下从识别相同抗原的一个或多个表达盒表达不同的tcr。在另一个优选的实施方案中,γδt细胞被工程化以表达一种tcr和针对来自与不同mhc单倍型复合的给定抗原的相同或不同肽的两种或更多种抗体。在一些情况下,由工程化的γδt细胞表达单一tcr有助于正确的tcr配对。表达不同tcr的工程化的γδt细胞可提供通用的同种异体工程化γδt细胞。在第二优选的实施方案中,γδt细胞被工程化以表达针对肽-mhc复合物的一种或多种不同的抗体,每种抗体针对与相同或不同的mhc单倍型复合的相同或不同的肽。在一些情况下,肿瘤识别部分可以是结合肽-mhc复合物的抗体。
γδt细胞可被工程化以从在不同mhc单倍型的背景下识别相同抗原的一个或多个表达盒表达tcr。在一些情况下,工程化的γδt细胞被设计成表达单一tcr或tcr与car的组合以最小化工程化的细胞内tcr错配的可能性。从两个或更多个表达盒表达的肿瘤识别部分优选具有不同的多核苷酸序列,并且编码识别相同靶标的不同表位的肿瘤识别部分。表达此类不同tcr或car的工程化的γδt细胞可提供通用的同种异体工程化γδt细胞。
在一些情况下,γδt细胞被工程化以表达一个或多个肿瘤识别部分。两个或更多个肿瘤识别部分可从在γδt细胞中工程化的遗传上相同或基本上相同的抗原特异性嵌合(car)多核苷酸表达。两个或更多个肿瘤识别部分可从在γδt细胞中工程化的遗传上不同的car多核苷酸表达。遗传上不同的car可被设计成识别与相同病状相关的不同抗原。
γδt细胞可选地可以是双特异性的。双特异性工程化的γδt细胞可表达两个或更多个肿瘤识别部分。双特异性工程化的γδt细胞可表达tcr和car肿瘤识别部分两者。双特异性工程化的γδt细胞可被设计成识别与相同病状相关的不同抗原。工程化的γδt细胞可表达识别相同或基本上相同的抗原的两种或更多种car/tcr双特异性多核苷酸。工程化的γδt细胞可表达识别不同抗原的两种或更多种car/tcr双特异性构建体。在一些情况下,本公开的双特异性构建体结合靶细胞的活化和失活结构域,从而提供增加的靶标特异性。γδt细胞可被工程化以表达至少1个肿瘤识别部分、至少2个肿瘤识别部分、至少3个肿瘤识别部分、至少4个肿瘤识别部分、至少5个肿瘤识别部分、至少6个肿瘤识别部分、至少7个肿瘤识别部分、至少8个肿瘤识别部分、至少9个肿瘤识别部分、至少10个肿瘤识别部分、至少11个肿瘤识别部分、至少12个肿瘤识别部分或另外合适数量的肿瘤识别部分。
可通过包含itam基序的两种功能ζ(ζ)蛋白来增强适当的tcr功能。还可通过表达αβ或γδ活化结构域如cd28、cd2、ctla4、icos、jamal、pd-1、cd27、cd30、41-bb、ox40、nkg2d、hvem或cd46来增强适当的tcr功能。表达的多核苷酸可包括肿瘤识别部分的遗传密码、接头部分和活化结构域。通过工程化的γδt细胞翻译多核苷酸可提供由蛋白质接头连接的肿瘤识别部分和活化结构域。通常,接头包含不会阻碍肿瘤识别部分和活化结构域的折叠的氨基酸。接头分子的长度可以是至少约5个氨基酸、约6个氨基酸、约7个氨基酸、约8个氨基酸、约9个氨基酸、约10个氨基酸、约11个氨基酸、约12个氨基酸、约13个氨基酸、约14个氨基酸、约15个氨基酸、约16个氨基酸、约17个氨基酸、约18个氨基酸、约19个氨基酸或约20个氨基酸。在一些情况下,接头中至少50%、至少70%或至少90%的氨基酸是丝氨酸或甘氨酸。
在一些情况下,活化结构域可包含一个或多个突变。合适的突变可以是例如使活化结构域为组成型活性的突变。改变一种或多种核酸的身份改变翻译的氨基酸的氨基酸序列。可进行核酸突变以使得编码的氨基酸被修饰成极性、非极性、碱性或酸性氨基酸。可进行核酸突变以使得肿瘤识别部分被优化以识别来自肿瘤的表位。γδt细胞的工程化的肿瘤识别部分、工程化的活化结构域或另一种工程化的组分可包含多于1个氨基酸突变、2个氨基酸突变、3个氨基酸突变、4个氨基酸突变、5个氨基酸突变、6个氨基酸突变、7个氨基酸突变、8个氨基酸突变、9个氨基酸突变、10个氨基酸突变、11个氨基酸突变、12个氨基酸突变、13个氨基酸突变、14个氨基酸突变、15个氨基酸突变、16个氨基酸突变、17个氨基酸突变、18个氨基酸突变、19个氨基酸突变、20个氨基酸突变、21个氨基酸突变、22个氨基酸突变、23个氨基酸突变、24个氨基酸突变、25个氨基酸突变、26个氨基酸突变、27个氨基酸突变、28个氨基酸突变、29个氨基酸突变、30个氨基酸突变、31个氨基酸突变、32个氨基酸突变、33个氨基酸突变、34个氨基酸突变、35个氨基酸突变、36个氨基酸突变、37个氨基酸突变、38个氨基酸突变、39个氨基酸突变、40个氨基酸突变、41个氨基酸突变、42个氨基酸突变、43个氨基酸突变、44个氨基酸突变、45个氨基酸突变、46个氨基酸突变、47个氨基酸突变、48个氨基酸突变、49个氨基酸突变或50个氨基酸突变。
在一些情况下,本公开的γδt细胞不表达一个或多个mhc分子。工程化的γδt细胞中的一个或多个mhc基因座的缺失可降低工程化的γδt细胞将被宿主免疫系统识别的可能性。被称为人白细胞抗原(hla)系统的人主要组织相容性复合物(mhc)基因座包含在抗原呈递细胞(包括γδt细胞)中表达的大基因家族。hla-a、hla-b和hla-c分子起到将细胞内肽作为抗原呈递至抗原呈递细胞的作用。hla-dp、hla-dm、hla-doa、hla-dob、hla-dq和hladr分子起到将细胞外肽作为抗原呈递至抗原呈递细胞的作用。hla基因的一些等位基因已经与gvhd、自身免疫性疾病和癌症相关。本文所述的工程化的γδt细胞可被进一步工程化以缺乏或破坏一种或多种hla基因的基因表达。本文所述的工程化的γδt细胞可被进一步工程化以缺乏或破坏mhc复合物的一种或多种组分的基因表达,如一种或多种mhc基因的完全缺失、特异性外显子的缺失或β2微球蛋白(b2m)的缺失。至少一种hla基因的遗传切除或基因破坏可提供临床治疗性γδt细胞,所述γδt细胞可施用至具有任何hla单倍型的受试者而不引起宿主抗移植物疾病。如本文所述的工程化的γδt细胞可以是具有任何hla单倍型的人受试者的通用供体。
γδt细胞可被工程化以缺乏一个或多个hla基因座(基因座)。工程化的γδt细胞可被工程化以缺乏hla-a等位基因、hla-b等位基因、hla-c等位基因、hla-dr等位基因、hla-dq等位基因或hla-dp等位基因。在一些情况下,hla等位基因与人病状如自身免疫性病状相关。例如,hla-b27等位基因已经与关节炎和葡萄膜炎相关,hla-dr2等位基因已经与全身性红斑狼疮相关,hla-dr3等位基因已经与21-羟化酶缺陷相关,hla-dr4已经与类风湿性关节炎和1型糖尿病相关。缺乏例如hla-b27等位基因的工程化的γδt细胞可施用至患有关节炎的受试者而不容易被受试者的免疫系统识别。在一些情况下,一个或多个hla基因座的缺失提供工程化的γδt细胞,所述γδt细胞是具有任何hla单倍型的任何受试者的通用供体。
在一些情况下,工程化的γδt细胞需要缺失γδt细胞基因组的一部分。在一些情况下,所述基因组的缺失部分包含mhc基因座(基因座)的一部分。在一些情况下,工程化的γδt细胞源自野生型人γδt细胞,并且mhc基因座是hla基因座。在一些情况下,所述基因组的缺失部分包含对应于mhc复合物中的蛋白质的基因的一部分。在一些情况下,所述基因组的缺失部分包含β2微球蛋白基因。在一些情况下,所述基因组的缺失部分包含免疫检查点基因,如pd-1、ctla-4、lag3、icos、btla、kir、tim3、a2ar、b7-h3、b7-h4和cecam-1。在一些情况下,工程化的γδt细胞可被设计成表达增强t细胞活化和细胞毒性的活化结构域。可由工程化的γδt细胞表达的活化结构域的非限制性实例包括:cd2、icos、4-1bb(cd137)、ox40(cd134)、cd27、cd70、cd80、cd86、dap、cd122、gitr、fcerig。
工程化的γδt细胞基因组的任何部分可缺失以破坏内源性γδt细胞基因的表达。可在γδt细胞的基因组中缺失或破坏的基因组区域的非限制性实例包括启动子、活化子、增强子、外显子、内含子、非编码rna、微小rna、小核rna、可变数量串联重复序列(vntr)、短串联重复序列(str)、snp模式、高变区、小卫星序列、二核苷酸重复序列、三核苷酸重复序列、四核苷酸重复序列或简单序列重复序列。在一些情况下,所述基因组的缺失部分的范围在1个核酸至约10个核酸、1个核酸至约100个核酸、1个核酸至约1,000个核酸、1个核酸至约10,000个核酸、1个核酸至约100,000个核酸、1个核酸至约1,000,000个核酸之间或其他合适的范围。
工程化的γδt细胞中的hla基因表达也可用本领域中已知的各种技术破坏。在一些情况下,使用大基因座基因编辑技术来从工程化的γδt细胞基因组中切除基因,或破坏工程化的γδt细胞中的至少一个hla基因座的基因表达。可用于编辑工程化的γδt细胞基因组上的所需基因座的基因编辑技术的非限制性实例包括成簇的规律间隔的短回文重复序列(crispr)-cas、锌指核酸酶(zfn)、转录活化子样效应子核酸酶(talen)和大范围核酸酶技术,如分别由wo201409370、wo2003087341、wo2014134412和wo2011090804所描述,并且所述专利各自以引用的方式整体并入本文。
γδt细胞可从已经表达肿瘤识别部分的分离的非工程化的γδt细胞工程化。工程化的γδt细胞可保留由分离的野生型γδt细胞内源表达的肿瘤细胞识别部分。在一些情况下,工程化的γδt细胞肿瘤细胞识别部分替代野生型γδtcr。
γδt细胞可被工程化以表达一种或多种归巢分子,如淋巴细胞归巢分子。归巢分子可以是例如淋巴细胞归巢受体或细胞粘附分子。归巢分子可在将工程化的γδt细胞施用至受试者时帮助工程化的γδt细胞迁移且浸润实体肿瘤,包括靶向的实体肿瘤。归巢受体的非限制性实例包括ccr家族的成员,例如:ccr2、ccr4、ccr7、ccr8、ccr9、ccr10、cla、cd44、cd103、cd62l、e-选择蛋白、p-选择蛋白、l-选择蛋白、整联蛋白,如vla-4和lfa-1。细胞粘附分子的非限制性实例包括icam、n-cam、vcam、pe-cam、l1-cam、结合素(pvrl1、pvrl2、pvrl3)、lfa-1、整联蛋白αxβ2、αvβ7、巨噬细胞-1抗原、cla-4、糖蛋白iib/iiia。细胞粘附分子的另外实例包括钙依赖性分子(如t-钙粘蛋白)以及针对基质金属蛋白酶(mmp)如mmp9或mmp2的抗体。
涉及t细胞成熟、活化、增殖和功能的步骤可通过免疫检查点蛋白通过共刺激和抑制信号进行调节。免疫检查点是免疫系统所固有的共刺激和抑制元件。免疫检查点有助于维持自身耐受性和在免疫系统对疾病状况(如细胞转化或感染)作出响应时调节生理免疫响应的持续时间和幅度,以防止对组织的损伤。用于控制来自γδ和αβt细胞的免疫响应的共刺激信号与抑制信号之间的平衡可通过免疫检查点蛋白来调节。免疫检查点蛋白如pd1和ctla4存在于t细胞的表面上,并且可用于转换免疫响应“开”或“关”。肿瘤可使检查点蛋白功能失调作为免疫抗性机制,特别是针对对肿瘤抗原具有特异性的t细胞。本公开的工程化的γδt细胞可进一步工程化以缺乏一个或多个免疫检查点基因座(基因座),如pd-1、ctla-4、lag3、icos、btla、kir、tim3、a2ar、ceacam1、b7-h3以及b7-h4。或者,本公开的工程化的γδt细胞中的内源性免疫检查点基因的表达可用基因编辑技术破坏。
免疫学检查点可以是在本公开的工程化的γδt细胞中调节抑制性信号传导途径的分子(由ctla4、pd1和lag3例示)或调节刺激信号传导途径的分子(由icos例示)。扩展型免疫球蛋白超家族中的几种蛋白质可以是免疫学检查点的配体。免疫检查点配体蛋白的非限制性实例包括b7-h4、icosl、pd-l1、pd-l2、megacd40l、megaox40l和cd137l。在一些情况下,免疫检查点配体蛋白是由肿瘤表达的抗原。在一些情况下,免疫检查点基因是ctla-4基因。在一些情况下,免疫检查点基因是pd-1基因。
pd1是属于cd28/ctla4家族的抑制性受体,并且在活化的t淋巴细胞、b细胞、单核细胞、dc和t-reg上表达。存在pd1的两种已知配体pd-l1和pd-l2,其在t细胞、apc和恶性细胞上表达,用于抑制自身反应性淋巴细胞且抑制taa特异性细胞毒性t淋巴细胞(ctl)的效应子功能。因此,缺乏pd1的工程化的γδt细胞可保留其细胞毒活性,而不管肿瘤细胞表达pd-l1和pd-l2与否。在一些情况下,本公开的工程化的γδt细胞缺乏pd-1基因的基因座。在一些情况下,工程化的γδt细胞中的pd-1基因的表达通过基因编辑技术破坏。
ctla4(细胞毒性t淋巴细胞抗原4)也称为cd152(分化簇152)。ctla4与共刺激分子cd28共享序列同源性和配体(cd80/b7-1和cd86/b7-2),但不同在于向作为受体的表达ctla4的t细胞递送抑制信号。ctla4对两种配体具有高的多的总体亲和力,并且当配体密度受限制时可超过cd28竞争结合。ctla4通常在cd8+效应t细胞的表面上表达,并且在初始和记忆t细胞的初始活化阶段中起功能性作用。ctla4经由在t细胞活化的早期阶段对cd80和cd86的增加的亲和力来抵消cd28的活性。ctla4的主要功能包括下调辅助t细胞和增强调节性t细胞免疫抑制活性。在一些情况下,本公开的工程化的γδt细胞缺乏ctla4基因。在一些情况下,工程化的γδt细胞中的ctla4基因的表达通过基因编辑技术破坏。
lag3(淋巴细胞活化基因3)在活化的抗原特异性细胞毒性t细胞上表达,并且可增强调节性t细胞的功能且独立地抑制cd8+效应t细胞活性。lag3是具有与mhcii类蛋白的高亲和力结合的cd-4样负调节蛋白,所述mhcii类蛋白在一些上皮癌上上调,从而导致t细胞增殖的耐受性和体内平衡。使用lag-3-ig融合蛋白降低lag-3/ii类相互作用可增强抗肿瘤免疫响应。在一些情况下,本公开的工程化的γδt细胞缺乏lag3基因的基因座。在一些实例中,工程化的γδt细胞中的lag3基因的表达通过基因编辑技术破坏。
工程化的γδt细胞的表型
工程化的γδt细胞可归巢至受试者体内的特定身体位置。工程化的γδt细胞的迁移和归巢可依赖于特定趋化因子和/或粘附分子的组合表达和作用。工程化的γδt细胞的归巢可通过趋化因子与其受体之间的相互作用来控制。例如,包括但不限于cxcr3(其配体由ip-10/cxcl10和6ckine/slc/ccl21表示)、ccr4+cxcr5+(rantes的受体、mip-1α、mip-1β)、ccr6+和ccr7的细胞因子可能影响工程化的γδt细胞的归巢。在一些情况下,工程化的γδt细胞可归巢至炎症和损伤的部位并且归巢至患病细胞以进行修复功能。在一些情况下,工程化的γδt细胞可归巢至癌症。在一些情况下,工程化的γδt细胞可归巢至胸腺、骨髓、皮肤、喉、气管、胸膜、肺、食道、腹部、胃、小肠、大肠、肝脏、胰腺、肾脏、尿道、膀胱、睾丸、前列腺、输精管、卵巢、子宫(uretus)、乳腺、甲状旁腺、脾脏或受试者体内的另一个部位。工程化的γδt细胞可表达一个或多个归巢部分,如特定tcr等位基因和/或淋巴细胞归巢分子。
工程化的γδt细胞可具有特定表型,并且表型可就细胞表面标志物表达而言进行描述。各种类型的γδt细胞可如本文中所述进行工程化。在优选的实施方案中,工程化的γδt细胞源自人,但是工程化的γδt细胞也可源自不同的来源,如哺乳动物或合成细胞。
抗原
本文公开的本发明提供表达抗原识别部分的工程化的γδt细胞,其中所述抗原识别部分识别疾病特异性表位。抗原可以是引发免疫响应的分子。这种免疫响应可涉及抗体产生、特异性免疫感受态细胞的活化或两者。抗原可以是例如肽、蛋白质、半抗原、脂质、碳水化合物、细菌、病原体或病毒。抗原可以是肿瘤抗原。肿瘤表位可由肿瘤细胞表面上的mhci或mhcii复合体呈递。表位可以是在细胞表面上表达并被肿瘤识别部分识别的抗原的部分。
由工程化的γδt细胞识别的抗原的非限制性实例包括cd-19、cd-30、cd-22、cd37、cd38、cd-33、cd-138、cd-123、cd-79b、cd-70、cd-75、ca6、gd2、甲胎蛋白、癌胚抗原、ca-125、muc-16、5t4、napi2b、ror1、ror2、5t4、her2/neu、egfrviii、gpmnb、liv-1、糖脂f77、成纤维细胞活化蛋白、psma、steap-1、steap-2、间皮素、c-met、cspg4、结合素-4、vegfr2、psca、叶酸盐结合蛋白受体、slc44a4、cripto、ctag1b、axl、il-13r、il-3r、sltrk6、gp100、mart1、酪氨酸酶、ssx2、ssx4、nyeso-1、上皮肿瘤抗原、magea、kklc1、突变ras、βraf、p53、mica和micb、或与病状相关的另一种抗原。参见修订列表-cd19、cd30、cd22、cd37、cd38、cd56、cd33、cd30、cd138、cd123、cd79b、cd70、cd75、ca6、gd2、甲胎蛋白(afp)、癌胚抗原(cea)、ron、ceacam5、ca-125、muc-16、5t4、napi2b、ror1、ror2、5t4、plif、her2/neu、egfrviii、gpmnb、liv-1、糖脂f77、成纤维细胞活化蛋白、psma、steap-1、steap-2、间皮素、c-met、cspg4、结合素-4、vegfr2、psca、叶酸盐结合蛋白/受体、slc44a4、cripto、ctag1b、axl、il-13r、il-3r、sltrk6、gp100、mart1、酪氨酸酶、ssx2、ssx4、nyeso-1、上皮肿瘤抗原(eta)、magea家族基因(如mage3a.mage4a)、kklc1、突变ras、βraf、p53、mhci类链相关分子a(mica)、或mhci类链相关分子b(micb)、hpv、cmv。
抗原可在细胞的细胞内或细胞外区室中表达,并且工程化的γδt细胞可识别细胞内或细胞外肿瘤抗原。在一些情况下,工程化的γδt细胞中的αβtcr识别源自细胞内或细胞外肿瘤抗原的肽。例如,抗原可以是由病毒感染的细胞细胞内或细胞外产生的蛋白质,如hiv、ebv、cmv或hpv蛋白。抗原也可以是由癌细胞细胞内或细胞外表达的蛋白质。
抗原识别部分可识别来自处于不良应激的细胞(如癌细胞或已被病毒感染的细胞)的抗原。例如,人mhci类链相关基因(mica和micb)位于染色体6的hlai类区域内。mica和micb蛋白被认为是人上皮中“应激”的标志物,并且充当表达常见的天然杀伤细胞受体(nkg2d)的细胞的配体。作为应激标志物,mica和micb可从癌细胞高度表达。工程化的γδt细胞可识别mica或micb肿瘤表位。
肿瘤识别部分可被工程化以便以一定亲合力识别抗原。例如,由tcr或car构建体编码的肿瘤识别部分可以至少10fm、至少100fm、至少1皮摩尔(pm)、至少10pm、至少20pm、至少30pm、至少40pm、至少50pm、至少60pm、至少7pm、至少80pm、至少90pm、至少100pm、至少200pm、至少300pm、至少400pm、至少500pm、至少600pm、至少700pm、至少800pm、至少900pm、至少1纳摩尔(nm)、至少2nm、至少3nm、至少4nm、至少5nm、至少6nm、至少7nm、至少8nm、至少9nm、至少10nm、至少20nm、至少30nm、至少40nm、至少50nm、至少60nm、至少70nm、至少80nm、至少90nm、至少100nm、至少200nm、至少300nm、至少400nm、至少500nm、至少600nm、至少700nm、至少800nm、至少900nm、至少1μm、至少2μm、至少3μm、至少4μm、至少5μm、至少6μm、至少7μm、至少8μm、至少9μm、至少10μm、至少20μm、至少30μm、至少40μm、至少50μm、至少60μm、至少70μm、至少80μm、至少90μm或至少100μm的解离常数识别抗原。
在一些实例中,肿瘤识别部分可被工程化以便以至多10fm、至多100fm、至多1皮摩尔(pm)、至多10pm、至多20pm、至多30pm、至多40pm、至多50pm、至多60pm、至多7pm、至多80pm、至多90pm、至多100pm、至多200pm、至多300pm、至多400pm、至多500pm、至多600pm、至多700pm、至多800pm、至多900pm、至多1纳摩尔(nm)、至多2nm、至多3nm、至多4nm、至多5nm、至多6nm、至多7nm、至多8nm、至多9nm、至多10nm、至多20nm、至多30nm、至多40nm、至多50nm、至多60nm、至多70nm、至多80nm、至多90nm、至多100nm、至多200nm、至多300nm、至多400nm、至多500nm、至多600nm、至多700nm、至多800nm、至多900nm、至多1μm、至多2μm、至多3μm、至多4μm、至多5μm、至多6μm、至多7μm、至多8μm、至多9μm、至多10μm、至多20μm、至多30μm、至多40μm、至多50μm、至多60μm、至多70μm、至多80μm、至多90μm或至多100μm的解离常数识别抗原。
γδt细胞的分离
在一些方面,本公开提供已经从受试者分离的γδt细胞的遗传工程化的方法。可从受试者的复杂样品中分离γδt细胞。复杂样品可以是外周血样品、脐带血样品、肿瘤、干细胞前体、肿瘤活组织检查、组织、淋巴或来自直接接触外部环境的受试者的上皮部位、或源自干细胞前体细胞。γδt细胞可从受试者的复杂样品中直接分离,例如通过用流式细胞术技术分选表达一种或多种细胞表面标志物的γδt细胞。野生型γδt细胞展示可与γδt细胞相关的许多抗原识别、抗原呈递、共刺激和粘附分子。一种或多种细胞表面标志物如特异性γδtcr,抗原识别、抗原呈递、配体、粘附分子或共刺激分子可用于从复杂样品中分离野生型γδt细胞。与γδt细胞相关或由γδt细胞表达的各种分子可用于从复合物样品中分离γδt细胞。在一些情况下,本公开提供用于分离vδ1+、vδ2+、vδ3+细胞或其任何组合的混合群体的方法。
外周血单核细胞可从受试者采集,例如使用血液成分分离机,包括ficoll-paquetmplus(gehealthcare)系统或另一合适的装置/系统。γδt细胞或所需的γδt细胞亚群可使用例如流式细胞术技术从所采集的样品纯化。脐带血细胞也可在受试者出生期间从脐带血获得。
在采集的γδt细胞上表达的细胞表面标志物的阳性和/或阴性选择可用于从外周血液样品、脐带血样品、肿瘤、肿瘤活组织检查、组织、淋巴或从受试者的上皮样品中直接分离表达类似细胞表面标志物的γδt细胞或γδt细胞群体。例如,可基于cd2、cd3、cd4、cd8、cd24、cd25、cd44、kit、tcrα、tcrβ、tcrγ、tcrδ、nkg2d、cd70、cd27、cd30、cd16、cd337(nkp30)、cd336(nkp46)、ox40、cd46、ccr7和其他合适的细胞表面标志物的阳性或阴性表达从复杂样品中分离γδt-细胞。
可从体外培养的复杂样品中分离γδt细胞。在一些实施方案中,可活化并扩增没有先前消耗特定细胞群体如单核细胞、αβt细胞、b细胞和nk细胞的完整pbmc群体。在其他实施方案中,可在其特异性活化和扩增之前产生富集的γδt细胞群体。在一些方面,γδt细胞的活化和扩增在不存在天然或工程化的apc的情况下进行。在一些方面,来自肿瘤样本的γδt细胞的分离和扩增可使用固定的γδt细胞有丝分裂原(包括对γδtcr具有特异性的抗体)和其他γδtcr活化剂(包括凝集素)进行。
在一些实施方案中,γδt细胞可响应于与一种或多种抗原接触而快速扩增。一些γδt细胞如vγ9vδ2+γδt细胞在组织培养过程中响应于与一些抗原(如异戊二烯基-焦磷酸酯、烷基胺以及代谢物或微生物提取物)接触而在体外快速扩增。此外,一些野生型γδt细胞如vγ2vδ2+γδt细胞在人体中响应于某些类型的疫苗接种而在体内快速扩增。刺激的γδt细胞可展示可促进从复杂样品中分离γδt细胞的许多抗原呈递、共刺激和粘附分子。复杂样品中的γδt细胞可在体外用至少一种抗原刺激1天、2天、3天、4天、5天、6天、7天或另一合适的时间段。用合适的抗原刺激γδt细胞可在体外扩增γδt细胞群体。
可用于在体外刺激从复杂样品扩增γδt细胞的抗原的非限制性实例包括异戊二烯基-焦磷酸酯如异戊烯基焦磷酸酯(ipp)、烷基胺、人微生物病原体的代谢物、共生细菌的代谢物、-甲基-3-丁烯基-1-焦磷酸酯(2m3b1pp)、(e)-4-羟基-3-甲基-丁-2-烯基焦磷酸酯(hmb-pp)、焦磷酸乙酯(epp)、焦磷酸法尼酯(fpp)、磷酸二甲基烯丙酯(dmap)、焦磷酸二甲基烯丙酯(dmapp)、三磷酸乙基-腺苷(epppa)、焦磷酸香叶酯(gpp)、焦磷酸香叶基香叶酯(ggpp)、三磷酸异戊烯基-腺苷(ipppa)、磷酸单乙酯(mep)、焦磷酸单乙酯(mepp)、3-甲酰基-1-丁基-焦磷酸酯(tubag1)、x-焦磷酸酯(tubag2)、三磷酸3-甲酰基-1-丁基-尿苷(tubag3)、三磷酸3-甲酰基-1-丁基-脱氧胸苷(tubag4)、单乙基烷基胺、焦磷酸烯丙酯、焦磷酸巴豆酯(crotoylpyrophosphate)、三磷酸二甲基烯丙基-γ-尿苷、三磷酸巴豆基-γ-尿苷、三磷酸烯丙基-γ-尿苷、乙胺、异丁胺、仲丁胺、异戊胺和含氮二膦酸酯。
γδt细胞的活化和扩增可使用本文所述的活化和共刺激剂来进行以触发特异性γδt细胞增殖和持续性群体。在一些实施方案中,来自不同培养物的γδt细胞的活化和扩增可实现不同的克隆或混合多克隆群体体亚群。在一些实施方案中,可使用不同的激动剂来鉴别提供特异性γδ活化信号的试剂。在一个方面,提供特异性γδ活化信号的试剂可以是针对γδtcr的不同单克隆抗体(mab)。在一个方面,mab可结合γtcr和/或δtcr的恒定区或可变区上的不同表位。在一个方面,mab可包括γδtcr泛mab。在一个方面,γδtcr泛mab可识别在两者(包括δ1和δ2细胞群体)上由不同的γtcr和δtcr共享的结构域。在一个方面,抗体可以是5a6.e9(thermoscientific)、b1(biolegend)、immu510和/或11f12(beckmancoulter)。在一个方面,mab可针对对γ链的可变区而言独特的特定结构域(7a5mab,针对如vγ9tcr(thermoscientific#tcr1720))或vδ1可变区上的结构域(mabts8.2(thermoscientific#tcr1730;mabtc1,mabr9.12(beckmancoulter))或vδ2链(mab15d(thermoscientific#tcr1732))。对这些mab特异性地活化和扩增独特群体vδ1或vδ2细胞亚群的能力进行了测试(图4)。图4描绘含血清培养基(r2:rpmi+10%fbs)和无血清培养基(aimv+牛白蛋白;具有cts无血清补体的cts优化无血清培养基)中的δ2t细胞生长。所有培养基含有100iu/mlil-2、2mm谷氨酰胺和1x青霉素/链霉素。在第0天时,用1、5和20μm的唑来膦酸刺激细胞。每2-3天补充培养基,而不进一步添加唑来膦酸。对于每种条件指示从106个pbmc扩增的总δ2t细胞和在13天后的倍数扩增。在一些实施方案中,可组合针对γδtcr的不同结构域的抗体(泛抗体和识别亚群群体上的特定可变区表位的抗体)以评估其增强γδt细胞活化的能力。在一些实施方案中,γδt细胞活化剂可以包括γδtcr结合剂,如mica、nkg2d的激动剂抗体、mica的(fc标签)融合蛋白、ulbp1、ulbp3(r&dsystemsminneapolis,mn)、ulbp2或ulbp6(sinobiologicalbeijing,china)。在一些实施方案中,可鉴别伴随共刺激剂以有助于触发特异性γδt细胞增殖而不诱导细胞无反应性和细胞凋亡。这些共刺激剂可包括在γδ细胞上表达的受体的配体,如nkg2d、cd161、cd70、jaml、dnax辅助分子-1(dnam-1)icos、cd27、cd137、cd30、hvem、slam、cd122、dap和cd28-。在一些方面,共刺激剂可以是对cd2和cd3分子上的独特表位具有特异性的抗体。当在αβ或γδt细胞上表达时,cd2和cd3可具有不同的构象结构,并且在一些情况下,cd3和cd2的特异性抗体可导致γδt细胞的不同活化。
γδt细胞的群体可在γδt细胞的工程化之前离体扩增。可用于在体外促进γδt细胞群体的扩增的试剂的非限制性实例包括抗cd3或抗cd2、抗cd27、抗-cd30、抗cd70、抗ox40抗体、il-2、il-15、il-12、il-9、il-33、il-18或il-21、cd70(cd27配体)、植物血凝素(pha)、伴刀豆球蛋白a(cona)、美洲商陆(pwm)、蛋白质花生凝集素(pna)、大豆凝集素(sba)、兵豆凝集素(lca)、豌豆凝集素(psa)、蜗牛凝集素(hpa)、蚕豆凝集素(vga)或能够刺激t细胞增殖的另一合适的有丝分裂原。γδt细胞的遗传工程化可包括将表达肿瘤识别部分如αβtcr、γδtcr、编码抗体的car、其抗原结合片段或淋巴细胞活化结构域的构建体稳定地整合到分离的γδt细胞的基因组中,细胞因子(il-15、il-12、il-2、il-7、il-21、il-18、il-19、il-33、il-4、il-9、il-23、il1β)以离体和体内增强t细胞增殖、存活和功能。分离的γδt细胞的遗传工程化还可包括缺失或破坏来自分离的γδt细胞的基因组中的一种或多种内源基因的基因表达(如mhc基因座(基因座))。
工程化的γδt细胞的离体扩增
在其他方面,本公开提供用于过继转移疗法的工程化的γδt细胞群体的离体扩增的方法。本公开的工程化的γδt细胞可离体扩增。本公开的工程化的γδt细胞可在不通过apc活化或不与apc和氨基磷酸酯共培养的情况下在体外扩增。
本发明的方法可扩增各种γδt细胞群体,如vγl+、vγ2+、vγ3+γδt细胞群体。在一些实例中,γδt细胞群体可在体外在少于36天、少于35天、少于34天、少于33天、少于32天、少于31天、少于30天、少于29天、少于28天、少于27天、少于26天、少于25天、少于24天、少于23天、少于22天、少于21天、少于20天、少于19天、少于18天、少于17天、少于16天、少于15天、少于14天、少于13天、少于12天、少于11天、少于10天、少于9天、少于8天、少于7天、少于6天、少于5天、少于4天、少于3天内扩增。
在一些方面,提供通过使γδt细胞与活化剂接触来扩增各种γδt细胞(包括工程化的和非工程化的γδt细胞)的方法。在一些情况下,活化剂与γδt细胞的细胞表面受体上的特异性表位结合。活化剂可以是抗体,如单克隆抗体。活化剂可特异性地活化一种或多种类型的γδt细胞,如δ1、δ2或δ3细胞群体的生长。在一些实施方案中,活化剂特异性地活化δ1细胞群体的生长。在其他情况下,活化剂特异性地活化δ2细胞群体的生长。
活化剂可刺激工程化的和非工程化的γδt细胞以快速生长速率扩增。例如,试剂刺激γδt细胞群体以在少于30小时内1次细胞分裂、在少于29小时内1次细胞分裂、在少于28小时内1次细胞分裂、在少于27小时内1次细胞分裂、在少于26小时内1次细胞分裂、在少于25小时内1次细胞分裂、在少于24小时内1次细胞分裂、在少于23小时内1次细胞分裂、在少于22小时内1次细胞分裂、在少于21小时内1次细胞分裂、在少于20小时内1次细胞分裂、在少于19小时内1次细胞分裂、在少于18小时内1次细胞分裂、在少于17小时内1次细胞分裂、在少于16小时内1次细胞分裂、在少于15小时内1次细胞分裂、在少于14小时内1次细胞分裂、在少于13小时内1次细胞分裂、在少于12小时内1次细胞分裂、在少于11小时内1次细胞分裂、在少于10小时内1次细胞分裂、在少于9小时内1次细胞分裂、在少于8小时内1次细胞分裂、在少于7小时内1次细胞分裂、在少于6小时内1次细胞分裂、在少于5小时内1次细胞分裂、在少于4小时内1次细胞分裂、在少于3小时内1次细胞分裂、在少于2小时内1次细胞分裂的平均速率扩增。
在一些情况下,活化剂可刺激工程化的和非工程化的γδt细胞以约1次分裂/约4小时的平均速率、约1次分裂/约5小时的平均速率、约1次分裂/约6小时的平均速率、约1次分裂/约7小时的平均速率、约1次分裂/约8小时的平均速率、约1次分裂/约9小时的平均速率、约1次分裂/约10小时的平均速率、约1次分裂/约11小时的平均速率、约1次分裂/约12小时的平均速率、约1次分裂/约13小时的平均速率、约1次分裂/约14小时的平均速率、约1次分裂/约15小时的平均速率、约1次分裂/约16小时的平均速率、约1次分裂/约17小时的平均速率、约1次分裂/约18小时的平均速率、约1次分裂/约19小时的平均速率、约1次分裂/约20小时的平均速率、约1次分裂/约21小时的平均速率、约1次分裂/约22小时的速率、约1次分裂/约23小时的速率、约1次分裂/约24小时的平均速率、约1次分裂/约25小时的平均速率、约1次分裂/约26小时的平均速率、约1次分裂/约27小时的平均速率、约1次分裂/约28小时的速率、约1次分裂/约29小时的速率、约1次分裂/约30小时的平均速率、约1次分裂/约31小时的平均速率、约1次分裂/约32小时的平均速率、约1次分裂/约33小时的平均速率、约1次分裂/约34小时的速率、约1次分裂/约35小时的速率、约1次分裂/约36小时的平均速率扩增。
活化剂可刺激工程化的和非工程化的γδt细胞的亚群以不同的生长速率扩增。例如,试剂可刺激δ1细胞群体以较快速率生长以使得在1天至90天培养的时间段内产生比另一γδt细胞群体,如δ2或δ3群体或另一γδ亚群大10倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1,000倍、10,000倍、100,000倍或1,000,000倍扩增。在其他情况下,所述试剂可刺激δ2或δ3群体以较快速率生长以使得在1天至90天培养的时间段内产生比δ1t细胞群体或另一γδt细胞亚群大10倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1,000倍、10,000倍、100,000倍或1,000,000倍扩增。在其他情况下,所述试剂可刺激δ2群体以较快速率生长以使得在1天至90天培养的时间段内产生比δ1t细胞群体、δ3t细胞群体或另一γδt细胞亚群大10倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍、1,000倍、10,000倍、100,000倍或1,000,000倍扩增。
在一些方面,本公开提供一种γδt细胞群体,其中所述γδt细胞群体的扩增用刺激γδt细胞群体以快速速率,如约1次细胞分裂/1小时或更快的速率扩增的试剂来活化。在一些情况下,所述试剂选择性地刺激δ1、δ2或δ3t细胞的增殖。γδt细胞群体可包含一定量的非工程化的γδt细胞和一定量的工程化的γδt细胞。在一些情况下,γδt细胞群体包含不同百分比的δ1、δ2和δ3t细胞。工程化的或非工程化的γδt细胞群体可包含例如少于90%δ1t细胞、少于80%δ1t细胞、少于70%δ1t细胞、少于60%δ1t细胞、少于50%δ1t细胞、少于40%δ1t细胞、少于30%δ1t细胞、少于20%δ1t细胞、少于10%δ1t细胞或少于5%δ1t细胞。或者,工程化的或非工程化的γδt细胞群体可包含多于5%δ1t细胞、多于10%δ1t细胞、多于20%δ1t细胞、多于30%δ1t细胞、多于40%δ1t细胞、多于50%δ1t细胞、多于60%δ1t细胞、多于70%δ1t细胞、多于80%δ1t细胞或多于90%δ1t细胞。
工程化的或非工程化的γδt细胞群体可包含例如少于90%δ2t细胞、少于80%δ2t细胞、少于70%δ2t细胞、少于60%δ2t细胞、少于50%δ2t细胞、少于40%δ2t细胞、少于30%δ2t细胞、少于20%δ2t细胞、少于10%δ2t细胞或少于5%δ2t细胞。或者,工程化的或非工程化的γδt细胞群体可包含多于5%δ2t细胞、多于10%δ2t细胞、多于20%δ2t细胞、多于30%δ2t细胞、多于40%δ2t细胞、多于50%δ2t细胞、多于60%δ2t细胞、多于70%δ2t细胞、多于80%δ2t细胞或多于90%δ2t细胞。
工程化的或非工程化的γδt细胞群体可包含例如少于90%δ3t细胞、少于80%δ3t细胞、少于70%δ3t细胞、少于60%δ3t细胞、少于50%δ3t细胞、少于40%δ3t细胞、少于30%δ3t细胞、少于20%δ3t细胞、少于10%δ3t细胞或少于5%δ3t细胞。或者,工程化的或非工程化的γδt细胞群体可包含多于5%δ3t细胞、多于10%δ3t细胞、多于20%δ3t细胞、多于30%δ3t细胞、多于40%δ3t细胞、多于50%δ3t细胞、多于60%δ3t细胞、多于70%δ3t细胞、多于80%δ3t细胞或多于90%δ3t细胞。
一种或多种活化剂可接触γδt细胞,并且之后共刺激分子可接触所述γδt细胞以提供进一步刺激且扩增所述γδt细胞。在一些实施方案中,活化剂和/或共刺激剂可以是植物和非植物来源的凝集素,活化γδt细胞的单克隆抗体以及其他非凝集素/非抗体试剂。在其他情况下,植物凝集素可以是伴刀豆球蛋白a(cona),但是可使用其他植物凝集素,如植物血凝素(pha)。凝集素的其他实例包括蛋白质花生凝集素(pna)、大豆凝集素(sba)、兵豆凝集素(lca)、豌豆凝集素(psa)、蜗牛凝集素(hpa)、蚕豆凝集素(vga)。
活化剂和共刺激分子的非限制性实例包括抗体,如5a6.e9、b1、ts8.2、15d、b6、b3、ts-1、γ3.20、7a5、immu510、r9.12、11f2或其组合。活化剂和共刺激分子的其他实例包括唑来膦酸盐、佛波醇12-肉豆蔻酸酯-13-乙酸酯(tpa)、欧瑞香素、葡萄球菌肠毒素a(sea)、链球菌蛋白a或其组合。
在其他情况下,活化剂和/或共刺激剂可以是αtcr、βtcr、γtcr、δtcr、cd277、cd28、cd46、ctla4、icos、pd-1、cd30、nkg2d、nkg2a、hvem、4-1bb(cd137)、ox40(cd134)、cd70、cd80、cd86、dap、cd122、gitr、fcerig、cd1、cd16、cd161、dnax、辅助分子-1(dnam-1)、slam、柯萨奇病毒和腺病毒受体或其组合的抗体或配体。
表位鉴别
在一个方面,本公开提供一种用于鉴别刺激工程化的和非工程化的γδt细胞以快速生长速率扩增的试剂的表位的方法。表位可包括呈独特空间构象的至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、或20个氨基酸。表位可从通过蛋白质的三级折叠并置的连续氨基酸或不连续氨基酸形成。由连续氨基酸形成的表位通常可在暴露于变性溶剂时保留,而通过三级折叠形成的表位通常可在用变性溶剂处理时丧失。
可进行表位作图以鉴别由目标活化剂识别的线性或非线性不连续氨基酸序列,即表位,如5a6.e9、b1、ts8.2、15d、b6、b3、ts-1、3.20、immu510、r9.12、11f2和7a5抗体。用于表位作图的一般方法可能需要通常在异源表达系统中表达由目标抗体或配体识别的全长多肽序列,以及各种片段,即所述多肽序列的截短形式。然后可使用这些各种重组多肽序列或其片段(例如,与n-末端蛋白(例如,gfp)融合)来确定目标抗体或配体是否能够结合所述多肽序列的一种或多种截短形式。通过使用重复截短和产生具有重叠氨基酸区域的重组多肽序列,有可能鉴别由目标抗体识别的多肽序列的区域(参见例如,epitopemappingprotocolsinmethodsinmolecularbiology,第66卷,glenne.morris,编辑(1996))。所述方法依赖于诸如目标抗体的试剂与从表位文库重新产生的序列结合的能力,所述表位文库如源自膜支持体上的合成肽阵列、组合噬菌体展示肽文库的表位文库。然后,表位文库提供针对抗体筛选的一系列可能性。另外,可追求靶向表位的一个或多个残基的位点特异性诱变或随机ala扫描,以确认表位的身份。
可通过合成设计γδt细胞受体(γδtcr)的各种可能的重组作为cdna构建体并在合适的系统中表达它们来产生表位文库。例如,可合成设计多个vδ1基因区段,在其jδ区域不同,包括jδ1、jδ2和jδ3基因区段。或者,vδ2jδ1和vδ3jδ1链也可称为合成基因并克隆到合适的载体中。可将多个合成克隆的δtcr链,如vδ1jδ1、vδ1jδ2、vδ1jδ3、vδ1jδ4、vδ2和vδ3链共转染到具有合成克隆的γtcr链(如vγ2、vγ3、vγ4、vγ5、vγ8、vγ9和vγ10合成设计的基因区段)的宿主系统中。在其他情况下,可从自人正常和恶性组织分离的人pbmc或γδt细胞提取的总rna中扩增δtcr链,如vδ1jδ1、vδ1jδ2、vδ1jδ3、vδ1jδ4、vδ2和vδ3链。
宿主系统可以是任何合适的表达系统,如293细胞、昆虫细胞或合适的体外翻译系统。转染到宿主系统中的合成设计的γδt细胞区段的多种各种可能的重组可提供例如超过25、30、35、40、45、50、55、60、65、70、75、80、85、或90种可能的γδtcr配对组合。可通过使标记的抗体如ts-1、5a6.e9、b1、ts8.2、15d、b6、b3、γ3.20、r9.12、7a5与前述文库的表位接触并检测来自标记的信号来检测试剂与所述文库中的表位之一的结合。
对于表位作图,还已经开发出已经显示映射构象不连续表位的计算算法。可通过用包括例如x射线晶体学和二维核磁共振的方法确定氨基酸的空间构象来鉴别构象表位。一些表位作图方法,如抗原:抗体复合物晶体的x射线分析可提供表位的原子分辨率。在其他情况下,可使用用于表位作图的计算组合方法来基于抗体(例如ts-1抗体或ts8.2抗体)的序列模拟潜在表位。在此类情况下,对抗体的抗原结合部分进行测序,并且使用计算模型来重建且预测抗体的潜在结合位点。
在一些情况下,本公开提供一种确定γδt细胞受体的表位的方法,所述方法包括:(a)从所述γδt细胞受体制备表位文库;(b)使所述表位文库与抗体接触;以及(b)鉴别所述表位文库中由所述抗体结合的至少一个表位的氨基酸序列。在一些情况下,抗体选自由以下组成的组:5a6.e9、b1、ts8.2、15d、b6、b3、ts-1、r9.12、11f2和7a5抗体。在一个实例中,抗体被连接至固体载体上。表位文库可包括对应于t细胞受体(如γtcr或δtcr)的连续和不连续表位的序列。在一些情况下,表位文库包括来自长度在约10个氨基酸至约30个氨基酸、长度在约10个氨基酸至约20个氨基酸或长度在约5个氨基酸至约12个氨基酸范围内的γδt细胞受体的片段。在一些情况下,抗体被标记并且标记是放射性分子、发光分子、荧光分子、酶或生物素。
治疗方法
可施用含有本文所述的工程化的γδt细胞的药物组合物用于预防性和/或治疗性治疗。在治疗性应用中,可以足以治愈或至少部分地阻止疾病或病状的症状的量向已经患有所述疾病或病状的受试者施用组合物。还可施用工程化的γδt细胞以降低发展、感染或恶化病状的可能性。用于治疗用途的工程化的γδt细胞群体的有效量可基于疾病或病状的严重性和和病程、先前疗法、受试者的健康状况、体重和/或对药物的反应、和/或主治医师的判断而不同。
本公开的工程化的γδt细胞可用于治疗需要治疗病状的受试者。病状的实例包括癌症、感染性疾病、自身免疫性病症和败血症。受试者可以是人、非人类灵长类动物如黑猩猩和其他猿类和猴物种;农场动物如牛、马、绵羊、山羊、猪;家养动物如兔、狗和猫;实验室动物包括啮齿类动物,如大鼠、小鼠和豚鼠等。受试者可具有任何年龄。受试者可以是例如老年人、成人、青少年、青春期前儿童、儿童、幼儿、婴儿。
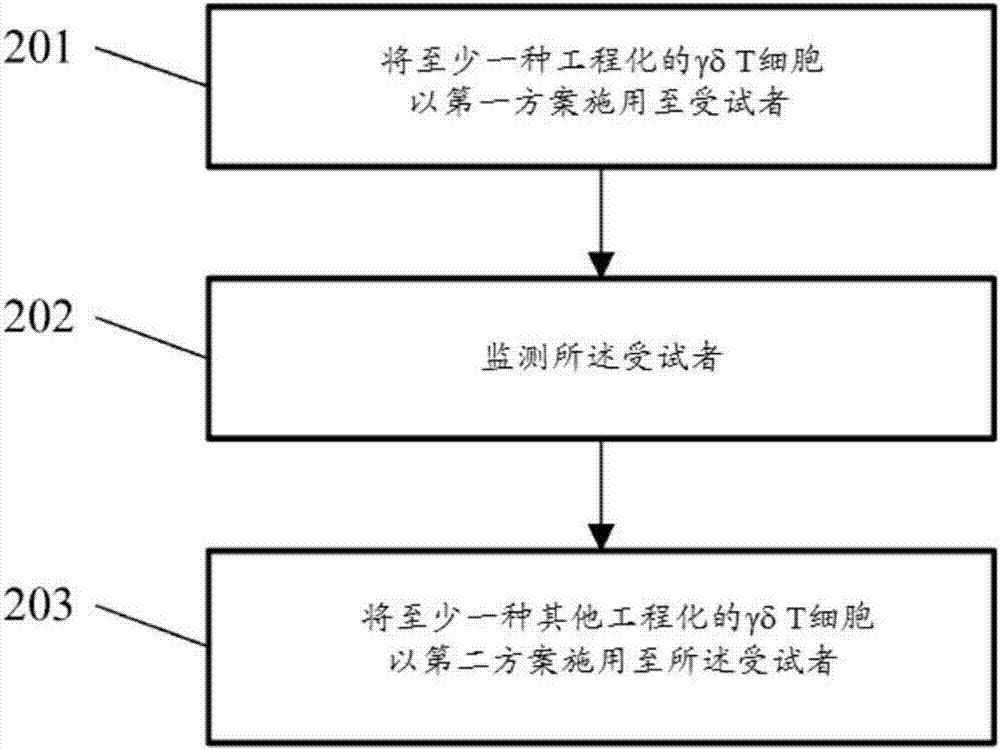
用γδt细胞治疗受试者的病状(例如,小病)的方法可包括向所述受试者施用治疗有效量的工程化的γδt细胞。本公开的γδt细胞可以各种方案(例如,时间、浓度、剂量、治疗间隔和/或制剂)施用。受试者也可在接受本公开的工程化的γδt细胞之前用例如化学疗法、放射或两者的组合进行预处理。作为治疗的一部分,可以第一方案向受试者施用工程化的γδt细胞,并且可监测受试者以确定第一方案的治疗是否达到给定水平的治疗功效。在一些情况下,可以第二方案向受试者施用工程化的γδt细胞或另一种工程化的γδt细胞。图2示意性地示出用于治疗受试者的方法。在第一操作201中,向患有或疑似患有给定病状(例如癌症)的受试者施用至少一种工程化的γδt细胞。工程化的γδt细胞可以第一方案施用。在第二操作202中,可例如由医疗保健提供者(例如,主治医师或护士)来监测受试者。在一些实例中,监测受试者以确定或评估工程化的γδt细胞在治疗受试者的病状中的功效。在一些情况下,还可监测受试者以确定受试者中γδt细胞群体的体内扩增。接下来,在第三操作203中,以第二方案向受试者施用至少一种其他工程化的γδt细胞。第二方案可与第一方案相同或不同于第一方案。在一些情况下,例如,如果第一操作201中的工程化的γδt细胞的施用被发现是有效的(例如,单轮施用可足以治疗病状),则不执行第三操作203。由于工程化的γδt细胞群体同种异体和通用供体特征,可将它们施用至具有不同mhc单倍型的各种受试者。工程化的γδt细胞可在施用至受试者之前冷冻或冷冻保存。
工程化的γδt细胞群体也可在施用至受试者之前冷冻或冷冻保存。工程化的γδt细胞群体可包含两种或更多种表达相同、不同或相同和不同肿瘤识别部分的组合的细胞。例如,工程化的γδt细胞群体可包含几种不同的工程化的γδt细胞,所述γδt细胞被设计成识别不同抗原或相同抗原的不同表位。例如,患有黑素瘤的人细胞可表达ny-eso-1癌基因。人体内的感染细胞可将ny-eso-1癌蛋白加工成更小的片段,并且呈递ny-eso-1蛋白的各种部分以用于抗原识别。工程化的γδt细胞群体可包含各种工程化的γδt细胞,所述γδt细胞表达被设计成识别ny-eso-1蛋白的不同部分的不同肿瘤识别部分。图3示意性地示出用识别黑素瘤抗原ny-eso-1的不同表位的工程化的γδt细胞群体治疗受试者的方法。在第一操作301中,选择识别相同抗原的不同表位的工程化的γδt细胞群体。例如,工程化的γδt细胞群体可包含两种或更多种表达不同肿瘤识别部分的细胞,所述肿瘤识别部分识别ny-eso-1蛋白的不同部分。在第二操作302中,可在第一方案施用工程化的γδt细胞群体。在第二操作303中,可例如由医疗保健提供者(例如,主治医师或护士)来监测受试者。
本公开的γδt细胞可用于治疗各种病状。在一些情况下,本公开的工程化的γδt细胞可用于治疗癌症,包括实体肿瘤和血液恶性肿瘤。癌症的非限制性实例包括:急性成淋巴细胞性白血病、急性骨髓性白血病、肾上腺皮质癌、aids相关癌症、aids相关淋巴瘤、肛门癌、阑尾癌、星形细胞瘤、成神经细胞瘤、基底细胞癌、胆管癌、膀胱癌、骨癌、脑肿瘤(如小脑星形细胞瘤、大脑星形细胞瘤/恶性神经胶质瘤)、室管膜瘤、成神经管细胞瘤、幕上原始神经外胚层肿瘤、视通路和下丘脑神经胶质瘤、乳腺癌、支气管腺瘤、伯基特淋巴瘤、未知原发起源癌、中枢神经系统淋巴瘤、小脑星形细胞瘤、子宫颈癌、儿童期癌症、慢性淋巴细胞性白血病、慢性髓细胞性白血病、慢性骨髓性增生病症、结肠癌、皮肤t细胞淋巴瘤、促结缔组织增生性小圆细胞肿瘤、子宫内膜癌、室管膜瘤、食管癌、尤文氏肉瘤、生殖细胞肿瘤、胆囊癌、胃癌、胃肠道类癌肿瘤、胃肠道间质瘤、神经胶质瘤、毛细胞白血病、头颈癌、心脏癌症、肝细胞(肝)癌、霍奇金淋巴瘤、下咽癌、眼内黑素瘤、胰岛细胞癌、卡波西肉瘤、肾癌、喉癌、唇和口腔癌、脂肪肉瘤、肝癌、肺癌(如非小细胞和小细胞肺癌)、淋巴瘤、白血病、巨球蛋白血症、骨/骨肉瘤的恶性纤维组织细胞瘤、成神经管细胞瘤、黑素瘤、间皮瘤、具有潜伏原发性的转移性鳞状颈癌、口腔癌、多发性内分泌腺肿瘤综合征、骨髓增生异常综合征、骨髓性白血病、鼻腔和鼻旁窦癌、鼻咽癌、成神经细胞瘤、非霍奇金淋巴瘤、非小细胞肺癌、口腔癌、口咽癌、骨肉瘤/骨恶性纤维组织细胞瘤、卵巢癌、卵巢上皮癌、卵巢生殖细胞肿瘤、胰腺癌、胰岛细胞胰腺癌、鼻旁窦和鼻腔癌、甲状旁腺癌、阴茎癌、咽癌、嗜铬细胞瘤、松果体星形细胞瘤、松果体生殖细胞瘤、垂体腺瘤、胸膜肺母细胞瘤、浆细胞瘤形成、原发性中枢神经系统淋巴瘤、前列腺癌、直肠癌、肾细胞癌、肾盂和输尿管移行细胞癌、成视网膜细胞瘤、横纹肌肉瘤、唾液腺癌、肉瘤、皮肤癌、梅克尔细胞皮肤癌、小肠癌、软组织肉瘤、鳞状细胞癌、胃癌、t细胞淋巴瘤、喉癌、胸腺瘤、胸腺癌、甲状腺癌、滋养细胞肿瘤(妊娠期)、未知原发部位的癌症、尿道癌、子宫肉瘤、阴道癌、外阴癌、瓦尔登斯特伦巨球蛋白血症和威尔姆斯肿瘤。
在一些情况下,本公开的工程化的γδt细胞可用于治疗感染性疾病。感染性疾病可由例如致病菌或病毒引起。各种致病性蛋白质、核酸、脂质或其片段可由患病细胞表达。抗原呈递细胞可例如通过吞噬或通过受体介导的内吞作用内化此类致病分子,并且展示结合至适当mhc分子的抗原的片段。例如,可通过apc展示致病性蛋白质的各种9聚体片段。本公开的工程化的γδt细胞可被设计成识别致病菌或病毒的各种抗原和抗原片段。致病菌的非限制性实例可在以下中找到:a)博德特氏菌属,如百日咳博德特氏菌种;b)疏螺旋体属,如伯氏疏螺旋体种;c)布鲁氏菌属,如流产布鲁氏菌、犬布鲁氏菌、马耳他布鲁氏菌和/或猪布鲁氏菌种;d)弯曲杆菌属,如空肠弯曲杆菌种;e)衣原体和嗜衣原体属,如肺炎衣原体、沙眼衣原体和/或鹦鹉热嗜衣原体种;f)梭菌属,如肉毒梭菌、艰难梭菌、产气荚膜梭菌、破伤风梭菌种;g)棒状杆菌属,如白喉棒状杆菌种;h)肠球菌属,如粪肠球菌和/或屎肠球菌种;i)埃希氏菌属,如大肠杆菌种;j)弗朗西斯氏菌属,如土拉弗朗西斯氏菌种;k)嗜血杆菌属,如流感嗜血杆菌种;1)螺杆菌属,如幽门螺杆菌种;m)军团菌属,如嗜肺军团菌种;n)钩端螺旋体属,如问号钩端螺旋体种;o)李斯特菌属,如单核细胞增多性李斯特菌种;p)分枝杆菌属,如麻风分枝杆菌、结核分枝杆菌和/或溃疡分枝杆菌种;q)支原体属,如肺炎支原体种;r)奈瑟氏菌属,如淋病奈瑟氏菌和/或脑膜炎奈瑟氏菌种;s)假单胞菌属,如铜绿假单胞菌种;t)立克次氏体属,如立氏立克次氏体种;u)沙门氏菌属,如伤寒沙门氏菌和/或鼠伤寒沙门氏菌种;v)志贺氏菌属,如宋内志贺氏菌种;w)葡萄球菌属,如金黄色葡萄球菌、表皮葡萄球菌和/或腐生葡萄球菌种;x)链球菌属,如无乳链球菌、肺炎链球菌和/或酿脓链球菌种;y)密螺旋体属,如梅毒螺旋体种;z)弧菌属,如霍乱弧菌;和/或aa)耶尔森氏菌属,如鼠疫耶尔森氏菌种。
在一些情况下,本公开的工程化的γδt细胞可用于治疗感染性疾病,感染性疾病可由病毒引起。病毒的非限制性实例可在以下病毒的科中找到并且用示例性种进行说明:a)腺病毒科,如腺病毒种;b)疱疹病毒科,如1型单纯疱疹、2型单纯疱疹、水痘-带状疱疹病毒、埃-巴二氏病毒、人巨细胞病毒、8型人疱疹病毒种;c)乳头瘤病毒科,如人乳头瘤病毒种;d)多瘤病毒科,如bk病毒、jc病毒种;e)痘病毒科,如天花病毒种;f)嗜肝dna病毒科,如乙型肝炎病毒种;g)细小病毒科,如人博卡病毒、细小病毒b19种;h)星状病毒科,如人星状病毒种;i)杯状病毒科,如诺沃克病毒种;j)黄病毒科,如丙型肝炎病毒(hcv)、黄热病毒、登革热病毒、西尼罗河病毒种;k)披膜病毒科,如风疹病毒种;l)肝炎病毒科,如戊型肝炎病毒种;m)逆转录病毒科,如人免疫缺陷病毒(hiv)种;n)正粘病毒科,如流感病毒种;o)沙粒病毒科,如瓜纳瑞托病毒、胡宁病毒、拉沙病毒、马丘波病毒和/或萨比亚病毒种;p)布尼亚病毒科,如克里米亚-刚果出血热病毒种;q)丝状病毒科,如埃博拉病毒和/或马尔堡病毒种;副粘病毒科,如麻疹病毒、腮腺炎病毒、副流感病毒、呼吸道合胞病毒、人偏肺病毒、亨德拉病毒和/或尼帕病毒种;r)弹状病毒科属,如狂犬病病毒种;s)呼肠孤病毒科,如轮状病毒、环状病毒、科蜱病毒和/或版纳病毒种。在一些实例中,病毒未分配至病毒科,如丁型肝炎。
在一些情况下,本公开的工程化的γδt细胞可用于治疗免疫疾病,如自身免疫性疾病。炎性疾病(包括自身免疫性疾病)也是一类与b细胞病症相关的疾病。可用本文公开的工程化的γδt细胞治疗的免疫疾病或病状(包括自身免疫性病状)的实例包括:类风湿性关节炎、风湿热、多发性硬化、实验性自身免疫性脑脊髓炎、银屑病、葡萄膜炎、糖尿病、全身性红斑狼疮(sle)、狼疮性肾炎、湿疹、硬皮病、多肌炎/硬皮病、多肌炎/皮肌炎、溃疡性直肠炎、严重联合免疫缺陷(scid)、迪格奥尔格综合征(digeorgesyndrome)、共济失调毛细血管扩张、季节性过敏、常年过敏、食物过敏、过敏反应、肥大细胞增多症、过敏性鼻炎、特应性皮炎、帕金森病、阿尔茨海默氏病、脾功能亢进、白细胞粘附缺陷、x连锁淋巴组织增生性疾病、x连锁无丙种球蛋白血症、选择性免疫球蛋白a缺乏症、超igm综合征、hiv、自身免疫性淋巴组织增生综合征、威斯科特-奥尔德里奇综合征、慢性肉芽肿病、普通可变型免疫缺陷(cvid)、高免疫球蛋白e综合征、桥本氏甲状腺炎、急性特发性血小板减少性紫癜、慢性特发性血小板减少性紫癜、皮肌炎、西登哈姆氏舞蹈病、重症肌无力、多腺体综合征、大疱性类天疱疮、亨-舍二氏紫癜、链球菌感染后肾炎、结节性红斑、多形性红斑、ga肾病、高安氏动脉炎、阿狄森氏病、肉样瘤病、溃疡性结肠炎、结节性多动脉炎、强直性脊柱炎、古德帕斯彻氏综合征、血栓闭塞性脉管炎、干燥综合征、原发性胆汁性肝硬化、桥本氏甲状腺炎、甲状腺毒症、慢性活动性肝炎、多软骨炎、寻常天疱疮、韦格纳氏肉芽肿病、膜性肾病、肌萎缩性脊髓侧索硬化、脊髓痨、巨细胞性动脉炎、/多肌痛、恶性贫血、快速进行性肾小球性肾炎、银屑病、纤维化性肺泡炎和癌症。
可在病状临床发作之前、期间和之后向受试者提供使用本公开的γδt细胞的治疗。可在疾病临床发作后1天、1周、6个月、12个月或2年后向受试者提供治疗。可在疾病临床发作之后向受试者提供治疗持续超过1天、1周、1个月、6个月、12个月、2年、3年、4年、5年、6年、7年、8年、9年、10年或更长。可在疾病临床发作后向受试者提供治疗持续少于1天、1周、1个月、6个月、12个月或2年。治疗还可包括在临床试验中治疗人。治疗可包括向受试者施用包含本公开的工程化的γδt细胞的药物组合物。
在一些情况下,向受试者施用本公开的工程化的γδt细胞调节受试者体内的内源性淋巴细胞的活性。在一些情况下,向受试者施用工程化的γδt细胞向内源性t细胞提供抗原并可增强免疫响应。在一些情况下,记忆t细胞是cd4+t细胞。在一些情况下,记忆t细胞是cd8+t细胞。在一些情况下,向受试者施用工程化的γδt细胞活化另一种免疫细胞的细胞毒性。在一些情况下,另一种免疫细胞是cd8+t细胞。在一些情况下,另一种免疫细胞是天然杀伤t细胞。在一些情况下,向受试者施用工程化的γδt细胞抑制调节性t细胞。在一些情况下,调节性t细胞是fox3+treg细胞。在一些情况下,调节性t细胞是fox3-treg细胞。活性可通过本公开的工程化的γδt细胞调节的细胞的非限制性实例包括:造血干细胞;b细胞;cd4;cd8;红血细胞;白血细胞;树突状细胞,包括树突状抗原呈递细胞;白细胞;巨噬细胞;记忆b细胞;记忆t细胞;单核细胞;自然杀伤细胞;中性粒细胞;t辅助细胞;以及t杀伤细胞。
在大多数骨髓移植期间,通常使用环磷酰胺与全身照射的组合来防止受试者的免疫系统排斥移植物中的造血干细胞(hsc)。在一些情况下,进行供体骨髓与白细胞介素-2(il-2)的离体孵育以增强供体骨髓中杀伤性淋巴细胞的产生。白细胞介素-2(il-2)是野生型淋巴细胞生长、增殖和分化所需的细胞因子。对γδt细胞过继转移到人体中的当前研究可能需要共同施用γδt细胞和白细胞介素-2。然而,低剂量和高剂量的il-2可能具有高毒性副作用。il-2毒性可在多种器官/系统中显现,最显著是心脏、肺、肾脏和中枢神经系统。在一些情况下,本公开提供一种在不共同施用细胞因子如il-2、il-15、il-12、il-21的情况下向受试者施用工程化的γδt细胞的方法。在一些情况下,可在不与il-2共同施用的情况下向受试者施用工程化的γδt细胞。在一些情况下,在手术如骨髓移植期间在不共同施用il-2的情况下向受试者施用工程化的γδt细胞。
施用方法
一种或多种工程化的γδt细胞可以任何顺序或同时施用至受试者。如果同时,则多种工程化的γδt细胞可以单一统一形式(如静脉内注射)或以多种形式(例如作为多次静脉内输注、皮下、注射液或丸剂)提供。工程化的γδt细胞可一起或单独地包装在单个包装或多个包装中。可以多个剂量给予一种或所有工程化的γδt细胞。如果不是同时,则多次剂量之间的时间可变化多达约一周、一个月、两个月、三个月、四个月、五个月、六个月或约一年。在一些情况下,在施用至受试者之后,工程化的γδt细胞可在受试者的身体内体内扩增。可将工程化的γδt细胞冷冻以提供用于使用相同细胞制剂的多次治疗的细胞。本公开的工程化的γδt细胞和包含所述γδt细胞的药物组合物可包装为试剂盒。试剂盒可包括关于使用工程化的γδt细胞和包含所述γδt细胞的组合物的说明书(例如,书面说明书)。
在一些情况下,治疗癌症的方法包括向受试者施用治疗有效量的工程化的γδt细胞,其中所述施用治疗所述癌症。在一些实施方案中,施用治疗有效量的工程化的γδt细胞持续至少约10秒、30秒、1分钟、10分钟、30分钟、1小时、2小时、3小时、4小时、5小时、6小时、12小时、24小时、2天、3天、4天、5天、6天、1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月或1年。在一些实施方案中,施用治疗有效量的工程化的γδt细胞持续至少一周。在一些实施方案中,施用治疗有效量的工程化的γδt细胞持续至少两周。
本文所述的工程化的γδt细胞可在疾病或病状发生之前、期间或之后施用,并且施用含有工程化的γδt细胞的药物组合物的时间可变化。例如,工程化的γδt细胞可用作预防剂,并且可连续施用至倾向于病状或疾病的受试者以降低所述疾病或病状发生的可能性。工程化的γδt细胞可在症状发作期间或之后尽快施用至受试者。可在症状发作内、在症状发作的前3小时内、在症状发作的前6小时内、在症状发作的前24小时内、在症状发作的48小时内或在距症状发作的任何时间段内立即开始施用工程化的γδt细胞。初始施用可通过任何可行的途径进行,如使用本文所述的任何制剂通过本文所述的任何途径进行。在一些实例中,本公开的工程化的γδt细胞的施用是静脉内施用。可在癌症、感染性疾病、免疫疾病、败血症或骨髓移植发作后尽快地施用工程化的γδt细胞一个或多个剂量,并且持续用于治疗免疫疾病所需的一段时间,例如像约24小时至约48小时、约48小时至约1周、约1周至约2周、约2周至约1个月、约1个月至约3个月。对于癌症的治疗,工程化的γδt细胞的一个或多个剂量可在癌症发作之后数年且在其他治疗之前或之后施用。在一些实例中,可施用工程化的γδt细胞持续至少约10分钟、30分钟、1小时、2小时、3小时、4小时、5小时、6小时、12小时、24小时、至少48小时、至少72小时、至少96小时、至少1周、至少2周、至少3周、至少4周、至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少1年、至少2年、至少3年、至少4年或至少5年。治疗的长度可因每个受试者而异。
剂量
本文公开的工程化的γδt细胞可配制成适于单次施用精确剂量的单位剂型。在一些情况下,单位剂型包含另外的淋巴细胞。在单位剂型中,将制剂分成含有适量的一种或多种化合物的单位剂量。单位剂量可呈含有离散量的制剂的包装形式。非限制性实例是包装的片剂或胶囊,和于小瓶或安瓿中的粉剂。水性悬浮液组合物可包装在单剂量不可再封闭的容器中。可使用多剂量可再封闭容器,例如与防腐剂组合或不含防腐剂。在一些实例中,药物组合物不包含防腐剂。用于胃肠外注射的制剂可以单位剂型呈现,例如,在具有防腐剂的安瓿或多剂量容器中。
本文所述的工程化的γδt细胞可在组合物中以至少5个细胞、至少10个细胞、至少20个细胞、至少30个细胞、至少40个细胞、至少50个细胞、至少60个细胞、至少70个细胞、至少80个细胞、至少90个细胞、至少100个细胞、至少200个细胞、至少300个细胞、至少400个细胞、至少500个细胞、至少600个细胞、至少700个细胞、至少800个细胞、至少900个细胞、至少1x103个细胞、至少2x103个细胞、至少3x103个细胞、至少4x103个细胞、至少5x103个细胞、至少6x103个细胞、至少7x103个细胞、至少8x103个细胞、至少9x103个细胞、至少1x104个细胞、至少2x104个细胞、至少3x104个细胞、至少4x104个细胞、至少5x104个细胞、至少6x104个细胞、至少7x104个细胞、至少8x104个细胞、至少9x104个细胞、至少1x105个细胞、至少2x105个细胞、至少3x105个细胞、至少4x105个细胞、至少5x105个细胞、至少6x105个细胞、至少7x105个细胞、至少8x105个细胞、至少9x105个细胞、至少1x106个细胞、至少2x106个细胞、至少3x106个细胞、至少4x106个细胞、至少5x106个细胞、至少6x106个细胞、至少7x106个细胞、至少8x106个细胞、至少9x106个细胞、至少1x107个细胞、至少2x107个细胞、至少3x107个细胞、至少4x107个细胞、至少5x107个细胞、至少6x107个细胞、至少7x107个细胞、至少8x107个细胞、至少9x107个细胞、至少1x108个细胞、至少2x108个细胞、至少3x108个细胞、至少4x108个细胞、至少5x108个细胞、至少6x108个细胞、至少7x108个细胞、至少8x108个细胞、至少9x108个细胞、至少1x109个细胞或更多个细胞的量存在。
治疗有效剂量的本发明的工程化的γδt细胞可以是约1个细胞至约10个细胞、约1个细胞至约100个细胞、约1个细胞至约10个细胞、约1个细胞至约20个细胞、约1个细胞至约30个细胞、约1个细胞至约40个细胞、约1个细胞至约50个细胞、约1个细胞至约60个细胞、约1个细胞至约70个细胞、约1个细胞至约80个细胞、约1个细胞至约90个细胞、约1个细胞至约100个细胞、约1个细胞至约1x103个细胞、约1个细胞至约2x103个细胞、约1个细胞至约3x103个细胞、约1个细胞至约4x103个细胞、约1个细胞至约5x103个细胞、约1个细胞至约6x103个细胞、约1个细胞至约7x103个细胞、约1个细胞至约8x103个细胞、约1个细胞至约9x103个细胞、约1个细胞至约1x104个细胞、约1个细胞至约2x104个细胞、约1个细胞至约3x104个细胞、约1个细胞至约4x104个细胞、约1个细胞至约5x104个细胞、约1个细胞至约6x104个细胞、约1个细胞至约7x104个细胞、约1个细胞至约8x104个细胞、约1个细胞至约9x104个细胞、约1个细胞至约1x105个细胞、约1个细胞至约2x105个细胞、约1个细胞至约3x105个细胞、约1个细胞至约4x105个细胞、约1个细胞至约5x105个细胞、约1个细胞至约6x105个细胞、约1个细胞至约7x105个细胞、约1个细胞至约8x105个细胞、约1个细胞至约9x105个细胞、约1个细胞至约1x106个细胞、约1个细胞至约2x106个细胞、约1个细胞至约3x106个细胞、约1个细胞至约4x106个细胞、约1个细胞至约5x106个细胞、约1个细胞至约6x106个细胞、约1个细胞至约7x106个细胞、约1个细胞至约8x106个细胞、约1个细胞至约9x106个细胞、约1个细胞至约1x107个细胞、约1个细胞至约2x107个细胞、约1个细胞至约3x107个细胞、约1个细胞至约4x107个细胞、约1个细胞至约5x107个细胞、约1个细胞至约6x107个细胞、约1个细胞至约7x107个细胞、约1个细胞至约8x107个细胞、约1个细胞至约9x107个细胞、约1个细胞至约1x108个细胞、约1个细胞至约2x108个细胞、约1个细胞至约3x108个细胞、约1个细胞至约4x108个细胞、约1个细胞至约5x108个细胞、约1个细胞至约6x108个细胞、约1个细胞至约7x108个细胞、约1个细胞至约8x108个细胞、约1个细胞至约9x108个细胞或约1个细胞至约1x109个细胞。
在一些情况下,本发明的工程化的γδt细胞的治疗有效剂量可以是约1x103个细胞至约1个细胞至约2x103个细胞、约1x103个细胞至约3x103个细胞、约1x103个细胞至约4x103个细胞、约1x103个细胞至约5x103个细胞、约1x103个细胞至约6x103个细胞、约1x103个细胞至约7x103个细胞、约1x103个细胞至约8x103个细胞、约1x103个细胞至约9x103个细胞、约1x103个细胞至约1x104个细胞、约1x103个细胞至约2x104个细胞、约1x103个细胞至约3x104个细胞、约1x103个细胞至约4x104个细胞、约1x103个细胞至约5x104个细胞、约1x103个细胞至约6x104个细胞、约1x103个细胞至约7x104个细胞、约1x103个细胞至约8x104个细胞、约1x103个细胞至约9x104个细胞、约1x103个细胞至约1x105个细胞、约1x103个细胞至约2x105个细胞、约1x103个细胞至约3x105个细胞、约1x103个细胞至约4x105个细胞、约1x103个细胞至约5x105个细胞、约1x103个细胞至约6x105个细胞、约1x103个细胞至约7x105个细胞、约1x103个细胞至约8x105个细胞、约1x103个细胞至约9x105个细胞、约1x103个细胞至约1x106个细胞、约1x103个细胞至约2x106个细胞、约1x103个细胞至约3x106个细胞、约1x103个细胞至约4x106个细胞、约1x103个细胞至约5x106个细胞、约1x103个细胞至约6x106个细胞、约1x103个细胞至约7x106个细胞、约1x103个细胞至约8x106个细胞、约1x103个细胞至约9x106个细胞、约1x103个细胞至约1x107个细胞、约1x103个细胞至约2x107个细胞、约1x103个细胞至约3x107个细胞、约1x103个细胞至约4x107个细胞、约1x103个细胞至约5x107个细胞、约1x103个细胞至约6x107个细胞、约1x103个细胞至约7x107个细胞、约1x103个细胞至约8x107个细胞、约1x103个细胞至约9x107个细胞、约1x103个细胞至约1x108个细胞、约1x103个细胞至约2x108个细胞、约1x103个细胞至约3x108个细胞、约1x103个细胞至约4x108个细胞、约1x103个细胞至约5x108个细胞、约1x103个细胞至约6x108个细胞、约1x103个细胞至约7x108个细胞、约1x103个细胞至约8x108个细胞、约1x103个细胞至约9x108个细胞或约1x103个细胞至约1x109个细胞。
保存
在一些实施方案中,γδt细胞可配制在冷冻介质中并置于低温储存装置如液氮冷冻器(-195c)或超低温冷冻器(-65c、-80c或-120c)中用于长期储存至少约1个月、2个月、3个月、4个月、5个月、6个月、1年、2年、3年或至少5年。冷冻介质可含有二甲亚砜(dmso)和/或氯化钠(nacl)和/或葡萄糖、和/或硫酸葡聚糖和/或羟乙基淀粉(hes)与生理ph缓冲剂,以将ph保持在约6.0至约6.5、约6.5至约7.0、约7.0至约7.5、约7.5至约8.0或约6.5至约7.5。冷冻保存的γδt细胞可被解冻并通过用如本文所述的抗体、蛋白质、肽和/或细胞因子刺激进一步加工。冷冻保存的γδt细胞可被解冻并且用如本文所述的病毒载体(包括逆转录病毒和慢病毒载体)或非病毒手段(包括rna、dna和蛋白质)遗传修饰。修饰的γδt细胞可进一步冷冻保存以产生在冷冻介质中至少约101、102、103、104、105、106、107、108、109或至少约1010个细胞/ml下的至少约1、5、10、100、150、200、500个小瓶的量的细胞库。冷冻保存的细胞库可保留其功能性并且可被解冻并进一步刺激和扩增。在一些方面,解冻的细胞可在合适的封闭容器如细胞培养袋和/或生物反应器中进行刺激和扩增以产生大量的作为同种异体细胞产物的细胞。冷冻保存的γδt细胞可在低温储存条件下维持其生物学功能持续至少约6个月、7个月、8个月、9个月、10个月、11个月、12个月、13个月、15个月、18个月、20个月、24个月、30个月、36个月、40个月、50个月或至少约60个月。在一些方面,制剂中不使用防腐剂。冷冻保存的γδt细胞可被解冻并作为同种异体现成细胞产物输注到多个患者中。
可通过参考以下实施例更好地理解本发明,所述实施例并不意图限制权利要求的范围。
实施例
实施例1.原代细胞分离
原代人外周血单核细胞(pbmc)使用血液成分分离机自健康供体收集。使用ficolll-paquetmplus(gehealthcarebio-sciencesab,uppsala,sweden)系统或类似的系统纯化pbmc。然后将细胞再悬浮在适当的生长培养基中。
或者,原代人细胞自外周血、脐带血、骨髓、健康组织或罹患疾病的组织如癌组织收集。
实施例2.来自健康供体的组织
来自健康供体的新鲜组织从thecooperativehumantissuenetwork(chtn)接收并在rpmi-1640培养基中运送至实验室。使用手术刀将组织切成1-3mm3片段。将2-5个片段/孔在24孔板(costar)中置于补充有glutamax、25mmhepesph7.2、100u/ml青霉素、100u/ml链霉素和10%人ab血清和100iu/mlrhil-2的2mlrpmi-1640中或如下文所述进行消化。将板在湿润孵育箱中在37℃、在空气中5%co2下孵育。每隔一天检查培养物以监测淋巴细胞的增殖。在培养开始后每7天替换所有孔中的一半培养基。当致密淋巴细胞地毯状覆盖物覆盖源自消化组织的达到合适浓度的片段或淋巴细胞群体的周围时收集淋巴细胞,如下文所述。
实施例3.组织酶消化
来自健康供体的新鲜组织样品从thecooperativehumantissuenetwork(chtn)接收并在rpmi-1640培养基中运送至实验室。使用两种酶共混物liberasetmdl研究级(sigmaaldrichco.,st.louis,mo)或liberasetmtm研究级(sigmaaldrichco.,st.louis,mo)通过酶消化分离淋巴细胞。将组织切割成2-3mm3片段并在370c和5%co2下消化1小时。使消化的细胞悬浮液通过40微米过滤器,离心沉淀且用rpmi-1640培养基洗涤。将细胞计数且再悬浮于补充有10%人ab血清(coming)和100iu/mlrhil-2的rpmi培养基(gibcobrl)中。将收集的细胞群体以0.5至1x106个细胞/ml接种于24孔组织培养板中。当细胞超过1.5x106个细胞/ml的浓度时,将细胞分到含有rpmi-il2的培养基中。
实施例4.肿瘤样本的培养
来自患有原发癌和转移癌(包括结肠癌、乳腺癌、卵巢癌、肾癌、头颈癌、口腔癌、胰腺癌和肝癌)的患者的新鲜肿瘤样本接收自thecooperativehumantissuenetwork(chtn)并在rpmi培养基中运送至实验室。使用手术刀将肿瘤样本切成1-3mm3片段。将2-5个片段/孔在24孔板(costar)中置于补充有glutamax、25mmhepesph7.2、100u/ml青霉素、100u/ml链霉素和10%人ab血清和100iu/mlrhil-2的2mlrpmi-1640中。将板在湿润孵育箱中在37℃、在空气中5%co2下孵育。每隔一天检查培养物以监测淋巴细胞的增殖。在培养开始后每7天替换所有孔中的一半培养基。当致密淋巴细胞地毯状覆盖物覆盖所述片段的周围时收集淋巴细胞。
实施例5.新鲜肿瘤样本酶消化
来自患有原发癌和转移癌(包括结肠癌、乳腺癌、卵巢癌、肾癌、头颈癌、口腔癌、胰腺癌和肝癌)的患者的新鲜肿瘤样本接收自thecooperativehumantissuenetwork(chtn)并在rpmi培养基中运送至实验室。使用两种酶共混物liberasetmdl研究级(sigmaaldrichco.,st.louis,mo)或liberasetmtm研究级(sigmaaldrichco.,st.louis,mo)通过酶消化分离淋巴细胞。将组织切割成2-3mm3片段并在37℃、在空气中5%co2下消化1小时。使消化的细胞悬浮液通过40微米过滤器,离心沉淀且用rpmi-1640培养基洗涤。将细胞计数且再悬浮于补充有10%人ab血清(coming)和100iu/mlrhil-2的rpmi培养基(gibcobrl)中。将收集的细胞群体以0.5至1x106个细胞/ml接种于24孔组织培养板中。当细胞超过1.5x106个细胞/ml的浓度时,将细胞分到含有rpmi-il2的培养基中。
实施例6.示例性补充血清的培养基中原代细胞的培养
通过使用ficoll-paquetmplus(gehealthcarebio-sciencespa,usa)从源自健康供体的血沉棕黄层分离来产生pbmc群体。将pbmc在24孔组织培养板中在补充有10%胎牛血清(gibco)、2mmol/ll-谷氨酰胺、100u/ml青霉素、100u/ml链霉素和100rhil-2/ml的rpmi-1640(comingcellgro)中以1x106个细胞/ml培养。
类似的培养条件可用于生长从外周血、脐带血、骨髓、健康组织或罹患疾病的组织(如先前描述的癌组织)收集的原代人细胞。
实施例7.示例性无血清培养基中原代细胞的培养
通过使用ficoll-paquetmplus(gehealthcarebio-sciencespa,usa)从源自健康供体的血沉棕黄层分离来产生pbmc群体。将pbmc以1x106个细胞/ml在24孔组织培养板中在具有cts-optmizer补充剂的cts无血清培养基中培养。
类似的培养条件可用于生长从外周血、脐带血、骨髓、健康组织或罹患疾病的组织(如先前描述的癌组织)收集的原代人细胞。
实施例8:粘附单核细胞和巨噬细胞的消耗
如先前所描述使用血液成分分离法收集pmbc,并且使用ficoll梯度离心通过低渗处理或密度分离除去红血细胞。将不含红血细胞的pbmc在大规模组织培养容器如10堆栈或40堆栈细胞工厂(nunc)、辊式瓶(nunc)中孵育。包含巨噬细胞和单核细胞的粘附群体通常保持结合至细胞培养容器的表面。在悬浮群体中生长的细胞群体富集在γδt细胞中。将大约108、109或1010个pbmc与cd4和cd8涂覆的含铁微珠(例如miltenyibiotechmicrobeads)一起孵育。使孵育的细胞群体流通过磁场,其中cd4+和cd8+t细胞被保留。“流过”细胞群体富集γδt细胞。
实施例9:单核细胞和巨噬细胞的消耗
如先前所描述使用血液成分分离法收集pmbc,并且使用ficoll梯度离心通过低渗处理或密度分离除去红血细胞。将不含红血细胞的pbmc在大规模组织培养容器如10堆栈或40堆栈细胞工厂(nunc)、辊式瓶(nunc)中孵育。通过使去除红血细胞的pbmc流过填充的玻璃棉柱来除去单核细胞和巨噬细胞。“流过”细胞群体富集γδt细胞以用于进一步加工。
实施例10:γδt细胞的富集
如先前所描述使用血液成分分离法收集pmbc,并且使用ficoll梯度离心通过低渗处理或密度分离除去红血细胞。将不含红血细胞的pbmc在大规模组织培养容器如10堆栈或40堆栈细胞工厂(nunc)、辊式瓶(nunc)中孵育。使用实施例8或实施例9中描述的方法消耗单核细胞和巨噬细胞。将大约108、109或1010个pbmc与cd4和cd8涂覆的含铁微珠(例如miltenyibiotechmicrobeads)一起孵育。使孵育的细胞群体流通过磁场,其中cd4+和cd8+t细胞被保留。“流过”细胞群体富集γδt细胞。使用针对不想要的细胞类型的抗体的混合物将不想要的细胞如nk、γδt细胞、b细胞、单核细胞和巨噬细胞通过免疫磁珠分离(例如miltenyibiotechautomacs系统)除去。
或者,通过使用针对在nk、abt细胞、b细胞、单核细胞和巨噬细胞上的表面受体的四聚体抗体复合物或双特异性抗体除去不想要的细胞类型。
实施例11.使用抗体从原代细胞分离γδt细胞
在一个实例中,基于细胞表面标志物的阳性(即γδtcr)或阴性(即αβtcr、cd4、cd8、cd56)表达,使用流式细胞术分选从原代培养物分离天然γδt细胞。
实施例12.从原发性肿瘤分离γδt细胞
新鲜收获的肿瘤样本从ncicooperativehumantissuenetwork(chtn)获得。将转移至肝的结肠腺癌(til1)和肾肿瘤(til2)在rpmi-1640培养基中运送。如所描述,使用平刀片、随后用rpmi中的2mlliberase酶混合物(sigmachemicalco.,st.louis,mo)和3000单位的dna酶消化来将肿瘤组织切碎成2mm3大小的小片。在消化之后,将肿瘤通过无菌纱布40-微米尼龙网过滤且在rpmi-1640中洗涤两次。将细胞计数且在24孔板中以1x106/ml置于补充有l-谷氨酰胺和100u/mlrhil-2的含有10%人ab血清的rpmi-1640中。在6天之后收集培养物中的肿瘤浸润淋巴细胞。通过流式细胞术抗δ1tcr(fitc缀合的抗vδ1ts8.2(thermofisher)和抗vδ2b6(biolegend)分析γδt淋巴细胞的存在。用flowjo软件分析数据。
图4描绘示出分离自转移至肝的结肠腺癌(til1)和肾肿瘤(til2)的γδ1和γδ2淋巴细胞的生长的图。这些淋巴细胞已经显示表达ccr4和ccr7。如图4所示,vδ1亚群是从这两种类型的肿瘤分离的主要群体。
实施例13.γδt细胞的刺激和扩增
将γδt细胞在含有细胞因子(il-2、il-4、il-7、il-15、il-12、il-21、il-23或il-33)、生长因子(胰岛素和转铁蛋白、胰岛素样生长因子)、白蛋白、脂质(胆固醇、脂质溶液、脂质前体)、维生素、铜、铁、硒、蛋白水解物、必需氨基酸、非必震氨基酸以及剪切保护基(pluronicf-68)的无血清培养基如ex-vivo10、ex-vivo15、ex-vivo20、aimv培养基、optimizercts中刺激并扩增。
在此实施例中描述的无血清培养基可补充有添加剂以支持在悬浮培养(例如wave生物反应器)中在105至2x107个细胞/ml之间的高细胞密度γδt细胞生长,同时维持γδt细胞的生物功能性。
实施例14.在无血清培养基中提供稳健γδt细胞生长的添加剂
提供稳健γδt细胞生长的另外添加剂包括无水氯化钙、硝酸钙、五水硫酸铜、柠檬酸铁、硝酸铁、硫酸亚铁、硫酸锌和/或腐胺。
在无血清培养基中提供痕量金属以提供用于替代血清的低水平的元素组分,包括仲钼酸铵、钒、锰、镍、亚硒酸钠、一水偏硅酸钠、氯化亚锡、氯化铝、乙酸钡、氯化镉、氯化铬、钴、二氧化锗、溴化钾、碘化钾、氯化铷、硝酸银、氟化钠和/或氯化氧锆。
添加至细胞培养基的支持γδt细胞的稳健生长的其他组分是腺苷、鸟苷、胞苷、尿苷、甜菜碱、牛磺酸、亚叶酸、乙醇胺、亚油酸、油酸、氢化可的松、丙酮酸酯、植物水解物、酵母水解物和/或β-巯基乙醇。
添加以促进稳健γδt细胞生长的维生素包括:生物素(b7)、d-泛酸钙(b5)、氯化胆碱、氰钴胺(b12)、叶酸(b9)、内消旋肌醇(肌醇)、烟酰胺(b3)、吡哆醛、单盐酸盐、吡哆醇、单盐酸盐(b6)、核黄素(b2)、硫胺素和/或单盐酸盐(b1)。
实施例15:扩增的γδt细胞的表征:免疫表型
通过区分不同群体的细胞表面标志物的facs染色来表征扩增的t细胞群体。将细胞在含有2%胎牛血清的hepes缓冲盐水溶液(hbss)中洗涤一次,在4℃下与适当量的mab一起孵育30分钟且在hbss中再次洗涤。简言之,将1x106个细胞在100ul体积facs染色培养基(fsm;含有2%胎牛血清的hbss)中染色,所述facs染色培养基含有与针对cd2、cd3(biolegend,克隆okt3)、cd4(biolegend克隆okt4)、cd7、cd8(biolegend,克隆rpat8)、cd11a、cd16、cd18、cd19、cd27、cd28、cd38、cd45ra、cd56、cd57、cd69、cd71、cd95、cd107、icam-1、mica/b、nkg2ddr5、ccr1、ccr2、ccr3、ccr4、ccr5、ccr6、ccr7、ccr10、cxcr1、cxcr2、cxcr3、cxcr5、cxcr5、cxcr6、cxcr7、il-2r、il-7r、ki67、l-选择蛋白、vla-4、jaml、pd1、pdl1、ctla-4、ox40、tcrv81(thermofisherscientific,克隆ts8.2)或tcrvδ2(biolegend,克隆b6)的mab缀合的异硫氰酸荧光素(fitc)或藻红蛋白(pe)。
除表面标志物之外,还对细胞因子分泌、细胞内细胞因子和/或膜相关细胞因子进行表征,包括tnf-αifn-γ、gm-csf、il-1、il-2、il-4、il-6、il-7、il-10、il-17或il-21。
通过zombie紫(biolegend)胺燃料的不存在或低并入确定活细胞。荧光扣除对照(fmo)对照用于定义每种抗原的表面表达的阳性和阴性门边界。将染色的细胞收集在使用sonysh800血细胞计数器上且使用flowjov10.1分析数据。将流式细胞术数据可视化为点曲线图。
实施例16.含血清和无血清培养基中的δ2t细胞扩增
在含血清培养基(r2:rpmi+10%fbs)和无血清培养基(aimv+牛白蛋白;cts无血清补充剂)中评估不同δ2t细胞的生长和扩增速率。图5描绘示出δ2t细胞的生长的图。用于当前实验的所有培养基含有100iu/mlil-2、2mm谷氨酰胺和1x青霉素/链霉素。此外,在第0天时,用1、5和20μm的唑来膦酸刺激细胞。每2-3天补充培养基,而不进一步添加唑来膦酸。在13天的时间段后从106个pbmc扩增的δ2t细胞总数和每种处理的倍数扩增在图5中示出。
实施例17.抗γδtcr抗体阻断和竞争测定
图6和图7描绘示出抗γδtcr抗体阻断实验的图,并且图8和图9描绘抗体竞争测定。图6和图7示出与各种抗体,即5a6.e9、b1、ts8.2、15d、b3、b6、ts-1、γ3.20、immu510或11f2一起预孵育的pbmc的阻断实验的结果。随后将细胞洗涤并且用第二ts8.2-fitc(δ1-特异性)或b6-pe(δ2-特异性)抗体染色。通过流式细胞术对pbmc样品进行分析。几何平均荧光强度(gmfi)的降低用于评定阻断程度。针对ts8.2-fitc(图6)且针对b6-pe(fig.7)示出抑制水平。
通过在冰上同时用1、2或10μg的未标记的竞争抗体(igg1、5a6.e9、b1、ts8.2、ts-1、r9.12、immu510或11f2)和0.2μg的fitc缀合的抗vδ1tcr克隆ts8.2(图8)或抗vδ1tcr克隆ts-1(图9)孵育1x105个细胞30分钟来进行mabts-1和ts8.2与抗体5a6.e9、b1、immu510、r9.12-2或11f2之间对于在表达γδ1tcr的细胞系be13上结合的竞争研究。%竞争通过几何平均荧光的变化除以几何平均荧光的最大变化来计算。如图9中所描绘,ts-1抗体与ts8.2抗体本身同样有效地与ts8.2竞争结合所述细胞。其他抗体中没有一个能够与ts8.2结合竞争。ts8.2抗体与ts-1竞争结合所述细胞,但不如ts-1本身一样有效。还用11f2抗体观察到一定水平的与ts-1结合的竞争。这些结果表明ts-1和ts8.2抗体两者均结合至γδ1,但是可能不在相同表位处。
实施例18.肿瘤样本的酶消化和使用针对特异性γδ表位的抗体进行的γδt细胞扩增
将24孔板涂覆0.5-1μg抗γδtcr抗体。将如实施例10中所描述分离自消化的肿瘤组织的细胞计数且在抗体涂覆的孔上以0.5-1x106个细胞/ml接种于补充有10%人ab血清和rhil-2(100iu/ml)的rpmi1640培养基中。将培养物在37℃、5%co2下孵育74-21天。
实施例19.肿瘤样本的酶消化和使用针对特异性γδ表位的抗体进行的γδt细胞扩增
将如实施例5中所描述分离自消化的肿瘤组织的细胞计数且在3d细胞培养板(
实施例20.来自pbmc的γδt细胞的活化和扩增
将活化剂作为可溶性试剂或固定在培养孔上的试剂进行测试。将可溶性抗原和抗体以0.1-5μg/ml的最终浓度添加至在24孔板中以1x106个细胞/ml的细胞密度培养的人pbmc。或者,通过24孔培养板的涂覆孔固定相同的抗γδtcr抗体。以0.1-10μg/ml浓度添加抗γδtcr抗体。将孔用pbs洗涤两次,然后将pbmc转移至所述板且在如上文所述的rpmi-1640、aim-v或cts-optmizer培养基中培养。培养基补充有100iu/ml的rhil-2。
实施例21.来自pbmc的γδt细胞的活化和扩增
在第0天将来自供体b3的一百万个pbmc/ml用以0.5、1和2μg/孔固定于24孔板中的各种抗体刺激。所测试的抗体是小鼠igg1同种型对照克隆mg1-45(biolegend)、ucht-1、5a6.e9、b1、ts8.2、15d、b6、b3、ts-1、γ3.20、7a5和唑来膦酸盐。图10和图11描绘分别示出来自pbmc的δ1和δ2t细胞的活化和扩增的图。将细胞活化且在含有具有10%fbs、100iu/mlrhil-2、谷氨酰胺和1x青霉素链霉素的rpmi中的培养基中扩增。在初始刺激之后的第7天,使细胞在新鲜培养基中传代并且置于具有相同浓度的相同抗体的新涂覆的24孔板中。每2-3天补充再刺激的培养物中的培养基直到第13天且通过流式细胞术进行分析
图12示出δ1t细胞的总数,并且图13示出在13天生长和扩增后δ2t细胞的总数。γδt细胞的总数通过将δ1和δ2t细胞的百分比(如通过流式细胞术分别使用ts8.2-fitc和b6-pe测定)乘以活细胞总数且从通过非特异性小鼠iggmg1-45活化的δ1和δ2t细胞中减去阴性对照值来进行计算。
仅当抗体被固定在培养板上时获得细胞扩增的活化,当这些抗体被添加至可溶形式的培养物,包括全pbmc细胞群体中(数据未显示)时没有检测到的扩增。泛γδtcrmab5a6.e9和b1活化δ1和δ2细胞群体的生长。mab15d和b6诱导δ2细胞群体的选择性生长。mabts8.2和ts-1诱导δ1细胞群体的选择性生长。令人感兴趣的是虽然mabts-1和ts8.2在结合细胞表面tcr方面彼此竞争,但ts-1诱导的增殖高3倍。类似地,在抗体b1、5a6.e9、15d、b6和b3之间检测到不同程度的δ2细胞群体增殖诱导。此数据表明需要独特的表位来触发γδ细胞群体的特异性和稳健扩增。
实施例22.活化γδtcrmab的表位作图
如下文针对ts-1mab所描述来鉴别γδtcr上的特异性活化表位。进行类似的步骤以鉴别活化本文所述的抗体的其他γδ的活化表位。
首先,鉴别由ts-1识别的特异性γδ重组。通过用人t细胞急性成淋巴细胞性白血病γδ细胞系molt-13(brenner等人,us005260223a)免疫小鼠来产生ts-1抗体(thermofisherscientific)。对molt-13γδtcr链进行了测序且鉴别了特异性δ链重排以包括vδ1dδ3jδ1基因区段。为了确定ts-1结合特异性是否是对vδ1的可变区或结合位点是否跨越包括vδ1-jδ1接点的tcrcdr3区且为了评定γ链在表位识别中的作用,将广泛γ链和δ链的组克隆在pci表达载体(promega)中。不同设计的γ和δtcr链被称为来自idt的合成gblock。将用nhei-noti消化的合成基因克隆到pci-neo载体中。通过测序确认来自单独细菌菌落的质粒dna的序列。
设计了三种vδ1基因区段,在其jδ区域不同(jδ1、jδ2和jδ3)。此外,vδ2jδ1和vδ3jδ1链被称为合成基因且类似地克隆。使用vγ2、vγ3、vγ4、vγ5、vγ8、vγ9和vγ10基因区段用γtcr链共转染五个δtcr链(vδ1jδ1、vδ1jδ2、vδ1jδ3、vδ2和vδ3)。将γδtcr的35种可能的配对组合在293转染细胞的表面上转染且表达。使用lipofectamine2000(invitrogen)进行用编码γδ链的pci载体瞬时转染293细胞。使用具有不同特异性的一组抗γδtcr抗体通过流式细胞术将转染的293细胞针对γδtcr的表达进行表征。在facscanto流式细胞仪(bdbiosciences)上进行facs分析,且使用flowjo软件(treestar)进行分析。一旦鉴别由ts-1mab识别的特异性γδtcr链配对,就将特异性结合表位表征为线性或表征为构象依赖性的。
通过蛋白质印迹分析确认抗体结合变性的或天然tcr的能力。通过在具有蛋白酶抑制剂混合物(sigma)的冰冷改性的ripa溶解缓冲液中均化来制备表达tcr的细胞的细胞溶解产物。通过bradford测定(bio-rad蛋白质测定,微量培养板标准测定)来测定蛋白质浓度。将细胞溶解产物在含有5%b-巯基乙醇的1xsds负载缓冲液(50mmtris-hc1ph6.8、12.5%甘油、1%十二烷基硫酸钠、0.01%溴酚蓝)中煮沸5分钟,且在聚丙烯酰胺凝胶电泳(page)上运行。在电泳之后,将分开的分子转移到pvdf膜上。接着,将膜封闭且与抗体一起孵育。第二荧光标记的抗体用于在荧光成像系统帮助下检测。
通过蛋白质印迹分析检测与δ链的结合的情况下,使用源自反应性链的多肽序列的一组合成膜结合重叠肽。(jpt肽技术gmbhgermany)。肽阵列包括重叠的12聚体肽,具有覆盖vδ1的单个残基偏移,如下进行完整序列spot扫描分析。将膜在tbs中洗涤三次且在封闭缓冲液(tbst(tbs中的0.05%tween20)中的5%低脂乳)中封闭过夜。将膜在tbs中洗涤且与在室温下在封闭缓冲液中在1μg/ml下稀释的tcs-1mab一起孵育3小时。
在tbs中洗涤膜三次之后,用在室温下在封闭缓冲液中稀释2小时的hrp缀合的山羊抗小鼠igg(jacksonimmunreaserch)检测结合的mab。将膜最终在tbs中洗涤三次且与信号显色溶液一起孵育。允许显色反应在室温下显色10至40分钟。结合位点由阳性肽斑点的序列表示。
实施例23.构象表位的表位作图
对于抗体的结合表位的适当折叠/组装需要形成二硫键的表位被称为构象表位。关键结合残基的鉴别可通过反应性vδ链的定点诱变来进行。针对对特异性抗体的反应性的损失来对突变链进行测试。当另外无反应性链中的关键残基的诱变导致ts-1抗体的结合恢复时,可鉴别由结合位点涵盖的残基。
反应性tcr链的随机ala扫描可用于评定ts-1mab的结合亲和力的变化、丧失的识别或增加的亲和力。
实施例24.γδt细胞活化和扩增的新颖调节因子的表位作图
cd2表位:
cd2分子包括两个细胞外免疫球蛋白超家族结构域ig样v型结构域和ig样c型结构域,已经关于所述结构域描述了三个主要免疫原性区域(davis等人,immunoltoday1996;17:177-187)。区域1和2位于第一结构域中,并且区域3位于第二结构域中。识别区域1的单克隆抗体(mab)结合静止和活化的t细胞两者且可强烈抑制cd58与cd2的结合。识别区域2的单克隆抗体具有类似的结合特性,但在阻断cd58结合方面不是有效的。识别区域3的单克隆抗体仅识别活化的t细胞上的cd2,并且不阻断cd58结合。
通过针对cd58(cd2的天然配体)的竞争测定和活化测定来进行cd2激动剂mab的结合表位的作图。此外,针对mab结合对导致cd58的结合丧失的关键cd2结合残基的定点诱变进行测试。突变的实例包括cd2序列在位置67(k至r)、70(q至k)、110(y至d)和在位置111(d至h)处的诱变。为了设计用于cd2的结合表位的作图的构建体,进行使用vectornti(thermofisher)的人和小鼠cd2的序列比对。比对显示人与小鼠cd2之间的50%序列同源性。结合人cd2的细胞外结构域的mab不被预期与小鼠cd2交叉反应。为了鉴别结合表位,产生小鼠/人嵌合cd2构建体的结构域交换。在此类构建体中,将人n末端ig样v型结构域(残基25-128)在表达cd2的细胞外结构域的表达载体中用小鼠残基(23-121)置换。将嵌合cdna物种瞬时转染到cho或293细胞中。人野生型cd2和人小鼠嵌合构建体在cho细胞的表面上表达。通过facscanto分析嵌合cd2细胞表面表达。与嵌合分子的结合或结合的丧失通过流式细胞术进行检测且通过活化测定进行验证。
nkg2d表位:
通过抗hnkg2d抗体减少或阻断nkg2d与一种或多种其配体(mica/micb)的相互作用或通过与已知阻断hnkg2d配体相互作用的抗体竞争来测试针对nkg2d的活化mab的表位作图。通过激动剂mab减少nkg2d介导的nk或t细胞活化的能力来鉴别激动剂mab。这可通过典型细胞毒性测定、添加配体阻断抗体或通过以剂量依赖性方式阻断γδt细胞介导的表达mica的肿瘤细胞的杀伤来评价。
cd27表位:
针对cd27的激动剂抗体的表位作图通过功能性测定以及其阻断人cd27与其天然配体人cd70之间的相互作用的能力来进行。将表达cd27的细胞与5μg的mab一起在4℃下孵育30分钟,之后将1μg的生物素化的cd70添加至管。在洗涤之前将混合物在4℃下孵育另外15分钟。接着,将细胞与链霉亲和素-pe(用于检测cd70配体结合)的混合物一起孵育30分钟,接着若干次洗涤步骤且使用facs分析。cd70结合的阻断指示mab和cd70共享相同表位。
实施例25:扩增的γδt细胞群体的tcrvδ谱系的表征
用聚合酶链式反应(pcr)评定来自单独供体的扩增的γδt细胞的克隆多样性。将来自健康供体的新鲜分离的pbmc的克隆多样性与用本文所述的不同活化剂(包括抗tcr特异性抗体、配体和凝集素)刺激7和13天的培养物的克隆多样性进行比较。
将来自前述γδt细胞的rna提取、逆转录到cdna中,且使用vδ1、vδ2和vδ3特异性引物对通过pcr进行扩增。vδ1正向引物(5’atgctgttctccagcctgctgtgtgtattt3’;seqidno:1)vδ2正向引物(5’atgcagaggatctcctccctcatccatct3’;seqidno:2)和vδ3正向引物(5’atgattcttactgtgggctttagctttttg3’;seqidno:3)与cδ反向引物(5’cttggggtagaattccttcaccagacaagc3’;seqidno:4)组合使用以扩增500bpdna片段。
使用vγ特异性引物在单独的rt-pcr反应中扩增γ链以扩增vγ2、vγ3、vγ4和vγ5(5’ggtgcttctagctttcctgtctcctgc3’)、vγ8(5’atgctgttggctctagctctgcttcta3’)和vγ9(5’atgctgtcactgctccacacatcaacg3’)。将vγ引物与cγ反向引物(5’ggaagaaaaatagtgggcttgggggaa3’)配对。γ反向引物基于cγ1和cγ2的共有序列。克隆pcr片段并且获得80个独立vγ插入片段的核苷酸序列。对vδ、dδ和jδ连接序列进行分析,连同cdr3序列比对。
实施例26:用于工程化γδt细胞的mab和相关靶向构建体
人cd20基因获自cdna克隆(origenetechnologies,inc.,6taftcourt,suite100,rockville,md.20850)。使用正向引物(5'atgacaacacccagaaattcagtaaatgg3')和反向引物(5'tcaaggagagctgtcattttctattggtg3')扩增cd20基因,将扩增的cd20cdna并入到作为哺乳动物细胞的高表达载体的pcdna3.4(thermofisherscientific)中,并且转染到作为宿主细胞的cho细胞中。通过facs分析鉴别在其细胞表面上以高水平表达cd20分子的重组cho细胞(cd20/cho细胞)。
使用cd20/cho细胞来免疫balb/c小鼠或工程化为产生完全人抗体的转基因小鼠,如jakobovits和bornstein(jakobovitscurr.opin.biotechnol.19956:561-6;bornstein等人,investnewdrugs.201028:561-74.)中所描述。通过facs测定筛选对人cd20具有高亲和力和特异性的抗体。将小鼠抗体通过cdr接枝人源化(kim和hongmethodsmolbiol.2012;907:237-45。还从工程化为产生人重链单结构域抗体的小鼠或大鼠产生了人单结构域cd20抗体(janssens等人,pnas2006第103卷:15130)。
将编码以上所述的高亲和力/特异性cd20抗体的基因克隆到msgv1逆转录病毒载体主链或pcag慢病毒载体中。vh和vl结构域克隆自表达所选择的mab的小鼠杂交瘤或人源化抗体链。用本文所述的cd20mab工程化γδt细胞。
实施例27:用于工程化γδt细胞的tcr构建体
表达包含高反应性αβtcr链的序列的tcr的构建体分离自表达ny-eso-1-mhc特异性肽复合物的t淋巴细胞。ny-eso-1-mhc特异性肽复合物诱导针对各种表达nyeso-1的肿瘤的有效体外和体内抗肿瘤活性。
高反应性αβtcr链分离自黑素瘤、肉瘤患者或分离自携带源自人黑素瘤或肉瘤肿瘤的患者源性异种移植物的小鼠。或者,tcr源自被改变为具有表达ny-eso-1肽或nyeso-1-肽复合物的人源化免疫系统的小鼠(参见gonzales等人,immunolres.201357:326-334;boucherma等人,jimmuno.2013.191;583-593;liang-pingl.等人,naturemed.2010,16:1029-1035)。鉴别了在显性i类等位基因hla-a*02(例如,肽sllmwitqc残基157-167)和显性hla-a*01相关肽的背景下识别ny-eso-1-肽的表位的t细胞。
使用一步rt-pcr试剂盒(qiagenhildengermany)根据制造商的建议通过逆转录-聚合酶链式反应(rt-pcr)产生tcrα和tcrβ转录物的序列。从自反应性t细胞分离的rna产生第一链cdna。用trizol总rna分离试剂(invitrogenlifetechnologies)从ctl克隆萃取总rna。tcrα和β链的扩增通过可结合tcrα和β链的高度保守区域的一组简并引物进行。围绕氨基酸位置34和35(kabat编号)处的色氨酸-酪氨酸残基为中心的v区与α和β恒定区反向引物组合使用(moonka和lohjournalofimmunologicalmethods169(1994)41-51)。将扩增的pcr片段凝胶纯化且直接测序。序列信息用于设计适合用于克隆单独全长cdna的pcr引物。
将tcr基因克隆且插入到基于msgv的逆转录病毒载体和从分泌的t细胞扩增的全长cdna中。使用msgv1主链构建编码野生型ny-eso-1-反应性人tcr的α链和β链两者的逆转录病毒载体。tcrα和tcrβ链的连接经由一种构建体中的内部核糖体进入位点(ires)元件或通过使用可裂解的picorovirus肽序列分离来进行。
通过如先前所描述使用lipofectamine2000(invitrogen)用每种msgv1tcr载体和编码内源性病毒逆转录病毒包膜蛋白的载体共转染稳定地表达mmlv标签和pol蛋白质的293细胞或通过使用nucleofector(lonza)电穿孔来产生逆转录病毒上清液。在转染后第2天和第3天收集上清液,并且用含有10%fcs的新鲜dmem1:1稀释。工程化的γδt细胞能够适当得地表达编码tcrα和β链的基因而无任何进一步操纵。
实施例28.用αβtcr构建体工程化γδt细胞
使用标准技术从被选择为对所需抗原具有特异性的t细胞克隆包含αβtcr(肿瘤识别部分)的多核苷酸。将分离的内源性野生型γδt细胞用在先前实施例中描述的方法生长至至少6x106个细胞,之后用包含编码肿瘤识别部分的表达盒的逆转录病毒或慢病毒感染。用于病毒感染的标准方案可用于将载体系统引入到野生型γδt细胞中。选择标志物的表达用于选择已经成功转染的细胞。
可针对细胞毒性和细胞因子选择使用靶细胞通过流式细胞术和/或通过定量qrt-pcr和通过功能测定来评价工程化的αβtcr的表达。还可通过流式细胞术和/或通过定量qrt-pcr来评价工程化的活化结构域的表达。通过流式细胞术测定表达目标细胞表面标志物的工程化的γδt细胞的数目。用本文所述的合适方法,如crispr-cas、talen、大范围核酸酶、锌指或睡美人转座子技术对工程化的γδt细胞进行进一步工程化以缺失与hla基因或β2m基因相关的外显子。
实施例29:用car和tcr构建体工程化γδt细胞
将γδt细胞用基于逆转录病毒或慢病毒的载体转导以表达靶向部分,所述靶向部分能够引导工程化的γδt细胞特异性地识别肿瘤细胞和变得活化以便杀伤它。转导的靶向部分包括针对肿瘤特异性表面蛋白或肿瘤特异性细胞内肽的mab。还用针对肽-mhc复合物的高亲和力tcr工程化γδt细胞。
或者,可经由用非病毒载体转导来工程化细胞。
实施例30:用靶向部分工程化分离的γδt细胞
car构建体设计包括不同主功能结构域、识别肿瘤细胞上展示的目标蛋白质或mhc相关肽的靶部分、将细胞外受体靶向元件连接至跨膜结构域的短间隔区,所述短间隔区横跨细胞膜且连接至细胞内活化信号传导结构域。
在γδt细胞的表面上表达的靶部分受体将被设计成特异性地结合在癌细胞上表达的靶蛋白。将设计针对白血病靶标的肿瘤识别部分,包括cd19、cd30、cd22、cd37、cd38、cd56、cd33、cd30、cd138、cd123、cd79b、cd70、cd75、ca6、gd2、甲胎蛋白(afp)、癌胚抗原(cea)、ceacam5、ca-125、muc-16、5t4、napi2b、ror1、ror2、5t4、plif、her2/neu、egfrviii、gpmnb、liv-1、糖脂f77、成纤维细胞活化蛋白、psma、steap-1、steap-2、间皮素、c-met、cspg4、结合素-4、vegfr2、psca、叶酸盐结合蛋白/受体、slc44a4、cripto、ctag1b、axl、il-13r、il-3r和sltrk6。
靶部分受体可源自对在肿瘤细胞表面上表达的肿瘤糖蛋白具有特异性的抗体的一部分,或可替代地工程化的受体可源自具有已知特异性的tcr受体或识别源自在与mhc复合物缔合的表面上呈递的细胞内肿瘤特异性抗原的特异性肽序列的抗体,所述抗原包括gp100、mart1、酪氨酸酶、ssx2、ssx4、nyeso-1、上皮肿瘤抗原(eta)、magea家族基因(如mage3a.mage4a)、kklc1、突变的ras、βraf、p53、mhci类链相关分子a(mica)、mhci类链相关分子b(micb)、hpv或cmv。此类高亲和力t细胞受体样肿瘤识别部分将识别具有高度特异性的肽-mhc复合物。
实施例31:具有间隔区和跨膜结构域的靶向部分构建体
不同的间隔区将被工程化到肿瘤识别部分构建体中以便优化工程化的t细胞针对癌细胞的效力。每个间隔区的大小将根据靶蛋白的大小、由受体识别的表位、工程化的肿瘤识别部分的大小和受体的亲和力而不同。可适应构象变化的间隔区包括人igg、cd8a和cd4铰链区的序列。
所测试的间隔区包括以不同长度(19至9个残基)使用的gly、ser和thr氨基酸以便提供具有改进的结合亲和力性质的嵌合受体。每个构建体的铰链和跨膜部分源自cd8a序列(人cd8a的残基117至178)或可替代地具有cd28跨膜结构域的人igg1铰链-fccdna(残基153-179)。
实施例32:具有共刺激结构域的靶向部分构建体
不同的共刺激结构域将被工程化到包含肿瘤识别部分的构建体中。将包含cd28、4-1bb、cd2、cd27、nkg2d、cd161、cd30、jaml、cd244或cd100共刺激信号传导结构域的共刺激结构域工程化到γδt细胞中以模拟通过嵌合受体增强活化的“第二信号”,从而产生更稳健的信号以增加且杀死癌细胞。
细胞质区源自αβ和/或γδt细胞共刺激分子的内结构域,所述共刺激分子包括:cd28(残基180-220)、cd137(残基214-255)、icos(残基165-199)、cd27(残基213-260)、nkg2d(残基1-51)、jaml(残基297-394)、cd2(残基236-351)、cd30(残基408-595)、ox40(残基1-23)、hvem(残基224-283)或cd46分子。基于工程化的γδt细胞群体对诱导的细胞毒性的活化程度且基于体外和体内细胞因子分泌程度选择最优构建体。
实施例33:包含cd3ζ活化结构域的靶向部分
克隆了含有三个itam结构域(itam1:apayqqgqnqlynelnlgrreeydvldkr,(seqidno:5);itam2:pqrrknpqeglynelqkdkmaeayseigm,(seqidno:6);和itam3:errrgkghdglyqglstatkdtydalhmq,(seqidno:7)的细胞内cd3ζ(残基52-164)。
使用引物5’agagtgaagttcagcaggagcgca-3’(seqidno:8)和反向引物5’ctcgagtggctgttagccaga-3’(seqidno:9)扩增tcrζ的细胞内结构域。
通过多步重叠延伸pcr产生car构建体。使用重叠延伸聚合酶链式反应方案,将产物在通过以铂taqdna聚合酶高保真试剂盒(invitrogen)加尾的引物驱动的单独pcr反应中融合。将编码全长构建体的dna连接到msgv1逆转录病毒载体中。所述构建体提供包含cd3ζ活化结构域的car靶向部分。
实施例34:具有多于一个识别部分的工程化γδt细胞
将γδt细胞用多于一个包含肿瘤识别部分的构建体转导,所述肿瘤识别部分包括针对相同细胞内肿瘤特异性蛋白质的tcr和mab。选择每个构建体以识别在不同mhc单倍型如a2和a1背景下的特异性肽、针对在相同肿瘤细胞上表达的不同靶标的抗体或针对相同靶标上的不同表位的抗体。
实施例35.工程化的γδt细胞的体外扩增
用适当的组织培养基,如在先前实施例中描述的组织培养基来生长和扩增工程化的γδt细胞。将工程化的γδt细胞在5%co2孵育箱中在37℃下在有或无通过外部抗原刺激和无与apc或氨基磷酸酯共培养的情况下成指数地生长至约1x106。
实施例36:由活化的工程化的和非工程化的γδt细胞释放的细胞因子的功能表征
将使用商业酶联免疫吸附测定(elisa)试剂盒测量ifn-γ、tnf-α(r&dsystems)、il-1β、il-2(biosourceinternational)、il-12(diacloneresearch)和il-18的表达。将根据制造商的说明书进行酶联免疫吸附测定。将在不同时间点(24至72小时)在4℃下涂覆有于0.05m碳酸氢钠缓冲液中在1μg/ml浓度下的针对人细胞因子的单克隆小鼠igg1过夜的聚苯乙烯96-孔板(maxisorb,nunc)中测量细胞因子的量。在用含有0.05%tween20的pbs洗涤之后,将板用pbst中的3%牛血清白蛋白(bsa,wt/vol,sigma)在37℃下封闭1小时。将添加标准物(来自r&d的重组人细胞因子)和来自γδ培养物样品的上清液,并且将板在室温下孵育2小时。关于重组人细胞因子标准物用匹配的抗体对检测。
实施例37.鉴别共刺激剂
通过将共刺激剂添加至全pbmc或富集的工程化的和非工程化的γδt细胞群体来测试不同的共刺激剂支持工程化的和非工程化的γδt细胞的活化、扩增和活力的能力。将共刺激剂以可溶性或固定化形式添加至不同的活化剂,包括抗γδtcr特异性mab。在针对cd2、cd27、cd28、cd30、cd137、icos、cd161、cd122、cd244和nkg2d的可溶性或固定化的激动抗体、或包括cd70-fc(cd27的配体)、mica、micb和ulbp(nkg2d的配体)、4-1bb(cd137配体)和pilar9(cd161的配体)的刺激配体存在或不存在下将如在先前实施例中所描述从健康供体的血沉棕黄层纯化的人pbmc或分离自组织的淋巴细胞以在1ml的补充有100iu/mlrhil-2的完全rpmi-1640培养基中2x106个接种于具有2-10μg抗γδtcr抗体的24孔平底组织中。
实施例38.细胞因子支持活化
通过将细胞因子添加至全pbmc或富集的工程化的和非工程化的γδt细胞群体来测试不同的细胞因子支持工程化的和非工程化的γδt细胞的活化、扩增和活力的能力。为了测试细胞因子活化支持,将各种细胞因子以100iu/ml每3天单独地添加至单独的细胞培养物。所测试的细胞因子包括il-2、il-7、il-12、il-15、il-33、il-21、il-18、il-19、il-4、il-9、il-23和il1β。在选择时间段结束后,收获细胞样品且通过流式细胞术确定细胞群体的组成,即γδt细胞、αβt细胞、b细胞和nk细胞的百分比。
将细胞保持培养且在第14天和第21天测试所选择群体的扩增。
实施例39:体外工程化的和非工程化的γδt细胞的体外细胞毒性测定
通过4个不同的细胞毒性测定来确定工程化的和非工程化的γδ-t细胞的体外细胞毒性测定:1)肿瘤细胞溶解;2)活化的t细胞的细胞因子释放;3)ldh测定;以及4)cd107a表达的活化。源自但不限于结肠癌、乳腺癌、卵巢癌、肾癌、头颈癌、口腔癌、胰腺癌和肝癌的各种人肿瘤细胞系或人肿瘤源性细胞(患者来源的异种移植物肿瘤系)用作靶细胞。正常人乳腺上皮细胞(hmec)用作阴性对照。简言之,将增殖靶细胞以1x104个细胞/孔接种于96孔板中。在24小时后,除去培养基且将活化γδ-t细胞以20:1或40:1的效应子与靶标比率添加在rpmi培养基(来自coming的rpmi-1640,10%hyclone胎牛血清、2mmol/ll-谷氨酰胺、100u/ml青霉素、100u/ml链霉素)中且在5%co2的湿润气氛中在37℃下孵育5小时。通过收集共培养上清液且使用可商购的elisa试剂盒(biolegend)定量包括ifn-γ、il2、tnfα、il-6和il1β的细胞因子的分泌来确定在此孵育之后由工程化的和非工程化的γδ-t细胞释放的细胞因子。使用ldh细胞毒性检测试剂盒(roche)按照制造商的说明书进行ldh测定。最后,通过在将γδ-t细胞添加至靶细胞后添加5ul的缀合至cy7pe(biolegend)的cd107a抗体来测定cd107a表达。将板短暂离心且在5%co2的湿润气氛中在37℃下孵育1小时,且然后添加8.5μl的golgistopbdbiosciences(bd)的1:50稀释液。将细胞在5%co2的湿润气氛中在37℃下孵育另外2小时。在此孵育之后,将细胞收集在冰上,用冷hbss洗涤一次,并且用1ul的zombieaqua(biolegend)胺染料染色以测定100ul的hbss中的活细胞群体。将细胞在facs染色培养基(fsm;含有2%胎牛血清的hbss)中洗涤,并且再悬浮于100ul的含有饱和量的抗体,包括缀合至fitc的vδ1抗体(来自thermofisher的克隆ts8.2)和缀合至pe的vδ2抗体(来自biolegend的克隆b6)的fsm中。将抗体与细胞一起在冰上孵育30分钟,且然后用过量的hbss洗涤。将染色的群体收集在bdfacscantoii上且使用flowjov10.1软件进行分析。
实施例40:体外扩增的γδt细胞的抗肿瘤活性
在1:1至40:1之间的效应子与靶标比率下测试针对各种肿瘤细胞系和原代肿瘤细胞的细胞毒性活性。通过检测细胞内酶乳酸脱氢酶的释放来测量肿瘤细胞系和原代肿瘤细胞的溶解。通过流式细胞术、elisa和/或elispot测定来测量培养物中的表达工程化的肿瘤识别部分的γδt细胞的百分比。
实施例41:体内抗肿瘤活性
将接枝有人肿瘤异种移植物的免疫缺陷小鼠、或hupbmc-nog(taconic)小鼠、或如上所述的具有人源化免疫系统的小鼠的组皮下或原位地注射源自患者源性的肿瘤或肿瘤细胞系(包括结肠癌、乳腺癌、卵巢癌、肾癌、头颈癌、前列腺癌、膀胱癌、口腔癌、胰腺癌和肝癌)的细胞,且使其达到达到100mm3的平均大小。将富集的或分离的γδ-t细胞(天然的或工程化的)以一系列剂量静脉内注射到小鼠中或直接注射到肿瘤中。肿瘤消退被定义为与特定适应症的未处理的和标准护理相比,在γδ-t细胞给药后肿瘤体积减小。在一些实验中,将天然或工程化的γδt细胞用gfp或荧光素酶标记且注射至携带肿瘤的小鼠以追踪其持久性和归巢。在研究结束时,收获肿瘤且通过流式细胞术和免疫组织化学分析gfp阳性细胞。
实施例42.在冷冻介质中冷冻保存γδt细胞以产生用于进一步加工的细胞库
将未修饰的γδt细胞配制在冷冻介质中且置于低温储存装置如液氮冷冻器(-195℃)或超低温冷冻器(-65℃、-80℃或-120℃)中用于长期储存。冷冻介质将含有二甲亚砜(dmso)、氯化钠(nacl)、葡萄糖、硫酸葡聚糖或羟乙基淀粉(hes)与介于6.5与7.5之间范围内的生理ph缓冲剂。
冷冻保存的γδt细胞将被解冻并通过用抗体、蛋白质、肽和细胞因子刺激进一步加工。冷冻保存的γδt细胞将被解冻且如在本申请中先前所描述进行遗传修饰。工程化的γδt细胞将被进一步冷冻保存以产生在冷冻介质中至少约106至108个细胞/ml下的10、100、200个小瓶的量的细胞库。
实施例43.在冷冻介质中替代冷冻保存γδt细胞以产生用于进一步加工的细胞库
将其他冷冻保护剂添加至在先前实施例中描述的低温保存载体以在冻融过程期间提供营养支持和针对溶解的生物物理学细胞保护。这些包括d-葡萄糖、甘露醇、蔗糖、腺嘌呤、鸟苷、重组人白蛋白、柠檬酸盐、抗凝剂、benzonase、dna酶、丙二醇、乙二醇、2-甲基-2,4-戊二醇。被设计用于为高细胞密度冷冻产物提供缓冲能力的另外添加剂包括无机磷酸盐、碳酸氢钠和hepes。
实施例44.在冷冻介质中冷冻保存γδt细胞以产生用于进一步加工的细胞库
使用受控速率冷冻器(例如cryomed受控速率冷冻器)或具有适当隔热的托架系统的机械-70℃冷冻器以传递所需冷冻速率,γδt细胞的初始冷冻以被设计成实现-0.1℃至-5℃/分钟之间的冷冻速率的温度受控斜坡进行。将冷冻的细胞置于-70℃冷冻器中以用于达30至60天的短期储存。将冷冻的细胞置于液态n2储存槽中用于达12、24、36和48个月的长期储存,同时维持γδt细胞数目和细胞功能而无劣化,如通过在先前部分中描述的方法所测量。
将在此实施例中描述的冷冻保存的细胞解冻且在合适的封闭容器如细胞培养袋和/或生物反应器中进一步刺激和扩增以产生用于施用至受试者的合适量的工程化的γδt细胞。
实施例45.用于直接输注到患者中的γδt细胞的配制
通过离心和/或膜渗滤将工程化的γδt细胞在含有冷冻保护赋形剂的生理缓冲液中浓缩至介于5x106个细胞/ml与108个细胞/ml之间且置于低温储存装置如液氮或超低温冷冻器中用于长期储存。
实施例46.罹患癌症的人受试者的治疗
将新鲜或冷冻的工程化的γδt细胞在床边解冻且静脉内输注到人受试者中。将约1个细胞/千克至约1x1010个细胞/千克工程化的γδt细胞在30-60分钟时间段内输注到人受试者中。在有或无共刺激细胞因子il-2或其他细胞因子的帮助下施用工程化的γδt细胞。任选地,重复所述程序。通过流式细胞术测量所述受试者中的γδt细胞的体内扩增。
虽然本文已经示出和描述了本发明的优选实施方案,但是对于本领域的技术人员将显而易见的是,此类实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域的技术人员现将会想到众多变化、改变和替代。应了解,本文描述的本发明的实施方案的各种替代方案可用于实践本发明。意图以下权利要求书限定本发明的范围并且由此覆盖在这些权利要求范围内的方法和结构以及其等同形式。
- 还没有人留言评论。精彩留言会获得点赞!