基于壳聚糖-无定形磷酸钙的牙齿再矿化技术的制作方法
本发明属于牙齿再矿化,尤其涉及一种基于壳聚糖-无定形磷酸钙的牙齿再矿化技术。
背景技术:
本申请涉及用于再矿化因龋齿和/或牙齿侵蚀等口腔状况而流失矿物质的牙齿的方法及其组合物。
龋齿(蛀牙)是一种流行性慢性疾病,影响着发达国家中的60%至90%在校学生,和多数成人。龋齿(蛀牙)是引起儿童住院治疗、紧急监护、全身麻醉的重要诱因。在美国,龋齿是童年时期最常见的慢性疾病。儿童龋齿的发病率(59%)是哮喘的发病率(11%)的6倍,是花粉过敏的发病率(8%)的8倍(美国卫生和公众服务部.美国口腔健康:卫生部长报告(2000))。全国健康和营养检查调查的1999年至2004年的数据显示,在美国28%的2周岁至5周岁儿童的乳牙患有龋齿,在过去的十年间龋齿发病率上升了15%((疾病预防控制中心周报54,1-44(2005),dye,b.a.;口腔健康趋势:美国,1988-1994和1999-2004;重要健康统计11,1-92(2007))。龋齿治疗相当昂贵,占用了大致60%的年度口腔健康消费,在发达国家占全部医疗费用的6%或者个人医疗费用的16%(经济合作组织.健康一览,2009:经合组织指标.(2009).)目前中国儿童患龋率约为80%,青年人患龋率约为60~70%,老年人患龋率约为52%,每个患者平均涉及2~3个牙齿,牙龈炎和牙周炎患病率也为70%。无论那一个年龄层,龋病都是口腔健康的严重挑战。
儿童时期的龋齿常常不被治疗,因而加重患情并且导致许多严重的并发症,包括慢性疼痛,牙齿脱落,听力、吞咽、发声、睡眠障碍,发育停滞,糟糕的在校表现、社交关系、自我认知,甚至降低人生的成功率。由于疾病负担、并发症和负面社交结果,国家口腔和颅面研究所和美国儿科研究所将龋齿作为致力解决的焦点问题以于减轻公众健康差距。在过去的40年间,氟化物成为了预防龋齿的基石。在此期间,氟化物供应源数量上升,目前已包括诸多来源,例如含氟牙膏、含氟凝胶以及其他治疗性含氟产品。即便含氟产品在人们生活消费中有如此高的普及率,氟化物在预防龋齿的作用已经显著达到平台期,而温和氟斑牙的发生率在过去的几十年间显著上升。含氟牙膏是最为广泛使用的氟化物形态,但是传统的含氟牙膏,只有其浓度不少于1000ppm时才具有显著的预防龋齿效果。然而,如此高浓度氟化物的牙膏被小于6周岁特别是小于2周岁的儿童使用时,会增加患氟斑牙的危险。出生后的头两年已经被确认为对早期萌发的切牙和第一恒磨牙等恒牙患氟斑牙与否至关重要(hong,l.,levy,s.m.,warren,j.j.,broffitt,b.&cavanaugh,j.永久性上颌骨中切牙和第一恒磨牙氟化物摄入量与氟斑牙发展相关.cariesres40,494-500(2006).hong,l.etal.上颌骨中切牙氟化物摄入量时间与氟斑牙发展相关.communitydentoralepidemiol34,299-309(2006).)因此,传统的抗龋齿氟化物治疗效果有其局限。
研究表明,含有钙盐和/或磷酸盐的无氟局部用再矿化剂具有作为氟化物的替代物的潜力,或在低氟的情况下作为辅助物以增强氟化物的效果。这些再矿化剂对于儿童额外用好处,因为降低了患氟斑牙的危险,也有利于预防龋齿。目前,酪蛋白磷酸肽-无定形磷酸钙(cpp-acp)在临床广泛使用。尽管具有大量实验室及原位证据表明其有益,美国口腔协会(ada)和科学事务委员会(csa)对近期的临床实验数据回顾并报道,这些现有证据不足以推荐任何矿物配方用于龋齿治疗,包括基于酪蛋白磷酸肽-无定形磷酸钙的产品(rethman,m.p.etal.无氟预防龋齿剂:基于证据的临床推荐执行总结.jamdentassoc142,1065-1071(2011)).磷酸钙(ca-p)已商业化地应用于牙膏、口香糖、漆和漱口水。(zero,d.t.牙膏、漱口水和再矿化/龋齿抑制策略.bmcoralhealth6suppl1,s9(2006)).如何保持钙离子和磷离子的生物可利用性,在有需要时提供牙齿以可利用的磷酸钙是一个重大挑战,这阻碍了基于磷酸钙的大规模产品在预防和控制龋齿的应用。因此,当牙齿被口腔细菌的酸性产物攻击时,基于酪蛋白磷酸肽-无定形磷酸钙的产品难以快速地在足够限度为再矿化提供新鲜的无定形磷酸钙。当前的情况强烈地需求更好的钙和磷输送载体系统以满足牙齿载矿化对钙和磷的需求。
因此,为了预防和治疗牙齿侵蚀和/或龋齿,特别是预防和治疗儿童的牙齿侵蚀和/或龋齿,仍有必要提供相关的组合物及其方法。再矿化牙齿需要额外的和更有效的组合物及其方法。饱受牙齿侵蚀和/或龋齿困扰的患者亟需氟化物治疗的替代选择。
技术实现要素:
为遭受牙齿矿物流失的患者提供有效预防和治疗牙齿侵蚀和/或龋齿的新组合物及其方法。
根据一个实施例,为牙齿再矿化提供一种组合物,所述组合物包含包封于聚合物的再矿化剂。
根据一个典型实施例,所述再矿化剂是一种聚合物微球和/或纳米球,所述聚合物是一种天然的包括壳聚糖的生物聚合物。
根据另一个典型实施例,所述组合物是一种牙膏、凝胶、漆、乳液、密封胶和/或口香糖。
根据另一个实施例,所述组合物包括占组合物总质量1%至10%的钙和磷。
根据另一个实施例,所述再矿化剂钙和/或磷包封在粒径介于1μm至250μm或者1μm至100μm的微球。
根据一个典型实施例,所述组合物包含微球,微球包含壳聚糖和钙盐,或者壳聚糖和磷酸盐,或者上述两种元素的混合物,或者所述组合物包括一第一系列微球,其包含钙盐;和/或一第二系列微球,其包含磷酸盐。
根据另一个实施例,包封有钙盐的所述微球和包封有磷酸盐的所述微球以钙磷比例为1:1至1:2混合。
根据另一个实施例,在人体口腔环境内包封有钙盐的所述微球和包封有磷酸盐的所述微球释放出钙离子及磷酸根离子而原位形成无定形磷酸钙。所述无定形磷酸钙能为牙齿的钙离子和磷离子提供来源。
根据另一个实施例,所述组合物进一步包含氟化盐和/或木糖醇。根据一些实施例,所述组合物进一步包含钙盐,其包括醋酸钙,cacl2,乳糖酸钙,抗坏血酸钙,葡萄糖酸钙,乳酸钙,乙酰丙酮钙,乳糖酸钙,柠檬酸钙,糖精钙和/或山梨酸钙。
根据一个实施例,提供一种预防或者治疗牙齿侵蚀的方法,所述方法为牙齿提供包封于聚合物的有效治疗量的再矿化剂。其中所述再矿化剂为钙盐和/或磷盐,聚合物为壳聚糖。
根据另一个实施例,所述再矿化剂被包封于微球和/或纳米球。
根据另一个实施例,所述壳聚糖微球包含壳聚糖和钙盐,或者壳聚糖和磷盐,或者上述二者的混合物。
根据一个实施例,为口腔空间提供一种抗菌组合物,所述组合物包含壳聚糖组分,其摩尔质量介于1kg/mol至10kg/mol。
根据另一个实施例,所述壳聚糖的摩尔质量介于1kg/mol至10kg/mol。
根据另一个实施例,提供一种增强口腔抗菌活力的口用组合物的方法,所述方法包括添加壳聚糖组分,其摩尔质量介于1kg/mol至10kg/mol。
根据另一个实施例,提供一种用于制备再矿化牙齿的口腔用组合物的方法,所述方法包括在第一系列壳聚糖微球内包封钙盐,在第二系列壳聚糖微球内包封磷酸盐,以及混合所述第一系列壳聚糖微球和第二系列壳聚糖微球。
各个实施例的额加特征和优点将在以下说明中被进一步阐述,且在一定程度上从该描述可显而易见,或者可以通过实施本发明而认识。各个实施例的目的和其他优点将通过以下说明和权利要求的组件和组合予以阐明。
附图说明
通过以下描述、附加权利要求和附图,将进一步阐明所述实施例的各个方面、特征、益处和优点。
图1阐述了即刻形成的壳聚糖-无定形磷酸钙的x射线的衍射图样及其物理外观。
图2阐述了利用无定形磷酸钙治疗前后的牙本质表面的扫描电子显微镜图像。
图3阐述了不同摩尔质量的壳聚糖对于细菌的抗菌效果。
图4阐述了10kg/mol的壳聚糖(10k壳聚糖)对于不同口腔细菌的抗菌效果。
图5阐述了在室温下ca2+从壳聚糖/cacl2微球释放。
图6阐述了磷从由10k壳聚糖制备的壳聚糖/na2hpo4微球释放的典型释放曲线。
图7阐述了所述两种微球在释放期间的释放介质的酸碱度。
图8阐述了10,000g/mol(10k)壳聚糖,壳聚糖/na2hpo4微球和壳聚糖/cacl2微球的红外光谱(ft-ir)。
图9的图像a阐述了负载有cacl2的壳聚糖微粒的扫描电子显微镜图像(5000x放大倍率),图像b阐述了负载有cacl2的壳聚糖微粒的扫描电子显微镜图像(100x放大倍率)。
图10的图像a阐述了负载有na2hpo4的壳聚糖微粒的扫描电子显微镜图像(5000x放大倍率),图像b阐述了负载有na2hpo4的壳聚糖微粒的扫描电子显微镜图像(100x放大倍率)。
图11阐述了添加酸碱度为9.6的精氨酸溶液对,cacl2/壳聚糖微球悬浮液和na2hpo4/壳聚糖微球悬浮液的酸碱度改变。
图12阐述了三组处理后的牙釉质表面(包括contr,chi-acp和mi+的三个组)的元素分析结果。与所述阴性对照组(contr组,采用蒸馏去离子水处理)相比,chi-acp组的牙釉质表面钙含量(37.23±4.25wt%与33.89±3.28wt%)和钙/磷质量比(2.02±0.19与1.88±0.11)均显著上升(见图像a和图像b)。与此同时,所述用mipasteplus处理的阳性对照组(mi+组)的牙釉质表面钙含量(36.51±4.14wt%与33.89±3.28wt%)和钙/磷质量比(1.99±0.14与1.88±0.11)均略有上升。三个组中,牙釉质表面磷含量从所述阴性对照组的17.97±0.82wt%略有上升到,所述阳性对照组的18.30±0.80wt%,再到所述实验组的18.4±1.59wt%,在任何两个组之间均不存在显著差异(参见图像c)。扫描电子显微镜图像被用于观测治疗后牙釉质的表面形态(参见附图d,e和f)。三个组均未在牙釉质表面观测到明显的沉积。
图13阐述了由plm测定的处理后牙釉质表面下的脱矿深度和再矿化厚度。图像a阐述了脱矿深度,图像b阐述了再矿化厚度。c,dande分别是三组(包括contr,chi-acp和mi+)典型的plm图像。
图14阐述了利用调整精氨酸盐酸盐和精氨酸游离碱的比例而改变两种被测试的牙膏配方的酸碱度。
具体实施方式
龋齿(蛀牙)是世界范围内最为常见的慢性疾病之一。由于细菌感染导致牙釉质和牙本质脱矿或者被破坏。龋齿影响着发达国家中60%至90%的在校儿童和绝大多数成人(经济合作组织.健康一览,2009:经合组织指标.(2009))。一份报告的数据显示,在美国28%的2周岁至5周岁儿童,其乳牙患有龋齿,在过去的十年间龋齿发生率上升了15%(美国卫生和公众服务部.美国口腔健康:卫生部长报告(2000).(疾病预防控制中心周报54,1-44(2005))。
牙齿侵蚀是牙齿矿物质不可逆转的流失,是没有细菌介入的纯化学过程。牙齿侵蚀可发生在乳牙和恒牙牙列,可能影响任何牙齿表面,尤以面向,咬合,和舌面为甚(bartlettdw,shahp.a非龋颈椎损伤和腐蚀及摩擦作用的严格审查.jdentres2006;85(4):306-12.williamsd,croucherr,marcenesw,o’farrellm.生活于英国伦敦伦敦塔桥和哈克尼地区的14周岁在校儿童的上颌骨切牙牙齿侵蚀发生率.intdentj1999;49(4):211-6)。
外源性酸或者内源性酸致使侵蚀性损伤可能导致牙列不可逆转的损伤。初始时钙元素和磷元素流失致使牙齿表面软化,最终导致牙齿结构的明显损失。牙齿侵蚀的临床表现包括,在平滑的牙釉质表面的宽槽,切牙透明度上升,以致负面的影响美观。而且,牙釉质流失导致牙本质暴露和过敏反应,甚至在一些极端案例中致使牙髓暴露。
牙齿侵蚀的流行病学研究报告,46%的13周岁至19周岁的儿童至少一颗牙齿被侵蚀,尤以上颌牙齿更为普遍(mcguirej,szaboa,jacksons,bradleyt.g.,okunseric.美国儿童的牙齿侵蚀:与种族/族裔和肥胖的关系.intjpeddent2009:19(2):91-8)。牙齿侵蚀在发达国家成为日益关注的问题(nunnj.牙齿侵蚀的发病率和口腔健康的意义.eurjoralsci1996;104(2):156-161)。鉴于日益增长的碳酸软饮料和果汁饮料的消费量,牙齿侵蚀的发病率和严重性日趋增加。
导致牙齿侵蚀的许多风险因素在过去已经被研究确认。例如,由贪食症或者厌食症引发呕吐、胃食管反流病等特定条件。大量酗酒可能引发牙齿侵蚀。抗坏血酸、盐酸、乙酰水杨酸也可能引发牙齿侵蚀。过量摄入或者过快摄入酸性水果、纯果汁和酸性饮料也可引发牙齿侵蚀。其他可能的风险因素包括个人职业和非法使用毒品。
研究证实,儿童牙齿磨损的主要诱因是牙齿侵蚀(dugmorec,&rockw.牙齿侵蚀的多因素分析.brdentj2004;196(5):283-6)。在早期阶段预防和治疗牙齿侵蚀非常重要。牙齿侵蚀是一个不可逆转的过程,当发生时必须仔细评估。该状况不可逆转,除非情况得到处理否则可能延续至成人。严重的牙齿结构损伤可能需要更多更广泛的口腔治疗。因此,及早预防和治疗牙齿侵蚀非常重要。
牙齿侵蚀在乳牙和恒牙牙列期期间发生,可能影响任何牙齿表面,尤以面向,咬合,和舌面为甚(bartlettdw,shahp.a非龋颈椎损伤和腐蚀及摩擦作用的严格审查.jdentres2006;85(4):306-12.williamsd,croucherr,marcenesw,o’farrellm.生活于英国伦敦伦敦塔桥和哈克尼地区的14周岁在校儿童的上颌骨切牙牙齿侵蚀发生率.intdentj1999;49(4):211-6)。
因此,当前需要能预防和治疗患者的牙齿侵蚀的组合物及其方法,尤其是儿童。再矿化牙齿需要额外的更有效的组合物及其方法。遭受牙齿侵蚀困扰的患者亟需牙齿再矿化治疗。牙釉质流失可能导致牙本质暴露和过敏反应,甚至在一些极端案例中致使牙髓暴露。
再矿化
再矿化用于预防和治疗龋齿是受到提倡鼓励的。再矿化发生在矿物质被添加到牙齿里以替代被消耗的牙齿矿物质成分时。常见的再矿化剂之一是氟化物。其他几种再矿化剂包括无定形磷酸钙,三磷酸钙,酪蛋白磷酸肽-无定形磷酸钙,生物活性的磷硅酸钙钠盐和复合精氨酸碳酸氢盐碳酸钙。除此之外,再矿化剂还包括钙盐,和/或磷酸盐或者上述二者组合。基于磷酸钙的再矿化产品作为无氟预防龋齿剂,可以给牙齿表面提供具有生物活性的及足够的浓度的钙离子和磷酸根离子,而以驱动牙齿再矿化过程。然而,近期临床实验数据显示,需要更有效地输送磷酸钙以充分减少龋齿。
根据本申请的一个实施例,提供一种用于再矿化牙齿的组合物,所述组合物包含再矿化剂。根据一些实施例,所述钙源再矿化剂包括氯化钙、磷酸钙、无定形磷酸钙及其组合。根据一些实施例,所述磷源再矿化剂包括从磷酸钠、磷酸钾、磷酸酪蛋白、酪蛋白及其消化物或者磷酸酪蛋白衍生物、无定形磷酸钙及其组合。根据一些实施例,添加至所述组合物的所述再矿化剂的浓度介于0.001%至10%w/w,w/v或v/v。
根据各个实施例,添加至所述组合物的再矿化剂的浓度为0.001%,0.005,0.010,0.015,0.020,0.025,0.030,0.035,0.040,0.045,0.050,0.055,0.060,0.065,0.070,0.075,0.080,0.085,0.090,0.095,0.10,0.15,0.20,025,0.30,0.35,0.40,0.45,0.50,0.55,0.60,0.65,0.70,0.75,0.80,0.85,0.90,0.95,1.0,1.05,1.10,1.15,1.20,1.25,1.30,1.35,1.40,1.45,1.50,1.55,1.60,1.65,1.70,1.75,1.80,1.85,1.90,1.95,2.0,2.05,2.10,2.15,2.20,2.25,2.30,2.35,2.40,2.45,2.50,2.55,2.60,2.65,2.70,2.75,2.80,2.85,2.90,2.95,3.0,3.05,3.10,3.15,3.20,3.25,3.30,3.35,3.40,3.45,3.50,3.55,3.60,3.65,3.70,3.75,3.80,3.85,3.90,3.95,4.0,4.05,4.10,4.15,4.20,4.25,4.30,4.35,4.40,4.45,4.50,4.55,4.60,4.65,4.70,4.75,4.80,4.85,4.90,4.95,5.0,5.05,5.10,5.15,5.20,5.25,5.30,5.35,5.40,5.45,5.50,5.55,5.60,5.65,5.70,5.75,5.80,5.85,5.90,5.95,6.0,6.05,6.10,6.15,6.20,6.25,6.30,6.35,6.40,6.45,6.50,6.55,6.60,6.65,6.70,6.75,6.80,6.85,6.90,6.95,7.0,7.05,7.10,7.15,7.20,7.25,7.30,7.35,7.40,7.45,7.50,7.55,7.60,7.65,7.70,7.75,7.80,7.85,7.90,7.95,8.0,8.05,8.10,8.15,8.20,8.25,8.30,8.35,8.40,8.45,8.50,8.55,8.60,8.65,8.70,8.75,8.80,8.85,8.90,8.95,9.0,9.05,9.10,9.15,9.20,9.25,9.30,9.35,9.40,9.45,9.50,9.55,9.60,9.65,9.70,9.75,9.80,9.85,9.90,9.95和10.0%w/w,w/v或v/v。
根据一些实施例,所述再矿化剂被包封于聚合物,钙源和磷源分别包封以稳定组合物。当所述钙源和所述磷源置于口腔环境时,钙离子和磷酸根离子从聚合物释放出而形成无定形磷酸钙,为再矿化牙齿提供钙离子和磷离子的来源。根据一些实施例,所述聚合物包括壳聚糖。根据另一些实施例,所述组合物包括纳米球和/或微球。所述再矿化剂被包封于聚合物微球,其浓度从0.001%至7.5%或者从0.01%至1%或者从0.05%至2%或者2%至5%w/w,w/v或v/v。
根据各个实施例,所述再矿化剂被包封于聚合物微球,其浓度为0.001%,0.005,0.010,0.015,0.020,0.025,0.030,0.035,0.040,0.045,0.050,0.055,0.060,0.065,0.070,0.075,0.080,0.085,0.090,0.095,0.10,0.15,0.20,025,0.30,0.35,0.40,0.45,0.50,0.55,0.60,0.65,0.70,0.75,0.80,0.85,0.90,0.95,1.0,1.05,1.10,1.15,1.20,1.25,1.30,1.35,1.40,1.45,1.50,1.55,1.60,1.65,1.70,1.75,1.80,1.85,1.90,1.95,2.0,2.05,2.10,2.15,2.20,2.25,2.30,2.35,2.40,2.45,2.50,2.55,2.60,2.65,2.70,2.75,2.80,2.85,2.90,2.95,3.0,3.05,3.10,3.15,3.20,3.25,3.30,3.35,3.40,3.45,3.50,3.55,3.60,3.65,3.70,3.75,3.80,3.85,3.90,3.95,4.0,4.05,4.10,4.15,4.20,4.25,4.30,4.35,4.40,4.45,4.50,4.55,4.60,4.65,4.70,4.75,4.80,4.85,4.90,4.95,5.0,5.05,5.10,5.15,5.20,5.25,5.30,5.35,5.40,5.45,5.50,5.55,5.60,5.65,5.70,5.75,5.80,5.85,5.90,5.95,6.0,6.05,6.10,6.15,6.20,6.25,6.30,6.35,6.40,6.45,6.50,6.55,6.60,6.65,6.70,6.75,6.80,6.85,6.90,6.95,7.0,7.05,7.10,7.15,7.20,7.25,7.30,7.35,7.40,7.45和/或7.50%w/w,w/v或v/v。
根据各个实施例,所述再矿化剂的粒径从1μm至100μm或者从5μm至100μm或者从100μm至200μm或者从1μm至200μm。根据各个实施例,所述再矿化剂的粒径1,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,105,110,115,120,125,130,135,140,145,150,155,160,165,170,175,180,185,190,195和/或200μm。
根据另一些实施例,所述聚合物微球的粒径从1μm至500μm或者从10μm至100μm或者从10μm至500μm。根据各个实施例,所述聚合物微球的粒径从l,5,10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95,100,105,110,115,120,125,130,135,140,145,150,155,160,165,170,175,180,185,190,195,200,205,210,215,220,225,230,235,240,245,250,255,260,265,270,275,280,285,290,295,300,305,310,315,320,325,330,335,340,345,350,355,360,365,370,375,380,385,390,395,400,405,410,415,420,425,430,435,440,445,450,455,460,465,470,475,480,485,490,495和/或500μm。
根据一些实施例,所述组合物包括微球一,所述微球包含壳聚糖和钙盐,或者微球二,所述微球包含壳聚糖和磷元素。所述组合物进一步包含第一微球和第二微球。
根据各个实施例,所述含钙微球和所述含磷微球按钙磷比为1:1至1:2混合。根据各个实施例,所述含钙微球和所述含磷微球按钙磷比为1:1,1:2,1:3,1:4,4:1,3:1和/或2:1混合。
本申请所述组合物为牙膏、凝胶、漆、漱口水或者密封胶。根据一个实施例,所述组合物是牙膏。根据一些实施例,所述钙源和所述磷源分别包封于各自的微球而在无水组合物中物理隔离。因此,所述含钙微球和所述含磷微球稳定所述钙离子和所述磷离子以提供生物活性的磷酸钙。
在含水的口腔环境,所述含钙微球和所述含磷微球释放所述钙离子和所述磷离子而形成无定形磷酸钙。所述无定形磷酸钙的酸碱度为1至10或者1至6或者5至10。根据一些实施例,所述无定形磷酸钙的酸碱度为1,2,3,4,5,6,7,8,9或10。所述无定形磷酸钙为钙离子和磷离子提供来源以穿透牙齿并且帮助牙齿再矿化。
根据另一些实施例,为预防或者治疗牙齿侵蚀或者腐蚀提供一种方法,所述方法包含为牙齿提供有效治疗量的被包封于聚合物的再矿化剂。
根据另一些实施例,提供一种制备用于再矿化牙齿的口腔用组合物的方法。所述方法包括包封钙源于第一系列壳聚糖微球,包封磷源于第二系列壳聚糖微球于及混合所述第一系列微球和所述第二系列微球。
本组合物提供壳聚糖和无定形磷酸钙,各组分为预防龋齿提供独特且互补/协同效益。无定形磷酸钙是一种固溶体并被转化为磷灰石。本组合物通过无定形磷酸钙技术为再矿化牙齿表面的微环境提供新鲜的钙离子和磷离子。无定形磷酸钙提供足够的磷酸钙以深度穿越牙齿的损伤主体。相比于其它复合磷酸钙,所述无定形磷酸钙的优势包括快速生成率,快速溶解率,高溶解度,快速转化为磷灰石,适于深度穿越的微粒径。本申请适于再矿化牙齿,还提供一种安全、生物兼容的组合物。儿童(小于等于2周岁)通常在刷牙期间可以安全地吞咽一些含壳聚糖和无定形磷酸钙的牙膏。
所述壳聚糖钙磷复合物可提供缓冲作用来中和酸性微环境。所述双微球系统,将钙源和磷源包封于不同的壳聚糖微球以物理隔离钙离子和磷离子,具有独特的供应功效和稳定性以获得较长的保质期。根据各个实施例,所述壳聚糖钙磷复合物具有6个月至2年的保质期。根据一些实施例,所述壳聚糖钙磷复合物的保质期为6个,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23或者24个月。
壳聚糖。
壳聚糖是一种几丁质的衍生物,节肢动物的外骨骼具有天然的生物聚合物稳定性,例如甲壳类动物(如螃蟹、龙虾和对虾)。壳聚糖的多糖结构具有生物兼容性、生物降解性和天然抗菌性能。壳聚糖在食品行业被用于微生物抑制剂和提供钙离子和磷离子的载体。不同于合成化学药物,壳聚糖是安全的抗菌剂并可避免细菌耐药性。根据本申请,壳聚糖微球作为供应系统以在独立微球内封钙离子和磷离子。在刷牙期间,形成足量新鲜的无定形磷酸钙,磷酸钙易于沉淀并再矿化羟基磷灰石晶体表面,有利于整个损伤主体(亚表层损伤)的均质再矿化。具有生物粘合性的壳聚糖在牙齿表面形成一聚合物薄膜,作为无定形磷酸钙的“蓄水池”并且扩展再矿化。壳聚糖通过有效抑制引起牙齿侵蚀和/或龋齿的细菌而预防牙齿侵蚀和/或龋齿,尤其是摩尔质量高的壳聚糖。
根据一个实施例,提供一种适于口腔环境的抗菌组合物。所述组合物进一步包括壳聚糖,其摩尔质量为1kg/mol至10kg/mol,或者2kg/mol至5kg/mol,或者5kg/mol至10kg/mol。根据各个实施例,所述组合物进一步包括壳聚糖,其摩尔质量为1,2,3,4,5,6,7,8,9和/或10kg/mol。
根据一些实施例,高摩尔质量的壳聚糖在酸碱度等于小于5的环境更为稳定,低摩尔质量的壳聚糖在酸碱度等于小于5的环境不太稳定。根据一些实施例,酸性环境的酸碱度范围介于2至6。根据各个实施例,所述低摩尔质量壳聚糖的摩尔质量范围是1kg/mol至10kg/mol质量单位。根据一些实施例,所述高摩尔质量壳聚糖的摩尔质量范围是100kg/mol至200kg/mol。
根据各个实施例,所述组合物进一步包括壳聚糖,其摩尔质量为100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165,166,167,168,169,170,171,172,173,174,175,176,177,178,179,180,181,182,183,184,185,186,187,188,189,190,191,192,193,194,195,196,197,198,199和/或200kg/mol。
根据一些实施例,壳聚糖的分子量范围为100kg/mol至200kg/mol。壳聚糖的稳定酸碱度范围为2至6。壳聚糖是弱碱性(基本性质),因此酸性环境有利于溶解壳聚糖并向牙齿供应。低摩尔质量的壳聚糖是水溶性的,溶解不需要低酸碱度。无论细菌或者化学有机酸使得口腔空间的酸碱度低于5时,容易致使龋齿和牙齿侵蚀。根据一些实施例,更高摩尔质量的壳聚糖(如1000至5000kd或者2000至4000kd)适于这些口腔状况。
根据各个实施例,所述抗菌组合物减少和/或抑制10%至90%的细菌生长。根据各个实施例,所述抗菌组合物减少和/或抑制细菌增速为10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94或95%。
根据各个实施例,提供一种在口腔空间内抗菌活性的方法。所述方法进一步包括配给壳聚糖,其摩尔质量为1kg/mol至10kg/mol,或者2kg/mol至5kg/mol,或者5kg/mol至10kg/mol。根据一些实施例,所述方法进一步包括壳聚糖,其摩尔质量为1,2,3,4,5,6,7,8,9和/或10kg/mol。根据一些实施例,被用于口腔空间的所述壳聚糖的浓度为0.1mg/ml至5mg/ml,或者1mg/ml至3mg/ml,或者1mg/ml至5mg/ml。根据各个实施例,被用于口腔空间的所述壳聚糖的浓度为0.1,0.5,1.0,1.05,1.10,1.15,1.20,1.25,1.30,1.35,1.40,1.45,1.50,1.55,1.60,1.65,1.70,1.75,1.80,1.85,1.90,1.95,2.0,2.05,2.10,2.15,2.20,2.25,2.30,2.35,2.40,2.45,2.50,2.55,2.60,2.65,2.70,2.75,2.80,2.85,2.90,2.95,3.0,3.05,3.10,3.15,3.20,3.25,3.30,3.35,3.40,3.45,3.50,3.55,3.60,3.65,3.70,3.75,3.80,3.85,3.90,3.95,4.0,4.05,4.10,4.15,4.20,4.25,4.30,4.35,4.40,4.45,4.50,4.55,4.60,4.65,4.70,4.75,4.80,4.85,4.90,4.95和/或5.0mg/ml。
根据各个实施例,牙齿再矿化比例为10%至90%。根据一些实施例,牙齿再矿化比例为30%至70%或者40%至60%。根据一些实施例,牙齿再矿化比例为10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或99%。
根据各个实施例,所述组合物减少已发蛀牙10%至90%。根据一些实施例,所述组合物减少已发蛀牙10,15,20,25,30,35,40,45,50,55,60,65,70,75,80,85,90,95或99%。
示例。
以下将对于本发明特定实施例做出详细说明。尽管以下将通过结合阐述实施例来描述本发明,但应理解这些实施例并不构成对于本发明的限制。相反,本发明意图覆盖任何由本发明附加权利要求涵盖的代替方案、修正方案和等同方案。以下标题并非限制任何公布,任何一个标题包括的实施例可与其它任何一个标题包括的实施例相结合以实施。
示例1:制备壳聚糖/无定形磷酸钙的混合粉末。
提供一种用共沉淀制备壳聚糖无定形磷酸钙混合的方法。用此法制备混合壳聚糖无定形磷酸钙。简要地,将10mlcacl2溶液与15ml含1.7%壳聚糖(摩尔质量5kg/mol,美国国际实验室)的k3po4,以钙磷摩尔比例1.5搅拌混合。通过过滤搜集的沉淀,先后用30ml的2%氨溶液和40ml的100%乙醇冲洗后真空下干燥。通过x光衍射(参见附图的图1)确定形成了无定形磷酸钙。
示例2:无定形磷酸钙的再矿化作用。
研究确认示例1中的无定形磷酸钙有助于牙齿的再矿化过程。附图的图2展示出了无定形磷酸钙的再矿化作用。对拔除的磨牙使用无定形磷酸钙以再矿化。附图图2的图像a,展示出了未经治疗的磨牙的腐蚀表面。无定形磷酸钙治疗有效地减少了牙小管的大小(附图图2,图像b)。附图图2图像c显示,所述沉淀的高倍放大显示纳米聚焦体。
示例3:壳聚糖的抗菌活性。
壳聚糖是已知的抗菌材料。所述壳聚糖的抗菌活性用基于细菌代谢活性的xtt比色法测定。所述细菌包括s.sanguis,s.fecalis和s.mutans。所述壳聚糖的平均摩尔质量为1kg/mol(1k),3kg/mol(3k),3kg/mol(5k)和10kg/mol(10k)。参见附图的图3,当壳聚糖的摩尔质量从1k增加至10k时,所述s.mutans的代谢活性和存活率降低。10k的壳聚糖抑制s.mutans的效果最佳。与对照组相比,经10k壳聚糖处理的s.mutans的存活率仅为对照组的10%。与对照组相比,5k壳聚糖具有中等抑制作用,经其处理的s.mutansd的存活率仅为对照组的55%。1k和3k壳聚糖无显著的抗菌效果。壳聚糖的抗菌性能与其摩尔质量有关,高摩尔质量壳聚糖具有更好的抗菌性能。基于xtt比色法,10k壳聚糖具有对于s.mutans的最佳的抑制效果。
示例4:10k壳聚糖针对不同口腔细菌的抗菌活性。
采用三种引发龋齿的不同口腔细菌以测试所述10k壳聚糖的抗菌活性。参见附图的图4,10k壳聚糖对于s.mutans,s.fecalus和s.sanguis具有显著抑制性。抗菌作用与浓度正相关。10k壳聚糖对于s.sanguisj(ic50=0.623mg/ml)具有最显著的抑制性,其次为s.mutans(ic50=0.655mg/ml)和s.fecalus(ic50=0.986mg/ml)。
示例5:包含壳聚糖提供无定形磷酸钙的牙膏的制备、优选及性质。
为增强输送钙离子和磷酸根离子,制备包含壳聚糖提供无定形磷酸钙(具有生物活性磷酸钙)的牙膏。采用喷雾-干燥方法将钙盐和磷酸盐分别包封于不同的壳聚糖微球,形成原位壳聚糖无定形磷酸钙微球。在使用时,钙和磷酸根快速地从壳聚糖微球释出并原位形成无定形磷酸钙。这将增强钙和磷酸根的生物利用性。壳聚糖通过增加无定形磷酸钙的保留时间以进一步提升其有效性。壳聚糖作为输送载体,同时也作为一种抗菌剂。由于钙离子和磷酸根离子分别被包封于不同的壳聚糖微球,该输送系统仅在刷牙时激活生成无定形磷酸钙。所述牙膏在储存阶段避免无定形磷酸钙过早转换为羟基磷灰石,从而显著提升产品稳定性、延长产品保质期。据此目的,制备一种新颖的复合功能的包括混合无定形磷酸钙微球的牙膏。
壳聚糖无定形磷酸钙微球的制备和表征。
据此方法,用喷雾干燥机制备包含氯化钙或磷酸钠的两种壳聚糖微球。制备溶有氯化钙或磷酸钠的壳聚糖。所述溶液采用带0.77mm流体加压雾化器的büchi-b190喷雾干燥机喷雾干燥。所述溶液的水和挥发性酸被气流移除,同时收集得到悬浮于气流的细颗粒。诸如给料速率、入口温度、雾化气流速率等参数将优化以控制壳聚糖无定形磷酸钙微球的性质。
所述壳聚糖-氯化钙微球和壳聚糖-磷酸纳微球将以钙-磷摩尔比例1.5而混合。该混合微球在遇水时原位形成无定形磷酸钙。
无定形磷酸钙微球的表征。
(a)粒径分析。微球悬浮于无水乙醇后,进行激光衍射确定微球粒径。
(b)钙和磷的释放曲线。壳聚糖微球悬浮于生理盐水。在预设时间内采取释放介质样品,钙的浓度用钙离子电极测量和磷的浓度将由比色法检测试剂盒(biovisioninc,ca)确定。
(c)粉末x光衍射(xrd)。由粉末x光衍射确认无定形磷酸钙的生成。具有原位生成无定形磷酸钙的壳聚糖微球与生理盐水混合,收集、烘干和分析所得沉淀以确认无定形磷酸钙的形成。
制备含壳聚糖提供无定形磷酸钙的牙膏。
在真空环境烘干的不含有任何有效成分(如氟化物)的标准牙膏将作为基础配方牙膏。通过混合基础配方牙膏、具有原位生成无定形磷酸钙的壳聚糖微球,和适量甘油以制备含壳聚糖提供无定形磷酸钙的牙膏。分别用钙离子电极和比色法检测试剂盒将用于评估钙和磷的释放曲线。
选择合适浓度的壳聚糖、钙盐、磷酸盐以及优化给料速率有助于得到最优粒径。
示例6:含壳聚糖提供无定形磷酸钙的牙膏的功效评估。
1.抗菌测试。
通过诸如xtt比色法、抑菌圈、菌落单位指数梯减实验等测试确认口腔微生物对于壳聚糖的敏感性。
1.1xtt比色法。
重复xtt比色法以确定细菌的代谢活性。所述细菌包括s.sanguis,s.fecalis和s.mutans。10k壳聚糖将被用于测试。通过xtt比色法确认浓度和治疗时间对于细菌代谢活性的影响。
1.2抑菌圈。
抑菌圈被用于度量壳聚糖对于在培养基内培养的口腔细菌的作用。所述细菌被均匀擦拭于培养板。浸渍有待测试复合物的滤纸盘被设置于琼脂表面。所述复合物从滤纸盘扩散进入所述琼脂。所述复合物浓度随着离滤纸盘的距离的增加而降低。如果所述复合物在特定浓度对于细菌具有抑制作用,除了高于或者等同于该浓度琼脂区域之外无菌落分布。因此,抑菌圈的尺寸将度量所述复合物的有效性:所述滤纸盘的净区域越大,所述复合物越有效。
1.3cfulogreduction菌落单位指数梯减实验。
菌落单位指数梯减实验将用于s.sanguis,s.fecalis和s.mutans。该测试将度量壳聚糖的杀菌能力。通过搜集测试微生物再梯度稀释其于mrd制备包含104fcu/ml的测试微生物悬浊液。各个测试样品按六份重复依次置于24孔无菌测试组织培养板。每培养板孔分别接种3ml所述悬浊液,其中1ml所述悬浊液被立即移除以提供0时刻基准值,剩余2ml述悬浊液仍保留在各个培养板孔内。培养板用封口膜密封于37℃及150rpm转速培养24小时,再进行菌落数枚举。将液体培养基样品通过梯度稀释后涂置预制板计数琼脂(difcolaboratories,detroit,mi),在0,4,8,12和24小时分别确认菌落数。在35℃培育培养板,在48小时培养期后用quebec菌落计数器(americanopticalcorp.)计算菌落数。
1.4口腔生物膜形成抑制。
涂有人类唾液的羟基磷灰石碟片与s.mutans31377的atcc系列培养,进而被分隔为两组:pbs对照组和10k壳聚糖组。经过7天培养收集生物膜。通过xtt存活率试验确定定植细菌细胞的数量,同时确定各个碟片的所述生物膜的干质量。所有试验均一式三份并且重复三次。
壳聚糖的抗菌性能众所周知,并被先前研究所证实(rabea,e.i.,m.e.,stevens,c.v.,smagghe,g.&steurbaut,w.壳聚糖作为抗菌剂:应用和作用方式.biomacromolecules4,1457-1465(2003).)devlieghere,f.,vermeulen,a.&debevere,j.壳聚糖:抗菌活性,作为水果和蔬菜涂层与食物成分和适用性相互作用.foodmicrobiology21,703-714(2004).)。
先前的xtt存活率试验清楚地表明5k和10k壳聚糖具有有效抑制作用(参见附图的图3和图4)。壳聚糖的抗菌性能有益于预防龋齿。根据第一阶段研究,除了xtt比色法和抑菌圈,还可采用菌落单位指数梯减实验测试度量壳聚糖的杀菌能力,揭示壳聚糖的广谱抗菌性能,以优化牙膏配方的壳聚糖浓度。
1.脱矿/再矿化测试。
1.1脱矿/再矿化评估的离体酸碱循环模式。
为进行脱矿/再矿化测试,费瑟斯通实验室的酸碱循环模型,作为一个高效的、有效的、可重复的且已被多点验证并且20多年间广泛使用的检测手段,被用于牙膏配方的抗龋齿潜力研究(stookey,g.k.etal.费瑟斯通实验室酸碱循环模式:一种前瞻性的多点验证方法.amjdent24,322-328(2011).)一种与此类似的酸碱循环模式先前已被用于氟化物漆的脱矿/再矿化研究.(hong,l.,ettinger,r.l.,c.a.&wefel,j.s.义齿基牙氟化物漆的离体评估.jprosthetdent89,28-36(2003).hong,l.,watkins,c.a.,ettinger,r.l.&wefel,j.s.离体牙根表面损伤的局部氟化物和氟化物漆作用.amjdent18,182-187(2005)。
随机选取40个拔除的人类第三磨牙,只选取具有健全且完整表面的牙齿。,除了留有一个2mm*4mm的窗口,各个牙齿表面均涂有两层耐酸的指甲油。牙经牙根顶部的钻孔系线用来将牙齿置于各种溶液内。用脱矿溶液来离体形成早期龋齿损伤。recaldent®酪蛋白磷酸肽-无定形磷酸钙(mipaste,gcamerica,alsip,il)和钙钠磷硅酸盐(sootherxtoothpaste,3mespewestpalmbeach,fi)用作阳性对照组,目前这两种再矿化剂产品已应用于临床。
所述牙齿将随机分为四个分组:阴性对照组、mipaste组、sootherx组和壳聚糖-无定形磷酸钙组。治疗方案如下。
组a:阴性对照组,无治疗措施,除了用蒸馏去离子水冲洗20秒钟,作为阴性对照。
组b:mipaste组,用棉签每天两次擦拭牙齿表面,放置不动两分钟。
组c:sootherx牙膏组,用牙刷每天两次刷牙齿表面两分钟。
组d:壳聚糖-无定形磷酸钙原型牙膏,用牙刷每天两次刷牙齿表面两分钟。
按各组治疗方案第一次治疗后,用去离子/蒸馏水冲洗牙齿20秒钟,再置于脱矿溶液6小时,以形成人造类龋齿损伤。所述脱矿溶液包括2.2mmcacl2·2h2o,2.2mmkh2po4和50mm醋酸,酸碱度为4.3。6小时后,取回样本,用去离子/蒸馏水冲洗20秒钟。按各组方案,所有样本按治疗方案分别再处理一遍。第二次治疗后,所有样本均被置于人工唾液溶液17个小时。所述人工唾液溶液包括1.5mmcacl2·2h2o,0.9mmkh2po4和150mmkcl,酸碱度为7。17个小时后,用去离子/蒸馏水冲洗所述样本20秒钟。该酸碱度循环与食物摄入有关,被用于模仿口腔环境的变化。该循环持续保持14天。
1.表征和数据分析。
采用现代仪器分析技术表征牙齿表面,包括形态、化学和机械分析。形态评估包括扫描电子显微镜(sem)和偏振光显微镜(plm)。由plm和μct度量损伤深度和再矿化宽度,μct还度量矿物质密度。常规显微压痕是表征表面硬度和强度的极佳工具,特别是薄或者厚的薄膜。根据本申请,大载荷的常规压痕用于表征表面硬度。化学分析包括auger电子能谱和xps以度量钙元素和磷元素的深度曲线。
采用anova比较4个分组的脱矿深度和再矿化宽度。spss统计程序处理脱矿深度数据、再矿化宽度数据、化学分析数据和机械分析数据,anova评估4个分组的差异。
示例7:壳聚糖/cacl2/na2hpo4用于原位生成无定形磷酸钙以再矿化牙齿。
1.制备负载cacl2或者na2hpo4的壳聚糖微球。
10k壳聚糖溶解于双蒸蒸馏水(dd)形成80mg/ml。离心或者过滤所述混合物以移除任何未溶解的残留物以获得工作用壳聚糖溶液。添加1v%的醋酸以溶解壳聚糖。cacl2溶解于双蒸蒸馏水以制备工作用1mcacl2溶液,na2hpo4溶解于双蒸蒸馏水以制备工作用0.667mna2hpo4溶液。
为了制备壳聚糖/cacl2微球,1ml上述制备的10k壳聚糖溶液与0.2ml的cacl2溶液通过涡旋混合2分钟。所述溶液被添加至10ml含100mg表面活性剂span80的轻质矿物油。所述混合物高速涡旋3分钟以形成乳白色的水-油乳化液。所述水-油乳化液被添加到放置于加热/搅拌器的100ml烧杯。保持38℃,以400rpm磁力搅拌所述乳化液19个小时以蒸发移除水分。所述混浊物被添加至80ml正己烷以沉淀形成的壳聚糖/cacl2微球。所述液体通过离心得以澄清。用40ml正己烷再次冲洗所述沉淀,离心以移除残留的表面活性剂。所述上层液体经离心得以澄清。冲洗过程和离心过程分别重复两次。经真空烘干所述沉淀最终获得干燥的壳聚糖/cacl2微球。产率为85wt%至95wt。采用离子选择电极法确定cacl2的负载量为14wt%至16.6wt%。
替代地,上述制备的10ml10k壳聚糖溶液与2mlcacl2溶液通过涡旋混合2分钟。于250ml烧杯内,上述溶液被添加至120ml含1200mg表面活性剂span80的轻质矿物油。所述混合物以1000rpm磁力搅拌30分钟,再以750rpm磁力搅拌3个小时以形成乳白色的水-油乳化液。所述水-油乳化液被添加至设置于加热/搅拌器的1000ml烧杯。以500rpm磁力搅拌所述乳化液,并在38℃保持19个小时然后升温至45℃保持2至5个小时以蒸发移除水分。所述混合物被添加至400ml正己烷以沉淀制备的壳聚糖/cacl2微球。所述液体经离心得以澄清。80ml正己烷再次冲洗所述沉淀,离心以移除残留的表面活性剂。冲洗过程和离心过程分别重复两次。经真空干燥所述沉淀最终获得壳聚糖/cacl2微球。所述产率为85wt%至95wt%。离子选择电极法确定cacl2的负载量为14wt%至16wt%。
为了制备壳聚糖/na2hpo4微球,上述制备的1ml10k壳聚糖溶液与0.2ml的na2hpo4溶液通过涡旋混合2分钟。所述溶液被添加至10ml含100mg表面活性剂span80的轻质矿物油。所述混合物高速涡旋3分钟以形成乳白色的水-油乳化液。所述水-油乳化液被添加至放置于加热/搅拌器的100ml烧杯。保持38℃,以400rpm磁力搅拌所述乳化液19个小时以蒸发移除水分。所述混浊物被添加至80ml的正己烷以沉淀所形成的壳聚糖/na2hpo4微球。所述液体通过离心得以澄清。40ml正己烷再次冲洗所述沉淀,离心以移除残留的表面活性剂。所述上层液体经离心得以澄清。冲洗过程和离心过程分别重复两次。经真空干燥所述沉淀最终获得干燥的壳聚糖/na2hpo4微球。产率为81wt%至85wt。采用abeam®磷酸盐比色试剂盒确定na2hpo4的负载量为22wt%至23wt%。
替代地,上述制备的10ml10k壳聚糖溶液与2mlna2hpo4溶液通过涡旋混合2分钟。250ml烧杯内,上述溶液被添加至120ml的包括1200mg表面活性剂span80的轻质矿物油。所述混合物以650rpm磁力搅拌3个小时以形成乳白色的水-油乳化液。所述水-油乳化液被添加至设置于加热/搅拌器的1000ml烧杯。以500rpm磁力搅拌所述乳化液,并在38℃保持19个小时然后升温至45℃保持2至5个小时以蒸发移除水分。所述混合物被添加至400ml正己烷以沉淀所形成的壳聚糖/na2hpo4微球。所述液体经离心得以澄清。80ml正己烷再次冲洗所述沉淀,离心以移除残留的表面活性剂。冲洗过程和离心过程分别重复两次。经真空干燥所述沉淀最终获得壳聚糖/na2hpo4微球。所述产率为81wt%至85wt%。采用abeam®磷酸盐比色试剂盒确定na2hpo4的负载量为22wt%至23wt%。
1.从壳聚糖微球释放钙离子或者磷酸根离子
在室温下,以双蒸蒸馏水为释放介质释放钙离子和磷酸根离子。在5分钟,55分钟,3小时,6小时10分钟,22小时10分钟从所述释放介质被分别取样。经适当处理所述样本,采用钙离子选择电极法或者abeam®磷酸盐比色试剂盒分别确定钙离子浓度和磷离子浓度。参见附图的图5,示出了由10k壳聚糖制备的壳聚糖/cacl2微球的钙离子典型释放曲线。钙离子释放非常迅速,接近瞬时,在5分钟内接近97%的钙离子被释放。为了延长钙离子的释放时间,可采用水溶性低的钙盐,以及采用亲水性弱的聚合物与壳聚糖混合而制备所述微球。
参见附图的图6,示出了由10k壳聚糖制备的壳聚糖/na2hpo4微球的磷酸根离子典型释放曲线。磷酸根离子释放迅速,在5分钟内超过63%的磷酸根离子被释放,在190分钟后85%的磷酸根离子被释放。为了延长磷酸根离子的释放时间,可采用水溶性低的磷酸盐,以及采用亲水性弱的聚合物与壳聚糖混合而合成所述微球。在室温下,从壳聚糖/na2hpo4微球释放磷酸根离子。释放介质的酸碱度在释放过程中被监测。
附图图7展示出了壳聚糖微球释放钙离子或磷酸根离子的释放过程中释放介质的酸碱度变化。所述双蒸蒸馏水具有中性酸碱度。从5分钟时的所述第一取样时间至22小时10分钟时的所述末次取样时间,壳聚糖/cacl2微球的释放介质酸碱度相对稳定地维持于6.1。与此同时,壳聚糖/na2hpo4微球的释放介质酸碱度从5分钟时的7.56下降至55分钟时的6.81,此后相对稳定地维持于6.8。精氨酸添加至最终牙膏配方以增强壳聚糖中和口腔细菌导致的酸性环境的能力。精氨酸比壳聚糖碱性更强。因酸通常加入以增强不溶于中性水溶液的壳聚糖的水溶性,添加精氨酸将使壳聚糖成游离碱的状态。添加精氨酸的其它益处包括促进形成无定形磷酸钙。一旦壳聚糖游离碱重新带正电荷,将再显示出其抗细菌性能。
采用ftir红外光谱仪记录所述10k壳聚糖,所述壳聚糖/cacl2微球和所述壳聚糖/na2hpo4微球的ftir红外光谱。附图图8展示出了所述10k壳聚糖,所述壳聚糖/cacl2微球和所述壳聚糖/na2hpo4微球的典型傅里叶变换红外光谱。10k壳聚糖在1153cm-1(vc-o-c糖苷桥),1061cm-1(vc-o伯羟基附近)和1017cm-1(vc-c和vc-o),1633cm-1(酰胺带i)和1538cm-1(酰胺带ii)具有特征峰。将na2hpo4加入到入壳聚糖而形成微球后,除已观测得到的壳聚糖特征峰,还观测得到1378cm-1和858cm-1两个新的特征峰,858cm-1特征峰是基于hpo42-。将cacl2加入到入壳聚糖而形成微球,除已观测得到的壳聚糖特征峰,还观测得到1527cm-1,1450cm-1,1378cm-1的新峰。
额外可使用的盐类。
化学品水溶性
醋酸钙34.7g/100ml(20℃)
cacl281.1g/100ml(25℃)
泛酸钙50mg/100ml(25℃)
抗环血酸钙50g/100ml
葡萄糖酸钙缓溶,4.33g/100ml
乳酸钙7.9g/100ml(30℃),6.7g/100ml(25℃)
乙酰丙酮酸钙
乳糖酸钙
柠檬酸钙0.095g/100ml(25℃)
糖庚糖酸钙
苯甲酸钙2.72g/100ml(20℃)
糖精钙
山梨酸钙
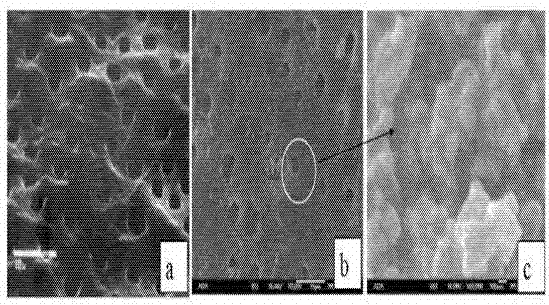
示例8:cacl2/壳聚糖和na2hpo4/壳聚糖微球的sem及edx分析。
采用扫描电子图像表征制备的cacl2/壳聚糖和na2hpo4/壳聚糖微球。简要地,采用双层碳粘合层将cacl2/壳聚糖和na2hpo4/壳聚糖微球分别固定于sem样品架。于所述样本的表面溅镀一薄层金。采用sem观测所述溅镀金后的样品。
附图图9展示出了制备的cacl2/壳聚糖微球的5000x和100x放大倍率的典型sem图像。附图图9的图像a展示出了微米级粒子(小于10μm纳米结构。edx分析显示,微米级粒子及其纳米结构均具有钙元素和氮元素,说明它们中均存在cacl2和壳聚糖,微米级粒子易于进一步形成小于100μm集体(附图图9的图像b)。附图图10展示出了制备的na2hpo4/壳聚糖微球的5000x和100x放大倍率的典型sem图像。附图图10的图像a示出了微米级粒子(小于5μm纳米结构。edx分析显示,微米级粒子和纳米结构均具有钠元素、磷元素和氮元素,说明它们中均存在na2hpo4和壳聚糖,微米级粒子易于进一步形成小于100μm的聚集体(附图图10的图像b)
附图图11阐述了添加酸碱度为9.6的精氨酸溶液时,cacl2/壳聚糖悬浮液或者na2hpo4/壳聚糖悬浮液的酸碱度变化。随着不断添加精氨酸,酸碱度迅速上升至8.3,随后逐渐接近酸碱度9。
示例9:脱矿/再矿化测试的牙膏配方。
混合非离子增稠剂羟乙基纤维素和甘油/水共溶剂以制备均匀粘稠的增稠混合物。冷冻干燥所述含水混合物以移除水分,得到无水粘稠的增稠混合物。按15:85的质量比例混合所述cacl2/壳聚糖微球和上述粘稠的增稠混合物以形成所述牙膏。
田纳西大学健康科学中心大学牙学院有因临床实践从口腔病人收集的灭菌了的人类第三磨牙形成收集池。该池中牙齿不能一一确认其口腔病人。使用上述牙齿是符合人类试验准则的。
从上述收集池随机选取健全的人类第三磨牙。除了留有一个2mm*7mm的窗口,在各个牙齿表面均涂有两层耐酸的指甲油。牙线将经过牙根顶部的钻孔系好牙齿,以将牙齿悬浮于各种溶液内。
涂有两层耐酸的指甲油的所述牙齿被随机分成三个组(每个组均有10个牙齿):阴性对照组(contr组),mipasteplus组(阳性对照组,mi+组)和实验组(chi-acp组)。mipasteplus(recaldentm酪蛋白磷酸肽-无定形磷酸钙,gcamerica)被用于阳性对照分组,是因其已在离体酸碱循环模型中测试其再矿化牙釉质亚层损伤。mipasteplus含有0.2%(900ppm)的氟化物,厂家不推荐6周岁以下儿童使用,也不推荐12周岁以下儿童整夜使用。mipasteplus由于含有乳蛋白和苯甲酸可能导致过敏反应。
为进行脱矿/再矿化测试,费瑟斯通实验室的酸碱循环模型,作为一个高效的、有效的、可重复的且已被多点验证并且20多年间广泛使用的检测手段,被用于牙膏配方的抗龋齿潜力研究(stookey,g.k.etal.费瑟斯通实验室酸碱循环模式:一种前瞻性的多点验证方法.amjdent24,322-328(2011)。此模式在此用来评价牙釉质矿物的获得及流失以研究牙膏配方的抗蛀牙潜力。所述离体酸碱循环过程由15个脱矿阶段和15个再矿化阶段组成,每个脱矿阶段为6个小时,每个再矿化阶段为16.5个小时(每天脱矿后再矿化)。所述脱矿溶液包括2.2mmcacl2,2.2mmkh2po4,50mm醋酸,酸碱度为4.3。所述再矿化溶液包括1.5mmcacl2,0.9mmkh2po,150mmkcl,和酸碱度为7.0。所述牙齿在从脱矿溶液至再矿化溶液转移间隙和从再矿化溶液至脱矿溶液转移间隙时得到处理。所述阴性对照组除了采用重蒸馏水冲洗60秒钟外无其它处理措施;根据制造商提供的指南,所述mipasteplus组采用刷子将mipasteplus涂刷于所述牙齿表面的暴露窗口,形成mipasteplus的薄层并静置10分钟。所述chi-acp组(即实验组),采用牙刷将选用的牙膏手动涂刷至所述牙齿表面的暴露窗口(每个牙刷涂刷40mg牙膏和150μl的na2hpo4/壳聚糖溶液),手动涂刷1分钟。在此处理前后分别采用重蒸馏水冲洗三个分组的牙齿样品。当牙齿从脱矿溶液或者再矿化溶液内移出时,所述牙齿各被冲洗60秒钟。治疗过程后,所述牙齿在室温下被悬置于相应的脱矿溶液或者再矿化溶液。
经15天的脱矿/再矿化过程,首先用与sem连用的edx分析所述经处理的牙釉质表面的元素成分。edx分析后,用硬组织切片机将所述牙齿切片为120μm至150μm的薄片以暴露处理过的牙釉质表面下的横截面,采用plm偏光显微镜观测上述薄片。
本申请的目的在于基于壳聚糖微球释放的钙离子和磷酸根离子原位生成无定形磷酸钙以提供一种新式抗龋齿牙膏。为测试此概念,将所述过程简化为采用cacl2/壳聚糖微球和代替壳聚糖-磷元素微球的磷酸盐溶液。配制包含cacl2/壳聚糖微球、多羟基纤维素和甘油的无水牙膏。该牙膏与阴性对照组和阳性对照组一起测试其再矿化牙釉质。在15天的脱矿/再矿化期内,所述实验组采用该配方牙膏于溶解有na2hpo4和精氨酸双蒸蒸馏水中涂刷所述牙釉质窗口一分钟,(附图图12和图13中的chi-acp组)。
图12阐述了三组处理后的牙釉质表面(包括contr,chi-acp和mi+的三个组)的元素分析结果。与所述阴性对照组(contr组,采用蒸馏去离子水处理)相比,chi-acp组的牙釉质表面钙含量(37.23±4.25wt%与33.89±3.28wt%)和钙/磷质量比(2.02±0.19与1.88±0.11)均显著上升(见图像a和图像b)。与此同时,所述用mipasteplus处理的阳性对照组(mi+组)的牙釉质表面钙含量(36.51±4.14wt%与33.89±3.28wt%)和钙/磷质量比(1.99±0.14与1.88±0.11)均略有上升。三个组中,牙釉质表面磷含量从所述阴性对照组的17.97±0.82wt%略有上升到,所述阳性对照组的18.30±0.80wt%,再到所述实验组的18.41±0.59wt%,在任何两个组之间均不存在显著差异(参见图像c)。扫描电子显微镜图像被用于观测治疗后牙釉质的表面形态(参见附图d,e和f)。三个组均未在牙釉质表面观测到明显的沉积。该观测与报道的抗过敏研究相反,过敏研究常发现牙膏所产生沉淀而闭塞牙本质管。然而,几乎上述研究均未将经处理的牙本质暴露于酸碱循环,并且是在处理过程后立即予以评估表征。
用plm度量处理过的牙釉质表面下的脱矿深度和再矿化厚度。对所有三个组,在三个组间和在任何两个组之间,脱矿深度均无显著差异。所述脱矿前缘深入牙釉质表面下650μm(参见附图图13),该深度大于先前研究报道的400μm,该差异的原因不是本研究的目的。然而,全部三个组的再矿化厚度具有统计学意义上的差异(参见附图图13)。所述阴性对照组(contr组)具有最小的再矿化厚度(73.8±24.9μm),此与先前的报道一致,。所述实验组(chi-acp组)具有最大的再矿化厚度(131.4±63.6μm),其后为阳性对照组(mi+组,115.2±26.8μm)。在p=0.05水平上,三个分组之间具有统计学意义上的显著差异。统计分析(dunnett’stest)显示,在p=0.05水平,在contr组和chi-acp组之间或者在contr组和mi+组之间再矿化厚度具有统计学意义上的显著差异。进一步分析显示,在chi-acp组和mi+组间再矿化厚度无统计学意义上的差异,chi-acp组的再矿化厚度略大于mi+组的再矿化厚度。基于mipasteplus包含有900ppm氟化物的事实,其含氟浓度接近常见的含氟牙膏的氟化物含量,所制备的牙膏比mipasteplus在再矿化侵蚀了的牙釉质更具有优势。
示例10:额外的牙膏配方。
配制包含壳聚糖微粒(16.7wt%,装载cacl2或者na2hpo4),poloxamer124(53.3wt%),聚乙二醇(12.0wt%),羟丙基纤维素(1.3wt%)和精氨酸(16.7wt%)的无水牙膏。调整精氨酸盐酸盐对精氨酸游离碱的质量比例得以使无水牙膏酸碱度被易于控制于8.5至9.7之间(参见附图图14)。其它牙膏中,所述壳聚糖含量为5wt%至18wt%,且cacl2和na2hpo4的含量少于2wt%。特别地,溶解羟丙基纤维素于聚乙二醇,添加poloxamer124可改变比例以制备均匀粘稠的增稠混合物。按不同比例混合壳聚糖微粒和上述均匀粘稠的增稠混合物以形成所述牙膏。添加游离精氨酸和盐酸盐以调节牙膏的酸碱度(参见附图图14)。在牙膏配方添加二氧化钛等其他成分以调节固体的总含量。
上述描述及附图中所示的本发明的实施例只作为举例而并不限制本发明。本发明的目的已经完整并有效地实现。本发明的功能及结构原理已在实施例中展示和说明,在没有背离所述原理下,本发明的实施方式可以有任何变形或修改。
- 还没有人留言评论。精彩留言会获得点赞!