一种同时处理多种生物组织的方法与流程
本发明涉及组织工程学医用生物材料技术领域,具体地涉及一种同时处理多种生物组织的方法。
背景技术:
随着社会老龄化现象越来越严重,癌症发生率也随之增加。各类实体瘤切除后,常常造成肿瘤组织周围软组织的缺损或薄弱,如乳腺癌切除后,造成胸壁软组织薄弱,再行乳房重建术时,常易引发假体移位、突出等并发症。
针对上述问题,采用同种异体脱细胞真皮基质及异种脱细胞基质进行肿瘤切除后软组织修复效果较佳,国内外临床应用已有二十余年历史。该类脱细胞基质产品也可用于其他原因造成的各类软组织薄弱处的增强或修复,如各类疝修复、肌腱加强、肩袖修复、肠胃吻合口加固等等。
目前有较多制备脱细胞基质的专利技术报道,但由于方法均采用强酸、强碱、蛋白酶或表面活性剂等对组织破坏较大的试剂,无法同批次相同工艺参数同时处理多种不同组织结构、不同厚度、不同成分及来源的生物组织,否则各种生物组织无法同时实现较好的脱细胞效果或较好的降解性能。例如较厚、组织结构较致密的猪真皮与较薄、组织结构较松散的猪小肠粘膜下层进行同时处理,往往能够实现前者完全去除细胞并保证组织不受破坏、降解性能较好的工艺参数用于后者时,后者亦能完全去除细胞,但组织破坏则较大,降解性能无法保证;而能够实现后者完全去除细胞并保证组织不受破坏、降解性能较好的工艺参数用于前者时,前者无法实现细胞完全去除,不能满足产品安全性相关要求。除此之外,目前的专利技术报道也有下述缺陷:
(1)采用酶及TritonX-100作为脱细胞试剂,试剂残留较难清洗,对胶原纤维破坏较大;
(2)采用苯扎溴铵溶液消毒,NaCl或EDTA高渗溶液及去垢剂Tween、SDS或Triton脱细胞,最后采用磷酸盐缓冲液洗涤后环氧乙烷灭菌,该方法采用的消毒液毒性较大,采用的脱细胞试剂较难清洗,对胶原纤维破坏亦较大;
(3)采用工艺中也使用到过氧乙酸强酸、去垢剂、胰酶等对材料破坏较大的试剂,材料完整性被破坏。
(4)采用工艺中使用毒性较大的化学交联剂,如戊二醛、环氧化物等,交联剂残留易降低材料生物相容性,部分交联剂处理的材料长期植入体内易引发钙化。
(5)单批次仅能处理单种生物组织,效率较低,产业化设备利用率低。
为了解决上述问题,本发明亟需开发一种同时处理多种生物组织的方法。
技术实现要素:
本发明的目的是提供一种同时处理多种生物组织的方法。
本发明的第一方面,提供一种同时处理多种生物组织的方法,包括以下步骤:
(a)预处理:将生物组织清洗后剥离无用组织,并进行消毒,获得预处理的目标组织;
(b)脱脂:采用脱氧胆酸钠或异丙醇浸泡所述预处理的目标组织,获得脱脂的目标组织;
(c)脱细胞:通过高压物理方法处理脱脂的目标组织以破碎细胞,再通过DNA酶浸泡及α-Gal酶溶液浸泡去除所有细胞碎片及抗原得到脱细胞的目标组织;
(d)交联:采用物理交联方法或化学交联方法对所述脱细胞的目标组织进行交联。
(e)灭菌:采用辐照或环氧乙烷对经步骤(d)交联的目标组织进行灭菌。
在另一优选例中,所述生物组织指动物源或同种异体组织,包括猪小肠、猪皮、牛皮、牛心包、猪心包、同种异体皮、牛心脏瓣膜、猪心脏瓣膜等任意两种或两种以上生物组织。
在另一优选例中,所述无用组织为脂肪。
在另一优选例中,步骤a)中,所述清洗为采用纯化水进行清洗。
在另一优选例中,步骤a)中,所述消毒为用75%乙醇或2%过氧化氢室温下消毒0.5-2h。
在另一优选例中,步骤b)中,所述浸泡为将所述预处理的目标组织置于1-3%脱氧胆酸钠或异丙醇中室温下浸泡12-48h。
在另一优选例中,步骤b)中,浸泡后再用纯化水冲洗3-8次,去除脱氧胆酸钠或异丙醇。
在另一优选例中,所述高压物理方法是指将所述脱脂的目标组织置于超高压设备中,在1-10MPa、4-40℃条件下处理1-60min。
在另一优选例中,所述DNA酶浸泡为室温下采用1-50U/mL的DNA酶溶液振荡浸泡4-24h。
在另一优选例中,所述α-Gal酶溶液浸泡为室温下采用1-50U/L的α-Gal酶溶液振荡浸泡4-24h。
在另一优选例中,所述振荡浸泡的振荡频率为80-150rpm。
在另一优选例中,所述振荡浸泡后用纯化水清洗5-10次。
在另一优选例中,所述物理交联方法是指将所述脱细胞的目标组织进行冷冻干燥,使其含水率低于10%,再置于真空干燥箱中,在80-130℃条件下,真空热处理24-120h,然后包装送灭菌。
在另一优选例中,所述化学交联方法为将所述脱细胞的目标组织浸泡于0.01-0.5mol/L的EDC溶液中,在室温下交联12-48h,再用纯化水清洗3-8次,最后包装送灭菌。
在另一优选例中,所述辐照采用的辐照源为伽马射线或电子束,灭菌剂量为15-30kGy。
在另一优选例中,采用环氧乙烷灭菌的参数为35-55℃下,灭菌4-20h,环氧乙烷浓度500-900mg/L。
本发明所提出的同时处理多种生物组织的方法,可同时处理多种生物组织,批处理生物组织量大,处理程度均一,工艺简单,易于产业化,实现高效生产。
本发明所提出的同时处理多种生物组织的方法,完全避免使用强酸、强碱和蛋白酶,可保留多种生物组织细胞外基质的天然三维胶原支架纤维结构,去除组织中引起免疫原性的细胞成分。采用本方法制备的生物组织,具有良好的生物相容性及机械性能,且相比天然生物组织,具有较高抗降解能力,可用于各类软组织损伤修复。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1为同批次处理的多种生物组织的HE染色图片,其中A为脱细胞猪真皮基质,B为脱细胞猪小肠粘膜下层基质,C为脱细胞牛心包膜。
图2为同批次处理的脱细胞猪真皮基质,脱细胞猪小肠粘膜下层基质及脱细胞牛心包膜在热处理前后的降解性能对比图片。
图3为同批次处理的脱细胞猪真皮基质、脱细胞牛心包膜、脱细胞猪小肠粘膜下层基质与同类产品降解性能对比图片。
图4为同批次处理的脱细胞猪心包,脱细胞牛真皮基质、脱细胞猪心脏瓣膜的细胞毒性检测结果图片。
具体实施方式
本发明人经过广泛而深入的研究,首次开发了一种同时处理多种生物组织的方法。所述方法包括步骤:预处理、脱脂、物理方法脱细胞、交联、辐照灭菌。本发明所提出的同时处理多种生物组织的方法,可同时处理多种生物组织,批处理生物组织量大,工艺处理程度均一,工艺简单,易于产业化,实现高效生产,避免产业化设备投料少、相对能耗大的问题。
处理方法
本发明的同时处理多种生物组织的方法,包括步骤:预处理、脱脂、物理方法脱细胞、交联、灭菌。
步骤一、预处理
将各类生物组织采用纯化水清洗,剥离无用组织如脂肪,并用75%乙醇或2%过氧化氢室温下消毒0.5-2h。各类生物组织指动物源或同种异体组织,包括猪小肠、猪皮、牛皮、牛心包、猪心包、同种异体皮、牛心脏瓣膜、猪心脏瓣膜等任意两种或两种以上生物组织。
本步骤通过清洗,物理剥离无用组织,并进行消毒,获得预处理目标组织以便后续处理。
步骤二、脱脂
将完成步骤一预处理的各类组织置于1-3%脱氧胆酸钠或异丙醇中室温下浸泡12-48h,浸泡后再用纯化水冲洗3-8次,去除脱氧胆酸钠或异丙醇。
本步骤通过脱氧胆酸钠或异丙醇浸泡,获得脱脂的目标组织。
由于本步骤去脂工艺对材料结构及完整性无破坏,所以对于厚薄不同,结构不同的多种组织同时处理,以最难去脂的组织为标准来选择浸泡时间。
步骤三、物理方法脱细胞
将完成步骤二脱脂的各类组织,置于超高压设备中,在1-10MPa、4-40℃条件下处理1-60min,再用1-50U/mL DNA酶溶液室温下振荡浸泡4-24h,1-50U/Lα-Gal酶溶液室温下振荡浸泡4-24h,振荡频率为80-150rpm,最后用纯化水清洗5-10次。
本步骤通过高压物理方法处理,可实现厚薄不同、结构不同的各种组织内部细胞同时破碎,不受组织来源影响;再通过DNA酶及α-Gal酶溶液浸泡即可去除所有细胞碎片及抗原。各种组织处理程度均一可控。本步骤采用的DNA酶及α-Gal酶均为非蛋白酶,对生物组织结构及完整性无破坏。
步骤四、交联
可采用物理交联方法,如热处理:将完成步骤三脱细胞的各类组织同批次冷冻干燥,使其含水率低于10%,再置于真空干燥箱中,在80-130℃条件下,真空热处理24-120h,然后包装送灭菌。
也可采用化学交联方法,如EDC(碳二亚胺)进行处理:将完成步骤三脱细胞的各类组织同批次浸泡于0.01-0.5mol/L的EDC溶液中,在室温下交联12-48h,再用纯化水清洗3-8次,最后包装送灭菌。
本步骤通过真空高温物理方法处理或采用无残留、生物相容性较高的催化剂EDC溶液浸泡处理,可实现厚薄不同、结构不同的各种组织同时交联处理,不受组织来源影响。各种组织处理程度均一可控。
催化剂EDC已用于多种植入医疗器械产品如胶原膜、透明质酸凝胶的交联处理,其能够催化胶原分子中的羧基发生酰胺反应,其本身作为催化剂未发生变化,且极容易溶于水,用纯化水清洗可彻底去除残留。
步骤五、灭菌
将最终包装完毕的各类组织,采用辐照灭菌或环氧乙烷灭菌方式进行灭菌;辐照灭菌的灭菌剂量为15-30kGy,辐照源为伽马射线或电子束;环氧乙烷灭菌参数为35-55℃下,灭菌4-20h,环氧乙烷浓度500-900mg/L。
本步骤通过辐照或环氧乙烷灭菌,可实现所有各类组织达到无菌状态,并可起到灭活各类病毒的效果。
本发明并非多工艺步骤简单排序,而是具有创新摸索出适合多种生物组织同时处理的工艺步骤及参数。并且本发明制备方采用了创新的1-10MPa超高压物理方法处理,使得多种组织的去细胞关键工序的效果均一。
本发明的主要优点包括:
(1)本发明所提出的同时处理多种生物组织的方法,完全避免使用强酸、强碱和蛋白酶,可保留多种生物组织细胞外基质的天然三维胶原支架纤维结构,去除组织中引起免疫原性的细胞成分。采用本方法制备的生物组织,具有良好的生物相容性及机械性能,且相比天然生物组织,具有较高抗降解能力,可用于各类软组织损伤修复。
(2)本发明所提出的同时处理多种生物组织的方法,可同批次处理多种生物组织,相比一批次处理单种生物组织的方法,可大大提高工艺处理效率,尤其是当某种生物组织数量较少的情况下,可混合多种组织处理,避免工业大型设备投料量过低,造成能源浪费及设备损耗相对较高的问题。
(3)本发明主要采用物理方法脱细胞,可实现多种生物组织同批次处理,相比化学试剂处理法处理程度更加均一可控。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
需要说明的是,在本专利的权利要求和说明书中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个”限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
实施例1
步骤一、预处理
将猪小肠、牛心包、猪皮采用纯化水清洗,剥离无用组织如猪小肠的肠系膜及浆膜层、牛心包外表粘附脂肪颗粒、猪皮表皮及皮下脂肪层等,获得猪小肠粘膜下层、牛心包、猪真皮层,并用75%乙醇室温下消毒0.5h。
步骤二、脱脂
将完成步骤一预处理的各类组织置于异丙醇中室温下浸泡48h,浸泡后再用纯化水冲洗8次,去除异丙醇。
步骤三、物理方法脱细胞
将完成步骤二脱脂的各类组织,置于超高压设备中,在10MPa、4℃条件下处理60min,再用50U/mL DNA酶溶液室温下100rpm振荡浸泡24h,50U/L的α-Gal酶溶液室温下100rpm振荡浸泡24h,最后用纯化水清洗10次。
步骤四、交联
将完成步骤三脱细胞的各类组织同批次冷冻干燥,使其含水率低于10%,再置于真空干燥箱中,在130℃条件下,真空热处理120h,然后包装送灭菌。
步骤五、辐照灭菌
将最终包装完毕的各类组织,采用辐照灭菌进行灭菌;辐照灭菌的灭菌剂量为30kGy,辐照源为伽马射线。
本实施例制备得到的脱细胞猪小肠粘膜下层基质、脱细胞牛心包、脱细胞猪真皮基质均实现了良好的脱细胞效果,各组织结构无破坏。
图1为采用上述三种组织的HE染色结果,其中A为脱细胞猪真皮基质,B为脱细胞牛心包,C为脱细胞猪小肠粘膜下层基质,从图中可以看出无任何细胞核残留,且各组织胶原纤维紧密无破坏。
实施例2
步骤一、预处理
将猪小肠、牛心包、猪皮采用纯化水清洗,剥离无用组织如猪小肠的肠系膜及浆膜层、牛心包外表粘附脂肪颗粒、猪皮表皮及皮下脂肪层等,获得猪小肠粘膜下层、牛心包、猪真皮层,并用2%过氧化氢室温下消毒1h。
步骤二、脱脂
将完成步骤一预处理的各类组织置于1%脱氧胆酸钠中室温下浸泡12h,浸泡后再用纯化水冲洗3次,去除脱氧胆酸钠。
步骤三、物理方法脱细胞
将完成步骤二脱脂的各类组织,置于超高压设备中,在5MPa、40℃条件下处理1min,再用30U/mL DNA酶溶液室温下120rpm振荡浸泡18h,30U/Lα-Gal酶溶液室温下80rpm振荡浸泡20h,最后用纯化水清洗8次。
步骤四、交联
将完成步骤三脱细胞的各类组织同批次冷冻干燥,使其含水率低于10%,再置于真空干燥箱中,在120℃条件下,真空热处理100h,然后包装送灭菌。
步骤五、辐照灭菌
将最终包装完毕的各类组织,采用辐照灭菌方式进行灭菌;辐照灭菌的灭菌剂量为25kGy,辐照源为电子束。
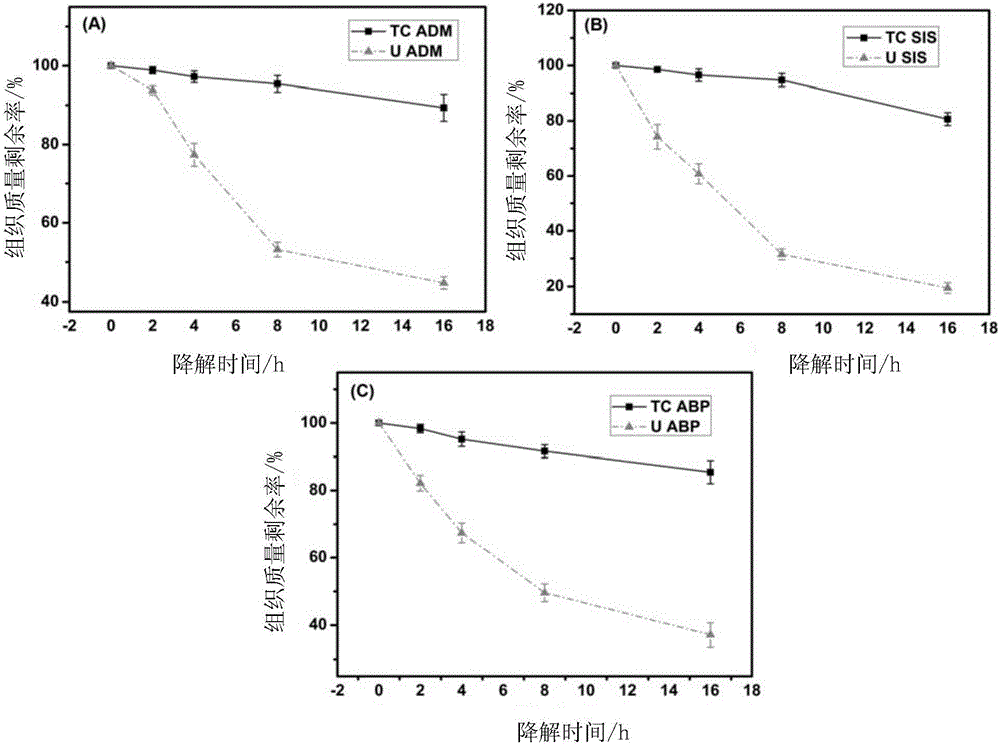
本实施例制备得到的脱细胞猪小肠粘膜下层基质、脱细胞牛心包、脱细胞猪真皮基质实现了同批次物理热交联处理,各组织的体外降解速率均明显慢于未经热处理的对照组织。
图2为上述三种本实施例制备的组织与未经热处理对照组织的体外降解对比结果。其中A为本实施例制备的脱细胞猪真皮基质(TC ADM)与未经热处理的脱细胞猪真皮基质(U ADM)的体外降解结果,B为本实施例制备的脱细胞猪小肠粘膜下层基质(TC SIS)与未经热处理的脱细胞猪小肠粘膜下层基质(U SIS)的体外降解结果,C为本实施例制备的脱细胞牛心包(TC ABP)与未经热处理的脱细胞牛心包(U ABP)的体外降解结果,上述三张对比图横坐标为降解时间,单位为h,纵坐标为组织质量剩余率,单位为%。从图中可以看出,采用本实施例的方法制备的各种组织,在实现较完整结构保留的基础上,均达到了良好的热交联效果,降解速率远远慢于未经热处理的各对照组织。
实施例3
步骤一、预处理
将猪小肠、牛心包、猪皮采用纯化水清洗,剥离无用组织如猪小肠的肠系膜及浆膜层、牛心包外表粘附脂肪颗粒、猪皮表皮及皮下脂肪层等,获得猪小肠粘膜下层、牛心包、猪真皮层,并用75%乙醇消毒2h。
步骤二、脱脂
将完成步骤一预处理的各类组织置于3%脱氧胆酸钠中室温下浸泡24h,浸泡后再用纯化水冲洗4次,去除脱氧胆酸钠。
步骤三、物理方法脱细胞
将完成步骤二脱脂的各类组织,置于超高压设备中,在1MPa、25℃条件下处理30min,再用1U/mL DNA酶溶液室温下150rpm振荡浸泡4h,1U/Lα-Gal酶溶液室温下150rpm振荡浸泡4h,最后用纯化水清洗5次。
步骤四、交联
将完成步骤三脱细胞的各类组织同批次浸泡于0.01mol/L的EDC溶液中,在室温下交联12h,再用纯化水清洗3次,最后包装送灭菌。
步骤五、辐照灭菌
将最终包装完毕的各类组织,采用环氧乙烷灭菌方式进行灭菌,环氧乙烷灭菌参数为55℃,灭菌4h,环氧乙烷浓度900mg/L。
本实施例制备得到的各类脱细胞组织,在实现良好的脱细胞效果同时,也能维持较完整的组织结构和完整性,与同类产品进行体外降解速率对比结果显示,本实施例制备得到的各类脱细胞组织的降解性能均优于或不差于同类产品。
图3为上述三种本实施例制备的组织与同类产品的体外降解对比结果。其中A为本实施例制备的脱细胞猪真皮基质(TC ADM)与同类未交联猪脱细胞真皮基质商品的体外降解结果,B为本实施例制备的脱细胞牛心包(TC ABP)与同类交联脱细胞牛心包商品的体外降解结果,C为本实施例制备的脱细胞猪小肠粘膜下层基质(TC SIS)与同类交联脱细胞猪小肠粘膜下层基质商品的体外降解结果,上述三张对比图横坐标为降解时间,单位为h,纵坐标为组织质量剩余率,单位为%。从图中可以看出,采用本实施例的方法制备的各种组织,在实现较好脱细胞效果的同时,均达到了良好的热交联效果,降解速率优于同类未交联产品或与同类交联产品相近。
实施例4
步骤一、预处理
将猪心包、牛皮、猪心脏瓣膜采用纯化水清洗,剥离无用组织如猪心包外表粘附脂肪颗粒、牛皮表皮及皮下脂肪层等,获得猪心包、牛真皮层、猪心脏瓣膜,并用75%乙醇室温下消毒1h。
步骤二、脱脂
将完成步骤一预处理的各类组织置于异丙醇中室温下浸泡36h,浸泡后再用纯化水冲洗5次,去除异丙醇。
步骤三、物理方法脱细胞
将完成步骤二脱脂的各类组织,置于超高压设备中,在8MPa、30℃条件下处理15min,再用20U/mL DNA酶溶液室温下110rpm振荡浸泡10h,40U/Lα-Gal酶溶液室温下140rpm振荡浸泡20h,最后用纯化水清洗7次。
步骤四、交联
将完成步骤三脱细胞的各类组织同批次浸泡于0.5mol/L的EDC溶液中,在室温下交联48h,再用纯化水清洗8次,最后包装送灭菌。
步骤五、辐照灭菌
将最终包装完毕的各类组织,采用环氧乙烷灭菌方式进行灭菌,灭菌参数为35℃灭菌20h,环氧乙烷浓度500mg/L。
本实施例制备得到的各类脱细胞组织,在有效去除细胞、热交联的同时,也具有良好的生物相容性及体外细胞毒性。
图4为上述三种本实施例制备得到组织体外细胞毒性检测结果之细胞增殖数量图片。其中A为空白对照组,B为阴性对照组,C为阳性对照组,D为脱细胞猪心包,E为脱细胞牛真皮基质,F为脱细胞猪心脏瓣膜。从图中可以看出,空白对照组A、阴性对照组B以及本实施例制备得到的三种脱细胞组织的细胞增殖数量接近,细胞形态均正常,说明本实施例制备得到的三种脱细胞组织具有良好的体外细胞相容性。
实施例5
本实施例与实施例1相同,仅步骤一中“将猪小肠、牛心包、猪皮采用纯化水清洗,剥离无用组织如猪小肠的肠系膜及浆膜层、牛心包外表粘附脂肪颗粒、猪皮表皮及皮下脂肪层等,获得猪小肠粘膜下层、牛心包、猪真皮层”更改为“将猪小肠,同种异体皮,猪皮,牛皮,牛心脏瓣膜采用纯化水清洗,剥离无用组织如猪小肠的肠系膜及浆膜层、各类皮的表皮及皮下脂肪层等,获得猪小肠粘膜下层,同种异体真皮层,猪真皮层,牛真皮层,牛心脏瓣膜”。
实施例6
本实施例与实施例3相同,仅步骤三、物理方法脱细胞中“将完成步骤二脱脂的各类组织,置于超高压设备中,在1MPa、25℃条件下处理1min,再用1U/mL DNA酶溶液室温下150rpm振荡浸泡4h,1U/Lα-Gal酶溶液室温下150rpm振荡浸泡4h,最后用纯化水清洗5次”更改为“将完成步骤二脱脂的各类组织,置于超高压设备中,在6MPa、10℃条件下处理25min,再用15U/mL DNA酶溶液室温下125rpm振荡浸泡14h,25U/Lα-Gal酶溶液室温下115rpm振荡浸泡10h,最后用纯化水清洗4次”。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!