一种具有生物活性的再生期器官去细胞生物支架的制备方法及其产品和应用与流程
本发明属于细胞生物学和生物材料技术领域,具体涉及一种具有生物活性的再生期器官去细胞生物支架的制备方法及其产品和应用。
背景技术:
为快速解决器官短缺难题,弥补采用生物支架材料移植后的组织不相容性和免疫排斥的弊端,人们利用实体器官本身包括肝脏、胰腺心脏、肾脏、肺脏等天然脏器,采用灌注方法获取去除细胞成分以后残留作为再生支架(Scaffold)结构。目前学术界认可的天然脏器去细胞Scaffold均来源于健康正常个体。首先,从生理角度考虑,健康正常个体去细胞天然生物支架(Naive decellularized sczaffold,NDS)其整体生物微环境处于“静息状态”,而再生期间器官去细胞生物支架(Regenerative Decellularized Scaffold,RDS)其整体生物微环境应该处于“活跃状态”,前期试验显示,健康个体来源的NDS与RDS相比,NDS缺乏再生器官所比备的细胞因子(IL-6,TNF-α,HGF,c-Met等);进一步,从功能角度考虑,实验验证发现,NDS对细胞支撑和诱导干细胞功能性定向诱导分化及器官生成方面潜力弱于RDS。因此,提供一种整体生物微环境处于“活跃状态”的器官去细胞生物支架的制备方法对器官工程与再生、转化医学研究及临床应用具有重要的应用价值。
技术实现要素:
有鉴于此,本发明的目的在于:(1)提供一种具有生物活性的再生期器官去细胞生物支架的制备方法;(2)一种具有生物活性的再生期器官去细胞生物支架;(3)一种具有生物活性的再生期器官去细胞生物支架的应用。
1、一种具有生物活性的再生期器官去细胞生物支架的制备方法,具体包括如下步骤:
(1)取离体再生期器官供体,采用生理盐水以灌注的方式洗出所述离体再生期器官中的红细胞;
(2)采用无菌双蒸水以灌注的方式溶解并洗出经步骤(1)处理过的器官中的细胞成分;
(3)采用十二烷基硫酸钠和微量消化液的混合液以灌注的方式洗出经步骤(2)处理过的器官中的细胞成分;所述微量消化液为胰蛋白酶和乙二胺四乙酸的混合液;
(4)采用无菌双蒸水以灌注的方式洗出经步骤(3)处理过的器官中的十二烷基硫酸钠和微量消化液的混合液;
(5)采用磷酸缓冲盐溶液以灌注的方式洗出经步骤(4)处理过的器官中无菌双蒸水,恢复生理状态,制得具有生物活性的再生期器官去细胞生物支架。
进一步,步骤(1)中,所述离体再生期器官为肝脏、胰腺、心脏、肾脏或肺脏中的一种。
进一步,步骤(1)中,所述生理盐水的质量分数为0.9%;所述灌注的速度为5-10mL/min,时间为10-30min。
进一步,步骤(2)中,所述灌注的速度为5-10mL/min,时间为24-48h。
进一步,步骤(3)中,所述十二烷基硫酸钠的质量分数为1%;所述胰蛋白酶的质量分数为0.005%;所述乙二胺四乙酸的质量分数为0.002%;所述灌注的速度为5-10mL/min,时间为24-48h。
进一步,步骤(4)中,所述灌注的速度为5-8mL/min,时间为4-6h。
进一步,步骤(5)中,所述磷酸缓冲盐溶液的pH值为7.0-7.2;所述灌注的速度为5-10mL/min,时间为1-1.5h。
2、由上述方法制得的具有生物活性的再生期器官去细胞生物支架。
进一步,具有生物活性的再生期器官去细胞生物支架在制备功能性器官中的应用。
本发明的有益效果在于:本发明提供一种具有生物活性的再生期器官去细胞生物支架的制备方法及其产品和应用,该方法主要采用灌注的方式去除离体再生期器官供体的细胞成分,获取该器官的去细胞生物支架(RDS),由动物实验证明,由于RDS是基于离体再生期器官供体制得,与来源于健康正常个体的器官制备的去细胞生物支架(NDS)相比,具有较强的生物活性,故在对细胞存活支撑、诱导干细胞向功能性细胞分化以及修复病损器官等作用方面具有明显的优势,同时,RDS在损伤微环境下,能够更好地“指挥”种植的种子干细胞按照RDS上的脉管网络模板“有条不紊”地进行时空排列,实现对功能性器官培育和重建的设想。同时,也为进行工程器官与再生以及转化医学研究提出了新的思路和可行性模型,可以进行临床推广应用,具有广阔的应用前景和较高的社会价值。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图:
图1为基于离体再生期器官供体制备去细胞生物支架的方法流程图;
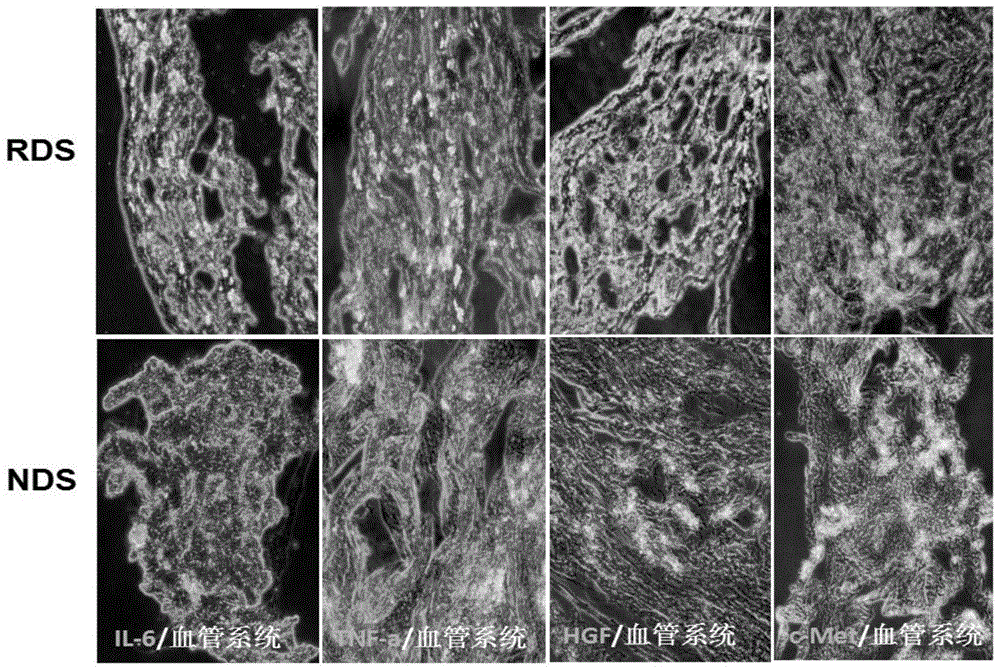
图2为肝再生期间所需细胞因子分别在RDS和NDS上的表达情况;
图3为分别种植在RDS和NDS上的成体干细胞向血管内皮细胞定向诱导分化的情况;
图4为分别种植在RDS和NDS上的成体干细胞向成熟肝细胞定向诱导分化的情况;
图5为RDS和NDS上的成熟肝细胞存活及增生的情况;
图6为种植在RDS和NDS上的成体干细胞体内移植后血流通畅性、成器官潜力和对病损器官修复能力情况。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。实施例中未注明具体条件的实验方法,通常按照常规条件按照制造厂商所建议的条件。
本发明实施例中使用的主要试剂如下:0.9%生理盐水(Saline),双蒸水(ddH2O),家用洗涤剂(1%SDS in ddH2O Gibco-BRL,cat.no.11330),磷酸盐缓冲液(0.01M PBS,北京中杉金桥生物技术公司,cat.no.ZLI-9062),羊抗IL-6(m-19)抗体(SANTA,cat.no.SC-1265),兔抗TNF-α抗体(Abcam,cat.no.Ab6617),兔抗HGF抗体(Affbiotech,cat.no.DF6326),羊抗HGF受体(c-Met)抗体(GenaTex,cat.no.GTX10681)。
实施例1
(1)健康成年小鼠离体肝脏器官去细胞生物支架(Normal Decellularized Liver Scaffold,N-DLS)的制备,操作流程如图1所示,具体步骤如下:
a.取体重约20-22g、8-10周龄C57BL/6健康成年小鼠的离体肝脏器官;
b.采用质量分数为0.9%的生理盐水以5mL/min的速度对离体肝脏器官灌注30min;
c.采用无菌双蒸水(ddH2O)以5mL/min的速度对离体肝脏器官灌注48h;
d.采用质量分数1%的十二烷基硫酸钠(SDS)和微量消化液(质量分数为0.005%的胰蛋白酶与质量分数为0.002%的乙二胺四乙酸的混合液)的混合液以5mL/min的速度对离体肝脏器官继续进行灌注48h;
e.采用无菌双蒸水(ddH2O)以5mL/min的速度对离体肝脏器官继续进行灌注6h;
f.采用磷酸盐缓冲液(0.01M PBS)以5mL/min的速度对离体肝脏器官继续进行灌注1.5
h,制得N-DLS。
(2)健康成年小鼠的离体再生期肝脏器官去细胞生物支架(Regenerative Decellularized Liver Scaffold,R-DLS)的制备,操作流程如图1所示,具体步骤如下:
a.取体重约20-22g、8-10周龄C57BL/6健康成年小鼠的离体再生期肝脏器官;
b.采用质量分数为0.9%的生理盐水以5mL/min的速度对离体再生期肝脏器官灌注30min;
c.采用无菌双蒸水(ddH2O)以5mL/min的速度对离体再生期肝脏器官灌注48h;
d.采用质量分数1%的十二烷基硫酸钠(SDS)和微量消化液(质量分数为0.005%的胰蛋白酶与质量分数为0.002%的乙二胺四乙酸的混合液)的混合液以5mL/min的速度对离体再生期肝脏器官继续进行灌注48h;;
e.采用无菌双蒸水(ddH2O)以5mL/min的速度对离体再生期肝脏器官继续进行灌注6h;
f.采用磷酸盐缓冲液(0.01M PBS)以5mL/min的速度对离体再生期肝脏器官继续进行灌注1.5h,制得R-DLS。
(3)R-DLS和N-DLS免疫组化
将制得的R-DLS和N-DLS用OCT包埋剂进行快速冷冻(液氮中)包埋,用冰冻切片机切成5-20μm厚的标本,采用免疫双染色方法进行特异标志物染色,观察比较R-DLS和N-DLS上的肝再生期间所需细胞因子(IL-6、TNF-a、HGF、c-Met)的变化,其中,标志物染色方法主要步骤为:a.在待检标本片上滴加0.01mol/L,pH7.4的PBS 200-500μL,10min后弃去,使标本保持一定湿度;b.向经步骤a处理过的待检标本片上滴加以1:400稀释的抗小鼠单克隆抗体(其中IL-6、TNF-α、HGF、c-Met的浓度均为25mM)溶液,使其完全覆盖标本,置于有盖搪瓷盒内,4℃保湿隔夜;c.向经步骤b处理过的待检标本片上滴加以1:2000稀释的荧光标记第二抗体(罗丹明),25℃下放置1h;d.取出玻片,先用0.01mol/L,pH7.4的PBS冲洗,再按顺序过0.01mol/L,pH7.4的PBS三缸浸泡,每缸3-5min,浸泡过程中不时振荡;e.以甘油覆盖载玻片后立即用荧光显微镜观察R-DLS和N-DLS两种生物支架的特异性荧光强度,结果如图2所示,R-DLS上IL-6、TNF-α、HGF的表达明显高于N-DLS,而c-Met在R-DLS上的表达明显低于N-DLS,说明R-DLS整体生物微环境处于活跃状态,具有生物活性。
实施例2
(1)配置内皮细胞条件培养基(CM1)
向细胞破碎并去除细胞碎片的哺乳动物发育期肝脏滤液和DMEM完全培养液体积比为1:4混合溶液中加入内皮细胞生长因子终浓度为20ng/mL。
(2)比较种植在R-DLS和N-DLS上的成体干细胞向血管内皮细胞定向诱导分化的情况
将实施例1所得两种去细胞生物支架(R-DLS,N-DLS)种植成体干细胞,然后置于12孔培养板培养,在CM1培养基中培养7天后取出,用OCT包埋剂进行快速冷冻(液氮中)包埋,然后用冰冻切片机切成5-20μm厚的标本,采用免疫双染色方法进行特异标志物染色。其中,标志物染色方法主要步骤为:a.在待检标本片上滴加0.01mol/L,pH7.4的PBS 200-500μL,10min后弃去,使标本保持一定湿度;b.向经步骤a处理过的待检标本片上滴加以1:400稀释的内皮细胞标记物(CD31浓度为25mM)溶液,使其完全覆盖标本,置于有盖搪瓷盒内,4℃保湿隔夜;c.向经步骤b处理过的待检标本片上滴加以1:2000稀释的荧光标记第二抗体(罗丹明),25℃下放置30min;d.取出玻片,先用0.01mol/L,pH7.4的PBS冲洗,再按顺序过0.01mol/L,pH7.4的PBS三缸浸泡,每缸3-5min,浸泡过程中不时振荡;e.以甘油覆盖载玻片后立即用荧光显微镜观察R-DLS和N-DLS两种生物支架的特异性荧光强度,结果如图3所示,R-DLS中干细胞表达CD31明显高于N-DLS,说明成体干细胞在R-DLS上分化为内皮细胞的能力明显强于N-DLS。
实施例3
(1)配置成熟肝细胞条件培养基(CM3)
向细胞破碎并去除细胞碎片的哺乳动物发育期肝脏滤液和DMEM完全培养液体积比为1:4混合溶液中加入HGF、bFGF、抑瘤素(Oncostatin)M、地塞米松、非必须氨基酸和L-谷氨酰胺至HGF终浓度为100ng/mL,bFGF终浓度为50ng/mL,Oncostatin M终浓度为20ng/mL,地塞米松终浓度为0.1μM,非必须氨基酸质量分数为1%,L-谷氨酰胺终浓度为5mM。
(2)比较种植在RDS和NDS上的成体干细胞向成熟肝细胞定向诱导分化的情况
将实施例1所得两种去细胞生物支架(R-DLS,N-DLS)种植成体干细胞,然后置于12孔培养板培养,在CM3培养基中培养7天后取出,用OCT包埋剂进行快速冷冻(液氮中)包埋,然后用冰冻切片机切成5-20μm厚的标本,采用免疫双染色方法进行特异标志物染色。其中,标志物染色方法主要步骤为:a.在待检标本片上滴加0.01mol/L,pH7.4的PBS 200-500μL,10min后弃去,使标本保持一定湿度;b.向经步骤a处理过的待检标本片上滴加一1:100稀释的白蛋白(ALB浓度为25mM)溶液,使其完全覆盖标本,置于有盖搪瓷盒内,4℃保湿隔夜;c.向经步骤b处理过的待检标本片上滴加以1:2000稀释的荧光标记第二抗体(罗丹明),25℃下放置1h;d.取出玻片,先用0.01mol/L,pH7.4的PBS冲洗,再按顺序过0.01mol/L,pH7.4的PBS三缸浸泡,每缸3-5min,浸泡过程中不时振荡;e.以甘油覆盖载玻片后立即用荧光显微镜观察R-DLS和N-DLS两种生物支架的特异性荧光强度,结果如图4所示,R-DLS中表达白蛋白细胞数量明显多于N-DLS,说明成体干细胞在R-DLS上分化为功能性肝细胞的能力明显强于N-DLS。
实施例4
(1)配置成体肝细胞培养基
向EBSS基础培养基中添加钙离子、镁离子、N-2-羟乙基哌嗪-N'-2-乙磺酸(HEPES)、HGF至钙离子浓度为1.8mM,镁离子浓度为0.813mM,HEPES浓度为10mM,HGF浓度为100ng/mL。
(2)比较RDS和NDS上的成熟肝细胞存活及增生的情况
将实施例1所得两种去细胞生物支架(R-DLS,N-DLS)种植原代培养的肝细胞,然后置于12孔培养板培养,在成体肝细胞培养基中培养4天后取出,用OCT包埋剂进行快速冷冻(液氮中)包埋,然后用冰冻切片机切成5-20μm厚的标本,采用免疫双染色方法进行特异标志物染色。其中,标志物染色方法主要步骤为:a.在待检标本片上滴加0.01mol/L,pH7.4的PBS 200-500μL,10min后弃去,使标本保持一定湿度;b.向经步骤a处理过的待检标本片上滴加以1:100稀释的Ki-67抗体溶液(含5%(v/v)正常羊血清的DMEM/F12溶液),使其完全覆盖标本,置于有盖搪瓷盒内,4℃保湿隔夜;c.用DMEM/F12培养液清洗经步骤b处理过的待检标本片,然后在其上滴加以1:2000稀释的荧光标记第二抗体(罗丹明),25℃下孵育30min;d.用DMEM/F12培养液对经步骤c处理过的待检标本片进行清洗,次数为6次,再用PBS进行清洗,系数为3次,再用DAPI染色1min后用去离子水清洗1次,最后用抗荧光淬灭PVP封片液封片,避光,荧光显微镜下观察。结果如图5所示,R-DLS中成熟肝细胞的Ki-67(细胞增殖与存活标记物)表达量明显高于N-DLS,说明成熟肝细胞在R-DLS上存活及增生能力明显强于N-DLS。
实施例5
(1)配置肝前体细胞条件培养基(CM2)
向细胞破碎并去除细胞碎片的哺乳动物发育期肝脏滤液和DMEM完全培养液体积比为1:4混合溶液中加入HGF、bFGF,牛胰岛素、人转铁蛋白、左旋甲状腺素、亚硒酸钠、腐胺、孕激素至HGF终浓度为10ng/mL,bFGF终浓度为5ng/mL,牛胰岛素终浓度为0.5mg/mL,人转铁蛋白终浓度为0.5mg/mL,左旋甲状腺素终浓度为40μg/mL,亚硒酸钠终浓度为34μg/mL,腐胺终浓度为0.5μg/mL,孕激素终浓度为6μg/mL。
(2)比较种植在RDS和NDS上的成体干细胞体内移植后血流通畅性、成器官潜力和对病损器官修复能力情况
将实施例1所得两种去细胞生物支架(R-DLS,N-DLS)种植成体干细胞,依次在三种条件培养基(CM1、CM2、CM3)中进行人工肝培养。结果如图6所示,由图6B可知,R-DLS中干细胞体外成器官能力(9-10天后有类肝样组织生成)明显快于N-DLS(9-10天后无类肝样轮廓生成)。由图6A和图6C可知,将R-DLS/干细胞体外培养9-10天后的复合物和N-DLS/干细胞体外培养9-10天后的复合物分别移植入终末期肝病动物模型体内,由图6A中激光散斑对比分析可知,移植后的R-DLS/干细胞复合物血流通畅性明显优于N-DLS/干细胞复合物,同时,经Masson染色处理后,图6C可知,移植后的R-DLS/干细胞复合物对硬化肝脏的修复能力明显优于N-DLS/干细胞复合物。上述结果表明,在病损条件下,R-DLS中干细胞再生修复能力明显优于其在N-DLS中。
本发明中,再生期器官是指器官在被切除一部分或者受损伤后,由于细胞死亡而数量急剧减少,各种修复再生信号通路由正常非活跃状态转变为快速生长活跃状态,刺激器官中的细胞因子、修复细胞(如成熟肝细胞或干细胞等)进行增殖,以补偿丢失、损伤的器官组织和恢复器官的生理功能,处在这个过程的器官称为再生期器官。上述实施例中,再生期器官除了使用肝脏,还可以使用胰腺、心脏、肾脏或肺脏,均可以制得具有生物活性的再生期器官去细胞生物支架。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!