花生枝叶水煎液的医药用途的制作方法
本发明属于医药领域,特别是涉及一种植物水煎液的医药用途。
背景技术:
缺血性脑卒中(cerebral ischemic stroke,CIS)又称脑梗死(cerebral infarction,CI),其具有高发病率、高病死率以及高致残率的特点,严重威胁着人类健康。
目前CIS治疗中使用药物溶解新形成的“血块”,使得血管再通、血流恢复是公认的挽救尚未梗塞的缺血脑组织的最有效的方法。而经过溶栓治疗的患者经常会出现以下情况:溶栓药物应用过程中,病人的症状往往得到明显好转,神经功能缺损明显减轻,甚至完全恢复正常,然而很快病人的症状又会再次加重,学界推测可能与缺血再灌注损伤(cerebral ischemia reperfusion injury,CI—RI)有关。
CI-RI是指因脑缺血致脑组织坏死前,闭塞的脑血管再通后缺血性损伤进一步加重的现象。其病理生理是一个多环节、多因素、多途径损伤的级联反应过程,现阶段临床上认为导致患者出现再灌注损伤的原因主要有以下几个方面,①兴奋性氨基酸产生毒性细胞;②神经细胞内钙超载;③酸中毒;④自由基形成过量;⑤自由基发生瀑布式连锁反应等。因为氧化应激导致的脑组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、NO等自由基生成过多,从而降低了线粒体呼吸链的氧化磷酸化效率,造成细胞结构损伤和功能代谢障碍,最终导致患者出现脑水肿;同时还会引起患者脑细胞、微血管内皮组织发生坏死现象.从而造成脑血管通透性增强,加重脑水肿。因此现阶段临床上将清除自由基,切断自由基的连锁反应作为治疗缺血再灌注损伤的关键环节。近半个世纪以来,一些治疗脑缺血的神经保护剂随着对缺血性脑卒中机制研究的不断深入而逐步问世,其中依达拉奉是目前被公认并列入指南推荐的高选自由基清除剂。然而由于其易对患者的肝肾功能造成损伤,导致患者出现急性肾衰、DIC、爆发性肝炎等不良反应,而限制了其临床应用。
落花生(Arachis hypogaea)属豆科类一年生草本植物,性味甘淡,微苦涩,入肝、心、肺经,其药用价值较少为人所知。
技术实现要素:
本发明的目的旨在提供花生枝叶水煎液在制备预防或者治疗脑缺血再灌注损伤的药物或保健品中的用途。
具体地说,本发明提供了花生枝叶水煎液在制备预防或者治疗脑缺血再灌注损伤的药物或保健品中的用途,所述花生枝叶水煎液通过如下方法制得:将花生枝叶12.5kg干燥、粉碎,加入相当于花生枝叶重量13倍量的水,煎煮1小时,倒出药液过滤,得滤液一;在滤渣中加入相当于滤渣重量11倍量的水煎煮1小时,倒出药液过滤,得滤液二;将两次滤液合并、浓缩,得到花生枝叶水煎液1000ml。
在一优选例中,所述花生枝叶水煎液的浓度为12.5g/ml。
本发明各个方面的细节将在随后的章节中得以详尽描述。通过下文以及权利要求的描述,本发明的特点、目的和优势将更为明显。
附图说明
图1为给药前和治疗7天后TTC染色的大鼠脑组织梗死体积测定结果
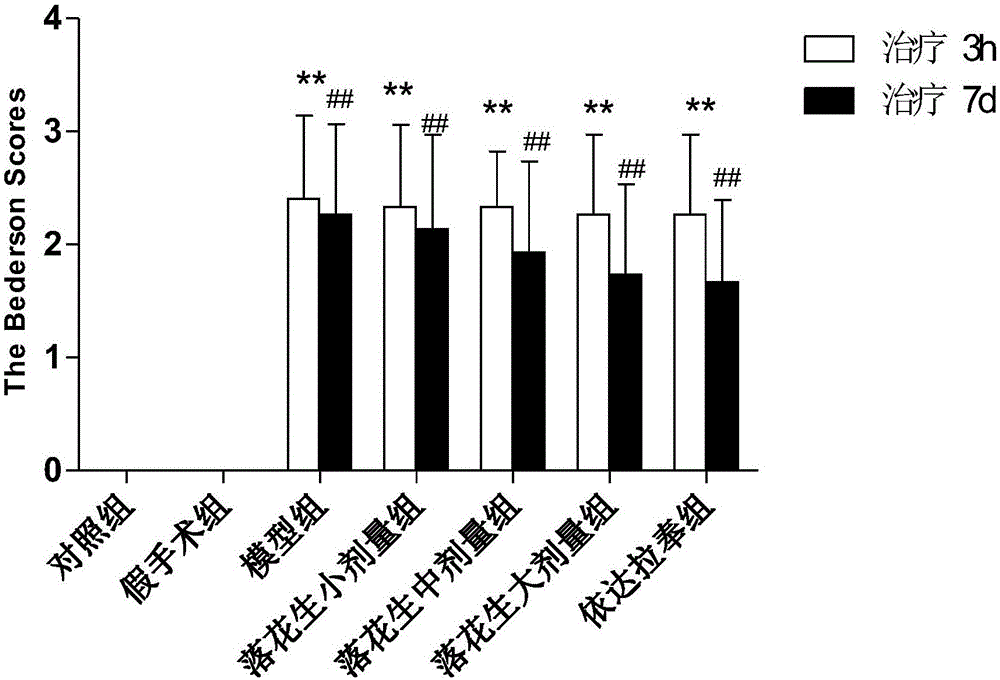
图2为给药前和治疗7天后大鼠神经缺损行为体征的Bederson评分结果
图3为给药大鼠脑组织的SOD生化检测结果
图4为给药大鼠脑组织的ROS含量检测结果
图5为给药大鼠脑组织的TNF-a含量检测结果
图6为给药大鼠脑组织各基因的Real time PCR检测结果
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中所使用的试剂和原料均可通过商业途径购买获得。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
本发明提到的上述特征,或实施例提到的特征可以任意组合。本专利说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以任何可提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。
实施例1花生枝叶水煎液的制备
称取花生枝叶12.5kg,粉碎、干燥,加13倍量的水,直火煮沸后文火煎煮1h,倒出药液过滤,得滤液一存放待用;然后在滤渣中加入11倍量的水,直火煮沸后文火煎煮1h,倒出药液过滤,得滤液二;将二份滤液合并,浓缩得到花生枝叶水煎液1000ml(浓度为12.5g/ml)。
实施例2花生枝叶水煎液治疗缺血再灌注损伤的药效学研究
1.大鼠急性中动脉栓塞后缺血再灌注模型(MCAO模型)的建立
本发明人采用改良的大脑中动脉栓塞法制备大鼠急性中动脉栓塞模型。具体操作方法如下:大鼠经10%水合氯醛(30mg/100g)腹腔注射麻醉后,取颈部正中切口,暴露右侧颈总动脉、颈外动脉和颈内动脉。结扎颈外动脉和颈总动脉近心端。用动脉夹夹闭颈总动脉远心端,并在动脉夹近端置丝线备用。在备用线近端剪一小口,将适合直径的线栓送入颈总动脉后,假性结扎备用丝线,并松开动脉夹。用镊子轻轻将线栓沿颈总动脉、颈内动脉,送入大脑中动脉起始部,遇阻力时停止,插入深度距离颈内外动脉分叉处约为17-24mm,造成右侧大脑中动脉的栓塞,扎紧备用丝线。缝合皮肤。用手术线固定钓鱼线于颈总动脉上防止滑脱与出血,将钓鱼线末段固定在皮下。逐层关闭各层组织。用100W的灯泡照射大鼠,保持体温(Longa EZ,Weinstein PR,Carlson S,et a1.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.;徐立新,袁芳.改良的大鼠脑局部缺血模型[J].中国康复理论与实践.2005,11(1):23-24.)。
再灌注的实施:
实验中模型组、花生枝叶水煎液各剂量组和阳性药物(依达拉奉)组在大鼠急性中动脉栓塞模型制备2小时后再行麻醉大鼠,从手术切口分离至皮下回拉钓鱼线lcm左右,使其后退出大脑中动脉主干,解除栓塞,此时大鼠脑底动脉环开通实现再灌注。
2.实验分组
本次实验分为对照组、假手术组、模型组、治疗组和阳性对照组。对照组为正常大鼠,未经过中动脉栓塞处理,采用生理盐水灌胃;假手术组为实验大鼠仅简单皮下切开,不进行大脑中动脉栓塞操作,处理后缝合切口,常规喂养,并同对照组一样采用生理盐水灌胃;模型组即大鼠急性中动脉栓塞后缺血再灌注模型鼠建立后采用生理盐水灌胃;治疗组即模型大鼠备制后分别给予花生枝叶水煎液高、中、低剂量灌胃治疗;阳性对照组即依达拉奉组,为模型大鼠备制后给予依达拉奉灌胃治疗。随后对各组大鼠进行脑组织梗死体积检测、Bederson分级评分、SOD生化检测、ROS含量检测、TNF-a含量检测和大鼠脑组织各基因Real time PCR检测。
3.大鼠脑组织梗死体积测定
3.1材料
选取健康雄性SD大鼠,体重250g±25g,共105只,由上海斯莱克实验动物中心提供,动物饲养环境:复旦大学清洁级实验室饲养,温度20-25℃,湿度40%-70%,噪声<60分贝,换气次数10-20次/h,工作照度L/D=12h/12h。所有动物购回后适应性分笼饲养1周,无不良反应,饮食、饮水正常者,即纳入实验。在常规适应性喂养后按照正常对照组、假手术组、模型组、落花生即花生枝叶水煎液(高、中、低剂量)治疗组及阳性对照组(依达拉奉组)组,各15只,制备急性大脑中动脉栓塞后缺血再灌注模型,造模成功后,落花生治疗组即花生枝叶水煎液治疗组按低剂量组、中剂量组和高剂量组分别予以花生枝叶水煎液50g/kg体重/d、100g/kg体重/d及150g/kg体重/d,分2次一天灌胃给药;同时依达拉奉组按每日3mg/kg体重/d,分2次一天灌胃给药,其余对照组、假手术组和模型组以等容量的生理盐水灌胃,连续7d后处死取材。
实验药物:花生枝叶水煎液(按实施例1制备)
3.2方法
大鼠脑组织梗死体积(infarct volume)测定:
采用TTC染色法进行大鼠脑组织梗死体积的测定。图像分析方法:用薄层扫描仪扫出图像,采用图像分析软件通过色彩分割等方法,由同一名操作者采用盲法计算出脑梗死病灶体积(像素数)。
3.3结果
表1给药前和治疗7天后TTC染色的大鼠脑组织梗死体积测定
*P<0.05VS对照组,**P<0.01VS对照组(所有组与对照组的比较),#P<0.05VS对照组,##P<0.01VS对照组(所有组与模型组的比较)
由图1可见,对照组及假手术组不存在大鼠脑组织坏死;模型组及落花生小、中和高剂量组和依达拉奉组可见明显的脑组织坏死。其中模型组梗死体积与落花生小剂量组间不存在统计学差异(P=0.63,P>0.05),模型组梗死体积显著大于落花生中剂量组(P=0.037,P<0.05);模型组梗死体积极显著大于落花生大剂量组与依达拉奉组(分别为P=0.004和0.001,P<0.01)。落花生小剂量组梗死体积显著大于依达拉奉组(P=0.004,P<0.01)。落花生大剂量组与依达拉奉组间不存在差异(P=0.072,P>0.05)。由此可见花生枝叶水煎液随着剂量增大梗死体积减小,且高剂量组与阳性依达拉奉疗效统计学无差异。
4.大鼠神经缺损行为体征的Bederson评分
4.1材料同3.1
4.2方法
采用Bederson评分法进行大鼠神经缺损行为体征评分。具体操作如下:
分别在实验动物成模后完全清醒(大约术后3小时)及7天对动物的神经缺损行为体征进行评分。根据Bederson神经缺损行为体征评分法进行综合等级评分。具体方法:轻提鼠尾,使其头部高于地面10cm,正常大鼠两侧前爪前伸。
具体评分标准如下:
0级(0分):无明显神经缺损症状;
I级(1分):梗塞对侧前肢回收屈曲内收,同侧前肢向地面伸展;
II级(2分):在I级体征基础上,加上俯卧于桌面时从梗塞侧向对侧推动大鼠时阻力降低;
III级(3分):在II级体征基础上,再加大鼠行走时向梗塞对侧肢体旋转(呈追尾状),甚至倾倒。
分值≥1分,为模型制作成功。
4.3结果
表2给药前和治疗7天后的大鼠神经缺损行为体征Bederson评分
*P<0.05VS对照组,**P<0.01VS对照组;3h时模型组和各治疗组间比较无差异;治疗7天,#P<0.05VS对照组,##P<0.01VS对照组;&&P<0.01VS模型组
如图2所示,对照组与假手术组的神经缺损行为评分为0分。造模成功后3小时模型组与各治疗组的Bederson评分无统计学差异(P>0.05);7天时落花生大剂量组与依达拉奉组的Bederson评分较模型组显著下降(P=0.045和0.037,P<0.05),它们的差异各具有显著统计学意义;低剂量组和中剂量组与模型组间均不存在统计学差异(P>0.05);7天时,落花生低、中剂量组均显著高于依达拉奉组(P=0.003和0.002,P<0.01);落花生高剂量组与依达拉奉组不存在统计学差异;模型组造模成功后3小时与7天的Bederson评分比较统计学不存在差异(P=0.081,P>0.05)。表明:治疗7天后模型组神经功能缺损体征改善不明显,而落花生高剂量组和依达拉奉组则有明显改善。
5.大鼠脑组织SOD生化检测
5.1材料
各组动物取材海马组织后放入-80度冰箱备用。
5.2方法
(1)样本前处理:
将组织样品按重量(g):体积(ml)=1:20的比例加入匀浆介质,匀浆介质采用100mM磷酸缓冲液,冰水浴条件下用研磨仪匀浆,1000g离心10分钟,稀释一定倍数,取上清液进行检测
(2)具体操作步骤
表3
(3)测定结果计算
SOD抑制率(%)=((A对照-A对照空白)-(A测定-A测定空白))/(A对照-A对照空白)*100%
SOD活力=SOD抑制率/50%*反应体系稀释倍数/待测样本蛋白浓度
浓度单位:(U/mgprot)
5.3结果
表4给药大鼠脑组织SOD生化检测
*P<0.05VS对照组,**P<0.01VS对照组,##P<0.01VS模型组
由图3可见,假手术组和对照组显著高于模型组(P=0.002和0.003,P<0.01);假手术组和和对照组间不存在差异。落花生中、高剂量组、依达拉奉组和模型组间均存在统计学差异(P=0.004、P=0.003、P=0.003,P<0.01);落花生小剂量组的SOD活性显著低于落花生中、高剂量组和依达拉奉组(P=0.035,P=0.002,P=0.001,P<0.01);落花生中剂量组低于高剂量组和依达拉奉组(P=0.042,P=0.043,P<0.05);落花生高剂量组与依达拉奉组间不存在差异(P=0.027,P>0.05)。
6.大鼠脑组织ROS含量检测
6.1材料
各组动物取材海马组织后放入-80度冰箱备用。
6.2方法
(1)样本前处理:
将组织样品按重量(g):体积(ml)=1:20的比例加入匀浆介质,匀浆介质采用100mM磷酸缓冲液,冰水浴条件下用研磨仪匀浆,1000g离心10分钟,稀释一定倍数,取上清液进行检测;取部分上清用于蛋白的测定(蛋白定量试剂盒使用A045-2考马斯亮蓝法蛋白定量试剂盒、A045-3BCA法蛋白定量试剂盒)
(2)加入荧光探针:
1mmol/L DCFH-DA工作液的配制:按10mM DCFH-DA:PBS=1:9的比例进行配制,现用现配
表5
(3)测定结果以荧光强度/毫克蛋白表示。
6.3结果
表6给药大鼠脑组织ROS含量检测
*P<0.05VS对照组,**P<0.01VS对照组,##P<0.01VS模型组
由图4可知,模型组的ROS含量均明显高于其他组(P<0.01,落花生小和中剂量组除外),落花生小剂量组的ROS含量均明显高于其他组(P<0.01,模型和落花生中剂量组组除外),对照组和假手术组的ROS含量均明显低于其他组,落花生中剂量组的ROS含量均明显高于落花生提取液大剂量组和依达拉奉组(P=0.047和0.036,P<0.05);落花生大剂量组和依达拉奉组之间差异不明显(P=0.071,P>0.05);说明落花生大剂量组和依达拉治疗组在抗氧化作用上优于落花生小、中剂量组。
7.大鼠脑组织TNF-a含量检测
7.1材料
各组动物取材海马组织后放入-80度冰箱备用。
7.2方法
(1)样本前处理:将组织样品按重量(g):体积(ml)=1:20的比例加入匀浆介质,匀浆介质采用100mM磷酸缓冲液,冰水浴条件下用研磨仪匀浆,1000g离心10分钟,稀释一定倍数,取上清液进行检测;参考试剂盒说明书配置所需溶液,并配置标准品梯度:在空白孔,标准孔和样品孔分别加入50μl样本稀释液,然后在空白孔,标准孔和样品孔分别加入50μl样本稀释液,标准品和样本每孔加入50μl Biotin-Conjugate。
(2)室温200rpm孵育2h。
(3)用洗液4次。
(4)每孔加入100μlStreptavidin-HRP
(5)室温200rpm孵育1h。
(6)用洗液4次。
(7)每孔加入100μlTMB Substrate Solution
(8)避光室温200rpm孵育10min。
(9)每孔加入100μl终止液
(10)在450nm处测吸光值。
7.3结果
表7给药大鼠脑组织TNF-a含量检测
*P<0.05VS对照组,**P<0.01VS对照组,##P<0.01VS模型组
由图5可见,模型组的TNF-a含量均明显高于其他组(P<0.01,落花生小和中剂量组除外),落花生小剂量组的TNF-a含量均明显高于其他组(P<0.01,模型和落花生中剂量组组除外),对照组和假手术组的TNF-a含量均明显低于其他组,落花生中剂量组的TNF-a含量均明显高于落花生大剂量组和依达拉奉组(P=0.033和0.029,P<0.05);落花生大剂量组和依达拉奉组之间差异不明显(P=0.085,P>0.05);说明落花生大剂量组和依达拉奉治疗组在抗炎方面疗效优于落花生小和中剂量组。
8.大鼠脑组织各基因Real time PCR检测
8.1实验试剂:
8.2实验方法
1.Total RNA的提取和鉴定
1)取适量组织样品加入Trizol,组织匀浆机匀浆3min;12,000g 4℃离心15min,取上清。
2)加入1/5体积氯仿,剧烈振荡15s,待溶液充分乳化无分相现象,室温静置5min;
3)12,000g 4℃离心15min;
4)小心取出离心管,吸取上清液转移至另一RNase free EP管中;
5)加入等体积的异丙醇,上下颠倒充分混匀后,室温静置10min;
6)12,000g 4℃离心10min,弃去上清;
7)75%乙醇l mL洗涤,12,000g 4℃离心5min,小心弃去乙醇;
8)室温干燥2-3min,加入20μL灭菌DEPC水溶解沉淀,用手指尖轻弹EP管底部至完全溶解。
9)测定RNA样品浓度。OD260/OD280=1.91,提取的RNA纯度高,无蛋白质和DNA的残余。
2.cDNA合成
1)0.2mL RNase free EP管中配制混合液,冰上操作。
2)反转录反应
表8反转录反应体系
3)37℃15min,85℃5sec。得到的cDNA加入10μL ddH2O稀释备用。可直接用于2nd-Strand cDNA的合成或PCR扩增,-20℃保存。PCR扩增时cDNA的推荐最大使用量为1μL。
3.定量PCR反应
1)设计的引物序列及分析条件如下:
表9引物信息
2)在PCR管中配制PCR反应混合液,冰上操作。
表10 real-time PCR反应体系
3)混匀,每个样品做3个重复对照。
4)设定PCR程序
Stage 1:预变性
Reps:1
95℃30s;
Stage 2:PCR反应
Reps:40
95℃5s
60℃30~40s;
Stage 3:
95℃15s
60℃1m
95℃15s;
Cycle 40
5)上机扩增检测,利用2–ΔΔCt计算相对表达量。
8.3实验结果
表11给药大鼠脑组织各基因Real time PCR检测
*P<0.05VS对照组,**P<0.01VS对照组
表12 P值:模型组VS治疗组
表13 P值:花生枝叶水煎液高剂量组VS依达
拉奉组
如图6所示:cleaved caspase3、PTEN和bax在正常组和假手术组的表达量显著低于其他组,另外模型组的cleaved caspase3、PTEN和bax的表达量显著高于其他组。随着落花生药物浓度增加cleaved caspase3、PTEN和bax的表达量依次降低,且落花生高剂量组和阳性药物组(依达拉奉)疗效最优。
- 还没有人留言评论。精彩留言会获得点赞!