一种脾脏源转移因子的制备方法与流程
本发明属于兽药领域,具体涉及一种脾脏源转移因子的制备方法。
背景技术:
转移因子 ( Transfer factor, TF)作为一种新型免疫激发剂,是T淋巴细胞释放的一种能够转移致敏信息的物质,它能够特异、高效地将供体的细胞免疫信息转移给受体,从而增强受体的免疫功能。从免疫学上,TF可分为特异性转移因子和非特异性转移因子两大类。
目前研究发现TF转移因子的功能与作用机理分别为:①增强细胞免疫功能;②增强体液免疫;③增强非特异性免疫;④抗免疫抑制功能;⑤进机体的生长发育。
脾脏TF以其富含多种氨基酸,无抗原性,无毒副作用,成为了一种安全的新型抗病毒生物制剂,广泛用于人与动物的病毒性疾病、细菌性疾病、真菌性疾病、寄生虫性疾病等疾病防治。尤其是特异性脾脏TF对目前用抗菌药物、抗病毒药物、疫苗等无法有效控制的病毒性疾病具有独特的疗效,其在兽医临床的应用具有广阔前景。转移因子存在于脾脏的淋巴细胞中,现有技术的转移因子制备方法普遍是将动物脾脏进行绞碎、破坏细胞结构使胞内转移因子释放到浆液中,再将浆液中的转移因子进行分离精制最终得到转移因子产品。反复冻融法和透析法是目前制取TF过程中使用较为普遍的方法,反复冻融法是指对动物脾脏进行-30℃低温冷冻再解冻的过程。透析法是指动物脾脏匀浆液的离心上清液进行若干次透析,实现对转移因子的分离纯化,上述两类方法操作简单,但生产周期长,操作费用高,劳动强度大,机械度较弱,且TF提取率不高,难以进行工业化规模和批量地生产,因此有必要开发一种脾脏源转移因子(TF)的制备新方法。
技术实现要素:
为解决现有转移因子制备方法存在的生产周期长、提取率不高问题,本发明的目的旨在提供一种脾脏源转移因子的制备方法,该方法能显著缩短制备时间和提高TF提取率。
为实现上述目的,本发明采取的技术方案如下:
一种脾脏源转移因子的制备方法,步骤如下:
S1、前处理:筛选检疫合格的动物脾脏,然后去杂、清洗、消毒,沥干备用;
S2、绞肉匀浆:
(a)绞肉:对前处理后的脾脏进行绞碎处理,要求绞碎后的脾脏颗粒物的颗粒度达0.5~1.0cm;
(b)匀浆:向绞碎后的脾脏颗粒物中,加入金刚砂、TritonX-100和浓度70~80%的柠檬酸水溶液进行匀浆,得脾脏匀浆液,且每100g脾脏颗粒物添加3~5 g的金刚砂、0.1~0.5 mL的TritonX-100 和4~6 mL的柠檬酸水溶液;其中,柠檬酸水溶液的“%”浓度是指柠檬酸与水以g/mL计量的质量/体积百分比浓度;
S3、酸化:调脾脏匀浆液pH值至3.0~3.5,得脾脏匀浆酸化液;
S4、冷冻、破碎解冻:
(a)、采用液氮冷冻处理脾脏匀浆酸化液,得脾脏匀浆酸化液冰块;
(b)、将脾脏匀浆酸化液冰块打碎,然后再进行解冻作业,解冻温度为30~37℃,作业时间为0.5~1h;
(c)、收集解冻脾脏液,再按S4(a)~(b)重复1~2次;
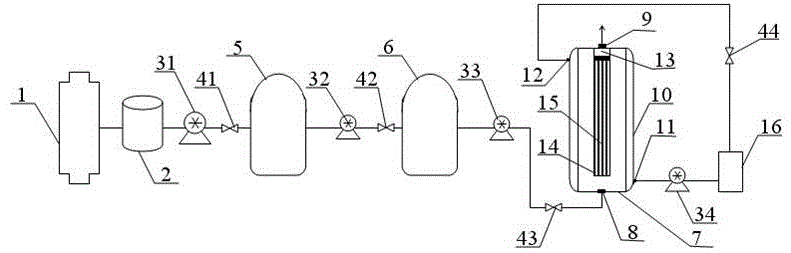
S5、离心纯化:利用自制离心纯化系统进行离心纯化,该离心纯化系统包括管式离心机、离心液储罐、动力传输组件I、动力传输组件II、动力传输组件III、一级过滤器、二级过滤器、三级过滤器及其外界附属系统;动力传输组件I由动力泵I和止回阀I串连而成;动力传输组件II由动力泵II和止回阀II串连而成;动力传输组件III由动力泵III和止回阀III串连而成;一级过滤器和二级过滤器为常规筒式过滤器;三级过滤器为自制过滤器,其结构包括筒体、中空纤维束组件、基座;筒体底部和顶部分别设有进液口和出液口,筒体外部设有夹层,夹层的上下两端分别设有夹层进口和夹层出口;中空纤维束组件包括均布有多孔的组件外壳、若干条中空纤维,这些中空纤维合并成束置于组件外壳内部;基座为圆柱体,圆柱体上段为中空呈筒状、中下段实心,基座的中下段实心上设有与中空纤维数量及其尺寸相适配的通孔;基座位于出液口下方、紧贴筒体顶壁并与其固定连接;中空纤维的上端敞口并穿设在基座的通孔内,下端封闭并与组件外壳底壁固定连接;三级过滤器的外界附属系统包括动力泵IV、止回阀IV、恒温制冷水箱,夹层出口依次串连止回阀IV、恒温制冷水箱和动力泵IV至夹层进口形成一封闭循环系统;管式离心机通过管路依次串连离心液储罐、动力泵I、止回阀I、一级过滤器、动力泵II、止回阀II、二级过滤器、动力泵III、止回阀III至三级过滤器的进液口;一级过滤器和和二级过滤器的滤芯孔径分别为4.5~5μm、0.2~0.22μm;中空纤维的截留分子量为5000~6000道尔顿;
离心纯化步骤为:
(a)首先将S4获得的脾脏匀浆解冻液输入管式离心机内腔中,启动该设备进行离心工作,离心转速达4000~6000rpm/min,离心20~30min;离心结束后及时将获取的离心清液转入至离心液储罐内,且该罐内温度控制范围为5~10℃;
(b)启动动力泵I将上工序获得的冷却离心液经管路过止回阀I输送至一级过滤器内,输入压力0.2 ~0.6 Mpa,实现第一次粗过滤;
(c)启动动力泵II将经一级过滤器后获得的一级过滤液经管路过止回阀II输送至二级过滤器内,输入压力0.2 ~0.6 Mpa,实现第二次粗过滤;
(d)启动动力泵IV,将恒温制冷水箱内所制得的温度为5~15℃的凉水经管路从夹层进口进入夹层内,并由夹层出口经管路过止回阀IV再循环至恒温制冷水箱内;待筒体内腔温度达到5~15℃时再启动动力泵III将经二级过滤器后获得的二级过滤液经管路过止回阀III由进液口输送至三级过滤器内,输入压力0.2~0.6 MPa,二级过滤液先从组件外壳上的多孔进入组件外壳内部,由于中空纤维的截留作用,二级过滤液中的杂质被挡在中空纤维的外面,而含转移因子的二级过滤液则通过中空纤维并从中空纤维顶口进入基座,然后从出液口出来,即得含转移因子的原液;
S6、干燥得成品:将S5所得含转移因子的原液经真空冷冻干燥或喷雾干燥,即得成品。
具体地,S1的过程为:筛选检疫合格的动物脾脏,要求脾脏新鲜、无淤血、无病变和无不良气味;然后在工作环境10万级的条件下去除脾脏的脂肪和结缔组织,同时保证脾脏完整性;再洗净脾脏渗出的血水,沥干水分;最后将脾脏浸入体积百分比浓度0.3~0.6%的甲酚水溶液中进行消毒处理,时间为20~30min,沥干备用。
具体地,S2是将S1消毒沥干的脾脏分别进行绞肉和匀浆处理,操作环境均在洁净度万级的洁净房间中进行,其过程为:
(a)绞肉:将消毒沥干的脾脏装入绞肉机机腔内,启动工作电源进行脾脏绞碎作业,工作速率为100~150kg/h,绞碎后脾脏颗粒物的颗粒度达0.5~1.0cm,绞碎后的脾脏颗粒物一并暂存在消过毒的塑料容器内待用;
(b)匀浆:将上步获得的脾脏颗粒物投入至同房间的高速匀浆机的腔体内,再向高速匀浆机的腔体内加入金刚砂、TritonX-100和浓度70~80%的柠檬酸水溶液,每100g脾脏颗粒物添加3~5 g的金刚砂、0.1~0.5 mL的TritonX-100 和4~6 mL的柠檬酸水溶液,启动工作电源进行脾脏匀浆作业,匀浆刀片转速为9000~15000rpm/min,匀浆温度控制在32℃以下,时间为20~30min;其中,该工序中柠檬酸水溶液的“%”浓度是指柠檬酸与水以g/mL计量的质量/体积百分比浓度。
具体地,S3的过程为:将脾脏匀浆液pH值调至3.0~3.5,该步骤中所使用的酸化剂为浓度15%的盐酸水溶液和浓度10%的柠檬酸水溶液按体积比2:1~4:1混合的混合液;酸化中酸化剂采用恒流泵添加至脾脏匀浆液中,同时匀速搅拌,酸化剂流加速率和搅拌速率分别为10~20 mL/min、600~800 rpm/min;其中,该工序中盐酸水溶液的“%”浓度是指质量百分比浓度,与柠檬酸水溶液的“%”浓度是指柠檬酸与水以g/mL计量的质量/体积百分比浓度。
具体地,S4的过程为:
(a)、将脾脏匀浆酸化液分装至容器内再转至液氮罐罐体腔内,处理时间10~20min;
(b)、将液氮冷冻后形成的脾脏匀浆酸化液冰块投料至碎冰机内将冰块打碎至直径为0.8~1.5cm的颗粒;然后再将获取的颗粒冷冻物投料至连续式微波解冻机的机腔内进行解冻作业,解冻温度为30~37℃,作业时间为0.5~1h;
(c)、收集解冻脾脏液,再按S4(a)~(b)重复1~2次。
进一步地,S5还包括步骤(e)反清洗:待过滤工作结束时,可进行该统的反向清洗作业,手动180°整体调整动力传输组件I、动力传输组件II、动力传输组件III的方向即原先的进口变为出口,再连接相应的管路,同时启动上述动力泵I、动力泵II、动力泵III,将清洁的纯化水经筒体出液口进入筒体内,则清洗水最终从离心液储罐排出,作业中各过滤器压力表指针不得高于0.3 MPa,重复2~3次即可。
较好地,离心液储罐与动力泵I之间、止回阀I与一级过滤器之间、一级过滤器与动力泵II之间、止回阀II与二级过滤器之间、二级过滤器与动力泵III之间、止回阀III与三级过滤器之间的管路采取活动连接方式。
进一步地,所述活动连接方式为卡箍连接。
较好地,管式离心机为GF-分离型。
脾脏源转移因子(TF)是从正常健康的动物脾脏分离提取获得,所述动物涉及为猪、牛、鸡和鸭等。
有益效果:本发明采取液氮和微波解冻的反复冻融法,较传统反复冻融(-30℃冷冻,37℃融化)能显著缩短脾脏源转移因子TF的制备提取时间,加入的金刚砂、TritonX-100和柠檬酸水溶液能显著提高转移因子(TF)的提取率,具有工艺简单、机械化程度较高,易便于规模流程标准化操作使用、可连续化操作、显著提高脾脏转移因子(TF)过滤效率,降低劳动强度和过滤纯化极易反向清洗的特点,该发明的脾脏源转移因子(TF)的制备方法适于产业化脾脏转移因子(TF)的工艺生产应用,具有突出的推广前景。
附图说明
图1:本发明中自制离心纯化系统的结构示意图;
图2:本发明中自制离心纯化系统处于反清洗工作状态时的结构示意图;
附图标记说明:1-管式离心机,2-离心液储罐,31-动力泵I,41-止回阀I,32-动力泵II,42-止回阀II,33-动力泵III,43-止回阀III、34-动力泵IV,44-止回阀IV,5-一级过滤器,6-二级过滤器,7-筒体,8-进液口,9-出液口,10-夹层,11-夹层进口,12-夹层出口,13-基座,14-组件外壳,15-中空纤维,16-恒温制冷水箱。
具体实施方式
下面结合附图和具体实施方式对本发明的内容作进一步详细说明。
实施例1
一种猪脾脏源转移因子的制备方法,步骤如下:
S1、前处理:筛选检疫合格的猪脾脏,要求脾脏新鲜、无淤血、无病变和无不良气味;然后在工作环境10万级的条件下去除脾脏的脂肪和结缔组织,同时保证脾脏完整性;再洗净脾脏渗出的血水,沥干水分;最后将脾脏浸入体积百分比浓度0.5%的甲酚水溶液中进行消毒处理,时间为25min,沥干备用;
S2、绞肉匀浆:S2是将S1消毒沥干的脾脏分别进行绞肉和匀浆处理,操作环境均在洁净度万级的洁净房间中进行,其过程为:
(a)绞肉:将消毒沥干的脾脏装入绞肉机机腔内,启动工作电源进行脾脏绞碎作业,工作速率为120kg/h,绞碎后脾脏颗粒物的颗粒度达0.8cm,绞碎后的脾脏颗粒物一并暂存在消过毒的硬质塑料容器内待用;
(b)匀浆:将上步获得的脾脏颗粒物投入至同房间的高速匀浆机的腔体内,再向高速匀浆机的腔体内加入金刚砂、TritonX-100和浓度75%的柠檬酸水溶液,每100g脾脏颗粒物添加4 g的金刚砂、0.3 mL的TritonX-100 和5 mL的柠檬酸水溶液,启动工作电源进行脾脏匀浆作业,匀浆刀片转速为13000rpm/min,匀浆温度控制在32℃以下,时间为25min;其中,该工序中柠檬酸水溶液的“%”浓度是指柠檬酸与水以g/mL计量的质量/体积百分比浓度;
S3、酸化:将脾脏匀浆液pH值调至3.0,该步骤中所使用的酸化剂为浓度15%的盐酸水溶液和浓度10%的柠檬酸水溶液按体积比3:1混合的混合液;酸化中酸化剂采用恒流泵添加至脾脏匀浆液中,同时匀速搅拌,酸化剂流加速率和搅拌速率分别为15 mL/min、700 rpm/min;其中,该工序中盐酸水溶液的“%”浓度是指质量百分比浓度,与柠檬酸水溶液的“%”浓度是指柠檬酸与水以g/mL计量的质量/体积百分比浓度;
S4、冷冻、破碎解冻:
(a)、将脾脏匀浆酸化液分装至容器内再转至液氮罐罐体腔内,处理时间20min;
(b)、将液氮冷冻后形成的脾脏匀浆酸化液冰块投料至碎冰机内将冰块打碎至直径为1.0cm的颗粒;然后再将获取的颗粒冷冻物投料至连续式微波解冻机的机腔内进行解冻作业,解冻温度为35℃,作业时间为0.5h;
(c)、收集解冻脾脏液,再按S4(a)~(b)重复1次;
S5、离心纯化:利用自制离心纯化系统进行离心纯化,如图1所示,该离心纯化系统包括GF-分离型管式离心机1、离心液储罐2(罐内温度控制范围为5~10℃)、动力传输组件I、动力传输组件II、动力传输组件III、一级过滤器5、二级过滤器6、三级过滤器及其外界附属系统;
动力传输组件I由动力泵I 31和止回阀I 41串连而成;动力传输组件II由动力泵II 32和止回阀II 42串连而成;动力传输组件III由动力泵III 33和止回阀III 43串连而成;
一级过滤器5和二级过滤器6为常规筒式过滤器;三级过滤器为自制过滤器,其结构包括筒体7、中空纤维束组件、基座13;筒体7底部和顶部分别设有进液口8和出液口9,筒体7外部设有夹层10,夹层10的上下两端分别设有夹层进口11和夹层出口12;中空纤维束组件包括均布有多孔的组件外壳14、数量600条、截留分子量为5000道尔顿的中空纤维15,这些中空纤维15合并成束置于组件外壳14内部;基座13为圆柱体,圆柱体上段为中空呈筒状、中下段实心,基座13的中下段实心上设有与中空纤维15数量及其尺寸相适配的通孔;基座13位于出液口9下方、紧贴筒体7顶壁并与其固定连接;中空纤维15的上端敞口并穿设在基座13的通孔内,下端封闭并与组件外壳14底壁固定连接;
三级过滤器的外界附属系统包括动力泵IV 34、止回阀IV 44、恒温制冷水箱16,夹层出口12依次串连止回阀IV 44、恒温制冷水箱16(可控温范围为:5~15℃)和动力泵IV 34至夹层进口11形成一封闭循环系统;
管式离心机1通过管道依次串连离心液储罐2、动力泵I 31、止回阀I 41、一级过滤器5、动力泵II 32、止回阀II 42、二级过滤器6、动力泵III 33、止回阀III 43至三级过滤器的进液口8;其中,离心液储罐2与动力泵I 31之间、止回阀I 41与一级过滤器5之间、一级过滤器5与动力泵II 32之间、止回阀II 42与二级过滤器6之间、二级过滤器6与动力泵III 33之间、止回阀III 43与三级过滤器之间的管道采取卡箍连接;
前述一级过滤器5和二级过滤器6通过市购获得,一级过滤器5和二级过滤器6的滤芯均为折叠式滤芯,一级过滤器5和和二级过滤器6的滤芯个数分别为5个和7个,一级过滤器5和二级过滤器6的滤芯孔径分别为5μm、0.22μm;一级过滤器5和二级过滤器6的滤芯材质为聚丙烯,滤芯骨架(支撑架)为硬质塑料,滤芯可耐压力为0.4 MPa;
离心纯化步骤为:
(a)首先将S4获得的脾脏匀浆解冻液输入管式离心机1内腔中,启动该设备进行离心工作,离心转速达5000rpm/min,离心30min;离心结束后及时将获取的离心清液转入至离心液储罐2内,且该罐内温度控制范围为10℃;
(b)启动动力泵I 31将上工序获得的冷却离心液经管道过止回阀I 41输送至一级过滤器5内,输入压力0.2 Mpa,实现第一次粗过滤;
(c)启动动力泵II 32将经一级过滤器5后获得的一级过滤液经管道过止回阀II 42输送至二级过滤器6内,输入压力0.2 Mpa,实现第二次粗过滤;
(d)启动动力泵IV 34,将恒温制冷水箱16内所制得的温度为5℃的凉水经管道从夹层进口11进入夹层10内,并由夹层出口12经管道过止回阀IV 44再循环至恒温制冷水箱16内;待筒体7内腔温度达到5℃时再启动动力泵III 33将经二级过滤器6后获得的二级过滤液经管道过止回阀III 43由进液口8输送至三级过滤器内,输入压力0.2 Mpa,二级过滤液先从组件外壳14上的多孔进入组件外壳14内部,由于中空纤维15的截留作用,二级过滤液中的杂质被挡在中空纤维15的外面,而含转移因子的二级过滤液则通过中空纤维15并从中空纤维15顶口进入基座13,然后从出液口9出来,此时即得含转移因子的原液;
(e)装置反清洗:待过滤工作结束时,可进行该系列装置的反向清洗作业,即首先拆卸离心液储罐2与动力泵I 31之间、止回阀I 41与一级过滤器5之间、一级过滤器5与动力泵II 32之间、止回阀II 42与二级过滤器6之间、二级过滤器6与动力泵III 33之间、止回阀III 43与三级过滤器之间的管道上的卡箍,手动180°整体调整动力传输组件I、动力传输组件II、动力传输组件III的方向(原先的进口变为出口),再通过卡箍连接相应的管道,调整后的状态如图2所示,同时启动上述动力泵I 31、动力泵II 32、动力泵III 33,将清洁的纯化水经筒体7出液口9进入筒体7内,则清洗水最终从离心液储罐2排出,作业中各过滤器压力表指针不得高于0.3 MPa,重复2次即可;
S6、干燥得成品:将S5所得含转移因子的原液经喷雾干燥,即得成品--转移因子干粉。
S1-S6整个生产周期为12h。传统方法生产周期一般却需要2~3d,相比较而言,本发明方法显著缩短了制备周期。
对所得转移因子(TF)干粉进行检测,TF干粉检测方法具体如下:
【性状】
本品为浅黄色疏松块状物或粉末。
【鉴别】
(一)取本品20mg,加1ml水溶解,加茚三酮试液数滴,加热,溶液应显蓝紫色。
(二)取本品10-15mg,加1ml水溶解,照紫外-分光光度法测定。在261±3nm(牛脾脏)或251±3nm(猪脾脏)的波长处有最大吸收。
【检查】 pH值 取本品,加适量水制成每1ml 中含1mg 的溶液,依法检查(中国药典2010年版二部附录Ⅵ H),pH 值应为5.0-7.5。
溶液的澄清度 本品,加适量水制成每1ml 中含2mg 的溶液,溶液应澄清;如显混浊,与1号浊度标准液(中国药典2010年版二部附录Ⅸ B)比较,均不得更浓。
蛋白质 取本品4mg,加2ml水溶解,加20 %(g/ml)磺基水杨酸溶液1ml,混匀,溶液应澄清,不得发生混浊或沉淀。
水分 取本品适量,照水分测定法(中国药典2010年版二部附录Ⅷ M第一法)测定,含水分不得超过6.0%
重金属 重金属含量不得过20ppm。
细菌 大肠埃希菌和沙门氏菌不得检出,总细菌数不得过 300CFU/g。
活性测定 取本品适量,照T细胞活性测定法-脱E受体法测定,供试品管的E玫瑰花结百分率与对照管的E玫瑰花结百分率之差应不得低于10.0%。
【含量测定】
多肽 取本品10mg ,加2ml水制成混合溶液,作为供试品溶液,精密量取1.0ml,照福林酚测定法测定多肽含量。
核糖
对照品溶液的制备 精密称取D-核糖对照品适量,用5%(g/ml,下同)三氯醋酸溶液溶解并制成每1ml中含20ug的溶液,摇匀。
供试品溶液的制备 取本品适量,用5%三氯醋酸溶液溶解并制成每1ml中含核糖5ug的溶液,作为供试品溶液。
标准曲线的制备 精密量取对照品溶液0.0ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml分别置具塞试管中,各加入5%三氯醋酸溶液适量至2.0ml,各加入1% 3,5-二羟甲基苯溶液【取3,5-二羟甲基苯1g,加0.1%三氯化铁-盐酸溶液(取三氯化铁0.5g,加浓盐酸溶解使成500ml,可长期使用)100ml中使溶解,临用新配】2.0ml,摇匀,置沸水浴中准确加热30min,迅速冷却至室温,以0号管为空白,照分光光度法(中国药典2010年版二部附录IV A)。在650nm的波长处测定吸光度,以浓度为横坐标,吸收度为纵坐标绘制标准曲线并进行线性回归,其相关系数应大于0.995。
测定法 精密量取供试品溶液2.0ml,照标准曲线的制备方法,自“各加入1% 3,5-二羟甲基苯溶液2.0ml”起,依法测定。从回归方程中求出核糖含量。
检测结果如表1。
对照例1--不同添加量的金刚砂、TritonX-100和柠檬酸水溶液对TF转移因子提取率的影响
与实施例1的不同之处在于:调整金刚砂、TritonX-100和浓度75%的柠檬酸水溶液的添加量如表2所示;其他步骤及工艺参数同实施例1。
不同添加量的金刚砂、TritonX-100和柠檬酸水溶液的TF提取率对照结果见表2,可知:实施例1、对照例1的2#~5#均高于对照例1的1#的TF提取率,即“添加金刚砂、TritonX-100和柠檬酸水溶液”均高于“不添加金刚砂、TritonX-100和柠檬酸水溶液的TF提取率”,同时实施例1、对照例1的2#、3#的TF提取率高于对照例1的4#、5#的TF提取率,表明金刚砂、TritonX-100、柠檬酸水溶液在本发明的添加量范围内能起到更好地协同作用,促进细胞膜更好地裂解,提高TF的提取率。
最后应说明的是:以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!