西北沼委陵菜抗HIV‑1病毒有效部位及制法和应用的制作方法
西北沼委陵菜抗HIV-1病毒有效部位及制法和应用,属于植物提取物技术领域。
背景技术:
西北沼委陵菜(Comarum salesovianum (Stepn.) Asch. et Gr.)为蔷薇科(Rosaceae)沼委陵菜属(Comarum palustre L.)多年生亚灌木植物[参见:中国科学院中国植物志编辑委员会.中国高等植物[M].北京:科学出版社,2003(6).],是传统药用植物。其主要生于海拔2800-4250米的山坡林缘、林下及河谷湿草地。分布在我国西南、西北、华北至东北。北温带广布,北美洲、欧洲至日本、小亚细亚至喜马拉雅等地也有[参见:GBIF (Global Biodiversity Information Facility). Comarum salesovianum (Stephan) Asch. & Graebn, 2015. www.gbif.org/ species/3020536.]。蒙古科学院发现其具有明显抗炎活性[参见:Odontuya G, Banzragchgarav O, Murata T, et al. Antibacterially active phenolic lipid derivatives from Comarum salesovianum (Steph.) Aschers. et Gr.[J]. Phytochemistry Letters, 2015, 13: 360-364.];一项日本专利表明其具有葡萄球菌抑制效果,可以预防痤疮和过敏性皮肤炎[参见:Y. Nobuo, S. Hiroyuki. JPO, 2011,JP 2011001329-A .]。
艾滋病即获得性免疫缺陷综合症(又译:后天性免疫缺陷症候群)。如今艾滋病己在全球范围内成为严重危害人类生存与发展的公共卫生和社会问题。我国艾滋病的流行经过传入期、扩散期,目前己进入快速增长期,处于全国低流行和局部地区及特定人群高流行并存的态势。艾滋病是一种危害性极大的传染病,由感染艾滋病病毒(HIV病毒)引起。HIV是一种能攻击人体免疫系统的病毒,即“人类免疫缺陷病毒”,它侵入人体后破坏人体的免疫系统,使人体发生多种难以治愈的感染和肿瘤,最终导致死亡,现已证实HIV分为两型:HIV-1型和HIV-2型。HIV-1型为逆转录病毒科慢病毒属,其病毒RNA基因组必须经先行由单链RNA逆转录为cDNA,形成RNA-DNA杂合体后,水解掉与DNA互补的RNA,再以单链的cDNA为模板合成双链DNA,从而可以整合人宿主DNA基因组当中,此过程由逆转录酶(RT酶)催化。RT酶功能多样,它由P66和P51两个蛋白单体构成异源二聚体,其中P66是酶活性的主要功能部分;除具有逆转录酶活性外,还具有DNA聚合酶活性以及RNAse酶活性。逆转录过程的分子机制亦颇为复杂:逆转录过程的起始引物并非来自病毒自身合成,而是利用宿主细胞内的tRNALye-3,与病毒RNA的引物结合位点(PBS)相结合后,再高效启动逆转录过程。其次,逆转录酶因为缺泛3'-5'核酸外切酶活性,无法完成校读功能,复制忠实性差,是HIV病毒高变异性的重要原因之一。人类免疫缺陷病毒1型(即HIV-1型)逆转录酶 (RT)一直是重要的抗 HIV感染的靶点,用于开发治疗艾滋病的药物。蛋白酶是人类免疫缺陷病毒基因编码中的一种特异天冬酰蛋白酶,其作用是将基因和基因表达所产生的蛋白裂解,成为具有活性的病毒结构蛋白和酶,是HIV病毒复制的关键物质。HIV蛋白酶抑制剂主要作用于艾滋病病毒复制的最后阶段,由于蛋白酶被抑制,使之从感染的CD4细胞核中形成DNA不能聚集和释放,导致蛋白前体不能裂解和形成成熟病毒体。
申请人在研究中发现:目前抗艾滋病药物的原料较为匮乏。现有的抗HIV病毒药物像其他类型的抗艾滋病病毒药物一样,随着 HIV-1逆转录酶产生耐药性突变,已上市的治疗艾滋病的药物的疗效受到限制。目前,迫切需要开发新一代抗HIV-1型病毒药物。
技术实现要素:
本发明要解决的技术问题是:克服现有技术的不足,提供西北沼委陵菜抗HIV-1病毒有效部位及制法和应用,该西北沼委陵菜抗HIV-1病毒有效部位能有效抑制HIV-1 病毒活性,能够用于制备抗HIV-1 病毒药物,适用于开发成抗艾滋病新药。
本发明解决其技术问题所采用的技术方案是:该西北沼委陵菜抗HIV-1病毒有效部位,其特征在于:选自西北沼委陵菜正丁醇部位或西北沼委陵菜水相萃取部位。
该西北沼委陵菜抗HIV-1病毒有效部位的制备方法,其特征在于,包括下述步骤:将西北沼委陵菜粉碎,加入体积百分比浓度65%~95%乙醇溶液提取,将所得提取液浓缩、干燥,得浸膏;将浸膏分散在蒸馏水中得浸膏分散液,然后依次采用石油醚、乙酸乙酯和正丁醇作为溶剂萃取浸膏分散液,将所得正丁醇萃取液挥去正丁醇,得西北沼委陵菜正丁醇部位;将萃取后剩余的浸膏分散液浓缩、干燥,得西北沼委陵菜水相萃取部位。
所述的提取为超声波辅助回流提取,超声波辅助回流提取具体操作为:将粉碎后的西北沼委陵菜加入体积百分比浓度65%~95%乙醇溶液超声波提取0.5~3小时,过滤,滤渣加入体积百分比浓度65%~95%乙醇溶液回流提取2~3次,合并提取液,浓缩干燥,得浸膏。将浸膏分散在蒸馏水中得浸膏分散液,然后依次采用石油醚、乙酸乙酯和正丁醇作为溶剂萃取浸膏分散液,将所得正丁醇萃取液挥去正丁醇,得西北沼委陵菜正丁醇部位;萃取后剩余的浸膏分散液浓缩、干燥,得西北沼委陵菜水相萃取部位。
该西北沼委陵菜抗HIV-1病毒有效部位的应用,其特征在于:在制备抗HIV-1 病毒药物中的应用。
所述抗HIV-1 病毒药物是通过:将西北沼委陵菜正丁醇部位或西北沼委陵菜水相萃取部位,与药用辅料混合后,制成的口服制剂或注射制剂。
所述的注射制剂为脂质体注射剂、纳米粒注射剂或微球注射剂。
所述的口服制剂为散剂、片剂、颗粒剂、胶囊剂、口服溶液剂。
申请人对于本发明的说明如下:现有技术中,西北沼委陵菜常规用途为消炎抗菌,未见其有抗HIV-1病毒功效的相关报道。申请人通过大量研究发现:西北沼委陵菜中的部分提取物还具有抗HIV-1病毒的作用,但是功效不明显,不能确定其具体的有效部位。申请人通过研究发现:采用本发明制备方法,筛选出的西北沼委陵菜石油醚部位、西北沼委陵菜乙酸乙酯部位均无明显的抑制效果。而西北沼委陵菜正丁醇部位、西北沼委陵菜水相萃取部位,均具有较好的抗HIV-1病毒的效果。
制备方法中,采用将西北沼委陵菜全草粉碎。超声波提取为常温下进行。过滤并回流提取是指:超声波提取后,过滤获得超声波提取液和滤渣,向滤渣中加质量百分比浓度65%~95%乙醇溶液回流提取,得回流提取液,合并超声波提取液和回流提取提取液。回流提取的具体操作为:向回流加热装置中加入粉碎后的药材和乙醇溶液,加热、回流提取,放冷过滤得一次提取液和滤渣;向滤渣中加入乙醇溶液,加热、进行第二次回流提取,放冷过滤得二次提取液和滤渣(以上为回流提取2次);合并多次提取液,即得回流提取提取液。优选的,每次回流提取0.5~2小时;每次回流提取时所加乙醇溶液没过药材表面1cm~2cm。回流提取的温度为乙醇回流提取的常规温度,需高于乙醇的沸点,优选为80℃~100℃。
制备方法中,浸膏为粗提取物,采用不同的溶剂萃取浸膏分散液,指的是依次将石油醚加入浸膏分散液萃取分离获得石油醚萃取液、将乙酸乙酯加入浸膏分散液萃取分离获得乙酸乙酯萃取液、将正丁醇加入浸膏分散液萃取分离获得正丁醇萃取液;取正丁醇萃取液挥发去除溶剂后,所得即为西北沼委陵菜正丁醇部位;将萃取后剩余的浸膏分散液(溶剂为水),挥发去除溶剂即得西北沼委陵菜水相萃取部位。水相萃取部位也可以称作水相萃取物,水相萃取部位易溶于水;而相对的,石油醚部位、乙酸乙酯部位和正丁醇部位分别指的是石油醚萃取物、乙酸乙酯萃取物、正丁醇萃取物,分别对应易溶于石油醚、乙酸乙酯和正丁醇。其中,西北沼委陵菜正丁醇部位的成分包含苷类和酚类化合物;西北沼委陵菜水相萃取部位的成分包含多糖和有机酸类化合物。挥去溶剂即挥发去除溶剂。挥去溶剂可以采用常压加热使溶剂(石油醚、乙酸乙酯和正丁醇)挥发。优选的,挥去溶剂采用减压浓缩,该方法效率高,并且能避免热敏性成分因高温丧失药性。
对于应用,申请人经研究发现:口服制剂和注射制剂为最佳给药途径。此处所述口服制剂为经肠胃道给药制剂,优选的,口服制剂为缓释、控释型口服制剂。胶囊剂包括软胶囊和硬胶囊。另外,该西北沼委陵菜抗HIV-1病毒有效部位的制剂也可以为其他给药途径的制剂:如呼吸道给药制剂(喷雾剂、气雾剂、粉雾剂);皮肤给药制剂(外用溶液剂、洗剂、搽剂、软膏剂、硬膏剂、糊剂、贴剂);膜给药制剂(滴眼剂、滴鼻剂、眼用软膏、含漱剂、舌下片剂);腔道给药制剂(栓剂)。注射制剂可以为常规注射制剂。根据药物传递系统进行分类,优选的,本发明的注射制剂为脂质体注射剂、纳米粒注射剂或微球注射剂;其他的,本发明的注射剂还可以为微囊注射剂、聚合物胶束注射剂、微乳注射剂、亚微乳注射剂、亚微粒注射剂或凝胶注射剂,以上药物传递系统的注射剂能延长药物载体在体内的循环时间、延长载药微粒在吸收部位的停留时间、控制药物在释放初期的突释效应。药用辅料包括药物载体,还包括溶剂、增溶剂、助溶剂、乳化剂、助悬剂、澄清剂、反絮凝剂、矫味剂、着色剂、防腐剂、化学灭菌剂、吸附剂、助滤剂、抗氧剂、pH调节剂、等渗调节剂、稀释剂、粘合剂、润湿剂、崩解剂、润滑剂、助流剂、抗粘着剂、缓释剂、控释剂、包衣材料、成膜材料、胶囊材料中的至少一种。
与现有技术相比,本发明的西北沼委陵菜抗HIV-1病毒有效部位及制法和应用所具有的有益效果是:
1、该西北沼委陵菜抗HIV-1病毒有效部位能有效抑制HIV-1 病毒活性,能够用于制备抗HIV-1 病毒药物。申请人在研究中发现:目前用于制备抗艾滋病药物的原料较为匮乏,而现有技术中仅具有消炎抗菌功效的西北沼委陵菜,还具有抑制HIV-1 病毒活性的功效,并首次在HIV-1逆转录酶和蛋白酶上进行药效筛选。申请人以抑制HIV-1病毒为活性指标进行抗HIV-1病毒药效学实验,以CCK-8法进行药物的细胞毒性实验,以对HIV-1逆转录酶和蛋白酶活性的影响为切入点进行抗HIV-1病毒活性机制研究。结果表明,西北沼委陵菜正丁醇部位、西北沼委陵菜水相萃取部位,通过结合逆转录酶蛋白及抑制HIV蛋白酶可以明显抑制HIV-1病毒,细胞毒性随给药浓度增大而增强。申请人发现西北沼委陵菜的新功效,设计制备方法,通过研究确定最佳的西北沼委陵菜抗HIV-1病毒有效部位,并制备成了多种剂型的药物,在以上过程中,是付出了大量的创造性劳动的。
2、该西北沼委陵菜抗HIV-1病毒有效部位的制备方法提取方便,是申请人经研究确定的方法。本发明制备方法中溶剂的萃取顺序是申请人经研究确定的,顺序不能颠倒替换,采用以上溶剂萃取顺序所得的西北沼委陵菜正丁醇部位、西北沼委陵菜水相萃取部位均具有较好的抗HIV-1 病毒的效果。
3、本发明拓展了抗HIV-1 病毒药物的原料渠道,扩大了西北沼委陵菜的用途,使西北沼委陵菜发展成为抗HIV-1 病毒药物的新原料,可显著提高西北沼委陵菜的附加值。
附图说明
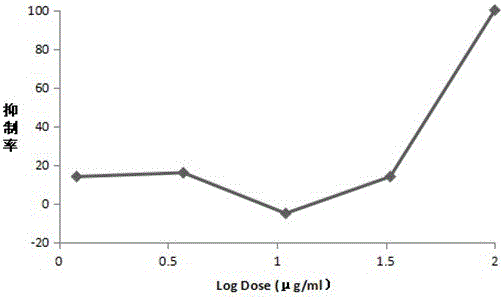
图1 P24抗原检测西北沼委陵菜正丁醇部位的抑制率。
图2 P24抗原检测西北沼委陵菜水相萃取部位的抑制率。
图3 西北沼委陵菜正丁醇部位的HIV-1假病毒单周期感染实验。
图4 西北沼委陵菜水相萃取部位的HIV-1假病毒单周期感染实验。
图5 西北沼委陵菜正丁醇部位的CCK8法细胞毒性实验。
图6 西北沼委陵菜水相萃取部位的CCK8法细胞毒性实验。
图7 西北沼委陵菜抗HIV-1病毒有效部位与逆转录酶蛋白的体外结合能力。
图8 西北沼委陵菜抗HIV-1病毒有效部位对HIV-1抑制逆转录酶活性的影响。
图9 西北沼委陵菜抗HIV-1病毒有效部位对HIV-1蛋白酶活性的影响。
具体实施方式
实施例1~3是本发明的西北沼委陵菜抗HIV-1病毒有效部位及制法的具体实施方式,其中实施例1为最佳实施例。
实施例1
制备方法,包括下述步骤:将西北沼委陵菜粉碎,采用体积百分比浓度75%~85%乙醇溶液超声波提取1~2时,过滤得超声波提取液和滤渣,滤渣加入质量百分比浓度75%~85%乙醇溶液回流提取3次,每次0.5~1小时,得回流提取液,合并声波提取液和回流提取液、浓缩干燥得浸膏;将浸膏加蒸馏水分散,得浸膏分散液,然后依次采用石油醚、乙酸乙酯和正丁醇作为溶剂萃取浸膏分散液,将所得正丁醇萃取液挥去正丁醇,得西北沼委陵菜正丁醇部位;将萃取后剩余的浸膏分散液浓缩、干燥,得西北沼委陵菜水相萃取部位。
实施例2
制备方法,包括下述步骤:将西北沼委陵菜粉碎,采用体积百分比浓度85%~95%乙醇溶液超声波提取2~3小时,过滤得超声波提取液和滤渣,滤渣加入质量百分比浓度85%~95%乙醇溶液回流提取2次,每次1.5~2小时,得回流提取液,合并声波提取液和回流提取液、浓缩干燥得浸膏;将浸膏加蒸馏水分散,得浸膏分散液,然后依次采用石油醚、乙酸乙酯和正丁醇作为溶剂萃取浸膏分散液,将所得正丁醇萃取液挥去正丁醇,得西北沼委陵菜正丁醇部位;将萃取后剩余的浸膏分散液浓缩、干燥,得西北沼委陵菜水相萃取部位。
实施例3
制备方法,包括下述步骤:将西北沼委陵菜粉碎,采用体积百分比浓度65%~75%乙醇溶液超声波提取0.5~1小时,过滤得超声波提取液和滤渣,滤渣加入质量百分比浓度75%~85%乙醇溶液回流提取3次,每次1~1.5小时,得回流提取液,合并超声波提取液和回流提取液、浓缩干燥得浸膏;将浸膏加蒸馏水分散,得浸膏分散液,然后依次采用石油醚、乙酸乙酯和正丁醇作为溶剂萃取浸膏分散液,将所得正丁醇萃取液挥去正丁醇,得西北沼委陵菜正丁醇部位;将萃取后剩余的浸膏分散液浓缩、干燥,得西北沼委陵菜水相萃取部位。
性能测试
以实施例1得到的西北沼委陵菜正丁醇部位(标号为B)和西北沼委陵菜水相萃取部位(标号为C)为受试药物,进行如下实验。
一、HIV-1 R3A野生病毒感染实验(即P24抗原检测)。
分别精密称定B、C部位各100mg于不同的离心管中,加入1mL DMSO溶解,配制100mg/mL的贮存液。实验时依次用无血清的培养基稀释至系列浓度为100µg/mL、33.3µg/mL、11.1µg/mL、3.7µg/mL、1.2 µg/mL,为不同浓度的给药组。实验设病毒对照组、细胞对照组和不同剂量给药组组。给药组于96孔板每孔中加入100µL不同浓度的受试药物溶液,每浓度设三复孔。取MT4细胞(5×105/mL)加入HIV-1 R3A病毒1×103TCID50/mL,37℃,5% CO2培养2 h,P;S洗涤3次,离心弃去上清,加入完全培养基后于96孔板每个加有药的孔中加入100µL此感染HIV-1的细胞(5×104/100µL),37℃,5% CO2培养,三天后半换液体,保持药物浓度不变,第六天收集各孔取上清,采用ELISA法测定P24抗原量,各孔取上清50µL加入到前1天已铺板的TZM-bl细胞中,37℃、CO2培养箱内培养48h。采用Promega Bright-Glo荧光素酶试剂盒检测荧光素酶含量,并计算抑制率,详见 图1~2。
二、HIV-1假病毒单周期感染实验。
分别精密称定B、C部位各100mg于不同的离心管中,加入1mL DMSO溶解,配制100mg/mL的贮存液。实验时依次用无血清的培养基稀释,B、C均为50µg/mL、16.67µg/mL、5.56µg/mL、1.85µg/mL、0.62µg/mL,为不同浓度的给药组,仅加入假病毒不加药组为病毒对照组,加入AZT(齐多夫定)组为阳性对照组。将TZM-bl细胞(Hela细胞表达CD4、CXCR4和CCR5,含Tat启动的荧光素酶和LacZ基因)接种于96孔板,37℃培养箱培养24h后,弃去上清,加入pSG3假病毒上清,病毒上清中加入DEAE(终浓度10µg/mL),同时加入不同浓度稀释的药物,培养48h后,弃去上清液,加入固定液室温固定5 min,PBS清洗后加入显色液,37℃培养箱中培养50min,PBS清洗,在显微镜下计数蓝斑数,根据抑制率公式:抑制率=[(病毒对照组-实验组)/病毒对照组] ×100%,计算得到量效曲线和半数抑制浓度(IC50)。结果表明药物对HIV-1病毒有明显的抑制作用,详见图3~4和表1。
表1 西北沼委陵菜抗HIV-1病毒有效部位的半数抑制制浓度IC50
。
三、药物在细胞水平的CCK-8细胞毒性试验。
分别精密称定B、C部位各100mg于不同的离心管中,以实施例1得到的柳兰抗HIV-1病毒有效部位为受试药物。分别精密称定B、C部位100mg于离心管中,加入1mL DMSO溶解,配制100mg/mL的贮存液。实验时依次用无血清的培养基稀释至系列浓度为250µg/mL、125µg/mL、62.5µg/mL、31.25µg/mL、15.63 µg/mL,为不同浓度的给药组。将TZM-bl细胞接种于96孔板,37℃培养箱培养24h后,加入不同浓度梯度的药物。继续培养48h后,采用CCK-8细胞增殖检测试剂(同仁化学),培养45 min,酶标仪检测 450 nm 处的吸光度值。计算提取物对正常 TZM-bl 细胞的抑制率,GraphPad Prism 5.0 软件对实验数据进行拟合,得到量效曲线和半数中毒浓度(TC50)。抑制率公式:抑制率=[(细胞对照组-实验组)/细胞对照组] ×100%,详见图5~6和表2。
表2 西北沼委陵菜抗HIV-1病毒有效部位的细胞毒性
。
四、 药物与逆转录酶蛋白体外结合实验。
采用 BIAcore 3000 生物分子相互作用仪,采用逆转录酶蛋白与CM5 芯片偶联,采用牛血清蛋白(BSA)作为阴性对照。将B、C部位用经 0.45µm 滤膜过滤的 PBS 稀释到200µg/mL,流速 20µL/min,注入量为 60µL 进样,记录样品流经靶蛋白结合期时的 RU 值与流经 BSA 蛋白结合期的 RU 值,二者之差为该样品与靶蛋白的结合响应值,详见图7和表3。
表3 西北沼委陵菜抗HIV-1病毒有效部位的体外结合RU值
。
五、药物对 HIV-1 逆转录酶活性的测定。
采用逆转录酶检测试剂盒体外检测化合物对 HIV-1 逆转录酶活性的影响。奈韦拉平(nevirapine,NVP)作为阳性药,浓度为2.5 ng/mL,B、C部位浓度为200µg/mL,实验设2个复孔。 实验在96孔板内加入含有1 ng HIV-1 RT的裂解液(20µL/孔),并与药物37℃ 孵育1 h。 将96孔板孔内的溶液转移到微孔板内,继续37℃孵育1h。弃除微孔板内的溶液,洗脱液洗5次后加入 200µL Anti - DIG - POD工作液,37℃孵育1h。弃除微孔板的溶液,洗脱液洗5次,每孔加入 200µL ABTs substrate solution,室温下孵育 30 min,使用酶标仪检测化合物在405nm处的吸光度值,计算抑制率,详见图8和表4。
表4 西北沼委陵菜抗HIV-1病毒有效部位对 HIV-1 逆转录酶活性的影响
。
六、药物对 HIV-1 蛋白酶活性的影响。
采用蛋白酶检测试剂盒体外检测药物对 HIV-1 蛋白酶活性的影响。采用Pepstatin A作为阳性对照,浓度为2×10-3mML,B、C部位浓度为200µg/mL,实验设2个复孔。 向384孔板中加入用药物(10µL/孔)和蛋白酶溶液(10µL/孔),溶剂对照组加入药物和缓冲液,阳性对照孔加入蛋白酶溶液和缓冲液,室温孵育15 min后,每孔加入10µL蛋白酶底物溶液,酶标仪中轻微震荡60s,室温下避光孵育30 min,检测340nm/490nm处吸光值,计算样品对逆转录酶的抑制率,详见图9和表5。
表5 体外检测西北沼委陵菜抗HIV-1病毒有效部位对 HIV-1蛋白酶活性的影响
。
实施例4
西北沼委陵菜有效部位的片剂制备方法:西北沼委陵菜水相萃取部位300mg和淀粉100mg混匀,加体积百分比浓度10%的淀粉糊40mg制成软材,过筛得湿颗粒,干燥得干颗粒,整粒,加硬脂酸镁4 mg混匀、压片,即得。
实施例5
冲剂的制备方法:按重量份配比将西北沼委陵菜水相萃取部位5份、蔗糖1份、糊精3份混匀,加入适量质量百分比95%乙醇溶液2~5份,边加边搅拌,制得软材,将软材干燥、过16目筛,分装即得。
实施例6
微丸胶囊由以下重量份原料组成:西北沼委陵菜正丁醇部位30份、卵磷脂5份、牛黄胆酸钠5份、微晶纤维素30份;
微丸胶囊的制备方法:按配比将西北沼委陵菜正丁醇部位、卵磷脂、牛黄胆酸钠和微晶纤维素混均,倒入乙醇水溶液搅匀获得软材,将软材倒入挤出机中挤出,经滚圆获得颗粒,挤出转速250r/min,滚圆转速800r/min,滚圆时间20min,干燥、过24~30目筛获得微丸,将微丸灌装入胶囊壳内,即得。
实施例7
脂质体注射剂的制备方法:
1)在氮气保护下,将50g胆固醇琥珀酸酯、250g二硬脂酰磷脂酰乙醇胺、40g大豆卵磷脂、50g泊洛沙姆-188、和10g西北沼委陵菜正丁醇部位溶解于1500ml体积比为1:1的乙醇和正丁醇的有机溶剂中,搅拌使其溶解获得混悬液;将混悬液通过减压浓缩挥去有机溶剂,获得磷脂膜;
2)在氮气保护下,向磷脂膜中加入8000ml pH为6.8的磷酸盐缓冲溶液,搅拌,使磷脂膜洗脱并充分溶胀水合,经0.22µm微孔滤膜过滤,得西北沼委陵菜正丁醇部位的脂质体;
3)在无菌条件下,向西北沼委陵菜正丁醇部位的脂质体中,加入100g海藻糖,搅拌均匀,超声波处理0.5~1小时,加注射用水定容,经0.22µm微孔滤膜过滤,灌装,即得西北沼委陵菜正丁醇部位的脂质体注射剂。
实施例8
纳米粒注射剂的制备方法:取25g西北沼委陵菜正丁醇部位和100g泊洛沙姆407用3000ml 无水乙醇溶解,加入30ml 1mol/L氯化锌的乙醇溶液,搅拌混合,超声波处理0.5~1小时使其溶解,获得混合液;将混合液减压浓缩挥去溶剂,放入-20℃冰箱冷冻2小时;取出加注射用水定容,超声波处理0.5~1小时,经0.22µm微孔滤膜过滤,灌装,即得西北沼委陵菜正丁醇部位的纳米粒注射剂。
以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!