一种呋喃类D-3-磷酸甘油酸脱氢酶别构抑制剂及其应用的制作方法
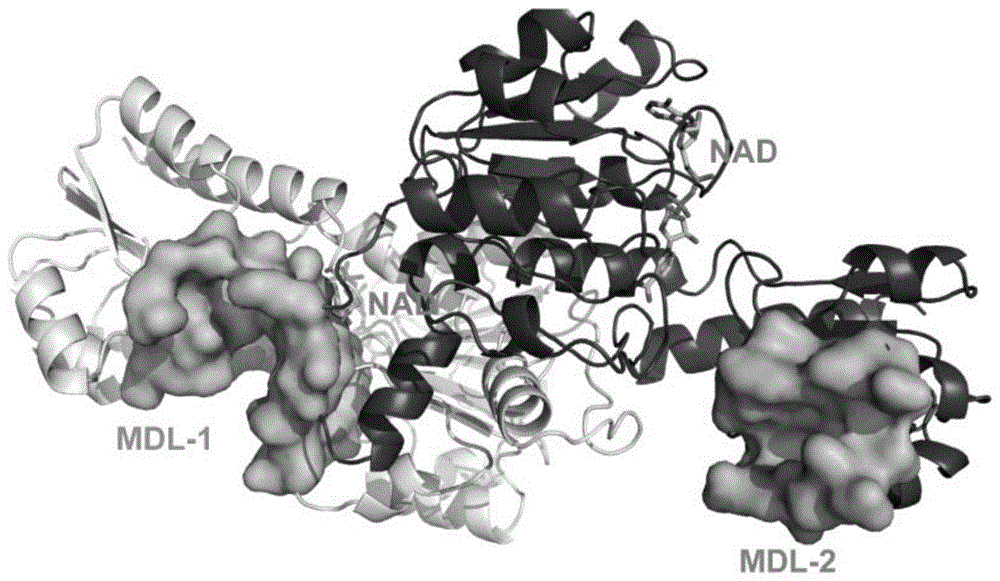
本发明涉及治疗和预防由于丝氨酸代谢紊乱导致的各种疾病的药物,特别涉及作为d-3-磷酸甘油酸脱氢酶抑制剂的呋喃类化合物,以及该化合物及其组合用药在治疗乳腺癌、结肠癌、黑色素瘤、非小细胞肺癌及其它疾病中的应用。
背景技术:
人体中的d-3-磷酸甘油酸脱氢酶(phgdh)催化丝氨酸合成第一步,是丝氨酸合成通路中的关键酶。phgdh于2011年被证实在人类40%的黑色素瘤细胞或70%的三阴性乳腺癌细胞等存在过表达的情况,进行phgdh基因的敲除实验发现,这些癌细胞在体内以及体外的生长被大幅度抑制【(1)locasale,j.w.,grassian,a.r.,melman,t.,lyssiotis,c.a.,mattaini,k.r.,bass,a.j.,heffron,g.,metallo,c.m.,muranen,t.,sharfi,h.,etal.(2011).phosphoglyceratedehydrogenasedivertsglycolyticfluxandcontributestooncogenesis.nat.genet.43,869-874.(2)possemato,r.,marks,k.m.,shaul,y.d.,pacold,m.e.,kim,d.,birsoy,k.,sethumadhavan,s.,woo,h.k.,jang,h.g.,jha,a.k.,etal.(2011).functionalgenomicsrevealthattheserinesynthesispathwayisessentialinbreastcancer.nature476,346-350.】。因此,以phgdh作为抗癌靶标进行药物设计具有广阔前景。由于phgdh活性口袋体积较小、辅基nad+在生物体内浓度高达0.3mm以及phgdh完整晶体结构至今未解出等原因,基于phgdh活性口袋的药物设计进展缓慢。新的思路是开展phgdh的别构调控,设计phgdh的抑制剂。
蛋白质中的别构调控可以描述为别构分子结合在蛋白的非活性位点而导致蛋白活性发生改变的现象。别构药物的优势在于其具有高专一性,调控靶标蛋白活性而不是完全使其丧失活性,且其只在内源配体存在的情况下发挥效应等。
有文献指出:phgdh基因的敲除与抗癌药物顺铂、阿霉素等联用可在体内及体外显著提高抗癌药物的生物活性[(3)jing,z.,heng,w.,xia,l.,ning,w.,yafei,q.,yao,z.,andshulan,z.(2015)downregulationofphosphoglyceratedehydrogenaseinhibitsproliferationandenhancescisplatinsensitivityincervicaladenocarcinomacellsbyregulatingbcl-2andcaspase-3,cancerbiol.ther.16,541-548.(4)zhang,x.,andbai,w.(2016)repressionofphosphoglyceratedehydrogenasesensitizestriple-negativebreastcancertodoxorubicin,cancerchemother.pharmacol.78,655-659.),这为开展phgdh抑制剂与抗癌药物联合使用提供了参考。迄今为止,未见phgdh抑制剂进入临床研究的报道,也未见其与抗癌药物联合使用的药物效果被报道。针对phgdh别构位点开展药物设计并将别构抑制剂用于肿瘤预防与治疗,具有新颖性和创造性。
技术实现要素:
本发明的目的是提供一种呋喃类化合物,作为phgdh的别构抑制剂。
本发明的目的还在于提供上述化合物在制备治疗和预防某些乳腺癌、结肠癌、黑色素瘤及非小细胞肺癌等疾病药物中的应用。
本发明的目的还在于提供上述化合物与其它phgdh抑制剂或抗癌药物组合用药在制备治疗和预防某些乳腺癌、结肠癌、黑色素瘤及非小细胞肺癌等疾病药物中的应用。
本发明通过对phgdh蛋白表面性质分析,发现适合小分子结合的潜在别构位点(参见图1),并针对所预测位点进行了虚拟筛选。通过体外酶活性测试、细胞活性测试以及小鼠异种移植模型实验,本发明提供的化合物被证实为phgdh抑制剂。同时,借助液相色谱-高校质谱连用技术分析检验并验证了这类化合物的专一性。
本发明提供的可以作为phgdh的别构抑制剂的化合物具有如下结构通式:
式i中,r1、r2、r3相同或不同,各自独立代表氢、卤素、硝基、羟基、氨基、羧基、烷基、烷氧基、卤素取代烷基、羧酸酯基、磺酰胺基、酰胺基或n-烷基取代酰胺基,或者其中相邻的两个取代基(r1和r2或者r2和r3)成环;r4代表烷基、卤素取代烷基、氨基、环烷基、未取代或取代芳基;x是o、n或s。
所述卤素包括f、cl、br和i。
当r1、r2和r3中的一个或多个为烷基时,优选为c1~c12烷基,更优选为c1~c6烷基,例如甲基、乙基、丙基、异丙基等;为烷氧基时,优选为c1~c8烷氧基,更优选为c1~c4烷氧基,例如甲氧基、乙氧基、丙氧基等;为卤素取代烷基时,优选为一个或多个卤素取代的c1~c12烷基,更优选为一个或多个卤素取代的c1~c6烷基,常为氟取代,例如三氟甲基。
当r1、r2和r3中的一个或多个为所述羧酸酯基时,优选为c1~c8酯氧基(-coocnh2n+1,n为1~7的整数),更优选为c1~c4酯氧基,例如甲氧酯基、乙氧酯基、异丙氧酯基等。
当r1、r2和r3中的一个或多个为所述n-烷基取代酰胺基时,优选为c1~c12烷基取代的酰胺基,更优选为c1~c6烷基取代的酰胺基,例如n-甲基酰胺基、n,n-二甲基酰胺基等。
当r1和r2或者r2和r3成环时,相邻的两个取代基联合代表1,3-丁二烯-1,4-亚基、1,4-二丁基等。
当r4为烷基时,优选为c1~c12烷基,更优选为c1~c6烷基,例如甲基、乙基、丙基、异丙基等。
当r4为卤素取代烷基时,优选为一个或多个卤素取代的c1~c12烷基,更优选为一个或多个卤素取代的c1~c6烷基,例如三氟甲基等。
当r4为环烷基时,优选为c5~c7环烷基,例如环己基。
当r4为未取代或取代芳基时,所述芳基优选为苯基,所述取代芳基优选为4-取代的苯基,苯基上的取代基优选为c1~c6烷基、卤素取代的c1~c6烷基、硝基、c1~c4烷氧基等,例如4-三氟甲基苯基、4-硝基苯基。
上述式i化合物可以通过下述方法制备得到:
将取代呋喃醛与取代氨基脲(或取代氨基硫脲、或取代氨基胍)反应,得到式i所示的抑制剂。
式i化合物的其他具体例子可参见实施例2中的表1。
此合成路线所用的化学物质为市售产品或者可通过现有技术合成得到,进行反应时,所采用的操作方法和操作步骤以及反应条件和中间体等,都是依据本领域技术人员熟知的有机合成方法设计、实施的,并公开于实施例中。
本发明通过体外酶活测试、细胞活性测试和小鼠异种移植模型实验证实,式i所示的化合物可特异性抑制phgdh活性。通过式i化合物别构抑制phgdh,可降低phgdh在癌细胞中的过表达,从而延缓癌细胞的生长。
将本发明的式i化合物单独,或者与其它phgdh抑制剂或抗癌药物组合用药,或者将它们的药用盐作为有效成分,添加常规药物载体,可制备用于治疗或预防各种癌症的药物。
本发明的式i化合物及其组合用药的药用盐是指药学上可接受的盐,例如与盐酸、硫酸、磷酸、硝酸等无机酸形成的盐,或是与柠檬酸、琥珀酸、枸橼酸、醋酸、酒石酸、甲磺酸等有机酸形成的盐。
常规药物载体指无毒固态、半固态或液态填充剂、稀释剂、佐剂、包裹材料或其他制剂辅料。根据本领域的公知技术,可以根据治疗目的、给药途径的需要将药物组合物制成各种剂型。
附图说明
图1显示了蛋白表面性质探测程序cavity预测的phgdh的别构位点。
图2是呋喃类化合物pkumdl-wl-2201与phgdh的分子对接图。
图3显示了实施例4中pkumdl-wl-2201的癌细胞致死活性(a)及其对乳腺癌细胞有丝分裂周期的影响(b)。
图4显示了实施例5中pkumdl-wl-2201对乳腺癌细胞中丝氨酸网络代谢产物的影响,其中a为代谢网络图,b表明化合物pkumdl-wl-2201影响细胞中丝氨酸及甘氨酸代谢产物的量。
图5显示了实施例6中pkumdl-wl-2201在小鼠异种移植模型中的体内生物活性,其中,a、b、c图显示了pkumdl-wl-2101给药剂量分别为5、10、20mg/kg/day时给药2个月肿瘤体积的变化;d显示了不同pkumdl-wl-2101给药剂量的小鼠体重的变化;e显示了pkumdl-wl-2201与阿霉素(dox)联合给药期间小鼠的体重变化,f显示了pkumdl-wl-2201与阿霉素联合给药后,肿瘤的体积变化。
图6显示了实施例7中pkumdl-wl-2201与苯甲酰肼类化合物pkumdl-wl-2101组合用药效果图。
具体实施方式
以下实施例用于说明本发明,表示实践本发明的方法,其对本发明的范围无任何限制。本领域技术人员可能找到对于他们而言显而易见的实现本发明的其他方法,均应认为那些方法被包括在本发明的范围之内。
实施例1、phgdh别构抑制剂的发现
一、phgdh别构位点的预测
phgdh(pdbcode:2g76)别构位点的预测,使用的是蛋白表面探索程序cavity。首先,该程序通过擦除球方法对蛋白表面进行探测,发现蛋白表面潜在的结合位点;随后,程序根据经验公式(cavityscore=(volume-adjustvolume)/(surfacearea-adjustsurfacearea))对蛋白结合小分子的能力进行打分。adjustvolume和adjustsurfacearea与所预测位点中残基疏水面积和氢键受体给体数量相关。通过对已知结合位点-配体结合对的最大pkd进行打分,并与已知实验pkd值进行拟合,得到较好的线性相关性。因此,程序可根据上述公式将打分以预测的结合位点-配体最大pkd值的形式给出。根据pkd的数值以及口袋体积的大小,最终选取合适的潜在的别构位点。对于phgdh,我们首次获得了两个全新的潜在的别构位点,mdl-1以及mdl-2。如图1所示,mdl-1位于活性位点以及辅基nad+结合位点的附近,口袋体积为
二、phgdh别构分子的虚拟筛选
针对预测的别构位点,采用分子对接的方法,对包含约二十万化合物的specs数据库进行虚拟筛选。首先,使用glidesp模式进行粗略的刚性对接,其次,选取打分前10,000的化合物,考虑化合物和蛋白残基侧链的柔性,使用glidexp模式进行进一步对接。最后,选取glidexp打分前1000的化合物进行人工挑选,购买化合物用于实验验证。这些化合物在体外酶活性测试中进一步验证活性。mdl-2位点得到的有活性的化合物为6个,ic50值小于50μm的化合物为3个,本发明选择化合物(e)-2-氯-4-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸进行深入研究。
实施例2、别构分子的合成
一、pkumdl-wl-2201类似物的设计
从活性化合物(e)-2-氯-4-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸(命名为pkumdl-wl-2201)与phgdh的对接模型(图2),可见小分子与phgdh的相互作用模式:2-苯基呋喃芳环占据口袋中的疏水空腔,苯环中4位羧基氧可与11位丝氨酸、35位亮氨酸或34位天冬酰胺形成氢键;氨基硫脲基团则可能与phgdh中的其它负电基团存在相互作用。我们通过分子等排等策略设计一系列化合物。
二、pkumdl-wl-2201及类似物的合成
以(e)-2-氯-4-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸(pkumdlwl-2201)为例,描述呋喃类phgdh抑制剂分子的合成方法。
合成路线为:
实验步骤为:
(1)将4-羧基-3-氯苯硼酸(1.342g,6.70mmol),5-溴-2-糠醛(1.406g,8.04mmol),tbab(2.160g,6.70mmol),pd(oac)2(0.015g,0.07mmol)和k2co3(1.420g,13.4mmol)加入到250ml圆底烧瓶中,加入100ml水。在ar下保护下室温搅拌,tlc检测至呋喃原料点消失。用50ml×3乙酸乙酯萃取,水相加入3nhcl酸化,产生大量沉淀。过滤,收集固体,烘干得到目标产物2-氯-4-(5-甲酰基呋喃-2-基)苯甲酸(1.055g,黄色固体,63%)。1h-nmr(400mhz,dmso):7.55(1h,d,j=3.76hz),7.70(1h,d,j=3.76hz),7.92(2h,m),8.05(1h,d,j=1.28hz),9.67(1h,s).
(2)将步骤(1)所得产物2-氯-4-(5-甲酰基呋喃-2-基)苯甲酸(0.100g,0.4mmol)与4-乙基-3-硫代氨基脲(0.048g,0.40mmol)在20ml甲醇溶液中室温搅拌反应,tlc检测至原料消失。减压蒸馏出去溶剂,残留物在甲醇中重结晶得到目标产物(e)-2-氯-4-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸0.126g(黄色固体,熔点:271-273℃,产率:90%)。1h-nmr(dmso):1.18(3h,t,j=7.08hz),3.62(2h,m,j=6.81hz),7.13(1h,d,j=3.65hz),7.39(1h,d,j=3.60hz),7.87(2h,q,j=9.09hz),7.98(1h,s),8.01(1h,s),8.39(1h,t,j=5.85hz),11.54(1h,s),13.40(1h,s);13cnmr(101mhz,dmso-d6)δ176.46,166.09,151.84,150.43,133.19,132.89,131.84,131.18,129.57,125.36,122.15,115.10,111.42,38.32,14.51。hrms(esi):352.0(352.0,理论值[(m+h)+])。
采用上述方法制备另外30个呋喃类化合物,所合成化合物名称如下:
pkumdl-wl-2202:(e)-n-乙基-2-((5-(4-(三氟甲基)苯基)呋喃-2-基)亚甲基)肼硫代甲酰胺;
pkumdl-wl-2203:(e)-n-乙基-2-((5-(4-甲氧基苯基)呋喃-2-基)亚甲基)肼基-1-硫代甲酰胺;
pkumdl-wl-2204:(e)-2-((5-(3-氯苯基)呋喃-2-基)甲基)-n-乙基肼基-1-硫代甲酰胺;
pkumdl-wl-2205:(e)-4-(5-((2-(苯基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸;
pkumdl-wl-2206:(e)-4-(5-((2-(甲基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸;
pkumdl-wl-2207:(e)-n-乙基-2-((5-苯基呋喃-2-基)亚甲基)肼硫代甲酰胺;
pkumdl-wl-2208:(e)-2-((5-(4-(叔丁基)苯基)呋喃-2-基)甲基)-n-乙基肼基-1-硫代甲酰胺;
pkumdl-wl-2209:(e)-2-氯-5-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸;
pkumdl-wl-2210:甲基(e)-4-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2211:(e)-n-乙基-2-((5-(对甲苯基)呋喃-2-基)亚甲基)肼硫代甲酰胺;
pkumdl-wl-2212:甲基(e)-4-(5-((2-((4-硝基苯基)碳酰)肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2213:(e)-4-(5-((2-(环己基碳酰)肼基)甲基)呋喃-2-基)苯甲酸;
pkumdl-wl-2214:(e)-n-乙基-2-((5-(萘-1-基)呋喃-2-基)亚甲基)肼硫代甲酰胺
pkumdl-wl-2215:甲基(e)-4-(5-((2-(2-(4-(三氟甲基)苯基)肼-1-羰)亚肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2216:(e)-n-乙基-2-((5-(4-氟苯基)呋喃-2-基)亚甲基)肼硫代甲酰胺;
pkumdl-wl-2217:甲基(e)-2-氨基-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2218:(e)-2-((5-(4-溴苯基)呋喃-2-基)甲基)-n-乙基肼基-1-硫代甲酰胺;
pkumdl-wl-2219:异丙基(e)-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2220:甲基(e)-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2221:(e)-2-((5-(4-氯苯基)呋喃-2-基)甲基)-n-乙基肼基-1-硫代甲酰胺;
pkumdl-wl-2222:(e)-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)苯甲酸;
pkumdl-wl-2223:甲基(e)-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)-3-甲基苯甲酸甲酯;
pkumdl-wl-2224:甲基(e)-4-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2225:(e)-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)苯磺酰胺;
pkumdl-wl-2226:(e)-4-(5-((2-(乙基氨基甲酰基)亚肼基)甲基)呋喃-2-基)苯甲酸;
pkumdl-wl-2227:乙基(e)-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)苯甲酸甲酯;
pkumdl-wl-2228:(e)-n-乙基-2-((5-(4-硝基苯基)呋喃-2-基)亚甲基)肼硫代甲酰胺;
pkumdl-wl-2229:(e)-n-乙基-2-((5-(4-羟基苯基)呋喃-2-基)亚甲基)肼硫代甲酰胺;
pkumdl-wl-2230:(e)-4-(5-((2-(肼羰)亚肼基)甲基)呋喃-2-基)-n-甲基苯甲酰胺;
pkumdl-wl-2231:(e)-4-(5-((2-((4-(三氟甲基)苯基)碳酰)肼基)甲基)呋喃-2-基)苯甲酸;
上述化合物的表征数据列见表1,核磁共振波谱数据(1h-nmr)由美国varianmercury400m测得。使用含有四甲基硅烷为内标的氘代二甲基亚砜作为溶剂,耦合常数以hz作为单位,所用缩写示意为:s=单峰,d=双峰,t=三重峰,q=四重峰,m=多重峰,br=单宽峰。高分辨质谱数据(hrms)由美国brsuckerapexivfticrms仪器测得。熔点由北京泰克仪器有限公司x-4数字显示显微熔点测定仪测得。
表1.化合物表征
实施例3、荧光动力学方法测定pkumdl-wl-2201及其类似物的phgdh体外酶活性
phgdh酶活性的测定是通过检测nadh在456nm处的荧光发射谱而实现的。首先,phgdh(终浓度30ng/μl)在96孔板中与hepes缓冲液(25mm,ph7.1,400mmkcl),5μmplp,0.5mmαkg,150μmnadh以及psat1(终浓度30ng/μl)孵育10分钟。随后,加入10μldmso(对照组)或者含小分子的dmso溶液,在25℃下以550rpm的转速震荡平衡5分钟。酶活体测试体系中保持dmso的终浓度(v/v)为5%。最后,加入pser水溶液(终浓度0.5mm),启动反应,并用紫外可见酶标仪监测456nm下nadh的消耗量随时间的变化。使用30s以内反应初速率对蛋白活性进行评估,此时nadh消耗随时间增长呈线性。
表2.化合物pkumdl-wl-2201及其类似物体外酶活性测试结果
深入研究化合物的量效关系,得到8个化合物的ic50数值,pkumdl-wl-2220的活性最高。
实施例4、化合物pkumdl-wl-2201的癌细胞抑制活性
选用一系列的癌细胞以及正常乳腺上皮细胞,采用mtt(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide)的实验方法,对化合物在细胞水平上的生物活性进行了研究。具体做法是:首先,将处于指数期生长的phgdh敏感的乳腺癌细胞mda-mb-468(5000细胞/孔)及hcc70(5000细胞/孔),phgdh不敏感的乳腺癌细胞mcf-7(3000细胞/孔)、mda-mb-231(2000细胞/孔)、zr-75-1(4000细胞/孔),结肠癌细胞dld-1(2000细胞/孔)及正常乳腺上皮细胞mcf-10a(3000细胞/孔)转移至96孔板中,过夜贴壁。然后,加入不同浓度的化合物至96孔板中,与细胞孵育72小时,控制dmso终浓度(v/v)为0.2%。不含任何化合物的dmso作为对照。随后,72小时后,向各个实验孔中加20μl5mg/mlmtt,孵育至少4小时后,移去各个实验孔中的液体,加入200μldmso,37℃缓慢摇晃10分钟,使用酶标仪检测490nm处的可以光吸收。实验数据使用细胞存活率%来表示,细胞半数致死率ec50值由hill方程拟合得到。
pkumdl-wl-2201在细胞水平上表现出微摩尔的细胞致死活性(见图3中a)。pkumdl-wl-2201对phgdh敏感的乳腺癌细胞mda-mb-468以及hcc70表现出的ec50值分别为6.90以及10.0μm,对phgdh不敏感的乳腺癌细胞mda-mb-231,zr-75-1以及mcf-7表现出的ec50值分别为>200,125以及>200μm,对结肠癌细胞表现出的ec50值为167μm。同时,pkumdl-wl-2201表现出微弱的细胞毒性,对mcf-10a细胞表现出的ec50值分别为64.7μm。
通过将处于指数生长周期的mda-mb-468细胞(3×105细胞/孔)转移至6孔板中,过夜贴壁加入不同浓度的化合物孵育24小时后,胰酶消化,离心,70%预冷的乙醇固定,pbs冲洗,离心,重悬(0.5%triton-x-100,50μg/mlpi以及50μg/mldnase-freernase的pbs),37℃避光30分钟,使用流式分析仪分析结果表明,pkumdl-wl-2201可以使细胞周期停滞在g0/g1期(见图3中b)。
以上实验结果表明,pkumdl-wl-2201对phgdh敏感的乳腺癌细胞表现出较好的细胞致死活性。
实施例5、pkumdl-wl-2201对丝氨酸代谢网络中代谢产物的影响。
首先,将mda-mb-468细胞(3×105细胞/孔)种植于6孔板中,经24h贴壁后,将细胞中的培养基置换成加入透析血清以及11mmu-13c-葡萄糖标记的新鲜培养基,同时加入50μμpkumdl-wl-2201后继续培养24h。随后,移去培养液,使用1×pbs溶液清洗6孔板,加入1ml-80℃预先冷却的80%甲醇水溶液,-80℃15min后,将细胞从6孔板中刮下,离心取上清。最后,每个孔的上清在氮吹仪下吹干,固体用15μl甲醇/乙腈(1:1v/v)重悬,离心后通过液相色-高分辨谱质谱联(lc-hrms)检测代谢产物浓度(见图4a)。
由实验结果可以看出,加入化合物后,mda-mb-468细胞中丝氨酸以及甘氨酸的合成被抑制,减少量约为50%(见图4中b)。
以上实验结果再次表明,化合物pkumdl-wl-2201能够显著影响细胞内丝氨酸及甘氨酸代谢产物的量。
实施例6、pkumdl-wl-2201在小鼠异种移植模型中的生物活性效果
1.pkumdl-wl-2201单独给药实验方案及结果
首先,将mda-mb-468(2×105)细胞注射至nod.cb17-prkdcscid/j小鼠(6-8周)的第四乳房脂肪垫中,待肿瘤平均体积长至30mm3,将小鼠随机分成8组,每组5只小鼠。随后,开始给药,对照组给药为溶解化合物的溶剂(10%dmso,20%eland70%pbs),pkumdl-wl-2201的给药方式为腹腔注射,给药组给药剂量分别为20,10以及5mg/kg/day。每两天检测肿瘤体积大小,肿瘤体积通过如下公式:
短径2(mm)×长径(mm)×0.5
计算得到。
pkumdl-wl-2201给药两个月后,由实验结果图可以看出,相较于对照组,小鼠体内的肿瘤生长被显著抑制(见图5中a-c)。实验过程中小鼠均保持较好的生长状态(见图5中d)。实验结果具有统计显著性,p值小于0.05。
2.pkumdl-wl-2201与阿霉素组合给药实验方案及结果
首先,将mda-mb-468(2x105)细胞注射至nod.cb17-prkdcscid/j小鼠(6-8周)的第四乳房脂肪垫中,待肿瘤平均体积长至150mm3,将小鼠随机分成5组,每组5只小鼠。随后,开始给药,第一组小鼠为对照组,只注射溶解pkumdl-wl-2201以及溶解阿霉素的溶剂(10%dmso,20%el和70%pbs);第二组小鼠仍为对照组,只注射溶解阿霉素的溶剂(10%dmso,20%el和70%pbs);第三组至第五组小鼠为实验组,给药方式分别为,阿霉素给药(2.5mg/kg/4day),pkumdl-wl-2201(20mg/kg/day)给药以及pkumdl-wl-2201(20mg/kg/day)与阿霉素(2.5mg/kg/4day)组合给药。之后,每两天监测肿瘤体积生长曲线以及小鼠生存曲线,肿瘤大小由卡尺测量。肿瘤体积仍由上述公式计算得到。
因抗癌药物阿霉素具有较强的细胞毒,实验组的小鼠在给药开始后的13天开始死亡,因此组合用药的实验结果只记录到给药开始后的11天。相较于pkumdl-wl-2201或者阿霉素单独用药,pkumdl-wl-2201与阿霉素的组合用药可以显著抑制小鼠体内的肿瘤生长,并与阿霉素单独用药时产生的肿瘤生长抑制效果存在显著性差异。组合用药的最大药效发生在给药开始后的第六天,相较于对照组,其对肿瘤生长的抑制效果达到41%(见图5中e和f)。
实施例7、pkumdl-wl-2201与苯甲酰肼类化合物pkumdl-wl-2101的组合用药
苯甲酰肼类化合物pkumdl-wl-2101的化学名称为:(e)-2,4-二羟基-n'-(2-羟基-5-硝基亚苄基)苯甲酰肼,其结构式如下:
实验的具体做法如下所示:在酶活性分析实验中,pkumdl-wl-2101的浓度梯度为0,1,5,12.5,25,50,100,200μm,依次选取其中一个浓度与pkumdl-wl-2201的不同浓度(0,1,5,12.5,25,50,100,200μm)两两组合,然后与phgdh孵育,检测混合物对phgdh酶活性的影响。在细胞活性分析实验中,首先,mda-mb-468(5000细胞/孔)转移至96孔板中过夜贴壁;其次,依次选取pkumdl-wl-2101不同浓度(0,0.1,0.5,1,2.5,5,7.5,10μm)中的一个浓度与pkumdl-wl-2201的不同浓度(0,0.1,0.5,1,2.5,5,7.5,10μm)两两混合;最后,混合物加入96孔板中与细胞孵育72小时,mtt方法检测混合物生物活性。
酶活性分析实验结果表明,当pkumdl-wl-2201的浓度由50μm增加至200μm时,协同现象被明显观测到,协同程度最强的点(ci=0.34)出现在当pkumdl-wl-2101的浓度为5μm,而pkumdl-wl-2201的浓度为200μm时(见图6中a)。与酶活性实验结果不同的是,在细胞活性测试中,协同现象则显著发生在实验条件下pkumdl-wl-2101浓度最大值处(见图6中b)。酶活性实验结果与细胞活性测试结果不同的原因可能是由于细胞内复杂的微环境造成的。
以上酶活性测试、细胞实验和小鼠异种移植模型实验结果表明,本发明化合物可特异性抑制phgdh活性。
- 还没有人留言评论。精彩留言会获得点赞!