一种代代花萼萃取物及制法与在制备减肥药物中的应用的制作方法
本发明属于中药领域,具体涉及一种代代花萼萃取物及其制备方法与在制备减肥药物中的应用。
背景技术:
代谢综合征是多种代谢异常症候群的总称,包括肥胖、胰岛素抵抗,血脂异常,高胰岛素血症、高血压等。在这些代谢异常中,肥胖首当其冲,成为其他代谢异常的首要体现,已经在全球范围内危害着人类的健康。Ⅱ型糖尿病、高血压、心脑血管疾病、肿瘤等多种疾病的发生、发展都与肥胖有着密切的关系。目前肥胖已成为危害人类健康的全球性健康问题,它与Ⅱ型糖尿病、高血压、心脑血管疾病、肿瘤等多种疾病的发生、发展密切相关。
3T3-L1前脂肪细胞分离自小鼠胚胎(17~19d)的Swiss 3T3细胞,能特异性地被诱导分化成成熟的脂肪细胞。由于小鼠前体脂肪细胞的取材较为方便,并且关于小鼠前体脂肪细胞的培养研究技术较成熟,使得3T3-L1前脂肪细胞已成为国际上公认的研究脂肪代谢的细胞模型。越来越多的研究发现中药可通过抑制3T3-L1前脂肪细胞的增殖发挥预防或减肥的功效。比如于华强等利用MTT法以及油红O染色法研究不同浓度的芹菜素对前脂肪细胞增殖以及分化的影响,实验结果表明,芹菜素能够显著地抑制3T3-L1前脂肪细胞的增殖以及分化,并呈剂量依赖性,提示芹菜素可能具有预防或治疗肥胖的作用。
代代(Citrus aurantium L.var.amara Engl)是芸香科柑橘属植物酸橙的一个变种,代代花是其花蕾的干品,具有良好的药理作用,常用于治疗气郁不舒、脘腹胀痛、积食不化、恶心呕吐等。目前国内外对代代花的研究主要以其挥发油类化合物为主,而对代代花其它有效成分的研究报道几乎没有。代代花作为药食两用价值的天然保健品,其有效成分的提取纯化和药理活性等方面的研究还有待进一步深入探讨,全面加强代代花的生物利用,对于开发新药、指导临床用药具有重要的意义。
技术实现要素:
为了克服现有技术的不足和缺点,本发明的首要目的在于提供一种代代花萼萃取物的制备方法。
本发明的另一目的在于提供上述制备方法制备得到的代代花萼萃取物。
本发明的再一目的在于提供上述代代花萼萃取物在制备减肥药物中的应用。
本发明的目的通过下述方案实现:
一种代代花萼萃取物的制备方法,包含如下步骤:
(1)将代代花萼(Citrus aurantium L.var.amara Engl)干燥,粉碎过筛,得代代花萼粗粉;
(2)采用乙醇溶液加热回流提取代代花萼粗粉,然后将提取液离心,并将上清液浓缩,干燥至恒重,得到代代花萼乙醇粗提物(记为CAV-I);
(3)将代代花萼乙醇粗提物用蒸馏水溶解,加入石油醚进行萃取,重复萃取数次,去除石油醚相;在去除石油醚相后的溶液中加入氯仿进行萃取,重复萃取数次,分别收集氯仿相和取出氯仿相后的溶液,将氯仿相浓缩蒸干,得到氯仿相萃取物(记为CAV-II);
(4)向取出氯仿相后的溶液中加入乙酸乙酯进行萃取,重复萃取数次,合并乙酸乙酯相,浓缩蒸干,得到乙酸乙酯相萃取物(记为CAV-III)。所述代代花萼萃取物为代代花萼乙醇粗提取物、氯仿相萃取物和/或乙酸乙酯相萃取物。
步骤(1)中所述干燥的温度为40~60℃;所述干燥时间为18~24h;所述粉碎过筛为40~60目筛。
步骤(2)中所述乙醇溶液的体积分数为70~90%。
步骤(2)中所述乙醇溶液与代代花萼粗粉的体积质量比为(10~30)mL:1g。
步骤(2)中所述加热回流提取的温度为80~100℃;所述加热回流提取次数为2~5次,每次提取的时间为1~3h。
步骤(2)中所述离心的转速为3000~5000r/min;所述离心的时间为8~12min。
步骤(2)中所述干燥的温度为40~60℃。
步骤(3)所述代代花萼乙醇粗提物与蒸馏水的质量体积比为1g:(10~20)mL。
步骤(2)、(3)和(4)中所述的浓缩的方式为减压浓缩;
步骤(3)中所述萃取的时间都为30~60min;步骤(4)中所述萃取的时间为30~60min;
步骤(3)中所述萃取次数都为3~5次;步骤(4)中所述萃取次数都为3~5次。
一种代代花萼萃取物(CAV-I、CAV-II、CAV-III),通过上述制备方法制备得到;
所述的代代花萼萃取物(CAV-I、CAV-II、CAV-III)在制备减肥药物中的应用;
所述的代代花萼萃取物(CAV-I、CAV-II、CAV-III)可作为新型的减肥药物,应用于肥胖症的治疗。
一种减肥药物,含有上述代代花萼萃取物(CAV-I、CAV-II、CAV-III)中的至少一种;
本发明的原理:天然植物来源的有效成分能通过抑制前脂肪细胞的增殖发挥减肥的功效。本发明发现和确证天然植物有效成分具有显著的减肥活性,且使用剂量低,在同样剂量下的毒副作用也较低。
本发明相对于现有技术具有如下的优点及效果:
(1)本发明首次发现代代花萼萃取物(CAV-I、CAV-II、CAV-III)在体外能显著抑制3T3-L1前脂肪细胞的增殖。
(2)本发明首次发现代代花萼萃取物(CAV-II)在体外能显著抑制3T3-L1前脂肪细胞的分化。
附图说明
图1是实施例1制备得到代代花萼乙醇粗提物CAV-I对3T3-L1前脂肪细胞增殖抑制作用图;
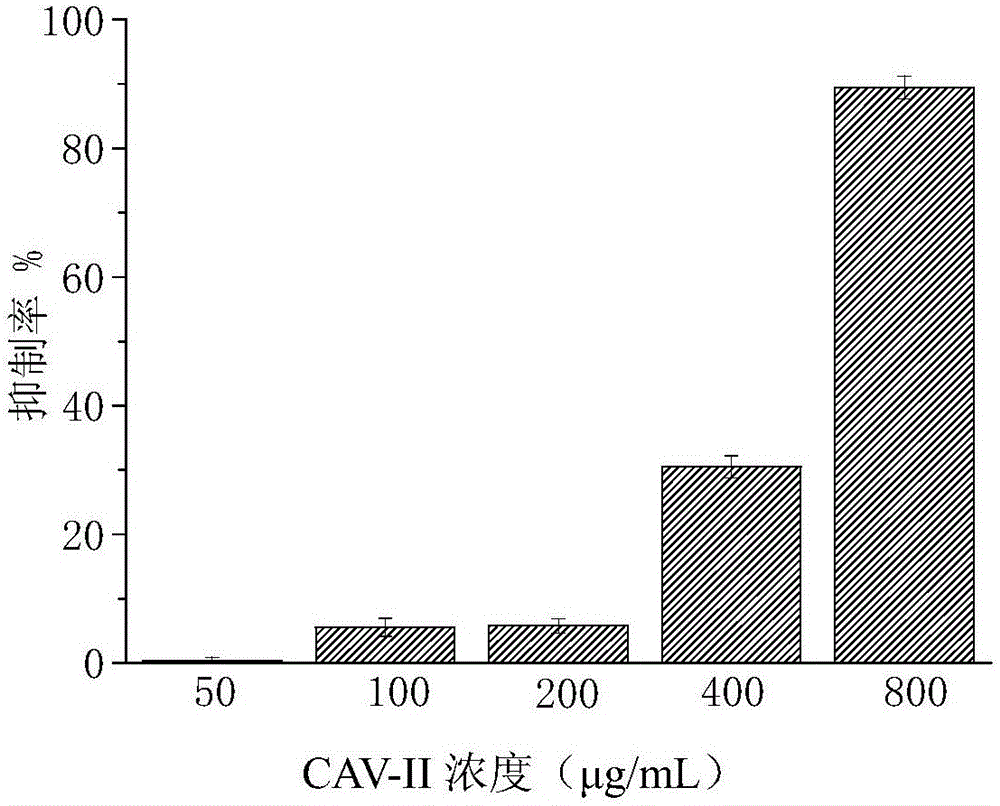
图2是实施例4制备得到的代代花萼萃取物CAV-II对3T3-L1前脂肪细胞增殖抑制作用图;
图3是实施例4制备得到的代代花萼萃取物CAV-III对3T3-L1前脂肪细胞增殖抑制作用图;
图4是实施例4制备得到的代代花萼萃取物CAV-II对3T3-L1前脂肪细胞分化早期的作用图;
图5是实施例4制备得到的代代花萼萃取物CAV-II对3T3-L1前脂肪细胞分化全过程的作用图。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例中,小鼠3T3-L1前脂肪细胞购自中科院上海生命科学研究院细胞资源中心;代代花萼购自广州清平药材市场。
实施例1从代代花萼中制备得到代代花萼萃取物CAV-I
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中50℃干燥24h,用粉碎机粉碎后,过60目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉100g于锥形瓶中,加入3000mL的体积分数为80%乙醇溶液,充分震荡摇匀,水浴锅90℃加热回流提取3次,每次加热3h;加热结束后,合并提取液,4000r/min下离心10min,取上层澄清液,将上清液用旋转蒸发仪在50℃下减压浓缩,真空干燥箱50℃干燥至恒重,即得代代花萼乙醇粗提物记为CAV-I即代代花萼萃取物CAV-I。
实施例2从代代花萼中制备得到代代花萼萃取物CAV-I
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中50℃干燥24h,用粉碎机粉碎后,过60目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉100g于锥形瓶中,加入2000mL的体积分数为90%乙醇溶液,充分震荡摇匀,水浴锅100℃加热回流提取4次,每次加热2h;加热结束后,合并提取液,5000r/min下离心8min,取上层澄清液,将上清液用旋转蒸发仪在40℃下减压浓缩,真空干燥箱45℃干燥至恒重,即得代代花萼乙醇粗提物记为CAV-I即代代花萼萃取物CAV-I。
实施例3从代代花萼中制备得到代代花萼萃取物CAV-I
(1)将代代花萼(Citrus aurantium L.var.amara Engl)置于电热鼓风干燥箱中45℃干燥18h,用粉碎机粉碎后,过50目筛,得代代花萼粗粉备用;
(2)称量代代花萼粗粉100g于锥形瓶中,加入1500mL的体积分数为70%乙醇溶液,充分震荡摇匀,水浴锅90℃加热回流提取3次,每次加热3h;加热结束后,合并提取液,4000r/min下离心10min,取上层澄清液,将上清液用旋转蒸发仪在60℃下减压浓缩,真空干燥箱45℃干燥至恒重,即得代代花萼乙醇粗提物记为CAV-I即代代花萼萃取物CAV-I。
实施例4从代代花萼中制备得到代代花萼萃取物CAV-III和CAV-II
(1)将实施例1中制备得到的代代花萼乙醇粗提物用蒸馏水溶解(代代花萼乙醇粗提物质量(g)与蒸馏水体积(mL)的质量体积比为1:10),加入与蒸馏水等体积的石油醚溶剂,充分震荡混匀,静置40min,待两相溶剂完全分层后,吸出上层的石油醚相,重复萃取三次,弃去石油醚层,得到水相溶液;
(2)在石油醚萃取后的水相溶液中加入与水相溶液等体积的氯仿溶剂,充分震荡混匀,静置40min,待两相溶剂完全分层后,收集氯仿相和取出氯仿相后的溶液,重复萃取三次,分别合并氯仿相和取出氯仿相后的溶液,将氯仿相于60℃减压浓缩,60℃真空干燥至恒重,得到氯仿相萃取物记为CAV-II即代代花萼萃取物CAV-II;
(3)在去除氯仿相后的水溶液中加入等体积的乙酸乙酯溶剂,充分震荡混匀,静置40min,待两相溶剂完全分层后,吸出上层的乙酸乙酯相,重复萃取三次,合并所得乙酸乙酯相萃取液,60℃减压浓缩,真空干燥至恒重,得到乙酸乙酯相萃取物记为CAV-III即代代花萼萃取物CAV-III。
实施例5从代代花萼中制备得到代代花萼萃取物CAV-III和CAV-II
(1)将实施例1中制备得到的代代花萼乙醇粗提物用蒸馏水溶解(代代花萼乙醇粗提物质量(g)与蒸馏水体积(mL)的质量体积比为1:15),加入2倍于蒸馏水体积的石油醚溶剂,充分震荡混匀,静置30min,待两相溶剂完全分层后,吸出上层的石油醚相,重复萃取四次,弃去石油醚层,得到水相溶液;
(2)在石油醚萃取后的水相溶液中加入2倍于蒸馏水体积的氯仿溶剂,充分震荡混匀,静置30min,待两相溶剂完全分层后,收集氯仿相和取出氯仿相后的溶液,重复萃取四次,分别合并氯仿相和取出氯仿相后的溶液,将氯仿相50℃减压浓缩,真空干燥至恒重,得到氯仿相萃取物CAV-II即代代花萼萃取物CAV-II;
(3)在去除氯仿相后的溶液中加入2倍体积的乙酸乙酯溶剂,充分震荡混匀,静置30min,待两相溶剂完全分层后,吸出上层的乙酸乙酯相,重复萃取四次,合并所得乙酸乙酯相萃取液,50℃减压浓缩,于50℃真空干燥至恒重,得到乙酸乙酯相萃取物记为CAV-III即代代花萼萃取物CAV-III。
实施例6从代代花萼中制备得到代代花萼萃取物CAV-III和CAV-II
(1)将实施例1中制备得到的代代花萼乙醇粗提物用蒸馏水溶解(代代花萼乙醇粗提物质量(g)与蒸馏水体积(mL)的质量体积比为1:20),加入3倍于蒸馏水体积的石油醚溶剂,充分震荡混匀,静置60min,待两相溶剂完全分层后,吸出上层的石油醚相,重复萃取五次,弃去石油醚层,得到水相溶液;
(2)在石油醚萃取后的水相溶液中加入3倍于蒸馏水体积的氯仿溶剂,充分震荡混匀,静置60min,待两相溶剂完全分层后,收集氯仿相和取出氯仿相后的溶液,重复萃取5次,分别合并氯仿相和取出氯仿相后的溶液,将氯仿相于55℃减压浓缩,55℃真空干燥至恒重,得到氯仿相萃取物CAV-II即代代花萼萃取物CAV-II;
(3)在去除氯仿相后的溶液中加入3倍体积的乙酸乙酯溶剂,充分震荡混匀,静置60min,待两相溶剂完全分层后,吸出上层的乙酸乙酯相,重复萃取五次,合并所得乙酸乙酯相萃取液,55℃减压浓缩,真空干燥至恒重,得到乙酸乙酯相萃取物记为CAV-III。
实施例7 MTT法检测代代花萼萃取物CAV-I、CAV-II、CAV-III对3T3-L1前脂肪细胞增殖的影响
分别取生长对数期的小鼠3T3-L1前脂肪细胞,1000rpm离心5min,弃去上清液,用含质量分数为10%胎牛血清的DMEM培养基调整细胞数为5×104/mL,100μL接种于96孔培养板中,置于5%CO2培养箱中,37℃培养24h后,弃去上清液,各组分别加入含有CAV-I(实施例1制得)、CAV-II(实施例4制得)、CAV-III(实施例4制得)的DMEM培养基(代代花萼萃取物CAV-I、CAV-II、CAV-III的终浓度分别为50μg/mL、100、200、400和800μg/mL)。在37℃、5%CO2培养箱中培养24h,弃去上清液,PBS清洗两次,每孔加入200μL不含血清的DMEM基础培养基和20μL噻唑蓝(MTT),放入培养箱中继续孵育4h,弃上清液,每孔加入150μL二甲基亚砜(DMSO),避光放置于微量振荡器均匀震荡10min,用酶标仪测量在490nm波长下的OD值,计算细胞增殖抑制率。
测试结果如图1~3所示。图1是实施例1制备得到代代花萼萃取物CAV-I对3T3-L1前脂肪细胞增殖抑制作用图;图2是实施例4制备得到的代代花萼萃取物CAV-II对3T3-L1前脂肪细胞增殖抑制作用图;图3是实施例4制备得到的代代花萼萃取物CAV-III对3T3-L1前脂肪细胞增殖抑制作用图。
CAV-I(图1)在50~800μg/mL范围对小鼠3T3-L1前脂肪细胞未表现出显著的增殖抑制作用。而代代花萼萃取物CAV-II(图2)、代代花萼萃取物CAV-III(图3)在50~800μg/mL范围内对小鼠3T3-L1前脂肪细胞均表现出显著的增殖抑制作用。说明代代花萼经过分级筛选,具有减肥功效的活性成分得到富集。综合考虑,进一步选用代代花萼萃取物CAV-II进行下一步实验。
实施例8油红O染色法检测代代花萼萃取物CAV-II对3T3-L1前脂肪细胞分化的影响
(1)本实验分为两组,记为I组和II组。分别取生长对数期的小鼠3T3-L1前脂肪细胞,1000rpm离心5min,弃去上清液,用含质量分数为10%胎牛血清的DMEM培养基调整细胞数为5×104/mL,100μL接种于96孔培养板中,置于5%CO2培养箱中,先用含10%FBS的完全培养液培养2d,待细胞长满后继续用完全培养液培养2d,使细胞达到接触抑制,I组和II组分别加入含10μg/mL胰岛素、0.05mmol/L IBMX和1μmol/L的完全培养液,加入代代花萼萃取物CAV-II(终浓度分别为6.25、12.5、25、50和100μg/mL),同时设置对照组,每种处理设5个重复。培养2d后,I组换只含有10μg/mL胰岛素的完全培养液,II组换含有10μg/mL胰岛素的完全培养液,加入代代花萼萃取物CAV-II(终浓度分别为6.25、12.5、25、50和100μg/mL),培养2~4d,I组换用完全培养液培养4d,II组换用含有代代花萼萃取物CAV-II(终浓度分别为6.25、12.5、25、50和100μg/mL)的完全培养液培养4d,直到分化结束,80%左右的细胞已经分化为成熟的脂肪细胞;
(2)将诱导分化成熟后的细胞用PBS小心洗涤3次,用100μL的4%多聚甲酵溶液固定30min,然后弃去多聚甲醛溶液,用PBS缓冲液洗涤3次,室温下晾干后每孔加入100μL油红O工作液室温下染色30min,染色30min后去除染液,再加70%乙醇迅速清洗细胞次达到脱色的目的,加PBS清洗细胞3次,然后加入200μL异丙醇,于490nm下测定吸光值;
测试结果如图4和5所示,图4是实施例4制备得到的代代花萼萃取物CAV-II对3T3-L1前脂肪细胞分化早期的作用图;图5是实施例4制备得到的代代花萼萃取物CAV-II对3T3-L1前脂肪细胞分化全过程的作用图。
I组(图4)以及II组(图5)可显著抑制3T3-L1前脂肪细胞的分化,细胞中的脂肪积累逐渐减少,脂肪滴变小,而且II组抑制效果比I组抑制效果更显著。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!