集成式消融与标测系统的制作方法
相关申请的交叉引用
本申请是提交于2011年4月13日的美国临时专利申请No.61/475,130(代理人案号No.31760-721.101)的非临时申请,并要求该临时申请的权益;其全部内容通过引用并入本文。
背景技术:
房颤(AF)以异常和不协调的心房收缩,并常常以存在不规律的心室反应为特征。在正常的窦性心律中,电脉冲发源于处在右心房中的窦房结(SA结)。心房心肌的异常搏动被称为纤颤,在一些情况下是由发源于肺静脉(PV)中的电脉冲所造成的,如M.Haissaguerre等人在发表于New England J Med.,Vol.339:659-666上的“Spontaneous Initiation of Atrial Fibrillation by Ectopic Beats Originating in the Pulmonary Veins”中所报告。
针对该状况存在取得了不同程度成功的药物治疗。此外,还有旨在控制左心房(LA)中异常电信号的外科手术,诸如由J.L.Cox等人在发表于Seminars in Thoracic&Cardiovascular Surgery,2000;12:2-14上的“The development of the Maze procedure for the treatment of atrial fibrillation”中描述的Cox-Maze III手术。其他相关出版物包括:J.L.Cox等人在Advances in Cardiac Surgery,1995;6:1-67上所发表的“Electrophysiologic basis,surgical development,and clinical results of the maze procedure for atrial flutter and atrial fibrillation”;以及J.L.Cox等人在Journal of Thoracic&Cardiovascular Surgery,1995;2110:485-95上所发表的“Modification of the maze procedure for atrial flutter and atrial fibrillation.II,Surgical technique of the maze III procedure”。
为治疗AF,已经在基于导管的系统的研发上做出了大量努力,以便消融引发AF的一些组织或将其电隔离。一种此类技术使用射频(RF)能量。在Haissaguerre等人的美国专利第6,064,902号;Schwartz等人的美国专利第6,814,733号;Maguire等人的美国专利第6,996,908号;Lesh的美国专利第6,955,173号;以及Stewart等人的美国专利第6,949,097号中描述了此类方法。另一种此类技术使用微波能量。在Walinsky的美国专利第4,641,649号;Langberg的美国专利第5,246,438号;Grundy等人的美国专利第5,405,346号;和Stern等人的美国专利第5,314,466号;以及Mody等人的美国专利公开第2002/0087151号;第2003/0050631号;和第2003/0050630号中描述了此类方法。
另一基于导管的方法利用低温技术将心房组织冷冻至-60℃的温度以下。在Lafontaine的美国专利第6,929,639号和第6,666,858号,以及Cox等人的美国专利第6,161,543号中描述了基于低温的示例设备。
治疗房颤的较新方法涉及对超声能量的使用。使用由一个或多个超声换能器所发射的超声能量来加热肺静脉周围区域的靶组织。Lesh等人在美国专利第6,502,576号中描述了一种此类方法。Gentry等人在发表于IEEE Transactions on Ultrasonics,Ferroelectrics,and Frequency Control,Vol.51,No.7,pp 799-807上的“Integrated Catheter for 3-D Intracardiac Echocardiography and Ultrasound Ablation”中描述了使用超声能量的另一导管设备。在Maguire等人的美国专利第6,997,925号;第6,966,908号;第6,964,660号;第6,954,977号;第6,953,460号;第6,652,515号;第6,547,788号;以及第6,514,249号;Lesh的第6,955,173号;第6,052,576号;第6,305,378号;第6,164,283号;以及第6,012,457号;Lesh等人的第6,872,205号;第6,416,511号;第6,254,599号;第6,245,064号;以及第6,024,740号;Diederich等人的第6,383,151号;第6,117,101号;以及WO 99/02096号;Fjield等人的第6,635,054号;Jimenez等人的第6,780,183号;Acker等人的第6,605,084号;Marcus等人的第5,295,484号;以及Wong等人的PCT公开WO 2005/117734号中描述了用以产生环形损伤的,基于超声能量的其他设备。
虽然单独的此类消融治疗是有前景的,但期望将消融设备与导引系统一同使用,该导引系统指示解剖结构以便协助超声消融器相对于治疗区域的定位,并引导对消融能量的放置。目前的导引能力依赖于多种技术,包括单独使用X射线透视或者与通常为经食管超声心动图或心脏内超声心动图(ICE)等超声成像一同使用。
最近,新型的心脏标测系统(CMS)变得越来越常用于为心房中的导管位置提供导引。这些CMS产生外部生成的能量场,通常为电场或磁场,该能量场经由消融导管远端中的传感器而被检测到。
CMS因而可以定位导管尖端在3D空间中的位置。通过操纵心房内的导管尖端的过程,CMS采集与心房壁和肺静脉相邻的一系列点,并使用这些数据来呈现代表心房解剖结构的形状。Ben-Haim的美国专利第5,738,096号公开了一种用于构建心脏标测图的此类方法。
通常,在消融术开始时获取这些CMS所呈现的心房形状。继而如Ben-Haim等人的美国专利第6,690,963号中所描述,在伴随着产生消融的一段时间中CMS感测消融导管远端的位置,并将导管位置叠加在这些先前呈现的解剖形状中。在所呈现的解剖形状上留下一串点或其他图形符号,这些点或其他图形符号对应于独立RF发生器驱动导管使其远侧尖端发射RF能量的位置。两种常用的CMS是如Hauck等人的美国专利第7263,397号中所描述的来自St.Jude Medical的EnSite系统,以及美国专利第6,788,967号中所公开的来自Biosense Webster,a Johnson&Johnson公司的Carto 3系统。
这些CMS还提供了用来采集和显示心内电描记图(IEGM)的装置,其中IEGM是从置于心脏内的电极检测到的电位变化的记录。CMS叠加经颜色编码的IEGM信息,该信息指示出去极化(depolarization)起源于心脏中的何处,以及其穿过心脏的传播图案。IEGM提供了有用的辅助工具来评价AF消融术的进度和即刻成功。
在美国专利申请第12/909,642号中描述了包括集成式心脏标测系统的消融系统,其包括由机器人控制的低强度准直超声(LICU)导管用于治疗AF。在美国专利公开第2007/0265609号中更详细描述了由导管提供的低强度准直超声能量束。这两个专利申请的全部内容均通过引用并入本文。
该LICU消融系统通过使用超声束而利用低强度准直超声波来形成损伤,其中该超声束具有足够的能量在射束与组织相遇之处产生损伤。引导损伤的形成是通过使用来自从心内膜结构返回的准直束的超声回波而推导出的标测图。
LICU消融系统包含导管、控制台、遥控箱以及操纵导管的机器人箱。以下描述该系统的典型使用。在将导管导入体内和最初置入心脏期间对其进行手动操纵和部署。一旦导管的远端处于期望的解剖位置并经由机器人箱连接,则导管尖端响应于医师在控制台或遥控箱的输入。导管尖端沿扫描图案移动,并且控制台中的软件算法处理A型超声信息,以产生在沿扫描图案的对应位置处导管尖端与心内膜之间距离的估计,又称间隙值。该间隙信息由系统软件呈现,并被作为标测图而显示在显示器上,从而可使相对于导管尖端位置的解剖特征和/或心壁轮廓可视化。
使用者继而选择叠加于间隙光栅显示上的合适的靶损伤轨迹。最后,医师选择合适的功率并命令系统在心壁中沿着指定轨迹产生损伤。如果期望,医师可选择不同的功率水平和/或速度用于轨迹的不同分段,并且系统将随着射束沿轨迹的这些分段移动而相应地调节输出功率。在形成损伤的同时,系统提供对间隙信息的实时连续监控,并将其与先前获取的扫描拂掠信息相比较,并在可能发生患者移动时提醒操作者。
该LICU系统通过用以在心脏中定位导管尖端的超声装置以及用以产生任何形状和图案的一致损伤的装置来提供同期导引。由于医师对CMS信息变得熟悉并依赖于此,因此将LICU与CMS解决方案相结合将十分有用。此外,集成的IEGM信息将为使用LICU系统的临床医师提供有用的辅助信息。
此外,集成的CMS位置信息协助LICU系统来精确控制导管远端的位置。当单独使用时,LICU系统通过位于或靠近导管近端的致动器和传感器来操纵和弯曲导管尖端。LICU控制器根据对响应于近端致动器的远端弯曲加以预测的数学(算法)模型来移动这些致动器。这些机械传递函数模型可能并不完美,并且即便有从近端传感器提供的反馈也仍可能导致偏离预定移动的远端弯曲。如果LICU系统既能感测致动器的近端位置又能感测导管尖端的远端位置,则将大大减少这种远端歪曲。CMS系统提供用以非干扰性地感测导管远端位置的装置。由CMS提供的该位置数据可用于调节和更改近端致动器的动作,并从而修正沿导管引入的任何歪曲。在工程意义上,来自CMS系统的位置数据用于在实现于LICU系统内的闭环导管控制系统中提供动态反馈。
消融系统和标测系统通常为独立的系统。在单一单元中提供导引和消融能力将会特别有用。此外,在诸如心脏组织等移动靶标中,由CMS所标识出的原始靶标可能发生移动并且非靶组织可能会被消融。因此,同期(或几乎同期)的导引和消融将使消融非靶组织的风险最小化。此类导引将会协助系统或操作者关于治疗区域而定位消融器,评价治疗进展,以及确保仅消融靶组织区域。本文公开的实施方式将会满足这些目标中的至少一些目标。
技术实现要素:
本申请公开了将心脏标测系统(CMS)与低强度准直超声(LICU)消融系统相组合的多种方法。由此产生的集成向医师提供了更完整的解决方案,该解决方案在一个系统中提供导管导航、电生理信息、损伤形成以及损伤检验。示例性实施方式阐释了导引与治疗的集成以在人体组织中产生消融区。更具体而言,本公开涉及用于改进使用超声能量对心脏房颤的治疗的系统及方法设计,并尤其涉及用于在心脏中特定位置处产生组织损伤的医疗设备。
在本发明的第一方面中,一种用于消融和标测组织的系统包括适于消融组织的独立组织消融系统,以及适于标测组织的独立心脏标测系统。所述消融系统可操作地与心脏标测系统相耦合,从而将来自心脏标测系统的标测数据提供给消融系统以产生组织和相对于该组织的消融系统位置的图形显示。
在本发明的另一方面中,一种用于消融和标测组织的系统包括适于消融组织的独立组织消融系统,以及适于标测组织的独立心脏标测系统。所述消融系统可操作地与心脏标测系统相耦合,从而将来自组织消融系统的表示组织特征的数据提供给心脏标测系统以产生组织和相对于该组织的消融系统位置的图形显示。
组织消融系统可包括基于可致动导管的超声消融系统,诸如低强度准直超声消融系统。导管可包含至少一个与该导管的远端部分相邻的感测元件。所述至少一个感测元件可与心脏标测系统可操作地耦合起来。
心脏标测系统可适于确定所述至少一个感测元件在空间中的位置。心脏标测系统可在显示设备中图形化显示叠加于组织的表示之上的所述至少一个传感器的位置。一个或多个传感器可适于捕捉来自组织的心内电描记图信号,并且该心内电描记图信号可由心脏标测系统或消融系统之中任一个来图形化显示。心脏标测系统可向组织消融系统提供视频信号,或者消融系统可向心脏标测系统提供视频信号。该视频信号可在消融系统中或心脏标测系统中的图形显示器的画中画显示中图形化显示。该视频信号可在不同于消融系统监视器的单独监视器上图形化显示。所述单独的监视器可显示来自心脏标测系统的信息。该视频信号可在不同于心脏标测系统监视器的单独监视器上图形化显示。所述单独的监视器可显示来自消融系统的信息。来自心脏标测系统的三维数据可指示传感器的位置,并且可将这些数据提供给消融系统并将其与三维消融系统数据相组合。可将来自消融系统的三维组织数据提供给心脏标测系统,并将其与三维标测数据相组合。组合的三维数据可图形化呈现在显示器中。心脏标测系统数据与消融系统数据可彼此按比例缩放和对准。
在本发明的又一方面中,一种用于消融和标测组织的集成系统包括适于消融组织的组织消融系统,以及适于标测组织的心脏标测系统。所述消融系统与心脏标测系统相集成以形成单一的集成系统。消融系统可操作地与心脏标测系统相耦合,从而将来自心脏标测系统的标测数据提供给消融系统以产生组织和相对于该组织的消融系统位置的图形显示。
在本发明的另一方面中,一种用于消融和标测组织的集成系统包括适于消融组织的组织消融系统,以及适于标测组织的心脏标测系统。所述消融系统可操作地与心脏标测系统相耦合,从而将来自组织消融系统的表示组织特征的数据提供给心脏标测系统以产生组织和相对于该组织的消融系统位置的图形显示。
在本发明的又一方面中,一种用于消融和标测组织的系统包括适于消融组织的独立组织消融系统,以及适于标测组织的心脏标测系统。所述消融系统可操作地与心脏标测系统相耦合,从而将来自心脏标测系统的标测和导引数据与来自消融系统的消融治疗数据相组合,组合的数据由系统来图形化显示。
组织消融系统和心脏标测系统可各自为独立系统,或者它们可集成为单一系统。
在本发明的另一方面中,一种用于消融和标测组织的方法包括提供组织消融系统和提供心脏标测系统。用心脏标测系统来进行组织标测,并捕捉关于标测的组织的数据。用消融系统来消融组织,并捕捉关于消融的组织的数据。将来自消融系统的组织消融数据提供给心脏标测系统,或者将来自心脏标测系统的心脏标测数据提供给组织消融系统。将组织消融数据与心脏标测数据相组合。继而在监视器上显示组合数据。
标测组织可包括标测消融系统相对于组织的位置。标测组织可包括标测组织表面。消融组织可包括用低强度准直超声束来超声消融组织。将组织消融数据与心脏标测数据相组合可包括按比例缩放和对准这两个数据集。
在本发明的又一方面中,一种用于精确弯曲和定位导管尖端的方法包括心脏标测系统向组织消融系统提供位置数据。该位置数据用于为机器人控制的导管提供反馈以减少远端尖端移动的预定图案的歪曲。
在本发明的另一方面中,一种用于消融组织的方法包括提供包含消融导管的组织消融系统,提供心脏标测系统,以及用消融导管上的传感器来感测由场发生器所生成的场从而确定消融导管的工作端的位置。该方法还包括:促动可操作地耦合至消融导管的致动器,从而将消融导管的工作端朝向靶治疗部位移动;检测与致动器位置相关联的操作参数;以及将所述操作参数提供给与组织消融导管相关联的控制系统,以便提供关于组织消融导管工作端位置的反馈。该方法还包括:基于反馈来调节一个或多个所述致动器,从而将导管的工作端适当地定位至靶治疗部位附近的期望位置;向心脏标测系统提供来自传感器的输出并确定对消融导管工作端位置的第二估计。将所述位置的第二估计提供给组织消融系统,并继而重新调节导管的工作端,从而使工作端相对于靶治疗部位适当地定位。
该方法还可包括用组织消融导管来消融组织。消融导管可包括超声消融导管。检测操作参数可包括测量一个或多个致动器的力、位移、旋转和扭矩中之一。可将传感器装设在消融导管的远端部分上,并且可将致动器装设在邻近消融导管的近端部分之处。
在本发明的又一方面中,一种用于消融组织的方法包括:提供具有消融导管的组织消融系统;提供心脏标测系统;以及使用消融导管上的传感器来测量来自外部功率源的电位或其所具有的阻抗,从而确定对消融导管工作端位置的第一估计。该方法还包括促动可操作地耦合至消融导管的致动器从而将消融导管的工作端朝向靶治疗部位移动,以及检测与致动器的位置相关联的操作参数。将所述操作参数提供给与组织消融导管相关联的控制系统,以便提供关于组织消融导管工作端位置的反馈。基于反馈来调节一个或多个致动器从而将导管的工作端适当地定位至靶治疗部位。继而向心脏标测系统提供来自传感器的输出,以便能够确定对消融导管工作端位置的第二估计。将所述位置的第二估计提供给组织消融系统,并基于该第二估计来重新调节导管工作端的位置,以使工作端更靠近靶治疗部位。
在以下与附图相关的描述中进一步详细描述了这些实施方式和其他实施方式。
援引并入
本说明书中所提及的所有公开、专利以及专利申请均通过引用并入本文,其程度如同每个单个的公开、专利或专利申请被特别地和单个地指出通过引用而并入本文。
附图说明
在所附权利要求中具体陈述了本发明的新颖特征。参考以下陈述采用了本发明原理的说明性实施方式的详细描述以及附图,将会取得对本发明特征和优势的更好理解,在附图中:
图1是与独立LICU消融系统相链接的独立CMS的示意图,其中在LICU系统中显示集成信息。
图2是与独立LICU消融系统相链接的独立CMS的示意图,其中在CMS中显示集成信息。
图3是集成在LICU消融系统内的CMS的示意图。
图4是集成在CMS内的LICU消融系统的示意图。
图5是向LICU消融系统提供动态导管尖端位置数据的CMS系统的框图。
具体实施方式
以下示例性实施方式阐释了一种将心脏标测系统(CMS)与低强度准直超声(LICU)消融系统的益处相组合的用于引导对机体组织的消融的医疗系统。有多个配置被包括在内,每个配置都涉及用于接合CMS与LICU系统以便能够共享数据从而实现集成式解决方案的益处的不同途径。
图1图示了链接至独立心脏标测系统(CMS)20的LICU消融系统10。导管30包含导管手柄40、导管主体50和远端60,该导管30如箭头45所示可操作地连接至LICU 10并由该LICU 10所控制,这样提供了用以操纵导管的机械装置以及用以驱动远端60和感测来自远端60的超声波的电气装置。位于导管远端60中的诸如电极(未示出)等一个或多个感测元件如箭头47所示可操作地连接至CMS 20。CMS 20使用普通CMS技术来确定远端60中的传感引线在空间中的位置,并在CMS显示器80上显示叠加于心房的图形表示之上的该位置。CMS还能够推导出IEMG信号并显示从远端60中的电极检测到的这些电位。
存在多个用以将CMS 20推导出的信息集成至LICU系统10中的不同方法。一种途径是如箭头85所示,向LICU 10发送含有CMS显示器80上所示信息的视频信号,这样转而在LICU显示器70的PIP(画中画)区域中显示该视频信号。拥有视频处理领域合理技能的人员熟悉用于将一个视频图像显示在第二视频图像的区域中的技术。一种简化的途径是提供第二显示监视器作为LICU系统10的一部分,并专门将该监视器用来显示CMS所提供的信息。
备选地,CMS 20提供3D数据集,该3D数据集包括位于心脏内部三维空间(X、Y、Z)的远端60中传感器的推导出的X、Y、Z位置。该3D数据被发送至LICU 10,在此将该数据与LICU 3D数据相组合并呈现在显示器70上。
为了利用两组3D数据的单一集成显示,需要将这两组数据按比例缩放和对准。在一种途径中,LICU系统10将导管远端60移动至三维空间中的多个(至少三个)不同位置作为参考点。LICU系统10在每个参考点查询CMS 20让其提供检测到的3D位置。这些参考数据点为LICU系统10提供足够的信息来将完整CMS 3D数据集与LICU 3D数据集按比例缩放和对准。继而可将这两个3D数据集相组合并呈现在显示器70上。拥有本领域合理技能的人员可提供按比例缩放和对准两组3D数据的替代方法。
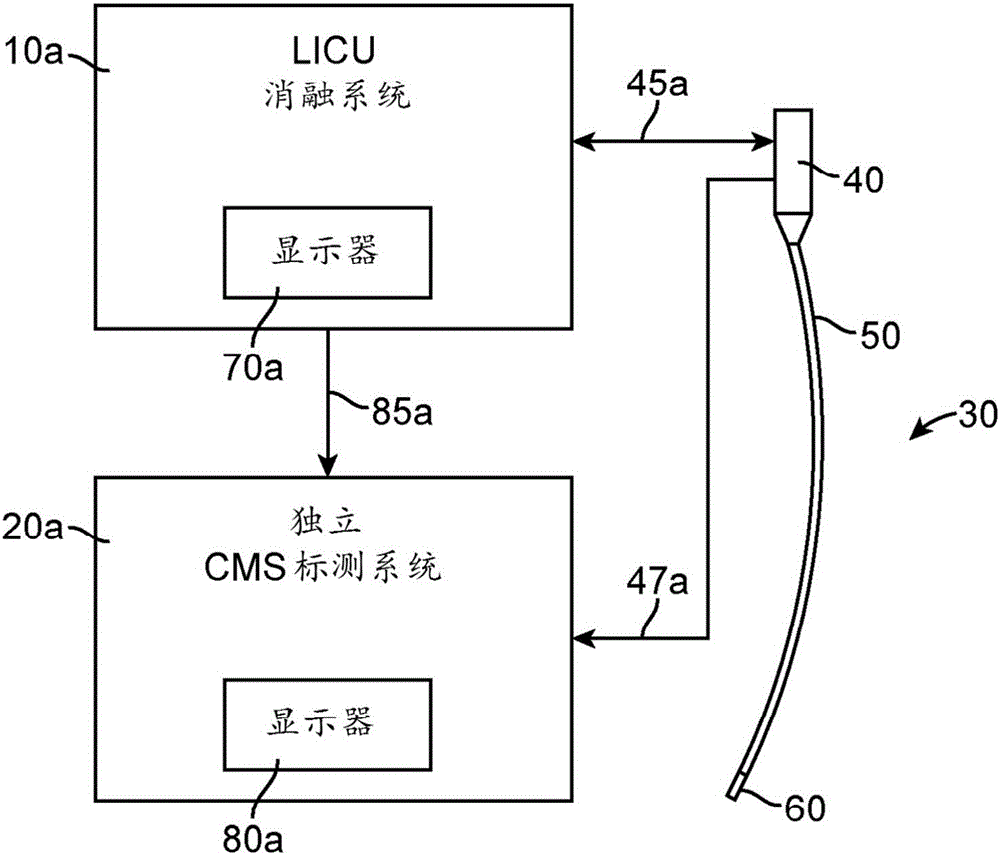
图2图示了链接至LICU消融系统10a的独立心脏标测系统
(CMS)20a。导管30包含导管手柄40、导管主体50和远端60,该导管30如箭头45a所示可操作地与LICU 10a相耦合并由该LICU 10a所控制,这样提供了用以操纵导管的机械装置以及用以驱动远端60和感测来自远端60的超声波的电气装置。位于导管远端60中的诸如电极(未示出)等一个或多个感测元件如箭头47a所示可操作地连接至CMS 20a。CMS 20a使用普通CMS技术来确定远端60中的传感引线在空间中的位置,并在CMS显示器80a上显示叠加于心房的图形表示之上的该位置。CMS还可推导出IEMG信号并显示从远端60中的引线检测到的这些电位。
存在多个用以如箭头85a所示将LICU系统10a所推导出的信息集成至CMS 20a中的不同方法。一种途径是向CMS 20a发送含有LICU显示器70a上所示信息的视频信号,这样转而在CMS显示器80a的PIP(画中画)区域中显示该视频信号。拥有视频处理领域合理技能的人员熟悉用于将一个视频图像显示在第二视频图像的区域中的技术。一种简化的途径是提供第二显示监视器作为CMS 20a的一部分,并专门将该监视器用来显示LICU所提供的信息。
备选地,LICU系统10a提供3D数据集,该3D数据集包括与LICU所显示的信息相对应的X、Y、Z位置。该3D数据被发送至CMS20a,在此该3D数据与CMS 3D数据相组合并呈现在显示器80a上。
为了利用两组3D数据的单一集成显示,需要将这两组数据按比例缩放和对准。在一种途径中,LICU系统10a将导管远端60移动至三维空间中的多个(至少三个)不同位置作为参考点。LICU系统1a在每个参考点捕捉该3D位置并通知CMS 20a让其也同样地捕捉对应的3D位置。这些参考数据点为CMS 2a提供足够的信息让其将完整LICU 3D数据集与CMS 3D数据集按比例缩放和对准。继而可将这两个3D数据集相组合并呈现在显示器80a上。拥有本领域合理技能的人员可提供用于按比例缩放和对准两组3D数据的替代方法。
图3图示了如箭头45b所示可操作地与导管30相耦合的、具有完全集成式心脏标测系统(ICMS)20b的LICU系统10b。ICMS 20b是从独立CMS 20或独立CMS 20a派生的集成式硬件和软件。备选地,所述特征可通过修改现有LICU系统硬件和软件而直接实现于LICU系统10c之中(见图4)。备选地,可以使用ICMS与LICU系统硬件及软件两者的混合。备选地,完全集成式LICU系统10或LICU系统10a可使用由第三方(OEM)供应商——诸如提供3D跟踪设备的Ascension Technology Corporation(Milton,VT)——所提供的模块。这些模块经专门设计用于集成至现有医疗系统之中。该集成式解决方案所具有的相比于图1和图2中所示解决方案的优势在于其在手术室中占用更少的空间,并可由单一操作者来控制。
图4图示了如箭头45c所示可操作地耦合至导管30的、具有完全集成式LICU消融系统10c的CMS 20c。集成式LICU系统10c可以是从独立LICU系统10或LICU系统10a派生的集成式硬件和软件,或者所述特征可通过修改现有硬件和软件或两者的组合而直接实现于CMS系统20c之中。备选地,完全集成式CMS 20c可使用由第三方(OEM)供应商所提供的模块,该模块提供可比于LICU消融系统的功能。该完全集成式解决方案所具有的相比于图1和图2中所示解决方案的优势在于其在手术室中占用更少的空间,并可由单一操作者来控制。诸如视频监视器等显示器70c图形化示出解剖标测、导管位置以及消融信息。
图5示出了用以提供对导管远端的精确控制的组件的示例性实施方式。本领域技术人员将会明白,还可使用其他确定和控制位置的方法,诸如像将在以下讨论的通过使用阻抗来确定和控制位置。导管30由远端60、导管主体50以及导管手柄40所构成。远端60包括适合于检测由CMS场发生器25所生成的场的传感器。导管手柄40耦合至导管箱70d(亦称“机器人”)中,该导管箱70d包括从LICU控制台80进行控制的致动器71。致动器71向导管手柄40中的机械构件施加力,该力最终转化为远端60的弯曲或转向运动。传感器72检测致动器的力或位移或旋转或扭矩并提供反馈,以便使用本领域技术人员所熟悉的反馈控制系统使致动器以受控的方式移动。远端60中的传感器的输出经由来自导管手柄40的缆线27连接至CMS系统20d。CMS系统20d计算远端60的位置信息,并将该数据提供给LICU控制台80,在此将该数据用作导管尖端位置控制系统中的另一反馈通道。导管手柄40中的附加传感器可增强或代替导管箱70d中的传感器72。
在对于以上图5中所描述的实施方式的备选实施方式中,系统使用电位而非使用场发生器来确定导管30的远端60的位置信息。这可以通过在患者身上放置成对的皮肤贴片来实现,优选地将三对贴片放置在三个正交轴上。从贴片发射出低振幅电信号并由导管远端60上的诸如电极等传感器来接收该电信号。继而通过由导管测量电位或场强来确定远端60的位置。这还可以通过测量或计算对应的阻抗来实现。该系统的其他方面总体上采取与上文关于图5的先前描述相同的形式。
虽然本文示出并描述了本发明的优选实施方式,但对于本领域技术人员显而易见的是,此类实施方式仅是以示例的方式提供的。在不偏离本发明的情况下,本领域技术人员将会想到许多变化、改变和替代。应当理解,在本发明的实践中可以采用对本文所描述的本发明实施方式的各种替代方案。以下权利要求旨在限定本发明的范围,并因此涵盖这些权利要求范围之内的方法和结构及其等同项。
- 还没有人留言评论。精彩留言会获得点赞!