一种气囊式白光—辐光多模态内窥成像系统的制作方法
本发明涉及内窥镜成像系统。
背景技术:
消化道系统肿瘤严重危害人类健康。当前临床实践中,其精准诊断的关键主要通过两种方式:1.基于放射影像学(CT、MRI和PET等)的早期诊断及全身分期;2.基于内窥镜(胃镜或肠镜)的直视诊断及同步活检(或切除)。PET等放射影像学技术可对病变实现无创、全身评价,但无法对病变进行直视形态的观察并同步进行病理活检以最终明确良恶性质。而内窥镜虽然可进行直视下的观察及活检,但观察范围仅限于消化道局部表面,无法对病变侵袭范围和全身转移情况进行全面评估。同时,由于缺乏必要的信号标识,内窥镜下的信息和体外放射检查的信息无法准确匹配。因此,临床需要一种能够在消化道中同时采集直视白光信息和分子影像信息的新型多模态内窥设备,并进行有效的图像融合,以便更精准的对病灶的形态和代谢信息进行检测。
临床上的超声内镜及荧光内镜均属于多模态内窥镜,但超声内镜额外提供的超声信号仅可对局部病变对肠管的侵袭范围进行探测,无法和CT、MRI、PET等全身检查相匹配,也无法提供PET的分子影像信息;荧光内镜虽然可提供分子影像信息,但光学信号穿透性及其有限,无法对其进行体外的全身评价,且经过审批可安全用于临床的荧光分子影像示踪剂极其有限,同时肠管深部的病变(如粘膜下或肌层中的间质瘤、神经内分泌肿瘤等)也可能因荧光信号穿透性限制而呈现假阴性。
文献“Feasibility study of novel endoscopic Cerenkov luminescence imaging system in detecting and quantifying gastrointestinal disease:first human results”披露的一种核素-切伦科夫光内窥镜可以在体内通过内窥镜对18F-FDG PET探针与放射性信号伴随发射的切伦科夫光信号进行探测,实现内窥镜下良恶性组织区分,且该分子影像信息与体外PET信息可相互印证,并无需像荧光内镜一样额外注射荧光探针,是一种潜力巨大的多模态精准诊断工具。但是,由于切伦科夫光信号强度非常微弱,且穿透性有限,造成了该设备成像速度慢、成像视野狭小、成像深度浅等一系列不足,极大限制了此类核素-切伦科夫多模态内窥镜的临床应用。
辐射发光(下面简称辐光)是某些辐射发光化合物(如稀土类氧化物等)在β、γ、X等放射线激发下发出可见光的现象。文献“Optical Imaging of Ionizing Radiation from Clinical Sources”已披露多种体内或体外应用此原理对切伦科夫光进行增强或实现光学设备检测放射性信号的目的。辐光信号的光强度明显高于切伦科夫光信号,且如果采用表面激发的成像方式则可克服穿透深度的限制,是实现内窥镜直视信号与分子影像信号融合的更优方案。
然而,辐光成像存在分辨率的缺陷,必须使辐光物质与病灶紧密贴合方可实现高分辨率的成像,否则,散射的放射性射线会额外激发其他区域的辐光物质发光,严重增加成像噪声,大大削弱成像的分辨率进而失去实用意义。既往有报道使用核医学准直器可改善放射性射线的散射效应,提高动物实验中图像的分辨率(Boschi F,Spinelli AE,D'Ambrosio D,Calderan L,Marengo M and Sbarbati A 2009 Combined optical and single photon emission imaging:preliminary results Phys.Med.Biol.54 L57-62),但铅制准直器较为笨重,不易整合于内窥镜系统中,因此,暂未见用于消化道的辐光内窥镜。
技术实现要素:
针对现有技术中的不足与缺陷,本发明旨在提供一种气囊式白光-辐光多模态内窥成像系统,解决辐光成像的辐光物质无法紧贴病灶表面所造成的分辨率缺陷。
一种气囊式辐光内窥成像系统,包括:
第二内窥镜;
气囊,与所述第二内窥镜的一端相连接,所述气囊的外壁上涂有荧光物质;
第二成像单元,与第二内窥镜的另一端相连接。
进一步地,所述气囊的最大膨胀直径为3cm。
进一步地,所述荧光物质为辐光荧光物质。
进一步地,所述第二成像单元为EMCCD相机。
本发明还提供了一种气囊式白光—辐光多模态内窥成像系统,包括:
第一内窥镜;
光源,与所述第一内窥镜的一端相连接,用于将光传递至所述第一内窥镜以照明关注区域;
第一成像单元,与第一内窥镜的另一端相连接,用于通过第一内窥镜接收从所述关注区域反射的光;
第二内窥镜;
气囊,与所述第二内窥镜的一端相连接,所述气囊的外壁上涂有荧光物质;
第二成像单元,与第二内窥镜的另一端相连接。
进一步地,所述气囊的最大横向膨胀直径为3cm。
进一步地,所述荧光物质为辐光荧光物质。
进一步地,所述第二成像单元为EMCCD相机。
进一步地,所述光源为白光光源。
与现有技术相比,本发明具有以下技术效果:
1、本发明通过使用气囊,创新性的使荧光材料可以紧紧贴附于消化道管壁上的靶标,使得荧光光斑聚焦在靶标上时是最小的,这样拍到的靶标是最清楚的,消除了距离对分辨率的影响,使成像分辨率达到临床应用的标准。
2、本发明所采用的荧光成像方式可以大大提升成像的灵敏度和信噪比,并且可将一帧的成像时间缩短至≤10s,具有更好的实时性;本发明的第二内窥镜可观测气囊覆盖的大片组织的整体荧光信号。
3、本发明将气囊外壁涂的辐光荧光物质是待无衰减的放射线穿透生物组织后再进行光信号转换的,无需考虑光信号的组织衰减,具有探测深度大的特点;本发明的第二内窥镜采用临床广泛使用的PET/CT或SPECT/CT核医学显像剂实现显像,可在患者接受完核医学检查后开展,无需额外注射显像剂。
附图说明
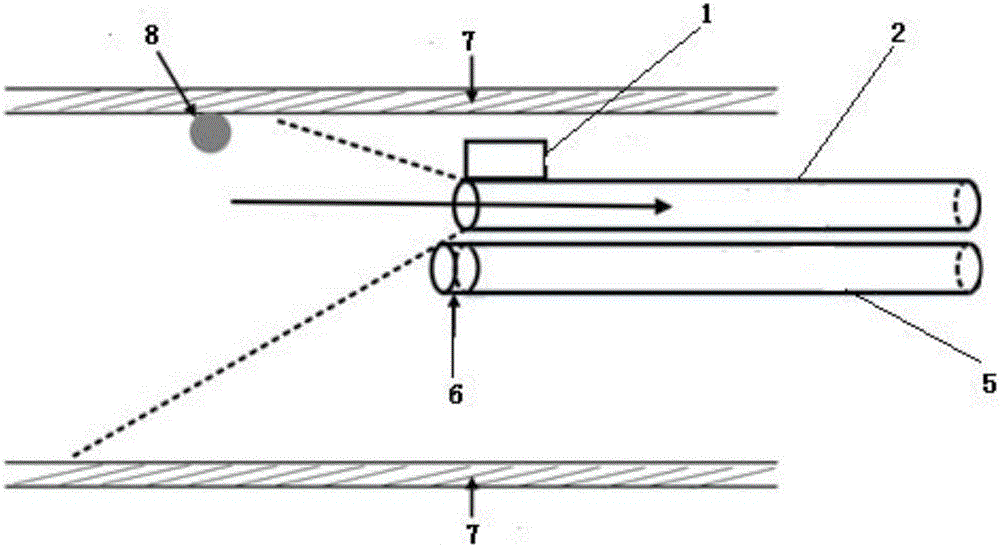
图1为气囊式白光—辐光多模态内窥成像系统示意图;
图2为本发明对消化道靶标进行白光成像示意图;
图3为本发明对消化道靶标进行辐光成像示意图;
图4为实施例2的实验结果图;
图中标号代表为:1—光源;2—第一内窥镜;3—第一成像单元;4—第二成像单元;5—第二内窥镜;6—气囊;7—消化道;8—靶标。
具体实施方式
下面通过实施例和附图对本发明作进一步说明。
本发明中气囊6的充气方式采用现在医学中常见的充气方式,例如在第二内窥镜5的侧壁设一气管,气管的一端与气囊6连通,气管的另一端与气体正压装置连接。由于肠管在传统的第一内窥镜2检查中需使用气体正压装置使肠管轻度膨胀便于检查,为了保证辐光检查与白光检查时肠管膨胀水平一致,气囊6采用与白光检查时肠管充气过程相同的气压和装置。
本发明采用的辐光策略是待无衰减的放射线穿透生物组织后再进行光信号转换,无需考虑光信号的组织衰减。
实施例1
本实施例提供了一种气囊式内窥成像系统,该系统包括:
第二内窥镜5;
气囊6,与所述第二内窥镜5的一端相连接,所述气囊6的外壁上涂有辐光荧光物质,该气囊6为可充气气囊;为了保证患者安全防止肠管过度膨胀,我们根据人体肠管解剖尺寸将气囊6的最大横向膨胀直径为3cm。
在使用时,使用气体正压装置通过设在气囊上的气管对气囊6进行充气。
第二成像单元4,与第二内窥镜5的另一端相连接。本实施例中第二成像单元4采用EMCCD相机。
实施例2
如图1所示,本实施例提供了一种气囊式白光—辐光多模态内窥成像系统,该系统包括:
第一内窥镜2;
白光光源1,与所述第一内窥镜2的一端相连接,用于将光传递至所述第一内窥镜2以照明关注区域;
第一成像单元3,与第一内窥镜2的另一端相连接,用于通过第一内窥镜2接收从所述关注区域反射的光;
其中,第一内窥镜2、白光光源和第一成像单元3组成第一内窥镜成像系统,粗略定位消化道管壁上靶标的位置。
第二内窥镜5;
气囊6,与所述第二内窥镜5的一端相连接,所述气囊6的外壁上涂有辐光荧光物质,该气囊6为可充气气囊;
第二成像单元4,与第二内窥镜5的另一端相连接。本实施例中第二成像单元4采用EMCCD相机。
其中,第二内窥镜5、气囊6和第二成像单元4组成第二内窥镜成像系统,通过使用气囊,使辐光材料可以紧紧贴附于消化道管壁上的靶标,消除距离对分辨率的影响,使成像分辨率达到临床应用的标准。
由于肠管在传统的第一内窥镜2检查中需使用气体正压装置使肠管轻度膨胀便于检查,为了保证辐光检查与白光检查时肠管膨胀水平一致,气囊6采用与白光检查时肠管充气过程相同的气压和装置。
本实施例提供的内窥镜成像系统在气囊6收起时通过第一内窥镜2进行临床常规的白光成像,如图2所示;当气囊充气时,气囊6外壁紧贴消化道7管壁,靶标8中的放射性示踪剂(18F-FDG)可激发紧贴其表面的气囊壁上的辐光物质发光,使用第二内窥镜5可采集高分辨率的辐光成像,如图3所示。白光及辐光两种图像信息可在计算机中进行图像融合等重建处理。
患者在注射放射性分子影像示踪剂(18F-FDG)接受PET检查之后,如发现异常病灶,即可接受该种检查。先通过带有白光的第一内窥镜2在直视下寻找可疑病灶,再利用带有辐光的第二内窥镜5系统检测放射性示踪剂的分布,如图4所示,使用肿瘤PET放射性显像剂18F-FDG进行辐光-白光融合显像后,白光下新生物在辐光显像中呈高信号,明显有别于周边正常组织,提示肿瘤可能性大,即可达到印证PET显像确认靶标、识别高代谢区域指导活检、内镜下良恶性鉴别等多种目的。
- 还没有人留言评论。精彩留言会获得点赞!