胰岛素和胰岛素类似物的高纯度可吸入颗粒及其高效制备方法与流程
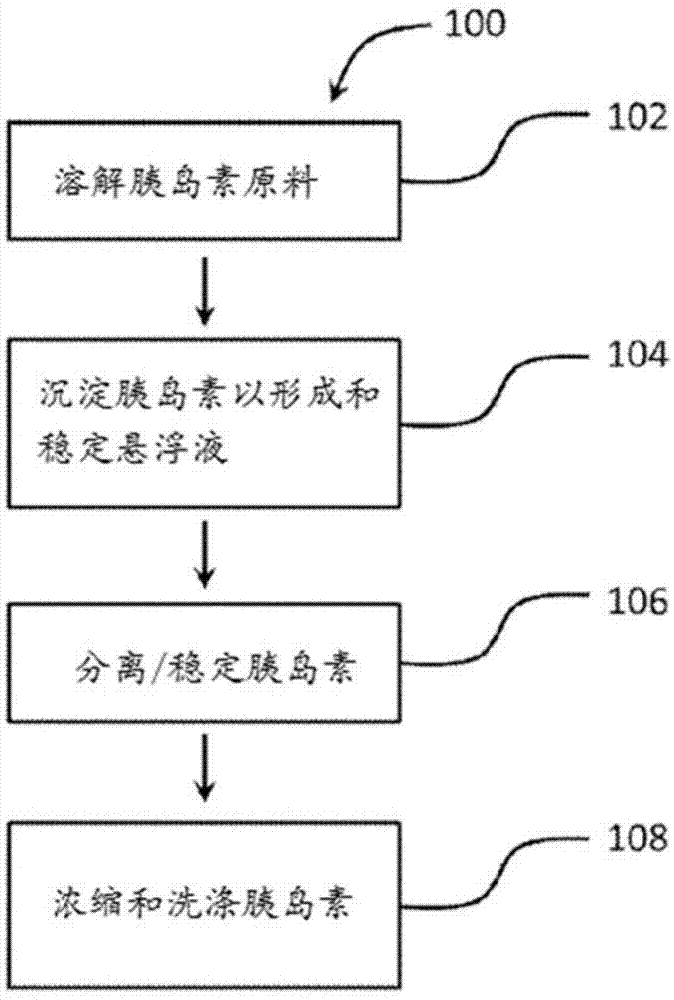
本发明的实施方案一般涉及高纯度人胰岛素和/或人胰岛素类似物的肺部递送,以及制备用于肺部递送的胰岛素颗粒(例如,人胰岛素和/或人胰岛素类似物)的高效工艺。本公开的实施方案一般还涉及包含具有改进的颗粒特征的胰岛素颗粒(例如,人胰岛素颗粒和/或人胰岛素类似物颗粒)的组合物。
背景技术:
人们越来越关注用于非侵入性施用和全身递送治疗剂(主要是肽和蛋白质)的肺部递送途径的潜力,因为肺能够提供大的吸收表面积(高达100m2),有非常或极薄的吸收性粘膜(例如,具有约0.1μm-0.2μm的厚度),并且血供良好。肺表面上非常薄的肺泡-毛细血管和支气管-毛细血管屏障允许人胰岛素颗粒快速摄入受试者的血流中,其速率与速效人胰岛素类似物达到的相似,所述速效人胰岛素类似物是形式改变的人胰岛素,不同于自然发生的人胰岛素,但仍以类似于人胰岛素的方式在人体中起作用,且在血糖控制方面具有更好的性能。胰岛素制剂可以通过皮下或静脉内注射施用。吸入型胰岛素似乎与注射的短效胰岛素一样有效。肺部递送技术的发展使得吸入型胰岛素能够有效地到达其被吸收的肺毛细血管。人肺气道含有支气管,其对胰岛素是不可透过的,肺气道还含有肺泡。吸入型胰岛素可以通过肺泡吸收并进入循环系统。吸入型哮喘药物到达肺泡之前就沉积下来。装置可以借由缓慢均匀的呼吸将人胰岛素颗粒递送到肺泡中,从而人胰岛素可以释放到循环系统中。吸入型人胰岛素可用于i型和/或ii型糖尿病患者的餐前胰岛素递送。它的使用还可以促进因为反应(例如炎症、瘀伤、焦虑等)而抗拒胰岛素注射的人早日接受胰岛素治疗。技术实现要素:根据本公开的一个实施方案,制备适用于肺部递送的可吸入胰岛素(例如,人胰岛素、动物胰岛素和/或人胰岛素类似物)的方法包括:将胰岛素原料溶解在酸性溶液(例如水和甲醇的混合物)中以形成溶解的胰岛素溶液;用缓冲溶液滴定所述溶解的胰岛素溶液以形成包含胰岛素颗粒的悬浮液;用乙醇稳定所述胰岛素颗粒;浓缩;和用乙醇洗涤并浓缩以获得具有微米级粒度的适用于肺部药物的胰岛素颗粒。所述酸性溶液可以包括水、有机溶剂(例如甲醇)或其混合物。基于所述酸性溶液的总体积计,所述酸性溶液可以包含10体积%至90体积%的量的所述有机溶剂。所述酸性溶液可以包括大于酸性溶液总体积的0体积%至90体积%的量的所述有机溶剂。所述有机溶剂可以包括醇。所述醇可以包括甲醇、乙醇或其混合物。所述缓冲溶液可以具有3至10的ph。所述微粒化胰岛素颗粒的稳定可以包括向悬浮液中加入稳定剂。所述稳定剂可以具有中性ph,并且可以是与水可混溶的。所述稳定剂可以包括醇、酮或其混合物。所述稳定可以提高微粒化胰岛素颗粒的产率。所述微粒化胰岛素颗粒可以在3至9的ph下制备。所述微粒化胰岛素颗粒可以在4.5至7.5的ph下制备。所述微粒化胰岛素颗粒可包括体积平均直径为约1至2μm(例如1.2至2μm)的基本上球形的颗粒。基于微粒化胰岛素颗粒的总体积计,所述微粒化胰岛素颗粒可以包含高达99体积%的粒度小于5μm的颗粒。所述酸性溶液可以具有1.0至3.0的ph范围。例如,所述酸性溶液可以具有在1.5至2.5(例如1.5至2.5)的范围内的ph。所述酸性溶液可以具有约2的ph,并且可以包括水和基于酸性溶液的总体积计10体积%至90体积%的包括甲醇、乙醇或其混合物的有机溶剂。所述微粒化胰岛素颗粒可以是基本上球形的形状并且可以具有小于5μm的粒度。所述微粒化胰岛素颗粒可以包括胰岛素,所述胰岛素包括人胰岛素、动物胰岛素、胰岛素类似物或其混合物。所述胰岛素类似物可以包括门冬胰岛素、甘精胰岛素或其混合物。所述溶解、所述滴定和/或所述稳定步骤可以在室温下进行。所述胰岛素原料可以包括结晶胰岛素,所述结晶胰岛素包括结晶人胰岛素、结晶动物胰岛素、结晶胰岛素类似物或其混合物。所述结晶胰岛素类似物可以包括结晶门冬胰岛素、结晶甘精胰岛素或其混合物。根据本公开的一个实施方案,所述微粒化胰岛素颗粒包括基本上球形的颗粒,其包含选自人胰岛素、动物胰岛素、胰岛素类似物及其混合物的胰岛素。获得的可吸入胰岛素颗粒具有高纯度的胰岛素(例如,基于干重>98%,例如基于干重以所述胰岛素颗粒的总重量计>98重量%)和低杂质,例如:胰岛素相关杂质基于干重小于2%,例如基于干重以所述胰岛素颗粒的总重量计小于2重量%;溶剂杂质的总量基于干重小于0.03%,例如基于干重以所述胰岛素颗粒的总重量计小于0.03重量%(其中所述溶剂杂质不包括用于肺部药物制剂的共溶剂组分),并且非溶剂杂质基于干重小于0.3%,例如基于干重以所述胰岛素颗粒的总重量计小于0.03重量%。所公开的方法的效率高。基于最终产品的总重量计,生成胰岛素颗粒的产率在75-85重量%的范围内,甚或更高。例如,基于最终产品的总重量计,胰岛素颗粒的产率可以为75重量%或更高(例如,85重量%或更高)。基本上球形的颗粒可具有约1.2至2μm的体积平均直径。基于微粒化胰岛素颗粒的总体积计,高达99体积%的基本上球形的颗粒可以具有小于5μm的粒度。所述胰岛素类似物可以包括门冬胰岛素、甘精胰岛素或其混合物。本公开的实施方案的前述描述不意指为详尽的概述,因为从独立地或结合附图和表格的以下详细描述中,本公开的其他相关方面对于本领域技术人员而言将变得显而易见,所述详细描述中描述和示出了本发明的一个或多个实施方案。附图说明附图与说明书一起示出了本公开的实施方案,并且与附图说明一起用于解释本公开的原理。图1是说明用于使胰岛素和/或胰岛素类似物微粒化的方法的实施方案的流程图。图2是根据本公开的一个实施方案制备的微粒化人胰岛素颗粒的扫描电子显微术(sem)图像。图3是说明根据图2的实施方案制备的微粒化人胰岛素颗粒的粒度分布的图。图4的图示出根据本公开的一个实施方案人胰岛素微粒化之前和之后的杂质情况。图5是根据本公开的一个实施方案制备的溶解的微粒化胰岛素颗粒的高效液相色谱(hplc)色谱图。图6和图7的图示出从填充的罐递送的人胰岛素颗粒的andersen级联冲击器研究的数据,所述颗粒根据本公开的一个实施方案制备。图8是根据本公开的一个实施方案制备的微粒化甘精胰岛素颗粒的扫描电子显微术(sem)图像。图9是根据图8的实施方案制备的溶解的微粒化甘精胰岛素颗粒的hplc色谱图。图10和图11的图示出从填充的罐递送的甘精胰岛素颗粒的andersen级联冲击器研究的结果,所述颗粒根据本公开的一个实施方案制备。图12是根据本公开的一个实施方案制备的微粒化门冬胰岛素颗粒的扫描电子显微术(sem)图像。图13是根据图12的实施方案制备的溶解的微粒化门冬胰岛素颗粒的hplc色谱图。图14和图15的图示出从填充的罐递送的门冬胰岛素颗粒的andersen级联冲击器研究的结果,所述颗粒根据本公开的一个实施方案制备。图16是根据喷射研磨方法制备的人胰岛素颗粒的原子力显微术(afm)图像。图17是如实施例2所述制备的微粒化胰岛素颗粒的原子力显微术(afm)图像。具体实施方式提供以下详细描述的目的仅在于说明本公开的某些特定实施方案,而不是为了限制本发明的范围。替代的实施方案对于本领域技术人员来说是显而易见的,并且旨在包括在本发明的范围内。此外,在本申请的上下文中,术语“胰岛素”以其广义使用,并且包括可用于治疗人或动物的任何形式的胰岛素或胰岛素类似物。例如,如本文所用,术语“胰岛素”包括天然或合成的人胰岛素、天然或合成的动物胰岛素和胰岛素类似物(例如门冬胰岛素、甘精胰岛素等)。用于制备用于肺部递送的可吸入胰岛素颗粒的微粒化工艺的实施方案包括:将胰岛素原料(例如,结晶胰岛素和/或结晶胰岛素类似物)溶解在酸性环境中(例如,溶解在酸性溶液中以促进胰岛素原料溶解)以形成溶解的胰岛素溶液;用缓冲溶液滴定所述溶解的胰岛素溶液以形成包含具有微米级粒度的胰岛素颗粒的悬浮液;并且在0至25℃下加入稳定剂(例如有机溶剂和/或共溶剂)以稳定胰岛素颗粒(例如,在纯化和干燥之前提高胰岛素颗粒的产率);浓缩所述悬浮液;在0至25℃下用溶剂(例如乙醇)洗涤所述悬浮液然后浓缩,其中洗涤/浓缩可以进行多次。该工艺的实施方案在室温或更低温度下进行并避免或减少高温的引入(这将导致胰岛素纯度降低并且还将导致杂质增加),避免特殊化学试剂(这将引入更多的非溶剂杂质),避免长时间的操作(即使在室温下这也将产生更多的胰岛素相关杂质),并避免机械力例如喷射研磨过程中引入的机械力。在不向所述酸性环境(包括溶解的胰岛素溶液和/或悬浮液)添加聚合物(例如,赋形剂聚合物,使得所获得的胰岛素颗粒中会存在显著量的聚合物)的情况下,进行该工艺的一些实施方案。本发明的实施方案提供了一种用于制备适用于肺部递送的高纯度可吸入胰岛素的工艺。该工艺的实施方案利用原始结晶胰岛素,其粒度范围可能是亚毫米级的,以提供具有微米范围内的粒度的可吸入胰岛素颗粒作为用于肺部递送的具有改进特征的活性药物成分(api),所述改进特征包括更球形的形状以及改善的光滑度。如本文所述,除非另有说明,否则粒度或粒径(例如体积平均直径)可通过激光衍射法测量。药物颗粒的肺部递送受药物颗粒的特征影响,所述特征包括颗粒大小、颗粒形状、表面粗糙度、溶解度、流动性等。由于可吸入胰岛素和/或胰岛素类似物是活性药物成分而不仅仅是被动载体,因此本公开的实施方案在将胰岛素和胰岛素类似物微粒化为高纯度胰岛素颗粒的同时,维持或基本上维持生物活性。如上所述,所获得的胰岛素颗粒将用于制备肺部药物。除粒度外,胰岛素的高纯度和低杂质将是非常重要的。粒度(或空气动力学直径)<5μm的颗粒允许吸入的药物被肺吸收。具有合适的空气动力学直径或粒度的颗粒具有良好的流动性并且更容易分散到下气道(支气管和肺泡区域)中,在下气道中通过肺的肺泡-毛细血管表面进入血流的吸收得到改善或优化。另一方面,过大的药物颗粒(例如,具有空气动力学直径或粒度>5μm的颗粒)将主要通过惯性冲击被捕获在诸如咽喉和气管的上气道中。过大的颗粒基本上不被吸收,因为它们积聚在上气道中,而上气道不具有肺泡的薄的可透过的毛细血管。积聚的药物颗粒可能触发肺部防御系统,这可能促使巨噬细胞增加。巨噬细胞的刺激或过度刺激可能导致其他炎性细胞的募集,并最终可能产生继发性组织损伤、再生和纤维化。药物粒度可在肺部递送中起决定性作用。为了制造粒径<5μm的颗粒,可以使用多种单步微粒化方法,例如喷雾干燥和机械研磨技术,使得在该方法之后,通常具有毫米级直径的起始的原始胰岛素粉末颗粒具有适用于肺部递送的微米范围的直径。然而,用于使胰岛素颗粒微粒化的那些工艺涉及在胰岛素微粒化过程期间在高温下的热量的引入、长时间的操作和/或赋形剂聚合物和特殊化学试剂,这可能导致胰岛素的聚集和活性丧失、降低其纯度或引入更多杂质,并且这可能会阻碍药品生产。此外,尽管赋形剂聚合物和其它特殊试剂有助于稳定制剂并增加加工过程中的溶解度,但赋形剂聚合物和其它特殊试剂可能会引入难以除去的杂质。还已发现,当在形成胰岛素微粒的过程中使用聚合物时,通过在接近胰岛素的等电点的ph下溶解结晶胰岛素从而形成胰岛素微粒。在该方法中可以使用各种适宜类型的聚合物,例如聚乙二醇(peg)、聚乙烯吡咯烷酮(pvp)、聚乳酸-共-乙醇酸(plga),以及生物粘附机制。当将所述聚合物加入缓冲溶液时,它可有助于进一步提高结晶胰岛素的溶解度。然而,在该过程之后,可能无法有效且完全地除去添加的聚合物。未除去的残留聚合物可能降低药效、增加毒性,并增加杂质水平。与制备含有胰岛素的微球相关的其他工艺引入赋形剂聚合物,例如pvp或peg,以帮助胰岛素在酸性环境中溶解。通过这种工艺制备的微球暴露于可能对胰岛素有害或破坏胰岛素的相对高的温度。在这些工艺结束时,用于洗涤聚合物的有机溶剂(其对胰岛素溶解度低)可能导致小胰岛素颗粒的聚集。而且,前述有机溶剂可使微球中含有的胰岛素分子变性,并且当给予人或动物时也可能是有毒的。一些胰岛素颗粒是通过使用可生物降解的聚合物材料对均匀的胰岛素微晶微包囊(例如,通过表面活性剂)而获得的。然而,此类组合物可能胰岛素含量低,例如,基于胰岛素颗粒的总重量计,平均胰岛素颗粒可能仅含有10至30%胰岛素(重量/重量)。本公开的实施方案的方法涉及克服上述困难并产生用于肺部药物产品的高纯度胰岛素颗粒。制备可吸入胰岛素或胰岛素类似物的方法的实施方案可包括以下四(4)步措施:(1)将胰岛素原料(例如结晶胰岛素或胰岛素类似物)溶解在酸性环境中以促进胰岛素原料的溶解,由此形成溶解的胰岛素纯(true)溶液。酸性环境可以包括酸性溶液。例如,酸性环境可以包括含有水、有机溶剂(例如醇,诸如甲醇)或其混合物的酸性溶液。可以利用胰岛素在酸性环境中的行为来溶解胰岛素。在一些实施方案中,酸性环境具有约1.0至3.0、例如1.5至2.5(例如,1.8至2.5)的ph,以提供良好的溶解条件。(2)用缓冲溶液滴定溶解的胰岛素溶液直至达到悬浮液状态(例如直至获得悬浮液)。溶解的胰岛素溶液的滴定使溶解的胰岛素沉淀为具有合适粒度和形状的胰岛素颗粒并形成悬浮液。当胰岛素沉淀时,溶解的胰岛素溶液从澄清或基本上澄清的溶液变为乳白色和发白色的悬浮液(例如包含微粒化胰岛素颗粒的悬浮液)。(3)通过加入稳定剂(例如有机溶剂乙醇)稳定微粒化胰岛素颗粒以增加胰岛素颗粒的产率。稳定剂可以在室温或0-25℃范围内的较低温度下加入。使用的稳定剂(例如有机溶剂和任选的共溶剂)可根据胰岛素的类型而变化,并将在下面的部分中进一步描述。然后,将悬浮液浓缩。(4)然后,在室温或0-25℃范围内的较低温度下,用相同的溶剂(例如相同种类的溶剂)洗涤浓缩的胰岛素颗粒悬浮液。该洗涤/浓缩可以进行多次。上述工艺将产生高纯度的胰岛素颗粒。获得的可吸入胰岛素颗粒具有高纯度的胰岛素(例如,基于干重>98%,例如基于干重以胰岛素颗粒的总重量计>98重量%)和低杂质比如,例如:胰岛素相关杂质基于干重小于2%,例如基于干重以胰岛素颗粒的总重量计小于2重量%;总溶剂杂质的量基于干重小于0.03%,例如以干燥的胰岛素颗粒的总重量计小于0.03重量%(其中所述溶剂不是用于肺部药物制剂的共溶剂组分),并且非溶剂杂质的量基于干重小于0.3%,例如基于干重以干燥的胰岛素颗粒的总重量计小于0.3重量%。如本文所用,除非另有说明,否则术语“基于干重”表示如果允许与以限定数量存在的水或其他挥发性物质一起使用,则在使用前不需要干燥所提及的成分(或组分,例如胰岛素颗粒或胰岛素)。本文所公开的方法效率高,产生具有微米级粒度的胰岛素颗粒的产率在75-85%甚至更高的范围内(例如基于最终产品的总重量计,产率为75%或更高、或85%或更高)。由于获得的胰岛素纯度高,且其他杂质含量低,获得的胰岛素颗粒可用于肺部药物产品的进一步加工,例如(i)直接加入或干燥然后加入推进剂(hfa134a或227)和用于剂量计量吸入(mdi)产品的其他制剂组分,或(ii)干燥然后与载体(例如乳糖)混合用于干粉吸入产品。本公开的实施方案的方面提供以下特征:与其他方法相比,可以高效制备高纯度可吸入胰岛素颗粒。用于根据本公开的用于肺部递送的在室温下胰岛素和胰岛素类似物可吸入颗粒的新工艺的实施方案包括以下四个主要步骤。首先,将粒度在亚毫米范围内的胰岛素原料溶解在酸性溶剂中作为纯溶液;第二,通过在合适的条件(ph、浓度、混合、时间等)下滴定,产生具有合适粒度的胰岛素颗粒;第三,用溶剂(如乙醇)稳定产生的胰岛素颗粒,然后在0-25℃下浓缩;第四,任选地,最后在0-25℃下用溶剂洗涤并浓缩。在第一个措施中,胰岛素原料可以溶解在包括水和极性、分子量小且与水可混溶的有机溶剂的酸性环境(例如酸性溶液)中。基于所述溶液的总体积计,在所述溶液中可以采用高达90体积百分比(体积%)的量的甲醇和/或乙醇,以控制胰岛素的起始溶解度。例如,甲醇和/或乙醇可以以优选大约90体积%(基于酸性溶液的总体积)的量包含于酸性溶液中,但是大于0至高达90体积%的任何量都可以考虑并可以采用。所述酸性溶液可以置于搅拌板的顶部。整个过程可以采用例如40至200转/分钟(rpm)的稳定的、连续的或基本上连续的搅拌,直到溶液变得完全或基本上完全澄清。在第二个措施中,搅拌速度可以减慢至约30至100rpm。所述溶解的胰岛素溶液用缓冲溶液(例如乙酸钠/乙酸)滴定或缓慢滴定,并随着溶解的胰岛素溶液从澄清或基本上澄清的溶液变为发乳白色的悬浮液并逐渐长大至合适的粒度时,逐渐出现胰岛素的沉淀。胰岛素和/或胰岛素类似物的颗粒可以在3至9的ph范围下例如4.5至7.5的ph范围下产生。所述缓冲溶液可制备成具有相同的ph范围。在第三个措施中,采用具有中性ph、在0-25℃的温度下的并与水可混溶的稳定剂。稳定剂的实例包括醇和/或酮。例如,所述醇可包括乙醇或其混合物。所述稳定剂稳定所述微粒化的胰岛素颗粒。然后将所述经稳定的悬浮液浓缩。在第四个措施中,将所述浓缩的悬浮液用溶剂如乙醇在0-25℃下洗涤并进一步浓缩。所述洗涤/浓缩可以重复多次。获得的所述胰岛素颗粒可用于肺部药物制剂的进一步加工,例如(i)直接加入或干燥然后加入推进剂(hfa134a或227)和用于剂量计量吸入(mdi)产品的其他制剂组分,或(ii)干燥然后与载体(例如乳糖)混合用于干粉吸入产品。图1的工艺流程图说明了用于在室温下使胰岛素和/或胰岛素类似物微粒化的方法的实施方案。在图1中,用于使胰岛素微粒化的方法100的实施方案包括溶解胰岛素原料102,沉淀(例如通过滴定)胰岛素以形成和稳定悬浮液104,分离/稳定胰岛素106,以及洗涤和浓缩胰岛素108。现在将参考实例描述本公开的实施方案来进行说明。然而,本公开不限于本文所描述的实例。实施例1:在90体积%甲醇溶液中制备可吸入胰岛素颗粒在40ml小瓶中,将70mg生物合成人胰岛素(即来自amphasterfrancepharmaceuticals,s.a.s.)原料粉末溶解于7.7ml具有约1.9ph的酸性溶液中,所述酸性溶液是90体积%甲醇和10体积%水的混合物。将所述小瓶置于搅拌板的顶部,稳定地搅拌所获得的溶液直至所述溶液完全溶解或基本上澄清以形成胰岛素纯溶液。然后,将搅拌减慢至较慢模式(例如约75rpm的旋转速度),并逐滴添加1.75ml的ph为5.64的0.1m乙酸钠/乙酸(naac/hac)缓冲溶液(1.825gnaac和0.165g乙酸溶解于250ml溶液中)以缓慢滴定所述溶解的胰岛素溶液。所述澄清的溶解的胰岛素溶液转变为乳白色和发黄色的包括微粒化胰岛素颗粒的悬浮液。所述滴定完成或基本上完成后,向悬浮液中加入约10ml乙醇(无ph调整的乙醇)。继续再搅拌30分钟,以使所述颗粒稳定,产率高。微粒化胰岛素颗粒通过离心作为固体从悬浮液的上清液中被分离出来,所述获得的固体经乙醇洗涤两次以除去甲醇和盐。将该固体在室温下真空干燥。图2是示出根据实施例1所述方法生产的可吸入人胰岛素api的扫描电子显微术(sem)图像。在本申请中,使用jeolcarryscopejcm-5700sem仪器获得所有的sem图像。图3是说明根据实施例1所述所制备的可吸入胰岛素api(微粒化胰岛素)的粒度分布的图。从图2和图3可以得出结论,根据实施例1所述所制备的可吸入胰岛素api(微粒化胰岛素)的粒度适合于肺部给药,例如具有<5μm的粒度。例如,从图3可看出,实施例1的微粒化胰岛素的平均粒度d50小于2μm。d50为这样一种最大粒径:在该最大粒径以下,基于所述样品的总体积计,50体积%的样品具有更小的粒径,且在该最大粒径以上,50体积%的样品具有更大的粒径。实施例2:用于在90体积%甲醇溶液中制备可吸入胰岛素颗粒的批量过程在包括离心搅拌器或搅拌棒的400ml烧杯中,将1克生物合成人胰岛素api粉末(即来自amphasterfrancepharmaceuticalss.a.s.的重组胰岛素)溶解于110ml具有约1.9ph的酸性溶液中,所述酸性溶液是90体积%甲醇和10体积%水的混合物。搅拌所得溶液直到所述胰岛素溶液完全溶解或基本上完全澄清以形成溶解的胰岛素纯溶液。然后,减慢搅拌至较慢模式(例如约50rpm的转速),并逐滴添加25ml的0.1m乙酸钠/乙酸(naac/hac)缓冲溶液(ph5.64)以滴定所述溶解的胰岛素溶液。所述澄清的溶解的胰岛素溶液变成乳白色和发黄色的包括微粒化胰岛素颗粒的悬浮液。滴定完成后,向所述悬浮液中添加约135ml乙醇(中性乙醇),再继续搅拌30分钟,以使所述颗粒稳定,产率高。通过采用来自加利福尼亚州ranchodominguez的spectrumlab的500kd改性聚醚砜膜超滤,从所述悬浮液的上清液中浓缩微粒化胰岛素颗粒。所述混合物先浓缩5-10ml,并经100ml乙醇洗涤三次以除去甲醇和盐。所述悬浮液的终体积为5至10ml。所述浓缩的悬浮液在室温下真空干燥2.5小时。产物重量用于计算回收率。使用激光衍射粒度分析仪(即jeolcarryscopejcm-5700sem仪器)分析粒度。上述操作重复四(4)次以分批制备微粒化胰岛素。表1显示了根据实施例2所述所生成的四(4)批次的回收率的再现性。从表1可看出,实施例2的回收率高于86%。表1工艺再现性批次no.回收率%批次186.4批次286.1批次386.8批次486.2平均86.4标准偏差0.3相对标准偏差,%0.4表2示出了在实施例2批次中生产的微粒化人胰岛素颗粒的粒度分布的再现性。从表2可以得出结论,根据如实施例2所述制备的微粒化胰岛素的粒度适合于肺部递送,例如粒度<5μm。例如,从表2中能够看到,对于实施例2的微粒化胰岛素,平均粒度d50为1.54μm,平均粒度d10为0.75μm,平均粒度d90为3.04μm,其适合于肺部递送。d50为这样一种最大粒径:在该最大粒径以下,基于所述样品的总体积计,50体积%的样品具有比d50粒径更小的粒径,且在该最大粒径以上,50体积%的样品具有比d50粒径更大的粒径。d10为这样一种粒径:在该粒径处,基于所述颗粒的总体积计,10体积%的颗粒具有比d10粒径更小的粒径。d90为这样一种粒径:在该粒径处,基于所述颗粒的总体积计,90体积%的颗粒具有比d90粒径更小的粒径。表2实施例2的粒度测量根据美国药典(usp)的<621>章和用于人胰岛素专题的杂质测试的usp方法,通过高效液相色谱(hplc)测试加工前后的胰岛素的化学稳定性。图4的图示出胰岛素根据实施例2所述的微粒化工艺前后的杂质情况。如图4所示,在微粒化工艺期间,所述胰岛素中的杂质,例如胰岛素二聚体、高分子量蛋白质、a-21脱酰胺胰岛素或相关化合物的数量没有统计学显著变化。图5是根据实施例2所述所制备的溶解的胰岛素颗粒的高效液相色谱(hplc)色谱图。图5的hplc色谱图示出了微粒化胰岛素的保留时间相对于原始胰岛素原料的保留时间没有表现出统计学显著变化。从微粒化胰岛素颗粒的分析得到的证据表明,在微粒化工艺期间,所述胰岛素的化学完整性得以保持或基本上得以保持。使用来自sympatecgmbh的激光衍射cuvettecuv-50ml/us仪器评估微粒化胰岛素颗粒的粒度分布。在乙醇介质(乙醇溶液)中测试微粒化胰岛素颗粒。数据显示,所有四(4)个批次的体积平均直径的平均值为1.79μm,如表2所示。图6的图示出分别使用包括1,1,1,2-四氟乙烷(hfa134a)、1,1,1,2,3,3,3-七氟丙烷(hfa227)或hfa134a及hfa227的混合物的推进剂从三个剂量计量吸入器递送的人胰岛素(如根据实施例2所述生产的api)的安德森级联冲击器研究。所述剂量计量吸入器如下文根据实施例11所述来制备。从图6所示的数据可以得出结论,当三种不同的推进剂(hfa134a、hfa227以及hfa134a和hfa227的混合物)与根据实施例2所述所生产的微粒化人胰岛素一起使用时,提供了相当的结果。图7的图进一步示出使用三种不同的推进剂(分别为hfa134a、hfa227或hfa134a和hfa227的混合物)从剂量计量吸入器递送的人胰岛素(如实施例2所述生产的api)在三个不同阶段分类的安德森级联冲击器分析结果。所述剂量计量吸入器如下文根据实施例11所述制备。从图7所示的数据可以得出结论,当所述三种不同的推进剂与根据实施例2所述所生产的用于胰岛素肺部递送的微粒化人胰岛素一起使用时,提供了相当的结果。实施例3:在100体积%水溶液中制备可吸入胰岛素颗粒的方法根据如实施例1所述制备可吸入人胰岛素颗粒,不同的是使用ph为2.0的大致100体积%的纯化水溶液(包括纯化水和量足以提供ph为2.0的酸的溶液)替换实施例1的含有90体积%的甲醇的酸性溶液。如实施例2所述分析了所得的可吸入人胰岛素颗粒的粒度分布。粒度分布分析的结果表明,所述可吸入人胰岛素颗粒具有2.01μm的体积平均直径。如上所述,根据如实施例1所述制备的可吸入人胰岛素颗粒具有小于2μm的粒度d50,根据如实施例2所述制备的所有4个批次的可吸入人胰岛素颗粒(其也使用包含90体积%甲醇的酸性溶液来制备)的体积平均直径的平均值为1.79μm。因此,可看出所述溶剂的组成(例如甲醇相比于水)可改变所产生的微粒化人胰岛素的尺寸。实施例4:在低甲醇浓度的溶液中制备可吸入人胰岛素颗粒的方法根据实施例1所述制备可吸入人胰岛素颗粒,不同的是,使用ph约2.0的含有50体积%的甲醇(另外50体积%含有水和hcl)的酸性溶液或基于所述酸性溶液的总体积计含有10体积%的甲醇(另外90体积%含有水和hcl)的酸性溶液来替换用于溶解实施例1的人胰岛素原料的所述含有90体积%的甲醇的酸性溶液。表3显示了如实施例1、3和4所述微粒化的人胰岛素颗粒的粒度分布数据。表3实施例1、3和4的粒度分布因此得出结论,用来溶解人胰岛素(原料)的起始溶剂(例如甲醇溶液相比于水)和溶剂浓度(例如基于所述酸性溶液的总体积计,10体积%、50体积%或90体积%的甲醇浓度)可以影响所述微粒化人胰岛素颗粒的粒度。实施例5:在10体积%乙醇溶液中制备可吸入人胰岛素颗粒的方法根据实施例1所述制备可吸入人胰岛素颗粒,不同的是使用ph2的基于所述酸性溶液的总体积计含有10体积%的乙醇(另外90体积%含有水和hcl)的酸性溶液替换用于溶解实施例1的胰岛素的含有90体积%的甲醇的酸性溶液。如实施例2所述分析了所得的可吸入人胰岛素颗粒的粒度分布。粒度分布分析的结果表明,所述可吸入人胰岛素颗粒的体积平均直径为1.36μm。实施例6:用于使用在不同ph下的90体积%甲醇溶液使人胰岛素微粒化为可吸入颗粒的方法根据实施例1所述制备可吸入人胰岛素颗粒,不同的是使用一系列含有naohph3至9的缓冲溶液来替代使用ph5.64的缓冲溶液。根据实施例2所述分析了所得的可吸入人胰岛素颗粒的粒度分布。naoh也用来调节所述溶液的ph。滴定后所述粒度分布分析的结果和相应的缓冲溶液的ph示于表4中。从表4所示的数据得出结论,采用ph3至9的缓冲溶液适合于所述微粒化工艺的实施方案。得到的数据显示,基于所述颗粒的总体积计,超过99体积%的颗粒具有小于5μm的粒度。因此,基于所述微粒化胰岛素颗粒的总体积计,所述微粒化胰岛素颗粒可以包括99体积%或更多(例如99至100体积%)的粒度小于5μm的颗粒。在这些实施方案中,基于所述微粒化胰岛素颗粒的总体积计,所述微粒化胰岛素颗粒可以包括多至99体积%的粒度小于5μm的颗粒。表4不同ph下生成的胰岛素粒度实施例7:使用异丙醇共溶剂制备可吸入人胰岛素颗粒的方法根据实施例1所述制备可吸入人胰岛素颗粒,不同的是在滴定完成或基本上完成后,使用异丙醇来替代实施例1的添加至所述悬浮液的乙醇。如实施例2所述分析了所得的可吸入人胰岛素颗粒的粒度分布。所述粒度分布分析的结果示出了所述可吸入人胰岛素颗粒的体积平均直径为1.27μm。实施例8:使用丙酮共溶剂制备可吸入人胰岛素颗粒的方法根据实施例1所述制备可吸入人胰岛素颗粒,不同的是在所述滴定完成或基本上完成后,使用丙酮来替代实施例1的添加至所述悬浮液的乙醇。如实施例2所述分析了所得的可吸入人胰岛素颗粒的粒度分布。所述粒度分布分析的结果示出了所述可吸入人胰岛素颗粒的体积平均直径为1.32μm。实施例9:用于使甘精胰岛素类似物微粒化为可吸入颗粒的的方法甘精胰岛素是长效人胰岛素类似物。本文使用的甘精胰岛素是通过超滤商购得到的甘精胰岛素获得的。甘精胰岛素在使用前经洗涤并冻干。将70mg的经洗涤和冻干的甘精胰岛素溶解在7.7ml的ph约2.2的酸性溶液中,所述酸性溶液是基于所述酸性溶液的总体积计90体积%甲醇和10体积%水的混合物,以形成包含甘精胰岛素的溶解的胰岛素溶液。在所述甘精胰岛素完全溶解后,逐滴添加1.75ml的ph为6.9的磷酸盐缓冲溶液以滴定溶解的甘精胰岛素溶液。向溶液加入10ml的乙醇。上述溶解、滴定和加入乙醇在稳定(基本上连续)的搅拌下进行。澄清的溶解的甘精胰岛素溶液成为包括微粒化甘精胰岛素颗粒(微粒化甘精胰岛素颗粒)的乳白色悬浮液。分离、洗涤并干燥微粒化甘精胰岛素颗粒。使用根据实施例2所述的激光衍射测试分析了微粒化甘精胰岛素颗粒的粒度分布。颗粒分布分析显示,所述微粒化甘精胰岛素颗粒的体积平均直径为2.27μm。图8是所述微粒化甘精胰岛素颗粒的扫描电子显微术(sem)图像。图9是溶解的微粒化甘精胰岛素颗粒的hplc色谱图。图9所示的hplc结果的保留时间表明所述甘精胰岛素的化学性质在微粒化过程期间没有改变(或基本上没有改变)。图10和图11的图示出从使用hfa134a作为推进剂的剂量计量吸入器递送的所述甘精胰岛素颗粒的安德森级联冲击器研究的结果。剂量计量吸入器如下文根据实施例11所述制备。图10和图11显示的研究结果证明了一致或基本上一致的胰岛素肺部递送模式。实施例10:用于使微粒化门冬胰岛素类似物微粒化为可吸入颗粒的方法门冬胰岛素是一种速效胰岛素类似物。本文使用的门冬胰岛素是通过超滤(从novonordisk,denmark购买)获得的。所述经超滤的门冬胰岛素在使用前经洗涤并冻干。将70mg的经洗涤和冻干的门冬胰岛素溶解在7.7ml的ph约2并且包括hcl的酸性溶液中,以形成包含门冬胰岛素的溶解的胰岛素溶液。在门冬胰岛素完全溶解后,逐滴添加4.2ml的ph为5.64的乙酸盐缓冲溶液,以滴定所述溶解的门冬胰岛素溶液。向所述溶液添加78ml的乙醇以获得悬浮液。上述溶解、滴定和添加乙醇在稳定(基本上连续)的搅拌下进行以在洗涤前使颗粒稳定。澄清的溶解的门冬胰岛素溶液变为包含微粒化门冬胰岛素颗粒(微粒化门冬胰岛素颗粒)的乳白色悬浮液。分离、洗涤并干燥所述微粒化门冬胰岛素颗粒。利用根据实施例2所述激光衍射测试分析了所述微粒化门冬胰岛素颗粒的粒度分布。颗粒分布分析显示所述微粒化门冬胰岛素颗粒的体积平均直径为2.72μm。图12是所述微粒化门冬胰岛素颗粒的扫描电子显微术(sem)图像。图13是溶解的所述微粒化门冬胰岛素颗粒的hplc色谱图。图13所示的hplc结果的保留时间表明在微粒化过程期间所述门冬胰岛素的化学性质没有改变(或基本上没有改变)。图14和图15的图示出从使用hfa134a作为推进剂的剂量计量吸入器递送的所述门冬胰岛素颗粒的安德森级联冲击器研究的结果。剂量计量吸入器如下文根据实施例11所述制备。图14和图15显示的研究结果证明了一致或基本上一致的胰岛素肺部递送模式。实施例11:用于体外安德森级联冲击器测试的剂量计量吸入器的制备剂量计量吸入器(mdi)根据以下工艺制备。将合适或适当量的微粒化人胰岛素api(例如微粒化人胰岛素颗粒或微粒化人胰岛素类似物颗粒)和乙醇填充到吸入器罐中。然后通过使用vwraquasonic应用超声能量混合所述罐的内容物5分钟,以获得均匀的或基本上均匀的悬浮液。添加不同的推进剂,例如hfa134a、hfa227或其混合物,并且利用合适的阀通过夹紧来密封该罐。将微粒化人胰岛素(例如微粒化人胰岛素颗粒或微粒化胰岛素类似物颗粒)作为活性成分填充至剂量计量吸入器(mdi)中。吸入器中人胰岛素或胰岛素类似物的浓度为3mg/g。图7、图11和图15所示的安德森级联冲击器数据与使用激光衍射粒度分析仪观察到的粒度分布结果很好地对应。在本文提供的安德森级联冲击器数据中,释放的剂量是指沉积在安德森级联冲击器上的人胰岛素或胰岛素类似物的百分比。通过本文公开的方法的实施方案而微粒化的人胰岛素颗粒的表面的形状和粗糙度(或平滑度)是非常合适的或有利的(例如适用于或有利于肺部递送)。经由喷射研磨的微粒化是将颗粒从毫米尺寸范围研磨至更小的微米尺寸范围的常用方法。喷射研磨过程涉及颗粒之间的频繁碰撞以及由高速气流引起的与研磨室的壁的碰撞。利用气流的圆周运动和离心力从研磨室中提取由喷射研磨产生的微粒化颗粒。这些机械力可能破坏微粒化颗粒的表面和形状,例如,如下面比较例1所述,这可能不利于或不适用于肺部递送。实施例12.适用于制药应用的高纯度微粒化可吸入胰岛素颗粒在包括离心搅拌器或搅拌棒的400ml烧杯中,将一(1)克生物合成人胰岛素api粉末(即来自amphastarfrancepharmaceuticalss.a.s.的重组胰岛素)溶解于110mlph为约1.9的酸性溶液中,所述酸性溶液是90体积%甲醇和10体积%水的混合物。搅拌所得溶液直至胰岛素溶液完全溶解或基本上完全澄清以形成胰岛素纯溶液。然后,将搅拌减慢至较慢模式(例如约50rpm的转速),并逐滴添加25ml的0.1mnaac/hac缓冲溶液(ph为5.64)以滴定所述溶解的胰岛素溶液。澄清的溶解的胰岛素溶液变成乳白色和发黄色的包括微粒化胰岛素颗粒的悬浮液。滴定完成或基本上完成后,向悬浮液中加入约135ml乙醇(未调节ph),继续搅拌30分钟以稳定颗粒并提高产率。通过超滤将微粒化胰岛素颗粒与悬浮液的上清液分离,并用乙醇洗涤固体两次以除去甲醇和盐。如果溶剂杂质多,则可以重复洗涤和浓缩过程。将固体在室温下真空干燥。如上文实施例2所述进行胰岛素的洗涤过程和浓缩。所得微粒化胰岛素的粒度为1.61μmvmd。使用相同的方法制备0.5g批次的更多份,用于纯度和杂质测试。测试所获得的三(3)批胰岛素颗粒的纯度和杂质情况,并基于干重列于下面的表5中(例如,结果显示为基于干重相对于胰岛素颗粒总重量的重量%)。表5胰岛素颗粒纯度和杂质情况的测试结果表5中的数据显示了所有三(3)份:●获得的胰岛素颗粒的纯度在98%以上(例如,基于胰岛素颗粒的总重量计,胰岛素颗粒中胰岛素的纯度基于干重在98重量%以上);●最终产品中的a21脱酰胺含量小于0.40%(例如,基于胰岛素颗粒的总重量计,基于干重0.40重量%),并且微粒化胰岛素相关化合物为约1.1%(例如,基于胰岛素颗粒的总重量计,基于干重为1.1重量%),低于usp标准的2重量%;●人胰岛素中的高分子量蛋白质为约0.3%(例如,基于胰岛素颗粒的总重量计,基于干重为0.3重量%),低于usp标准的1%;●甲醇溶剂杂质的量不大于0.009%(例如,基于胰岛素颗粒的总重量计,基于干重为0.009重量%);●乙酸盐非溶剂杂质(乙酸盐)的量不大于0.07%(例如,基于胰岛素颗粒的总重量计,基于干重为0.07重量%);和●所得胰岛素颗粒的纯度大于98%(例如,基于胰岛素颗粒的总重量计,胰岛素颗粒中胰岛素的纯度基于干重在98重量%以上)。实施例13.微粒化可吸入胰岛素颗粒中受控的锌含量在40ml小瓶中,将七十(70)mg生物合成人胰岛素(即从amphastarfrancepharmaceuticalss.a.s.获得的重组胰岛素)原料粉末溶解于7.7ml的ph为约1.9的酸性溶液中,所述酸性溶液是90%体积的甲醇和10%体积的水的混合物。将小瓶置于搅拌板的顶部,稳定搅拌所得溶液直至溶液完全溶解或基本上澄清以形成胰岛素纯溶液。然后,将搅拌减慢至较慢模式(例如约75rpm的转速),并逐滴加入1.75ml的ph为5.64的0.1m乙酸钠/乙酸(naac/hac)缓冲溶液以缓慢滴定所述溶解的胰岛素溶液。澄清的溶解的胰岛素溶液变成乳白色和发黄色的包括微粒化胰岛素颗粒的悬浮液。滴定完成或基本上完成后,向悬浮液中加入约10ml乙醇。继续搅拌30分钟以稳定颗粒并提供更高的产率。通过离心将微粒化胰岛素颗粒作为固体与悬浮液的上清液分离。将所述固体用乙醇洗涤两次以除去甲醇和盐。在室温下将所述固体真空干燥。在所述加工过程中,微粒化胰岛素中的锌含量没有显着变化:●加工前,胰岛素中的锌含量为0.39%(例如,基于生物合成人胰岛素的总重量计,为0.39重量%),●加工后,微粒化胰岛素中的锌含量为0.42%(例如,基于胰岛素颗粒的总重量计,基于干重为0.42重量%)。因此,在本公开的实施方案中,如果使用人胰岛素usp作为起始材料,微粒化颗粒中的锌含量将在1%以下(例如,基于胰岛素颗粒的总重量计,基于干重在1重量%以下)并且高于0.3%(例如,基于胰岛素颗粒的总重量计,基于干重高于1重量%)。实施例14.具有更高回收率的胰岛素微粒化工艺在包括离心搅拌器或搅拌棒的400ml烧杯中,将一(1)克生物合成人胰岛素api粉末(即来自amphastarfrancepharmaceuticalss.a.s.的重组胰岛素)溶解于110mlph为约1.9的酸性溶液中,所述酸性溶液是90体积%甲醇和10体积%水的混合物。搅拌所得溶液直至胰岛素溶液完全溶解或基本上完全澄清以形成胰岛素纯溶液。然后,将搅拌减慢至较慢模式(例如约50rpm的转速),并逐滴添加25ml的0.1mnaac/hac缓冲溶液(ph为5.64)以滴定所述溶解的胰岛素溶液。所述澄清的溶解的胰岛素溶液变成乳白色和发黄色的包括微粒化胰岛素颗粒的悬浮液。滴定完成后,向悬浮液中加入2-8℃下的约135ml乙醇。在2-8℃下继续搅拌30分钟,以稳定粒度和提高产率。通过超滤将微粒化胰岛素颗粒作为固体从悬浮液的上清液中分离,并用乙醇洗涤固体两次以除去甲醇。将获得的微粒化胰岛素固体在室温下真空干燥。共获得0.92克微粒化胰岛素。采用该工艺的胰岛素回收率为92%(例如,基于最终产品的总重量计,胰岛素颗粒的产率为92重量%)。实施例15.与mdi配方和组成相适应的胰岛素微粒化工艺在包括离心搅拌器或搅拌棒的400ml烧杯中,将一(1)克生物合成人胰岛素api粉末(即来自amphastarfrancepharmaceuticalss.a.s.的重组胰岛素)溶解于110mlph为约1.9的酸性溶液中,所述酸性溶液是90体积%甲醇和10体积%水的混合物。搅拌所得溶液直至胰岛素溶液完全溶解或基本上完全澄清以形成胰岛素纯溶液。然后,将搅拌减慢至较慢模式(例如约50rpm的转速),并逐滴添加25ml的0.1mnaac/hac缓冲溶液(ph为5.64)以滴定所述溶解的胰岛素溶液。所述澄清的溶解的胰岛素溶液变成乳白色和发黄色的包括微粒化胰岛素颗粒的悬浮液。滴定完成后,向悬浮液中加入在2-8℃下的约135ml乙醇。在2-8℃的温度下继续搅拌30分钟以稳定粒度并在洗涤前获得更高的产率。通过采用来自加利福尼亚ranchodominguez的spectrumlab的500kd改性聚醚砜膜超滤,从悬浮液的上清液中浓缩微粒化胰岛素颗粒。将胰岛素颗粒的悬浮液浓缩至5-10ml,用100ml乙醇洗涤三次以除去杂质,如甲醇和盐。用所获得的胰岛素颗粒容易地加工和混合剂量计量吸入器或mdi产品(一种肺部产品)。比较例1.通过喷射研磨制备人胰岛素颗粒通过采用75psi的研磨n2压力以及约1g/min的进料速率的喷射研磨,制备了人胰岛素颗粒。图16是采用所述喷射研磨方法微粒化的人胰岛素颗粒的原子力显微术(afm)图像。如图16的图像可看出,通过喷射研磨制备的人胰岛素颗粒具有粗糙的以及不规则的(或不均匀的)外观。图17是根据实施例2所述所微粒化的可吸入人胰岛素颗粒的apm图像。由于本文公开的工艺的实施方案在室温下进行并且不涉及机械力和/或热量(或基本上没有机械力和/或热量),所述微粒化人胰岛素颗粒具有更合适或更优选用于人肺部递送的形状和表面。根据一个实施方案,用于肺部药物产品的高纯度可吸入胰岛素材料包括:具有微米级粒度并且具有以下特征的胰岛素颗粒:(i)胰岛素颗粒的纯度基于干重不小于96重量%(例如,基于胰岛素颗粒的总重量计,胰岛素颗粒中存在的胰岛素的量基于干重不小于96重量%);(ii)任选地,胰岛素颗粒中锌的量基于干重不大于1重量%且不小于0.3重量%(例如,基于胰岛素颗粒的总重量计,基于干重不大于1重量%且不小于0.3重量%);(iii)胰岛素颗粒中胰岛素相关杂质的总量不超过2重量%(例如,基于胰岛素颗粒的总重量计,基于干重不超过2重量%);(iv)胰岛素颗粒中溶剂相关杂质的总量不超过0.03重量%,其中溶剂相关杂质不包括肺部产品中的共溶剂制剂组分(例如,基于胰岛素颗粒的总重量计,基于干重不大于0.03重量%);并且胰岛素颗粒中非溶剂相关杂质的总量不大于0.3重量%(例如,基于胰岛素颗粒的总重量计,基于干重不大于0.3重量%)。胰岛素颗粒可进一步包括以下任意或所有特征。所述微粒化胰岛素颗粒可以包括选自人胰岛素、动物胰岛素、胰岛素类似物及其任意混合物的胰岛素。所述胰岛素类似物可以选自门冬胰岛素、甘精胰岛素及其任意混合物。所述胰岛素颗粒可以是基本上球形的(例如,大致为球形)的形状,并且具有小于5μm的粒度。基于所述微粒化胰岛素颗粒的总体积计,99体积%的胰岛素颗粒可以包括粒度小于5μm的颗粒。所述胰岛素颗粒可以包括基本上球形(例如,大致为球形)的、具有约1μm至2μm的体积平均粒径(例如,d50)的颗粒。根据一个实施方案,制备高纯度的、具有适用于肺部药物产品的微米级粒径的、可吸入胰岛素的高效方法,所述方法包括:(1)将胰岛素原料溶解在酸性溶液中以形成溶解的胰岛素溶液;(2)用缓冲溶液滴定溶解的胰岛素溶液以形成包含具有微米级粒度的胰岛素颗粒(例如微粒化胰岛素颗粒)的悬浮液;(3)用溶剂稳定所述胰岛素颗粒(例如微粒化胰岛素颗粒);(4)浓缩包含所述胰岛素颗粒(例如微粒化胰岛素颗粒)的悬浮液;并且用溶剂洗涤所述悬浮液并进一步浓缩所述悬浮液,其中所得的经洗涤和浓缩的包含微粒化胰岛素颗粒的悬浮液准备好并适用于进一步加工以形成肺部产品,并且其中所述方法产生(例如,提供)具有微米级粒度的胰岛素颗粒,其中99%(例如,99体积%)的胰岛素颗粒(例如微粒化胰岛素颗粒)具有小于5μm的粒度且胰岛素颗粒(例如微粒化胰岛素颗粒)的体积平均粒径(例如,d50)为约1μm至2μm,并且其中胰岛素颗粒的纯度基于干重不小于96%(例如,基于胰岛素颗粒的总重量计,胰岛素颗粒中胰岛素的量基于干重不小于96重量%);任选地,胰岛素颗粒中锌的量基于干重不大于1%(例如,基于胰岛素颗粒的总重量计,基于干重不大于1重量%),并且不小于0.3重量%(例如,基于胰岛素颗粒的总重量计,基于干重);胰岛素颗粒中所有胰岛素相关杂质的总量不大于2%(例如,基于胰岛素颗粒的总重量计,基于干重不大于2重量%);胰岛素颗粒中溶剂相关杂质的总量不大于0.03%(例如,基于胰岛素颗粒的总重量计,基于干重不大于0.03重量%),其中所述溶剂相关杂质不包括肺部产品中的共溶剂制剂组分;并且胰岛素颗粒中非溶剂相关杂质的总量不大于0.3%(例如,基于胰岛素颗粒的总重量计,基于干重不大于0.3重量%)。该方法还可包括以下任意或全部。所述胰岛素原料可以包括选自结晶人胰岛素、结晶动物胰岛素、结晶胰岛素类似物(例如结晶人胰岛素类似物)及其任意混合物的结晶胰岛素。所述结晶胰岛素类似物可以选自结晶门冬胰岛素、结晶甘精胰岛素及其任意混合物。所述酸性溶液可以包括水和甲醇。基于酸性溶液的总体积计,所述酸性溶液可以包括10体积%至90体积%的量的甲醇。所述酸性溶液的ph可以在1至3的范围内。所述酸性溶液的ph可以在1.5至2.5的范围内。所述酸性溶液可以在室温下制备。采用包含乙酸钠和乙酸的缓冲溶液进行所述酸性溶液的滴定。所述滴定可以在ph3至9的范围内进行。所述滴定可以在ph4.5至7.5的范围内进行。所述滴定可以在室温下进行。所述稳定可以包括向所述悬浮液中加入包含乙醇的稳定剂。所述包含乙醇的稳定剂的体积可以是所述胰岛素溶液(例如,溶解的胰岛素溶液)的体积的0.5至2倍大。所述包含乙醇的稳定剂可以具有中性ph。所述包含乙醇的稳定剂的温度可以在0至25℃的范围内。在一些实施方案中,所述稳定剂的加入提高所述胰岛素颗粒的产率。包含所述胰岛素颗粒的悬浮液的洗涤可以包括用乙醇洗涤所述悬浮液。所述乙醇的温度可以是0至25℃。所述悬浮液可以是经浓缩的悬浮液。在一些实施方案中,所得的包含胰岛素颗粒和乙醇的经浓缩的悬浮液和由所得经浓缩的悬浮液制备的干燥胰岛素颗粒准备好用于进一步加工以形成肺部产品。所述洗涤和浓缩可以重复数次(例如,多次)。所述可吸入胰岛素颗粒的产率可以是75%或更高(例如,基于最终产品的总量计,例如基于干重,可吸入胰岛素颗粒的产率可以是75重量%或更高)。所述可吸入胰岛素颗粒的产率可以是85重量%或更高(例如,基于最终产品的总重量计,所述可吸入胰岛素颗粒的产率可以是85重量%或更高)。虽然已经结合某些实施方案描述了本发明,但是应当理解,本发明不限于所公开的实施方案,而相反的,旨在涵盖在所附权利要求及其等效变化的精神和范围内包括的各种变形和等效安排。在整个文本和权利要求中,所有如相关领域的普通技术人员所理解的,术语“约”和“基本上”用作近似的术语,而不是程度的术语,并且反映与测量、有效数字和可互换性相关联的固有变动。此外,应当理解,除非另有说明,在整个本公开的以及所附的权利要求中,即使数值前没有术语“约”,其也被该术语隐含地修饰。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1