一种骨组织三维微纳尺度预制血管网络的构建系统和方法与流程
本发明涉及一种骨组织三维微纳尺度预制血管网络的构建系统和方法,应用于生物制造技术领域。
背景技术:
组织工程的最终目标是植入人造组织或器官来代替人体内的病变部位,为组织或器官移植提供不同的解决方案,以提高生活质量、延长生命活动。生物3d打印技术在再生组织修复方面有了很大的进展,已经制备了大量的生物支架应用于临床,如皮肤、骨骼、软骨和神经。但仍有一些技术障碍需要克服,其中之一是构建三维微纳尺度预制血管网络,特别是对于尺寸较小的组织和器官。血管网络起到向组织和器官递送营养物质和排除新陈代谢产物的作用,避免体内组织器官坏死。因此,组织工程结构的预血管化对于将体外制造的组织有效地转移至临床医学有着极其重要的意义。
目前,一些研究人员已经用不同的方法获得了可灌注的预制血管网络。其中一种方法是用3d打印将牺牲模块应用于生物制造过程,牺牲模块包裹在水凝胶中,待水凝胶成型后溶解掉牺牲模块,从而形成具有含预制血管网络的支架。海藻酸钠和琼脂糖等水凝胶已被用作支架材料,在合成材料、pdms和纤维支架上填充水凝胶,溶解牺牲模块以形成三维血管网络结构。可溶于水的蔗糖也可以用来产生圆柱形微流体通道,从而制造三维血管结构。虽然这种方法可以制造出类似于人体骨组织三维血管网络结构,但所得到的血管通道的尺寸比较大,不适用人体较小尺度的血管网。因此,这种方法并不能有效地解决骨组织微纳尺度预制血管化网络制造的的问题。
技术实现要素:
为了解决现有技术问题,本发明的目的在于提供一种骨组织三维微纳尺度预制血管网络的构建系统和方法,利用电流体动力学直写工艺与减材制造技术相结合制造微纳尺度的预制血管通道结构,直写含聚合物ⅰ和聚合物ⅱ的混合溶液制备三维微纳尺度预制血管网络,使得所构建的预制血管网络结构具有三维微纳尺度,以便更好地模拟骨组织的血管结构,进行快速修复,提高修复速率。
为达到上述目的,本发明采用下述技术方案:
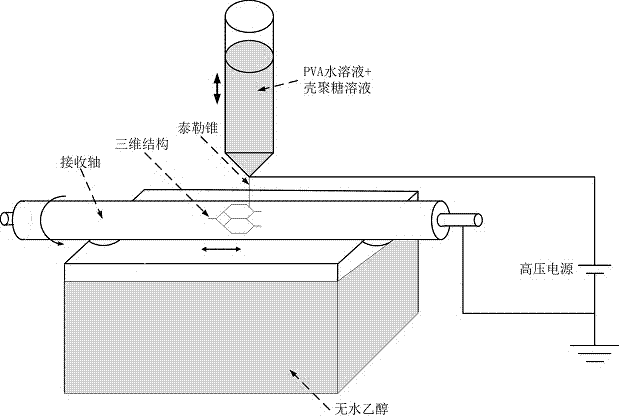
一种骨组织三维微纳尺度预制血管网络的构建系统,包括3d打印机,医用注射器,旋转接收圆轴,无水乙醇浴缸和高压电源,所述医用注射器安装在3d打印机上,医用注射器的针头与高压电源的正极相连,作为3d打印喷头,所述旋转接收圆轴安装在3d打印喷头下方,通过电机驱动旋转,所述旋转接收圆轴与高压电源的地线相连,在旋转接收圆轴下方放置无水乙醇浴缸;在高压电场作用下,产生静电力形成泰勒锥,电纺丝射流稳定可控,一步实现纤维丝的精确定位与形貌控制,形成未固化的流体纤维,在无水乙醇的催促挥发下形成固化的纤维。所述旋转接收圆轴的可以为铝合金圆轴。
一种骨组织三维微纳尺度预制血管网络的构建方法,使用上述的骨组织三维微纳尺度预制血管网络的构建系统,包括如下步骤:
a.采用聚合物ⅰ和聚合物ⅱ的共混液作为牺牲材料,以无水乙醇为催发剂,旋转接收圆轴为接收装置,将高压电源的正极与3d打印喷头相连,地线与旋转接收圆轴相连,当有电压时形成的纤维丝将喷头与旋转接收圆轴连接,形成闭合的通路,通过缩短喷头与旋转接收圆轴的距离实现对直写过程的控制;
b.将在步骤a中喷头换为规格为20g的针头,在3d打印机中输入牺牲结构的编码程序并运行,在高压电场作用下,电荷借助电极,通过分子极化以及电解质电离的方式形成流体纤维,在旋转接收圆轴上打印出微纳尺度的流体纤维,并通过逐层叠加的方式制备三维牺牲结构,同时旋转接收圆轴在转动时与无水乙醇接触,从而快速形成具有三维结构的聚合物ⅰ和聚合物ⅱ共混的牺牲模块;
c.采用水凝胶作为骨支架材料,mtg酶为交联剂,石蜡作为涂覆剂;在步骤b中制备的三维微纳尺度牺牲模块形成后,在其表面涂覆一层液体石蜡,之后放置在37℃干燥箱中以干燥石蜡,同时用去离子水配置15%的水凝胶,放置60℃水浴中进行搅拌,直至水凝胶颗粒均匀溶解并且温度降到30℃,此时加入mtg酶以交联水凝胶溶液,水凝胶与mtg酶的质量比为10:1;之后将三维牺牲模块放在水凝胶中并在37℃下保持4h以交联水凝胶;
d.将在步骤c中含有三维牺牲模块的水凝胶采用医用微创手术刀剪切去除多余部分,露出三维牺牲模块的头部与尾部,将含有三维牺牲模块的水凝胶放在培养皿以溶解牺牲模块,从而得到三维微纳尺度预制血管网络通道。
作为本发明第一种优选技术方案,在步骤a和b中,聚合物ⅰ和聚合物ⅱ分别为pva和壳聚糖;在步骤c和d中,水凝胶为明胶。
作为本发明第二种优选技术方案,在步骤a和b中,聚合物ⅰ和聚合物ⅱ分别为pga和壳聚糖;在步骤c和d中,水凝胶为明胶。
作为本发明第三种优选技术方案,在步骤a和b中,聚合物ⅰ和聚合物ⅱ分别为pva和壳聚糖;在步骤c和d中,水凝胶为载有人骨髓间充质干细胞的明胶。
作为本发明第四种优选技术方案,在步骤a和b中,聚合物ⅰ和聚合物ⅱ分别为pga和壳聚糖;在步骤c和d中,水凝胶为载有人骨髓间充质干细胞的明胶。
载有人骨髓间充质干细胞的明胶的配制方法为:在配制明胶时,从培养箱中取出正在培育中的第五代人骨髓间充质干细胞,经胰蛋白酶作用使细胞离散、离心机离心等步骤,倒掉离心管中的上清液部分获得人骨髓间充质干细胞,向该离心管中加入合适的细胞培养液并均匀吹打,然后用移液管将含有干细胞的液体移入步骤c中的明胶溶液中、搅拌均匀,从而获得含有人骨髓间充质干细胞的明胶溶液,所有步骤均在无菌环境下操作,加入的人骨髓间充质干细胞有向成骨细胞分化的作用,其利于骨组织的生长。
本发明与现有技术相比较,具有如下显而易见的突出实质性特点和显著优点:
1.与现有的针对组织修复制作的预制血管网络结构相比较,本发明在采用电流体动力学直写打印牺牲材料,以形成三维牺牲模块,实现微观尺度预制血管网络的制造;
2.本发明制备三维微纳尺度牺牲模块所用的材料易溶于水,整个过程无有害物质产生,且材料易获得;
3.本发明制备预制血管网络可更换不同内径的针头,以满足不同的应用要求,灵活性较高;
4.本发明含有三维微纳尺度预制血管网络的骨支架制备工艺简单,直写的三维牺牲模块只需挥发固化即可获得结构形状。
本发明针对骨缺损修复中至关重要的三维微纳尺度预制血管网络问题进行设计,将电流体动力学直写工艺和减材制造技术相结合,所采用的方法为电流体动力学直写打印牺牲材料,该方法借助计算机辅助设计和精密机械,精确控制悬浮液的沉积,在高压电场作用下,电荷借助电极,通过分子极化以及电解质电离等方式形成流体纤维,并通过逐层叠加的方式制备纳米或亚微米且具有高分辨率的三维牺牲模块结构,接着采用水凝胶进行涂覆或者填充,将牺牲模块进行溶解,此时就会在水凝胶块中形成三维预制血管网络的通道。
附图说明
图1是本发明骨组织三维微纳尺度预制血管网络的构建系统结构示意图。
图2是本发明实施例一电流体动力学直写的示意图。
图3是本发明实施例一三维微纳结构预制血管网络通道及方法的流程图。
图4是本发明中不同三维微纳尺度的牺牲模块示意图。
具体实施方式
本发明的优选实施例结合附图详述如下:
如图1和图2所示,一种骨组织三维微纳尺度预制血管网络的构建系统,包括3d打印机,医用注射器,旋转接收圆轴,无水乙醇浴缸和高压电源,所述医用注射器安装在3d打印机上,医用注射器的针头与高压电源的正极相连,作为3d打印喷头,所述旋转接收圆轴安装在3d打印喷头下方,通过电机驱动旋转,所述旋转接收圆轴与高压电源的地线相连,在旋转接收圆轴下方放置无水乙醇浴缸;在高压电场作用下,产生静电力形成泰勒锥,电纺丝射流稳定可控,一步实现纤维丝的精确定位与形貌控制,形成未固化的流体纤维,在无水乙醇的催促挥发下形成固化的纤维。
如图4所示,将喷头更换不同规格的医用针头,可形成多尺度的三维微纳牺牲模块,从而实现骨组织三维微纳多尺度预制血管网络的构建,以满足不同的应用要求。
实施例1:
在本实施例中,参见图1~图3,一种骨组织三维微纳尺度预制血管网络的构建方法,包括如下步骤:
a.采用pva水溶液和壳聚糖溶液的共混液作为牺牲材料,以无水乙醇为催发剂、可协调运动的铝合金圆轴作为接收装置,将高压电源的正极与3d打印喷头相连,地线与旋转接收圆轴相连,当有电压时形成的纤维丝将喷头与旋转接收圆轴连接,形成闭合的通路,通过缩短喷头与旋转接收圆轴的距离实现对直写过程的控制;
b.将在步骤a中喷头换为规格为20g的针头,在3d打印机中输入牺牲结构的编码程序并运行,在高压电场作用下,电荷借助电极,通过分子极化以及电解质电离等方式形成流体纤维,在铝合金圆筒接收装置上打印出微纳尺度的流体纤维并通过逐层叠加的方式制备三维牺牲结构,同时圆筒在转动时与无水乙醇接触,从而快速形成具有三维结构的pva和壳聚糖共混的牺牲模块;
c.在步骤b中制备的三维微纳尺度牺牲模块形成后,在其表面涂覆一层液体石蜡,之后放置在37℃干燥箱中以干燥石蜡,同时用去离子水配置15%的明胶,放置60℃水浴中进行搅拌,直至明胶颗粒均匀溶解并且温度降到30℃,此时加入mtg酶(明胶与mtg酶的质量比为10:1)以交联明胶溶液,之后将三维牺牲模块放在明胶中并在37℃下保持4h以交联明胶;
d.将在步骤c中含有三维牺牲模块的明胶采用医用微创手术刀剪切去除多余部分,露出三维牺牲模块的头部与尾部,将含有三维牺牲模块的明胶放在培养皿以溶解牺牲模块,从而得到三维微纳尺度预制血管网络通道。
在本实施例中,参见图1~图3,利用pva和壳聚糖的可打印性,将pva水溶液和壳聚糖溶液的共混液在圆轴上用电流体动力学直写技术进行打印,直写打印出的结构表面涂覆一层石蜡,再放进配置好浓度的明胶中裹覆,使其结构固定并具有一定的强度。首先将高压电源的正极与医用规格为20g的针头相连、地线与铝合金圆轴相连,然后利用pva和壳聚糖可以与水完全溶解的特性,将pva制成pva水溶液、壳聚糖配成溶液,在以铝合金圆轴作为接收装置的3d打印机上进行电流体动力学直写打印。因此,pva、壳聚糖和水需要进行一定的浓度选择,使所形成的三维结构表面具有一定的平滑性和粘附性。在电流体动力学直写打印过程中,输入牺牲结构的编码程序并运行,在高压电场作用下,电荷借助电极,通过分子极化以及电解质电离等方式形成流体纤维,并通过逐层叠加的方式制备三维血管结构。微纳结构的pva和壳聚糖牺牲模块打印成形后,将此结构放在液体石蜡中涂覆一层石蜡,使微纳尺度的纤维在填充明胶后不发生变形且具有一定的强度。将含有牺牲模块的明胶放在冰箱和干燥箱中进行冷冻干燥,之后含有三维pva和壳聚糖牺牲模块的明胶采用医用微创手术刀剪切去除多余部分,露出三维牺牲模块的头部与尾部,将含有三维牺牲模块的明胶放在培养皿以溶解牺牲模块,从而得到三维微纳尺度预制血管网络通道。本实施例用于生物制造领域,采用将电流体动力学直写工艺和减材制造技术相结合的方法,利用pva和壳聚糖的可溶性和可打印性来制备微纳尺度的血管结构,以此来模拟组织工程中骨缺损修复等血管化存在的微纳尺度血管网络的构建问题。本实施例构建微纳尺度血管网络的方法是根据直写打印出的pva和壳聚糖三维形状由无水乙醇催发pva水溶液和壳聚糖溶液制得的,所需材料极易获得。借助于pva和壳聚糖的可打印性来成型微纳尺度的血管结构,解决了采用生物3d打印技术无法获得微纳尺度血管结构网络的问题。对于临床医学上解决人体组织修复问题中的血管尺度问题具有重要意义。
实施例2:
本实施例与实施例一基本相同,特别之处在于:
在本实施例中,一种骨组织三维微纳尺度预制血管网络的构建方法,聚合物ⅰ材料采用pga,包括如下步骤:
a.采用pga水溶液和壳聚糖溶液的共混液作为牺牲材料,以无水乙醇为催发剂、可协调运动的铝合金圆轴作为接收装置,将高压电源的正极与3d打印喷头相连,地线与旋转接收圆轴相连,当有电压时形成的纤维丝将喷头与旋转接收圆轴连接,形成闭合的通路,通过缩短喷头与旋转接收圆轴的距离实现对直写过程的控制;
b.将在步骤a中喷头换为规格为20g的针头,在3d打印机中输入牺牲结构的编码程序并运行,在高压电场作用下,电荷借助电极,通过分子极化以及电解质电离等方式形成流体纤维,在铝合金圆筒接收装置上打印出微纳尺度的流体纤维并通过逐层叠加的方式制备三维牺牲结构,同时圆筒在转动时与无水乙醇接触,从而快速形成具有三维结构的pga和壳聚糖共混的牺牲模块;
c.本步骤与实施例1相同;
d.本步骤与实施例1相同。
实施例3:
本实施例与前述实施例1基本相同,特别之处在于:
在本实施例中,一种骨组织三维微纳尺度预制血管网络的构建方法,水凝胶采用载有人骨髓间充质干细胞的明胶,包括如下步骤:
a.本步骤与实施例1相同;
b.本步骤与实施例1相同;
c.在步骤b中制备的三维微纳尺度牺牲模块形成后,在其表面涂覆一层液体石蜡,之后放置在37℃干燥箱中以干燥石蜡,同时用去离子水配置15%的明胶,放置60℃水浴中进行搅拌,直至明胶颗粒均匀溶解并且温度降到30℃,此时加入mtg酶(明胶与mtg酶的质量比为10:1)以交联明胶溶液,在配制明胶时,从培养箱中取出正在培育中的第五代人骨髓间充质干细胞,经胰蛋白酶作用使细胞离散、离心机离心等步骤,倒掉离心管中的上清液部分获得人骨髓间充质干细胞,向该离心管中加入合适的细胞培养液并均匀吹打,然后用移液管将含有干细胞的液体移入步骤c中的明胶溶液中、搅拌均匀,从而获得含有人骨髓间充质干细胞的明胶溶液,之后将三维牺牲模块放在明胶中并在37℃下保持4h以交联明胶,所有步骤均在无菌环境下操作;
d.本步骤与实施例1相同。
实施例4:
本实施例与前述实施例2基本相同,特别之处在于:
在本实施例中,一种骨组织三维微纳尺度预制血管网络的构建方法,聚合物ⅰ材料采用pga,水凝胶采用载有人骨髓间充质干细胞的明胶,包括如下步骤:
a.本步骤与实施例2相同;
b.本步骤与实施例2相同;
c.在步骤b中制备的三维微纳尺度牺牲模块形成后,在其表面涂覆一层液体石蜡,之后放置在37℃干燥箱中以干燥石蜡,同时用去离子水配置15%的明胶,放置60℃水浴中进行搅拌,直至明胶颗粒均匀溶解并且温度降到30℃,此时加入mtg酶(明胶与mtg酶的质量比为10:1)以交联明胶溶液,在配制明胶时,从培养箱中取出正在培育中的第五代人骨髓间充质干细胞,经胰蛋白酶作用使细胞离散、离心机离心等步骤,倒掉离心管中的上清液部分获得人骨髓间充质干细胞,向该离心管中加入合适的细胞培养液并均匀吹打,然后用移液管将含有干细胞的液体移入步骤c中的明胶溶液中、搅拌均匀,从而获得含有人骨髓间充质干细胞的明胶溶液,之后将三维牺牲模块放在明胶中并在37℃下保持4h以交联明胶,所有步骤均在无菌环境下操作;
d.本步骤与实施例1相同。
- 还没有人留言评论。精彩留言会获得点赞!