作为骨移植替代物的含有部分脱乙酰壳多糖的自硬化生物活性接合剂组合物的制作方法
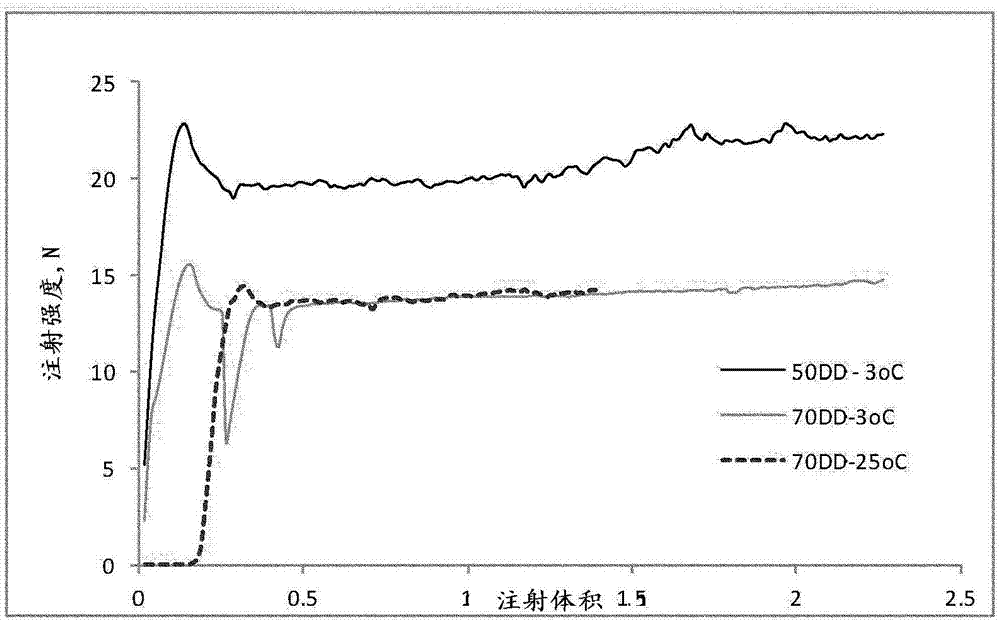
本申请是申请日为2013年4月23日、发明名称为“作为骨移植替代物的含有部分脱乙酰壳多糖的自硬化生物活性接合剂组合物”的中国发明专利申请no.201380029068.6的分案申请。发明领域本发明在骨折和骨缺陷的医疗领域内,其涉及部分脱乙酰壳多糖的化合物和组合物,及其医学用途。发明背景当疾病或创伤引起骨骼空洞时,或无论何时骨折的愈合受损时,通常的外科手术技术涉及从髂骨收集骨头并且将骨移植物转移至受伤部位。将这称为骨自体移植。自体移植用于填补骨空洞,提供了损伤有效愈合需要的骨传导和骨生成特性。通常认为这种技术是整形外科手术的金标准,但由于与骨收集相关的频繁发病,带来了严重的缺陷。因此,工业和学术界同样针对消除对骨自体移植的需求,需要具有骨传导和骨生成特性的骨移植替代物。这样的骨移植替代物通常称为合成骨移植替代物。迄今为止,没有出现单一的产品证明能给实质性地骨缺陷损伤侧提供了骨传导性以及骨生成特性。壳多糖是从甲壳动物壳获得的天然生物聚合物,但也可以获自其他无脊椎动物和真菌。通过壳多糖聚合物的n-乙酰葡糖胺残基的脱乙酰,通常通过用浓碱水解n-乙酰连接,获得壳聚糖。根据定义,壳聚糖通常描述为d-葡糖胺(d)和n-乙酰-d-葡糖胺(a)的共聚物,其不溶于ph高于6.2(游离胺基的等电点)的水中,但在低于约6.2的ph下溶解。通常,常规壳聚糖共聚物中约75-100%单体单元是d-葡糖胺,可以将其描述为75-100%脱乙酰壳聚糖,或具有75-100%的脱乙酰程度(dd)。因此,这样的材料中的0-25%单体是n-乙酰-d-葡糖胺基因(a)。当脱乙酰的程度低于约75%时,壳多糖聚合物呈现出不同的溶解特性,这样具有从约75%降至约40%dd的材料通常称为部分脱乙酰壳多糖,在本文中称为pdc。本发明的发明人之前已经描述了部分脱乙酰壳多糖聚合物和寡聚物的生物特性。wo03/026677描述了pdc寡聚物用于治疗类风湿性病症的用途。wo2006/134614讨论了部分脱乙酰壳多糖聚合物和寡聚物的生物特性,并且讨论了这样的寡聚物怎样作为壳多糖酶的阻断剂。chaecho等(j.craniofacialsurgeryvol.16no2,2005年3月)描述了使用含有壳聚糖-硫酸钙复合物的固体小球的实验及其对兔子中有缺陷的胫骨的骨生成的作用,使用具有90%dd的壳聚糖。yamada等,(j.biomed.matresearchvol.66ano.3,2003年9月1日,pp500-506)研究和讨论了壳聚糖对生物矿化作用的效果,并且研究了补充至培养基中的壳聚糖对成骨细胞的作用。klokkevold等(jperiodontol.1996年11月;67(11):1170-75)评价了壳聚糖对成骨祖细胞分化的作用。wo2004/028578公开了用于刺激骨-形成和骨-固结的组合物,其包含骨形态形成蛋白(bmp)作为制剂中的活性成分,使用三聚磷酸盐和壳聚糖的溶液,其中两种溶液将在混合时立即固化,在临床中引起特定的操作问题。wo01/41822描述了自胶凝矿物质-聚合物混合制剂,其包含(i)包含溶解的壳聚糖并且具有6.5至7.4ph的水基热胶凝液体成分,和(ii)包含钙的固体成分,所述液体和固体成分混合在一起形成非硬化热胶凝组合物,其在体温下形成凝胶。wo2006/057011公开了以1:1比例共同沉淀的羟磷灰石和壳聚糖的固体植入物(壳聚糖具有87%的脱乙酰程度),以及具有“油灰”-样稠度的组合物,含有总共5%壳聚糖、磷酸钙和聚二甲基硅氧烷,并且固液比为2:1。油灰-糊状物的凝固时间短于6分钟。测试了糊状物用于愈合大鼠中的诱导性骨损伤。本领域通常认为壳聚糖自身不是骨传导性的(参见,例如,venkatesan和kim,“chitosancompositesforbonetissueengineering-anoverview(用于骨组织工程化的壳聚糖组合物-综述”,mardrugs2010;8(8):2252-2266。为了有效且低成本的骨愈合治疗,仍然很重视可替换的且更有效的,临床应用实用的产品的进一步研发。发明概述本发明的发明人已经仔细地研究了部分脱乙酰壳多糖(pdc)聚合物和寡聚物的生物作用,并且研发了新的且有效的刺激新骨组织再生的组合物。本发明提供了可注射的原位自硬化生物活性接合剂材料。本发明的组合物可用作人工骨移植替代物。组合物具有几个实际益处,如:-天然和无毒成分,在混合过程中没有冒烟或臭味,-良好的生物相容性且避免了宿主组织对外来物体的反应,-在固化过程中产热低,-允许空洞的注射和填补,没有任何相关渗漏,-良好的可塑性和可注射性,这使得允许使用最小入侵的技术(注射)来应用,-粘结性和良好的润湿区域的特性,允许注入潮湿的环境中,而没有过度分解或丢失完整性,-合适的工作时间,允许合适的施用时间,在原位具有相对快速的固化,-原位固化时接近生理ph和盐度,-良好的散装容积,允许液体成分(如,血液或血液成分、骨髓或蛋白质分离物的溶液等)的混合。-防止受损的宿主骨组织中疤痕组织形成,并且促进空洞填补组合物的表面上和内部的新骨组织的再生。-具有有益的抗微生物特性,并且因此有助于最小化感染的风险。本发明的新组合物依赖于pdc的特性,这取决于脱乙酰的程度和分子量,并且使用具有40-75%范围脱乙酰程度的pdc。其他参数可以合适地优化,如本文中进一步描述的。本发明的组合物作为试剂盒来提供,其具有包含pdc的固体部分和液体部分,在使用前混合。混合的组合物含有在1:1.2至1:6范围中,并且更优选在1:1.5至1:4的范围中的低固液比。本发明进一步提供了用于愈合骨缺陷和病症(如,骨折)的方法。附图简述图1:用于测量粘结性/分层的设置的说明。(1)水位,(2)接合剂组合物,(3)网。图2:具有不同脱乙酰程度(dd)的组合物的注射强度/阻力的测量,参见实施例2。图3:本发明的接合剂组合物的抗压强度,使用不同的脱乙酰程度和不同含量的pdc。图4:用于微-ct分析的下颌骨体积的标准化(参见实施例3)。包围下颌骨的整个后部的较大圆柱体(lc)和包围植入的组合物的小圆柱体(sc)的方向。图5:在植入后7天沿着大鼠下颌骨的表面形成的总体积,与第0天的总体积进行比较(0d70dd)。7-8个个体的平均和sem(实施例3)。图6:手术后14天,通过植入了70%dd聚合复合物的大鼠的下颌骨的横截面。截面在钻孔前面的1-2mm。上图显示了下颌骨的h&e染色的石蜡切片。下图呈现了通过相同下颌骨的相同区域的微-ct构造的横截面(参见实施例3)。图7:在右腿胫骨中接受了本发明的组合物的绵羊胫骨左腿中的空洞的微ct构造。该图表示了手术后3个月后三个不同平面(x、y和z)中的横截面(参见实施例4)。该图显示了怎样形成与钻孔同心的具有不同半径的实际圆柱体。图8:体内手术后3个月,三个不同平面(x、y和z)中接受了本发明组合物的右腿胫骨的微ct构造。贯穿植入组合物的内部,与矿化组织的分散岛一起,沿着组合物的表面,可以注意到密集的矿化组织。图9:本发明的植入组合物内部,具有2mm半径的实际球体内部形成了矿化(每mm3)。(参见实施例4)。图10:实际圆柱体r3和实际外壳r4-r3、r5-r4和r6-r5中的骨矿化(每mm3)。(参见实施例4)。空洞由e来表示,填补了本发明组合物的空洞由br来表示。图11:本发明的植入组合物的显微图像显示出植入组合物内部新骨的形成(参见实施例4)。发明详述本发明提供了易于使用的适用于骨外科手术的试剂盒,其包含分开包装并且通过γ照射灭菌的固体和液体部分。就在手术前,将液体部分与固体部分混合,产生液体或糊状接合剂。接合剂混合物可以方便地注入骨空洞或骨折中,并且具有良好的可塑性和良好的粘结性。其还允许使用最小入侵的技术,如通过针的注射在骨中应用。在其他实施方案中,将组合物施用于现有的骨表面上,例如,使用抹刀或类似工具来施用。如本文中所解释的,将本发明的组合物优化,通过刺激成骨细胞在植入的复合材料的表面和内部停留并增殖,来提供骨缺陷的机械支持并且增强新骨组织的再生。如就ph和盐度而言,通过形成理想的生理条件,和通过控制固液比的促进细胞渗透和复合物的生物降解性/再吸收,来获得这一效果。本发明进行了优化,以控制植入的复合物的物理化学和生物特性。这可以涉及以下的一种或多种:通过组合物的酸(其优选是磷酸)和部分脱乙酰的壳多糖的缓冲能力控制ph,通过仔细选择电解质来控制离子强度以及通过合适调节pdc聚合物的脱乙酰程度和组合物中的pdc的相对含量控制水结合能力/润湿区域特性和注射力。通过免疫系统的各种细胞表达的内源性家族18种壳多糖酶,在原位水解pdc,获得了成骨细胞的生物刺激物。这得到了我们在实施例3中进一步显示和讨论的数据的支持(参见实施例3“结果”)。这将产生pdc寡糖的生物活性分子物质的持续释放。因此,这些寡聚分子将随着复合材料分解而逐渐释放,并且扩散至邻近组织中,提供了成骨细胞的持续刺激,侵袭退化的复合物,其又将被新的骨组织替代。对于这个完整过程的优化,固液比起着关键作用。因此,为了优化以上特性,已经出人意料地发现了混合的组合物含有约1:1.2至约1:6范围的低的固液比是有利的。这对应于组合的混合物中约14wt%至45wt%固体部分的范围。优选,组合物具有约1:1.3至约1:4范围的固液比或约1:1.3至约1:3的范围,并且更优选在约1:1.5至约1:3的范围中,如在约1:2至约1:3的范围中,包括但不限于1:1.2、1:1.33、1:1.15、1:1.8、1:2、1:2.25、1:2.5、1:3和1:4的比例。(这些比例对应于组合混合物中44.4%、42.9%、40%、35.7%、33.3%、30.8%、28.6%、25%和20%的固体部分的重量含量)。具有优选的固液比(s/l)的接合剂组合物在人体中具有良好的粘结性(显示出少的分层)和良好的润湿区域特性,具有最小的分解,意味着材料维持其完整性,并且没有从注射位点扩散出来。这允许良好的空洞填补能力,包括渗入海绵状和多孔的骨中,对骨组织兼具有最初的和长期的粘附性。尽管低s/l比例可能导致接合剂降低的机械强度,优化的s/l比和壳聚糖含量促进了更快的接合剂降解,允许细胞更有效地渗入复合物中,并且成骨pdc和羟磷灰石可用于早期开始的骨再生。因此,低的初始机械强度得到早期开始的骨生成的补偿,并且随后新骨的形成,快速获得了机械负荷。可以以各种方式评价机械强度,其中一些描述于所附实施例1中。在特定的实施方案中,本发明的组合物具有在盐水溶液(0.9%nacl)中在37℃下24h固化后作为最终抗压强度测量的机械强度,在0.2至10n/mm2的范围中,如在0.5-5n/mm2的范围中,或在0.5-2.5n的范围中。作为所需的组合物的低s/l比的结果,本发明的固化接合剂组合物将具有相当大含量的游离水,表示所形成的复合植入物开放、多孔性质。因此,在优选的实施方案中,本发明的组合物在固化后具有约40-90%范围,或更优选,40-70wt%范围,如50-70wt%,如约55-65wt%,并且更优选60-65wt%,如约60wt%的游离水含量(通过在105℃下干燥24h释放的水)。这些值是指在体外形成的、在盐水溶液中固化24h(0.9%nacl)接合剂中测量的游离水含量。通常,s/l比越低,固化复合物干燥过程中失水量越多。例如,2的s/l比可以导致约60±5%固化湿重的失水量。可以以各种方式评价粘结性/分解或完整性丢失。发明人已经发现了通过将一定量的新鲜混合的组合物置于在含有盐溶液的烧杯中的液体表面下的网上(例如,大约1mm网),对于评价这种特性是有用的,其中用磁棒搅拌溶液。(参见实施例1中的更多描述)。优选,在短时间搅拌后,如10min,基本上所有的材料,如超过95%,或更优选,超过98%,并且再更优选,超过99%,并且最优选,超过99.9%仍然粘附。混合的组合物接合剂优选具有接近于中性的ph,或在约6.0至7.8的范围中,并且更优选在6.5至7.4的范围中,最优选约ph7。含有磷酸钙的固体部分通常基本上是碱性的,而为了中和碱性磷酸盐,液体部分通常是酸性的。在优选的实施方案中,液体部分包含一种或多种酸,所述酸选自但不限于磷酸、盐酸、抗坏血酸、乳酸、醋酸、柠檬酸、甲酸、丙酸、苹果酸和谷氨酸。足以中和混合组合物的酸的合适浓度/含量取决于组合物的s/l比、磷酸盐的含量以及pdc的dd。使用较低的s/l比(固体较少),需要较少含量的酸。本发明实施方案中优选的酸是磷酸。在优选的实施方案中,液体成分包含至少约5%磷酸,如约2.5-20wt%磷酸,如2.5-15wt%,或5-15%,如约5%,约8%,约10%,约12%或约15%。在其他有用的实施方案中,液体部分包括一种或多种其他的酸,作为磷酸的替换或除了磷酸以外另外的酸,如上述任一种或多种酸。在这些实施方案中,酸的总量应当优选在混合碱性固体部分和液体部分后足以中和溶液。因此,优选酸度至少与5%磷酸溶液的相同。因此,液体部分可以合适地具有约1至2.5,并且更优选约1至2范围的ph。在其他实施方案中,可以通过在液体部分中提供具有5%磷酸溶液当量浓度(n)的含量的酸来获得所述酸度。pdc自身也具有缓冲能力,因此常规的磷酸化自硬化复合物与本发明优选的组合物相比,在固化过程中显示出更快的且不太好控制的ph下降。pdc的存在意味着pdc可以消耗(中和)羟磷灰石形成过程中残余的质子,并且由此降低ph变化。因此断定如果除了磷酸以外或替代磷酸使用其他酸,需要更多磷酸钙来提供足够的磷酸盐含量。在整体组合物中,混合固体和液体部分后,由此获得的组合物的酸含量优选为至少约2.0%磷酸,或等量的其他酸(含或不含磷酸),如约2.5-25%,如约3.5-15%,或5-10%磷酸或其等价物。本发明的组合物具有良好的可注射性。使用5ml注射器(b.braun或等价物),具有12mmid和2mm出口,注射2-3ml本发明的新鲜接合剂组合物的最佳注射力优选在约10-30n范围中,并且更优选不高于约20n,并且更优选低于约15n或低于约10n。这可以按照实施例1中所述的来测量。本发明的组合物包括掺入固体部分中的pdc;这在接合剂的凝固中具有决定性的作用。脱乙酰程度(dd)越高,凝固时间越短。另一方面,凝固是温度相关的,即,温度越高,凝固时间越快。因此,可以通过选择具有合适参数的pdc并且因此根据实际操作需求优化组合物来控制接合剂凝固时间。在室温(20-25℃)下,使用50%ddpdc,获得的凝固时间为30min,而在<5℃下,凝固时间超过>3h。本文中所用的术语凝固时间是指从混合到接合剂硬化至不能按照本文中所述的易于施用并且不破碎不能再模制的程度的时间点。另一个有用的术语是工作时间或使用时间,这是指最初混合后(并且短暂等待组合物变得足够粘)并且直至达到凝固时间,组合物可以工作/使用的时间。对于本发明的组合物,室温(20-25℃)下的使用时间优选为从初始混合开始的2-25分钟,如从混合开始的2-20分钟或3-20分钟。这可以根据确切的组合物和手术室中的温度而改变。通常,对于越低的s/l比组合物,工作时间开始的等待时间段更长,如对于1:2至1:3范围的s/l比,3-8分钟的范围,但这用稍后的凝固时间进行了补偿。因此,当s/l比为1:1.5时,室温下的工作时间通常从混合开始约2分钟至约9分钟,而s/l比较低时,如1:2,工作时间从混合开始约6分钟,持续至从混合开始约20分钟,因此获得了较长的使用时间。使用甚至更低的s/l值(如1:2.5或1:3)时,工作时间进一步变化,混合后更晚再开始,但组合物保持可工作更长时间。通常通过调节pdc的相对含量来获得所需的机械强度,这对于接合剂的机械特性是关键的。接合剂在总接合剂约20%pdc(w/w)下达到峰抗压强度。通常,可以制备具有50%pdc(w/w)的接合剂。在优选的实施方案中,本发明的组合物包含混合组合物(固体和液体部分)总重的10wt%或更低含量,如组合部分的约2-10%,并且在一些实施方案中,在约2.5-5%范围中的pdc。此外,施用于骨空洞或骨折中时,接合剂组合物中的pdc含量对成骨作用具有影响,越高的含量产生越多的成骨作用。对于本发明的组合物,固体部分优选包含3-30wt%pdc;具有超过所述含量pdc的接合剂可以诱导过度的骨生长,这取决于乙酰化的程度和模式。更优选,固体部分包含5-15wt%,如5-10%的pdc。优选本发明组合物中的pdc包含再生的聚合物,其已经经历了溶解和随后的杂质过滤并且从基质除去内毒素,并且此后在合适的干燥过程中干燥。在其他实施方案中,这种再生的壳聚糖可以被传统壳聚糖或部分脱乙酰的具有相似脱乙酰程度、分子量和颗粒大小的壳多糖替代,只要基本上是纯的并且含有低水平的内毒素。此外,在本发明的特定实施方案中,化学修饰的pdc或壳聚糖的盐形式或其他形式,如季壳聚糖(quaternarychitosan)、羧甲基壳聚糖等,可以用于接合剂的制剂中。本发明组合物中的pdc优选是具有低于100eu/g内毒素水平的高度纯化的pdc。这确保了接合剂的良好生物相容性并在接触骨组织时提供了即时的成骨作用。如所述的,本发明中使用的pdc材料具有40-75%,并且更优选约40-70%,如约40-60%,包括约40%、约45%、约50%,或约50-60%,如,例如,55%或60%dd的脱乙酰程度。此外,pdc优选在脱乙酰过程中脱乙酰至随机形式(即,壳多糖的脱乙酰,这是获得用于本发明的合适壳多糖衍生物的优选方式),使得块状(blockwise)n-乙酰-d-葡糖胺(a)或d-葡糖胺(d)部分(例如,a-a-a-a或d-d-d-d)的存在最小化。通过体内内源性壳多糖酶的水解时,这样所需的半随机脱乙酰化材料就其含量、分子量、家族18壳多糖酶的阻断和对壳多糖酶样蛋白质的亲和性产生了最佳的寡聚物长度,以获得用于骨组织再生的最佳治疗目的。脱乙酰程度和剩余乙酰基团的分布对pdc聚合物和寡聚物的成骨活性具有显著影响。脱乙酰越低和乙酰基团更均匀的分布,pdc呈现出更好的成骨活性。在本发明的优选实施方案中,半均匀分布是有利的,即,不是如上所述的块状分布并且同时也不是乙酰基团完全均匀的分布(例如,在具有50%dd的pdc中,n-乙酰葡糖胺残基不必定是100%地每隔一个单体分布)。如本文中涉及的pdc的分子量(mw)是指pdc聚合物的加权平均分子量。pdc的mw影响组合物的各种特性;这些包括机械强度、可注射性、可塑性、粘结性或分层、填补能力、凝固时间等。优选的可工作mw为10-1000kda,因此,本发明组合物中的pdc的优选mw在所述范围内。可塑性和分层特性随着mw提高而提高;然而,非常高的mw不能有利地作用于可注射性和填补能力。对于本发明的组合物,壳多糖材料的优选范围在30-200kda内。高和低mw的混合物可以平衡各种矛盾的特性,例如,可注射性vs.分层特性。另一方面,寡聚物形式的治疗性pdc的掺入可以缩短愈合过程。在特定的实施方案中,组合物包括部分脱乙酰的壳寡聚物(chitooligomer),通常在寡聚物链中具有约3-12个糖残基范围的寡聚合物长度和约30-70%范围的dd值,作为pdc材料的一部分,如pdc材料的总含量的约5-25wt%,如约5%、10%或15%。这将促进骨生成的早期开始。试剂盒制备和包装后,优选用γ照射的灭菌。γ照射可以影响初始pdc材料的mw,因此如果组合物中的pdc材料在照射之前具有200至1000kda范围的mw,在γ照射后,照射可以给予30-200kda的最终mw。在一些实施方案中,有效的初始mw范围为10至超过1500kda,并且最终mw范围为10至1000kda。最终mw的最优选范围如上所述,在30-200kda范围内,并且因此优选的初始mw范围在20-1000kda内,如100-1000kda范围内,并且更优选在200-1000kda范围内,如使用光散射检测仪,通过gpc/sec系统测量的。本文内容中γ照射的可工作剂量优选在9至100kgray范围中,最佳优选的剂量在20-35kgray范围中。优选,本发明组合物中的pdc具有不超过500μm的颗粒大小。在酸性环境中,这样的材料快速溶解并且与磷酸钙反应,以调节接合剂特性。如所述的,本发明具有掺入固体部分中的pdc。这具有避免存储过程中可能的酸降解的附加优势。这确保了接合剂合理的货架期并且避免较差的接合剂特性和经济损失的产生。此外,磷酸钙包括在组合物的固体部分中。在本发明的优选组合物中,磷酸钙将形成低晶体沉淀的羟磷灰石,以确保最佳的同化作用以及在体内形成骨组织。优选,组合物固体部分包含酸性磷酸钙和碱性磷酸盐。在与液体部分混合并中和时,磷酸钙导致沉淀的羟磷灰石的形成。钙与磷的最优比例,ca/p比,在约1.6至1.7的范围中,然而,1.2至2.2范围中的ca/p比是可工作的,其是根据本发明的优选范围。因此,在一个实施方案中,磷酸钙是α-磷酸三钙和磷酸四钙。这些优选具有高于80%的纯度。(根据发明人的经验,低于80%的纯度也可以使用,并且没有产生较差的成骨特性)。导致羟磷灰石形成的其他磷酸钙的组合也可以用于本发明中。硫酸钙是易碎的,并且提供比磷酸钙低的强度,因此在体内易于具有比磷酸钙更快的再吸收速率。硫酸钙和磷酸钙的混合物可以结合接合剂在体内的再吸收速率和机械特性的益处。磷酸钙应当优选具有不超过180μm,更优选小于约100μm的颗粒大小。机械强度与颗粒大小成反比。最优大小为50μm或更小。在一些实施方案中,组合物在固体部分中包含甘油磷酸钠。甘油磷酸钠可以用于进一步提高接合剂的机械特性并且将接合剂的盐度调节至生理条件。在其他实施方案中,也可以使用其他磷酸盐,作为甘油磷酸钠的替换或除了甘油磷酸钠以外,包括磷酸氢钠、磷酸氢二钠等。如上所述,本发明进一步提供了基于使用本发明组合物的方法,用于愈合骨折的骨头。这些方法包括提供如上所述的固体部分和液体部分,并且以约1:1.2至约1:6固体部分比液体部分的比例将两个部分混合在一起,并且更优选在如上所述和限定的范围中,如最优选以约1:2的比例。将这两个部分混合,并且混合允许固化合适的时间,直至获得所需的稠度和粘度,这时,组合物的“工作时间”开始,然后插入混合物,优选通过注入希望愈合的骨折部位。组合物的操作非常适合涉及整形外科手术的临床程序。填补骨空洞时,产品可以用于替代骨移植物,以促进骨折愈合中的结合,促进如脊柱融合术手术、骨切除术中的融合,例如,在牙周外科手术、骨癌外科手术中,如保肢外科手术、外周骨的非结合重建、良性过程中的骨性(ostelytic)过程的修复中等等。因此断定本发明还提供了本文中所述的pdc材料通常用作用于修复和愈合骨的药物,特别是在如本文中所述的组合物试剂盒中提供pdc时。具体实施方式实施例1:具有1:2s/l比的本发明的特定组合物的材料特性将固体和液体成分分开混合,并在使用前用刮刀立即组合和混合。表1组合物成分相对含量固体部分:磷酸四钙46α-磷酸三钙35甘油磷酸钠11pdc,50%dd8液体部分磷酸20磷酸钙4水176质地:就在混合后的接合剂组合物在工作时间开始时具有乳状糊状物的质地。使用5mlb.braun注射器(12mmid和2mm出口)测量的注射强度在15-30n范围中。组合物在室温(20-25℃)下的工作时间在初始混合开始的3-25分钟内,即室温下25分钟的凝固时间,但在3℃下长达3h。将2g组合物置于5ml未缓冲盐水(0.9%nacl)中时,初始ph为7.4。6小时后,ph为6.84,1天后,为6.47,并且在5天后,为5.94。如下测定组合物的粘结性:将50ml盐水(0.9%nacl)置于100ml烧杯中,在底部具有2.5cm磁搅拌棒,并且在低于表面1cm的深度放置25目网。将0.5ml即可使用的接合剂注射在网上(以圆形运动,提供“圆环”形状)。设置显示于图1中。将溶液以100rpm的速度搅拌10min。测定注射的接合剂的精确重量(通过称重注射前后的注射器的重量)。搅拌时间后,将溶液转移至浊度测量试管并且测量浊度,表示为ntu。校准曲线:通过使用各自的接合剂作为标准来制备储备悬浮液。将称重部分的接合剂(精确到0.0000g)彻底分散,以产生1000ntu的浊度。通过连续稀释,将储备悬浮液用于制备具有0、200、400、600、800和1000ntu的标准悬浮液。用接合剂含量相对悬浮液浊度绘制曲线,获得了线性图。因此,通过测量10min搅拌后的测试溶液的浊度,确定分散的接合剂含量。使用这种测量,确定了<0.1%的接合剂组合物已经分层并且分散于盐溶液中。更多的机械特性:使用测力计测量了抗穿透性,通过将针(3mmod)压入嵌入96孔平板(ф6.7×13mm)中的完全固化的组合物中5mm的深度来测量。通过在盐溶液(0.9%nacl)中在37℃下孵育24小时来固化组合物。针对每个组合物使用了6-8次重复,使用mts测试仪(mtsinsight10,edenprairie,mn,usa),测量了表1中所列组合物(s?l比为1:2)的抵抗力为8.08±0.34n/mm2。还测试了具有不同s/l比的组合物的穿透。具有1:1.5s/l比的组合物具有17,25n/mm2的抗穿透性,与s/l1:2组合物(6,221n/mm2)相比,这几乎是三倍,而具有1:1s/l比的组合物具有测量的32,82n/mm2的抗穿透性。从5mm位移的穿透力计算了接合剂的强度。早先的实验已经显示出所述的穿透测试和传统的压力测试(cct)之间的线性相关。实施例2:脱乙酰对机械特性的作用注射力:按照实施例1中所述的配制了两种组合物,但使用两种不同dd值,50%和70%的pdc。使用mts测试仪,在具有12mmid和2mm出口的b.braun5ml注射器中进行了注射测试。结果显示于图1中。(在25℃或3℃下进行了测试,参见图2)。抗压强度:按照实施例1制备了三种组合物,但使用三种不同dd值,40%、70%和94%的pdc,并且s/l比为1。使用mts测试仪,使用20mm/min的十字头速度,使用500n测力计,测试了抗压强度。将测试过程中的初始接合剂温度设定在3和25℃。结果显示于图3中。在压力测试中,对于每个处理,重复5次,每次使用ф9.6×15mm大小。将这些样本在盐水(0.9%nacl)中在37℃下孵育24h用以固化,并且测试条件与注射测试所述的相同。实施例3:在大鼠下颌骨模型中的体内测试组合物-脱乙酰程度的优化介绍:大鼠下颌骨(颚骨)是骨愈合研究经常使用的模型(bonerepairinratmandiblebyrhbmp-2associatedwithtwocarriers(通过与两种载体相关的rhbmp-2的大鼠下颌骨的骨修复);micron,第39卷,第4期,2008年6月,第373-379页,paulomardeganissa等;boneformationintrabecularbonecellseededscaffoldsusedforreconstructionoftheratmandible(用于大鼠下颌骨重建的小梁骨细胞接种支架的骨形成);internationaljournaloforalandmaxillofacialsurgery,第38卷,第2期,2009年2月,第166-172页,h.schliephake等,boneregenerationintheratmandiblewithbonemorphogeneticprotein-2:acomparisonoftwocarriers(使用骨形态形成蛋白-2的大鼠下颌骨中的骨再生:两种载体的比较);otolaryngology-headandnecksurgery,第132卷,第4期,2005年4月,第592-597页,oneidaa.arosarena,wesleyl.collins;spontaneousbonehealingofthelargebonedefectsinthemandible(下颌骨中大的骨缺陷的自发性骨愈合);internationaljournaloforalandmaxillofacialsurgery,第37卷,第12期,2008年12月,第1111-1116页,n.ihanhren,m.miljavec)。下颌骨是对喂食和咬动引起的恒应力起反应的代谢上活动的骨。我们已经研发了用于大鼠下颌骨中关键骨损伤的动物模型,使用微-ct分析来测量新的骨生长和成骨应答以及组织学检查,以将微-ct构造的矿化特征翻译成矿化骨组织。大鼠颚的咬肌窝(massetericfossa)的中间区域中直径4mm的钻孔提供了影响骨机械特性的关键大小的空洞(图4)。这确保了骨对损伤有应答,补偿了由激活适当的成骨应答引起的骨结构弱化。微-ct分析能够使用限定部分的下颌骨来定量矿化作用(图4)。这证明了这是用来评价注入这个空洞中作为骨植入物的生物材料的成骨作用的极好工具。在这个研究中,模型用来评价基于磷酸钙的可注射骨空洞填充剂中不同壳多糖衍生物的骨生长刺激作用。这些壳多糖衍生物是三种不同脱乙酰的壳多糖聚合物,50%、70%和96%脱乙酰的,和一种50%脱乙酰的寡聚物(t-chostm,genishf.,iceland)。基于我们之前的大鼠颚研究,植入时间调整为7天。聚合物的乙酰化似乎对于诱导新骨形成是重要的,显示出50dd聚合物活性最大,而96%dd聚合物无活性。材料和方法用于这个研究中的壳多糖衍生物如下:50ddpdc。脱乙酰程度50%。(表1中所述的相同材料)。70ddpdc。脱乙酰程度70%。96ddpdc。脱乙酰程度96%。50dd寡聚物(t-chostm,genishf.,iceland)。t-chostm没有单体并且含有低于10%的二聚物和三聚物。八聚物是组合物中最大量的寡聚物。所有聚合物的平均分子量大于130kda,如通过大小排阻色谱判定的。生产了四种不同植入物组合物的试剂盒,每种试剂盒含有固体成分(固体部分)和液体成分(液体部分)。固体成分(一试管)含有0.155g壳多糖衍生物,0.904g磷酸四钙和0.701gα-磷酸三钙,0.220g甘油磷酸钠和0.098g氢氧化钙(固体部分的总重为2.078g)。液体成分(一试管)含有0.398g磷酸和3.504g水,总重为3.902g(s/l比1:1.88)。将一个固体和一个液体成分放入铝薄片和热密封的塑料袋中,产生完整的即可使用的试剂盒。所有试剂盒通过γ照射灭菌(20kgy;radiationcenter,oregonstateuniversity,usa)。在手术过程中和植入之前,以无菌方式混合成分,放入注射器中,并且保持在4℃,直至植入。测试动物是spraguedawley雄性大鼠(260-280g),由丹麦的taconic供应。在到达和离开时在临床上检查动物,在手术前在实验机构适应和生长30天。在手术那天,动物的平均重量为413g,范围为430-464g。实验在冰岛动物实验管理委员会(icelandiccommitteeonanimalexperimentsapproval)的许可(执照号0709-0405)下进行。通过整形外科医生和麻醉师进行了手术,药物剂量和动物护理由兽医来管理。通过剃毛和消毒,将每只动物的左颚准备用于外科手术。通过平行于下颌骨并且在下颌骨下缘上方的切口,进入下颌骨。通过咬肌(musculusmasseter)纤维的钝的和无创伤的解剖,进入咬肌窝(fossamasseterica)。使用4mm牙钻,通过咬肌窝的中央部分钻出4mm孔。用无菌盐水(5ml)彻底冲洗后,使用eppendorf分配器给孔注入25μl实验测试制剂或留着未处理(空的孔洞对照)。用缝合将外科手术伤口闭合。使用39只动物建立了总共6组。表2显示了实验设定。表2.实验设定。每个组中的动物数量,孔的处理和存活期的持续时间。动物数量处理植入时间(天)4空的孔洞7470%dd聚合物0896%dd聚合物7770%dd聚合物7850%dd聚合物;7850%dd寡聚物;7最后,用异氟烷将大鼠麻醉,并且在麻醉下,最后从心脏放血。然后从颌关节解剖出左颚,并且放入ph7.0的50mm磷酸盐缓冲液中的3.7%甲醛中。在微-ct扫描仪(来自generalelectricinspectiontechnologies的nanotom)中进行了扫描。将样品固定于充满固定溶液的密闭塑料圆柱体中并且安放在ct-扫描仪的旋转台上。使用al-体模和塑料体模(pet)作为用于灰度值比较的参照点进行了扫描。放大倍数为4,三维像素大小为12.50μm/三维像素边缘,收集的图像数量为1080(步长为0,33°),暴露时间为2000ms,均帧为3,跳帧(frameskipped)为1。x-射线设定为100kv,125μa,使用电子管(tubemode)0,并且无滤波器。使用伴随ct-扫描仪的datos-x软件进行了体积重建。使用来自volumegraphics的volumegraphicsstudiomax2.0进行了数据分析。限定了圆柱形的体积,包括从最后面的臼齿的远侧边缘往后延伸的整个骨头,包括下颌突、角状突、冠突和具有或不具有植入物的孔(图3;lc)。通过灰度值截留/灰度值限定,测定了总的骨体积(旧骨和新骨)和该体内内的植入材料。在具有植入物的颚的情况中,限定了垂直于较大圆柱体的较小圆柱体,包括植入材料(图3;sc)。从通过大的圆柱体测定的总的骨和植入物体积减去该圆柱体内的植入材料的体积。这样,获得了处理和未处理颚的总骨体积(新骨和旧骨)的估算值(图3)。微-ct扫描后,将样品放入缓冲的固定溶液中。将选择的样品在decalc(histolab,no.00601,gothenburg,瑞典)中脱钙3hr。然后将样本脱水,石蜡包埋,切片(2μm)并用苏木精-曙红染色。使用连接数码相机(leicadfc290)的光学显微镜(leicadm2000,德国)检查切片并拍照。结果在7天的时间段内,乙酰化的壳聚糖诱导了矿化颚骨体积的增加(图4)。计算每组的平均矿化骨体积(ambv,以mm3计)(平均值±sem)。在两个对照组之间没有观察到显著差异(空的孔洞组和零天组,各自为69.4±3.1和71.1±2.3;图5)。对于脱乙酰壳多糖聚合物,ambv与%dd值负相关;96dd组具有71.9±2.9的平均值,70dd组为84.2±4.5的值,50dd组为87.3±3.8(图5)。与空的孔洞组相比,70dd和50dd组的ambv显著提高(各自为18和23%)。令人感兴趣的,96dd组(96%脱乙酰壳聚糖)对矿化骨体积不具有显著作用(图5)。寡聚物复合物(t-chostm植入物)诱导11%的骨体积(图5)。这种诱导是显著的(p<0.05)。然而,由于较差的物理化学特性,t-chostm植入物常常被咬碎并且离开空洞。微-ct扫描检查时,这种情况是明显的。在钻孔中,大部分的t-chostm植入物已经不见。聚合物显然对于这种骨接合剂制剂的机械稳定性是必需的。图6显示了植入基于70%dd聚合物的可注射组合物后14天,通过相同的大鼠下颌骨的组织学和微-ct横截面的比较。切片是钻孔前沿的1-2mm。矿化组织(a、b和c),通过微-ct分析表征为新骨,显示出新形成的骨组织,如通过苏木精-曙红染色切片所判定的。所有新骨具有比原始颚骨低的密度,通过微-ct和组织学检查来判定。组织学制备物揭示了小梁骨形成,在新骨长出物内具有血管形成。新骨长出物通常来自覆盖骨外表面的骨膜,而不是骨缺陷自身(图6)。因此,可以声明这种pdc诱导的骨长出物位于钻孔远侧,遍布下颌骨骨表面,主要沿着暴露于颚内的最大机械应力的部位。这只可以通过能够遍布骨相关组织分散的小分子的活性来解释。这些小分子最可能是通过植入物中的pdc聚合物的原位水解形成的pdc寡聚物。这种水解最可能是通过白细胞(嗜中性粒细胞和巨噬细胞)表达的家族18壳多糖酶来催化的。这些活性壳多糖酶将分裂部分乙酰化的壳多糖聚合物,形成各种大小的pdc寡聚物。这些所述pdc寡聚物从植入的组合物扩散至邻近组织中,并且介导这种应答骨的机械应力的远侧骨生长促进。实施例4:绵羊胫骨近侧中关键骨空洞的处理通过植入四十五只5岁大(年龄5.83±0.71,平均±sd)的绵羊的胫骨近侧的骨骺中来测试如实施例1(表1)和实施例2中所述的组合物。所有绵羊以相似的方式进行手术,15只保持3个月用于短期评价,15只保持13个月用于长期评价。实验在冰岛动物实验管理委员会的许可(执照号0709-0405)下进行。通过整形外科医生和麻醉师进行了手术,药物剂量和动物护理由兽医来管理。液体和固体成分的混合用于这个样品中的部分脱乙酰壳多糖聚合物具有以下特性:50%脱乙酰程度:1%醋酸的1%溶液中的100%溶解性;460cp的溶液粘度;溶液中<10ntu的浊度;330kda的表观平均分子量;内毒素含量93eu/g。将试剂盒的固体和液体成分倒入无菌塑料杯中,并且用无菌刮刀搅拌和捏合2分钟,形成粘性浆液。外科手术程序在每只动物的骨的前后边缘之间的中部和左右胫骨粗隆的高度,钻出直径8mm的孔。以垂直角度通过皮层钻出进入孔,并且随后将钻孔机改变方向至45°向上,结束于胫骨平台面的下方。在钻孔程序过程中钻孔机没有冷却。钻孔后,通过用40-50ml无菌盐水冲洗和彻底抽吸,彻底冲洗掉钻孔的骨碎片。将测试试剂盒的液体和固体成分混合后,将1.5ml浆液放入5ml安装有无菌移液尖端的无菌注射器中,并且将全部内含物注入钻孔中,确保材料到达,以填补从胫骨平台开始向下和向外至皮层开口的钻孔的完整空间。左腿孔留着空的,并且用作阴性对照。此后,用4-0连续vicryl皮下缝合闭合两条腿的外科手术伤口,并且用4-0etilone连续皮内缝合闭合皮肤。外科手术和醒来后,将动物移回羊圈恢复,在那仔细监控它们,直至能走动。样品的死后处理移出后,立即将骨样品放入ph7.0的50mm磷酸盐缓冲液的3.7%甲醛中,并且此后连同羟磷灰石体模标准品一起在微ct-扫描仪(来自generalelectricinspectiontechnologies的nanotom)中扫描。还扫描了通过离体制备的并且使其在盐水中在37℃下静置和硬化24h的圆柱状样品,以获得来自零时间点的数据。扫描后,将骨样品锯成4mm厚的切片,并且返回缓冲的固定剂中,持续最少4周。完成固定阶段后,将样品放入中性ph的15%edta溶液中,用于脱钙,持续长达4个月,定期更新edta溶液。脱钙后,制备用于组织学(石蜡)的样品,并且使用苏木精-曙红染色。微ct分析将原始微ct数据接受使用来自volumegraphics的datos-x软件和volumegraphicsstudiomax2.0的体积重建和数据分析。重建的体积包括胫骨的完整垂体(hypophysisofthetibia),从胫骨平台到达并且向下3cm,包括钻孔和全部可能在钻孔外发现的植入材料。通过灰度值截留/灰度值限定,确定了该重建体积内的旧骨、新骨和植入材料的体积。标准品中羟磷灰石的浓度越高,在微ct图像中显示出更亮的灰度值(“更白”)。因为羟磷灰石是钙化骨中诱导x-射线减弱的主要成分,标准品的灰度值可以用于估算样品中矿化的程度和分布。通过比较羟磷灰石标准品和样品的灰度值,因此可以判定矿化程度。ct图像中最亮的区域表示具有最高矿化程度的组织。为了定量评价,限定了4mm长和3mm半径的虚拟圆柱体并且相对于钻孔方向的纵轴仔细并同心地定向(图7)。在保持固定的圆柱体的方向的同时,将半径逐步提高至4、5和6mm,并且测量每个圆柱体中的矿物体积。在所有样品中重复这种分析,包括空洞(左胫骨)和具有植入物的孔。通过从较宽的圆柱体减去较窄的圆柱体,如从半径4mm减去半径3mm(r4-r3),r5-r4和r6-r5,获得了每个圆柱体1mm外壳(管)的矿物相体积。将所有圆柱体壳的矿物相体积标准化至1mm3的标准体积,获得矿物密度,并且使用sigmastat和sigmaplot软件对这一数据进行统计学分析。结果从所有样品制备横截面微ct图像,显示出3个平面中的植入材料和周围的组织。将这些图像用于目测和限定用于矿物密度定量评价的虚拟圆柱体。将组织学切片用于评价组织对植入材料的应答,着重于炎症、异物反应、疤痕组织形成和新形成的骨组织的体征。微ct数据的解释体内3个月后,目测揭示了围绕植入物的明显的新骨的密集外壳并且很好地连接邻近的小梁骨组织。植入物内部密集结构的岛表明遍布材料散射的骨形成(图8)。体内13个月后,这甚至更明显,与体内3个月相比,显示出周围的外壳更厚,并且植入物内的骨形成更明显。离体和体内样品中的矿物密度的统计学评价揭示了体内3个月过程中矿物密度降低21%。体内3和13个月之间,植入物的矿物密度再次提高33%(图9)。在3个月和13个月时,空洞没有显示出任何矿化组织的生长。然而,围绕空洞的密度骨组织的薄外壳是明显的。这通过了r4-r3数据的定量评价得到了证实(图10)。这揭示了8mm钻孔是这个模型中的临界骨缝隙。使用matlab(matrixlaboratory)和mimics(医学成像分割软件)软件,通过测量3个月和13个月时的灰度值分布,来定量植入物和骨变化。结果证明了3个月时植入物和骨之间灰度值分布的显著差异。然而,在13个月时,植入物的灰度值分布变得与周围骨的灰度值分布相似。这些结果表明植入物在10个月期间的形态学变化,表明植入物材料到骨组织的渐进性转变。通过组织学分析的证实3个月后的胫骨的组织学评价显示出植入材料完全是生物相容性的,没有炎症或异物反应的体征。疤痕组织形成是可以忽略的。围绕完整植入物的新骨组织的外壳是明显的,大范围地整合至邻近小梁骨中,并且新骨的岛在整个植入物中散布(图11)。组织学切片的内衬图像和微ct切片的同系物图像证实了被围绕植入物和遍布植入物散布的高密度(最高程度的x-射线减弱)表征的区域是新形成的骨组织。本发明涉及以下实施方式:1.一种用于骨愈合医疗的组合物试剂盒,其包括a.固体部分,包括具有40-75%脱乙酰程度的部分脱乙酰壳多糖(pdc)和磷酸钙;b.酸性液体部分,包括水和酸;在分开的小瓶中提供所述部分,在使用前混合,其中固体与液体部分的重量:重量比在1:1.2至1:6的范围中。2.实施方式1的组合物试剂盒,其中pdc具有40-60%范围,并且优选约50%的脱乙酰程度。3.实施方式1的组合物试剂盒,其中所述固体部分包括3-30wt%,优选5-15wt%的pdc。4.实施方式1-3任一项的组合物试剂盒,其中所述液体部分包括一种或多种选自磷酸、盐酸、抗坏血酸、乳酸、醋酸、甲酸、丙酸、苹果酸、柠檬酸和谷氨酸的酸。5.实施方式1-4任一项的组合物试剂盒,其中所述液体部分具有等于至少5wt%磷酸的酸度。6.实施方式1的组合物试剂盒,其中所述液体部分进一步包括氢氧化钙。7.实施方式1的组合物试剂盒,其中所述固体与液体部分的重量比在约1:1.3至约1:4的范围中。8.实施方式7的组合物试剂盒,其中所述固体与液体部分的重量比在约1:1.5至约1:3的范围中。9.上述任一项实施方式的组合物试剂盒,其包括含量为组合部分的0.5-10wt%范围,优选约1-5wt%范围的pdc。10.上述任一项实施方式的组合物试剂盒,其中所述pdc已经溶解和沉淀。11.上述任一项实施方式的组合物试剂盒,其中所述磷酸钙包括磷酸四钙、α-磷酸三钙和可以形成羟磷灰石和/或透钙磷石的沉淀物的其他磷酸钙中的一种或多种。12.上述任一项实施方式的组合物试剂盒,其中所述固体部分包括甘油磷酸钠。13.上述任一项实施方式的组合物试剂盒,其中组合物在混合后在室温下开始硬化,并且在室温下具有约15-30分钟范围内的凝固时间。14.实施方式13的组合物试剂盒,所述组合物在混合后具有如通过可注射性确定的粘度,所述粘度用具有12mmid和2mm出口的5mlb.braun注射器测量时,低于30n。15.上述任一项实施方式的组合物试剂盒,其中所述组合物不包括骨形态形成蛋白或选自骨髓、血液、骨和成骨蛋白的其他生物因子。16.上述任一项实施方式的组合物试剂盒,进一步在固体部分中包括硫酸钙。17.上述任一项实施方式的组合物试剂盒,用γ照射将其灭菌。18.用作用于修复和愈合骨头的药物的具有40-75%范围的脱乙酰程度的部分脱乙酰壳多糖(pdc)。19.根据实施方式18的用作药物的具有40-75%范围的脱乙酰程度的pdc,其中将所述pcd包含在根据实施方式1-17任一项的组合物试剂盒中。20.一种骨愈合的方法,其包括:-将固体部分和酸性液体部分混合在一起,形成是液体、半液体或糊状接合剂混合物的混合物,所述固体部分包括具有40-75%范围的脱乙酰程度的部分脱乙酰壳多糖(pdc)和磷酸钙,所述酸性液体部分包括水和酸,其中固体部分与液体部分的重量:重量比在1:1.2至1:6的范围中;-将所获得的混合物施用于待愈合的骨头部位。21.实施方式20的方法,其中通过注射来进行所述施用。22.实施方式20的方法,其中所述施用是通过如刮刀来施用于骨表面。23.实施方式20的方法,其中固体部分与液体部分的重量:重量比在约1:1.3至约1:4的范围中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1