用于无创测量受检者的血糖水平的设备的制作方法
本申请是申请号为201180021344.5、申请日为2011年4月26日、发明名称为“用于无创测量血糖的设备”的pct国际发明专利申请的分案申请。
本发明涉及医疗领域和特定疾病的治疗,尤其涉及一种用于无创测量受检者的血糖水平的设备。
背景技术:
糖尿病及其并发症对个人、家庭、医疗卫生系统和国家产生显著的经济影响。由于直接和间接费用,在2007年仅在美国用于糖尿病的年度开支估计超过$1700亿(americandiabetesassociation.economiccostsofdiabetesintheu.s.in2007.diabetescare.2008march,31(3):1-20)。在2010年,用于糖尿病的卫生保健支出预计占全世界卫生保健总支出的11.6%。估计全球将有大约2.85亿人在2010年患有糖尿病,占世界成人人口的6.6%,预测到2030年有4.38亿(internationaldiabetesfederation.diabetesatlas,fourthedition.internationaldiabetesfederation,2009)。
近年来,研究最终表明改善的血糖控制减少糖尿病的长期并发症(dcctresearchgroup.theeffectofintensivetreatmentofdiabetesonthedevelopmentandprogressionoflong-termcomplicationsininsulin-dependentdiabetesmellitus.northenglandjournalofmedicine.1993sep30;329(14):977-986;ukpdsgroup:intensiveblood-glucosecontrolwithsulphonylureasorinsulincomparedwithconventionaltreatmentandriskofcomplicationsinsubjectswithtype2diabetes(ukpds33).thelancet.1998sep12;352(9131):837-853)。根据美国糖尿病协会(ada),血糖的自我监测(smbg)对用胰岛素、口服剂和医疗营养治疗的结果有积极影响(americandiabetesassociation.clinicalpracticerecommendations,standardsofmedicalcareindiabetes.diabetescare.2006jan29:s4-s42)。在它的出版物“consensusstatement:aeuropeanperspective”中,慕尼黑的糖尿病研究机构推荐smbg用于所有类型的糖尿病治疗方法,以便实现接近正常的适当血糖控制和值而不增加低血糖的风险(schnello等人,diabetes,stoffwechselundherz,2009;4:285-289)。此外,最近由国际糖尿病联合会(idf)出版了带有适当推荐的专用指南以支持用于非胰岛素治疗t2dm患者的smbg(基于临床指南任务小组(internationaldiabetesfederationclinicalguidelinestaskforce)与smbg国际工作小组(smbginternationalworkinggroup)合作的研讨会的建议。guidelinesonself-monitoringofbloodglucoseinnon-insulintreatedtype2diabetics.internationaldiabetesfederation,2009)。
smbg在糖尿病教育和治疗中具有若干优点。它可以通过提供一种器械帮助促进个人的糖尿病管理,所述器械用于每日生活方式习惯、个人血糖分布图(包括锻炼和食物摄取对该分布图的影响)的影响的客观反馈,并且由此准许个人进行必要的变化。而且,smbg可以支持卫生保健团队提供关于生活方式组成和降血糖(bg)药疗的个人定制建议,因此帮助实现特定血糖目标。
然而,在常规(有创)smbg中涉及的不便、花费、疼痛和复杂性导致它的利用不足,主要用于2型糖尿病患者中(mollemaed,snoekfj,heinerj,vanderploeghm.phobiaofself-injectingandself-testingininsulintreateddiabetespatients:opportunitiesforscreening.diabetmed.2001;18:671–674;davidsonmb,castellanosm,kaind,duranp.theeffectofselfmonitoringofbloodglucoseconcentrationsonglycatedhemoglobinlevelsindiabeticpatientsnottakinginsulin:ablinded,randomizedtrial.amjmed.2005;118(4):422-425;hallrf,josephdh,schwartz-barcottd:overcomingobstaclestobehaviorchangeindiabetesself-management.diabeteseduc.2003;29:303–311)。精确、无痛、便宜和易操作设备的可用性将促进更频繁的测试(wagnerj,malchoffc,abbottg.invasivenessasabarriertoself-monitoringofbloodglucoseindiabetes.diabetestechnology&therapeutics.2005august;7(4):612-619;soumeraisb,mahc,zhanf,adamsa,baronm,fajtovav,ross-degnand.effectsofhealthmaintenanceorganizationcoverageofself-monitoringdevicesondiabetesself-careandglycemiccontrol.archinternmed.2004;164:645–652),导致更严格的血糖控制和长期并发症和它们的相关卫生保健成本的延迟/减小。
无创(ni)血糖监测可以减小smbg的成本并且显著增加测试的频率。ni方法中的主要关注点是获得高精度结果,不管执行非直接血液或间质液测量的事实。
所以,在医疗领域中公知地,为了诊断目的测量的多个重要血液成分之一是血糖,尤其对于糖尿病患者。用于确定血糖浓度的公知和典型技术是保管血液样本并且将该血液应用于酶催药物比色条或电化学探头。通常,这从手指针刺实现。对于可能需要一天几次测量血糖的糖尿病患者,显然可以理解该程序导致很大的不适、对皮肤的明显刺激,并且当然,特别当手指被针刺时导致感染。
多年来,有许多程序用于监测和测量人和动物中的血糖水平。然而,这些方法通常涉及有创技术,并且因此具有一定程度的风险,或者使患者至少有些不适。近来,开发了一些无创程序,但是它们仍然并不总是提供血糖的最佳测量。目前,没有可行的可靠解决方案。
多数无创监测技术集中于使用入射辐射,所述入射辐射能够穿透组织和探测血液。目前已知的无创血糖测量方法主要基于光学技术。不太成功的和比较罕见的电测量集中于指定频率范围(典型地为1-50mhz)内的水溶液的介电性质。在一种形式或另一种中,这样的方法试图监测血糖或其他被分析浓度对血糖自身或对水的二次影响的介电频率响应的影响。
尽管对声监测的使用进行了研究,但是研究主要涉及器官之间的声速度的差异。这些研究试图使声速度变化与慢性或连续疾病状态相关联。另外,有一大批医学或科学文献涉及器官的声吸收和散射性质用于成像、治疗甚至诊断目的。
在现有技术中,仅仅测量一个参数。因此,增加了误差的可能性。
freger(美国专利6,954,662)公开了一种用于测量通过血液的声音的速度、血液的传导率和血液的热容量的无创技术和方法(而不是设备)。其后,计算三个测量中的每一个的血糖水平并且通过三个算出的血糖值的加权平均确定最终血糖值。
尽管freger提到可以对通过血液的声音的速度、血液的传导率和血液的热容量进行测量,但是未公开任何设备怎样可以被构造用于实现这样的测量。所以,在这里公开和要求权利的发明是freger的改进并且指定了可以在其中实现这些测量的专用设备。
所以,需要一种用于通过在单一单体式设备中监测多个参数来测量血糖水平的更精确无创设备。所以本发明的一个目标是提供一种用于无创测量受检者中的血糖水平的设备。这些目标由权利要求和以下描述中的特征实现,尤其由与优选的附加和/或备选实施例相关的本发明的以下优选方面实现。
技术实现要素:
本发明的这个和其他目标由一种设备,优选单体式设备实现,所述设备能够通过三个不同的协议无创测量身体的血糖水平。
特别地,根据本发明的设备优选地包括包含硬件并且也包含软件应用程序的主单元,和优选用于附着到患者的外部单元(一个或多个)/外部设备(一个或多个)(优选耳夹)。所述外部单元包括彼此连接的第一和第二部分,其中第一和第二部分位于所述外部单元所附着的受检者的一部分的相对侧面上。例如,当所述外部单元附着到患者的耳垂时,所述两个相对侧面分别位于耳垂的两个相对侧面上。
优选的是在所述单体式外部单元中包含实现血糖的三个独立和不同无创测量的以下三个元件中的至少一个。另外,还优选的是提供至少两个或三个元件以分别实现血糖的两个或三个独立和不同无创测量。根据本发明的一个优选实施例,实现血糖的三个独立和不同无创测量的至少三个不同元件设在单一、单体式外部设备内,例如设在单一外壳内。
也应当领会和理解每个测量通道本身并且独自是新的和新颖的。因此每个测量通道可以独自单独(或与另外的其他测量通道)被使用。通过将三个测量通道组合到一个单体式设备中,从三个独立和独特测量通道获得测量,由此优化最终测量。
对于通过使用超声进行的无创测量,优选发射器(例如超声发射器)和接收器(例如超声接收器)安装在外部单元的相对侧面上。当外部单元适配在患者上时,患者的身体的一部分(例如耳垂)位于发射器和接收器之间。当接收合成信号时,在它穿过患者之后,接收器将信号发送到主单元供合适的算法进行处理。在一些实施例中,薄膜可以用于覆盖和保护发射器和接收器。
为了实现电磁测量,电容器被限定在外部单元中。电容器板定位在外部设备的相对侧面上并且布置在外部单元的部分之间的身体部分(例如耳垂)充当电介质。在一些情况下用于防护或覆盖发射器和接收器的薄膜也可以充当电容器板。
第三技术基于测量血糖水平的热技术。为此,优选加热器和传感器设在外部设备。优选的是将加热器和传感器(热传感器)设在外部设备的相对侧面。然而根据另一个优选实施例,优选的是将加热器和传感器安装在两个相对侧面的相同侧面上,例如,将加热器和传感器定位在外部单元的一个侧面的尖端上。
本发明的目标例如由本发明的以下方面解决。
根据第一方面,一种用于无创测量受检者中的血糖水平的单体式设备包括:超声压电元件,其定位在所述设备的相对部分上并且围绕所述设备可附连的受检者的身体的一部分;电容器板,其定位在所述设备的相对部分上并且围绕外部装置可附连的受检者的身体的所述部分,和连接到所述电容器板的自振荡装置;以及加热器和传感器,其紧邻所述设备可附连的受检者的身体的所述部分定位。
在一个优选实施例中,所述设备还包括用于附着到受检者的身体的外部装置(例如耳夹),其中所述超声压电元件、所述电容器板以及所述加热器和传感器包含在所述外部装置内。
优选地也可以有用于控制测量和计算血糖水平的主单元;和用于电连接所述主单元和所述外部装置的装置,其可以是电流的或无线的。
优选地,薄膜覆盖所述超声压电元件。
所述超声压电元件可以优选地包括换能器和接收器。
优选地,所述电容器板包括薄膜。在这样的实施例中,所述薄膜也可以覆盖所述超声压电元件。
一个优选实施例可以包括用于确定所述外部装置的相对部分之间的距离的装置。在一些实施例中,该装置可以包括磁体和传感器。
优选地也可以有设置所述外部装置的相对部分之间的距离的调节螺钉。
在一些实施例中,可以包括环境温度传感器。
根据其他方面,可以单独利用单个测量通道。
根据本发明的第二方面,一种用于无创测量受检者中的血糖水平的设备可以包括:外壳;以及电容器板,其定位在所述外壳的相对部分上并且围绕所述设备可附连的受检者的身体的一部分,和连接到所述电容器板的自振荡装置。
在一个优选实施例中,该设备也包括用于基于组织阻抗信号计算血糖水平的处理装置,和用于将组织阻抗信号传送到所述处理装置的装置。
该实施例可以包括由薄膜组成的电容器板。
根据该实施例的一个备选型式,也可以有超声压电元件,其定位在所述外壳的相对部分上并且围绕所述设备可附连的受检者的身体的所述部分。它可以包括由薄膜组成的电容器板并且所述薄膜可以覆盖所述超声压电元件。
该实施例的一个不同的备选型式可以包括:超声压电元件,其定位在所述外壳的相对部分上并且围绕所述设备可附连的受检者的身体的所述部分;用于检测发射和接收波之间的相移的装置;和处理装置,用于基于所述相移计算血糖水平并且与所述用于检测的装置通信。
根据该实施例的第三备选型式,也可以有加热器和传感器,其紧邻所述设备可附连的受检者的身体的所述部分定位在所述设备上。它可以包括用于将热传递特性传送到用于计算血糖水平的所述处理装置的装置。
根据本发明的第三方面,一种附着到受检者的身体的一部分用于无创测量血糖水平的设备包括:超声压电元件,其定位在所述设备的相对部分上并且围绕所述设备可附连的受检者的身体的一部分;以及用于检测发射和接收波之间的相移的装置。
它可以优选地包括处理装置,用于基于所述相移计算血糖水平并且与所述用于检测的装置通信。
根据该实施例的一个备选型式,也可以有加热器和传感器,其紧邻所述设备可附连的受检者的身体的所述部分定位在所述设备上。它可以包括用于将热传递特性传送到用于计算血糖水平的所述处理装置的装置。
根据本发明的第四方面,一种附着到受检者的身体的一部分用于无创测量血糖水平的设备包括:加热器和传感器,其紧邻所述设备可附连的受检者的身体的所述部分定位在所述设备上;以及用于将热传递特性传送到用于计算血糖水平的处理装置的装置。
通过结合附图和权利要求阅读以下详细描述将显而易见本发明的其他目标、特征和优点。
附图说明
在说明书的结束部分特别地指出并且清楚地声明了本发明的主题。然而,当结合示出本发明的实施例的例子的附图阅读时,通过参考以下详细描述可以最佳地理解本发明(关于构造和操作方法)及其目标、特征和优点,在附图中:
图1是本发明的视图,显示了主单元(mu)和个人耳夹(pec);
图2是pec的部分剖开和截面的侧视图;
图3是用于热测量通道的一个实施例的传感器-组织结构的视图;
图4是显示加热受检者中的传感器-组织结构的原始过程的图形,反映了不同的血糖水平;
图5是显示受检者中的积分和温度修正等效热信号与血糖水平的关系的图形;
图6a是用于超声测量通道的两个超声压电元件之间的耳垂的示意图;
图6b是显示作为δφ被测量的接收和发射波之间的相移的图形;
图7是显示相移与低频范围中的输入换能器频率的关系的图形;并且显示了在选定频率的放大相移值,所述选定频率是在受检者校准期间找到的最佳频率;
图8是在超声通道中的受检者的图形,显示了经温度修正的相移(在选定频率测量)与血糖水平的关系;
图9是显示电磁通道的示意图;
图10是显示受检者的经温度修正的电磁信号(频率)与血糖水平的关系的图形;
图11是耳夹的透视图;
图12是耳夹的侧视图;
图13是耳夹的剖开和部分截面的侧视图;
图14a是热通道的元件的透视图;
图14b是热通道的备选实施例的元件的部分截面端视图;
图14c是类似于图14b的视图并且显示了备选实施例;
图15是超声换能器的第一薄膜的横截面侧视图,第一薄膜优选地也充当电磁通道的电容器的板中的一个;
图16是超声换能器的第二薄膜的横截面侧视图,第二薄膜优选地也充当电磁通道的电容器的板中的一个;
图17a是耳夹的尖端的放大侧视横截面图并且显示了构成测量通道的元件;以及
图17b是耳夹的尖端的一部分的放大顶视横截面图。
具体实施方式
在以下详细描述中,为了提供本发明的透彻理解阐述了许多具体细节。然而,本领域的技术人员应当理解本发明可以在没有这些具体细节的情况下被实施。在其他情况下,未详细描述公知的方法、程序和部件以免使本发明的晦涩难解。
通过参考附图和以下描述可以最佳地理解系统的优选实施例及其优点,其中相似的数字指示各个图的相似和相应部分。对优选实施例的参考是为了举例说明和理解,而不应当被视为限制。
尽管本文中的描述关于人类患者,但是应当理解本文中的设备可以用于测量包括动物的任何受检者中的血糖。
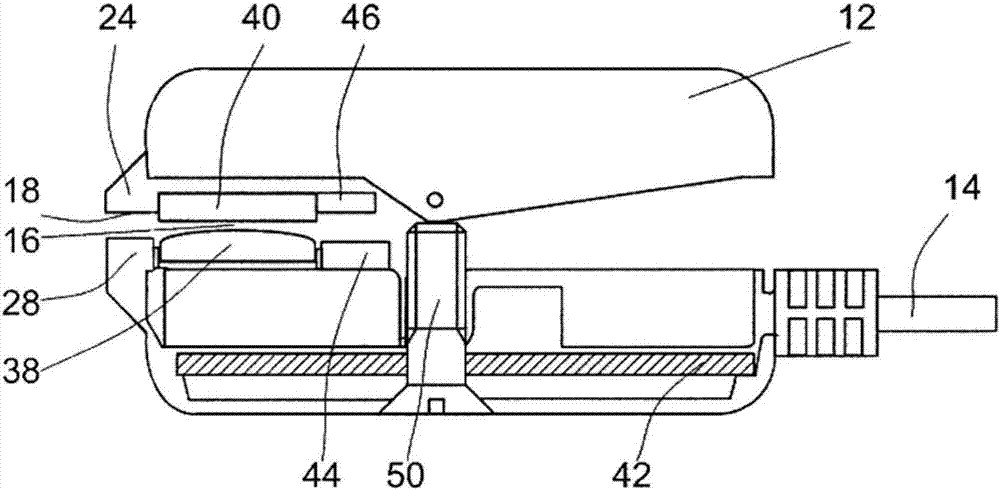
特别地,该设备包括主单元10,所述主单元包含软件应用程序和用于附着到患者的外部单元12。典型地外部单元被放置在患者的(或受检者的或动物的)耳垂上,因此外部单元将典型地被配置为耳夹。
电缆14优选地用于提供主单元10和外部单元12之间的工作连接。应当理解也可以使用无线(例如蓝牙)技术,并且可以避免电缆。
应当理解的是外部单元12可以被放置在受检者的身体的任何其他合适的位置,例如脚趾、手指、拇指和第二指(食指)之间的蹼。通常它应当是具有类似于耳垂的皮肤和组织特性的身体部分。当外部单元在身体上放置在不同于耳垂的地点时,算法的一些调节可能是必要的,原因是皮肤和组织特性在整个身体上是不均匀的。
参考图1,显示了一种用于测量多个血糖值并且然后获得最终血糖读数的单体式无创设备。为了增加无创血糖测量的精度,根据本发明的设备优选地使用一种以上无创方法,优选三种无创方法的组合:超声、电磁和热。这些方法解释血糖变化的组织生理反应,由于两个室的离子浓度、密度、压缩性和水合的变化,导致细胞、间质和血浆室的物理性质(例如电和声阻抗,以及热传递(ht)特性)的变化。
如图1中所示,该无创血糖监测仪包括主单元(mu)10,所述主单元驱动位于被配置为个人耳夹(pec)12(图1)的外部单元上的多个不同的传感器通道,优选三个不同的传感器通道(优选每种技术一个)。为了执行定点测量,pec12在测量期间(大约1分钟)在外部夹紧到用户的耳垂并且之后被去除。电缆14(或任何公知的无线(例如蓝牙)技术)连接设备的这两个部件。
本发明的独特方面在于(单一)外部单元12容纳一个以上测量通道/协议。更优选地它容纳所有元件以实现多个独立和不同的无创血糖测量。优选地,外部单元容纳元件以通过三个独立和不同的技术实现三个独立和不同的无创血糖测量。该单一外部设备提供的优点在于仅仅单一设备必须附连到受检者的身体,这方便了医生和/或患者。在优选实施例中外部单元被配置为耳夹12。
也应当领会和理解每个测量通道本身并且独自是新的和新颖的。因此每个测量通道可以独自单独(或与另外的其他测量通道)被使用。通过将三个测量通道组合到一个单体式设备中,从三个独立和独特测量通道获得测量,由此优化最终读数。
由于水/电解质移位(hillierta,abbotrd,barretej.hyponatremia:evaluatingacorrectionfactorforhyperglycemia.amjmed.1999apr;106(4):399-403;moransm,rljamison.thevariablehyponatremicresponsetohyperglycemia.westjmed.1985jan;142(1):49-53),血糖变化通过组织的热容量(zhaoz.pulsedphotoacoustictechniquesandglucosedeterminationinhumanbloodandtissue.actauniv.oulc169.oulu,finland,2002)、密度(toubalm,asmanim,radziszewskie,nongaillardb.acousticmeasurementofcompressibilityandthermalexpansioncoefficientoferythrocytes.physmedbiol.1999;44:1277-1287)和热导率(muramatsuy,tagawaa,kasait.thermalconductivityofseveralliquidfoods.foodsci.technol.res.2005;11(3):288-294)的变化影响热传递(ht)特性。因此,发生在多层传感器-组织机械结构中的热传递过程的改变是血糖浓度的变化的直接结果(wisslereh.pennes'1948paperrevisited.japplphysiol.1998jul;85(1):35-41)。血糖浓度越高,热容量越低并且热导率越低,因此响应加热导致外部组织层的温度升高越大。由于根据本发明的传感器(一个或多个)(例如热敏电阻器(一个或多个))优选地安装/附着在表皮层上,因此当加热时测量的温度变化的速率和幅度大于内部组织。
根据本发明的热方法将特定量的能量施加于组织。优选地由已知量的能量施加于组织导致的温度变化的速率和/或幅度都是组织的热容量、密度和热导率的函数。因此,根据本发明的设备提供装置使得通过测量在组织加热预定持续时间之后获得的ht特性的变化优选地间接评价血糖水平。
图3显示了根据本发明的一个优选实施例的传感器-组织结构。底板充当加热器18并且热导体20被包括(参见图17)。热传感器22位于导体20之间的中间部分中。如图2中所示,热传感器位于耳夹(pec)12的尖端24上。
现在参考图12和13,优选地包括热敏电阻器22,加热器18和导体20的热模块位于耳朵26上,从耳夹12的一个侧面的末端(例如在耳夹的第一部分上)延伸。相对表面28(即,耳夹的第二部分)优选是空的,不带有热敏电阻器元件。换句话说,当加热器18和热传感器22位于耳夹的相同侧面上时是优选的。特别地,优选的是当外部单元12附连到耳垂时,加热器18和热传感器22关于耳垂位于相同的侧面上。
如图14a,14b和14c中所示,加热器18优选地被制造为板或块并且优选地由电阻器构成。两个板20固定到板的顶部以传导热能并且充当导体20。这可以通过粘接、胶粘或结合或任何其他合适的手段实现。优选地导体20是铝,但是可以使用任何导热材料。在板的底部,优选地设有焊盘30,所述焊盘可以用于将加热器18连接到集成电路板42(参见图13)。优选地,外壳包含所有传感器(例如热敏电阻器)模块化部件。理想地对于4伏系统,电阻器(例如加热器板)具有23到43欧姆之间的电阻并且优选为33欧姆。它生成在大约15°-45℃范围内的热并且优选为大约42–45摄氏度。可以使用任何合适的热传感器。
加热器将热能送入耳朵中。它在标准环境温度15-35℃开始加热过程。通常耳垂的表面略热,为28-32℃。加热器的功率提供优选0.5瓦的最大值和优选0.1瓦的最小值。然而根据其他优选实施例,可以使用优选地加热更长时间的带有更小热能的加热器。也可以使用优选地加热更短时间的带有更大热能的加热器。
应当理解,热敏电阻器模块应当足够小以适配在耳夹的尖端上。优选地构成加热器18的电阻器板为大约5毫米长,0.6毫米厚和2.4毫米宽。导体20优选地为1.5毫米长,0.7毫米厚和2.4毫米宽。至于传感器22,它优选地为1.30毫米长,0.8毫米厚和2.0毫米宽。这些是在市场上可获得的标准元件;并且因此标准的可用传感器不与电阻器板和导体一样宽,而是略微延伸超出导体。总尺寸的小差异是无关紧要的。
热通道有若干可能的实施例。在图14a中显示了一个优选实施例。该实施例由热传感器(热敏电阻器)22,加热器18和热导体20组成。接触耳垂的热模块的表面涂覆有导热生物相容涂层64。当加热器18被接通时,热通量穿过热导体20和热敏电阻器22,通过涂层到达耳垂(或身体的其他部分)。耳垂的热吸收取决于血糖水平。热敏电阻器22测量耳垂中的温度的变化,所述温度的变化受到耳垂的加热强度和吸收影响。该温度用于通过数据处理进行分析以确定血糖水平。
图14b表示热通道的另一个优选实施例。它由热传感器(热敏电阻器)22,加热器18和具有高热导率的金属薄膜58组成。这些部件(薄膜58,热敏电阻器22和加热器18)用导热粘合剂54胶粘在一起。优选地,薄膜58用粘合剂56粘接到pec12。薄膜58的外表面具有与耳垂的良好热接触。当加热器18被接通时,热通量穿过热敏电阻器22和薄膜58到达耳垂(或身体的其他部分)。耳垂的温度变化取决于血糖水平,并且热敏电阻器22测量耳垂中的温度的变化,所述温度的变化用于数据处理和确定血糖水平。
在图14c中显示了热通道的第三优选实施例。它由热传感器(热敏电阻器)22,两个加热器18,印刷电路板(pcb)60和具有高热导率的金属薄膜58组成。这些部件(薄膜58,热敏电阻器22和加热器18)用导热粘合剂54粘接在一起。优选地,薄膜58用粘合剂56胶粘到pec12。加热器18和热敏电阻器22焊接到pcb60上。薄膜58的外表面具有与耳垂的良好热接触。当加热器18被接通时,热通量穿过薄膜58到达耳垂(或身体的其他部分)。耳垂的温度变化取决于血糖水平,并且热敏电阻器22测量耳垂中的温度的变化,所述温度的变化用于数据处理和确定血糖水平。
图4显示了加热受检者中的传感器-组织结构的原始过程。加热过程的不同曲线形状表示不同的血糖浓度。温度在图4中以摄氏度表示。
限定表面皮肤温度和传感器的初始温度的边界条件的环境温度也对该过程有影响。所以,热过程被积分和归一化以考虑初始皮肤表面温度,接着进行环境和皮肤温度之间的温差的补偿(方程1)。在图5中显示了作为血糖浓度的函数的积分、修正和补偿信号(热信号)。
其中t0和tf是加热过程的开始和结束时间;tear和tamb是组织和环境温度,并且k相应地是温度修正系数。
图5显示了受检者中的积分和温度修正热信号与血糖水平的关系。
可以通过测量通过组织的声速度间接地评价血糖浓度的变化。当血糖浓度增加时,传播速度也增加(zhaoz.pulsedphotoacoustictechniquesandglucosedeterminationinhumanbloodandtissue.actauniv.oulc169.oulu,finland,2002;toubalm,asmanim,radziszewskie,nongaillardb.acousticmeasurementofcompressibilityandthermalexpansioncoefficientoferythrocytes.physmedbiol.1999;44:1277-1287;美国专利5,119,819)。由于传播速度线性地取决于血糖浓度,因此组织中的血糖含量越高,超声波传播通过它越快,因此减小了传播的时间。
在一个优选实施例中,超声测量通道由靠近受检者的耳垂16附连(或可附连)的压电元件(具体地,超声发射器34和超声接收器36)组成。优选地电子电路也被提供用于超声测量通道。发射器34(超声压电元件)位于外部设备中,使得(当外部设备附连到耳垂时)由发射器产生的连续超声波以特征速度传播通过耳垂,导致发射和接收波之间的相移
压电元件(发射器34和接收器36,可选地后面跟着放大器)布置在受检者的耳垂的每个侧面的一个上(例如参见图6a)。主单元(mu)10将信号发送到发射器34以发射信号。在传播通过耳垂16之后,接收器36升高接收信号并且将它发回mu10供算法进行处理以获得相应的血糖值。
在耳夹12的相对侧面上布置有压电元件(发射器36和接收器34)。通常,超声元件对机械压力敏感。为了保护元件和保持元件的功效,薄膜38和40优选地被放置在超声元件上(参见图15和16)。优选地,超声传导粘合剂或胶水(例如环氧树脂)被放置在薄膜和超声元件之间以将薄膜紧紧地保持在超声元件上。通常粘合剂或胶水或环氧树脂应当适合于传导超声波,因此信号损失极小。0.05mm的层通常足以用于粘接材料。
由于超声压电元件也布置在耳夹中,因此这里它们再次应当被制造得较小。它们可以是任何合适的尺寸,但是优选地在本文中所示的优选实施例中超声压电元件为圆形并且直径为大约9.0毫米且厚度小于3.0毫米。薄膜38,40优选地被制造为圆形并且具有大约9.5毫米的直径。应当理解的是任何尺寸是可接受的,只要它适配在耳夹中。
导电和生物相容涂层优选地被放置在薄膜38,40的外表面上以增强信号的传播。典型地0.01mm的涂层就足够了。
薄膜可以优选地由镍制造,镍通常是生物稳定的并且传导信号良好。可以使用任何其他合适的材料,例如金或钛。
优选地,薄膜38,40由带有镍涂层的铜制造。在一个备选实施例中,薄膜可以由不锈钢制造并且将不需要涂层。
在优选实施例中,发现有利的是一个薄膜40是平坦的并且另一个38是凸出的。从适配的观点来看该“混合”组合提供最佳解决方案,并且将设备牢固地保持在受检者的耳垂上。
频率范围可以从180k赫兹(18khz)到1兆赫兹(1mhz)并且信号幅度可以从0.5伏到3伏。接收信号幅度可以在5mv到50mv之间。优选地接收器将信号放大大约20倍。
如图15和16中所示,超声压电元件优选地适配到各自薄膜中,在它们之间有粘合剂(或环氧树脂)层。
速度是相位相关的(方程2):
其中f:频率(hz);
在校准期间,两个最佳频率被选择,一个来自低频范围并且一个来自高频范围,其中所述频率范围是不交迭的。在校准之后,在两个选定频率进行测量。
图7显示了作为函数族的测得相移值的图形,所述函数族以激励频率作为自变量并且以血糖值作为族的参数。组织厚度确定测得相移循环的部分(上升或下降)。在图7所示的布置中,循环的下降部分被显示,导致
图7中的该图形显示了相移与低频范围中的输入换能器频率的关系。显示了在选定频率的放大相移值,所述选定频率是在受检者校准期间找到的最佳频率。图形上的不同曲线适用于不同的血糖水平。
公知的是超声波的速度取决于传播介质温度(美国专利5,119,819;zipsa,faustu.determinationofbiomassbyultrasonicmeasurements.applenvironmicrobiol.1989july;55(7):1801–1807;sarvazyana,tatarinova,sarvazyann.ultrasonicassessmentoftissuehydrationstatus.ultrasonics.2005;43:661–671)。环境温度影响传感器参数,而组织温度影响组织自身中的波传播。所以,使用环境和组织温度的温度修正是必要的。使用以下公式(方程3)对测得放大相移执行温度修正(图8):
其中phase_shift_cor是温度修正放大相移;g2是修正系数;tamb是环境温度;并且tear是耳垂表面温度。修正的符号取决于相移随着频率变化的方向。
图8是显示受检者的经温度修正的相移(在选定频率测量)与血糖的关系的图形。
血糖诱导的水和离子穿过细胞膜的转移导致细胞和随后细胞外室的电性质的变化(genets,costalatr,burgerj.theinfluenceofplasmamembraneelectrostaticpropertiesonthestabilityofcellioniccomposition.biophysj.2001nov;81(5):2442–2457;hayashiy,livshitsl,caduffa,feldmany.dielectricspectroscopystudyofspecificglucoseinfluenceonhumanerythrocytemembranes.jphysd:applphys.2003;36:369-374)。最初,观察到介电性质的变化(gudivakar,schoellerd,kushnerrf.effectofskintemperatureonmulti-frequencybioelectricalimpedanceanalysis.applphysiol.1996aug;81(2):838-845),其因此在整个组织阻抗的变化中被反映。为了反映由血糖变化导致的组织电阻抗的变化,电磁通道(emc)包括专用自振荡电路并且充当介电材料的耳垂定位在连接到电路(图9)的两个电极之间。
图9显示了电磁测量通道(emc),其中rin是输入电阻;z(d,ε)是反馈中的感测元件(包括耳垂组织的emc积分器)的传递算子;传递算子时间常数取决于表示为ε的组织电容率;
用于超声通道的相同薄膜38和40也可以优选地充当电容器板并且耳垂16充当电介质。振荡器用于生成信号并且这些信号取决于耳垂的参数。频率范围可以从5k赫兹(5khz)到100k赫兹(100khz)并且幅度可以从0.1伏到1.5伏。
在测量中也考虑耳垂温度,原因是组织阻抗是温度相关的(gudivakar,schoellerd,kushnerrf.effectofskintemperatureonmulti-frequencybioelectricalimpedanceanalysis.applphysiol.1996aug;81(2):838-845)。在em通道的干扰表示变量当中,环境温度扮演两个角色:a)影响组织参数;b)影响传感器的电磁参数,例如电极的寄生电容。所以使用方程4对电磁信号进行环境和耳朵温度修正,如图10中所示。
其中:electromagnetic_signal_cor是温度修正电磁信号(自振荡频率);d是修正系数;tamb是环境温度;并且tear是耳垂表面温度。
在一个优选实施例中,也有在耳夹(pec)12上的距离传感器,在一个侧面上的磁体44和在另一个侧面上的传感器46。传感器46优选地是磁场测量传感器,测量磁场强度以保证薄膜之间的距离与在校准阶段相同。
图11显示了耳夹12的优选实施例。优选地它由abs塑料制造,但是任何合适的材料将是有效的。尺寸取决于受检者的耳垂尺寸。在一个优选实施例中,它优选地为大约25毫米长和大约宽。它可以为锥形。优选地将有不同尺寸的夹子以适应不同耳垂尺寸的受检者。
对于夹子来说公知的是优选一个侧面围绕另一个枢转。一个侧面具有枢轴销,所述枢轴销适配在耳夹的另一部件中的适当容座中。弹簧用于偏压。
优选地,也提供可以位于外部单元12,主单元10和/或可以被放置在电缆14上(参见图1)的环境温度传感器52。
优选地,在现代电子设备中常见地,集成电路板42安装在耳夹12内(参见图13)。三个通道(超声、电磁和热)的前述部件安装在它们上。然后,通过电缆或通过无线技术(例如蓝牙),建立与主单元的通信。当需要时,主单元发出信号以用于启动每个测量通道并且然后用于收集数据,其后计算血糖值。
优选地,在血糖测量之前执行校准,使得个人准稳定因素(例如组织结构)的影响可以被最小化。在校准之前,根据用户的耳垂的厚度,传感器单独被调节以获得最佳适配。优选地调节螺钉50(图2,14和16)用于调节传感器之间的距离并且因此调节耳垂上的压力以获得最佳适配。该动作可以由主单元10引导。可选距离传感器44,46优选地保证该预设距离被保持。
在调节耳夹(pec)12之后,校准过程开始。在本文中阐述了用于校准的一个优选程序。
校准程序包括使从指尖毛细血管血获得的有创基本和餐后血糖数据与用该设备和作为参考的有创设备进行的六个顺序测量相关联,生成每个个人独有的校准曲线。
前三个校准点在相同(禁食)血糖水平被执行并且帮助建立在校准中使用的模型的相当精确的初始点。它们在禁食状态下被执行,由一个有创和三个连续无创测量组成,接着进行食物和饮料摄取,以便将血糖从禁食值增加至少30%但是不低于30mg/dl。在一些情况下这可以在非禁食状态下完成。餐后20分钟,进行一组五对顺序测量,之间的时间间隔为大约10分钟。校准过程总共耗时大约1.5到2小时。
在第一校准点,距离自动被测量(借助于设在耳夹12中的可选距离传感器44,46或通过使用备选方法)并且被设置为传感器的参考距离(初始位置或预设参考点),在后续参考点以及测量点中,在开始测量之前检验所述参考距离。耳垂是带有同质表面的大体平行组织。所以,如果在任何校准点或在定期测量点中的距离不同于(在一定公差范围内)预设参考点,则当需要时用户由设备引导移动pec12以便达到参考距离。一旦校准完成,个人线性模型的参数的向量被设置用于每个技术的输出。
对于热技术,在第一点的测量期间检验加热密度并且计算将在结果测量中使用的最佳加热密度的修正系数。为每个用户单独计算该系数以便保证将组织表面温度增加到最小增量阈值之上。
对于电磁技术,在三个接近但是不同的频率范围执行振荡。根据校准期间个人对血糖变化的敏感度选择最佳频率范围。此外,工作频率范围和相邻频率范围之间的最大和最小偏差被设置为电磁信号有效性过滤器的阈值(方程5):
其中emmin和emmax相应地是最小和最大电磁信号阈值;emi是工作频率范围内的电磁信号;并且emj是相邻频率范围内的电磁信号。
为了选择声测量方法的最佳工作频率,在校准期间,在低频和高频范围内执行2个频率范围的扫描。在每个范围内,根据信号的幅度(传播信号的强度)和在该特定频率下相移对血糖变化的敏感度选择最佳频率。校准后,在这2个选定频率(一个来自低频范围并且一个来自高频范围)下执行测量。
在每个校准点,优选的是获得环境和组织温度。在校准过程结束时,找到两个温度之间的关联。该关联以后用于发现每个测量的测得耳朵和环境温度中的偏差。
在校准之后,可以通过在测量期间(大约1分钟)将耳夹12夹紧到耳垂执行血糖定点测量并且之后去除它。
在传感器的定位验证之后(通过该设备),使用在调节期间建立的距离参考,开始测量。每个测量通道产生若干输出,对所述输出应用三级信号处理:信号验证和异常值的识别;温度补偿和温度修正。
在超声通道的第一阶段中,检验每个选定频率的信号幅度以保证合适的波传播通过组织。
由于电磁和超声传感器物理地安装在组织的相同区域上,因此低测量幅度指示不良接触质量。在该情况下被测量被忽略并且故障提示被提供给用户。在热技术中,传感器安装在不同于电磁和超声传感器的组织区域上。所以,后两个技术的良好质量接触并不保证热通道的良好质量接触。因此,也通过有效性过滤器检验加热过程的最小和最大温度阈值上升。越界上升被视为不良接触质量并且为用户产生故障提示。如校准部分中所述,也检验电磁通道输出的工作频率范围和相邻范围之间的最大和最小偏差。
由于环境和组织温度在每个测量通道中都用于补偿,因此它们应当首先被检验有效性。所以,在第二阶段中,测试温度相对于校准的关联。所以,对于每个测量,低关联指示测量温度中的一个的干扰。受扰温度首先根据另一个温度被补偿,然后两者用于信号温度修正,在所有三个技术上被协调。
第三阶段包括所有技术的输出的温度修正,如先前所述。此外,使用在校准程序中建立的模型系数计算每个测量通道的血糖值。
检验从每个测量通道接收的血糖值的关联。随后,根据关联的程度将权重分配到三个值的每一个。最后,三个技术输出的加权组合产生更精确的血糖读数。
血糖和其他血液溶质影响不同组织室(例如间质、血液、细胞)中的不同组织性质,例如传导率、电容率、热容量、密度和压缩性。因此,测量这样的性质可以导致人体中的bg水平的评价。
通常,产生趋势分析或连续血糖值的无创设备(在开发阶段)测量由与血糖关联的组织参数的变化反映的生理现象(khalilos.non-invasiveglucosemeasurementtechnologies:anupdatefrom1999tothedawnofthenewmillennium.diabetestechnolther.2004oct;6(5):660-697;smithjl.thepursuitofnoninvasiveglucose:“huntingthedeceitfulturkey”.2006)。然而,从这样的关联导出的实际血糖值不同于真实血糖值,原因是除了血糖以外的因素也影响组织参数。这些干扰因素减小信噪比并且导致读数的不精确。
为了最小化那些干扰的影响,组合多技术和多传感器的方法被提出。每个技术测量受到血糖浓度的相同变化影响的不同组织参数。因此,每个方法本身指示血糖,但是由于缺少专一性,由干扰因素的影响限制。所以,通过由血糖浓度的变化引起的组织干扰的不同集合的测量同时评价所述生理变化预期增加最终结果的有效性。
提出的方法显示了有助于多技术和多传感器方法的不错结果。原因是该整合有助于增加信噪比。这些多传感器允许传感器的接触质量的确定,解释测量参数的有效性,以及干扰(例如温度)的补偿和修正。
尽管在本文中示出和描述了本发明的某些特征,但是本领域的普通技术人员将容易想到许多修改、替换、变化和等效物。参考特定实施例详细描述了本发明,但是应当理解各种其他修改可以实现并且仍然在本发明的精神和范围内。所以应当理解附带权利要求旨在涵盖属于本发明的真实精神内的所有这样的修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!