一种可调节药物释放的脂质体组合物及其制备方法与流程
本发明涉及制药领域,尤其涉及一种可调节药物释放的脂质体组合物及其制备方法。
背景技术:
不依靠药物递送系统(drugdeliverysystem,dds)的药物治疗通常受限于活性成分广泛的生物分布和对病变细胞较低的特异性,这种体内行为不仅会造成药物在病灶部位达不到有效浓度,还有可能引起严重的副作用。
脂质体作为一种药物载体被广泛使用,它不仅可以改善药物体内分布,隐形修饰后,还具有一定的长循环和缓释作用,同时能减少对正常细胞的毒性。特别地,对于肿瘤治疗来说,由于实体瘤的高通透性和滞留效应(enhancedpermeabilityandretentioneffect,epr),药物用脂质体包裹后,能被动靶向作用于病变部位,从而提高药物的治疗指数,同时还可减少药物的治疗剂量,降低全身不良反应,提高用药安全性。
脂质体作为多种药物的载体,具有较好的生物相容性和一定的靶向性,但为了在临床上达到较好的治疗效果,脂质体递送系统首先应该具有较高的药物装载效率;其次,由于脂质体多是注射给药,因此在到达靶部位前,包载药物的脂质体在血液和正常生理环境中应该有合理的稳定性;最后,在到达靶部位时,药物应能有效地从脂质体中释放,及时发挥其生物活性。此外,脂质体产品在储藏期间也应该具有一定的稳定性。
目前,脂质体的制备方法主要包括被动载药法和主动载药法,其中主动载药法的发明,如ph梯度法、硫酸铵梯度法和离子载体法等,使得多数弱酸和弱碱性药物都可达到较理想的包封效率,此外,脂质体的隐形修饰也使其在血液中的循环时间大大延长。但另一方面,某些疾病如恶性肿瘤,细胞增殖迅速,疾病进程发展较快,到达肿瘤部位的脂质体中的活性药物能否有效地从脂质体中释放出来,及时发挥疗效,这是脂质体药物能否发挥其临床优势的一个关键因素。
脂质体中药物的释放行为与其疗效密切相关。一方面,药物在装载入脂质体后,若释放速率过快,有可能会造成药物在血液中的快速泄露,使得到达靶部位的药物量大大减少,严重降低脂质体药物的治疗效果。另一方面,即使脂质体中的药物在血浆中可达到较好的保留,其临床效果也不一定理想,如包载顺铂的隐形脂质体,在肿瘤部位的药物浓度是游离药物注射时的好几倍,但其临床效果并不显著,这是因为药物在靶部位没有及时从脂质体中释放出来,发挥作用(systemicandtumordispositionofplatinumafteradministrationofcisplatinorstealthliposomal-cisplatinformulations(spi-077andspi-077b103)inapreclinicaltumormodelofmelanoma[j].cancerchemotherapyandpharmacology,2004,53(4))。由此说明,脂质体药物在靶组织或靶部位的释放行为,很大程度上决定了其治疗效果。
随着脂质体制剂应用范围的逐渐增大,许多研究者们都对脂质体的释放行为做了诸多改善,以期望在不影响脂质体稳定性的前提下,使脂质体药物在疾病治疗中有合适的释放效率和理想的治疗效果。
中国专利cn101744767b提供了一种包含喜树碱类抗肿瘤药物的热敏脂质体制剂,在脂质体中加入了磷脂相变调节剂,使脂质体在肿瘤组织局部加热时,在该部位大量释放药物,以提高疗效。但这种脂质体在使用时,需对患者进行局部加热,这对于某些内脏肿瘤、血液瘤和淋巴瘤明显不适用。
中国专利cn106668882a公布了一种超声敏感性脂质体的制备方法,该制备方法制备的脂质体磷脂双分子层之间分布的气体在超声作用下逐渐膨胀,使脂质体在治疗部位定点快速释放药物,增加疗效。同样的,对于外加超声来说,某些内脏肿瘤、血液瘤和淋巴瘤并不适用。
中国专利cn103585106a和韩国专利wo2011129588公布了一种表面由改性聚天冬氨酸修饰的脂质体,该改性聚天冬氨酸在侧链上接枝了一条脂肪链,疏水性的脂肪链插入磷脂双分子层的疏水层,使得改性聚氨基酸主链修饰在脂质体表面,起到稳定脂质体的作用。中国专利cn103585106a还提到,这种修饰脂质体在酸性条件下,由于改性聚天冬氨酸的构象变化,可破坏磷脂双分子层,使药物释放。这两项专利中的修饰剂需由聚天冬氨酸与脂肪链反应得到,反应步骤较复杂;另外,由于聚天冬氨酸的表面修饰,得到的脂质体表面电位达到-40mv左右,这种较高负电荷的纳米制剂可能获得较低的细胞摄取效率(细胞表面带负电);最后,这种酸诱导性的释放对于被动载药法制备的脂质体可能适用,但对于peg修饰的隐形脂质体或主动载药法(如硫酸铵梯度法)制备的脂质体来说,可能并不适用,原因在于这些脂质体中的药物释放行为对酸刺激相对不敏感。
由以上分析可知,利用物理因素诱导脂质体药物的定点释放有一定的局限性,而利用疾病部位的微环境和生理因素诱导的药物释放具有更普遍的适应性,这种方法的应用一方面要求对脂质体进行有针对性的改造,另一方面还要注意这种改造不应该对脂质体特征产生较大的影响。
技术实现要素:
为了解决上述技术问题,本发明提供了一种可调节药物释放的脂质体组合物及其制备方法。本发明脂质体组合物的脂质体内水相中含有治疗剂、聚氨基酸或其盐,该脂质体组合物在使治疗剂有较高的包封效率和一定的稳定性的基础上,还可确保药物在病灶部位有合理的释放效率,从而使药物及时从脂质体释放出来,有效发挥脂质体作为药物递送载体的优势。同时,由于该聚氨基酸具有优良的可降解性,因而得到的脂质体组合物安全性较高。另一方面,本发明的聚氨基酸制备方法简便,国内可大规模供货,且在本发明中可直接作为内水相使用,因而使得脂质体制备工艺简单、条件温和、控制参数较少,有利于降低生产成本,易于工业化生产。
本发明的具体技术方案为:一种可调节药物释放的脂质体组合物,包括:
脂质体;
包含封装在所述脂质体内水相的介质;所述介质包括:
至少一种聚氨基酸或其盐;
至少一种治疗剂;
可使脂质体内外产生离子梯度且可使治疗剂包封在脂质体内水相的化合物。
针对脂质体在到达病灶部位后药物的释放速率问题,如上背景技术中所述,以peg修饰的隐形脂质体在血液中非常稳定,由于其稳定性过强,这种脂质体到达病灶区后,药物释放过于缓慢甚至无法释放,即使检测到病灶区已达到有效药物治疗浓度,其治疗效果也差强人意,甚至可能不如游离药物的治疗效果。
本发明人发现,将水溶性的聚氨基酸与药物同时装载入脂质体内水相时,在某些特定环境下,可以调节药物从脂质体中的释放速率,而且这种调节作用还与内水相中聚氨基酸的量有一定的关系。
氨基酸是一类同时含有一个或多个氨基和羧基的脂肪族有机酸,天然氨基酸具有良好的生物相容性和生物降解性。聚氨基酸是由天然氨基酸聚合而成,在体内可降解为氨基酸单体,因而其安全性较高。聚氨基酸可含有大量的氨基和羧基,进一步可分为阳离子聚氨基酸(如聚赖氨酸、聚精氨酸等)和阴离子聚氨基酸(如聚天冬氨酸、聚谷氨酸等)。
阴离子聚氨基酸侧链含有丰富的-coo-,而磷脂作为构成脂质体的主要成分,通常含有大量的磷脂酰胆碱,其亲水头部-n+基团带正电,在将阴离子聚氨基酸作为内水相制备脂质体时,聚氨基酸可通过静电吸附作用吸附到脂质体亲水内表面,另一方面,由于阴离子聚氨基酸的这种聚阴离子特性与所处环境中的氢质子h+浓度有关,在h+浓度较高时,-coo-可结合质子,并发生构象变化,从而对脂质体双层膜的结构和流动性造成一定影响,加速药物释放。
作为优选,所述聚氨基酸为阴离子聚氨基酸;聚氨基酸盐为聚氨基酸与碱生成的盐。
作为优选,所述阴离子聚氨基酸为侧链上有多个羧基的聚氨基酸。
作为优选,所述阴离子聚氨基酸为由天然氨基酸和/或其衍生物无规共聚形成的侧链上有多个羧基的聚氨基酸。
作为优选,所述天然氨基酸为天冬氨酸和谷氨酸。
作为优选,所述聚氨基酸的分子量为0.5×104至20×104。
作为优选,所述聚氨基酸在脂质体内水相的浓度为0.1-100mg/ml。
作为优选,所述脂质体由脂类或脂类与胆固醇类化合物构成。
作为优选,所述脂类为天然磷脂、合成磷脂中的至少一种。
作为优选,所述天然磷脂为大豆磷脂、卵磷脂中的一种或两种;所述合成磷脂为胆碱类磷脂、乙醇胺类磷脂或聚乙二醇修饰的磷脂中的一种或多种。
作为优选,所述胆碱类磷脂选自二豆蔻酰磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、二油酰基卵磷脂、二芥酰基卵磷脂、1-棕榈酰基-2-油酰基卵磷脂中的至少一种。
所述乙醇胺类磷脂选自二肉豆蔻酰基磷脂酰乙醇胺、二棕榈酰基磷脂酰乙醇胺、二硬脂酰基磷脂酰乙醇胺、二油酰磷脂酰乙醇胺、二芥酰基磷脂酰乙醇胺中的至少一种。
所述聚乙二醇修饰的磷脂为二硬脂酰磷脂酰乙醇胺-聚乙二醇。
作为优选,所述胆固醇类化合物选自普通胆固醇、聚乙二醇修饰的胆固醇中的一种或者两种。
作为优选,所述聚乙二醇修饰的胆固醇为聚乙二醇单甲醚胆固醇琥珀酸酯。
作为优选,所述治疗剂为弱碱性治疗剂。
作为优选,所述弱碱性治疗剂选自抗肿瘤化合物、局部麻醉剂、肾上腺素拮抗剂、抗心律失常药物、生物胺类、抗抑郁药物、抗组胺药物、抗疟疾药物、抗原虫药中的至少一种。
作为优选,所述抗肿瘤化合物选自蒽环类抗生素、喜树碱类、长春花碱类;
所述局部麻醉剂选自氯丙嗪、利多卡因、二丁卡因、布比卡因;
所述肾上腺素拮抗剂选自普萘洛尔、噻吗洛尔;
所述抗心律失常药物为奎尼丁;
所述生物胺类选自多巴胺、5-羟色胺;
所述抗抑郁药物为丙咪嗪;
所述抗组胺药物为苯海拉明;
所述抗疟疾药物选自奎宁、氯喹、羟氯喹;
所述抗原虫药为奎纳克宁。
作为优选,所述蒽环类抗生素可为多柔比星、柔红霉素;所述喜树碱类可为如伊立替康、拓扑替康;所述长春花碱类可为长春花碱、长春新碱、长春瑞滨。
作为优选,所述化合物为采用主动载药法包载治疗剂时,形成脂质体内外离子梯度所需的化合物。该化合物属于本领域技术人员所常用或知晓的化合物
作为优选,所述主动载药法选自ph梯度法、硫酸铵梯度法、离子载体法。
一种上述的可调节药物释放的脂质体组合物的制备方法,包括以下步骤:
(1)将脂类或脂类与胆固醇类化合物溶解于油相,与含有可形成离子梯度的化合物、聚氨基酸或其盐的水相混合,得到内水相含有聚氨基酸的空白脂质体悬浮液。
(2)置换外水相,使脂质体内外形成离子梯度。
(3)在外水相中添加治疗剂,使治疗剂主动载入脂质体内水相。
与现有技术对比,本发明的有益效果是:
1、本发明的脂质体组合物在使治疗剂有较高的包封效率和一定的稳定性的基础上,还可确保药物在病灶部位有合理的释放效率,从而使药物及时从脂质体释放出来,有效发挥脂质体作为药物递送载体的优势。
2、本发明的脂质体组合物含有水溶性聚氨基酸或其盐类化合物作为脂质体内水相成分,由于这类天然氨基酸及其聚合物具有优良的可降解性,因而得到的脂质体组合物安全性较高。
3、另一方面,这类氨基酸聚合物制备方法简便,国内可大规模供货,且在本发明中可直接作为内水相使用,因而使得脂质体制备工艺简单、条件温和、控制参数较少,有利于降低生产成本,易于工业化生产。
附图说明
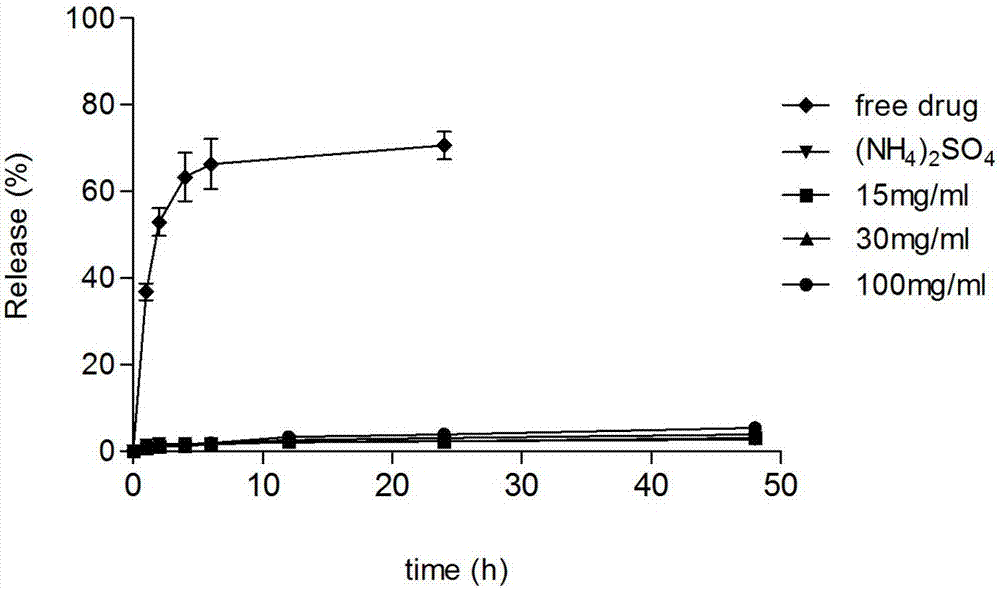
图1为游离盐酸伊立替康溶液及不同内水相的伊立替康脂质体在ph7.4的磷酸盐缓冲液中的药物释放曲线图。
图2为游离盐酸伊立替康溶液及不同内水相的伊立替康脂质体在含有铵离子的ph7.5的等渗缓冲液中的药物释放曲线。
具体实施方式
下面结合实施例对本发明作进一步的描述。
实施例1
内水相含有聚天冬氨酸钠(15mg/ml)的载药脂质体的制备:
空白脂质体的制备:将二硬脂酰磷脂酰胆碱(dspc)、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)以质量比3∶1∶0.36溶解于无水乙醚中,充分溶解后混合均匀,然后减压蒸去有机溶剂乙醚,使磷脂等成膜材料在烧瓶底部形成均匀脂膜,然后加入含有0.25m硫酸铵和15mg/ml聚天冬氨酸钠(mw=9k)的水溶液,50℃水浴旋蒸水化30min,涡旋5min,使用脂质体挤出设备,将所得到的脂质体悬浮液挤压通过孔径为200nm和100nm的聚碳酸酯膜各10次,以降低空白脂质体的粒径。
弱碱性药物的包载:将上一步得到的空白脂质体通过切向流超滤设备进行外水相的置换,将外水相置换为0.9%的氯化钠溶液,以形成脂质体内外的离子梯度。以药脂比为1∶3.85(w/w)将溶有盐酸伊立替康的水溶液加入到上述脂质体溶液中,并在65℃孵育10min,冰浴快速冷却至室温后,得到载药脂质体溶液。
实施例2
内水相含有聚天冬氨酸钠(30mg/ml)的载药脂质体的制备:
空白脂质体的制备:将二硬脂酰磷脂酰胆碱(dspc)、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)以质量比3∶1∶0.36溶解于无水乙醚中,充分溶解后混合均匀,然后减压蒸去有机溶剂乙醚,使磷脂等成膜材料在烧瓶底部形成均匀脂膜,然后加入含有0.25m硫酸铵和30mg/ml聚天冬氨酸钠(mw=9k)的水溶液,50℃水浴旋蒸水化30min,涡旋5min,使用脂质体挤出设备,将所得到的脂质体悬浮液挤压通过孔径为200nm和100nm的聚碳酸酯膜各10次,以降低空白脂质体的粒径。
弱碱性药物的包载:将上一步得到的空白脂质体通过切向流超滤设备进行外水相的置换,将外水相置换为0.9%的氯化钠溶液,以形成脂质体内外的离子梯度。以药脂比为1∶3.85(w/w)将溶有盐酸伊立替康的水溶液加入到上述脂质体溶液中,并在65℃孵育10min,冰浴快速冷却至室温后,得到载药脂质体溶液。
实施例3
内水相含有聚天冬氨酸钠(100mg/ml)的载药脂质体的制备:
空白脂质体的制备:将二硬脂酰磷脂酰胆碱(dspc)、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)以质量比3∶1∶0.36溶解于无水乙醚中,充分溶解后混合均匀,然后减压蒸去有机溶剂乙醚,使磷脂等成膜材料在烧瓶底部形成均匀脂膜,然后加入含有0.25m硫酸铵和100mg/ml聚天冬氨酸钠(mw=9k)的水溶液,50℃水浴旋蒸水化30min,涡旋5min,使用脂质体挤出设备,将所得到的脂质体悬浮液挤压通过孔径为200nm和100nm的聚碳酸酯膜各10次,以降低空白脂质体的粒径。
弱碱性药物的包载:将上一步得到的空白脂质体通过切向流超滤设备进行外水相的置换,将外水相置换为0.9%的氯化钠溶液,以形成脂质体内外的离子梯度。以药脂比为1∶3.85(w/w)将溶有盐酸伊立替康的水溶液加入到上述脂质体溶液中,并在65℃孵育10min,冰浴快速冷却至室温后,得到载药脂质体溶液。
对比例1
硫酸铵法包载弱碱性药物的脂质体的制备:
空白脂质体的制备:将二硬脂酰磷脂酰胆碱(dspc)、胆固醇、二硬脂酰磷脂酰乙醇胺-聚乙二醇(dspe-peg)以质量比3∶1∶0.36溶解于无水乙醚中,充分溶解后混合均匀,然后减压蒸去有机溶剂乙醚,使磷脂等成膜材料在烧瓶底部形成均匀脂膜,然后加入0.25m的硫酸铵水溶液,50℃水浴旋蒸水化30min,涡旋5min,使用脂质体挤出设备,将所得到的脂质体悬浮液挤压通过孔径为200nm和100nm的聚碳酸酯膜各10次,以降低空白脂质体的粒径。
弱碱性药物的包载:将上一步得到的空白脂质体通过切向流超滤设备进行外水相的置换,将外水相置换为0.9%的氯化钠溶液,以形成脂质体内外的离子梯度。以药脂比为1∶3.85(w/w)将溶有喜树碱类药物-盐酸伊立替康的水溶液加入到上述脂质体溶液中,并在65℃孵育10min,冰浴快速冷却至室温后,得到载药脂质体溶液。
实施例4
含有不同内水相的载药脂质体的表征:
将实施例1~3以及对比例1中的载药脂质体溶液采用动态光散射粒径仪测定粒径,同时,用sephadexg-50凝胶柱层析法分离脂质体和未被包封在内的游离药物,计算药物包封率。
实验结果。
含有不同内水相的载药脂质体的表征,结果如表1所示:
表1.含有不同内水相的载药脂质体的表征
结论:采用硫酸铵梯度法包载弱碱性药物伊立替康时,内水相分别加入15mg/ml、30mg/ml和100mg/ml的聚天冬氨酸钠,在药脂比(w/w)为1∶3.85时,均获得了较高的包封率,且制备的载药脂质体具有相似的粒径和表面电位。
实施例5
含有不同内水相的载药脂质体的体外释放:
样品分别为游离盐酸伊立替康溶液及实施例1~3、对比例1中所制得的载药脂质体。
释放介质1:ph7.4的磷酸盐缓冲液
取250ml0.2mol/l磷酸二氢钾溶液,再加入195.5ml0.2mol/l氢氧化钠溶液混合后,加水稀释至1000ml,摇匀,即得。
释放介质2:含有铵离子的ph7.5的等渗缓冲液
称取葡萄糖45g,l-组氨酸1.55g,氯化铵0.56g,加水溶解并稀释至1000ml,用氢氧化钠溶液调节ph至7.5,混匀即得。
释放条件:将样品与相同体积的释放介质混合后,装入透析袋,两端扎紧,放入装有释放介质的溶剂瓶中,并将溶剂瓶置于37℃的恒温震荡水浴锅中,设置震荡速度为100rpm,并分别在1、2、4、6、8、12、24、48小时取样,测定释放率。
实验结果
图1显示了样品在ph7.4的磷酸盐缓冲液中的药物释放曲线,图2显示了样品在含有铵离子的ph7.5的等渗缓冲液的药物释放曲线。
结论1:对比例1中内水相为硫酸铵的伊立替康脂质体在ph7.4的磷酸盐缓冲液非常稳定,释放极为缓慢,而在内水相引入不同剂量的阴离子聚天冬氨酸钠后,释放速率基本没有差异,这表明聚天冬氨酸钠的引入对于脂质体在正常生理环境中的稳定性没有影响。样品在ph7.4的磷酸盐缓冲液的稳定性得益于脂质体表面peg的隐形修饰。
结论2:实施例1~3以及对比例1中的脂质体样品是采用硫酸铵梯度法制备的,对于内水相仅含硫酸铵的对比例1的样品来说,当释放介质中含有氯化铵时,游离的nh3可跨膜进入脂质双层内部,使质子化的伊立替康药物转变为可跨膜的分子态,进而促进伊立替康的释放,因此对比例1的样品在含有氯化铵的释放介质中有一定的释放速率,24h的累计释放率为67.4%。
结论3:实施例1~3中的脂质体样品在脂质体制备时,内水相引入了聚天冬氨酸钠,聚阴离子侧链的coo-与磷脂双分子层的亲水头部有一定的静电吸附,聚阴离子保持舒展的构象;在释放介质含有氯化铵时,内水相伊立替康的分子态转变使脂质体内环境中的游离质子增多,使得聚天冬氨酸的coo-质子化,聚阴离子构象发生变化,发生链收缩效应,进而对脂质体双分子层结构造成一定的破坏,促进了药物的进一步释放。从图2可以看出,阴离子聚天冬氨酸钠的这种促进释放作用随着其在内水相的含量增多而更明显,这种效应有利于开发者根据疾病需要,调整脂质体中药物的释放,从而达到较理想的治疗效果。
有研究表明,小鼠肿瘤部位的nh4+/nh3水平要明显高于血液中的水平,这是由于肿瘤组织中的谷氨酰胺分解产生的nh3,肿瘤的这种微环境诱导了以硫酸铵梯度法制备的阿霉素脂质体的释放(silvermanl,barenholzy.invitroexperimentsshowingenhancedreleaseofdoxorubicinfrom
本发明中所用原料、设备,若无特别说明,均为本领域的常用原料、设备;本发明中所用方法,若无特别说明,均为本领域的常规方法。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制,凡是根据本发明技术实质对以上实施例所作的任何简单修改、变更以及等效变换,均仍属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!