免疫球蛋白在婴幼儿血管瘤病程进展中的作用的制作方法
本发明属于医药技术领域,涉及免疫球蛋白在婴幼儿血管瘤病程进展中的诊断和/治疗作用。
背景技术:
婴幼儿血管瘤(infantilehemangioma,ih)是婴幼儿最常见的先天性良性肿瘤,发病率约为4%~10%,且呈逐年升高趋势。发生于口腔颌面部的ih约占全身病变的60%,多见于面颈部皮肤、皮下组织,少数见于口腔黏膜。约10%的ih生长快速,如不积极处理,可出现呼吸道阻塞、视力受损、溃疡、感染、出血、畸形等多种并发症,甚至危及生命,给患儿及家庭造成严重的社会心理伤害。ih多在出生后数天内出现,早期表现为红色小斑点,伴随患儿的快速生长期,一般在4周及4-5个月时呈现快速生长。1岁以后进入自然消退过程,可持续3-8年甚至更长时间,多数为不完全消退,消退后常遗留有色素沉积、瘢痕、纤维增生、皮肤萎缩下垂等。
目前国际上主张对ih进行早期积极干预以减少并发症,常用的治疗方法有多种,如手术切除、激光治疗、硬化治疗等。自2008年léauté-labrèzec等偶然发现口服普萘洛尔(心得安)具有治疗ih的作用以来,该方法逐渐成为近年来治疗ih的主要方法,但在适应症、并发症、作用机理等方面仍存在争议。
ih在组织学上表现为以血管瘤内皮细胞(hemangiomaendothelialcells,hemecs)为主,成纤维细胞、脂肪细胞、肥大细胞、周细胞等多种细胞并存的血管性肿瘤,hemecs作为ih的主要细胞成分,直接决定着ih的各种生物学特性。研究表明,增殖期ih以hemecs为主,且细胞表现较为活跃的增殖活性。而随着病变的进展,hemecs发生凋亡,并逐渐被脂肪细胞取代。现阶段针对ih的药物研究多以hemecs为研究对象,通过研究药物对hemecs增殖或凋亡的调控机制,揭示ih的发病机理,探索其治疗ih的潜能。
体液免疫是机体免疫系统的重要组成部分,在抗肿瘤免疫中发挥重要作用。肿瘤抗原能刺激b淋巴细胞或记忆b淋巴细胞增殖分化成的浆细胞,进而分泌抗肿瘤抗体,可与相应抗原发生特异性结合,通过补体依赖的细胞毒作用(complement-dependentcytotoxity,cdc)、抗体依赖细胞介导的细胞毒作用(antibody-dependentcell-mediatedcytotoxicity,adcc)以及抗体的调理作用等发挥杀伤肿瘤细胞作用。分子水平的研究表明,抗体的分子结构为球蛋白,即免疫球蛋白(immunoglobulin,ig)。人体中参与体液免疫的ig主要有5种:igg、iga、igm、ige、igd。其中igg的血清含量最高,约占75%-85%,是激活补体系统,发挥抗肿瘤作用的重要抗体。igg可通过经典途径(igg1、igg2、igg3)或替代途径(igg4)激活补体系统,形成膜攻击复合体(membraneattackcomplex,mac),发挥溶菌或溶细胞的作用。在肿瘤免疫中,肿瘤抗原与抗体结合,形成抗原抗体复合物,通过补体激活的经典途径,依次激活c1、c4、c2、c3、c5,最终形成以c5b-9为主要成分的mac,形成跨膜通道,使水和无机盐自由进出,k+外溢,大量ca2+向细胞内弥散,最终导致细胞溶解和死亡。
对儿童免疫系统发育的研究表明,胎儿和新生儿无产生igg和iga的b细胞,其体内的igg主要来源于母体,出生后3-5个月降至最低,随后逐渐恢复,约3-5岁接近成人水平。ih的病程演变与婴幼儿体液免疫的成熟存在一定相关性,早产低体重患儿的体液免疫发育更不完善,而其血管瘤发病率也较高。另有研究表明,ih患儿在1岁以前血清igg和iga水平较正常儿童偏低。补体系统的发育相对更为复杂,新生儿即存在分泌补体的能力,儿童的总补体水平一般在6月龄左右即可基本发育到成人水平,但补体系统的各种成分多在1岁左右基本发育成熟。
静脉注射用人免疫球蛋白(intravenousimmunoglobulin,ivig)由健康人血浆经分离纯化、病毒灭活处理制成,主要成分为igg。免疫球蛋白可占95%以上,且各亚型分布情况与体内情况基本相似,主要辅料为山梨醇或麦芽糖。临床上可用于治疗原发性ig缺乏症、继发性ig缺陷病、自生身疫病等。经静脉输注后能显著提高受者血清igg水平,增强免疫调节功能。有研究表明,在小鼠体内,ivig可通过促进nk细胞产生il-12,进而抑制肿瘤的扩散。通过elisa实验证明,ivig在下肢缺血小鼠模型中可减轻血管内皮生长因子(vegf)介导的再灌注损伤。在系统性毛细血管渗漏综合征的临床研究中发现,ivig可降低患者血清vegf水平,进而改善疾病状态下的血管内皮高通透性,发挥治疗作用。然而现有技术中免疫球蛋白在婴幼儿血管瘤病程进展中的作用及机制尚未有报道。
技术实现要素:
针对上述现有技术存在的问题,本发明针对免疫球蛋白在婴幼儿血管瘤病程进展中的作用及机制进行研究,通过检测抗体和补体膜攻击复合体(membraneattackcomplex,mac)在不同时期ih中的表达分布情况,发现igg-c5b-9的共沉积与ih的消退存在相关性;通过体外药物干预实验,检测ivig对hemecs的增殖及分泌vegf情况的影响,发现浓度大于等于10mg/ml的ivig可显著抑制hemecs的增殖,基于此,发明人提出了本发明。
本发明的目的之一在于提供静脉注射用人免疫球蛋白(ivig)在治疗婴幼儿血管瘤中的用途。
本发明的目的之二在于提供igg和c5b-9在婴幼儿血管瘤病程进展诊断中的应用。
针对上述发明目的,具体的,本发明提供以下技术方案:
首先,本发明公开了静脉注射用人免疫球蛋白(ivig)在制备治疗婴幼儿血管瘤的药物中的用途。
静脉注射用人免疫球蛋白(ivig)在制备抑制血管瘤内皮细胞hemecs增殖的药物中的用途。
所述药物优选的,还包括药用辅料;更优选的,药用辅料为固态或液态,固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸;其中优选,粉剂及片剂可包含约5%至约95%的活性成分;固体辅料选自碳酸镁、硬脂酸镁、滑石粉、糖或者乳糖;
液态形式的制剂包括溶液、悬浮液及乳液,优选的,液态选自非经肠注射用水溶液或水-丙二醇溶液,或添加甜味剂及造影剂的口服溶液;
此外,所述药物可制成注射用小水针、注射用冻干粉针、大输液或小输液。
所述药物用药的有效浓度为10mg/ml及以上,所述有效浓度为到达病灶的体内药物的浓度。
其次,本发明公开了igg和c5b-9在制备针对婴幼儿血管瘤病程进展的诊断试剂中的应用。
所述诊断试剂用于检测婴幼儿血管瘤组织中igg和c5b-9的表达情况。
优选的,所述诊断试剂为免疫荧光染色检测igg和c5b-9的共沉积情况的试剂。
婴幼儿血管瘤病程进展的诊断包括:增殖早期(0-5月)瘤体内仅少数血管内红细胞表面可见igg和c5b-9的表达;增殖晚期(5-12月)瘤体内可见多数血管内内皮附近igg阳性表达;c5b-9表达较不明显;消退期(12月以上)瘤体内可见igg和c5b-9阳性共沉积,主要分布在肿瘤中残存血管附近;瘤周正常组织中,未见明显的igg和c5b-9阳性表达。
本发明取得了以下效果:
(1)现阶段的研究中,针对免疫系统在ih病程演变中的作用的研究较少,相关研究均主要针对免疫细胞,特别是巨噬细胞在ih血管生成中的作用,而未见关于免疫球蛋白与ih病变发展相关性的研究报道。本发明将ih与免疫球蛋白相结合,通过研究不同时期ih中igg和补体膜攻击复合体c5b-9表达分布的情况,研究抗体-补体系统在ih消退中的作用。过免疫荧光染色发现,c5b-9主要在消退期ih中表达,而在增殖期ih中表达不明显,igg在消退期ih中同样明显表达,但在在增殖期ih中,以5月龄为分界,可见igg的表达水平不同:小于5月的患者,病变内未见明显igg的表达;而大于5月的患者,病变内可见多数血管内内皮附近igg沉积;在进行结果分析时,本发明依据igg的表达情况,将增殖期ih又分为增殖早期(0-5月)和增殖晚期(5-12月),这使得对igg和c5b-9的表达情况与ih病程演变的关系,有了更加细致的认识。而且上述结果表明,ih的病程演变与igg和c5b-9的表达存在相关性,即ih快速增殖时(增殖早期),igg和c5b-9表达均不明显;ih增殖减缓时(增殖晚期),血管内皮附近出现igg的沉积;而当ih开始消退时,igg和c5b-9阳性共沉积。
(2)本发明通过体外细胞实验进一步验证igg对血管瘤内皮细胞(hemangiomaendothelialcells,hemecs)的作用,选取静脉注射用人免疫球蛋白(intravenousimmunoglobulin,ivig)作为研究对象,通过药物干预实验发现,浓度大于等于10mg/ml的ivig可显著抑制hemecs增殖,同时抑制vegf的分泌,特别是浓度为15mg/ml的ivig,其对hemecs的增殖抑制作用随时间延长更加明显,即细胞出现“负增长”现象。ivig为治疗ih的提供了新的思路。
(3)本发明采用ivig作为研究对象,该药是现阶段的一种在临床上广泛应用的人免疫球蛋白,主要用于治疗免疫缺陷疾病或严重感染的病人,儿童用药安全性也已得到广泛的实践证明,与重组人igg相比,该药成本较低,且在临床上应用广泛,通过研究该药对hemecs的作用,可为拓展该要的临床应用前景奠定理论基础;同时,作为多种免疫球蛋白的混合物,ivig更接近体液免疫系统的实际情况;同时,作为静脉给药剂型,ivig的安全性较肌肉注射型免疫球蛋白更高,特别是对于ih这种血管丰富的病变,无论是采取全身给药还是局部给药的方法都可以保障其安全性。
附图说明
图1不同时期ih组织igg、c5b-9表达(亮处为阳性表达)(a):增殖早期ih组织的igg-tritc染色(2月,200×);(b):增殖早期ih组织的c5b-9-fitc染色(2月,200×);(c):增殖晚期ih组织的igg-tritc染色(8月,200×);(d):增殖晚期ih组织的c5b-9-fitc染色(8月,200×);(e):消退期ih组织的igg-tritc染色(1岁8月,200×);(f):消退期ih组织的c5b-9-fitc染色(1岁8月,200×)。可见增殖早期igg及c5b-9均表达较少,主要分布在血管内红细胞表面;增殖晚期部分血管内皮附近出现igg的沉积,但c5b-9表达仍不明显;消退期ih组织中存在igg及c5b-9阳性表达,分布在残余血管周围。
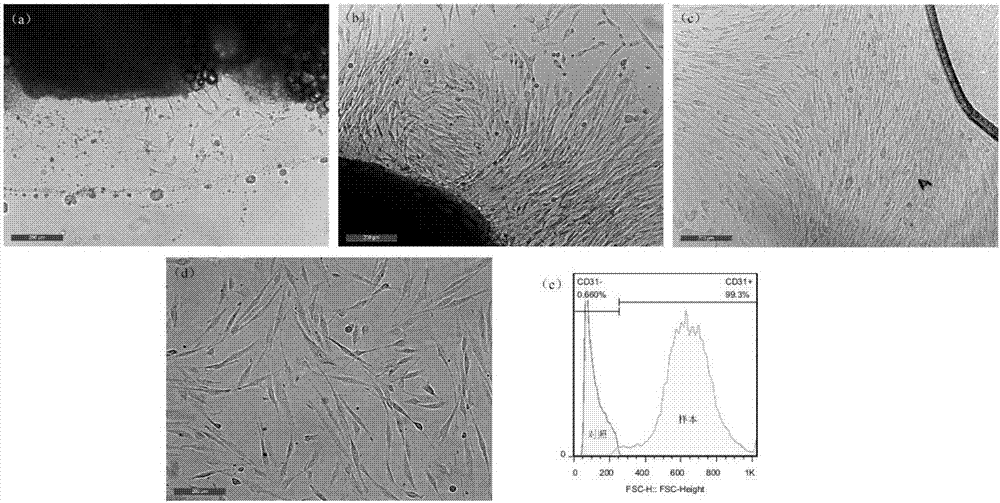
图2血管瘤内皮细胞的分离培养及纯化鉴定(a):组织块接种后第4天镜下观(100×),可见开始有细胞从组织块边缘爬出贴壁生长,形状不规则,多角形为主,有较多突起。(b):组织块接种8天镜下观(100×),可见组织块周围细胞密集生长,以长梭形为主,以组织块为中心向外生长,细胞排列方向一致。(c):组织块接种第10天镜下观(100×):去除组织块后细胞继续生长,以长梭形为主,排列方向一致,部分细胞呈多角形。(d)cd31+免疫磁珠分选后细胞形态镜下观(第七代,100×),可见多数细胞表现为长梭形,两端伸出突起,较筛选前变短,变扁平,体积变小,突起减少;(e)流式细胞术鉴定cd31+免疫磁珠分选后hemecs纯度,可见磁珠分选后细胞cd31表达阳性率达99%以上。
图3不同浓度ivig作用下hemecs的增殖及vegf分泌量的变化(a)cck-8法检测不同浓度ivig作用于hemecs24h、48h后细胞增殖的变化(每组设置5个复孔)。可见od值随ivig浓度增加而降低,即细胞数量减少,细胞增殖受到抑制;至ivig浓度达10mg/ml时,无论处理24h还是48h,实验组od值与对照组(mal)相比有明显统计学差异(p<0.05);当药物浓度为15mg/ml时,延长作用时间,od值降低(p<0.05);至药物浓度达20mg/ml是,随药物浓度增加,od值变化不明显(p>0.05);(b)elisa检测不同浓度ivig作用于hemecs24h、48h后细胞培养上清液中vegf浓度的变化(每组设置3个复孔,下同),当ivig浓度为5mg/ml时,细胞培养上清液(以下简称“上清液”)中的vegf浓度高于对照组(p<0.05);当ivig浓度为10mg/ml时,作用24h后上清液中的vegf浓度与对照组相比无明显统计学差异(p>0.05),作用48h后vegf浓度降低(p<0.05);当ivig浓度大于10mg/ml时,上清液中的vegf浓度低于对照组(p<0.05)。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作和/或它们的组合。
术语“静脉注射用人免疫球蛋白(intravenousimmunoglobulin,ivig)”,由健康人血浆,经分离纯化,病毒灭活处理制成,主要成分为igg,免疫球蛋白可占95%以上,且各亚型分布情况与体内情况基本相似。
术语“血管瘤内皮细胞hemecs”,与正常血管内皮细胞不同,其是一种肿瘤细胞,具有非常活跃的增殖特性;在形态上,血管瘤内皮细胞表现为长梭形,或有较多突起的多角形细胞,细胞体积较大;而正常血管内皮细胞增殖能力不强且表现为多角形,细胞较小,一般无突起;在功能上,血管瘤内皮细胞可构成血管样结构,但不具有正常血管的功能,其内的血液处于停滞状态。hemecs作为ih的主要细胞成分,直接决定着ih的各种生物学特性,增殖期ih以hemecs为主,且细胞表现较为活跃的增殖活性。
本发明的一个实施方式中公开了静脉注射用人免疫球蛋白(ivig)在制备治疗婴幼儿血管瘤的药物中的用途。
本发明的另一个具体实施方案中公开了静脉注射用人免疫球蛋白(ivig)在制备抑制血管瘤内皮细胞hemecs增殖的药物中的用途。
所述药物优选的,还包括药用辅料;更优选的,药用辅料为固态或液态,固态形式的制剂包括粉剂、片剂、分散颗粒、胶囊、药丸;其中优选,粉剂及片剂可包含约5%至约95%的活性成分;固体辅料选自碳酸镁、硬脂酸镁、滑石粉、糖或者乳糖;
液态形式的制剂包括溶液、悬浮液及乳液,优选的,液态选自非经肠注射用水溶液或水-丙二醇溶液,或添加甜味剂及造影剂的口服溶液;
此外,所述药物可制成注射用小水针、注射用冻干粉针、大输液或小输液。
所述药物用药的有效浓度为10mg/ml及以上,所述有效浓度为到达病灶的体内药物的浓度。
此外,本发明的具体实施方案中公开了igg和c5b-9在制备针对婴幼儿血管瘤病程进展的诊断试剂中的应用。
所述诊断试剂用于检测婴幼儿血管瘤组织中igg和c5b-9的表达情况。
优选的,所述诊断试剂为免疫荧光染色检测igg和c5b-9的共沉积情况的试剂。
婴幼儿血管瘤病程进展的诊断包括:增殖早期(0-5月)瘤体内仅少数血管内红细胞表面可见igg和c5b-9的表达;增殖晚期(5-12月)瘤体内可见多数血管内内皮附近igg阳性表达;c5b-9表达较不明显;消退期(12月以上)瘤体内可见igg和c5b-9阳性共沉积,主要分布在肿瘤中残存血管附近;瘤周正常组织中,未见明显的igg和c5b-9阳性表达。
本发明材料与试剂如下,未及的试剂和设备均为本领域内常规使用。
1.血管瘤组织切片:经山东大学齐鲁医院伦理委员会批准并告知患儿监护人知情同意后,选取2010-2016年间于山东大学齐鲁医院口腔科或小儿外科行手术切除的婴幼儿血管瘤病例。增殖期(0-1岁)和消退期(1岁以上)各10例。纳入标准包括:①根据mulliken标准病理诊断为婴幼儿血管瘤;②手术治疗前未行任何其他治疗;③病变表面无明显破溃、感染。病例资料详见表1,组织切片的固定、脱水、透明、包埋等步骤由山东大学齐鲁医院病理科完成。
表1血管瘤病理切片临床病例资料
注:*此病例同时进行细胞培养
2.新鲜血管瘤标本:经山东大学齐鲁医院伦理委员会批准并告知患儿监护人知情同意后,收集山东大学齐鲁医院口腔颌面外科、小儿外科手术切除的婴幼儿增殖期血管瘤新鲜标本1例,病例信息:女性患儿,4月18天龄,肩部血管瘤;病变符合mulliken标准;患儿无其他全身系统性疾病,可以耐受手术;手术治疗前未行任何其他治疗;病变无感染、破溃。
3.主要试剂
3.1组织切片染色:兔抗人glut-1抗体购自武汉博士德公司;小鼠抗人igg抗体购自英国abcam公司;兔抗人c5b-9抗体购自英国abcam公司;fitc标记羊抗兔igg抗体购自北京中山金桥公司;tritc标记羊抗小鼠igg抗体购自北京中山金桥公司;超敏二步法免疫组化检测试剂盒购自北京中山金桥公司;10%羊血清工作液购自北京中山金桥公司;改良型苏木素染液购自北京鼎国昌盛生物技术有限责任公司;抗荧光猝灭封片剂购自广州碧云天公司;
3.2hemecs培养、筛选及鉴定:cd31免疫磁珠购自德国miltenyi公司;cd31-fitc流式抗体购自美国affymetrix公司;兔抗人cd31抗体购自武汉博士德公司;兔抗人vwf抗体购自武汉博士德公司;
3.3其他:静脉注射用人免疫球蛋白购自山东邦泰生物制品公司;麦芽糖购自美国sigma公司;cck-8试剂盒购自南京恩晶生物科技有限公司;人vegfelisa试剂盒购自武汉博士德公司;
实施例
一、试验方法
1.免疫荧光染色检测不同时期ih中igg和c5b-9的共沉积情况
1)将切片置于60℃恒温干燥箱中加热45min,取出后立即依次放入二甲苯ⅰ、ⅱ中各10min,100%,90%,80%,70%乙醇,蒸馏水中各2min;
2)滴加3%h2o2与甲醇的1:1混合液,室温避光孵育10min,磷酸盐缓冲液(pbs,0.01mph7.2~7.3,下同)洗5min×3次;
3)将切片放入枸橼酸盐缓冲液(tbs)中,置微波炉内加热煮沸30min,进行抗原修复;
4)取出染色盒,打开盒盖,室温冷却45min,取出切片,pbs洗5min×3次;
5)擦干切片,勿碰触样本,滴加10%羊血清封闭,室温孵育10min;
6)吸水纸吸掉封闭液,不洗,每张玻片滴加pbs1:100稀释的兔抗人igg和小鼠抗人c5b-9混合一抗并放入湿盒,4℃孵育过夜;
7)pbs洗10min×3次,吸水纸吸干多余液体;
8)滴加pbs1:100稀释的tritc标记的羊抗兔igg和fitc标记的羊抗小鼠igg混合二抗,湿盒中37℃避光孵育1h,pbs洗10min×3次;
9)核复染:滴加dapi,避光孵育5min,pbs洗10min×3次;
10)用吸水纸吸干液体,用含抗荧光淬灭剂的封片液封片,在荧光显微镜下观察采集图像。
2.组织块培养法分离、纯化、鉴定hemecs
2.1组织块法分离hemecs
1)手术切取的新鲜增生期婴幼儿血管瘤瘤体,经生理盐水冲洗后,浸泡于ecm培养液中,4℃冰盒内保存,15min内运至细胞培养室;
2)用大量pbs冲洗标本,同时用剪子、镊子去除血凝块、坏死组织等非血管瘤组织,直到肉眼观察冲洗液颜色清亮、无浑浊及脱落组织;
3)选择瘤体组织,用剪子和镊子剪成小块,并将其浸入0.25%胰蛋白酶中,37℃水浴振荡消化10min;
4)用剪子和镊子将消化后的瘤体组织块修剪至1mm3/块,接种于六孔板中,3块/孔,细胞培养箱内(37℃,5%co2,下同)倒置10min;
5)将六孔板从培养箱内取出后正置,加入少量ecm培养基(含100u/ml青霉素、100μg/ml链霉素、10%fbs,下同),仅使培养液刚刚湿润组织块,勿使其浮起,放入细胞培养箱内过夜;
6)24h后补充足够的完全培养液,添加时要缓慢轻柔地浸没组织块,切勿使其浮起,放入细胞培养箱内继续培养;
7)接种后每日观察细胞爬出情况,每2天更换培养液,待孔内有足够多细胞(细胞密度约50%)爬出时,去除组织块,更换培养液后继续培养。
2.2免疫磁珠法提纯hemecs
1)缓冲液配置:ph=7.2的不含ca2+、mg2+的pbs加0.5%fbs,加2mmedta,滤网除菌过滤,-20℃长期保存;
2)制备hemecs(未经筛选)细胞悬液,细胞计数,每107个细胞(不足107按107计,下同)加60μl缓冲液重悬;
3)依次加入20μlfcr封闭剂和20μlcd31磁珠,轻轻混匀,4℃孵育30min;
4)加入3ml缓冲液,300g离心3min,弃上清;
5)将ms分选柱置于铁架上,500μl缓冲液洗柱;
6)每107个细胞用500μl缓冲液冲悬,过滤网后,流入分选柱;
7)500μl×3次缓冲液冲洗柱子,收集流出液体;
8)从铁架上取下分选柱,置于空离心管之上,加入1ml缓冲液后迅速推动塞子,推出所有液体,收集细胞;
9)重复4)—7)步,过第二富集柱,收集细胞,培养于25cm2培养瓶中。
2.3流式细胞术鉴定hemecs纯度
1)制备筛选后的hemecs细胞悬液,行细胞计数
2)取含2×105个细胞的细胞悬液,再次离心,以400μlpbs重悬;
3)取2支流式管,各加5μlcd31-fitc抗体,然后各加入200μl细胞悬液,轻振荡,常温避光孵育30min;
4)加入2mlpbs,800rpm离心7min,弃上清;
5)重复洗一次,离心后残余液体回流,此时流式管内残余液体量约为100μl,借此将细胞震荡混勻;
6)加入100-200μlpbs(适量,保证细胞浓度),半小时内上机检测;
7)用flowjo软件分析结果,作图。
3.ivig干预下hemecs增殖及vegf量的变化检测
3.1cck-8法检测hemecs的增殖情况
1)药物配置:根据表2的药物配比配制浓度为0、5、10、15、20、25mg/ml的ivig;0.5g麦芽糖粉末加入10mlpbs溶液中,充分混匀,除菌过滤,配制5%麦芽糖溶液(mal),-20℃保存,使用前以等体积ecm稀释至25mg/ml,现配现用;
表2不同浓度ivig的配制(单位:ml)
注:此表为配制10ml各浓度药物用量
2)种板:收集对数生长期hemecs,以500个/孔的密度接种至96孔板中,每组设置复孔×5,每孔加ecm100μl,周围孔加等体积pbs,37℃培养24h;
3)加药:吸出培养基,pbs洗2次,分别加入0、5、10、15、20、25mg/mlivig和25mg/ml麦芽糖溶液(150μl/孔),置于培养箱中继续培养;
4)24h或48h后,吸除原有培养基,pbs洗2次,每孔加入100μlecm和10μlcck-8;
5)将培养板置于培养箱中孵育4h;
6)用酶标仪测定450nm处吸光度。
3.2elisa法检测hemecs分泌vegf的含量变化
3.2.1试剂的准备
1)取1ml样品稀释液加入标准品管(10ng重组人vegf)内,盖好后静置10min,然后反复颠倒,搓动;
2)取0.2ml10000pg/ml标准品加入有0.8ml样品稀释液的ep管中,混匀,做标记;
3)准备6支ep管,每管加0.3ml样品稀释液,分别标记上1000、500、250、125、62.5、31.2、15.6pg/ml。取0.3ml2000pg/ml标准品加入标记1000pg/ml的管中,混匀后同样取出0.3ml加入下一管中。以此类推,至最后一只样品管。
4)根据每孔需要100μl计算总用量。按1μl生物素标记抗人vegf加抗体稀释液99μl的比例配制工作液,轻轻混匀。
5)根据每孔需要100μl计算总用量。按1μl亲和素-过氧化物酶复合物(abc)加abc稀释液99μl的比例配制工作液,轻轻混匀。
3.2.2操作程序
1)药物配置:根据附表2的药物配比配制浓度为5、10、15、20mg/ml的ivig;25mg/ml麦芽糖溶液配制方法同实验5;
2)种板:收集对数生长期hemecs,以10000个/孔的密度接种至12孔板中,每孔加ecm1ml,37℃培养24h;
3)加药:吸出培养基,pbs洗2次,分别加入5、10、15、20mg/mlivig和25mg/ml麦芽糖(500μl/孔),置于培养箱中继续培养;
4)24h、48h后收集细胞培养上清液(以下简称“上清液”),2500rpm离心10min,取上清;
5)将1000、500、250、125、62.5、31.2、15.6pg/ml的标准品及药物处理24h、48h后的上清液(复孔×3,随机配对)依次加入酶标板中,1孔只加样品稀释液作为零孔,。每孔加液量均为100μl。酶标板加上封板膜,37℃反应90min;
6)反应后甩去酶标板内液体,对着吸水纸拍几下,不洗;
7)将生物素标记抗人vegf抗体工作液按每孔100μl依次加入(tmb空白显色孔除外)。酶标板加上封板膜,37℃反应60min;
8)1×洗涤缓冲液洗3次,每次浸泡1min左右(每孔洗液至少300μl)。
9)将准备好的abc工作液按每孔100μl依次加入(tmb显色孔除外)。酶标板加上封板膜,37℃反应30min;
10)1×洗涤缓冲液洗5次,每次浸泡1-2min左右(每孔洗液至少300μl);
11)按每孔90μl依次加入已在37℃平衡30min的tmb显色液,37℃避光反应20-25min(时间以肉眼可见标准品的前3-4孔有明显的梯度蓝色,后3-4孔差别不明显为准);
12)按每孔100μl依次加入tmb终止液,顺序同前,此时蓝色转为黄色;
13)用酶标仪在450nm测定od值,减去tmb显色孔od值为最终结果;
14)microsoftexcel绘制标准曲线,计算回归方程,根据od值计算相应样品中vegf浓度;
15)计算不同浓度ivig作用下hemecs24h分泌vegf的量(δcvegf=cvegf-48-cvegf-24).
表3elisa标准曲线
标准曲线回归方程:y=181x2+231.6x+2.939,r2=0.998
二、试验结果
1.免疫荧光染色发现:
1.1增殖早期(0-5月)瘤体内仅少数血管内红细胞表面可见igg和c5b-9的表达(附图1a、b)。
1.2增殖晚期(5-12月)瘤体内可见多数血管内内皮附近igg阳性表达;c5b-9表达较不明显,仅少数血管可见阳性(附图1c、d)。
1.3消退期(12月以上)瘤体内可见igg和c5b-9阳性共沉积,主要分布在肿瘤中残存血管附近(附图1e、f)。
2.组织块培养法分离、纯化、鉴定hemecs:
2.1组织块法分离hemecs:血管瘤组织块贴壁培养后,一般于第3天开始有细胞从组织块边缘爬出贴壁生长,形状不规则,多呈多角形,有较多突起(附图2a);随细胞密度增加,细胞伸长,大约7天后细胞密度可达到50%,并朝远离组织块的方向增殖移动(附图2b);去除组织块,细胞继续生长,约10天左右原组织块附近细胞铺满孔底,细胞呈长梭形,生长方向一致,进行传代(附图2c)。2.2免疫磁珠法提纯hemscs:、免疫磁珠法成功分离cd31+hemecs,分离出的细胞呈多角形或长梭形,有较长突起伸出,增殖迅速(附图2d)。流式细胞术鉴定hemecs纯度达99%以上(附图2e)。
3.ivig干预下hemecs增殖及vegf量的变化检测
3.1cck-8法检测ivig干预下hemecs的增殖情况:od值随ivig浓度增加而降低。至ivig浓度大于等于10mg/ml,od值与对照组(mal)相比有明显统计学差异(p<0.05);当药物浓度为15mg/ml时,od值随作用时间延长而降低(p<0.05);至药物浓度达20mg/ml,od值随药物浓度增加降低不明显(p>0.05)。
3.2elisa法检测ivig干预下hemecs分泌vegf的变化:ivig作用于hemecs24h或48h后,随药物浓度增加,细胞培养上清液(以下简称“上清液”)中vegf浓度降低(p<0.05)。当ivig浓度小于10mg/ml时,中的vegf浓度高于对照组(p<0.05);当ivig浓度大于10mg/ml时,上清液中的vegf浓度低于对照组(p<0.05);当ivig浓度为10mg/ml时,作用24h后上清液中的vegf浓度与对照组相比无明显统计学差异(p>0.05),作用48h后vegf浓度降低(p<0.05)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!