一种MMP‑8响应性智能牙周药物控释水凝胶材料及其用途的制作方法
本发明属于化学制药领域,具体涉及一种mmp-8响应性智能牙周药物控释水凝胶材料及其在牙周病变治疗中的应用。
背景技术:
牙周炎作为口腔最常见的疾病之一,是引起成年人牙齿丧失的首要原因,是危及人类口腔和全身健康的常见疾病(sundararajsc,etal.biomaterials.2013;34(34):8835-42.)。根据目前的理论,周围炎是一种以菌斑生物膜为始动因素的感染性疾病,牙周细菌粘附聚集并释放毒素、酶以及机体的免疫反应等造成了牙周组织的感染和破坏(joshid,etal.drugdeliv.2016;23(2):363-77.),导致牙周袋形成和牙槽骨吸收,最终造成牙齿丧失。
牙周炎的基础治疗是去除牙体表面菌斑生物膜的附着,控制感染,之后采取措施恢复牙周组织。对于感染控制,目前临床上采用的方法主要有机械治疗和化学治疗。机械去除牙石菌斑等是牙周治疗基础,然而单纯的机械治疗存在不能到达深牙周袋、受根面形貌及根分叉等的影响(jepsenk,etal.periodontol2000.2016;71(1):82-112),化学药物治疗是必要的。化学治疗主要是系统使用抗生素或局部使用抗菌药物。由于牙周炎发生率较高,长期系统或局部大量使用抗生素不仅可能扰乱身体正常菌群、容易导致耐药菌的出现(dabhimr,etal.drugdeliv.2010;17(7):520-31.),而且存在药物释放不持久、特异性不强等缺陷(nguyens,etal.therdeliv.2015;6(5):595-608.)。此外,由于口腔环境的特殊性,如口水冲刷、唇舌扰动等作用,药物易流失,致使药效难以保证,因此发展能够克服传统局部药物治疗缺陷的新型药物治疗方式具有重要的意义。
近年来,刺激响应性智能药物控释系统成为了药物应用研究的热点,并取得了令人鼓舞的成果。所谓刺激响应性即药物控释系统对病变区域的内源性(酶、ph变化等)或外源性(温度变化、致病菌等)刺激作出特异性响应,使得药物仅在病变区域局部释放产生治疗作用(muras,etal.natmater.2013;12(11):991-1003.)。这些智能刺激响应性药物控释系统大大提高了药物释放的特异性和局部药物浓度(xiongmh,etal.advmater2012;24(46):6175-80.),在发生病变部位保持了感染程度和或细菌数量与药物释放量高度一致,做到了精准抗菌(jih,etal.small2016;12(45):6200-06.),从而降低了药物的毒副作用及细菌耐药性的产生。基于目前牙周药物治疗面临的问题,获得能够在口腔复杂的微环境中智能识别定位病变,特异性释放抗感染药物,持续发挥治疗作用的刺激响应性载药控释体系,对于牙周病变的治疗提供了崭新的思路。
酶敏感水凝胶可利用酶敏感多肽(esp)作为交联剂合成聚乙二醇基(peg)高分子水凝胶材料,在特定酶的作用下特异性裂解,释放出所载药物。以esp作为门控开关,实现载药系统仅在具有特异性酶的部位释放药物,一旦感染好转或消失时,即停止裂解释放,从而做到智能响应、精准抗感染。
基质金属蛋白酶(mmps)是一个含有钙锌等金属离子的大家族,负责细胞外基质蛋白质的降解过程,能够特异性的切断相关蛋白或多肽链。mmps在正常组织中表达和激活水平非常低,然而,在感染及肿瘤生长过程中,其水平会出现明显增高。mmps,主要是mmp-8和-9,在牙周病变的发生发展中发挥着重要作用,其在牙周炎龈沟液中的浓度与炎症程度成正相关(uittovj,etal.periodontology2000.2003;31:77–104.sorsat,etal.oraldis.2004;10(6):311-8.)。因而,mmp-8可作为一个良好的生物标记(biomarker)精确定位牙周病变(sorsat,etal.oraldis.2004;10(6):311-8.)。这为我们牙周刺激响应载药系统的设计提供了基础。目前,关于mmps的智能响应性控释系统对于口腔局部病变尚属空白,关于mmp-8响应性的研究未见报道。
技术实现要素:
本发明的目的在于提供一种mmp-8响应性智能牙周药物控释凝胶材料及制备方法,该材料具有制备工艺简便、性能稳定、药物负载率高、智能控释、生物相容性好等特点。本发明的进一步目的在于提供上述凝胶材料在牙周病变治疗中的应用。
为实现上述目的,本发明采用以下技术方案:
第一方面,本发明提供一种mmp-8响应性智能牙周药物控释凝胶材料的制备方法,其步骤如下:
1)mmp-8特异性切断多肽cgpqg~iwqgc(m8sp,~表示多肽被mmp-8切断的位置)的合成:采用fmoc固相合成法合成mmp-8特异性切断多肽cgpqg~iwqgc(m8sp),采用质谱esi对多肽进行鉴定,采用高效液相色谱hplc对多肽进行纯化;
2)配置0.3mol/l三乙醇胺缓冲液(tea,ph8.0),使用tea缓冲液配制浓度为20mg/ml的m8sp溶液;
3)使用分子量为20kda的四臂聚乙二醇丙烯酸酯4-arm-peg-ac,利用michael加成反应,保持peg不饱和双键与m8sp巯基的比例是1:1.1,利用巯基和双键的反应,37℃下充分反应30min,交联生成质量/体积比为10%的复合peg水凝胶;
4)在加入多肽溶液对peg进行交联之前,加入牙周药物或生物因子,生成负载有牙周药物或生物因子的复合水凝胶。
优选的,上述步骤3)取5mg4-arm-peg-ac溶于21μltea缓冲液,加入20mg/ml的m8sp溶液29μl,37℃下充分反应30min,得到质量/体积比为10%的复合peg水凝胶;
优选的,上述步骤4)的牙周药物为0.5mg的盐酸米诺环素。
优选的,上述步骤4)的生物因子为牛血清白蛋白(bsa),生成负载有大分子药物模型的复合水凝胶。
第二方面,本发明提供根据上述制备方法获得的mmp-8响应性智能牙周药物控释凝胶材料。
优选的,所述的牙周药物为盐酸米诺环素。
第三方面,本发明提供一种用于牙周治疗的药物组合物,含有上述制备方法获得的mmp-8响应性智能牙周药物控释凝胶材料。
该药物组合物可采用药剂学上允许的赋型剂、ph调节剂、渗透压调节剂等辅料配伍,按照药学领域的常规或用特定的生产方法制备成相应的药物组合制剂。
以下以mmp-8响应性智能盐酸米诺环素控释凝胶材料为例,通过试验说明本发明的有益效果:
(1)流变性能测试:流变学检测是研究水凝胶化过程的重要手段,取100mg4-arm-peg-ac溶于420μltea缓冲液中,混合均匀后加入580μl浓度为20mg/ml的m8sp溶液,震荡20s后立即注射到流变检测仪平板上,上下平板接触后在平板周围涂一层硅油防止溶液挥发,37℃下进行动态时间扫描,检测其流变性能。与此方法类似,在加入m8sp之前,在peg溶液中加入10mg盐酸米诺环素,检测负载药物盐酸米诺环素对该凝胶流变性能的影响。
(2)形貌观察:取50mg4-arm-peg-ac溶于210μltea缓冲液中,混合均匀后加入290μl浓度为20mg/ml的m8sp溶液,震荡后37℃下静置成胶,继续反应30min后将制备的水凝胶反复用蒸馏水冲洗,液氮淬断。使用真空冷冻干燥机真空干燥,喷金,然后利用扫描电镜观察水凝胶的内部形貌。
(3)体外溶胀与降解性能
将空白和载药水凝胶各50μl,称重湿凝胶初始质量记为w0。随后加入pbs10ml,置于37℃恒温震荡箱,每隔一定时间去除pbs,将湿凝胶称重记为wt,试管中补加10mlpbs,凝胶继续溶胀。溶胀比s采用公式计算:s=wt/w0。同时将制得的水凝胶各50μl,分别浸于入1mlpbs、10nm和20nmmmp-8溶液中,记录凝胶完全降解所用的时间。
对于凝胶材料来说,溶胀时主要为吸水溶胀,表现为质量和体积的快速增加。凝胶吸水能力达到极限后,凝胶分解,宏观表现为质量下降,逐步降解,凝胶这种先溶胀后降解的性质有利于其作为药物或因子的载体,一方面起到保护药物的作用,另一方面降解使药物释放。
(4)药物控释效果检测
选用经典牙周炎常用药物盐酸米诺环素作为小分子药物模型,考察负载盐酸米诺环素的复合凝胶的mmp-8响应性控释效果;选用牛血清白蛋白(bsa)作为大分子药物模型,考察负载bsa的peg水凝胶mmp-8响应性释放效果。
(5)抗菌性能检测
将制备的负载盐酸米诺环素的复合水凝胶,加入pbs溶胀24h后继续使用pbs或者10nmmmp-8溶液浸泡至水凝胶完全降解,分别于24h、48h、72h后收集缓释溶液用于药物的抗菌活性检测。取75μl的缓释溶液置于96孔板中,使用tsb细菌培养基二倍稀释缓释液10次,随后将75μl处于对数增殖期的p.gingivalis溶液加入每个孔中,对照组使用灭菌pbs代替缓释液。37℃下厌氧培养48小时。检测每孔od600的吸光度值。
(6)生物安全性评价
按照iso-10933标准,采用甲基噻唑基四唑(mtt)法,通过细胞与材料浸提液共培养和细胞染色的方式检测凝胶及其产物的细胞相容性。
经上述实验结果证实,本发明的突出特点是:
(1)本发明mmp-8响应性牙周药物智能控释水凝胶性能稳定、载药负载方法简单。
(2)本发明mmp-8响应性牙周药物智能控释水凝胶正常体温下(37℃)、原位、快速(4分钟内)成胶,使用方便,临床推广前景好。
(3)本发明mmp-8响应性药物智能控释水凝胶可被用于牙周药物的控释,不影响药物活性,抗菌效果好。
(4)本发明利用mmp-8响应性牙周药物智能控释水凝胶利用多肽交联形成,所用物质无毒无刺激,生物相容性好。
(5)本发明mmp-8响应性牙周药物智能控释水凝胶活性稳定、孔隙率高、孔径适宜,可用于牙周药物、生物因子的负载。
此外,本发明mmp-8响应性牙周药物智能控释水凝胶制备工艺简单,易于掌握。可用于牙周炎的控制和牙周组织再生相关研究,应用范围广。
附图说明
图1为本发明实施例2得到的m8sp的质谱检测结果和m8sp的结构图;
a为m8sp的质谱检测结果;b为m8sp的结构图。
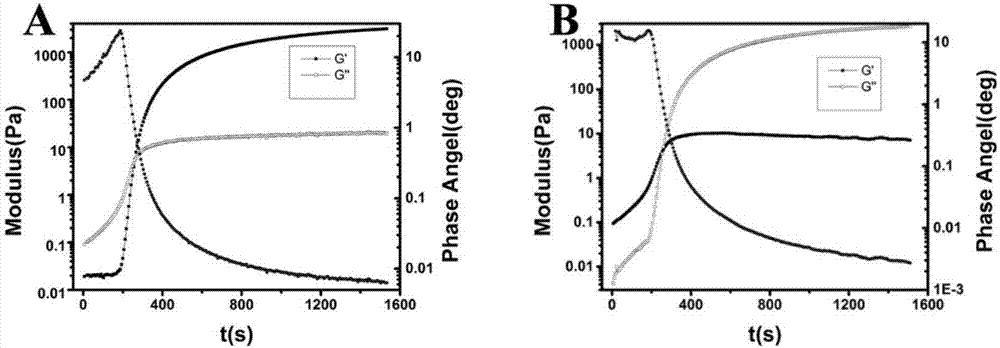
图2为本发明实施例2得到的mmp-8响应性水凝胶流变图;
由图可知,37℃下,该凝胶注射后4min内成胶(图2a),并且盐酸米诺环素的负载(图2b)并不影响凝胶的流变学性能(成胶时间和强度等)。
图3为本发明实施例2得到的mmp-8响应性水凝胶的外观性状;
图3a可知,所制得为透明、凝胶状材料;图3b、3c为水凝胶的扫描电镜(sem)图,由图可知,所得为规则多孔的水凝胶材料(图3b),孔隙均匀,孔径约为100um,盐酸米诺环素的负载并不影响凝胶的形貌(图3c)。
图4为本发明实施例2得到mmp-8响应性水凝胶溶胀和降解特性。
图5为本发明实施例2得到的mmp-8响应性水凝胶的药物释放特性;
图5a为负载有10%盐酸米诺环素的复合水凝胶的盐酸米诺环素释放特性;
图5b为负载大分子药物模型bsa的药物释放特性。
图6为本发明实施例2得到的mmp-8响应性水凝胶缓释液的抗菌效果。
图7为本发明实施例2得到的mmp-8响应性水凝胶的生物安全性评价结果。图7a为使用mtt评价凝胶浸提液对细胞活性的影响,图7b、c、d为牙龈成纤维细胞在凝胶表面的生长情况。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
【实施例1】
(1)室温下,使用1000mg氯树脂,采用fmoc固相合成法合成序列为cgpqgiwqgc(cys-gly-pro-gln-gly-ile-trp-gln-gly-cys,半胱氨酸-甘氨酸-脯氨酸-谷酰胺-甘氨酸-异亮氨酸-色氨酸-谷酰胺-甘氨酸-半胱氨酸)的mmp-8敏感多肽(m8sp)。
(2)采用质谱(esi)鉴定合成的多肽,分子量为1048,确定所合成的多肽为目的多肽。
(3)使用高效液相色谱(hplc)检测所合成的多肽纯度,并对多肽进行纯化,使纯度达到99%以上。
(4)配置0.3mol/l的三乙醇胺(tea)水溶液,利用0.1mol/l的盐酸溶液将ph调整至8.0,得到ph为8.0的tea缓冲液。
(5)将20mg纯化后的m8sp加入1ml上述配好的tea缓冲液中,得到浓度为20mg/ml的m8sp溶液。
(6)取5mg4-arm-peg-ac溶于10.5μltea缓冲液中,震荡使混合均匀。
(7)在上述peg溶液中加入39.5μlm8sp溶液,37℃下反应,成胶后继续反应30min,得到质量/体积比为10%的peg水凝胶。
(8)与上述方法类似,在加入m8sp溶液之前,加入0.5mg的盐酸米诺环素,得到负载盐酸米诺环素的复合peg水凝胶(每100μl凝胶里含有1mg盐酸米诺环素)。
由图1a可知,所合成的多肽为所需的m8sp目的多肽,图1b为m8sp的结构图,该多肽两端半胱氨酸的巯基可与4-arm-peg-ac的双键发生michael加成反应,从而交联peg生成水凝胶。
【实施例2】
(1)室温下,使用500mg氯树脂,采用fmoc固相合成法合成序列为cgpqgiwqgc(cys-gly-pro-gln-gly-ile-trp-gln-gly-cys,半胱氨酸-甘氨酸-脯氨酸-谷酰胺-甘氨酸-异亮氨酸-色氨酸-谷酰胺-甘氨酸-半胱氨酸)的mmp-8敏感多肽(m8sp)。
(2)采用质谱(esi)鉴定合成的多肽,确定合成分子量为1048即为目的多肽。
(3)使用hplc检测多肽纯度,并对多肽进行纯化,使纯度达到99%以上。
(4)配置0.3mol/l的三乙醇胺水溶液(tea),利用0.1mol/l的盐酸溶液将ph调整至8.0,得到ph为8.0的tea缓冲液。
(5)将20mg纯化后的m8sp加入1ml上述配好的tea缓冲液中,得到浓度为20mg/ml的m8sp溶液。
(6)取5mg4-arm-peg-ac溶于21μltea缓冲液中,震荡使混合均匀。
(7)在上述peg溶液中加入29μlm8sp溶液,37℃下反应,约4分钟成凝胶,继续反应30min,得到质量/体积比为10%的peg水凝胶,在以下实施例中可以作为空白对照。
(8)与上述方法类似,在加入m8sp溶液之前,加入0.5mg的盐酸米诺环素,得到负载盐酸米诺环素的复合peg水凝胶。
或者,
(9)在加入m8sp溶液之前,加入0.5mgbsa,得到负载大分子药物模型bsa的复合peg水凝胶。
(10)同理,合成氨基酸序列为cgdqgiagfc的mmp-8不敏感多肽(m8ip),制备mmp-8不敏感的空白水凝胶(mih),和负载盐酸米诺环素的mih。
【实施例3】
(1)室温下,使用500mg氯树脂,采用fmoc固相合成法合成序列为cgpqgiwqgc(cys-gly-pro-gln-gly-ile-trp-gln-gly-cys,半胱氨酸-甘氨酸-脯氨酸-谷酰胺-甘氨酸-异亮氨酸-色氨酸-谷酰胺-甘氨酸-半胱氨酸)的mmp8敏感多肽(m8sp)。
(2)采用esi鉴定合成的多肽,确定所合成的为分子量为1048的目的多肽。
(3)使用hplc检测所合成的多肽纯度,并对多肽进行纯化,使纯度达到99%以上。
(4)配置0.3mol/l的三乙醇胺水(tea)溶液,利用0.1mol/l的盐酸溶液将ph调整至8.0,得到ph为8.0的tea缓冲液。
(5)将20mg纯化后的m8sp加入1ml上述配好的tea缓冲液中,得到浓度为20mg/ml的m8sp溶液。
(6)取10mg4-arm-peg-ac溶于42μltea缓冲液中,震荡使混合均匀。
(7)在上述peg溶液中加入58μlm8sp溶液,37℃下反应,5分钟内成凝胶,继续反应30min,得到质量/体积比为10%的peg水凝胶。
(8)与上述方法类似,在加入m8sp溶液之前,加入2mg的盐酸米诺环素,得到负载有20%盐酸米诺环素的peg水凝胶。
(9)在加入m8sp溶液之前,加入2mgbsa,得到负载有20%bsa的peg水凝胶。
性能测试:
(1)流变性能测试
取100mg4-arm-peg-ac溶于420μltea缓冲液中,混合均匀后加入580μl浓度为20mg/ml的m8sp溶液,震荡20s后立即注射到流变检测仪平板上,上下平板接触后在平板周围涂一层硅油防止溶液挥发,37℃下进行动态时间扫描,检测其流变性能。与此方法类似,在加入m8sp之前,在peg溶液中加入10mg盐酸米诺环素,检测负载药物盐酸米诺环素对该凝胶流变性能的影响。
流变学检测是研究水凝胶化过程的重要手段,由图2的结果可知,储存模量g’在测试的短时间内急剧升高,随后趋于平稳,这说明凝胶化迅速发生。损耗模量g”用以衡量材料因粘性形变而损耗的能量,其值越低表明材料弹性越好。所制凝胶在37℃下,4分钟之内成凝胶,并且药物的负载并不影响其流变学性能。该实验结果为实施例2所获效果,实施例1和3亦能取得类似结果。
(2)形貌观察
取50mg4-arm-peg-ac溶于210μltea缓冲液中,混合均匀后加入290μl浓度为20mg/ml的m8sp溶液,震荡后37℃下静置成胶,继续反应30min后将制备的水凝胶反复用蒸馏水冲洗,液氮淬断。使用真空冷冻干燥机真空干燥,喷金,然后利用扫描电镜观察水凝胶的内部形貌。
由图3的结果可知,所制得的水凝胶肉眼为透明、凝胶状材料,弹性良好。扫描电镜观察,该水凝胶内部呈均匀网状多孔,孔隙规则,为水凝胶的经典状态,孔径一致,约为100um。
(3)体外溶胀与降解性能
按实施例2的方法制备空白和载药水凝胶各50μl,称重湿凝胶初始质量记为w0。随后加入pbs10ml,置于37℃恒温震荡箱,每隔一定时去除pbs,将湿凝胶称重记为wt,试管中补加10mlpbs,凝胶继续溶胀。溶胀比s采用公式计算:s=wt/w0。同时将制得的水凝胶各50μl,分别浸于入1mlpbs、10nm和20nmmmp-8溶液中,记录凝胶完全降解所用的时间。
对于凝胶材料来说,溶胀时主要为吸水溶胀,表现为质量和体积的快速增加。凝胶吸水能力达到极限后,凝胶分解,宏观表现为质量下降,逐步降解,凝胶这种先溶胀后降解的性质有利于其作为药物或因子的载体,一方面起到保护药物的作用,另一方面降解使药物释放。由如图4a所示,24小时内,该凝胶先吸水膨胀,在8小时后达到稳定状态,并且米诺环素的负载不影响该凝胶的溶胀特性。图4b可知,在pbs中,凝胶完全降解所需时间约为8天,在10nmmmp-8溶液中完全降解约需3天,在20nmmmp-8溶液中,不足48小时即可全部降解。而对照组凝胶(mih),溶液的不同(pbs、10nmmmp-8、20nmmmp-8)并不影响其完全降解所需的时间,说明本实验设计合成的凝胶(msh)具有mmp-8特异性降解特性。
(4)药物控释效果检测
选用经典牙周炎常用药物盐酸米诺环素作为小分子药物模型,考察负载盐酸米诺环素的复合凝胶的mmp-8响应性控释效果。配制浓度梯度的盐酸米诺环素标准液,使用hplc在345nm检测吸光度值,以吸光度值对浓度作图并线性拟合,得到浓度标准曲线和回归方程。按照例2中的方法,制备负载有盐酸米诺环素的复合peg水凝胶100μl,将载药凝胶加入pbs溶胀24h后,分别放入pbs、10nmmmp-8、20nmmmp-8溶液中,37℃恒温震荡,每隔一定时间,取出100μl释放液,并补充新鲜溶液,使用hplc检测吸光度值,得到盐酸米诺环素浓度和释放量,计算累计释放百分比并绘制释放曲线。
选用牛血清白蛋白(bsa)作为大分子药物模型,考察负载bsa的peg水凝胶mmp-8响应性释放效果。根据考马斯亮蓝与蛋白结合生成复合物,在595nm处其吸光度值与蛋白浓度呈线性关系的原理,定量测定bsa。配置bsa的标准液,使用酶联免疫检测仪测波长595nm处吸光度值,绘制标准曲线并得到回归方程。将1mgbsa加入10mgpeg凝胶前驱液中,后加入m8sp溶液交联生成凝胶,制得负载有bsa的peg复合水凝胶,将载药复合凝胶分别加入pbs、10nmmmp-8、20nmmmp-8溶液中,37℃恒温震荡,每隔一定时间,取出100μl释放液,并补充新鲜溶液,使用酶联免疫检测仪测波长595nm处吸光度值,计算bsa浓度和释放量,计算累计释放百分比并绘制释放曲线。
如图5a所示,与mmp-8不敏感水凝胶组(mih)和溶液为pbs的组相比,mmp-8响应性水凝胶组(msh)在加入mmp-8时,药物释放速度明显增加,并且随着mmp-8的浓度增加而增加。为了减少小分子药物的突释,常用的大分子药物模型牛血清白蛋白(bsa,mw=66.430kda)被用来检测该控释载体对大分子药物的特异性控释效果,如图5b所示,药物的突释效果得到明显改善,mmp-8响应性控释效果更加明显,并随着mmp-8浓度的增加,释放速度加快。
(5)抗菌性能检测
按照实施例2中的方法制备负载盐酸米诺环素的复合水凝胶,加入pbs溶胀24h后继续使用pbs或者10nmmmp-8溶液浸泡至水凝胶完全降解,分别于24h、48h、72h后收集缓释溶液用于药物的抗菌活性检测。取75μl的缓释溶液置于96孔板中,使用tsb细菌培养基二倍稀释缓释液10次,随后将75μl处于对数增殖期的p.gingivalis溶液加入每个孔中,对照组使用灭菌pbs代替缓释液。37℃下厌氧培养48小时。检测每孔od600的吸光度值。
如图6所示,与对照组相比,负载盐酸米诺环素的载药水凝胶缓释溶液展示出了明显的抗菌效果。由于盐酸米诺环素的突释效应,初期的药物浓度较高,表现出了最强的抑菌效果。48h、72h后的缓释液与对照组相比,仍然具有明显的抗菌效果,证实该载药体系并不影响药物活性,是一种有效、可行的药物控释载体。
(5)生物安全性评价
按照iso-10933标准,采用甲基噻唑基四唑(mtt)法,通过细胞与材料浸提液共培养和细胞染色的方式检测凝胶及其产物的细胞相容性。
配制空白凝胶(msh)和负载盐酸米诺环素凝胶(msh/mino)的前驱液各150μl,注入0.8mm的模板中,继续凝胶化24h,取出凝胶片pbs冲洗三次。在无菌条件下酒精消毒凝胶片2小时,后pbs浸泡2小时*4次。无菌条件下将凝胶片分别浸泡于细胞培养液α-dmem(5ml)中24小时,得到的即为浸提液。将牙龈成纤维细胞接种于96孔板,每孔100μl,约1*104个细胞,每组复种6孔,24小时后弃掉原培养基,分别使用新鲜培养基(对照组)、空白凝胶浸提液(msh组)以及负载盐酸米诺环素凝胶浸提液(msh/mino组)继续培养细胞。24和72小时后向每孔内加入50μlmtt溶液(5mg/ml),继续培养4h,倒置显微镜下观察mtt结晶,然后弃去孔内上清液,每孔内加入100μl二甲基亚砜,震荡10min后在酶联仪570nm下测定od值,取6孔平均值。由图7a可知,与对照组相比,空白凝胶和负载有盐酸米诺环素的凝胶幷不影响细胞的增殖活性。
将50μlmsh和msh/mino凝胶前驱液分别注入48孔板,继续凝胶化24h后取出凝胶片,使用pbs冲洗三次。在无菌条件下酒精消毒凝胶片2h,后pbs浸泡2小时*4次。将凝胶片放于24孔板中,对照组使用细胞爬片,将牙龈成纤维细胞接种于24孔板中的凝胶片或细胞爬片上,浓度为2×105cells/ml,每孔1ml培养24h和48h。pbs冲洗凝胶2次,使用活死细胞液染色细胞,冲洗,荧光显微镜观察。由图7b(对照组)、7c(msh)、7d(msh/minio)可知,无论是未负载药物的空白凝胶还是负载有盐酸米诺环素的凝胶,都显示出了良好的细胞相容性,表面细胞的生长情况与对照组无明显差异。
由此可知,无论是凝胶还是其降解产物,均显示出了良好的生物安全性,peg被广泛用来作为药物载体,已被证实无毒性,其分解产物为小分子,可被代谢排出体外,是安全的药物载体,本实验结果亦表明其具有良好的生物安全性,可被用作口腔药物的载体。
- 还没有人留言评论。精彩留言会获得点赞!