手术注射系统和方法与流程
本公开大体上涉及用于治疗肌骨骼病症的医疗装置,并且更具体地说涉及用于治疗脊柱的手术系统和方法。
背景技术
脊柱病症如退行性椎间盘疾病、椎间盘突出、骨质疏松、脊椎前移、狭窄症、脊柱侧凸及其它曲度异常、脊柱后凸、肿瘤和骨折可能由包括创伤和衰老所导致的外伤、疾病和退行性病状的因素引起。脊柱病症通常导致包括疼痛、神经损伤和部分或完全丧失活动能力的症状。
非手术治疗,如药物治疗、康复和锻炼可能是有效的,然而,可能不能缓解与这些病症相关的症状。这些脊柱病症的手术治疗包括融合、固定、矫正、椎间盘切除术、微椎间盘切除术、椎体切除术、减压术、椎板切除术、椎板切开术、椎间孔切开术、椎骨关节面切除术和植入式假体。作为这些手术治疗的一部分,可将包括植入物(例如骨移植物,骨紧固件、脊柱杆和椎体间装置)的脊柱构建体递送到手术部位以与骨固定以固定关节。脊柱构建体可用于为治疗区域提供稳定性并促进愈合。本公开描述了对这些技术的改进。
技术实现要素:
在一个实施例中,提供手术注射装置。手术注射装置包括限定通道的至少一个管状元件。通道被配置成用于处置安置在通道内的选定体积的药剂和排空器。致动器可与排空器接合,以将选定体积的药剂从通道全部排出到选定的部位。在一些实施例中,公开了脊柱构建体、植入物、系统和方法。
附图说明
根据伴随着下列附图的具体说明,本公开将变得更加清楚,其中:
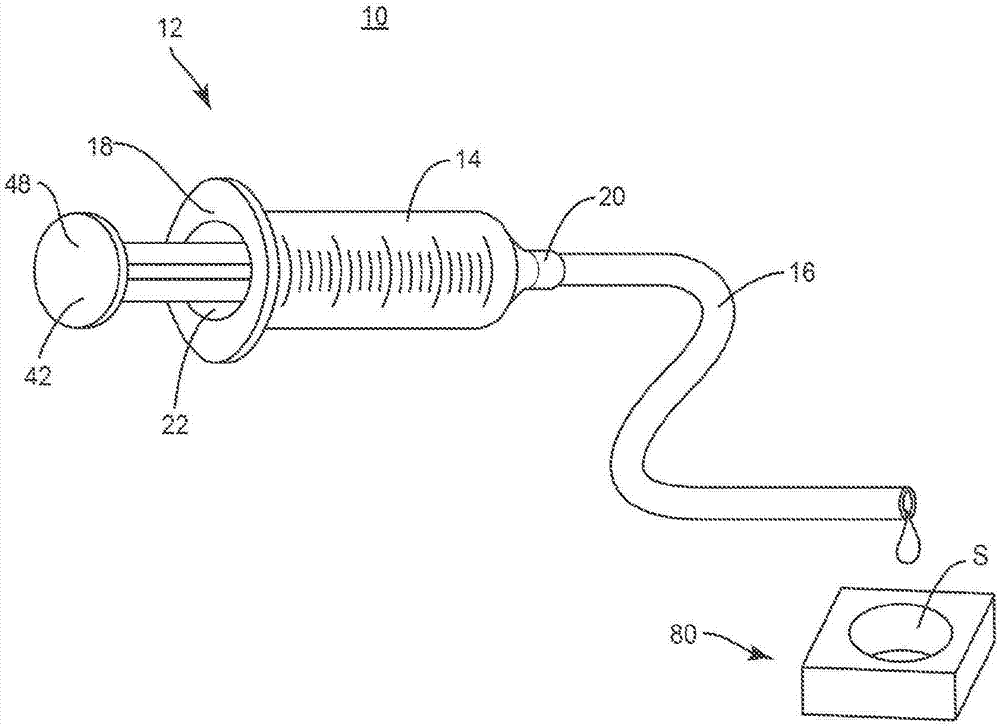
图1是根据本公开原理的手术系统的一个实施例的组件的透视图;
图2是图1中所示系统的组件的透视图;
图图3是图1中所示系统的组件的透视图;
图4是图1中所示系统的组件的透视图;
图5是根据本公开原理的手术系统的一个实施例的组件的横截面图;
图6是图5中所示组件的横截面图;
图7是图5中所示组件的横截面图;
图8是根据本公开原理的手术系统一个实施例的组件的透视图;
图9是根据本公开原理的手术系统的一个实施例的组件的横截面图;
图10是图9中所示组件的横截面图;
图11是图9中所示组件的横截面图;
图12是根据本公开原理的手术系统的一个实施例的组件的透视图;
图13是根据本公开原理的手术系统的一个实施例的组件的透视图;
图14是根据本公开原理的手术系统的一个实施例的组件的剖视图;
图15是根据本公开原理的手术系统的一个实施例的组件的剖视图;
图16是根据本公开原理的手术系统的一个实施例的组件的透视图,其中部件是分开的;
图17是根据本公开原理的手术系统的一个实施例的组件的横截面图;
图18是根据本公开原理的手术系统的一个实施例的组件的横截面;
图19是图18中所示组件的横截面图;
图20是根据本公开原理的手术系统的一个实施例的组件的透视图,其中部件是分开的;
图21是根据本公开原理的手术系统的一个实施例的组件的横截面图;
图22是根据本公开原理的手术系统的一个实施例的组件的横截面图;和
图23是图22中所示组件的横截面图。
具体实施方式
在用于治疗肌骨骼病症的医疗装置方面,和更具体地,在用于治疗脊柱的手术系统和方法方面,讨论公开的手术系统和相关的使用方法的示例性实施例。
在一些实施例中,手术系统包括手术注射装置,例如,注射器。在一些实施例中,手术注射装置包括选定量的药剂(例如骨移植材料)和一定量的排空器(例如可流动回填材料)。在一些实施例中,回填材料被配置成有助于从注射器完全排空骨移植材料。在一些实施例中,注射器被配置成用于与套管附接。在一些实施例中,注射器被配置成用于与管腔附接,例如管。在一些实施例中,回填材料用注射器以串联构型包装在骨移植材料后面。在一些实施例中,回填材料被配置成有助于用骨移植材料填充管腔,并有助于骨填充材料从管腔完全排空到手术部位和/或植入物中。
在一些实施例中,手术注射装置被配置成有助于手术程序和使外科医生能够可靠地将离散量的骨移植材料放置到手术部位和/或植入物中。在一些实施例中,手术注射装置向外科医生提供关于用手术部位注射的骨移植材料的量的更高水平的确定性。在一些实施例中,手术注射装置被配置成减少留在注射器中的骨移植材料的浪费。在一些实施例中,药剂可包括同种异体移植材料。
在一些实施例中,手术注射装置包括双腔室,一个用于回填材料,另一个用于骨移植材料。在一些实施例中,双腔室有助于为一个区域分配一定量,然后使用回填材料将其注入,然后将第二量分配给第二区域并使用回填材料将其排出。在一些实施例中,手术注射装置包括单向阀,所述单向阀被配置成防止一个腔室将材料注射到另一个腔室中并将骨移植材料引导到管腔中。在一些实施例中,手术注射装置被配置成用于将骨移植材料混合用于注射的一部分而不将骨移植材料混合用于另一部分注射。
在一些实施例中,手术注射装置用于填充脊柱植入物的空隙,例如,椎体间装置。在一些实施例中,手术注射装置用于在后侧向融合期间填充如沟槽的骨腔。在一些实施例中,手术注射装置用于填充围绕和/或邻近椎间间隔物的椎体间空间。在一些实施例中,手术注射装置可包括交替层的回填材料和骨移植材料。在一些实施例中,手术注射装置可包括各种类型的回填材料分层的不同纹理或类型的骨移植材料。在一些实施例中,基于手术程序选择骨移植材料的类型并根据需要注射,例如,粗大的骨移植材料,然后光滑的骨移植材料,然后回填材料。在一些实施例中,根据需要重复注射过程,例如,用于填充沟槽。
在一些实施例中,回填材料可包括,例如,甘油、水、盐水、油或任何多糖;和/或可流动且生物相容的材料。在一些实施例中,回填材料可包括,例如,水泥,以使手术注射装置成为单次使用或一次性装置。在一些实施例中,回填或骨移植材料可包括或以这样的方式形成,以包含当注射时类似于液体流动的细的、润滑的或光滑的/球状材料的固体块。
在一些实施例中,骨移植材料可包括,例如,自体移植物、同种异体移植物、
在一些实施例中,回填材料用于堆积骨移植材料,如用双注射器。例如,骨移植材料对于某些应用可能太强,如当在颈椎中使用bmp时,并且因此可使用少量或大量的回填材料来稀释骨移植材料。因此,回填材料用于将骨移植物驱动到手术部位中并用于降低骨移植物的效力。
在一些实施例中,骨移植材料和回填材料在视觉上是类似的,其中在材料中没有差别可辨别,或材料制成在视觉上不同。一个益处是确保在执行下一部分程序之前完全注射全部量的骨移植材料或回填材料。
在一些实施例中,可放置在手术注射装置中的骨移植材料可是脱矿质的骨材料(例如,纤维、碎片、粉末或其组合)。在一些实施例中,脱矿质骨纤维可是细长的并且具有至少约50:1至约至少约1000:1的纵横比。在一些实施例中,细长的脱矿质骨纤维沿装置的轴线定向,例如沿装置的管的整个长度定向。细长的骨纤维可通过几种方法中的任何一种获得,例如,通过铣削或刮削整个骨或相对大部分骨的表面。
在其它实施例中,纤维的长度可为至少约3.5cm,并且平均宽度为约20mm至约1cm。在各种实施例中,细长纤维的平均长度可为约3.5cm至约6.0cm,并且平均宽度为约20mm至约1cm。在其它实施例中,细长纤维的平均长度为约4.0cm至约6.0cm,并且平均宽度为约20mm至约1cm。
在又其它实施例中,细长纤维的直径或平均宽度为,例如,不超过约1.00cm、不超过0.5cm或不超过约0.01cm。在再其它实施例中,纤维的直径或平均宽度可为约0.01cm至约0.4cm或约0.02cm至约0.3cm。
在另一个实施例中,纤维的纵横比可为约50:1至约950:1、约50:1至约750:1、约50:1至约500:1、约50:1到约250:1;或者约50:1至约100:1。根据本公开的纤维可有利地具有约50:1至约1000:1、约50:1至约950:1、约50:1至约750:1、约50:1至约600:1、约50:1至约350:1、约50:1至约200:1、约50:1至约100:1或约50:1至约75:1的纵横比。
在一些实施例中,可使用骨碎片或它们可与骨纤维组合,其中碎片与纤维的比率为约90:10、80:20、70:30、60:40、50:50、40:60、30:70、20:80和/或10:90。在各种实施例中,可在装置中使用的表面脱矿质骨碎片与纤维的比率约为90:10、80:20、70:30、60:40、50:50、40:60、30:70、20:80和/或10:90。在一些实施例中,可在装置中使用的表面脱矿质碎片与完全脱矿质纤维的比率为约90:10、80:20、70:30、60:40、50:50、40:60、30:70、20:80和/或10:90。
在一些实施例中,骨移植材料的粘度和回填材料的粘度可是不同的。在一些实施例中,回填材料的粘度将小于骨移植材料的粘度。在一些实施例中,回填材料将尽可能薄以降低注射阻力。
在一些实施例中,手术注射装置被配置成填充体积为3立方厘米(cc)的椎间间隔物中的空隙。在一些实施例中,手术注射装置包括体积为3cc的管腔。在一些实施例中,手术注射装置填充有3cc的骨移植材料和3cc的回填材料,使得回填材料将全部3cc的骨移植材料排空到椎间间隔物的3cc空隙中。本文所述的体积仅供参考,并且可应用与所使用和填充的装置的尺寸相关的适当的任何体积。
在一些实施例中,手术注射装置包括:包括分配特定量的骨移植物材料的一个注射器和被配置成分配特定量的回填材料的第二注射器的双注射器装置。在一些实施例中,骨移植材料注射器被启动以填充空隙。在一些实施例中,填充管与双注射器装置附接。在一些实施例中,骨移植材料被配置成填充填充管。在一些实施例中,向回填材料注射器施加正压力以抵抗和/或防止骨移植材料进入回填材料注射器中。在一些实施例中,双注射器装置包括单向阀,以抵抗和/或防止一种材料进入另一种材料的注射器中。
在一些实施例中,回填材料注射器被启动以将骨移植材料从填充管排空到植入物中。在一些实施例中,可再次启动骨移植材料注射器以填充第二空隙。在一些实施例中,骨移植材料注射器和回填材料注射器可同时被启动。在一个实施例中,回填物注射器填充有不透射线的材料,使得以一定的间隔,外科医生可看到已经注射了多少骨移植材料。在一个实施例中,外科医生在每次1cc分配的骨移植材料之间注射0.1cc的不透射线标记材料,使得在装置填充时,每个不透射线标记层指示已进入椎体间装置的骨移植材料的量。在一些实施例中,手术注射装置可包括多于两个注射器,以提供具有不同材料特性的各种骨移植材料。在一些实施例中,系统可包含3个或更多个注射器。
在一些实施例中,手术注射装置包括预包装有骨移植材料的管。在一些实施例中,管被配置成用于与压力施加装置连接,例如注射器,以从管中排空骨移植材料。在一些实施例中,骨移植材料通过帽在一端或两端处封闭在管内。在一些实施例中,管包括塞子。在一些实施例中,管可与鲁尔锁连接器附接。在一些实施例中,管包括被配置成用于与灌注器械连接的端部。
在一些实施例中,利用预包装管的方法包括从一端或两端移除帽的步骤。在一些实施例中,利用预包装管的方法包括将管附接到植入物。
在一些实施例中,手术注射装置包括被配置成在管内部或大体上在管内部的插塞。在一些实施例中,插塞被配置成用于植入骨移植材料,从而消除在施加骨移植材料之前移除插塞的需要。
在一些实施例中,手术系统的一个或所有组件是可与植入物一起使用的一次性的剥离型包、预包装的无菌装置。手术系统的一个或所有组件可是可重复使用的。手术系统可被配置为具有多个设定尺寸和配置的组件的套件。
在一些实施例中,本公开可用于治疗脊柱病症,例如,退行性椎间盘疾病、椎间盘突出、骨质疏松、脊椎前移、狭窄症、脊柱侧凸及其它曲度异常、脊柱后凸、肿瘤和骨折。在一些实施例中,本公开可与其它骨骼和骨相关应用一起使用,包括与诊断和治疗相关的那些应用。在一些实施例中,所公开的手术系统和方法可替代地用于患者处于俯卧位或仰卧位的手术治疗中,和/或采用各种手术入路进入脊柱,包括前、后、后中线、直接侧向、后外侧和/或前外侧入路,以及用于其它身体区域中。本公开还可与用于治疗脊柱的腰部、颈部、胸部和骨盆区域的程序替代地使用。本公开的系统和方法还可用于动物、骨模型和其它非生物基质,例如,用于训练、测试和演示中。
本公开可通过参考结合附图的本公开的以下详细描述更容易地理解,所述附图形成本公开的一部分。应理解,本公开不限于本文描述和/或示出的具体装置、方法、条件或参数,并且本文使用的术语仅出于举例的目的描述特定实施例,并不旨在限制要求保护的公开内容。在一些实施例中,除非上下文明确规定,否则,如说明书中使用并且包括所附权利要求书,单数形式“一(a/an)”和“所述(the)”包括复数,并且对特定数值的引用至少包括所述特定值。范围在本文中可表示为从“约”或“大约”一个特定值和/或至“约”或“大约”另一个特定值。当表达这类范围时,另一个实施例包括从一个特定值和/或至另一个特定值。类似地,当通过使用先行词“约”将值表示为近似值时,应理解所述特定值形成另一个实施例。还应理解,所有空间参考,例如水平、垂直、顶部、上、下、底部、左和右仅用于说明目的,并且可在本公开的范围内变化。例如,引用“上”和“下”是相对的并且仅在上下文中用于另一个,并且不一定是“上方”和“下方”。
如在本说明书中使用并且包括所附权利要求书,“治疗(treating)”或“治疗(treament)”疾病或病况是指执行可包括施用一种或多种药物到患者(正常或不正常的人,或其它哺乳动物)以致力于缓解疾病或病况的体征或症状的程序缓解可在疾病或病况的体征或症状出现之前以及出现之后发生。因此,治疗或治疗包括预防或预防疾病或不良状况(例如,预防疾病在可能易患所述疾病但尚未被诊断为患有所述疾病的患者中发生)。此外,治疗或治疗不需要完全缓解体征或症状,不需要治愈,并且具体地包括对患者仅具有边际效应的程序。治疗可包括抑制疾病,例如阻止其发展,或减轻疾病,例如引起疾病消退。例如,治疗可包括减少急性或慢性炎症;缓解疼痛以及减轻和诱导新韧带、骨和其它组织的再生;作为手术的辅助手段;和/或任何修复程序。此外,如说明书中使用并且包括所附权利要求书,除非另有特别说明,否则术语“组织”包括软组织、韧带、腱、软骨和/或骨。
下面的讨论包括根据本公开原理的手术系统以及采用手术系统的相关方法的描述。还公开了替代实施例。详细参考本公开的示例性实施例,其在附图中示出。转到图1-7,示出了包括手术注射装置12的手术系统10的组件。
手术系统10的组件可由适合于医疗应用、生物学上可接受的材料制成,包括金属、合成聚合物、陶瓷和/或它们的复合材料。例如,手术系统10的组件,单独地或共同地,可由以下材料制成:如不锈钢合金、商业纯钛、钛合金、5级钛、超弹性钛合金、钴铬合金、超弹性金属合金(例如,镍钛诺、超弹塑性金属,如
手术系统10的各种组件可具有材料复合材料,包括以上材料,以实现如强度、刚度、弹性、顺从性、生物力学性能、耐久性和射线可透性或成像偏好的各种期望特性。手术系统10的组件单独地或共同地也可由异质材料制成,如两种或更多种上述材料的组合。手术系统10的组件可整体地形成、一体地连接或包括紧固元件和/或器械,如本文所述。
包括手术注射装置12的手术系统10的组件可与例如经皮手术植入、微创手术、迷你开放和开放式手术技术一起使用来准备手术部位(包括组织)与手术程序连接、引入手术器械和/或递送和引入一种或多种生物材料和/或植入物,例如脊柱植入物、杆、紧固件、连接器、板、椎间植入物、椎体间装置和关节成形术装置在患者体内的手术部位处,例如脊柱的一部分。在一些实施例中,手术系统10可与例如减压、椎体切除术和椎间盘切除术的手术程序一起使用,所述手术程序可包括采用植入物的融合和/或固定治疗。
手术注射装置12包括多个管状元件,例如,注射器筒14和限定通道p的管子16。排空器,例如,可流动回填材料32可与选定体积v的药剂(例如在通道p内的骨移植材料30)接合,以将选定体积v的骨移植物30从通道p全部排出到选定部位的空隙,如本文所述。在一些实施例中,手术注射装置12可包括单个管状元件,或一体地连接或整体地形成的多个管状元件。
在一些实施例中,骨移植物30被配置成用于在干燥状态下安置到筒14中。在一些实施例中,手术注射装置12被配置成用于通过抽吸或真空从选定部位(例如,椎间盘空间)抽出血液或液体以水合干燥骨移植物30。在一些实施例中,在骨移植物30水合之后,将其注射到选定部位中。
在一些实施例中,骨移植物30可从一个选定部位抽出。在一些实施例中,当骨移植物30被注射到错误部位中时,或如果骨移植物30由于紧急情况而被注射到部位中,那么手术注射装置12被配置成通过抽吸或真空从所述部位抽出骨移植物30。
筒14在近侧端部18和远侧端部20之间延伸。端部18限定被配置成用于处置致动器例如柱塞42的开口22,如本文所述。端部20限定开口24并且被配置成用于与管子16连接,如本文所述。在一些实施例中,端部20包括具有锥形物、喷嘴、阀和/或用于与管子16连接的鲁尔锁定连接件的尖端。在一些实施例中,端部20包括压力配件、摩擦配件或用于与管子16连接的螺纹连接件。在一些实施例中,端部20与管子16一体地连接或整体地形成。
筒14限定纵向轴线x1,如图5中所示。在一些实施例中,筒14可具有横截面构型,例如椭圆形、圆柱形、三角形、正方形、多边形、不规则的、均匀的、不均匀的、偏移的、交错的、波浪形、弓形、可变的和/或锥形。在一些实施例中,筒14的壁可是柔性的、弹性的、半刚性的或刚性的。
筒14包括表面26表面26限定空腔,例如通道28。通道28限定了通道p的一部分,如本文所述。通道28沿轴线x1在端部18、20之间延伸。通道28被配置成用于处置骨移植物30和回填物32,如本文所述。在一些实施例中,通道28可具有横截面构型,例如椭圆形、圆柱形、三角形、正方形、多边形、不规则的、均匀的、不均匀的、偏移的、交错的、波浪形、弓形、可变的和/或锥形。
在一些实施例中,筒14包括被配置成提供材料的注射量的视觉指示的视觉标记,如在外表面上的渐变。在一些实施例中,一部分或整个筒14是透明的,以提供保留在筒14中的材料量的视觉指示。
管子16被配置成用于邻近开口24与筒14的尖端附接。管子16在端部60和端部62之间延伸。端部60包括表面64。表面64以各种构型与筒14的尖端连接,例如鲁尔锁连接件、摩擦配件、压力配件、锁定突起/凹槽、锁定键槽和/或粘合剂。端部62被配置成用于邻近选定部位的空隙安置,如本文所述,在骨移植物30全部从通道p排出时。
管子16包括限定空腔例如通道68的表面66。管子16邻近开口24与筒14的尖端附接,以连接通道28与通道68以形成通道p。通道68被配置成用于骨移植物30和回填物32的通过,使得选定体积v的骨移植物30从通道p全部排出到选定部位的空隙,如本文所述。在一些实施例中,通道68可具有横截面构型,例如椭圆形、圆柱形、三角形、正方形、多边形、不规则的、均匀的、不均匀的、偏移的、交错的、波浪形、弓形、可变的和/或锥形。应理解,根据手术程序,管子16可是任何长度。
在一些实施例中,管子16包括被配置成提供材料的注射量的视觉指示的视觉标记,如在外表面上的渐变。在一些实施例中,一部分或整个管子16是透明的,以提供保留在管子16中的材料量的视觉指示。
在一些实施例中,不透射线标记定位在尖端上并且管子16由射线可透过的材料制成在一些实施例中,管包含转向构件,所述转向构件允许尖端可转向,使得表面64的角度可改变并且量值可改变。在一些实施例中,可转向尖端利用与可转向导管类似的技术(例如,多个管腔,其中一个用于拉线以拉动尖端)。在一些实施例中,管子16的端部可是闭合的或具有开口,并且管子的表面可具有一个或多个开口或开窗,用于分配移植材料和/或流体。在一些实施例中,这些开口可以一定角度和/或定向安置,用于将移植物材料和/或流体分配到期望的一个或多个部位。在一些实施例中,多个开窗也可沿管定向以给出分配线,而不是分配点。在一些实施例中,多个开窗可通过单个长开口来合拢。
在一些实施例中,管子16的表面可具有用于分配移植材料和/或流体的一个或多个开口并且装置可包括用于定向开口的手柄。手柄可旋转、平移或枢转到适当的定向用于递送移植材料和/或流体。
选定体积v的骨移植物30被配置成流过通道p到选定部位中。在一些实施例中,骨移植物30包括粘度,所述粘度被配置成减小与表面26的阻力并有助于在通道p内流动。在一些实施例中,骨移植物30包括润滑材料。在一些实施例中,骨移植物30可包括,例如,骨材料,其包括自体移植物、同种异体移植物、异种移植物、
在一些实施例中,骨移植物30包含脱矿质骨材料。脱矿质骨材料可包含脱矿质骨、粉末、碎片、三角形棱柱、球体、立方体、圆柱体、小碎片、纤维或具有不规则或随机几何形状的其它形状。这些可包括,例如,“大体上脱矿质的”,“部分脱矿质的”或“完全脱矿质的”皮质和松质骨。这些还包括表面脱矿质,其中骨构建体的表面是大体上脱矿质的、部分脱矿质的或完全脱矿质的,但骨构建体的主体是完全矿化的。
在一些实施例中,骨移植物30包含至少一种生长因子。这些生长因子包括骨诱导剂(例如,在没有骨生长的区域中引起新骨生长的试剂)和/或骨传导剂(例如,引起细胞生长进入和/或通过同种异体移植物的试剂)。骨诱导剂可是多肽或多核苷酸组合物。骨诱导剂的多核苷酸组合物包括但不限于分离的骨形态发生蛋白(bmp)、血管内皮生长因子(vegf)、结缔组织生长因子(ctgf)、骨保护素、生长分化因子(gdf)、软骨衍生的形态发生蛋白(cdmp)、lim矿化蛋白(lmp)、血小板衍生的生长因子(pdgf或rhpdgf)、胰岛素样生长因子(igf)或转化生长因子β(tgf-β)多核苷酸。骨诱导剂的多核苷酸组合物包括但不限于含有编码关注的骨诱导多肽的多核苷酸的基因治疗载体。基因治疗方法通常利用多核苷酸,其编码以操作方式连接或与启动子缔合的骨诱导多肽或由靶组织表达骨诱导多肽所必需的任何其它遗传要素。这类基因治疗和递送技术是本领域已知的(参见,例如,国际公开第wo90/11092号)。合适的基因治疗载体包括但不限于不整合到宿主基因组中的基因治疗载体。替代地,合适的基因治疗载体包括但不限于整合到宿主基因组中的基因治疗载体。
在一些实施例中,多核苷酸以质粒制剂形式递送。质粒dna或rna制剂是指编码骨诱导多肽的多核苷酸序列,其不含任何用于辅助、促进或有助于进入细胞的递送载体,包括病毒序列、病毒粒子、脂质体制剂、脂质体、沉淀剂等。任选地,基因治疗组合物可以脂质体制剂和脂质体制剂的形式递送,其可通过本领域技术人员熟知的方法制备。一般方法描述于例如美国专利第5,593,972号、第5,589,466号和第5,580,859号中。
基因治疗载体进一步包含合适的腺病毒载体,包括但不限于例如描述于美国专利第5,652,224号中的那些。
分离的骨诱导剂的多肽组合物包括但不限于分离的骨形态发生蛋白(bmp)、血管内皮生长因子(vegf)、结缔组织生长因子(ctgf)、骨保护素、生长分化因子(gdf)、软骨衍生的形态发生蛋白(cdmp)、lim矿化蛋白(lmp)、血小板衍生的生长因子(pdgf或rhpdgf)、胰岛素样生长因子(igf)或转化生长因子β(tgf-β707)多肽。骨诱导剂的多肽组合物包括但不限于全长蛋白质、其片段或变体。
分离的骨诱导剂的变体包括但不限于被设计成增加体内骨诱导剂的活性的持续时间的多肽变体。变体骨诱导剂的实施例包括但不限于与聚乙二醇(peg)部分缀合以增加其体内半衰期(也称为聚乙二醇化)的全长蛋白质或其片段。聚乙二醇化多肽的方法是本领域熟知的(参见,例如,美国专利第6,552,170号和欧洲专利第0,401,384号作为产生聚乙二醇化多肽的方法的实例)。在一些实施例中,(一种或多种)分离的骨诱导剂作为融合蛋白提供。在一个实施例中,(一种或多种)骨诱导剂可作为与人igg的fc部分的融合蛋白获得。在另一个实施例中,(一种或多种)骨诱导剂可作为异二聚体或同二聚体或多聚体获得。一些融合蛋白的实例包括但不限于成熟骨诱导多肽与人免疫球蛋白g(igg)的fc部分之间的配体融合。制备融合蛋白和编码其的构建体的方法是本领域熟知的。
在一些实施例中,包括在骨移植物30中分离的骨诱导剂是无菌的。在非限制性方法中,例如通过无菌过滤膜(例如,0.2微米膜或过滤器)过滤可容易地实现无菌。在一个实施例中,分离的骨诱导剂包括骨形态发生蛋白(“bmp”)家族中的一个或多个成员。bmp是一类被认为在内源性骨组织上具有骨诱导或生长促进活性的蛋白质,或作为前胶原前体起作用。bmp家族的已知成员包括但不限于bmp-1、bmp-2、bmp-3、bmp-4、bmp-5、bmp-6、bmp-7、bmp-8、bmp-9、bmp-10、bmp-11、bmp-12、bmp-13、bmp-15、bmp-16、bmp-17、bmp-18以及其多核苷酸或多肽,以及成熟多肽或编码其的多核苷酸。
用作骨诱导剂的bmp包含bmp-1;bmp-2;bmp-3;bmp-4;bmp-5;bmp-6;bmp-7;bmp-8;bmp-9;bmp-10;bmp-11;bmp-12;bmp-13;bmp-15;bmp-16;bmp-17;或bmp-18中的一种或多种;以及这些bmp中的一种或多种的任何组合,包括全长bmp或其片段,或其组合,或作为多肽或编码所有所述bmp的多肽片段的多核苷酸。分离的bmp骨诱导剂可作为多核苷酸、多肽、全长蛋白质或其组合施用。
在另一个实施例中,分离的骨诱导剂包括破骨细胞生成抑制剂,以抑制植入部位周围由破骨细胞的的骨组织的骨再吸收破骨细胞和破骨细胞生成抑制剂包括但不限于骨保护素多核苷酸或多肽,以及成熟的骨保护素蛋白质、多肽或编码其的多核苷酸。骨保护素是tnf受体超家族的成员,并且是成骨细胞分泌的诱饵受体,其作为骨吸收的负调节剂起作用。该蛋白特异性结合其配体、骨保护素配体(tnfsf11/opgl),这两者都是破骨细胞发育的关键细胞外调节剂。
破骨细胞生成抑制剂进一步包括但不限于,如二膦酸盐的化合物,5-脂氧合酶抑制剂,如美国专利第5,534,524号和第6,455,号中所述的那些,杂环化合物,如美国专利第5,658,935号中所述的那些,2,4-二氧代咪唑烷和咪唑烷衍生物化合物,如美国专利第5,397,796号和第5,554,594号中所述的那些,磺酰胺衍生物,如美国专利第6,313,119号中所述的那些,或酰基胍化合物,如美国专利第6,492,356号中所述的那些。
在另一个实施例中,分离的骨诱导剂包括结缔组织生长因子(“ctgf”)家族中的一个或多个成员。ctgf是一类被认为对结缔组织具有促生长活性的蛋白质。ctgf家族的已知成员包括但不限于ctgf-1、ctgf-2、ctgf-4多核苷酸或其多肽,以及成熟蛋白质、多肽或编码其的多核苷酸。
在另一个实施例中,分离的骨诱导剂包括血管内皮生长因子(“vegf”)家族中的一个或多个成员。vegf是一类被认为对血管组织具有促生长活性的蛋白质。vegf家族的已知成员包括但不限于vegf-a、vegf-b、vegf-c、vegf-d、vegf-e或其多核苷酸或多肽,以及成熟vegf-a、蛋白质、多肽或编码它们的多核苷酸。
在另一个实施例中,分离的骨诱导剂包括转化生长因子-β基因(“tgf-β”)家族中的一个或多个成员。tgf-β是一类被认为对一系列组织(包括结缔组织)具有促生长活性的蛋白质。tgf-β家族的已知成员包括但不限于tgf-β-1、tgf-β-2、tgf-β-3、其多核苷酸或多肽,以及成熟蛋白、多肽或编码其的多核苷酸。
在另一个实施例中,分离的骨诱导剂包括一种或多种生长分化因子(“gdfs”)。已知的gdf包括但不限于gdf-1、gdf-2、gdf-3、gdf-7、gdf-10、gdf-11和gdf-15。例如,适用作分离的骨诱导剂的gdf包括但不限于以下gdf:对应于基因库(genbank)登录号m62302、aaa58501和aab94786的gdf-1多核苷酸或多肽,以及成熟gdf-1多肽或编码其的多核苷酸。对应于基因库登录号bc069643、bc074921、q9uk05、aah69643或aah74921的gdf-2多核苷酸或多肽,以及成熟gdf-2多肽或编码其的多核苷酸。对应于基因库登录号af263538、bc030959、aaf91389、aaq89234或q9nr23的gdf-3多核苷酸或多肽,以及成熟gdf-3多肽或编码其的多核苷酸。对应于基因库登录号ab158468、af522369、aap97720或q7z4p5的gdf-7多核苷酸或多肽,以及成熟gdf-7多肽或编码其多核苷酸。对应于基因库登录号bc028237或aah28237的gdf-10多核苷酸或多肽,以及成熟gdf-10多肽或编码其的多核苷酸。
对应于基因库登录号af100907、np_005802或095390的gdf-11多核苷酸或多肽,以及成熟gdf-11多肽或编码其的多核苷酸。对应于基因库登录号bc008962、bc000529、aah00529或np004855的gdf-15多核苷酸或多肽,以及成熟gdf-15多肽或编码其的多核苷酸。
在另一个实施例中,分离的骨诱导剂包括软骨衍生的形态发生蛋白(cdmp)和lim矿化蛋白(lmp)多核苷酸或多肽。已知的cdmp和lmp包括但不限于cdmp-1、cdmp-2、lmp-1、lmp-2或lmp-3。
适用作分离的骨诱导剂的cdmp和lmp包括但不限于以下cdmp和lmp:对应于基因库登录号nm_000557、u13660、np_000548或p43026的cdmp-1多核苷酸和多肽,以及成熟cdmp-1多肽或编码其的多核苷酸。对应于基因库登录号或p55106的cdmp-2多肽,以及成熟cdmp-2多肽。对应于基因库登录号af345904或aak30567的lmp-1多核苷酸或多肽,以及成熟lmp-1多肽或编码其的多核苷酸。对应于基因库登录号af345905或aak30568的lmp-2多核苷酸或多肽,以及成熟lmp-2多肽或编码其的多核苷酸。对应于基因库登录号af345906或aak30569的lmp-3多核苷酸或多肽,以及成熟lmp-3多肽或编码其的多核苷酸。
在另一个实施例中,分离的骨诱导剂包括骨形态发生蛋白(bmp)、结缔组织生长因子(ctgf)、血管内皮生长因子(vegf)、骨保护素家族中任一项的一个或多个成员,或其它破骨细胞生成抑制剂、生长分化因子(gdf)、软骨衍生的形态发生蛋白(cdmp)、lim矿化蛋白(lmp)或转化生长因子β(tgf-β)、tp508(血管生成组织修复肽)中任一种,以及其混合物或组合。
在另一个实施例中,适用于骨移植物30中的一种或多种分离的骨诱导剂选自由以下组成的组:bmp-1、bmp-2、bmp-3、bmp-4、bmp-5、bmp-6、bmp-7、bmp-8、bmp-9、bmp-10、bmp-11、bmp-12、bmp-13、
bmp-15、bmp-16、bmp-17、bmp-18或其任何组合;ctgf-1、ctgf-2、cgtf-3、ctgf-4或其任何组合;vegf-a、vegf-b、vegf-c、vegf-d、vegf-e或其任何组合;gdf-1、gdf-2、gdf-3、gdf-7、gdf-10、gdf-11、gdf-15或其任何组合;cdmp-1、cdmp-2、lmp-1、lmp-2、lmp-3和或其组合;骨保护素;tgf-β-1、tgf-β-2、tgf-β-3或其任何组合;或这些组中一个或多个成员的任何组合。
在一些实施例中,他汀类药物可被用作生长因子。他汀类药物包括但不限于阿托伐他汀(atorvastatin)、辛伐他汀(simvastatin)、普伐他汀(pravastatin)、西立伐他汀(cerivastatin)、美伐他汀(mevastatin)(参见美国专利第3,883,140号,韦罗他汀(velostatin)(也称为synvinolin;参见美国专利第4,448,784号和第4,450号,氟伐他汀(fluvastatin)、洛伐他汀(lovastatin)、罗苏伐他汀(rosuvastatin)和氟多他汀(fluindostatin)(sandozxu-62-320)、达伐他汀(dalvastain)(欧洲申请公开第738510号a2爱普他汀(eptastatin)、匹伐他汀(pitavastatin)或其药学上可接受的盐或其组合。在各种实施例中,他汀类药物可包含他汀类药物的(+)r和(-)-s对映体的混合物。在各种实施例中,他汀类药物可包含他汀类药物的1:1外消旋混合物。
生长因子可含有惰性材料,如缓冲剂和ph调节剂如碳酸氢钾、碳酸钾、氢氧化钾、乙酸钠、硼酸钠、碳酸氢钠、碳酸钠、氢氧化钠或磷酸钠;降解/释放调节剂;药物释放调节剂;乳化剂;防腐剂如苯扎氯铵、氯丁醇、乙酸苯汞和硝酸苯汞、硫酸氢钠、亚硫酸氢钠、硫代硫酸钠、硫柳汞、对羟基苯甲酸甲酯、聚乙烯醇和苯乙醇;溶解度调节剂;稳定剂;和/或内聚调节剂。在一些实施例中,生长因子可包括无菌和/或无防腐剂的材料。
上述这些非活性成分可具有多功能目的,包括承载、稳定和控制生长因子和/或(一种或多种)其它治疗剂的释放。例如,持续释放过程可通过溶液扩散机制或者可通过侵蚀持续过程来控制。
在一些实施例中,生长因子是在水性缓冲溶液中提供。示例性水性缓冲溶液包括但不限于te、hepes(2-[4-(2-羟乙基)-1-哌嗪基]乙磺酸)、mes(2-吗啉代乙磺酸)、乙酸钠缓冲液、柠檬酸钠缓冲液、磷酸钠缓冲液、tris缓冲液(例如tris-hcl)、磷酸盐缓冲盐水(pbs)、磷酸钠、磷酸钾、氯化钠、氯化钾、甘油、氯化钙或其组合。在各种实施例中,缓冲液浓度可为约1mm至100mm。
在一些实施例中,bmp-2是在含有蔗糖、甘氨酸、l-谷氨酸、氯化钠和/或聚山梨醇酯80的媒介(包括缓冲液)中提供。
在一些实施例中,骨移植物30包括治疗剂。示例性治疗剂包括但不限于il-1抑制剂,这类
适于使用的治疗剂的{3]实例还包括但不限于抗炎剂、止痛剂或骨诱导生长因子或其组合。抗炎剂包括但不限于阿帕宗(apazone)、塞来昔布(celecoxib)、双氯芬酸(diclofenac)、二氟尼柳(diflunisal)、烯醇酸(吡罗昔康(piroxicam)、美洛昔康(meloxicam))、乙哚乙酸(etodolac)、芬那酯(fenamate)(甲芬那酸(mefenamicacid)、甲氯芬那酸(meclofenamicacid))、金、布洛芬(ibuprofen)、吲哚美辛(indomethacin)、酮洛芬(ketoprofen)、酮咯酸(ketorolac)、萘丁酮(nabumetone)、萘普生(naproxen)、尼美舒利(nimesulide)、水杨酸盐、柳氮磺胺吡啶[2-羟基-5-[-4-[c2-吡啶基氨基]磺酰基]偶氮]苯甲酸、舒林酸、替泊沙林(tepoxalin)和托美汀(tolmetin);以及抗氧化剂,如二硫代氨基甲酸盐、类固醇如皮质醇、可的松(cortisone)、氢化可的松(hydrocortisone)、氟氢可的松(fludrocortisone)、泼尼松(prednisone)、泼尼松龙(prednisolone)、甲基强的松龙(methylprednisolone)、曲安西龙(triamcinolone)、倍他米松(betamethasone)、地塞米松(dexamethasone)、倍氯米松(beclomethasone)、氟替卡松(fluticasone)或其组合。
合适的镇痛剂包括但不限于对乙酰氨基酚、布比卡因(bupivicaine)、氟轻松(fluocinolone)、利多卡因(lidocaine)、阿片类镇痛药如丁丙诺啡(buprenorphine)、布托啡诺(butorphanol)、右旋吗拉迈得(dextromoramide)、地佐辛(dezocine)、右丙氧芬(dextropropoxyphene)、二乙酰吗啡(diamorphine)、芬太尼(fentanyl)、阿芬太尼(alfentanil)、舒芬太尼(sufentanil)、氢可酮(hydrocodone)、氢吗啡酮(hydromorphone)、凯托米酮(ketobemidone)、左旋美沙酮(levomethadyl)、杜冷丁(mepiridine)、美沙酮(methadone)、吗啡(morphine)、纳布啡(nalbuphine)、鸦片(opium)、氧可酮(oxycodone)、阿片全碱(papaveretum)、戊唑辛(pentazocine)、哌替啶(pethidine)、苯哌利定(phenoperidine)、哌腈米特(piritramide)、右旋丙氧芬(dextropropoxyphene)、瑞芬太尼(remifentanil)、替利定(tilidine)、曲马多(tramadol)、可待因(codeine)、二氢可待因(dihydrocodeine)、美普他酚(meptazinol)、地佐辛(dezocine)、依他佐辛(eptazocine)、氟鲁匹汀(flupirtine)、阿米替林(amitriptyline)、卡马西平(carbamazepine)、加巴喷丁(gabapentin)、普瑞巴林(pregabalin)或其组合。
在一些实施例中,骨移植物30包括至少一种抗微生物剂。抗微生物剂包括例如抗生素、抗真菌剂、抗病毒剂等。用于治疗感染的抗微生物剂包括(作为举例且不限于)杀菌剂、抗菌剂;喹诺酮类,特别是氟喹诺酮(例如诺氟沙星(norfloxacin)、环丙沙星(ciprofloxacin)、洛美沙星(lomefloxacin)、氧氟沙星(ofloxacin)等)、氨基糖苷(例如庆大霉素(gentamicin)、妥布霉素(tobramycin)等)、糖肽(例如万古霉素(vancomycin)等)、林可酰胺类(lincosamide)(例如克林霉素(clindamycin))、头孢菌素(cephalosporin)(例如,第一代、第二代、第三代)和相关的β-内酰胺、大环内酯(例如阿奇霉素(azithromycin)、红霉素(erythromycin)等)、硝基咪唑(例如甲硝唑)、青霉素(penicillin)、多粘菌素(polymyxin)、四环素(tetracycline)或其组合。
一些示例性抗微生物剂包括(作为举例说明且不限制)醋氨苯砜(acedapsone);乙酰砜钠(acetosulfonesodium);阿来霉素(alamecin);阿来西定(alexidine);阿姆地诺西林(amdinocillin);阿姆地诺西林特戊酸甲酯(amdinocillinpivoxil);阿米环素(amicycline);氨氟沙星(amifloxacin);甲磺酸氨氟沙星(amifloxacinmesylate);阿米卡星(amikacin);硫酸阿米卡星(amikacinsulfate);氨基水杨酸;氨基水杨酸钠;阿莫西林(amoxicillin);安福霉素(amphomycin);氨苄西林(ampicillin);氨苄西林钠(ampicillinsodium);阿帕西林钠(apalcillinsodium);安普霉素(apramycin);门冬托星(aspartocin);硫酸阿司米星(astromicinsulfate);阿维拉霉素(avilamycin);阿伏霉素(avoparcin);阿奇霉素(azithromycin);阿洛西林(azlocillin);阿洛西林钠(azlocillinsodium);盐酸巴卡西林(bacampicillinhydrochloride);杆菌肽(bacitracin);亚甲基二水杨酸杆菌肽(bacitracinmethylenedisalicylate);杆菌肽锌(bacitracinzinc);巴波霉素(bambermycins);苯沙酸钙(benzoylpascalcium);去氧红霉素(berythromycin);硫酸倍他霉毒(betamicinsulfate);比阿培南(biapenem);比尼拉霉素(biniramycin);盐酸苯柳胺酯(biphenaminehydrochloride);硫酸镁双巯氧吡啶(bispyrithionemagsulfex);布替卡星(butikacin);硫酸丁酰苷菌素(butirosinsulfate);硫酸卷曲霉素(capreomycinsulfate);卡巴氧(carbadox);羧苄西林二钠(carbenicillindisodium);羧苄西林二氢茚基钠(carbenicillinindanylsodium);羧苄西林苯基钠(carbenicillinphenylsodium);羧苄西林钾(carbenicillinpotassium);卡芦莫南钠(carumonamsodium);头孢克洛(cefaclor);头孢羟氨苄(cefadroxil);头孢孟多(cefamandole);头孢孟多酯钠(cefamandolenafate);头孢孟多钠(cefamandolesodium);头孢哌罗(cefaparole);头孢曲嗪(cefatrizine);头孢氮氟钠(cefazaflursodium);头孢唑啉(cefazolin);头孢唑啉钠(cefazolinsodium);头孢拉宗(cefbuperazone);头孢地尼(cefdinir);头孢吡肟(cefepime);盐酸头孢吡肟(cefepimehydrochloride);头孢替考(cefetecol);头孢克肟(cefixime);盐酸头孢甲肟(cefmenoximehydrochloride);头孢美唑(cefmetazole);头孢美唑钠(cefmetazolesodium);头孢尼西单钠(cefonicidmonosodium);头孢尼西钠(cefonicidsodium);头孢哌酮钠(cefoperazonesodium);头孢雷特(ceforanide);头孢噻肟钠(cefotaximesodium);头孢替坦(cefotetan);头孢替坦二钠(cefotetandisodium);盐酸头孢替安(cefotiamhydrochloride);头孢西丁(cefoxitin);头孢西丁钠(cefoxitinsodium);头孢咪唑(cefpimizole);头孢咪唑钠(cefpimizolesodium);头孢匹胺(cefpiramide);头孢匹胺钠(cefpiramidesodium);硫酸头孢匹罗(cefpiromesulfate);头孢泊肟普塞酯(cefpodoximeproxetil);头孢丙烯(cefprozil);头孢沙定(cefroxadine);头孢磺啶钠(cefsulodinsodium);头孢他啶(ceftazidime);头孢布烯(ceftibuten);头孢唑肟钠(ceftizoximesodium);头孢曲松钠(ceftriaxonesodium);头孢呋辛(cefuroxime);头孢呋辛酯(cefuroximeaxetil);头孢呋辛匹伏替(cefuroximepivoxetil);头孢呋辛钠(cefuroximesodium);头孢菌素钠(cephacetrilesodium);头孢氨苄(cephalexin);盐酸头孢氨苄(cephalexinhydrochloride);头孢来星(cephaloglycin);头孢噻啶(cephaloridine);头孢噻吩钠(cephalothinsodium);头孢匹林钠(cephapirinsodium);头孢拉定(cephradine);盐酸西托环素(cetocyclinehydrochloride);乙酰氯霉素(cetophenicol);氯霉素(chloramphenicol);棕榈酸氯霉素(chloramphenicolpalmitate);泛酸氯霉素复合物(chloramphenicolpantothenatecomplex);氯霉素琥珀酸钠(chloramphenicolsodiumsuccinate);氨基苯磷酸氯己定(chlorhexidinephosphanilate);氯二甲苯酚(chloroxylenol);硫酸氢金霉素(chlortetracyclinebisulfate);盐酸金霉素(chlortetracyclinehydrochloride);西诺沙星(cinoxacin);环丙沙星(ciprofloxacin);盐酸环丙沙星(ciprofloxacinhydrochloride);西罗里霉素(cirolemycin);克拉霉素(clarithromycin);盐酸克林沙星(clinafloxacinhydrochloride);克林霉素(clindamycin);盐酸克林霉素(clindamycinhydrochloride);克林霉素棕榈酸盐酸盐(clindamycinpalmitatehydrochloride);磷酸克林霉素(clindamycinphosphate);氯法齐明(clofazimine);苄星氯唑西林(cloxacillinbenzathine);氯唑西林钠(cloxacillinsodium);氯己定(chlorhexidine)、氯羟喹(cloxyquin);粘菌素甲烷磺酸钠(colistimethatesodium);硫酸粘杆菌素(colistinsulfate);香豆霉素(coumermycin);香豆霉素钠(coumermycinsodium);环己西林(cyclacillin);环丝氨酸(cycloserine);达福普汀(dalfopristin);氨苯砜(dapsone);达托霉素(daptomycin);地美环素(demeclocycline);盐酸地美环素(demeclocyclinehydrochloride);去甲四环素(demecycline);地奴真菌素(denofungin);二甲氧苄氨嘧啶(diaveridine);二氯西林(dicloxacillin);二氯西林钠(dicloxacillinsodium);硫酸二氢链霉素(dihydrostreptomycinsulfate);双吡硫翁(dipyrithione);地红霉素(dirithromycin);强力霉素(doxycycline);强力霉素钙(doxycyclinecalcium);磷酸强力霉素(doxycyclinefosfatex);盐酸强力霉素(doxycyclinehyclate);氧氟沙星钠(droxacinsodium);依诺沙星(enoxacin);依匹西林(epicillin);盐酸差向四环素(epitetracyclinehydrochloride);红霉素(erythromycin);醋硬脂红霉素(erythromycinacistrate);依托红霉素(erythromycinestolate);琥乙红霉素(erythromycinethylsuccinate);葡庚糖酸红霉素(erythromycingluceptate);乳糖酸红霉素(erythromycinlactobionate);丙酸红霉素(erythromycinpropionate);硬脂酸红霉素(erythromycinstearate);盐酸乙胺丁醇(ethambutolhydrochloride);乙硫异烟胺(ethionamide);氟罗沙星(fleroxacin);氟氯西林(floxacillin);氟氘丙氨酸(fludalanine);氟甲喹(flumequine);磷霉素(fosfomycin);磷霉素氨丁三醇(fosfomycintromethamine);呋莫西林(fumoxicillin);呋唑氯铵(furazoliumchloride);呋唑酒石酸铵(furazoliumtartrate);夫西地酸钠(fusidatesodium);夫西地酸(fusidicacid);更昔洛韦(ganciclovir)和更昔洛韦钠(ganciclovirsodium);硫酸庆大霉素(gentamicinsulfate);格洛莫南(gloximonam);短杆菌肽(gramicidin);卤普罗(haloprogin);海他西林(hetacillin);海他西林钾(hetacillinpotassium);海克西定(hexedine);依巴沙星(ibafloxacin);亚胺培南(imipenem);异康唑(isoconazole);异帕米星(isepamicin);异烟肼(isoniazid);交沙霉素(josamycin);硫酸吉他霉素(kanamycinsulfate);吉他霉素(kitasamycin);左呋喃他酮(levofuraltadone);左旋丙基西林钾(levopropylcillinpotassium);来红霉素(lexithromycin);林可霉素(lincomycin);盐酸林可霉素(lincomycinhydrochloride);洛美沙星(lomefloxacin);盐酸洛美沙星(lomefloxacinhydrochloride);甲磺酸洛美沙星(lomefloxacinmesylate);劳拉卡(loracarbef);米隆(mafenide);甲氯环素(meclocycline);磺基水杨酸甲氯环素(meclocyclinesulfosalicylate);巨蛋白磷酸钾(megalomicinpotassiumphosphate);美喹多司(mequidox);美罗培南(meropenem);甲烯土霉素(methacycline);盐酸甲烯土霉素(methacyclinehydrochloride);乌洛托品(methenamine);马尿酸乌洛托品(methenaminehippurate);扁桃酸乌洛托品(methenaminemandelate);甲氧西林钠(methicillinsodium);美替普林(metioprim);盐酸甲硝唑(metronidazolehydrochloride);磷酸甲硝唑(metronidazolephosphate);美洛西林(mezlocillin);美洛西林钠(mezlocillinsodium);米诺环素(minocycline);盐酸米诺环素(minocyclinehydrochloride);盐酸米那霉素(mirincamycinhydrochloride);莫能菌素(monensin);莫能菌素钠(monensinsodiumr);萘夫西林钠(nafcillinsodium);萘啶酸钠(nalidixatesodium);萘啶酸(nalidixicacid);萘他尼星(natainycin);尼拉霉素(nebramycin);棕榈酸新霉素(neomycinpalmitate);硫酸新霉素(neomycinsulfate);十一碳烯酸新霉素(neomycinundecylenate);硫酸奈替米星(netilmicinsulfate);中性霉素(neutramycin);硝呋唑烯(nifuiradene);硝呋氨氧腙(nifuraldezone);硝呋太尔(nifuratel);硝呋隆(nifuratrone);硝呋达齐(nifurdazil);硝呋米特(nifurimide);硝呋吡醇(nifiupirinol);硝呋奎唑(nifurquinazol);硝呋噻唑(nifurthiazole);硝环素(nitrocycline);呋喃妥因(nitrofurantoin);硝胺(nitromide);诺氟沙星(norfloxacin);新生霉素钠(novobiocinsodium);氧氟沙星(ofloxacin);onnetoprim;苯唑西林(oxacillin)和苯唑西林钠(oxacillinsodium);肟莫南(oximonam);肟莫南钠(oximonamsodium);欧索林酸(oxolinicacid);土霉素(oxytetracycline);土霉素钙(oxytetracyclinecalcium);盐酸土霉素(oxytetracyclinehydrochloride);帕地霉素(paldimycin);对氯酚(parachlorophenol);保洛霉素(paulomycin);培氟沙星(pefloxacin);甲磺酸培氟沙星(pefloxacinmesylate);培那西林(penamecillin);青霉素(penicillin)如苄星青霉素g(penicillingbenzathine)、青霉素g钾(penicillingpotassium)、普鲁卡因青霉素g(penicillingprocaine)、青霉素g钠(penicillingsodium)、青霉素v(penicillinv)、苄星青霉素v(penicillinvbenzathine)、海巴明青霉素v(penicillinvhydrabamine和青霉素v钾(penicillinvpotassium);戊齐酮钠(pentizidonesodium);苯基氨基水杨酸酯(phenylaminosalicylate);哌拉西林钠(piperacillinsodium);吡苄西林钠(pirbenicillinsodium);吡地西林钠(piridicillinsodium);盐酸吡利霉素(pirlimycinhydrochloride);盐酸匹氨西林(pivampicillinhydrochloride);恩波酸匹氨西林(pivampicillinpamoate);磺胺匹西林(pivampicillinprobenate);硫酸多粘菌素b(polymyxinbsulfate);泊非霉素(porfiromycin);普匹卡星(propikacin);吡嗪酰胺(pyrazinamide);吡硫翁锌(pyrithionezinc);乙酸喹地卡明(quindecamineacetate);奎奴普丁(quinupristin);消旋甲砜霉素(racephenicol);雷莫拉宁(ramoplanin);雷尼霉素(ranimycin);雷洛霉素(relomycin);瑞普米星(repromicin);利福布丁(rifabutin);利福美坦(rifametane);利福克昔(rifamexil);利福米特(rifamide);利福平(rifampin);利福喷丁(rifapentine);利福昔明(rifaximin);罗利环素(rolitetracycline);硝酸罗利环素(rolitetracyclinenitrate);蔷薇霉素(rosaramicin);丁酸蔷薇霉素(rosaramicinbutyrate);丙酸蔷薇霉素(rosaramicinpropionate);蔷薇霉素磷酸钠(rosaramicinsodiumphosphate);硬脂酸蔷薇霉素(rosaramicinstearate);罗索沙星(rosoxacin);洛克沙胂(roxarsone);罗红霉素(roxithromycin);山环素(sancycline);山费培南钠(sanfetrinemsodium);沙莫西林(sarmoxicillin);沙匹西林(sarpicillin);司可芬净(scopafungin);西索米星(sisomicin);硫酸西索米星(sisomicinsulfate);司帕沙星(sparfloxacin);盐酸状观霉素(spectinomycinhydrochloride);螺旋霉素(spiramycin);盐酸司他霉素(stallimycinhydrochloride);司替霉素(steffimycin);硫酸链霉素(streptomycinsulfate);链霉素异烟胼(streptonicozid);磺胺苯(sulfabenz);磺胺苯酰(sulfabenzamide);磺乙酰胺(sulfacetamide);磺乙酰胺钠(sulfacetamidesodium);磺胺西汀(sulfacytine);磺胺嘧啶(sulfadiazine);磺胺嘧啶钠(sulfadiazinesodium);磺胺多辛(sulfadoxine);磺胺林(sulfalene);磺胺甲基嘧啶(sulfamerazine);磺胺对甲氧嘧啶(sulfameter);磺胺二甲嘧啶(sulfamethazine);磺胺甲二唑(sulfamethizole);磺胺甲恶唑(sulfamethoxazole);磺胺间甲氧嘧啶(sulfamonomethoxine);磺胺恶唑(sulfamoxole);磺胺酸锌(sulfanilatezinc);磺胺硝苯(sulfanitran);柳氮磺胺吡啶(sulfasalazine);磺胺异噻唑(sulfasomizole);磺胺噻唑(sulfathiazole);磺胺甲苯吡唑(sulfazamet);磺胺异恶唑(sulfisoxazole);乙酰基磺胺异恶唑(sulfisoxazoleacetyl);磺胺异恶唑二乙醇胺(sulfisboxazolediolamine);磺粘菌素(sulfomyxin);硫培南(sulopenem);舒他西林(sultamricillin);森西林钠(suncillinsodium);盐酸酞氨西林(talampicillinhydrochloride);替考拉宁(teicoplanin);盐酸替马沙星(temafloxacinhydrochloride);替莫西林(temocillin);四环素(tetracycline);盐酸四环素(tetracyclinehydrochloride);磷酸四环素络合物(tetracyclinephosphatecomplex);四氧普林(tetroxoprim);甲砜霉素(thiamphenicol);替芬西林钾(thiphencillinpotassium);替卡西林甲酚钠(ticarcillincresylsodium);替卡西林二钠(ticarcillindisodium);替卡西林单钠(ticarcillinmonosodium);替克拉酮(ticlatone);噻碘氯铵(tiodoniumchloride);妥布霉素(tobramycin);硫酸妥布霉素(tobramycinsulfate);妥舒沙星(tosufloxacin);三甲氧苄胺嘧啶(trimethoprim);硫酸三甲氧苄胺嘧啶(trimethoprimsulfate);三重磺胺嘧啶(trisulfapyrimidines);醋竹桃霉素(troleandomycin);硫酸托霉素(trospectomycinsulfate);短杆菌素(tyrothricin);万古霉素(vancomycin);盐酸万古霉素(vancomycinhydrochloride);维吉霉素(virginiamycin);佐尔博霉素(zorbamycin);或其组合。
抗病毒剂可包括但不限于阿糖腺苷(vidarabine)、阿昔洛韦(acyclovir)、泛昔洛韦(famciclovir)、伐昔洛韦(valacyclovir)、更昔洛韦(gancyclovir)、缬更昔洛韦(valganciclovir)、核苷类似物逆转录酶抑制剂(如azt(齐多夫定(zidovudine))、ddi(去羟肌苷(didanosine))、ddc(扎西他滨(zalcitabine))、d4t(司他夫定(stavudine))和3tc(拉米夫定(lamivudine)))、奈韦拉平(nevirapine)、地拉夫定(delavirdine)、蛋白酶抑制剂(如沙奎那韦(saquinavir)、利托那韦(ritonavir)、茚地那韦(indinavir)和奈非那韦(nelfinavir))、利巴韦林(ribavirin)、金刚烷胺(amantadine)、金刚乙胺(rimantadine)、神经氨酸酶抑制剂(如扎那米韦(zanamivir)和奥司他韦(oseltamivir))、普可那利(pleconaril)、西多福韦(cidofovir)、膦甲酸(foscarnet)和/或干扰素。
回填物32被配置成流过通道p以将选定体积v的骨移植物30排出到选定部位中。在一些实施例中,回填物32的粘度有助于将骨移植物30从通道28,通过通道68驱动到选定部位中。在一些实施例中,回填物32的粘度低于骨移植物30的粘度以有助于骨移植物30移动通过通道p。在一些实施例中,骨移植物30的粘度等于回填物32的粘度。在一些实施例中,排空器可包括固体、液体或气体物质,和/或包括机械元件,如垫圈、圆盘、塞子或柱塞。
在一些实施例中,回填物32可包括例如无菌水、甘油、盐水、油或任何多糖;和/或可流动且生物相容的材料,例如血液,或血液成分,包括血浆、富含血小板的血浆、血沉棕黄层。在一些实施例中,回填物32可包括例如水泥,以使手术注射装置12成为单次使用装置和/或一次性的。在一些实施例中,回填物32可包括例如当注射时类似于液体流动的固体材料块。
柱塞42致动回填物32和骨移植物30在通道p内的移动。柱塞42在端部44和端部46之间延伸端部44包括被配置成用于操纵以使柱塞42相对于筒14的壁在通道28内平移的手柄48。端部46包括柱塞密封件50,所述柱塞密封件50可滑动地接合筒14的壁,使得柱塞42可移动地用开口22安置。柱塞密封件50被配置成抵抗和/或防止回填物32和/或骨移植物30离开开口22。
柱塞密封件50被配置成在通道28内平移和接触回填物32。柱塞42相对于筒14在初始定向(如图5中所示)和完全或全部排出的定向(如图7中所示)之间平移。在初始定向中,柱塞42邻近回填物32安置。柱塞42在图5中箭头a所示的方向上平移,使得柱塞密封件50向回填物32施加力。由柱塞密封件50施加的力使回填物32压缩骨移植物30。骨移植物30的压缩使骨移植物30从通道28流过开口24。柱塞42的进一步平移使回填物32迫使骨移植物30进入通道68,如图6中所示。柱塞42向全部排出的定向的平移使回填物32流入通道68,迫使骨移植物30通过通道68,以将选定体积v的骨移植物30全部排出到选定部位中,例如,如图7中所示。
在一些实施例中,骨移植物30与回填物32以串联构型安置在通道p内,使得选定体积v的骨移植物30可通过回填物32全部排出。在一些实施例中,全部排出整个选择体积v的骨移植物30包括保留在限定通道p的表面上的骨移植物30的颗粒和/或残余物。在一些实施例中,骨移植物30和回填物32分层安置,例如,在通道28内交替层的骨移植物30和回填物32。在一些实施例中,骨移植物30和回填物32的交替层被配置成有助于用骨移植物30和回填物32选择性填充选定部位s。在一些实施例中,外科医生在至少一个骨紧固件的基部处添加2cc的骨移植物30,并添加1cc的回填物32以便于确认骨移植物30的完全注射。在一些实施例中,筒14包括多层2cc的骨移植物30,其中散布有1cc层的回填物32。
在一些实施例中,选定部位包括,例如,椎体间植入物80。在一些实施例中,椎体间植入物80包括表面82。表面82限定空隙84。空隙84被配置成接收选定体积v的骨移植物30。在一些实施例中,椎体间植入物80的横截面几何形状可具有各种构型,例如圆柱形、圆形、椭圆形、长椭圆形、三角形、具有平面或弓形侧部的多边形、不规则的、均匀的、不均匀的、一致的、可变的、马蹄形、u形或芸豆形状。
在组装、操作和使用中,类似于本文所述的系统和方法的手术系统10,包括手术注射装置12并且用于治疗患者身体的受影响部分,例如,用脊柱植入物例如椎体间植入物80治疗椎骨。手术系统10可与包括开放手术、微型开放手术、微创手术和经皮手术植入的手术方法或技术一起使用,其中椎骨通过小切口或套管进入,所述小切口或套管提供到手术部位的受保护通道。一旦获得进入手术部位的通路,就可进行类似于本文所述的手术治疗,例如脊柱稳定程序,以治疗脊柱病症。在一些实施例中,可移除椎骨的患病和/或受损部分,并且为椎体间植入物80准备椎间空间。
包括手术注射装置12的手术系统10的组件用于增强手术治疗在一些实施例中,手术注射装置12可在选定手术部位s处用椎骨处置椎体间植入物80之前、期间和/或之后,将选定体积v的骨移植物30引入或输送到椎体间植入物80中。在一些实施例中,手术注射装置12可在体内将选定体积v的骨移植物30注射到椎体间植入物80中。在一些实施例中,手术注射装置12可处将选定体积v的骨移植物30直接注射在选定手术部位s的椎骨附近或注射到椎骨中。
手术注射装置12提供有选定体积v,例如3cc的骨移植物30,如图5中所示。手术注射装置12提供有一定体积的回填物32,例如3cc的回填物32。管子16的端部62邻近椎体间植入物80的空隙84安置。在一些实施例中,空隙84被配置成接收3cc的骨移植物30。
从初始定向,一个力被施加到柱塞42和/或柱塞42被操纵,使得柱塞42在图5中箭头a所示的方向上平移。如本文所述,柱塞密封件50向回填物32施加力以压缩骨移植物30邻近开口24。柱塞42的继续操纵使骨移植物30从通道28流过开口24,使得回填物32迫使骨移植物30进入通道68,如图6中所示。在柱塞42被进一步操纵时,回填物32流入通道68,迫使骨移植物30通过通道68,以将选定体积v的骨移植物30从通道p全部排出到选定部位s处的空隙84中,如图7中所示。
在一些实施例中,手术系统10包含包括可与单个椎骨水平或多个椎骨水平一起使用的多个椎体间装置、连接器、板、骨紧固件和/或固定元件的套件。在完成程序后,移除手术系统10的手术器械、组合件和非植入组件,并闭合切口。手术系统10的组件可由射线可透过的材料制成,如聚合物。可包括放射性标记物用于在x射线、荧光透视法、ct或其它成像技术下进行识别。在一些实施例中,借助于手术系统10,可使用手术导航、显微手术和图像引导技术来进入、查看和修复脊柱恶化或损伤。
在一些实施例中,手术系统10的组件含有放射性标记物和/或不透射线性增强剂。在一些实施例中,放射性标记物和/或不透射线性增强剂使外科医生能够将骨移植物30递送到部位可视化(例如,通过c臂放射线照相术)并评估预期递送部位处的填充质量。在一些实施例中,放射性标记物包括但不限于钡、磷酸钙、铋、碘、钽、钨和/或金属珠或颗粒。
在一个实施例中,如图8-11中所示,手术系统10,类似于上面关于图1-7所描述的系统和方法,包括手术注射装置112,类似于本文所述的手术注射装置12。手术注射装置112包括注射器筒114、注射器筒214和管子116。筒114在端部118和端部120之间延伸。端部118限定开口122,所述开口122被配置成用于处置致动器,例如柱塞142,类似于本文所述的柱塞42。端部120限定被配置成用于与管子116连接的开口124和尖端,类似于本文所述的那些。筒114限定纵向轴线x2,如图8中所示。
筒114包括表面126。表面126限定通道128。通道128限定流体通道p1的一部分,类似于本文所述的那些。通道128沿轴线x2在端部118、120之间延伸。通道128被配置成用于处置选定体积v1的骨移植材料130,类似于本文所述的那样。
柱塞142可移动地用开口122安置。柱塞142被配置成致动骨移植物130在通道128内的移动。柱塞142包括柱塞密封件150,所述柱塞密封件150可滑动地接合筒114的壁,使得柱塞142可移动地用开口122安置。柱塞密封件150被配置成抵抗和/或防止骨移植物130离开开口122。
柱塞密封件150被配置成在通道128内平移和接触骨移植物130。柱塞142被配置成相对于筒114在初始定向(如图9中所示)和分配定向(如图10中所示)之间平移。在初始定向中,柱塞142邻近骨移植物130安置。柱塞142被配置成用于在图10中箭头b所示的方向上平移,使得柱塞密封件150向骨移植物130施加力。由柱塞密封件150施加的力使骨移植物130从通道128流过开口124进入管子116,类似于本文所述的那样。
筒214在端部218和端部220之间延伸。端部218限定开口222,所述开口222被配置成用于处置柱塞242,类似于本文所述的柱塞42。端部220限定被配置成用于与管子116连接的开口224和尖端,类似于本文所述的那些。筒214限定纵向轴线x3,如图。8中所示。在一些实施例中,轴线x3平行于轴线x2安置。在一些实施例中,轴线x3可相对于轴线x2以交替定向安置,例如横向和/或其它角度定向,如锐角或钝角。
筒214包括表面226。表面226限定通道228。通道228限定流体通道p1的一部分。通道228沿轴线x3在端部218、220之间延伸。通道228被配置成用于处置回填材料232,类似于本文所述的那那样。
柱塞242可移动地用开口222安置。柱塞242被配置成致动骨填充物232在通道228内的移动。柱塞242包括柱塞密封件250,所述柱塞密封件250可滑动地接合筒214的壁,使得柱塞242可移动地用开口222安置。柱塞密封件250被配置成抵抗和/或防止回填物232离开开口222。
柱塞密封件250被配置成在通道228内平移和接触回填物232。柱塞242被配置成相对于筒214在初始定向(如图9中所示)和完全或全部排出的定向(如图11中所示)之间平移。在初始定向中,柱塞242邻近回填物232安置。柱塞242被配置成用于在图11中箭头c所示的方向上平移,使得柱塞密封件250向回填物232施加力。由柱塞密封件250施加的力使回填物232从通道228流过开口224。柱塞242的进一步平移使回填物232流入管子116,类似于本文所述的那样。
管子116在端部160和端部162之间延伸。管子116被配置成用于与开口124、224连接,如本文所述。在一些实施例中,端部160包括具有部分166和部分168的分叉延伸部164。部分166包括表面170。在一些实施例中,表面170与筒114的尖端连接,类似于本文所述的那样。部分166包括限定通道176的表面174。部分166与筒114连接,以定向与通道128连通的通道176。
部分168包括表面172。在一些实施例中,表面172与筒214的尖端连接,类似于本文所述的那样。部分168包括限定通道180的表面178。部分168与筒214连接,以定向与通道228连通的通道180。通道176、180合并到通道192中。在一些实施例中,通道176、180在接合点处合并,例如,混合腔室182,其可用于选择性地组合一种或多种药剂和回填物,如本文所述。
管子116包括表面190。表面190限定通道192。通道192与通道176、180连通以形成通道p1的一部分。通道192被配置成用于选定体积v的骨移植物130和回填物232的通过。端部162被配置成用于与选定部位s1接合,以将选定体积v1的骨移植物130的流动引导到选定部位s1中,类似于本文所述的那样。
回填物232被配置成迫使骨移植物130通过腔室182,如图11中所示。柱塞242向完全或全部排出的定向的平移使回填物232流入腔室182,迫使骨移植物130通过通道192以将选定体积v1的骨移植物130全部排出到选定部位s1中,如图11中所示并且类似于本文所述的那样。
在一些实施例中,筒114以与筒214并排构型安置。在此构型中,在将回填物232注射到管子116中之前,将选定体积v的骨移植物130注射到管子116中。在一些实施例中,骨移植物130和回填物232分阶段注射到管子116中以在选定的部位s1内形成层,例如交替层的骨移植物130和回填物232。在一些实施例中,筒114包括邻近端部120安置的单向阀,所述单向阀被配置成抵抗和/或防止骨移植物130回流到通道128中。在一些实施例中,筒214包括邻近端部220安置的单向阀,所述单向阀被配置成抵抗和/或防止回填物232回流到通道228中。
在一些实施例中,筒114和筒214的大小相同。在一些实施例中,根据骨移植物130的所需应用数量、管腔的体积和选定部位s1,筒114和筒214的大小不同。
在一个实施例中,如图。12-19中所示,类似于本文所述的系统和方法的手术系统10包括手术注射装置312,类似于本文所述的手术注射装置。手术注射装置312包括管状元件,例如管314和注射器筒414,如本文所述。管314在端部318和端部320之间延伸。端部318包括鲁尔锁定连接件352,如图15中所示。在一些实施例中,鲁尔锁352被配置成便于将筒414与管314附接,如本文所述。在一些实施例中,端部318包括凸缘362。凸缘362被配置成用于与筒414接合,以抵抗和/或防止筒与管314分离,如图18中所示。端部320限定被配置成用于与选定部位s2连接的开口324。管314限定纵向轴线x4,如图18中所示。
在一些实施例中,端部318被配置成用于与尖端325连接,如图15中所示。在一些实施例中,尖端325被配置成便于与灌注器械连接。在一些实施例中,尖端325被配置成便于与灌注器械连接。在一些实施例中,管314预包装有选定体积v2的骨移植物330,类似于本文所述的那样。在一些实施例中,管314包括可与端部318接合的帽326,以防止骨移植物330离开开口322,如图13中所示。在一些实施例中,管314包括可与端部320接合的帽328,以防止骨移植物离开开口324。
管314包括表面342。表面342限定通道344。通道344限定流体通道p2的一部分,类似于本文所述的那些。通道344沿轴线x4在端部318、320之间延伸。通道344被配置成用于处置选定体积v2的骨移植材料330,类似于本文所述的那样。选定体积v2的骨移植物330被配置成流过通道p2进入选定部位s2。
筒414包括表面426。表面426限定通道428。通道428限定流体通道p2的一部分,如本文所述。通道428沿轴线x4延伸。通道428被配置成用于处置回填物432,所述回填物432被配置成用于由柱塞442致动,如本文所述。
柱塞442包括柱塞密封件450。柱塞密封件450被配置成向回填物432施加力,使骨移植物330从管子314排出,如本文所述。柱塞442被配置成用于在通道428内相对于筒414的壁平移。在一些实施例中,柱塞442被配置成相对于筒414在图19中箭头e所示的方向上平移,以接合回填物432以将选定体积v2的骨移植物330从通道p2全部排出到选定部位s2中,类似于本文所述的那样。
在一些实施例中,管314包括被配置成提供材料的注射量的视觉指示的视觉标记,例如在外表面上的渐变。在一些实施例中,一部分或整个管314是透明的,以提供保留在管314中的材料量的视觉指示。
在一些实施例中,手术器械,例如,包括用于处置手术注射装置312的插管的插入器370用于便于与选定部位s2连接,如图18中所示。插入器370被配置成便于将手术系统10的组件引入和/或递送到手术部位,如本文所述,和/或接合选定部位s2。在一些实施例中,插入器370可包括一个或多个针、套管针、护套和/或微创器械。在一些实施例中,插入器370可包括切割表面,所述切割表面可伸展和缩回以切割和/或切断组织和/或手术系统10的组件。在一些实施例中,插入器370可通过成像引导来引导,如本文所述。在一些实施例中,插入器370包括被配置成有助于手术注射装置312的操纵和定位的手柄372。
在一个实施例中,如图20-23中所示,类似于本文所述的系统和方法的手术系统10包括手术注射装置512,类似于本文所述的手术注射装置。手术注射装置512包括管状元件,例如管514和柱塞552,类似于本文所述的那些。管514在端部518和端部520之间延伸。
管514包括表面542。表面542限定通道544。通道544限定流体通道p3的一部分,类似于本文所述的那些。通道544沿轴线x5在端部518、520之间延伸。通道544被配置成用于处置选定体积v3的骨移植材料530,类似于本文所述的那样。选定体积v3的骨移植物530被配置成流过通道p3进入选定部位s3。在一些实施例中,管514预包装有选定体积v3的骨移植物530,类似于本文所述的那样。在一些实施例中,管514包括可与端部520接合的帽526,以防止骨移植物530离开管514,如图20中所示。
在一些实施例中,管514包括排空器,例如,邻近端部518安置的塞子532。在一些实施例中,塞子532包括生物相容的材料,类似于本文所述的那些,并且被配置成用于用选定部位s3安置。在一些实施例中,塞子532被配置成有助于从管514排出全部选定体积v3的骨移植物530,类似于本文所述的那样。
柱塞552可与管514接合,并相对于管514的壁可平移,以从通道p3全部排出骨移植物530,如本文所述。柱塞552在端部554和端部556之间延伸。端部554包括被配置成用于操纵以使柱塞552在通道544内平移的手柄557。柱塞552包括柱塞密封件558,所述柱塞密封件558被配置成向塞子532和/或骨移植物530施加力,类似于本文所述的那样。在一些实施例中,柱塞552被配置成相对于管514平移,如图22和23中所示,使得柱塞密封件558接合塞子523,这将选定体积v3的骨移植物530从通道p3全部排出到选定部位s3(例如,椎体间植入物的空隙)中,类似于本文所述的那样。
在一些实施例中,管514包括被配置成提供材料的注射量的视觉指示的视觉标记,例如在外表面上的渐变。在一些实施例中,一部分或整个管514是透明的,以提供保留在管514中的材料量的视觉指示。
在一些实施例中,包括用于处置手术注射装置512插管的插入器370用于便于与选定部位s3连接,如图21-23中所示。在一些实施例中,插入器570包括被配置成有助于手术注射装置512的操纵和定位的手柄572。
应理解,可对本文公开的实施例进行各种修改。因此,以上描述不应被解释为限制性的,而仅仅是作为各种实施例的例证说明。本领域技术人员将设想在所附权利要求的范围和精神内的其它修改。
- 还没有人留言评论。精彩留言会获得点赞!