生理条件下具有较差溶解度的维多瑞肽用于治疗肢端肥大症、肢端肥大症癌症、SST-R5表达型肿瘤、II型糖尿病、高血糖症和激素相关肿瘤的制作方法
本公开涉及药物组合物以及用于使用这类药物组合物的方法,所述药物组合物包括肽或其药学上可接受的盐,其中该肽可以溶解于水,但是在生理条件下具有低溶解度。
背景技术:
阻碍线性肽用作药物的主要问题与这样的事实有关,即这类肽以多种构象之间的快速平衡存在,而这些构象中仅有极少数的构象具有生物活性。这样的机动性导致选择性差、蛋白水解消化迅速和生物利用度低。克服该问题最好的方式之一是通过环化,其将构象约束引入肽。
在天然产生的环状肽中,环化将肽中的特定侧链和/或末端基团连接在一起。由于少量的氨基酸侧链和肽末端使其自身环化,被称为经典环化模式的这些环化模式是高度受限的。因此,给定序列可能受约束的“经典”环状类似物的多样性很低。
主链环化克服了这些限制(afargan等,具有内分泌选择性的新型长效作用生长激素抑制素类似物:对生长激素而非胰岛素的潜在抑制(novellong-actingsomatostainanalogwithendocrineselectivity:potentsuppressionofgrowthhormonebutnotofinsulin),endocrinology,142:1(2001)477-486)。利用该技术,通过肽主链中的一个或多个α-氮彼此之间或与胺基或羧基末端或与侧链的共价互连实现环化。
生长激素抑制素是存在于中枢神经系统和外周组织两者中的环状十四肽。其最初分离自哺乳动物下丘脑,并且被鉴定为来自垂体前叶的生长激素分泌的重要抑制剂。其所具有的多种生物活性包括抑制胰腺分泌胰高血糖素和胰岛素,调节大多数肠道激素和调节涉及整个中枢神经系统的运动活动和认知过程的其他神经递质的释放(参见lamberts,endocrinerev.,9:427,1988)。此外,生长激素抑制素和其类似物可以潜在地用作抗增殖试剂,用于各种类型肿瘤的治疗。
生长激素抑制素以其天然形式作为治疗剂的应用有限,因为其具有两种不期望的性质:生物利用度低和作用持续时间短。以此原因,在过去的二十年间,人们已经努力在寻找这样的生长激素抑制素类似物,其在对于抑制生长激素、胰岛素或胰高血糖素释放方面在选择性、效力、生物稳定性或作用持续时间中任一项上具有优势。
一组生长激素抑制素类似物(美国专利号4,310,518和4,235,886)包括奥曲肽(octreotide),其是第一种批准的临床可及的生长激素抑制素类似物。
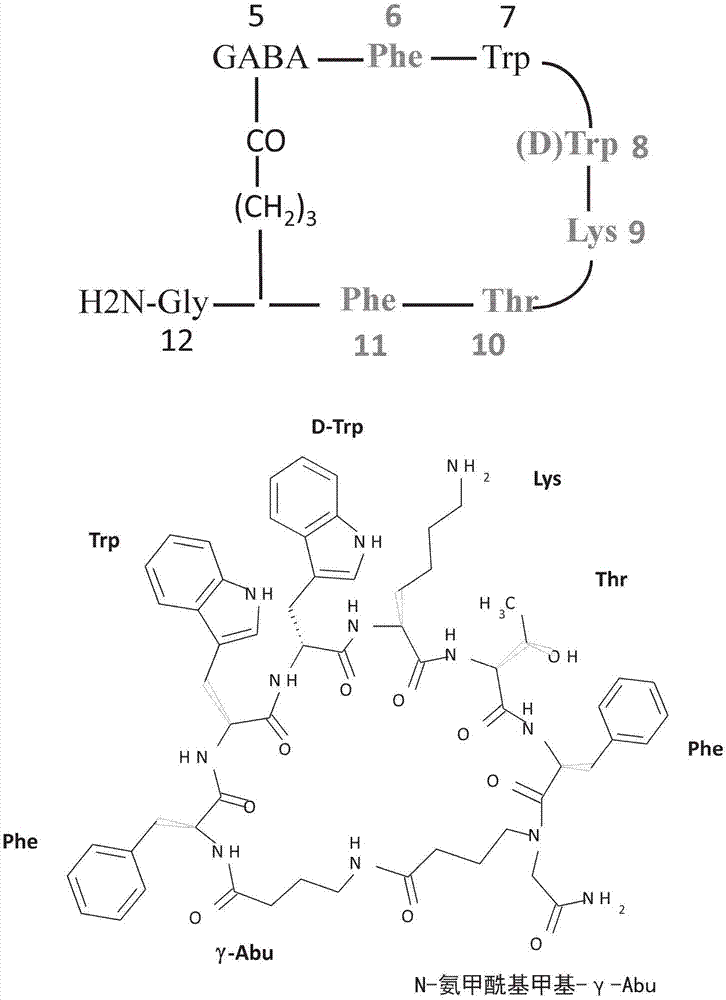
另一种生长激素抑制素是维多瑞肽(veldoreotide)(之前称之为ptr3173或dg3173),其是一种构象受限的主链环状合成肽,其描述于图1并且如下:
-γ-abu-phe-trp-d-trp-lys-thr-phe-n-氨甲酰基甲基
其中abu是氨基丁酰。
维多瑞肽乙酸盐更常被描述为环(-γ-氨基丁酰-l-苯丙氨酰-l-色氨酰-d-色胺酰-l-赖氨酰-l-苏氨酰-l-苯丙氨酰-n-氨甲酰基甲基-γ-氨基丁酰)乙酸盐或环(-γ-abu-phe-trp-d-trp-lys-thr-phe-n-氨甲酰基甲基-γ-abu)乙酸盐。
奥曲肽和维多瑞肽在用于注射的等离子水中具有相似的溶解度,但是在生理条件下具有非常不同的溶解度。一旦对维多瑞肽进行人体试验,人们发现尽管维多瑞肽乙酸盐具有与奥曲肽相同的gh抑制受体亲和性,但是当将两者以乳酸缓冲液注射时,为达相同的药理作用需要增加剂量。在研究导致该问题的原因后,人们发现维多瑞肽乙酸盐在生理条件下可溶性差,导致“翻转(flip-flop)”药代动力学。以维多瑞肽乙酸盐进行的之前的研究已经发现注射维多瑞肽乙酸盐的溶液因其在等渗溶液中相对低的溶解度导致不良注射位点反应和受限的生物利用度。因此,需要提高维多瑞肽乙酸盐在生理(等渗)溶液中溶解度的方法。
技术实现要素:
本公开旨在提供增强可注射肽或其药学上可接受盐的溶解度和分散的制剂,改善生物利用度和分布,并且减少注射位点的不良反应。
无论本公开中讨论的理论和机制如何,本发明的精神包括改善的生理化学和药代动力学性质以及本文所述组合物的用途,不管实际的机制如何。
在一实施方式(实施方式1)中,药物组合物包括:肽或其药学上可接受的盐,其中肽或其药学上可接受的盐易溶解于去离子水,其在去离子水中的溶解度为100至350mg/ml,但是在生理条件下或在具有氯离子的其它溶液中以2-3mg/ml的溶解度微溶,并且所述肽或药学上可接受的盐经盐析沉淀的浓度大于3mg/ml;药学上可接受的运载体或稀释剂;和赋形剂,其中赋形剂是环状多糖或右旋糖或其组合。
在某些实施方式中,利用了维多瑞肽独特的表面活性性质。例如,维多瑞肽使水的表面张力降低多于30%,并且其独特的两亲性质与其作为表面活性剂的使用一致。这样的表面张力降低通过添加右旋糖或环状多糖而部分减轻。
因此,提供了包含维多瑞肽和运载体或稀释剂形式的右旋糖或环状多糖的组合物,其中组合物的表面张力是单独运载体的约60%至约80%。在其他实施方式中,5℃温度下测量的组合物的表面张力为约40达因/cm至约60达因/cm。
本发明还提供了一种制备聚合物微球的方法,其包括以下步骤:
(i)将含有环状多糖或右旋糖或其组合的赋形剂以及肽或其药学上可接受的盐在水中混合以形成第一水性混合物,其中肽或其药学上可接受的盐易溶解于去离子水,其在去离子水中的溶解度为100至350mg/ml,但是在生理条件下或在具有氯离子的其它溶液中以2-3mg/ml的溶解度微溶,并且所述肽或药学上可接受的盐经盐析沉淀的浓度大于3mg/ml;
(ii)将聚合物混合在有机溶剂如二氯甲烷中以形成聚合物溶液;
(iii)将第一水性混合物混合在聚合物有机溶液中以形成包括油包水初级乳液的第一分散体混合物;
(iv)将聚乙烯醇(pva)以0.1至3重量%的量混合在磷酸盐缓冲盐水或盐水中以形成第二水性混合物;
(v)将初级乳液混合在pva的第二水性混合物中以形成水包油包水双重乳液以提供二级分散体混合物;
(vi)允许二级分散体混合物中的有机溶剂蒸发以形成固体聚合物微球,其中肽或其药学上可接受的盐被包封在聚合物微球中;
(vii)洗涤并分离聚合物微球;并且
(viii)在干燥过程期间,在具有或不具有表面活性剂和甘露糖醇混合物的控制条件下干燥微球。
本发明还提供了通过上述方法产生的缓释药物组合物。在这样的实施方式中,提供了包括维多瑞肽的多个聚合物微球,其中聚合物微球据例如布伦纳-埃米特-特勒(bet)方法测量具有约7m2/g至约12m2/g的表面积。在某些实施方式中,多个聚合物微球的平均直径为约10μm至约100μm,并且更优选在约10μm至约30μm的范围内。在某些实施方式中,聚合物微球可以包括少量右旋糖,如占聚合物微球总重量的约0.1重量%至约1重量%。在其他实施方式中,聚合物微球可以包括环状多糖,其占聚合物微球总重量的约1重量%至约10重量%,并且更优选约2.5重量%至约5重量%。在某些实施方式中,维多瑞肽占聚合物微球总重量的约10重量%至约30重量%,并且更优选约15重量%至约20重量%。
本发明还提供了一种用于制备聚合物微球的组合物,其包括:维多瑞肽或其药学上可接受的盐;包括环状多糖或右旋糖或其组合的赋形剂;和聚合物。
本发明还提供了一种用于治疗患有下述疾病或病症对象的方法:肢端肥大症、肢端肥大症癌症、sst-r5表达型肿瘤、ii型糖尿病、高血糖症、良性肿瘤、库欣综合症(cushing’ssyndrome)和激素相关的肿瘤,所述方法包括:向患有所述疾病或病症的对象给予权利要求1-37中任一项所述的药物组合物。
附图简述
结合附图,通过以下详细描述,本发明的以上方面以及许多伴随的优点将更容易理解。
图1描述了维多瑞肽的化学结构。
图2描述了维多瑞肽乙酸盐和奥曲肽乙酸盐两者的三维结构。
图3显示了中80:20棉籽油:注射用水(wfi)中维多瑞肽乙酸盐、奥曲肽乙酸盐和戈舍瑞林(goserelin)油包水(w/o)乳液制剂的图片。
图4显示了用具有或不具有赋形剂的各种维多瑞肽乙酸盐制剂注射的大鼠中维多瑞肽乙酸盐的血浆浓度的图表。
图5显示了说明大鼠中以0.3mg/kg,dex:pep比为5:1的右旋糖/盐水ir制剂对cor005pk概况的作用的图表。
图6显示了说明大鼠中hpb/盐水(hpb:pep15:1)的右旋糖/盐水ir制剂对cor005pk概况作用的图表。
图7是比较迷你猪中0.4mg/kg的hpb和dexsc制剂的图表。
图8是比较迷你猪中0.4mg/kg的hpb制剂与乳酸的图表。
图9是显示迷你猪中dex对cor005乙酸盐ir制剂,sc,0.4mg/kg的pk概况作用的图表。
图10是显示迷你猪中dex对cor005乙酸盐ir制剂,sc,0.1mg/kg的pk概况作用的图表。
图11显示了sc处理组b9-13的cor005血浆浓度曲线。
图12显示了sc处理组b9-13单个sc剂量的“突释(burst)”药代动力学的图表。
图13显示了hpb对cor005plgams突释的作用。
图14显示了dex对cor005plgams突释的作用。
图15显示了dex:pep1:8在具有psi13(b12:dxe:pep1:8)微球pk概况的迷你猪中的作用。
图16显示了hpb:pep1:2在具有突释微球制剂b13的pk概况的迷你猪中的作用。
图17显示了hpb:pep1:4在具有来自组合物b14的微球的突释的pk概况的迷你猪中的作用。
图18显示了来自微球制剂b9-13的cor005的比较性ivr概况。
图19显示了基础微球制剂b10外部形态学的sem显微图。
图20显示了基础微球制剂b10内部形态学的显微图。
图21显示了制剂b12外部形态学的sem图像。
图22显示了制剂b12内部形态学的sem图像。
图23显示了制剂b13外部形态学的sem图像。
图24显示了制剂b13内部形态学的sem图像。
图25显示了具有hpb但不具有肽的安慰剂ms的外部和内部形态学。
图26显示了具有dex但不具有肽的安慰剂ms的外部和内部形态学。
图27显示了各种hpb:pep比的ms制剂内部基质的形态学sem图像。
图28显示了用维多瑞肽乙酸盐配制的脂质体的sem显微图。
图29显示了用维多瑞肽乙酸盐脂质体注射的大鼠与用乳酸载剂中的维多瑞肽乙酸盐注射的大鼠中维多瑞肽随时间(小时,横轴)的血浆浓度(ng/ml,纵轴)。
发明详述
本文引用的所有专利和发表物,包括其中的引用通过引用全文纳入本文用于所有目的。
本文所用“聚合物”指任何类型的聚合物,包括例如均聚物、共聚物、嵌段共聚物、随机共聚物等。除非另有说明,本文所述物质包括所有可能的单独异构体,例如,各对映体及非对映体,和异构体的混合物,如外消旋或非外消旋(scalemic)混合物。对映体物质可能以不同的异构体或对映体形式存在。除非另外指出,本文所讨论的不涉及其异构体形式的对映体物质应当包括所有各种异构体形式以及异构体形式的外消旋混合物。例如,提及乳酸本文应当包括l-乳酸,d-乳酸,和乳酸l-和d-异构体的外消旋混合物;提及交酯本文应当包括l-交酯,d-交酯,和dl-交酯(其中dl-交酯指交酯l-和d-异构体的外消旋混合物);相似地,提及聚(交酯)本文应当包括聚(l-交酯),聚(d-交酯)和聚(dl-交酯);相似地,提及聚(交酯-共-乙交酯)将包括聚(l-交酯-共-乙交酯),聚(d-交酯-共-乙交酯),和聚(dl-交酯-共-乙交酯)。
如本文所用,术语“生理条件”指正常存在于哺乳动物(例如,小鼠、大鼠或人)身体中的条件,如含浓度与哺乳动物体液中存在的浓度等同的溶质(例如,包括氯离子的盐)的溶液。本文所用术语“等渗”指流体溶液具有与一些其它溶液(特别是在细胞或体液中的溶液)相同的渗透压。在一些示例中,等渗溶液具有与血液相同的溶质浓度,如等渗盐水溶液。
本文所用术语“维多瑞肽(veldoreotide)”是一种环状聚合物,其也被称为环(-γ-氨基丁酰-l-苯丙氨酰-l-色氨酰-d-色胺酰-l-赖氨酰-l-苏氨酰-l-苯丙氨酰-n-氨甲酰基甲基-γ-氨基丁酰)。其也被称为“cor-005”、“cor005”,在本文中可互换使用。其之前被称为ptr3173或dg3173。术语“维多瑞肽乙酸盐”、“cor-005乙酸盐”、“cor005乙酸盐”在本文可互换使用,其指维多瑞肽的单乙酸盐。
本发明将构象受限的主链环状合成肽类似物与赋形剂组合,从而增强其在等渗溶液中的溶解度并且增加这类肽在通过注射递送时的吸收性和生物利用度。本发明还公开了具有或不具有赋形剂的构象受限的主链环状合成肽类似物的制剂,其证明了药代动力学的改善以及注射位点反应的减少。
本发明的组合物可以用于本发明的用于治疗多种疾病的方法,所述疾病包括但不限于,癌症、ii型糖尿病、肢端肥大症和激素相关肿瘤。
药物组合物可以包括肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度,聚合物,和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
药物组合物可以包括肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度,形成微球的聚合物,和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
药物组合物可以包括肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度,聚合物形成的微球,其中聚合物是plga,和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
药物组合物可以包括肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度,聚合物,和赋形剂;其中药物组合物形成凝胶。
药物组合物可以形成乳液,该乳液包括肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度,油相,水相,和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸,其中药物组合物是乳液。
药物组合物可以包括肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度,药学上可接受的运载体或稀释剂,脂质体试剂形成的脂质体,和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
在任一实施方式中的肽或其药学上可接受的盐可以是环状肽,肽两亲分子,离子,水溶性表面活性剂,生长激素抑制素类似物,环状生长激素抑制素类似物,构象受限的主链环状肽,构象受限的主链环状生长激素抑制素类似物,构象受限的主链环状单胺生长激素抑制素类似物,维多瑞肽和其药学上可接受的盐,例如,维多瑞肽乙酸盐。肽或其药学上可接受的盐可以作为油包水乳化剂,并且具有3-8之间的亲水亲脂平衡。
药学上可接受的盐可以是盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、乙酸盐、三氟乙酸盐、柠檬酸盐、草酸盐、丙二酸盐、水杨酸盐、对氨基水杨酸盐、苹果酸盐、富马酸盐、琥珀酸盐、抗坏血酸盐、马来酸盐、磺酸盐、膦酸盐、高氯酸盐、硝酸盐、甲酸盐、丙酸盐、葡萄糖酸盐、乳酸盐、酒石酸盐、双羟萘酸盐、羟基马来酸盐、丙酮酸盐、苯乙酸盐、苯甲酸盐、对氨基苯甲酸盐、对羟基苯甲酸盐、甲磺酸盐、乙磺酸盐、亚硝酸盐、羟基乙磺酸盐、乙烯磺酸盐、对甲苯磺酸盐、萘磺酸盐、氨基苯磺酸盐、樟脑磺酸盐、扁桃酸盐、邻甲基扁桃酸盐、氢苯磺酸盐、苦味酸盐、己二酸盐、d-邻甲苯酒石酸盐、丙醇二醇盐、α-甲苯甲酸盐、(邻、间、对)-甲苯磺酸盐、萘胺磺酸盐、辛酸盐、棕榈酸盐、硬脂酸盐、脂肪酸盐、其他无机酸盐和羧酸。
糖可以是单糖,二糖,多糖,环状多糖,环糊精,β-环糊精,羟基丙基-β-环糊精,或右旋糖。右旋糖可以约2.5%组合物的重量存在。氨基酸可以是任何氨基酸,包括赖氨酸或精氨酸,或其药学上可接受的盐,如盐酸盐,例如,l-赖氨酸盐酸盐或l-精氨酸盐酸盐。疏水性清除剂可具有至少一个游离的胺基。
药学上可接受的运载体或稀释剂可以包括等渗乙酸盐缓冲液,乳酸,盐水和磷酸盐缓冲盐水。药学上可接受的运载体可以处于以所述组合物的重量计约0.45%的浓度,例如,0.45%盐水。
聚合物可以包括形成基质的聚合物,形成颗粒的聚合物,形成微球的聚合物,形成凝胶的聚合物,和具有生物相容性的聚合物。聚合物可以包括聚乳酸-共-乙醇酸(plga)或羧甲基纤维素。聚合物形成的微球可以包括plga。plga可以包括50:50比率的乳酸与乙醇酸。形成凝胶的聚合物可以包括纤维素胶以及其衍生物,如羧甲基纤维素。用于形成凝胶的聚合物可具有粘度改性剂,增稠剂和凝胶形成剂(胶凝剂)的特点。这类试剂增强其中添加了它们的流体的粘度,从而可形成凝胶。这类聚合物在1%水性溶液中可具有1500-3000cps的平均黏度。这类聚合物还可以与肽或其药学上可接受的盐和环糊精相互作用以形成凝胶。
形成脂质体的脂质体试剂可以包括任何药学上可接受的脂质体试剂,其包括磷脂酰胆碱和其衍生物,如1,2-二肉豆蔻酰-sn-甘油-3-磷脂酰胆碱(dmpc),hspc,胆固醇,dspg,dopc,dppg,lipova-e120,leciva-s70,leciva-s90,卵pg,mpeg-dspe,大豆油,聚山梨酯-80,卵鞘磷脂和磷脂酰胆碱。
其中聚合物形成微球的本文所述的药物组合物,相较于不具有赋形剂的微球,可能使多孔性增加,表面积增加,肽释放增加,药物组合物注射到患者后第一个24小时阶段内的肽释放增加。其中聚合物形成微球的药物组合物在注射药物组合物到患者后可能还具有至少1、2或4周的缓释概况。此外,聚合物可以包封赋形剂,肽或其药学上可接受的盐,或赋形剂和肽其药学上可接受的盐两者,并且肽或其药学上可接受的盐和赋形剂可以共定位在聚合物内。前述实施方式的聚合物还可以具有约7-约17千道尔顿或38-54千道尔顿的平均分子量。
药物组合物可以通过如27g的小号针头注射。
油相可以包括棉籽油或任何药学上可接受的油。前述实施方式的水相可以包括水或任何药学上可接受的水性载剂。药物组合物可以形成乳液,该乳液是油包水乳液。油相与水相的比可以为50.1:49.9至99.9:0.01之间。油相与水相的比可以为80:20。在药物组合物形成的乳液中,肽或其药学上可接受的盐可以作为约1%重量/体积浓度的乳化剂。
包括脂质体试剂的药物组合物可能具有至少48小时的肽或其药学上可接受的盐的缓释概况。缓释概况可以包括至少48小时的肽或其药学上可接受的盐的治疗有效血浆浓度。
将理解的是本文所述实施方式可能使用公开成分的任何可能的组合。例如,药物组合物可以包括肽或其药学上可接受的盐、药学上可接受的运载体或稀释剂和赋形剂任何可能的组合。
在某些方面,相较于采用赋形剂的注射而言,用于在患者中降低注射位点副作用的方法包括将本文所述实施方式的药物组合物与赋形剂配制,并且通过注射向所述患者给予该药物组合物。在一些实施方式中,用于增加肽或其药学上可接受的盐的生物利用度的方法包括将前述实施方式的药物组合物与赋形剂制剂,并且通过注射向所述患者给予该药物组合物。在这类实施方式中,肽或其药学上可接受的盐以治疗有效剂量给予。
在一些方面,用于配制本文所述实施方式的包括形成凝胶的聚合物的药物组合物的方法包括:将肽或其药学上可接受的盐和赋形剂混合,并且缓慢地添加聚合物。
在某些方面,用于治疗疾病的方法包括向有此需要的患者给予本文所述实施方式的药物组合物。疾病可能是癌症,ii型糖尿病,肢端肥大症,代谢紊乱,内分泌失调,外分泌失调或激素相关的肿瘤。药物组合物可以通过注射给予,如皮下或静脉内注射。此外,肽或其药学上可接受的盐可以治疗有效剂量给予。
值得注意的肽是维多瑞肽,并且其药学上可接受的盐是维多瑞肽乙酸盐。尽管本发明以具体的实施方式和实施例对于维多瑞肽和/或维多瑞肽乙酸盐进行描述,但是本公开中所描述的组合物、过程和方法也可以适用于其它肽或肽盐,包括其它生长激素抑制素类似物。
维多瑞肽乙酸盐具有对sst受体亚型sst-r2、sst-r4和sst-r5独特的结合概况和改善的结合选择性,并且使药物候选物具有明确的治疗潜力,用于治疗:类癌瘤、肢端肥大症和糖尿病相关并发症,独特的生长激素抑制素受体亚型2-、4-和5-选择性类似物有效地减少人gh分泌型脑垂体腺瘤中的gh分泌,甚至在奥曲肽无响应肿瘤中也是如此。维多瑞肽乙酸盐比目前可用的任何生长激素抑制素类似物(包括奥曲肽)具有显著的优势,其中,其在生长激素抑制中与可用的生长激素抑制素类似物能力相当,并且对胰岛素或胰高血糖素没有非选择性作用。因此,维多瑞肽乙酸盐可以改善用于与生长激素和igf-1分泌过多相关的内分泌异常的药物疗法的有效性,具有对这些患者更好的选择性和更好的血糖控制。
根据本发明,构象受限的主链环状合成肽类似物可以与赋形剂组合以形成用于向患者给药的药物组合物。例如,尽管维多瑞肽乙酸盐是水溶性分子,某些赋形剂出乎意料地改善了维多瑞肽乙酸盐在等渗条件中的溶解度。
包括肽或其药学上可接受的盐和赋形剂的药物组合物可以与药学上可接受的运载体或稀释剂组合以配制用于向患者给药的组合物。
患者肽维多瑞肽由这样的氨基酸残基的特定组合组成,所述氨基酸残基有助于其独特的物理化学性质以及生物作用机制。原位的疏水性氨基酸组合,phe6、trp7、d-trp8、phe11,其相对于lys9的荷电胺的两个亲水性头部基团,和thr10的极性羟基头部基团,产生了两个不同的亲水性与疏水性结构域。因为其不同的亲水性和疏水性结构域,三维β转角和单个乙酸盐抗衡离子的特定盐形式,维多瑞肽乙酸盐具有两亲性特征并且因此被认为是肽两亲物并且还具有表面活性剂性质。图2示出维多瑞肽乙酸盐和奥曲肽乙酸盐三维结构的比较,其显示了维多瑞肽乙酸盐在赖氨酸残基上有单个游离胺以及单个乙酸盐抗衡离子,而奥曲肽有两个乙酸盐抗衡离子,一个在赖氨酸残基上而一个在末端胺上。
考虑到生长激素抑制素类似物药学上的应用,特别是维多瑞肽乙酸盐,一种两亲性质增加的主链环状生长激素抑制素类似物作为乳化剂和凝胶生成试剂,以及油包水表面活性剂,这类组合物可以被用于治疗多种疾病和紊乱,包括但不限于:癌症、ii型糖尿病、肢端肥大症、代谢紊乱、内分泌和外分泌紊乱和激素相关的肿瘤,提供以更低不良影响和延长的药物作用为特点的改善药物治疗。
该药物组合物的另一优势在于具有本公开的赋形剂的维多瑞肽乙酸盐组合物能改善生物利用度,并且出人意料地减少不良注射位点反应。
已经发现维多瑞肽乙酸盐和其它主链环状生长激素抑制素类似物具有相当大的代谢生物稳定性以抵抗酶的降解。
维多瑞肽乙酸盐产生显著抑制,在生长激素-igf-1轴上具有与药物奥曲肽类似量级的延长的作用持续时间,但是其不具有奥曲肽的缺点,如抑制胰岛素分泌。相比奥曲肽,维多瑞肽对胰高血糖素释放的影响也低得多,因此其具有不导致高血糖症的优势,而这使其成为对于改善肢端肥大症患者的血糖控制以及治疗ii型糖尿病的非常有吸引力的化合物。
维多瑞肽乙酸盐表现出对于cho-细胞表达克隆的人sst-r5的显著生长抑制,这表明其在sst-r5表达型肿瘤(例如,类癌,垂体肿瘤)治疗中的潜在作用。维多瑞肽乙酸盐抑制来自人类癌细胞系的嗜铬粒蛋白a释放,这表明其抗肿瘤作用。
在动物中评估的维多瑞肽乙酸盐独特的药代动力学概况与其代谢稳定性一致,所述代谢稳定性针对各种酶和组织匀浆体外评估。皮下给予大鼠后,维多瑞肽乙酸盐具有约3小时的血液循环半衰期,显著超过长效药物奥曲肽,其具有仅为40分钟的血液循环半衰期。该延长的半衰期是由于其独特的“翻转”动力学,这是由于其从注射位点缓慢释放的结果。
维多瑞肽乙酸盐对生长激素抑制素受体具有选择性,并且与其它人类克隆g蛋白偶联受体的结合显著少于奥曲肽。该特征是有利的,因为与非生长激素抑制素受体的结合可能在人体中导致潜在的不良影响。
还发现维多瑞肽乙酸盐在人外周血淋巴细胞增殖试验中对人淋巴细胞是非促有丝分裂的。
已经发现维多瑞肽乙酸盐在水、5%右旋糖、丙酮和各种醇类(包括乙醇、甘油和丙二醇)中具有相对高的溶解度。同样已经发现维多瑞肽乙酸盐在酸性水性溶液如乳酸、乙酸和三氟乙酸中具有相对高的溶解度。出乎意料地,发现维多瑞肽乙酸盐在盐酸中的溶解度为浓度依赖型(增加的氯化物浓度导致溶解度降低,这归因于肽沉淀/盐析)。与氯化物的不相容性导致发现其在生理条件(即0.9%氯化钠ph4.5和磷酸盐缓冲盐水ph7.2)下相对低的溶解度,并且这不是ph依赖型的。
维多瑞肽乙酸盐在生理条件中受限的溶解度是该肽的一种非常特别的性质,并且这在之前是未知的。鉴于其在水中相对高的溶解度,维多瑞肽盐酸盐被认为是水溶性药物。令人惊讶和出乎意料地发现,水溶性药物维多瑞肽盐酸盐在生理条件下具有低溶解度。
维多瑞肽盐酸盐的三维结构含有特定的ii型和β-转角,这是一种存在于大多数生长激素抑制素类似物中的典型构象。这样的构象造成肽的三维柔性被约束,并且导致暴露于面对水性环境的肽环外侧的疏水性(芳香族)残基的重叠。
其它环状生长激素抑制素类似物(即奥曲肽、兰瑞肽(lanreotide)、万破肽(valpreotide)和帕瑞肽(pasireotide))含有两个游离胺基(带正电的头部基团);其中一个是赖氨酸残基的胺,而另一个是位于这些肽的氨基末端的胺。维多瑞肽盐酸盐仅有一个游离胺作为极性头部基团。其氨基末端是酰胺。
此外,不同于具有1-2个苯丙氨酸和1个色氨酸氨基酸的大多数的生长激素抑制素类似物,维多瑞肽盐酸盐在其序列中具有2个苯丙氨酸和1个色氨酸氨基酸。
维多瑞肽是环状分子。环化的主要作用是减少或约束分子的构象空间或三维(3d)形状。因此,如此,其为构象受限的分子。然而,虽然该肽被其环状结构约束,但是其在各种水性介质中的3d结构或构象可能依赖于h-h键合的分子间和分子内相互作用。h-h键合是肽和多肽3d结构的主要因素。
维多瑞肽盐酸盐具有一系列h-供体和受体:12个氢供体和10个氢受体。其它环状生长激素抑制素类似物具有相似的氢供体和氢受体比。例如,奥曲肽具有13个氢供体和10个氢受体。
因为维多瑞肽具有双倍数量的疏水性氨基酸——2个trp和2个phe,以及仅单个阳离子/胺,所以维多瑞肽具有5:2的疏水性和亲水性基团比。应注意,维多瑞肽乙酸盐中有比亲水基团更多的疏水基团。奥曲肽乙酸盐仅有1个trp和2个phe,但是更重要的是,其具有两个阳离子/胺以及额外的末端oh,以及3:5的疏水性与亲水性基团比。这使得奥曲肽乙酸盐比维多瑞肽更加溶于水,并且具有更少的表面活性。
维多瑞肽具有疏水性氨基酸的独特的组成,其相比该肽的亲水部分占优势。这样的组成导致相对高度的两亲性。这样的两亲性性质影响肽在水性介质中的分隔。其趋向于在介质的表面处浓集,从而将疏水性残基暴露于空气来提供热力学稳定性。当其在水的表面处浓集时,其将降低溶液表面张力。
表面张力是流体的分子在流体//空气界面彼此之间的粘附比与空气分子更强的性质,并且导致流体像其表面似乎覆盖有拉伸弹性膜那样表现。通常,相较于纯溶剂的表面张力,溶质将降低表面张力。水和各种等渗溶液在25℃所具有的表面张力在65-72达因/cm范围内。具有表面活性的肽将减少表面张力:溶质表面活性越高,表面张力越低,从而游离分子或目标可以更自由地通过界面。维多瑞肽乙酸盐将二次蒸馏水(ph=5.0)的表面张力降至约45达因/cm(参见表3)。
当肽溶解于水性溶液时,疏水性氨基酸通常形成受保护的疏水性区域,而亲水性氨基酸与溶解的分子相互作用,并且允许肽与周围水分子形成氢键。如果肽表面充分亲水,那么肽可以被溶解于水中。当盐浓度升高时,例如在生理介质如0.9%nacl或pbs中,一些水分子被盐离子吸引,而这将减少能够通过氢键与肽的带电部分相互作用的水分子的数量。对于溶剂分子的增长的需求导致肽-肽相互作用比溶剂-溶质相互作用强;这导致肽的去溶剂化。通过彼此之间形成疏水性相互作用,肽分子会凝结。该过程被称为盐析。
根据维多瑞肽乙酸盐的亲水性性质,通过乳液形成的方法对其进行评估。然而,发现维多瑞肽乙酸盐不作为水包油o/w乳化剂起作用。令人惊讶地,发现维多瑞肽乙酸盐是油包水(w/o)乳化剂。用维多瑞肽乙酸盐和油包水的乳化获得稳定的w/o乳液。因此,维多瑞肽乙酸盐可以被认为是w/o离子型表面活性剂或亲水亲脂平衡(hlb)为6的助水溶物。
由于维多瑞肽的高疏水性基团与极性头部基团比(4:1),其更具两亲性并且具有增强的表面活性剂性能,如表3中数据所证明。
用各种赋形剂的维多瑞肽制剂
赋形剂可以改善可注射肽诸如v维多瑞肽乙酸盐的溶解度、分散和生物利用度。这类赋形剂可以包括疏水性清除剂、糖和氨基酸,如羟基丙基-β-环糊精、l-赖氨酸hcl和右旋糖。
羟基丙基-β-环糊精
β-环糊精如羟基丙基-β-环糊精(hp-β-cd或hpbcd)是用于本发明的赋形剂的示例性类型。hpbcd是由通过1-4个键结合的7个右旋糖单元组成的环状寡糖,具有相对亲水性的内部和相对疏水性的外部,并且趋于形成包合复合物(chang,美国专利号7,259,153)。
并不束缚于任何具体假设,hpbcd可以形成具有维多瑞肽疏水性部分的包合复合物,从而降低其有效疏水性。1:2或以上(例如,10:1)的hpbcd:pep比将改善生理条件下该肽的溶解度。然而,用于实现所需药代动力学概况和生物利用度的比例(1hpbcd:4pep)并不改善高浓度维多瑞肽在生理条件下(盐水或磷酸缓冲盐水)的溶解度,而是显示出改变了该肽的物理性质,如表面张力所证明。相较于未复合的维多瑞肽乙酸盐的45达因/cm的表面张力,与维多瑞肽乙酸盐的hpbcd复合物提供了超过50达因/cm的表面张力(参见表3)这表明hpbcd:维多瑞肽乙酸盐复合物在表面作用较小,而多在本体溶液中作用。与环糊精络合以改善溶解度在环糊精与肽之比为1:1-10:1时出现,这与所观测的完全相反。用hpbcd改善维多瑞肽乙酸盐的溶剂化相较于不用hpbcd的情况对表面张力造成的变化较少。
本发明将环状生长激素抑制素类似物与hp-β-cd组合,以增强其在等渗溶液中的溶解度,并且增加这类肽在通过注射递送时的吸收性和生物利用度。此外,令人惊讶地发现注射位点处不良副作用降低。
l-赖氨酸hcl
已经观察到在含有氯离子的溶液中维多瑞肽乙酸盐的溶解度降低。例如,尽管可溶于0.1nhcl,但是维多瑞肽不溶于0.9nhcl。类似地,维多瑞肽乙酸盐在含有氯化物的等渗溶液(包括0.9%盐水和磷酸盐缓冲盐水)中的溶解度受限制。
出乎意料地发现了维多瑞肽乙酸盐在20mmtris-hcl中高度可溶,无关于该缓冲溶液的氯含量。然而,随着氯化物浓度增加,维多瑞肽乙酸盐的溶解度急剧降低。例如,如果tris-hcl的浓度增加至137mm或添加117mmnacl,维多瑞肽乙酸盐的溶解度将显著降低。
如tris的结构所示,trizma/tris缓冲部分包含游离胺。因此,假设trizma胺与维多瑞肽乙酸盐上赖氨酸残基的游离胺竞争溶液中的氯化物。甚至在氯化物浓度升高的情况下,这样的作用导致肽的溶解度增加,虽然其可在围绕游离胺基的氯化物较少的情况下溶解。这通过随着氯化物浓度增加,tris-hcl中维多瑞肽乙酸盐的溶解度降低而得以确认。
鉴于tris-hcl中维多瑞肽乙酸盐的溶解度,在含有l-赖氨酸和l-赖氨酸hcl的溶液中测试维多瑞肽乙酸盐的溶解度。
意外地发现尽管l-赖氨酸具有与维多瑞肽乙酸盐胺竞争氯化物的游离胺,并未实质上改善维多瑞肽乙酸盐的溶解度。然而,更令人意外地是发现添加l-赖氨酸hcl实质上改善了维多瑞肽乙酸盐在等渗介质中的溶解度,并且限制了肽的沉淀。
右旋糖
同样意外地发现等渗和生理溶液中维多瑞肽乙酸盐的生物利用度通过添加作为赋形剂的右旋糖而得到改善。发现维多瑞肽乙酸盐易溶解于5%右旋糖(usp),其溶解度为约400mg/ml。令人惊讶地,5%右旋糖并不改善生理介质(盐水或磷酸盐缓冲的盐水)中高浓度维多瑞肽的溶解度。这与5%右旋糖水溶液中维多瑞肽的非常高溶解度相反。尽管使用了低右旋糖:肽比(1:8),但是实现了改善的lar药代动力学概况和生物利用度。如此的低比例并不被预期会改善生理介质中的肽溶解度,但是这里显示能够调节该肽的物理性质,如表面张力性能所示。
并不束缚于任何具体假设,右旋糖改善肽极性基团周围的水的溶剂化作用。用右旋糖改善维多瑞肽乙酸盐的溶剂化所造成的表面张力变化少于不用右旋糖的溶剂化。相较于未复合的维多瑞肽乙酸盐45达因/cm的表面张力,与右旋糖复合的维多瑞肽乙酸盐提供了超过50达因/cm的表面张力(参见表3)这表明右旋糖:维多瑞肽乙酸盐复合物在表面处作用较少,而多在本体溶液中作用。这样的相互作用增强维多瑞肽的亲水性,并且因此更多的肽将被浓集在本体溶液中而非表面。这改善了维多瑞肽的生物利用度。
本发明将环状生长激素抑制素类似物与右旋糖组合,以增强其在等渗溶液中的溶解度并且增强这类肽在通过注射递送时的吸收性和生物利用度。此外,令人惊讶地发现注射位点处不良副作用降低。
烟酰胺是能够用于组合物的另一种赋形剂(参见美国专利号6,331,520)。
缓释(sr)制剂
微球制剂
考虑到环状生长激素抑制素类似物的药代动力学,人们常常希望提供用于体内缓释的制剂。可以使用许多方法来实现缓释,包括使用各种基于聚合物的制剂,如使用plga微球和水凝胶。还可以使用乳液和脂质体制剂。尽管缓释制剂,包括乳液、凝胶、微球和最终脂质体,可以降低注射位点反应,改善生物利用度并提供缓释概况,基于对用于即释制剂的赋形剂的发现结果,研究了这类赋形剂在缓释制剂中的使用,并且令人惊奇地发现,使用这类赋形剂能够改善环状生长激素抑制素类似物的体内药代动力学并且减少注射位点反应。
可以使用本领域技术人员已知的常规技术(如实施例7中所公开的)制备plga微球中的环状生长激素抑制素类似物。环状生长激素抑制素类似物还可以基于其特定性质被配制成乳液和凝胶。
并不束缚于任何具体假设,微球之间的差异可能归因于赋形剂如何与维多瑞肽的3d结构相互作用,这可与其表面活性相关。如表3所示,右旋糖-维多瑞肽乙酸盐溶液的表面张力与hpbcd-维多瑞肽乙酸盐溶液的表面张力相似,两者分别为54和51达因/cm。然而,用hpbcd和右旋糖制备的微球的微球结构不同。
hpbcd具有比右旋糖高得多的分子量(mv),其大致在与肽mw相似的范围。hpbcd具有这样的疏水性核心,所述疏水性核心可与疏水性部分如肽的疏水性残基相互作用,生成具有肽的疏水性部分的一个或多个包合复合物。当导入疏水性聚合物时,裹入包合复合物的肽的部分可赋予与聚合物接触的较少的移动性和较少的可用性。与hdpcd复合导致肽的疏水性的有效降低。因此,不太期望肽和聚合物溶液之间的表面相互作用,而hpbcd与肽的复合物吸引水。这将导致hpbcd在聚合物溶液中较少的稀释/分散,其产生了大液滴的内部结构,并且因此,相较于含有右旋糖的微球,形成了较少孔但具有更大直径和更小表面积。
在含有右旋糖的微球中,我们观察到大量小直径孔。作为小分子,右旋糖在肽溶液中的分散/稀释比hpbcd多得多。稀释的右旋糖能够赋予该肽更好的移动性。更好的移动性将导致该肽在聚合物溶液更好的分布。肽更好的分布/分散归因于其疏水性性质。当添加疏水性聚合物时,肽的疏水性部分趋向于被吸引至疏水性聚合物。总之,右旋糖经由h-h键合影响肽3d结构,改善其溶剂化,并且因其小mw,其将改善肽在疏水性聚合物溶液内的分布和分散。结果是微球中更高密度的孔。如通过合适方法(如bet)测量,微球内部结构的改变反映在聚合物微球的表面积。当以特定比例如1:8(右旋糖与维多瑞肽)和1:2或1:4(hpbcd与维多瑞肽)添加右旋糖或hpbcd至用于形成微球的初级乳化物时,所得微球具有约7m2/g至约12m2/g的表面积。应当理解的是,最终微球产物中可能仅存在痕量的右旋糖,从而右旋糖在微球形成中的作用可能与右旋糖修饰维多瑞肽的表面活性的能力大幅相关。该作用在下述是实例中进一步更具体讨论。然而,确实看起来当hpbcd被用于初级乳液以形成微球时,大多数hpbcd被保留在最终微球产物中。
因此,在某些实施方式中,形成微球的初级乳液中的右旋糖与维多瑞肽的质量比为约1:1至约1:16,更优选约1:4至约1:8。因此,在一些实施方式中,质量比可以为约1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15或1:16。
在某些实施方式中,形成微球初级乳液中的hpbcd与维多瑞肽的质量比为约1:1至约1:8,并且更优选约1:2至约1:4。.因此,在一些实施方式中,该质量比可以为约1:1、1:2、1:3、1:4、1:5、1:6、1:7或1:8。
在其他实施方式中,形成微球的初级乳液可以如上所示的与维多瑞肽的各种质量比包含右旋糖和hpbcd两者。
脂质体制剂
同样已经发现维多瑞肽乙酸盐可以配制成具有至少48小时缓释概况的脂质体,其中维多瑞肽乙酸盐的血浆浓度处于治疗有效水平。
脂质体为同心、双层囊泡,其中水性体积完全由主要由天然或合成的磷脂组成的膜脂质双层包围。脂质体在薄脂质膜或脂质饼(cake)水合且液晶双层的堆叠变得流动和膨胀时形成。搅拌期间,水合的脂质片层分离并自联合以形成囊泡,这防止水与边缘处的双层的烃核相互作用。这类脂质体包括多层囊泡(mlv),其由单一磷脂组成,其是磷脂酰胆碱,更优选1,2-二肉豆蔻酰基-sn-丙三基-3-磷脂酰胆碱(dmpc)。
乳液和水凝胶制剂
如之前所述,已经发现维多瑞肽乙酸盐作为表面活性剂并且可以乳化油包水。此外,考虑到维多瑞肽乙酸盐的两亲性质,其还可以被配制成水凝胶。两种载剂均可以提供缓释制剂。
相似地,已经发现油包水乳液制剂中的维多瑞肽乙酸盐的注射将降低和延缓注射位点反应的发展并且可以使用如27g针头一样小的针头注射。
此外,已发现维多瑞肽乙酸盐可以形成稳定的水凝胶,其将延缓诱发位点注射反应,并且可同样地使用如27g针头一样小的针头注射。
因此,已经发现维多瑞肽乙酸盐的乳液和水凝胶制剂将更容易注射并且产生更少的注射位点反应,同时提供维多瑞肽乙酸盐的缓释制剂。
实施例
本发明将在下述实施例中说明,应当理解的是它们仅用于示例性目的,并且本发明并限于此。
材料
cor005乙酸盐(隆萨公司(lonza),dadr-apj-001-5an1r)
羟基丙基β环糊精-hpb(德国达姆施塔特的默克公司(merckkgaa,darmstadt,germany)(药用级)环糊精hpbph.eur.,nf1.4220.0050)
右旋糖5%-usp–dex(梯瓦制药(tevamedical)右旋糖5%awb0064ph4.0252mosmol/lph4.0252mosmol/l)
无菌注射用水–wfi(北爱尔兰的诺博克实验室公司(norbrooklaboratoriesnorthernireland).b.w.4364-90)
甘露醇-m200(德国达姆施塔特的默克公司(药用级)parteckm200emproveexppheur,bp,jp,usp,e421)
乳酸溶液(90%)–(西格玛奥德里奇公司(sigma-aldrich)uspspec.l6661批次#mkbr6268v)
常规盐水0.9%nacl,ph5.0(梯瓦制药awb1324lotxp5e035ph5.0,308mosmol/l)
无钙和镁的pbs10mmph7.4(达式磷酸盐缓冲盐水生物工业公司(biologicalindustries)ref02023-1a)。
缩写
ns–常规盐水(0.9%nacl),ir–即释,f-针对ir载剂iv的auc计算的绝对生物利用度(大鼠或迷你猪),ms–微球,sc–皮下,ba–绝对生物利用度,c最大–最大血浆浓度,man–甘露醇,hpb–羟基丙基β环糊精dex-右旋糖,pep–肽-cor005乙酸盐,lys-hcl–赖氨酸盐酸盐,est.–通过uv-vis.估计的,nt–未测试的,ne-由于变异性而不适用。
实施例1
维多瑞肽乙酸盐在水性介质中的溶解度通过下述方法筛选。称量10毫克固定量的肽,并且在环境温度通过体积增加的(增量的)测试介质将其溶解直到观察到完全溶解度,即清澈/透明的溶液并且不出现任何沉淀(根据usp指南确定溶解度终点值)。按照筛选研究的结果,选择多种介质进行验证研究,所述研究研究基于hplc定量评估肽浓度(最大溶解度)。筛选研究的结果如表1所述,而验证研究的结果包括在表2。从数据中可以得到维多瑞肽乙酸盐在水和其它水性介质中表现出高溶解度,而在等渗介质中受限于有限的溶解度。
表1:维多瑞肽乙酸盐的溶解度筛选
表2:维多瑞肽乙酸盐溶解度的定量评估
表3总结了cor005乙酸盐在各种水性介质中的溶解度,盐水和生理条件中添加剂如dex和hpb对肽溶解度的作用,以及用这些添加剂制备的ir和ms制剂的pk概况,与作为对照的无添加剂的cor005做比较。
cor005乙酸盐在水性介质中的溶解度
cor005乙酸盐在水中和等渗5%右旋糖(见下文)中的溶解度相对较高(至少300mg/ml)。然而与其在水中的高溶解度相比,如在等渗pbsph7.4和在盐水中所观测的那样,cor005乙酸盐的溶解度在生理(水性)条件下显著较低(在1-2mg/ml的范围内)。注意到,两种介质(pbs或盐水)均含有生理浓度的氯化物,这表明该肽在氯离子存在的情况下的不相容性和盐析情况。
添加剂的作用
右旋糖:cor005乙酸盐在5%右旋糖(水中)中超过500mg/ml的相对较高的溶解度表明右旋糖改善该肽在水中的溶解度。将右旋糖添加到等渗盐水导致肽溶解度在常规盐水中稀释的5%右旋糖(其具有2.5%右旋糖和0.45%盐水(nacl)的最终浓度)中由2mg/ml增加到6至7mg/ml。注意到,在盐水中1:1稀释的右旋糖在大鼠和迷你猪中的cor005乙酸盐ir研究中被用作载剂(dex:pep比为5:1)。
表3
大鼠和迷你猪中皮下注射的ir制剂的pk数据显示了右旋糖载剂使cor005乙酸盐c最大和绝对生物利用度值增加高于其它ir制剂(右旋糖中的cor005的大鼠-c最大-544ng/ml对比作为对照的乳酸缓冲液中cor005的345ng/mlc最大)。右旋糖中cor0050.4mg/kg的迷你猪-c最大–238ng/ml和ba88.4对比作为对照的乳酸缓冲液中cor0050.4mg/kg的108ng/mlc最大和ba69%,cor0050.1mg/kg的ba分别为91%对比45%。该pk数据提供了向ms制剂中添加右旋糖的可能原理的两个主要原因:1)右旋糖在其由ms释放后可能增加肽的溶解度和ba,并且2)已知右旋糖为多孔性试剂,并且其可能增强ms的渗透性,从而改善肽由ms基质的释放。
出乎意料地,pbs中的右旋糖的溶解度结果明显不同于盐水中肽溶解度的右旋糖作用。如表3所示,如在等渗pbsph7.4中以5:1的1:8的dex:pep比所观察到的,右旋糖并不改善肽在生理条件下的溶解度,其中的溶解度分别仅为1.6mg/ml和2mg/ml。pbs中采用右旋糖的弱(未改变的)肽溶解度可能的原因是pbs相比盐水增加的离子强度;pbs含有0.02%kcl、0.02%kh2po4、0.115%na2hpo4和0.8%nacl,而盐水仅含有0.9%nacl。
1:8的dex:pep比是用于ms制剂b12或psi13的比例。这可以指示在这些dex制剂中观测的cor008乙酸盐pk概况,其显示高于基础ms制剂b10(无dex)的c最大和绝对ba,这不是由于生理条件下肽的溶解度改善,因为添加了dex的pbs中的cor005乙酸盐的溶解度仅为1-2mg/ml。因此,这似乎是dex对ms制剂中的肽的作用,其超过了生理条件下增加的溶解度的作用。
右旋糖如何增强来自ms的cor005的释放和ba的机制在如下表面张力对比sem总结数据中详述。
hpb:如表3所示,添加剂hpb在盐水和pbs中以浓度依赖型的方式增强cor005乙酸盐的溶解度。采用1:2的hpb:pep比(ms制剂b13,见下文)观察到超过无hpb情况的溶解度的轻微增加(由2.2增加至2.5mg/ml)。当hpb:pep比增加至1:1、10:1和15:1以及更高时,hpb进一步改善溶解度,最终达到10mg/ml的溶解度。注意到,采用1:4的hpb:pep比(ms制剂b14,见下文)的cor005的溶解度与仅pbs中的肽的弱溶解度在相同的范围。
ir制剂中hpb作为cor005乙酸盐的添加剂的pk数据表明了大鼠中c最大和ba的增加,以及在迷你猪中显著的增加(在两个情况中,这是具有第二高c最大和ba的ir制剂)。hpb中cor005的大鼠-c最大–451ng/ml对比作为对照的乳酸缓冲液中cor005的345ng/mlc最大。hpb中cor005的迷你猪-c最大–255ng/ml和ba85.3%对比作为对照的乳酸缓冲液中cor005的108ng/mlc最大和ba69%。
这些pk结果提供了将hpb用于ms制剂相似的原理以实现如右旋糖一样的作用。右旋糖和hpb两者是多孔性试剂,并且它们在ms中的组合物可导致ms渗透性的增强以及肽释放的增加。此外,在hpb的情况中,我们假设除了预期的多孔性作用外,其可以轻微地改善肽在生理条件下的溶解度(特别是在1:2的hpb:pep比的情况中,如溶解度数据所示)。
然而,令人惊讶地是,以hpb作为添加剂的ms的啮齿动物中的pk数据显示了hpb对ms制剂b13和b14中的ba和突释(burst)的两种不同的作用。在b13的情况中(这是在大鼠中测试的两种中的唯一一种),用1:2的hpb:pep比制备的ms制剂(该比例导致肽在生理条件下溶解度轻微的增加),大鼠中的pk显示,相较于基础制剂b10,其在第一个24小时内突释和绝对ba显著增加(ba0-24小时);cor005-b13211ng/ml的c最大和ba(0-24小时)11%对比cor005-b1030ng/ml的c最大和ba(0-24小时)2%。
同样在迷你猪pk研究中观测并验证了这种趋势。在b14的情况中,其具有降低的1:4的hpb:pep比,预期的结果是在生理条件下较低的肽溶解度和微球的孔隙率降低(如表中所示)将因此减少随时间的肽释放和血浆浓度。
令人惊奇并且出人意料地是迷你猪中b14的pk数据显示了相反的作用:降低的hpb:pep比导致肽释放显著地增加,并且c最大、ba和血浆肽水平显著地高于b13、b12和基础ms制剂b10的观察值。
注意到,b14(hpb:pep1:4)以及b12和psi13(各自为dex:pep1:8)都具有相对低的hpb与pep比例。这些低的比例在生理条件下未显示改善的肽溶解度。尽管溶解度低,但是相较于b12和psi13的数值,由b14ms释放的肽显著增加,如体内cor005乙酸盐随时间的高ba和持久的血浆浓度所示。因此,似乎hpb对ms制剂中的肽具有作用,其超过了生理条件下增加溶解度的作用。
hpb如何增强来自ms的cor005的释放和ba的机制在下文表面张力对比sem的总结数据中详述。
实施例2
维多瑞肽乙酸盐对水的密度、ph和表面张力的作用如表4所示。已经发现维多瑞肽乙酸盐表现为肽两亲物,并且降低水的表面张力。然而,水的表面张力的降低并不是以剂量依赖型的方式下降,这表明维多瑞肽乙酸盐作为助水溶物,而非表面活性剂发挥作用。
吐温80用作对照表面活性剂用于比较。以1ml固定体积的样品测量密度。所有测试都在25℃重复三次。维多瑞肽乙酸盐对双蒸水(ddw)的ph的作用在所有维多瑞肽乙酸盐浓度相同。ddw的ph5.0降低至ph4.5。维多瑞肽乙酸盐对ddw密度(ddw的初始密度为1.003g/ml)的作用从1.4mg/ml至21.5mg/ml是浓度依赖型,密度分别在0.986至0.998g/ml的范围内。然而,在45和102mg/ml的维多瑞肽乙酸盐浓度下,密度增加至ddw初始密度以上。这些结果表明ddw中超过45mg/ml的肽溶液达到饱和状态。维多瑞肽乙酸盐对ddw表面张力(初始表面张力为64.9达因/cm)的作用与表现为肽两亲物(表面活性剂)的维多瑞肽乙酸盐一致。ddw的表面张力被维多瑞肽乙酸盐最多由64.9降低至45达因/cm。为了阐明该作用的意义,吐温80用作参照表面活性剂。其它表面活性剂包括polexamer188。由吐温80诱导的表面张力降低为40%范围内(从64.9达因/cm至约39达因/cm),相较于维多瑞肽乙酸盐的30%(从64.9达因/cm至约45达因/cm)。注意到,在这些实验条件下;吐温80的作用指示浓度-效应关系。而维多瑞肽乙酸盐对表面张力降低的作用对于测试的所有浓度处于相同的范围。
表4:维多瑞肽乙酸盐对水的密度和表面张力的作用
表5示出注射用水(wfi)中维多瑞肽乙酸盐与奥曲肽(生长激素抑制素类似物)和戈舍瑞林(lhrh类似物)比较的比较性表面张力。
表5
微球制剂中cor005乙酸盐的表面活性
表4的数据显示了高浓度cor005乙酸盐(200mg/ml)的表面活性,所述高浓度cor005乙酸盐具有或不具有wfi中的添加剂,其模拟微球的初级乳液的制备条件。测试1和2的结果(表4)显示了cor005乙酸盐对水表面张力的作用。当cor005乙酸盐溶解于水时,表面张力降低减少了约36%,由对于单独水的68.5达因/cm降低至对于具有200mg/mlcr005乙酸盐水溶液的44达因/cm。
表5中的数据和图3显示了cor005对比作为本文两亲肽对照提供的奥曲肽和戈舍瑞林的比较性乳化性质。该数据显示了相较于对照肽,cor005独特的表面活性。cor-005具有比奥曲肽更高的表面活性,以及与戈舍瑞林(其是比奥曲肽疏水性更高的肽)相似的表面活性。
图3显示了cor005相对奥曲肽和戈舍瑞林采用16.6重量%的棉籽油(cso)、74.2重量%注射用水wfi和9.2重量%的肽的乳化样品的图像。使用25g注射器混合样品,并在室温下涡旋。乳化结果显示cor005对油/水界面显著的亲和力,允许乳液形成。奥曲肽显示了弱乳化效率,而戈舍瑞林显示乳液形成的最小潜力。这些结果证明cor005作为表面活性剂的独特的两亲性质。
并不束缚于任何具体假设,在水性介质中,cor005似乎对水和空气之间的界面表面有优选的亲和性,这归因于其疏水性氨基酸(2个色氨酸、2个苯丙氨酸和仅单一的胺类阳离子),如图2所示。因此,由于肽疏水性,将损失较少的水的熵。水的热力学通过最大熵、水分子的无序和其动态氢键表征。当疏水性部分与水混合时,其干扰水分子的天然无序并产生“冰笼(icecage)”,所述冰笼降低水熵,由此水分子将疏水部分排斥到表面以使熵的损失最小化。
在分散系统如水和油或具有疏水性聚合物如plga的水性介质中,由于cor005的两亲性质,其对亲脂性/疏水性界面表面具有高亲和性。对ms初级乳液预期的作用可以是在预期乳液中生成较小的液滴尺寸,由于肽降低系统的表面张力而增加乳液稳定性,以及肽在plga聚合物(其为在界面形成的疏水性“表面”)中更好的相互作用、取向和分散。
观测到的从基础b10ms制剂的cor005体外释放概况显示了最低速率的释放。此外,sem图像(见下文)显示了基础制剂b10ms的固体且凝缩基质,其与肽释放概况相关。此外,迷你猪中的pk数据证明了b10制剂随时间的差cor005血浆浓度(表3)。
hpb对cor005乙酸盐表面活性的作用,hpb:pep1:2
以1:2hpb:pep比添加hpb导致肽表面活性降低。当以1:2比(52达因/cm)添加hpb时,不含添加剂的肽在水中观测的表面活性(44达因/cm)转而向水(68达因/cm)增加。该结果指示hpb通过增加其在水中的溶解度来降低肽作为表面活性剂的潜力。肽表面活性降低和较高水溶解度的结果是界面处存在较少的肽。
其对ms初级乳液的作用将会是初级乳液相对较高的表面张力(相较于不含hpb的肽的基础制剂)以及水与聚合物溶液的界面表面处相对较低的肽浓度。此外,由于水对hpb的高亲和性,ms沉淀期间plga基质内将会保留相对较多的水。
体外和体内观测到的来自b13(hpb:pep以1:2比)的cor005突释(c最大)在基础b10和dex–b12和psi13ms组合物中是最高的。此外,大鼠中b13的pk数据显示了大多数的肽是在第一个24小时内释放,“倾泻(dumping)”约20%总auc(0-28天),随后是在余下的27天内显著较低的血浆浓度。
hpb对cor005乙酸盐表面活性的作用,hpb:pep1:4
测试4的结果(表4)显示了将hpb:pep比由1:2(制剂b13)降至1:4(制剂b14)的作用。表面张力结果显示降低的hpb:pep1:4浓度(45达因/cm)具有与水中的cr005乙酸盐相同的表面活性(44达因/cm),这表明在该较低的比例下,hpb对于肽表面活性剂性质无作用。
在该情况中,预期肽在界面处将具有比hpb:pep1:2更高的浓度。相较于制剂b13的ivr和pk概况,降低的hpb:pep1:4比的预期作用将会是降低体外释放和ba以及pk概况。基本的假设是相较于由hpb:pep1:2的制剂,将来自hpb:pep1:4的ms制剂中的降低的hpb浓度将形成具有更致密核心的微球,因为更少的水会被肽/hpb复合物所吸引。此外,预期ms表面的渗透性将降低(更少hpb=更少的孔)。具有hpb:pep1:4比的ms的所有这些可能的作用将导致减少的突释,之后是随时间推移的cor005从ms的更缓慢释放,相较于制剂b13(hpb:pep1:2)的pk概况。换言之,b14制剂在应在延长的一段时间内释放相同量的肽,而不是在最初几天中从ms快速释放肽,如在制剂b13所观察到的那样。
出乎意料地是,对该hpb:pep1:4比的ivr和pk研究显示了相反的结果:降低的hpb:pep比导致ivr增加(参见psi系列的ivr)。同样的趋势也在pk研究中观测到:b14的pk概况导致较高的突释(c最大),其比制剂13高。此外,由制剂b14随时间推移释放的cor005的血浆水平显著地高于制剂13,并且也高于制剂b10和b12。
dex对cor005乙酸盐表面活性的作用,hpb:pep1:8
实验5的结果(表4)显示了当以1:8dex:pep比添加至ms制剂时dex:pep的作用。该表面张力结果显示了dex:pep1:8溶液(54达因/cm)的明显表面张力与测试3的hpb:pep1:2(51达因/cm)相当。该作用表明更多的肽集中于本体溶液中,而不是界面处。事实上,相较于单独的肽(44达因/cm),在这些dex和hpb与肽比例下,肽的表面活性降低。集中在水中的添加剂可能导致初级乳液期间肽周围的水的吸引增加。这可能导致微球的多孔性增加,因为内部基质中相对较高的水含量,如预期b13制剂将出现的情况。
然而,制剂b12(dex:pep)和b13(hpb:pep)的比较性pk数据并不支持这些假设。尽管制剂b13的肽释放和血浆水平显示了随时间的高突释和低血浆浓度,但是来自制剂b12的突释降低并且血浆水平随时间显著增加高于制剂b13的血浆水平。这些出人意料的结果表明初级乳液的表面张力和最终ms的外部多孔性并不是影响观测的肽pk概况的唯一因素。
因此,寻找将ms的外部多孔性与肽的表面张力联系的其它因素以支持(凭经验)ivr和pk研究中观察到的添加剂的意想不到的作用。在试图评估各种条件对各种ms制剂内部(而非外部)形态的影响后确定该因素。此外,如下讨论的sem图像支持这样的假设,即,表面张力测量确定了不同肽界面浓度的条件,其受添加剂hpb和dex浓度变化的影响。事实上,只有当sem成像通过切割微球来重复以暴露其内部结构时,才能观察到表面活性数据与cor005ms制剂ivr和pk数据之间的联系(见下文)。
表6总结了添加剂在生理条件下(37℃)对cor005乙酸盐表面活性概况的作用,所述生理条件模拟注射位点处的cor005释放。
表6
表6中所示数据显示了添加剂dex或hpb两者与cor005乙酸盐的比例在生理条件下不改善cor005乙酸盐的溶解度(表3和4中示出dex不改善肽在pbs中的溶解度,而hpb以浓度依赖型的方式改善肽在pbs中的溶解度)。具有用于ms制剂的浓度的添加剂的肽的溶解度不支持观测到的肽的归因于溶解度的增加的释放和ba。具有处于10:1的高hpb:pep比的hpb的cor005的表面张力(50达因/cm)证实了该假设以及观察到的hpb对肽表面活性的作用:增加的hpb将增加肽溶解度并且降低肽表面活性,因为更多的肽将在本体溶液中,而非处于界面处。在hpb:pep由1:2降低至1:4的情况中,溶液的表面张力也降低。系统中较少的hpb导致更大的肽表面活性,伴随更多的肽存在于界面处。这样的结果支持制剂b13对比制剂b14观测到的ivr和pk数据。当将hpb添加到ms中时,多孔性增加且肽释放受到ms内部空间微环境中hpb和肽之间相互作用(包合复合物)程度的影响。在其中hpb:pep相对高的制剂b13的情况中,ms中产生更多的孔,并且更多的肽处于孔的内表面,而不是位于聚合物基质内。内部基质可以获得更多的水(由于外壳中有更多的孔),并且水会快速扩散到内部基质中。处于内部基质时,由于hpb的作用,大多数的肽能够由聚合物释放。这导致了肽相对快速的释放,如在制剂b13的ivr和pk中所观测的那样,其显示了在最初的几天里突释和快速释放,之后是随时间推移的较低的血浆浓度。
相同的趋势通过1:4降低的hpb:pep比的作用(制剂b14)支持。表4显示了该条件下(低hpb)肽的表面活性与不存在添加剂的肽表面活性相似,分别为34与39达因/cm。在该情况中,ms的多孔性相较于制剂b13(具有更多hpb)降低,且保留肽表面活性,这导致更多的肽取向于孔的界面处。当水扩散到b14ms中时,肽的释放受到来自内部聚合物基质和来自孔内部空间的释放的影响。
这些观测结果和结论由对hpb的ms制剂中残基hpb浓度的分析支持。事实上,分析数据(见下文)确认在hpb的最终的ms中维持了相同的hpb:pep比,并且因此验证了表6的数据和条件。
至于dex的结果,最终ms中残基dex的分析数据显示了显著较低的dex:pep比,而这表明大多数初始dex物质在制备过程期间被洗去。因此,不同于hpb的情况,dex在注射位点对cor005表面活性的作用似乎是微不足道的。对dex的作用在下述sem分析部分讨论。
实施例3
制备维多瑞肽乙酸盐即释制剂(组1m-6m)用于注射到hsd:sprague
表7
制备用于大鼠注射的制剂,汇总于表8。
根据上述给药方案,各处理向5只大鼠的组的受试大鼠(各对象的平均重量是约370g)进行注射。给药前2天采集大鼠的基线尾部血样样品。对于组1m,给药后5分钟、10分钟、30分钟、1小时、2小时、4小时、6小时、8小时和24小时采集血样。对于组2m-6m,给药后30分钟、1小时、2小时、3小时、6小时、8小时、12小时和24小时采集尾部血样。血样为收集于市售k3edta涂覆的试管的约300ul全血。观测受试大鼠给药后长达5-7天的注射位点反应。
所有皮下注射诱导位点注射反应。表9显示了注射位点反应的评分。
表8
表9
乳酸载剂配制的维多瑞肽乙酸盐注射观测到严重的注射位点反应。然而,用盐水中的l-赖氨酸hcl或右旋糖(分别为组4m和6m)配制的维多瑞肽乙酸盐注射大鼠显示出相对低的注射位点反应。
收集血液样品后将其保持于冰上直到离心。在血液采集的60分钟内处理血液样品。样品在冷冻离心分离机(5℃)中以3000g进行15分钟离心。离心后将血浆由试管移出并且将其置于新的试管内,适当标记试管并将其储存于-65℃至-80℃直到转移。
经由lc-ms/ms分析血浆样品以确定组1m-6m的维多瑞肽乙酸盐血浆浓度。用甲醇:水(1:9)连续稀释维多瑞肽乙酸盐标准品,并且将其添加至空白大鼠血浆以生成标准校正和qc样品。校正样品储存于-70℃。冷冻样品然后在室温解冻。同样制备空白血浆和试剂空白(水)。对样品的每100ul等分,校准物或样品,添加25ul(约100ng/ml)的甲醇:水(1:9)中的内标(奥曲肽乙酸盐)以及600ul的乙腈:甲酸(99:1),并且涡旋混合样品30秒。通过将20ul血浆样品与180ul空白血浆混合来稀释样品,并且在添加内标和乙腈:甲酸溶液前将其以100ul进行等分。
然后将样品在4℃以14,000rpm离心10分钟。然后将450ul的上(有机)层转移至蒸发试管,并且在约50℃在氮气下蒸发。然后在200ul的重组溶液(水:乙腈:甲酸为70:30:0.2)中重组。然后将样品在8℃以4000rpm离心10分钟。取出160ul各样品,并将其置于具有圆锥玻璃插件的自动取样器,并且通过lc-ms/ms分析。
然后对维多瑞肽乙酸盐血浆浓度进行绘图并且使用标准药代动力学技术分析。获得的组1m-6m的药代动力学参数如表10所示。组2m-5m的血浆浓度(半对数)对比时间的图表如图4所示。
表10
cor005乙酸盐sc相对iv的半对数pk概况显示cor005乙酸盐具有翻转动力学。与iv的消除曲线相比,sc曲线的速率斜率向右移动。因此,sc注射位点的表观肽吸收速率显著更慢并且持续高于消除速率。因此,所有sc制剂的表观半衰期值实际上是吸收的半衰期,其主导药代动力学概况消除阶段的作用。
图5是说明相较于用作对照的乳酸缓冲液(3m)中的cor005,大鼠中0.3mg/kgdex:pep比5:1(6m)的右旋糖/盐水ir制剂对cor005pk概况作用的图表。图6是说明相较于用作对照的乳酸缓冲液ph4(3m)中的cor005,大鼠中hpb/盐水(hpb:pep15:1)(5m)的右旋糖/盐水ir制剂对cor005pk概况作用的图表。图7是比较迷你猪中0.4mg/kg的hpb和dexsc制剂与用作对照的乳酸缓冲液ph4(3m)中的cor005的图表。图8是比较迷你猪中0.4mg/kg的hpb制剂与用作对照的乳酸缓冲液ph4(3m)中的cor005的图表。图9是显示相较于用作对照的乳酸缓冲液ph4的迷你猪中dex对cor005乙酸盐ir制剂,sc,0.4mg/kg的pk概况的作用的图表。图10是显示相较于用作对照的乳酸缓冲液ph4的迷你猪中dex对cor005乙酸盐ir制剂,sc,0.1mg/kg的pk概况的作用的图表。
比较性pk概况表明右旋糖或hpb增强cor005血浆c最大且使其生物利用度高于其它载剂。
表11总结了迷你猪中cor005乙酸盐ir制剂的药代动力学参数,(剂量0.4mg/kg),显示了以乳酸缓冲液ph4最为对照,hpb和dex对cor005c最大和绝对ba的作用。表12总结了迷你猪中cor005乙酸盐ir制剂的药代力学参数,(剂量0.1mg/kg),显示了以乳酸缓冲液ph4最为对照,dex对cor005c最大和绝对ba的作用。
表11
相较于乳酸载剂(m3)和右旋糖(m6),hpb增加cor005吸收(m2和m5)的半衰期。这表明来自hpb载剂的cor005的较慢释放和延长的吸收。
也对组2m-6m在24小时的低谷浓度进行了分析,并示于表13。
表13
可能会注意的是,根据现有文献,维多瑞肽乙酸盐的静脉内注射确认了13ml/分钟/kg的预期cl(afargan等,具有内分泌选择性的新型长效作用生长激素抑制素类似物:对生长激素而非胰岛素的潜在抑制(novellong-actingsomatostainanalogwithendocrineselectivity:potentsuppressionofgrowthhormonebutnotofinsulin),endocrinology,142:1(2001)477-486)。此外,添加赋形剂改善了维多瑞肽乙酸盐的药代动力学表现。例如,添加右旋糖盐水(组6m)改善了auc并且产生超过100%的f值。如图5-11所示,添加赋形剂导致维多瑞肽的生物利用度改善。此外,如表13所示,添加赋形剂如羟基丙基-β-环糊精(组2m和5m)和右旋糖(组6m)导致24小时后可测量的维多瑞肽乙酸盐低谷浓度。因此,已经证明添加赋形剂不但降低注射位点反应,而且改善大鼠模型中速释维多瑞肽的药代动力学。
实施例4
维多瑞肽乙酸盐根据表14中的配方被配制成plga(聚乳酸-共-乙醇酸)微球。
表14
表14中的制剂这样给予大鼠:对于制剂b9和b10使用23g针头经由注射给予,对于制剂b11-b13为19g针头。将0.5ml精确体积的制剂给予每只动物。尾部血液样品在28天内的各个时间点采集以确定维多瑞肽乙酸盐制剂的药代动力学,并且监测注射位点反应。采用的放于与实施例3中公开的那些相似。
大鼠血浆中plga-ms-cor005乙酸盐制剂的药代动力学分析
cor005的药代动力学分析使用pksolutions2.0软件(美国科罗拉多州名特的顶峰研究服务公司(summitresearchservices,montrose,colorado))进行。该软件使用非房室(区域)和房室(指数项)方法计算结果,不假设任何特定的房室模型。由单个剂量结果自动投射多个剂量和稳态参数。pk参数计算基于两种标准分析方法:(1)曲线剥离(或残数法(methodofresiduals))以得出描述血液水平曲线的指数项,以及(2)曲线下面积计算.pksolutions2.0在适用的情况下应用这两种方法,并将结果并排比较。
通过对各组的各动物的pk分析进行pk数据分析。各种治疗的比较pk参数由各组的平均值±stdev表示。
图11显示了cor005血浆浓度的标准曲线,作为sc处理组b9-13的cor005乙酸盐plga-ms制剂的平均值±stdev时间曲线(时间:0至28天)。
图12显示了“突释”药代动力学的图表,作为处理组b9-13的plga-ms-cor005(时间:0至24小时)大鼠(n=16)单个sc剂量的平均值±stdev的cor005血浆浓度时间曲线的标准曲线。
图13显示了相较于基础ms制剂,hpb对cor005plgams突释(时间:0至24小时)的作用。
表15总结了大鼠中来自ms制剂的co5005乙酸盐突释的药代动力学参数,显示了hpb对cor005c最大和绝对ba的作用。
表15
图14是这样的图表,其显示了相较于基础ms制剂,dex对cor005plgams突释(时间:0至24小时)的作用。
表16总结了大鼠中来自ms制剂的co5005乙酸盐突释的药代动力学参数,显示了dex对cor005c最大和绝对ba的作用。
表16
表17总结了大鼠中全pk概况-cor005ms-plga7-17kda–制剂b13的绝对和相对生物利用度值(时间:0-28天)。
表17
表18总结了cor005乙酸盐plga-ms制剂的添加剂hpb和dex在迷你猪中的作用。
表18
图15显示了相较于作为对照的b10(基础ms制剂),dex:pep1:8在迷你猪中的作用,具有psi13(b12:dxe:pep1:8)的微球的比较性pk概况。图16显示了迷你猪中hpb:pep1:2的作用,示于突释微球制剂b13的比较性pk概况的图表中,与作为对照的b10(基础ms制剂)做比较。图17显示了迷你猪中hpb:pep1:4的作用,以来自组合物b14的微球的突释的比较性pk概况的图表形式,与作为对照的b10(基础ms制剂)做比较。
表19和20总结了通过hplc测量的微球批样品的包封率(ee)和肽含量。
表19
表20
测量了来自plga微球的维多瑞肽乙酸盐的体外释放(ivr)。向20ml玻璃药瓶中的10ml磷酸盐缓冲液(10mm,ph=7.4,无钙、镁或氯化物)添加50mg的各微球批料(b9-b13)。将药瓶保持在37℃150rpm的控温振荡器。在各时间点收集样品并且经由
表21
图18和上述表21描述了来自微球制剂b9至b13的cor005的比较性ivr概况。数据显示了用于微球制备的两种特定类型的plga50:50之间显著的差异。相较于用较高分子量38-54kda(38-54kd)制备的微球,用低分子量聚合物7-17kda(7-17kd)制备的微球的释放肽累积量和释放速率均显著增加。与基础制剂b10(不含添加剂)相比,hpb或dex(分别为b13和b12)之间的体外比较释放概况显示,添加剂hpb或dex使释放自微球的释放速率和总累积肽增加高于基础制剂。用添加剂hpb制备的b13的cor005体外释放概况显示约40%的最高突释。突释后接下来的14天为非常低的释放速率,在第14天以约45%的总释放结束。注意到,b13的ivr概况与其pk概况相关,如大鼠和迷你猪中pk数据所示。相较于b13,用添加剂右旋糖制备的b12的cor005体外释放概况显示约20%的减少的突释。b12突释后,在14天的时间过程中释放速率连续增加,在第14天以约40%的总释放结束。大鼠和迷你猪中b12对比b13和b10的比较性突释的体外释放概况与b12的pk概况相关。无添加剂制备的基础制剂-b10的cor005体外释放概况显示约5%的显著低的突释。b10突释后,在14天的时间过程中释放连续增加,在第14天以约20%的总释放结束。相较于b12和b13,b10的观测释放速率以及这些微球释放的总累积肽显著地低。观测的b10体外突释与其pk概况相关。在大鼠和迷你猪中,相较于b12和b13,b10展现出较低的体内突释。
表22和23分别显示了28天内注射位点反应和制剂的“突释”动力学(0-24小时)的结果。图11-18显示了针对不同制剂的药代动力学概况。
表22
表23
表24
如表23所示,在大鼠中,注射位点处的耐受度似乎是≤0.5mg,并且约1mg诱导注射位点反应。
来自在该实施例中制备的各批次的plga微球也进行了电子显微镜术(sem)。所得图像示于图19-27。
如可从图12和13所观测的,相较于维多瑞肽乙酸盐的其它制剂,制剂b13(低分子量plga微球中的维多瑞肽乙酸盐与羟基丙基-β-环糊精)在最初的24小时具有增加的“突释”释放,然后是以界定的c最小的缓释28天。制剂b10和b12(分别为不具有和具有右旋糖的低分子量plga微球中的维多瑞肽)具有较小的“突释”,然后从约第2周到第4周在不增加注射位点反应的情况下逐渐增加的释放,这表明缓释具有改善的耐受度。b12特别显示了比b13外推生物利用度(auc)显著高的auc。无论如何,比起不具有赋形剂的plga微球,用羟基丙基-β-环糊精)或右旋糖制备的含有维多瑞肽乙酸盐的plga微球在“突释”阶段中展现出增强的释放。在不受理论限制的情况下,这些赋形剂疑似导致微球的孔隙率和表面积增加。总之,b10是最耐受的制剂,其在“突释”阶段产生约30ng/ml的血浆水平(c最大)。还值的注意的是,ivr与注射位点反应负相关,并且可用于预测制剂的注射部位反应潜力。
cor005醋酸盐plga-ms制剂的对比sem成像显示了添加剂的效果
sem成像的第一个目的是评估和比较各种ms制剂的外部形态学,并验证添加剂hpb和dex对液滴尺寸和表面张力的影响。第二个目标是评估和比较各种ms基质的内部结构。更具体地说,鉴定各种内部基质之间可能存在的差异,这些差异与cor005、添加剂(dex和hpb)和疏水性plga聚合物之间的所提出的独特相互作用相关联(在初级乳液期间以及由最终ms在注射部位释放肽期间),以及这些相互作用对cor005(含或不含添加剂)观察到的ivr和pk概况的影响。
图19显示了无添加剂的cor005乙酸盐的基础微球制剂b10的外部形态学的sem显微图像。图20显示了无添加剂的cor005乙酸盐的基础微球制剂b10的内部形态学的sem显微图像。在图20中,箭头表示经切割以显示内部形态学的微球。
图19和20描述了基础制剂b10的外部和内部形态学。ms制剂的初级乳液基于在没有任何添加剂的情况下将肽水溶液与二氯甲烷中的聚合物混合。注意到,在这些制备条件下,cor005具有其最大表面活性(如表2、3和4所示)。图19描述了制剂b10ms的对称形状和近具有少量小孔的ms的相对光滑外表面。因此,在切割ms样品后进行了另一sem系列以评估这些外部孔与ms内部形态学的结果。图20的sem图像显示了由于冷冻切割而暴露的ms内部结构。观测的内部基质具有仅有少量孔的固体质地,这与该基础b10制剂外表面的观察相关。基于这些sem观察,最好将制剂b10描述为具有相对低渗透性的微球。这些结果支持cor005与聚合物之间高亲和性的假设,其产生相对光滑的外表面以及固态且凝结的内部基质。这种形态是由于cor005作为水包油独特的表明活性、相对疏水性表面活性剂以及其在与聚合物二氯甲烷溶液作为疏水表面的界面处的取向性(图20和表3、4和5)。该肽:聚合物物理(非化学)相互作用的结果是,来自制剂b10的预期释放应当较为缓慢。事实上,ivr数据显示,相较于hpb和dexms制剂,来自制剂b10的cor005释放率是最慢的。该缓慢释放率与b10体内pk概况关联,相对于制剂b12、b13和b14(表3),所述b10体内pk概况在大鼠和迷你猪中的观测具有最低突释(c最大)以及迷你猪中观测的最低血浆水平。应注意的是,大鼠中的pk表明来自b10ms制剂的cor005血浆水平的增加高于制剂b12和b13,然而,由于与b10动物组相关的显著变异性,该结果是不确凿的。来自制剂b10的缓释cor005与低血浆水平和低ba之间的决定性关联在如表3所示的迷你猪中的pk研究证明。来自基础b10制剂的cor005释放速率太慢以至于无法超过迷你猪中cor006的清除速率,并且因此随着时间的推移获得了较差的血浆水平。
含有dex的b12制剂的外部和内部形态学
图21和22描述了基础制剂b12的外部和内部形态学。图21中所示图像显示了相较于基础b10制剂中观测到的较少孔,制剂b12的代表性ms由于表面处许多可见的孔而具有显著高的多孔性。在图22中,制剂b12的内部基质在冷冻切割ms后暴露。该图像显示了通过相对薄的间隙聚合物边界分隔显著高数量的空隙,这导致内部基质中高密度的小空隙,并因此增加空隙体积。这种增加的空隙体积的第一个预期影响是内部基质中聚合物密度降低。对于给定体积的ms,由于空隙的内部空间,ms内部更多的空隙等于更少的聚合物。该高空隙体积的第二预期结果是ms中的肽含量降低。基质中较少的聚合物可导致ms内较少的肽包封。该高空隙体积的第三个预期影响是由制剂b12ms中快速释放包封的肽,与制剂b10基础ms的固体和更致密的基质相比具有更短的释放持续时间。
然而,出乎意料的是,在cor005的ivr和pk数据中未观察到所有三种预期结果。ivr数据(见下文)显示了制剂b12相比制剂b10延长和恒定释放cor005,并且pk显示了随着时间推移增加的血浆水平和高于制剂b10的制剂b12的绝对ba。
这些结果指向这样的事实,在cor005与dex的初级乳液情况中,肽不是浓集在plga基质内,而是在内部空隙的聚合物表面。因为cor005具有独特的表面活性剂活性,其导致肽与疏水性plga聚合物的高亲和性,所以它在聚合物与初级乳液的内部水相的界面处浓集。因此,在没有添加剂的ms固化阶段期间,大部分的cor005将浓集于在plga聚合物链之间。
然而,当添加dex时,在基质内产生产生的许多空隙呈现出许多小空间,其导致ms内的表面积增加。在这种情况下,ms的总表面积以显著高于具有相对固体基质的制剂b10ms的情况的方式增加。这导致cor005从b12的释放显著延长,而这之后在延长的时间内增加血浆水平,这可以通过从空隙的内表面而不是从固体聚合结构释放cor005来解释。只有当肽从表面释放时,该释放的动力学才与pk相关。
plgams中dex的另一意想不到的影响是其在ms的初级乳化和固化期间对cor005分散和分布的作用。结果表明,右旋糖提高了cor005在水中的溶解度(表3显示了5%右旋糖中>500mg/ml的高溶解度)。该作用可能是由于右旋糖和cor005之间潜在的氢键键合,其将肽构象变为更亲水的构象,其中较少的疏水性部分暴露在分子外。换言之,水对右旋糖的高氢键结合能力和亲和性可以帮助溶解肽。该作用导致改善ms内肽的分布体积和分酸。当将初级乳液添加到为水性pva相的二级乳液时,大多数的右旋糖从初生期(embryonic)ms渗漏至连续相。肽将再次采用其原始疏水构象,其对plga具有高亲和性,从而在空隙的界面表面和聚合物基质内浓集。这得到在最终ms中非常低的右旋糖回收的支持,在最终ms中仅检测到约0.5%的右旋糖,而不是4%的理论载量(下述表25)。
表25
含有hpb的b13制剂的外部和内部形态学
图23和24描述了制剂b13ms的外部和内部形态学的sem图像。图25描述了安慰剂ms的外部和内部形态学,所述安慰剂ms作为对照以与用于制剂b13的hpb相同的量制备(其中没有添加cor005乙酸盐)。如图23所示的制剂b13的外部形态学支持hpb作为plga-ms中多孔性试剂的预期作用。许多表面上的孔具有宽范围的孔直径。然而,图24显示了通过冷却切割进行切割后的制剂b13ms的内部结构,其指明了制剂b13与制剂b12内部形态学之间显著的差异。相较于制剂12中空隙的尺寸(图22),制剂b13的内部结构表现为空隙尺寸显著增加。此外,相较存在于制剂b12中高密度的许多小空隙,制剂b13中内部较大空隙的数量减少。这些结果表明,在制剂b13的情况中,由于内部空隙产生而增加的总表面积少于制剂b12的情况。
因此,相较于制剂b10和b12,由于内部表面积,预期制剂b13中cor005的包封率将降低。然而,cor005的包封率与这三种ms制剂相似。这意味着cor005将在ms的外壳附近以相对高的浓度浓集,这可能导致突释增加。此外,hpb和cor005之间的相互作用作为内含物复合物将导致hpb与肽的亲水性复合物浓度增加。由于hpb和cor005之间的这种相互作用,亲水性复合物将吸引更多的水并且将限制plga的固化效率,而这将最终导致具有相对较大孔的内部基质,如图23和24所示。
相较于dex,hpb的分子量显著地更高(与cor005大致相同),因此相较于dex较高的分布体积,hpb在ms内部空间中的移动性和分散性也受到限制。内部空隙明显更大的尺寸(如存在于制剂b13中的)以及与该内部表面区域相关的肽表面活性的后续作用与制剂b13的独特ivr和pk概况相关。当水进入制剂b13ms内部空间时,由于肽附近存在高hpb,出现肽的即释。如表25所示,大多数hpb保留在最终ms中,这导致与1:2理论hpb:pep比相同的hpb:pep比。此外,如表6所示,在这些条件下,处于注射位点的肽的表面活性降低。这两种作用的结果是大部分肽将作为亲水性复合物与hpb在ms中大空隙的内部空间的表面浓集。
该数据进一步支持大部分肽负荷在水渗透(注射后)早期阶段的即释,随后剩余的包封的肽的释放极差。此外,为了进一步确认cor005:hpb相互作用以及该独特的相互作用对包封肽的表面活性的影响,制备了b13的“安慰剂”ms制剂,其是基于hpb和plga组合作为制剂b13,但是不含肽cor005。图25显示了不含cor005乙酸盐的制剂b13的“ms”形态学的sem图像。该图像清楚地显示了包封不含cor005的hpb导致中空微胶囊而不是固体微球。更具体地,hpb在ms固化时保留水,可能在初生期ms中减缓plga固化。该作用将导致plga基质中明显更大的穴/孔(如对安慰剂的观测),其将远大于制剂b13中的穴/孔。该证据进一步支持了hpb和cor005之间的相互作用在plga-ms制剂中产生独特且意料之外的内表面。
图26显示了使用dex和赋形剂、不含肽cor005的制剂b12相似的“安慰剂”微球制剂的sem显微照片。这些图显示了仅用添加剂(无cor005)以与含肽制剂相同输入量制备的微球的外部和内部结构。安慰剂微球的外部形态学显示出非常少的表面孔。在内部,存在有限数量的大内部孔。该微球仅为具有中空核型的聚合物的“壳”。它们有时被成为微胶囊。不受任何特定假设的约束,一旦形成初级油包水乳液,仅wfi和添加剂的表面张力允许较小液滴聚结。聚乙烯醇(pva)将初生期微球(初级乳液)保持为离散液滴。溶剂蒸发过程相对较慢,从而允许初级乳液形成两相:含有添加剂的内部水相和由聚合物和二氯甲烷组成的外部聚合物溶液相。ms的表面具有很少的孔,这些孔通过在有机聚合物相内将水滴精细分散而产生。
在图23和24中,我们看到了连同hpb添加cor005的作用。内部水性相中表面张力的改变允许hpb和肽的较小液滴在整个溶剂蒸发过程中保持,如所述设定内部和表面结构。相似地,右旋糖和cor005的结合提供了具有大量小内部空隙的微球(图22)。
b14(psi12)范例和具有hpb的cor005的pk和改善的释放概况
制剂b13ivr和其pk概况意想不到的数据显示了大部分包封肽内含物的即释,然后是随时间推移显著低的血浆水平,该意想不到的数据提供了以降低的hpb:pep比设计ms制剂的基础。该反常理的ivr和pk结果显示了将hpb:pep比由1:2降至1:4甚至是1:8导致来自ms的肽释放的意想不到的增加。为了研究这些ivr和pk结果与cor005独特的表面活性之间的联系,对hpb:pep比降低的ms进行了评估它们内部形态学目的地详细sem分析。图27显示了比较各种hpb:pep比的cor005ms制剂内部基质形态学的sem图像。
从图27比较性sem图像可以看出,将hpb:pep比由1:2(制剂b13)降至1:4(制剂b14)并进一步降低至1:8和1:10导致这些微球内部介质中间隙数量意料之外的增长。此外,将比例由1:2降至1:4引起另一反常理的结果,即,ms外表面中的孔分布增加,如b14的hpb:pep1:4示例(相较于b13)所示。在如该比例sem图像所示的1:10最小hpb:pep比的情况中,降低hpb:pep比的相反/意料之外的作用进一步增强,其显示了具有显著密集分布的较小空隙的内部基质。
总之,随着hpb:pep比降低,更多的cor005取向于ms内部表面处。该独特的表面活性导致肽释放的增加和延长,这是主要由于肽从空隙填充增加的内部表面区域释放。因此,肽释放将随着时间推移而增强并延长,如制剂b14的情况下在ivr和pk研究中所观察到的。注意到,通过sem分析观测的hpb:pep比之间的相反关系也与这些不同的hpb:pep比的比较性ivr研究相关。
表面积
在micromeriticsasap2020仪器上使用氮气吸附测量微球的表面积。将15-25mg的微球添加到机器的分析管,并用专门的密封玻璃料将其密封在管内。分析分两个阶段进行:脱气和氮吸附测量。脱气是一种利用热量和真空去除微球内部的水分和其他残留气体的过程。将微球在真空(100μmhg)下脱气并在35℃下加热150分钟。然后将样品管转移到仪器的分析阀。将样品管放入杜瓦瓶中液氮冷却样品至77°k。氮气以受控方式添加,并且监测管压以产生吸附等温线。根据等温线,应用布伦纳-埃米特-特勒(brunauer-emmett-teller,bet)理论来计算各单位质量的表面积。分析时间约为4小时,各样品的总运行时间为6.5小时。
通过表面积测量再次证实了表面张力影响孔结构的概念。该测试对如上所述没有用赋形剂(psi-7)和用dex或hpb(psi-6和psi-12)制备的几个不同微球测试的结果总结在表26中。
表26
较高水平的表面积表示微球中内部空隙的数量较多。
包括维多瑞肽乙酸盐和右旋糖或hpb之一作为赋形剂的微球具有从约7m2/g至约12m2/g的多个聚合物微球的表面积,如从约7m2/g至约10m2/g。
相比之下,由plga和奥曲肽乙酸盐与0、0.2%或1%葡萄糖制备的微球分别具有4.4、4.7或4.9m2/g的表面积(biomaterials,2004,25,1919-1927)。
实施例5
使用80%(重量%)棉籽油、20%(重量%)注射用水(wfi)和1%(重量%)维多瑞肽乙酸盐将维多瑞肽配制成油包水乳液。具体地,将10mg维多瑞肽乙酸盐溶解于5ml玻璃小瓶中的200ulwfi,然后添加800mg棉籽油,然后将所得混合物以1000rpm在室温磁性搅拌下搅拌15分钟。然后在光学显微镜下观察乳液并在冷藏储存。得到的稳定的乳液,并且发现其可通过27g针注射。
也使用0.7%(w/v)羧甲基纤维素钠盐(sigmac5013)高黏度、37.5%(w/v)羟基丙基-β-环糊精和0.5%(w/v)维多瑞肽乙酸盐将维多瑞肽乙酸盐配制成水凝胶。具体地,10mg维多瑞肽乙酸盐与75mg羟基丙基-β-环糊精在2mlwfi中混合,然后在5ml玻璃药瓶中混合直到清澈。将14mg羧甲基纤维素钠盐通过浇铸缓慢地加入室温下磁力搅拌的混合物,然后冷藏储存。得到的水凝胶也发现可通过27g针注射。出人意料地,发现配制的顺序对凝胶稳定性十分重要。比起首先将羧甲基纤维素钠盐添加至维多瑞肽乙酸盐或者同时组合成分,将维多瑞肽乙酸盐与羟基丙基-β-环糊精组合后再添加羧甲基纤维素钠盐导致更强的水凝胶。有趣的是,将羟基丙基-β-环糊精与羧甲基纤维素钠盐单独组合并不导致凝胶形成。因此可以认为,并不受限于理论,聚合物因其独特的性质与环糊精和肽相互反应以导致形成稳定的凝胶。
以1mg各注射位点的剂量使用27g针头将乳液制剂和水凝胶注射到大鼠中,大鼠的每一侧使用一种制剂。直到给药后48小时,对于各制剂,并未在注射位点观察到肿胀。给药48小时后,仅在水凝胶的注射位点观察到肿胀,而对于乳液未见该情况。给药72小时后,对于凝胶制剂观察到肿胀和小伤口。乳液制剂的注射位点没有出任何显著的注射位点反应,没有观察到肿胀和脱毛。
处死大鼠,并进行尸体剖检以评估皮下注射位点反应。在72小时的水凝胶注射位点处,发现水肿和局部炎症的迹象,包括真皮的增厚。在48小时的乳液注射位点处,皮下组织是良性的,没有观察到肿胀、水肿、炎症或皮下增厚的迹象。
实施例6
通过将维多瑞肽乙酸盐和1,2-二肉豆蔻酰基-sn-甘油-3-磷脂酰胆碱(dmpc)以1:10的比例组合,通过将7mg维多瑞肽乙酸盐和70mgdmpc(14:0pc(dmpc)1,2-二肉豆蔻酰基-sn-甘油-3-磷脂酰胆碱850345(来自阿凡提公司(avanti),7重量%)在5ml玻璃小瓶中的1mlwfi中组合,将维多瑞肽乙酸盐配制成脂质体(多层囊泡)。使用磁力搅拌将混合物在室温下以1000rpm搅拌30分钟。如图28所示,使用sem成像分析该制剂。将脂质体冷藏保存。
用实施例3中乳酸载剂中的维多瑞肽乙酸盐注射两只大鼠。用维多瑞肽乙酸盐脂质体注射三只
经证明脂质体是一种用于以治疗浓度(>1-5ng/ml)进行至少48小时维多瑞肽乙酸盐缓释的合适递送载剂,这可与用于人的每周一次剂型相关联。可以理解是脂质体可以通过本领域技术人员已知的任何方法形成,并且维多瑞肽乙酸盐与脂质体试剂的比例可以在至少1:5至1:20的范围内。此外,可以使用任何药学上可接受的运载体或稀释剂。
实施例7
制备含有维多瑞肽乙酸盐的plga微球。将500mg的plga50:50(7-17kda)溶解于5ml二氯甲烷油相)。分开制备1mlddw中的含有50mg维多瑞肽乙酸盐的水相溶液(内部水性相)。使用高速均化器(宝创公司(polytron))在2-8℃使用不同速度和持续时间将第一水性相乳化成油相(含有plga)以形成油包水初级乳液。将第一乳液添加(逐滴)到100ml外部水相(含pbs中的1%pva溶液)以形成第二乳液。将pva溶解在pbs中的理由是为了将从水到外部相的维多瑞肽乙酸盐的泄漏量降至最低。然后将湿微球在冰中以1000rpm搅拌2小时以允许dcm蒸发并使微球固化。在pbs中洗涤三次后通过离心收集湿微球,然后悬浮在6ml的2%甘露醇中并冷冻干燥。将干燥微球的样品溶解于ddw:丙酮1:1,并且通过naovue分光光度计估计提取的肽量。微球中维多瑞肽乙酸盐的最终载药量为6重量%,并且包封率(ee)%为77%。
药物组合物的实施方式包括:
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;药学上可接受的运载体或稀释剂;和赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度,其中所述药学上可接受的盐选自:盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、乙酸盐、三氟乙酸盐、柠檬酸盐、草酸盐、丙二酸盐、水杨酸盐、对氨基水杨酸盐、苹果酸盐、富马酸盐、琥珀酸盐、抗坏血酸盐、马来酸盐、磺酸盐、膦酸盐、高氯酸盐、硝酸盐、甲酸盐、丙酸盐、葡萄糖酸盐、乳酸盐、酒石酸盐、双羟萘酸盐、羟基马来酸盐、丙酮酸盐、苯乙酸盐、苯甲酸盐、对氨基苯甲酸盐、对羟基苯甲酸盐、甲磺酸盐、乙磺酸盐、亚硝酸盐、羟基乙磺酸盐、乙烯磺酸盐、对甲苯磺酸盐、萘磺酸盐、氨基苯磺酸盐、樟脑磺酸盐、扁桃酸盐、邻甲基扁桃酸盐、氢苯磺酸盐、苦味酸盐、己二酸盐、d-邻甲苯酒石酸盐、丙醇二醇盐、α-甲苯甲酸盐、(邻、间、对)-甲苯磺酸盐、萘胺磺酸盐、辛酸盐、棕榈酸盐、硬脂酸盐、脂肪酸盐、其他无机酸盐和羧酸;药学上可接受的运载体或稀释剂;和赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;聚合物;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;形成微球的聚合物;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;形成微球的聚合物;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;形成微球的聚合物,其中聚合物是plga;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽或其药学上可接受的盐是维多瑞肽或其药学上可接受的盐;药学上可接受的运载体或稀释剂;和赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或药学上可接受的盐,其中肽或药学上可接受的盐是维多瑞肽或其药学上可接受的盐,其中所述药学上可接受的盐选自:盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、乙酸盐、三氟乙酸盐、柠檬酸盐、草酸盐、丙二酸盐、水杨酸盐、对氨基水杨酸盐、苹果酸盐、富马酸盐、琥珀酸盐、抗坏血酸盐、马来酸盐、磺酸盐、膦酸盐、高氯酸盐、硝酸盐、甲酸盐、丙酸盐、葡萄糖酸盐、乳酸盐、酒石酸盐、双羟萘酸盐、羟基马来酸盐、丙酮酸盐、苯乙酸盐、苯甲酸盐、对氨基苯甲酸盐、对羟基苯甲酸盐、甲磺酸盐、乙磺酸盐、亚硝酸盐、羟基乙磺酸盐、乙烯磺酸盐、对甲苯磺酸盐、萘磺酸盐、氨基苯磺酸盐、樟脑磺酸盐、扁桃酸盐、邻甲基扁桃酸盐、氢苯磺酸盐、苦味酸盐、己二酸盐、d-邻甲苯酒石酸盐、丙醇二醇盐、α-甲苯甲酸盐、(邻、间、对)-甲苯磺酸盐、萘胺磺酸盐、辛酸盐、棕榈酸盐、硬脂酸盐、脂肪酸盐、其他无机酸盐和羧酸;药学上可接受的运载体或稀释剂;和赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽或其药学上可接受的盐是维多瑞肽或其药学上可接受的盐;聚合物;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽或其药学上可接受的盐是维多瑞肽或其药学上可接受的盐;形成微球的聚合物;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:维多瑞肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;形成微球的聚合物,其中聚合物是plga;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;聚合物;和赋形剂;其中药物组合物是凝胶。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有低溶解度;油相;水相,其中肽或其药学上可接受的盐作为乳化剂;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸;其中药物组合物形成乳液。
一种药物组合物,其包括:肽或其药学上可接受的盐,其中肽是水溶性的,但是在等渗条件下具有较慢的溶解性;药学上可接受的运载体或稀释剂;和形成脂质体的脂质体试剂;和任选的赋形剂,其中赋形剂是疏水性清除剂、糖或氨基酸。
前述药物组合物中的任一项的实施方式包括:
该药物组合物,其中肽或其药学上可接受的盐是:环状肽;肽两亲物;或生长激素抑制素类似物;或环状生长激素抑制素类似物;构象受限的主链环状肽;或构象受限的主链环状生长激素抑制素类似物;或构象受限的主链环状单胺生长激素抑制素类似物;或离子,水溶性表面活性剂。
该药物组合物,其中药学上可接受的盐是乙酸盐;或选自下述的盐:盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、乙酸盐、三氟乙酸盐、柠檬酸盐、草酸盐、丙二酸盐、水杨酸盐、对氨基水杨酸盐、苹果酸盐、富马酸盐、琥珀酸盐、抗坏血酸盐、马来酸盐、磺酸盐、膦酸盐、高氯酸盐、硝酸盐、甲酸盐、丙酸盐、葡萄糖酸盐、乳酸盐、酒石酸盐、双羟萘酸盐、羟基马来酸盐、丙酮酸盐、苯乙酸盐、苯甲酸盐、对氨基苯甲酸盐、对羟基苯甲酸盐、甲磺酸盐、乙磺酸盐、亚硝酸盐、羟基乙磺酸盐、乙烯磺酸盐、对甲苯磺酸盐、萘磺酸盐、氨基苯磺酸盐、樟脑磺酸盐、扁桃酸盐、邻甲基扁桃酸盐、氢苯磺酸盐、苦味酸盐、己二酸盐、d-邻甲苯酒石酸盐、丙醇二醇盐、α-甲苯甲酸盐、(邻、间、对)-甲苯磺酸盐、萘胺磺酸盐、辛酸盐、棕榈酸盐、硬脂酸盐、脂肪酸盐、其他无机酸盐和羧酸。
该药物组合物,其中赋形剂是糖,并且其中糖为:糖类;或选自单糖、二糖和多糖;或环状多糖;或环糊精;或β-环糊精;或羟基丙基-β-环糊精;或单糖;或右旋糖;或基于组合物的总重量处于约2.5重量%至约5.0重量%的浓度。
该药物组合物,其中所述赋形剂是氨基酸并且是天然氨基酸,并且其中氨基酸是赖氨酸或精氨酸;或者氨基酸的盐酸盐;或l-赖氨酸盐酸盐或l-精氨酸盐酸盐。
该药物组合物,其中赋形剂是疏水性清除剂,并且其中疏水性清除剂具有至少一个游离的胺基。
该药物组合物,其中药学上可接受的运载体或稀释剂是选自:等渗乙酸盐缓冲液,乳酸,盐水和磷酸缓冲的盐水;或盐水;或以该组合物的重量计处于约0.45重量%的浓度。
该药物组合物,其中聚合物是生物相容的;或形成基质;或形成颗粒;或形成微球。
该药物组合,其中该微球:相较于不用赋形剂配制的微球,其多孔性增加;或相较于不用赋形剂配制的微球,其表面积增加;或相较于不用赋形剂配制的微球,其肽释放增加;或相较于不用赋形剂配制的微球,其在将药物组合物注射到患者后第一个24小时时段内肽的释放增加;或在将药物组合物注射到患者后表现出至少一周的缓释概况;或在将药物组合物注射到患者后表现出至少两周的缓释概况;或在将药物组合物注射到患者后表现出至少四周的缓释概况。
该药物组合物,其中聚合物是聚乳酸-共-乙醇酸(plga);或其中聚乳酸-共-乙醇酸(plga)包括50:50比例的乳酸与乙醇酸。
该药物组合物,其中聚合物包封:肽或其药学上可接受的盐;或赋形剂;或肽或其药学上可接受的盐和赋形剂两者。
该药物组合物,其中聚合物的平均分子量是约7-约17千道尔顿;或其分子量是约38-约45千道尔顿。
该药物组合物,其中肽和赋形剂被共定位于聚合物内。
该药物组合物,其中药学上可接受的盐是维多瑞肽乙酸盐。
该药物组合物,其中聚合物包封维多瑞肽或其药学上可接受的盐;或赋形剂;或肽或药学上可接受的盐和赋形剂两者;或维多瑞肽或其药学上可接受的盐和赋形剂两者。
该药物组合物,其中维多瑞肽和赋形剂被共定位于聚合物内。
该药物组合物,其中聚合物包封维多瑞肽或其药学上可接受的盐;或赋形剂;或维多瑞肽或其药学上可接受的盐和赋形剂两者。
该药学组合物,其中聚合物是粘度改性剂;或是增稠剂;或是凝胶形成剂(胶凝剂);或在1%水性溶液中具有1500-3000cps的平均粘度;或是纤维素胶或其衍生物;或是羧甲基纤维素;或与肽或其药学上可接受的盐相互作用;或与肽和环糊精相互作用以形成凝胶。
该药物组合物,其中药学组合物可以通过小至27g的小号针头注射。
该药物组合物,其是一种乳液,其中油相包括药学上可接受的油;或棉籽油;或其中水相包括水;或乳液是油包水乳液;或油相与水相之比如下:约60:40至99.9:0.1之间;或约70:30至99.9:0.1之间;或约80:20至99.9:0.1之间;或约90:10至99.9:0.1之间;或约95:5至99.9:0.1之间;或约50.1:49.9至90:10之间;或约50.1:49.9至80:20之间;或约50.1:49.9至70:30之间;或约50.1:49.9至60:40之间;或约60:40至90:10之间;或约70:30至80:20之间;或约80:20。
该药物组合物,其中脂质体试剂是:磷脂酰胆碱或其衍生物;或dmpc。
其它实施方式包括:
一种相较于不存在赋形剂的注射的情况用于在患者中减少注射位点副作用的方法,其包括:(a)配制具有赋形剂的上述实施方式中任一项所述的药物组合物;并且(b)将药物组合物通过注射给予所述患者。
一种相较于不存在赋形剂的注射的情况用于增加肽或其药学上可接受的盐的生物利用度的方法,其包括:(a)配制具有赋形剂的上述实施方式中任一项所述的药物组合物;并且(b)将药物组合物通过注射给予所述患者。
对于该方法,其中肽或其药学上可接受的盐以治疗有效剂量给予。
一种用于配制上述实施方式中任一项所述的药物组合物的方法,其包括:(a)将肽或其药学上可接受的盐与赋形剂混合;并且(b)缓慢地添加聚合物。
一种治疗疾病的方法,其包括向有此需要的患者给予上述实施方式中任一项所述的药物组合物。
对于该方法,其中疾病选自:癌症,ii型糖尿病,肢端肥大症,代谢紊乱,内分泌失调,外分泌失调,和激素相关的肿瘤。
对于该方法,其中,所述药物组合物的通过注射,或皮下注射,或静脉内注射给予。
实施方式1的药物组合物的具体实施方式包括下述:
2.该药物组合物,其中药学上可接受的盐选自:盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、乙酸盐、三氟乙酸盐、柠檬酸盐、草酸盐、丙二酸盐、水杨酸盐、对氨基水杨酸盐、苹果酸盐、富马酸盐、琥珀酸盐、抗坏血酸盐、马来酸盐、磺酸盐、膦酸盐、高氯酸盐、硝酸盐、甲酸盐、丙酸盐、葡萄糖酸盐、乳酸盐、酒石酸盐、双羟萘酸盐、羟基马来酸盐、丙酮酸盐、苯乙酸盐、苯甲酸盐、对氨基苯甲酸盐、对羟基苯甲酸盐、甲磺酸盐、乙磺酸盐、亚硝酸盐、羟基乙磺酸盐、乙烯磺酸盐、对甲苯磺酸盐、萘磺酸盐、氨基苯磺酸盐、樟脑磺酸盐、扁桃酸盐、邻甲基扁桃酸盐、氢苯磺酸盐、苦味酸盐、己二酸盐、d-邻甲苯酒石酸盐、丙醇二醇盐、α-甲苯甲酸盐、(邻、间、对)-甲苯磺酸盐、萘胺磺酸盐、辛酸盐、棕榈酸盐、硬脂酸盐、脂肪酸盐、其他无机酸盐和羧酸。
3.如实施方式1或2所述的药物组合物,其中药学上可接受的盐是肽的乙酸盐。
4.如实施方式1-3中任一项所述的药物组合物,其中药学上可接受的运载体或稀释剂选自:等渗乙酸盐缓冲液,0.9%nacl水溶液或0.45%nacl水溶液构成的常规盐水,注射用水,等渗5%或2.5%右旋糖,等渗乳酸和磷酸缓冲盐水。
5.如实施方式1-4中任一项所述的药学组合物,其中药学上可接受的运载体是0.9%nacl水溶液或0.45%nacl水溶液构成的盐水。
6.如实施方式1-5中任一项所述的药学组合物,其中药学上可接受的运载体或稀释剂是常规盐水(0.9%nacl水溶液)。
7.如实施方式1-6中任一项所述的组合物,其中肽或其药学上可接受的盐分别是维多瑞肽或维多瑞肽乙酸盐。
8.如实施方式1-7中任一项所述的药物组合物,其中肽是维多瑞肽。
9.如实施方式1-8中任一项所述的方法,其中肽的药学上可接受的盐是维多瑞肽乙酸盐。
10.如实施方式1-9中任一项所述的药物组合物,其中赋形剂是环状多糖。
11.如实施方式10所述的药物组合物,其中环状多糖是羟基丙基-β-环糊精。
12.如实施方式11所述的药物组合物,其中羟基丙基-β-环糊精与肽或其药学上可接受的盐的质量比是1:1至20:1。
13.如实施方式12所述的药物组合物,其中羟基丙基-β-环糊精与肽或其药学上可接受的盐的质量比是1:1。
14.如实施方式12所述的药物组合物,其中羟基丙基-β-环糊精与肽或其药学上可接受的盐的质量比是20:1。
15.如实施方式1-9中任一项所述的药物组合物,其中赋形剂是右旋糖。
16.如实施方式15所述的药物组合物,其中右旋糖与肽或其药学上可接受的盐的质量比是1:1至约5:1;优选5:1。
17.如实施方式16所述的药物组合物,其中右旋糖与肽或其药学上可接受的盐的质量比是5:1。
18.如实施方式1-10中任一项所述的药物组合物,其包括:
维多瑞肽乙酸盐;药学上可接受的运载体或稀释剂,其选自:等渗乙酸盐缓冲液,等渗乳酸,水,0.9%nacl水溶液或0.45%nacl水溶液构成的盐水,注射用水,等渗的5%或2.5%右旋糖,和磷酸缓冲盐水;和羟基丙基-β-环糊精(hpbcd)。
19.如实施方式18所述的药物组合物,其中羟基丙基-β-环糊精与维多瑞肽乙酸盐的质量比是1:1至25:1。
20.如实施方式19所述的药物组合物,其中羟基丙基-β-环糊精与维多瑞肽乙酸盐的质量比是1:1。
21.如实施方式19所述的药物组合物,其中羟基丙基-β-环糊精与维多瑞肽乙酸盐的质量比是25:1。
22.如实施方式18-21所述的药学组合物,其中所述药学上可接受的运载体是用于注射的nacl水溶液或0.45%nacl水溶液构成的盐水。
23.如实施方式1、2、3、4、5、6、7、8或15中任一项所述的药物组合物,其包括:维多瑞肽乙酸盐;药学上可接受的运载体或稀释剂,其选自:等渗乙酸盐缓冲液,注射用水,用于注射的0.9%nacl水溶液或0.45%nacl水溶液构成的盐水,等渗乳酸,等渗的5%或2.5%右旋糖,和磷酸缓冲盐水;和右旋糖。
24.如实施方式23所述的药物组合物,其中右旋糖与维多瑞肽乙酸盐的质量比是1:1至约5:1。
25.如实施方式23所述的药物组合物,其中右旋糖与维多瑞肽乙酸盐的质量比是5:1。
26.如实施方式23-25所述的药学组合物,其中所述药学上可接受的运载体是用于注射的nacl水溶液或0.45%nacl水溶液构成的盐水。
27.如实施方式1-26中任一项所述的药物组合物,其包括:
肽或其药学上可接受的盐,其中所述肽或其药学上可接受的盐易溶解于水;但是在生理条件下微溶;赋形剂,其中赋形剂是环状多糖或右旋糖或其组合;和
聚合物微球,其中肽或其药物上可接受的盐以及赋形剂被包封在聚合物微球中。
28.如实施方式27所述的药物组合物,其中聚合物微球包括聚(乳酸-共-乙醇酸)(plga)。
29.如实施方式27或28所述的药物组合物,其中赋形剂是右旋糖。
30.如实施方式27-29所述的药物组合物,其中右旋糖的量是根据所述聚合物微球的总重量的约0.1重量%至约1.0重量%。
31.如实施方式27-30中任一项所述的药物组合物,其包括:维多瑞肽乙酸盐;右旋糖;和聚合物微球,其中聚合物微球包括聚(乳酸-共-乙醇酸)(plga),并且其中维多瑞肽和右旋糖被包封在聚合物微球中。
32.如实施方式27或28所述的药物组合物,其中赋形剂是环状多肽。
33.如实施方式27所述的药物组合物,其中环状多糖是羟基丙基-β-环糊精(hpbcd)。
34.如实施方式27、28、32或33中任一项所述的药物组合物,其中hpbcd的量是根据组合物的总聚合物(plga)重量的约2重量%至约20重量%。
35.如实施方式27、28、32、33或34中任一项所述的药物组合物,其包括:维多瑞肽乙酸盐;羟基丙基-β-环糊精(hpbcd);和聚合物微球,其中聚合物微球包括聚(乳酸-共-乙醇酸)(plga),并且其中维多瑞肽乙酸盐和hpbcd被包封在聚合物微球中。
36.如实施方式27或28所述的药物组合物,其包括:维多瑞肽乙酸盐;右旋糖和hpbcd;和聚合物微球,其中聚合物微球包括聚(乳酸-共-乙醇酸)(plga),并且其中维多瑞肽、右旋糖和hpbcd被包封在聚合物微球中。
37.如实施方式27-36中任一项所述的药物组合物,其中聚合物微球体的直径是约10微米至约100微米,更优选的约10微米至约30微米。
实施方式38:一种制备聚合物微球的方法,其包括以下步骤:
(i)将含有环状多糖或右旋糖或其组合的赋形剂以及肽或其药学上可接受的盐混合在水中以形成第一水性混合物,其中肽或其药学上可接受的盐易溶解于去离子水,其在去离子水中的溶解度为100至350mg/ml,但是在生理条件下以2-3mg/ml的溶解度微溶,并且所述肽或药学上可接受的盐经盐析沉淀的浓度大于3mg/ml;
(ii)将聚合物混合在有机溶剂如二氯甲烷中以形成聚合物溶液;
(iii)将第一水性混合物混合在聚合物有机溶液中以形成包括油包水初级乳液的第一分散体混合物;
(iv)将聚乙烯醇(pva)以0.1至3重量%的量混合在磷酸盐缓冲盐水或盐水中以形成第二水性混合物;
(v)将初级乳液混合在pva的第二水性混合物中以形成水包油包水双重乳液以提供二级分散体混合物;
(vi)允许二级分散体混合物中的有机溶剂蒸发以形成固体聚合物微球,其中肽或其药学上可接受的盐被包封在聚合物微球中;
(vii)洗涤并分离聚合物微球;并且
(viii)在干燥过程期间添加或不添加表面活性剂和甘露糖醇混合物的控制条件下干燥微球。
39.如实施方式38所述的方法,其中赋形剂是环状多糖,并且环状多糖与肽或其药学上可接受的盐的质量比是约1:2至约1:20。
40.如实施方式39所述的方法,其中环状多糖是羟基丙基-β-环糊精(hpbcd)。
41.如实施方式39所述的方法,其中hpbcd与肽或其药学上可接受的盐的质量比是约1:2至约1:4。
42.如实施方式38所述的方法,其特征在于,所述赋形剂是右旋糖,并且右旋糖与肽或其药学上可接受的盐的质量比是1:4至1:16。
43.如实施方式42所述的方法,其中右旋糖与肽或其药学上可接受的盐的质量比是1:6至1:10。
44.如实施方式42或43所述的方法,其中右旋糖与肽或其药学上可接受的盐的质量比是1:8。
45.如实施方式38-44中任一项所述的方法,其中肽或其药学上可接受的盐分别是维多瑞肽或维多瑞肽乙酸盐。
46.如实施方式38-45中任一项所述的方法,其中聚合物溶液包括聚(乳酸-共-乙醇酸)(plga)。
实施方式47:一种通过实施方式38-46中任一项所述的方法产生的缓释药物组合物。
实施方式48:一种用于制备聚合物微球的组合物,其包括:维多瑞肽或其药学上可接受的盐;包括环状多糖或右旋糖或其组合的赋形剂;和聚合物溶液。
49.如实施方式48所述的组合物,其中赋形剂是环状多糖羟基丙基-β-环糊精(hpbcd)。
50.如实施方式49所述的组合物,其中hpbcd与维多瑞肽或其药学上可接受的盐的质量比是约1:1至约1:20;或约1:2至约1:4;或约1:4。
51.如权利要求48所述的组合物,其中述赋形剂是右旋糖。
52.如实施方式51所述的组合物,其中右旋糖与维多瑞肽或其药学上可接受的盐的质量比是1:4至1:16;或1:6至1:10;或是1:8。
53.如实施方式48-52中任一项所述的组合物,其中聚合物溶液包括聚(乳酸-共-乙醇酸)(plga)。
实施方式54:一种用于治疗患有下述疾病或病症对象的方法:肢端肥大症、肢端肥大症癌症、良性肿瘤、库欣综合症(cushing’ssyndrome)、sst-r5表达型肿瘤、ii型糖尿病、高血糖症和激素相关的肿瘤,所述方法包括:向患有所述疾病或病症的对象给予实施方式1-37中任一项所述的药物组合物。
55.如实施方式54所述的方法,其中药物组合物通过注射给予。
56.如实施方式54所述的方法,其中药物组合物通过皮下注射给予。
57.如实施方式54所述的方法,其中药物组合物通过肌肉内注射给予。
58.如实施方式54-57中任一项所述的方法,其中药物组合物分散于药学上可接受的稀释剂中,所述稀释剂包括待用于注射的等渗溶液中的表面活性剂和甘露糖醇。
尽管根据具体的实施方式描述了本发明,但可以在不背离本发明范围的情况下进行改变和修改,本发明范围应仅受权利要求书范围的限制。
- 还没有人留言评论。精彩留言会获得点赞!