基于感测到的病变特征给出治疗建议的医疗设备的制作方法
本申请依据35u.s.c.§119(e)的规定要求于2016年4月11日提交的、题为“medicaldevicemakingtreatmentrecommendationsbasedonsensedcharacteristicsofalesionofaduct”的美国临时专利申请序列号为62/321,001的优先权,其内容整体并入本文。
背景技术:
血管(包括静脉或动脉)的堵塞可能发生在动物(例如,人或非人类动物)的各个部位中,并且可能产生严重的后果。例如,在缺血性中风中,血凝块完全或部分地阻塞脑动脉中的血流。如果凝块未得到快速治疗,血流不足可能会对大脑造成不可挽回的损害。
堵塞可能是由血凝块引起的,血凝块可能是由血管内的红细胞和/或白细胞和/或血小板凝固引起的。凝血可以由多种因素引发,包括受伤、堵塞部位的异常血流、使动物易于凝血的疾病/条件和/或其他因素。
对凝块的常见处理是化学溶解凝块,这在血管堵塞后的最初4.5小时内是可行的。另一种常见的选择是机械血栓切除术,其中使用抽吸导管或支架-取出器从血管中去除血凝块。
支架-取出器包括附接在线末端的支架。支架在脉管系统中展开并进入凝块,扩张到凝块中,并且一般在0.5至10分钟的等待时间之后,抽出支架以将凝块从血管中拉出。由于支架-取出器不能最佳地抓住凝块,凝块的某些部分可能会被取出器遗留或丢失,因此,可能需要几次连续治疗(平均3次)来治疗血管堵塞并恢复血管中的流通。每次重复都会增加对血管壁的损伤,并且由于堵塞而增加干预持续时间和阻塞血流的持续时间,这可能导致对动物无法修复的损伤。目前对凝块抓取的生理机械过程知之甚少,但对于不能最佳抓取凝块的两种最常见的解释是:(1)支架-取出器无法布置到血凝块中,而只有由支架-取出器将血凝块推向血管壁引起的摩擦使得血凝块被取出,(2)支架布置到血凝块中,但是没有足够的时间使支架与血凝块结合。
如果使用抽吸导管去除血凝块,则临床医生将导管插入到脉管系统中并操作导管以将凝块吸入导管中。根据导管的直径,导管可以布置成与凝块直接接触或布置在血管的近端区域。根据凝块的组成和粘度,抽吸方法可能是不同的。抽吸导管可能会面临一些难题。例如,一旦凝块被吸入导管中,它就会阻塞导管内的流动。在这种情况下,临床医生在不拔出导管的情况下可能不知道凝块是阻塞了导管的尖端还是在导管内并阻塞了管。如果凝块堵塞了导管的尖端,则存在在移除导管期间可能无意中释放凝块的风险,这样,凝块可能成为穿过血流并阻塞动物的另一部位的血管的栓塞。
技术实现要素:
所描述的实施例涉及包括侵入式探针的医疗设备,当插入到动物(例如,人类或非人类动物,包括人类或非人类哺乳动物)时,该侵入式探针可以帮助诊断和/或治疗病变(例如,导管(例如脉管系统)内的完全或部分阻塞导管的生长或沉积物)。侵入式探针可以具有一个或更多个传感器以感测病变的特征,包括检测病变的组织和/或生物物质的一个或更多个特征。医疗设备可以被配置成分析病变的特征,并且基于该分析,向临床医生提供治疗建议。这种治疗建议可以包括治疗病变的方式,例如使用哪种治疗方法来治疗病变和/或使用治疗设备的方式。在一些情况下,本发明的主题涉及相互关联的产品、特定问题的替代解决方案和/或一个或更多个系统和/或物品的多种不同用途。
在一个实施例中,提供了用于诊断和/或治疗动物病变的医疗设备。该医疗设备包括侵入式探针、至少一个处理器和至少一个存储介质。该侵入式探针用于插入到动物中并在诊断和/或治疗后从动物中取出,该侵入式探针包括至少一个传感器;该至少一个存储介质上编码有可执行指令,可执行指令在由至少一个处理器执行时使该至少一个处理器执行方法。该方法包括使用至少一个传感器识别病变的组成,其中,识别病变的组成包括确定病变中存在的一种或更多种生物物质,并至少部分地基于该组成来识别病变的至少一个特征。
在另一个实施例中,提供了操作用于诊断和/或治疗动物病变的医疗设备的方法。该医疗设备包括侵入式探针,其被插入到动物中,并在诊断和/或治疗病变之后从动物中取出。该方法还包括当医疗设备的侵入式探针设置在动物内时,利用侵入式探针生成数字信号,该数字信号指示由侵入式探针在病变的多个位置处测量的、病变的多种生物物质的阻抗谱,其中生成数字信号包括:操作侵入式探针以在多个频率下施加电信号,并操作侵入式探针的多个传感器以测量病变的多种生物物质的阻抗。该方法还包括至少部分地基于对数字信号的分析来识别病变,使用医疗设备的至少一个处理器并且至少部分地基于对数字信号和/或病变的标识的分析来确定治疗病变的方式的一个或更多个治疗建议,以及输出一个或更多个治疗建议以通过用户界面呈现给用户。
在又一实施例中,提供了一种操作用于诊断和/或治疗动物病变的医疗设备的方法,该医疗设备包括侵入式探针,其被插入到动物中,并在诊断和/或治疗病变之后从动物中取出。该方法包括当医疗设备的侵入式探针设置在动物内时,利用侵入式探针生成指示动物病变中存在的生物物质的一种或更多种电特性的数据,其中生成数据包括:操作侵入式探针的至少一个传感器以测量病变中存在的生物物质的一种或更多种电特性,以及输出指示该一种或更多种电特性的信息,以便通过用户界面呈现给用户。
在另一个实施例中,提供了一种方法,包括操作至少一个处理器以执行以下动作:随着时间的推移,从多个医疗设备接收关于对多个动物病变进行的医学治疗的多个报告,该多个报告中的每个报告包括:在相应的医学治疗中治疗的病变的一个或更多个特征,为治疗病变而进行的相应医学治疗的一个或更多个参数,以及相应医学治疗结果的指示;随着时间的推移并基于机器学习过程对多个医学治疗报告的应用,学习病变特征与病变治疗成功和/或不成功的参数之间的一个或更多个关系,其中学习一个或更多个关系包括确定与多个治疗方案中的每个治疗方案相关联的一个或更多个条件,其中该一个或更多个条件与病变的特征有关,使得当病变的特征满足相应治疗方案的一个或更多个条件时,推荐相应的治疗方案用于治疗病变;基于对与多个治疗方案中的每一个相关联的一个或更多个条件对病变的特征的评估,配置该多个医疗设备以从多个治疗方案中向临床医生提供建议。
在另一实施例中,提供了至少一个存储介质,其上编码有可执行指令,当由至少一个处理器执行时,可执行指令使得该至少一个处理器执行任何前述方法。
在另一实施例中,提供了一种装置,包括至少一个处理器和至少一个其上编码有可执行指令的存储介质,当由至少一个处理器执行该可执行指令时,使至少一个处理器执行任何前述方法。
在另一个实施例中,提供了诊断和/或治疗动物病变的方法,该方法包括:将医疗设备的侵入式探针插入到动物中,其中侵入式探针包括至少一个传感器,以测量病变的多种生物物质中的每一种的一个或更多个特征;至少部分地基于病变的多种生物物质中的每一种的一个或更多个特征来识别病变;至少部分地基于多种生物物质中的每一种的一个或更多个特征和/或病变的标识来操作医疗设备以生成关于治疗病变的一个或更多个建议;根据医疗设备的一个或更多个建议来治疗病变;以及从动物的导管中移除侵入式探针。
当结合附图考虑本发明的各种非限制性实施例的以下详细描述时,本发明的其他优点和新颖特征将变得显而易见。在本说明书和通过引用并入的文件包括冲突和/或不一致的公开内容的情况下,本说明书应当起决定作用。因此,前述内容是本发明的非限制性概述,其由所附权利要求限定。
附图说明
附图不是按比例绘制的。在附图中,在各个图中示出的每个相同或几乎相同的部件由相同的数字表示。为清楚起见,并非每张图中都标记了每个部件。在图中:
图1是根据本文描述的实施例的、临床医生可以操作医疗设备以诊断和/或治疗病变的方式的流程图;
图2是根据一些实施例的医疗设备的示例的图示;
图3是根据一些实施例的侵入式探针的示例的图示;
图4-5是可以在一些实施例中实现以确定病变的组成的过程的流程图;
图6是病变阻抗模数的示例性频谱的表示;
图7至图10示出了可以在图4的方法中实现的病变阻抗的示例性模型,包括恒定相位元件;
图11示出了用于实现图4的方法的示例性系统;
图12是用于操作根据本文描述的一些实施例的医疗设备以生成治疗建议的说明性方法的流程图;
图13是用于操作根据本文描述的实施例的医疗设备以部分地基于病变的组成生成治疗建议的一些实施例的另一说明性方法的流程图;
图14是可以在一些实施例中实现的使用条件来生成治疗建议的说明性方式的流程图;
图15a-15b是可以在一些实施例中实现的用于操作服务器来分析治疗报告以确定配置医疗设备的条件的说明性过程的流程图;
图16是可以在一些实施例中实现的用于生成治疗记录的过程的示例;
图17是一些实施例可以操作的计算设备的框图;
图18-20是用于操作根据本文描述的实施例的医疗设备的一些实施例的说明性方法的流程图,以部分地基于癌性和/或非癌性组织的特征生成治疗建议;
图21是示出了结合本文所述的一些技术的临床前动物试验的一些结果的直方图。
具体实施方式
本文描述的一些实施例涉及包括侵入式探针的医疗设备,当插入动物(例如,人类或非人类动物,包括人类或非人类哺乳动物)时,该侵入式探针可以帮助诊断和/或治疗动物的病变。病变可以是动物生物结构的异常,例如与动物的一部分的正常结构和/或功能的偏离,例如与伤害、医疗症状或疾病相关的异常。病变可能出现在动物的不同部位,包括在动物的导管内。例如,导管的病变可以是完全或部分阻塞导管的堵塞。导管可以是例如动物的血管或其他导管,并且病变可以全部或部分地由导管中的生长、导管中的物质积聚和/或病变的任何其他原因形成。侵入式探针可具有一个或更多个传感器以感测病变的特征,其可包括检测病变的组成。在一些实施例中,检测病变的组成可包括识别病变的一种或更多种生物物质,包括存在于病变中的一种或更多种细胞和/或一种或更多种组织,和/或存在于病变中的一种或更多种斑块物质。在一些这样的实施例中,侵入式探针可以至少部分地基于病变的组成(例如,病变的一种或更多种生物物质)来确定作为整体的病变的一种或更多种其他特征,在一些实施例中,包括通过识别病变和/或分类病变。在一些实施例中,识别或分类病变可包括诊断病变。医疗设备可以被配置成分析病变的特征,并且基于该分析,向临床医生提供治疗建议。这样的治疗建议可以包括治疗病变的方式,例如使用哪种治疗方法来治疗病变(例如,如果要移除病变,是否使用抽吸导管或支架-取出器)和/或使用治疗设备的方式(例如,抽出支架-取出器的速度有多快)。
在一些实施例中,侵入式探针可包括一个或更多个传感器,可包括用于测量病变的阻抗的传感器。当具有特定频率的电信号施加到病变时,传感器可以测量病变的阻抗。医疗设备可以被配置成基于阻抗值确定病变的组成和病变的一个或更多个特征。例如,在一些实施例中,每个传感器都可以被操作以检测接触该传感器的生物物质的阻抗谱,这样,侵入式探针的不同传感器可以同时为病变的不同生物物质生成不同的阻抗谱。然后,医疗设备可以部分地基于所确定的组成来生成治疗建议。
本文描述的各示例将在脉管系统病变和治疗脉管系统病变的方式的背景下讨论医疗设备。然而,应该理解,实施例不限于此。本文描述的用于感测病变的特征和生成治疗建议的技术可以用于任何合适的病变,包括动物的解剖学导管的任何合适的病变或可以出现在动物的解剖结构内的其他位置的病变。在病变是导管的病变的情况下,这样的导管可包括例如脉管系统和胃肠导管。本领域技术人员应当理解,解剖学中的导管与解剖学腔不同。例如,导管在一个维度(例如,宽度)上可以明显小于另一个维度(例如,长度)。
因此,在一些实施例中,侵入式探针可以是用于诊断和/或治疗脉管系统病变的医疗设备的组件。例如,医疗设备可以是血栓切除设备,侵入式探针可以是该血栓切除设备的组件。因此,侵入式探针可以是导丝、抽吸导管、微导管、支架-取出器和/或另一血栓切除设备的组件。在一些实施例中,医疗设备可包括导丝、抽吸导管和支架-取出器中的两个或更多个,并且侵入式设备可以是这些中的一个或更多个的组件,包括可以是所有这些的组件。
发明人已经认识并理解,用于基于病变的电测量来识别病变、包括识别导管中的病变类型的典型传统技术是非常不准确且不可靠的,以至于它们不能有效地用于医疗环境中。这些常规技术中的一些涉及:针对各种类型的病变中的每一种,生成全部病变的大量阻抗谱,并且为每种类型的病变生成“平均”阻抗谱。然而,病变因人而异,甚至在同一个人内也不同,使得为病变整体生成准确或代表性的“平均”或“标准”阻抗谱是不切实际的。一些这样的常规技术试图通过采用严格的测量过程来提高可靠性,其在确定“标准”谱期间,针对每次测量需要精确定位接触病变的传感器以及在随后对患者使用期间的相同测量位置。这种精确定位在实践中几乎不可能实现,并且仍然不能将可靠性提高到可以以足够的精确度使用这些技术以有助于与患者一起使用的程度。例如,在对患者使用期间,需要测量患者病变的阻抗谱,需要将测量结果与每种类型病变的多个“标准”谱进行比较,并需要进行计算密集型统计分析以确定病变的类型。然而,对于典型的常规技术,即使是这些复杂的分析产生的结果的置信度也仅略高于50%。
一些实施例涉及用于识别病变类型的方法,该方法不涉及使用整体病变的“标准”阻抗谱数据库,或不涉及用于比较这种整体病变阻抗谱的统计分析。这些实施例中的一些被配置成通过识别病变的组成来表征病变,例如识别病变中存在的生物物质的类型和数量。这可以包括识别病变的一种或更多种组织和/或细胞,和/或病变中存在的一种或更多种斑块物质。在一些这样的实施例中,然后可以分析病变的组成以高置信度识别病变的特征。病变的这些特征可以包括病变的类型,并且实施例可以包括诊断病变。在一些实施例中,可以将病变的组成与一种或更多种与病变类型相关的条件进行比较,例如,确定特定类型的病变与特定组成(例如,一组特定的生物物质,或生物物质的特定相对量)相关联的条件。一旦由特定组成满足与一种病变类型相关联的条件而确定该特定组成与该类型匹配,则具有该组成的病变可以被识别为该类型。基于识别病变的生物物质来识别病变可以具有很高的可靠性(例如,大于90%)。
发明人进一步认识并理解,常规医疗设备,包括常规血栓切除设备,不提供关于包括血管在内的脉管系统的损伤特征的信息,常规医疗设备也不提供关于病变治疗状态的信息。发明人还认识到并理解,信息的这种缺乏导致了治疗病变的困难。例如,在没有病变组成的信息的情况下,临床医生可能难以在可用的治疗方案之间进行选择,因为每种治疗方案可能对不同组成的病变最有效。此外,在没有病变治疗状态的信息的情况下,临床医生可能不知道治疗是成功还是不成功。由于信息的这种缺乏,可能需要多次治疗才能正确治疗病变。每次这样的治疗都增加了患者受伤的风险,并且更重要的是对于一些病变,增加了病变的持续时间。当血管部分地或完全被病变阻塞时,血流减少可能对动物组织造成伤害。
因此,根据本文描述的实施例,医疗设备可以确定病变的特征并监测治疗的情况,以及在治疗之前和/或期间生成关于治疗病变的方式的建议。该附加信息可以帮助临床医生初始时确定如何治疗病变,以及治疗过程中试图确保或至少增加仅通过一次治疗即去除病变的机会,并且对于相同的病变不需要随后的治疗。医疗设备可以在医疗干预期间实时向临床医生提供信息,例如向临床医生提供医疗设备和病变之间的交互的实时信息。在一些实施例中,实时可以包括在医疗设备感测到相应数据的时间段内向临床医生提供信息,其中该时间段可以少于5秒、少于10秒、少于30秒、少于一分钟或少于5分钟,这可以取决于对数据进行分析以生成建议的需求。
并非所有病变都在导管内形成。例如,一些癌细胞可以在动物(例如人)身体的其他部位上形成。本文描述的一些实施例涉及通常不会在导管内发现的病变(例如癌细胞)的诊断和/或治疗。然而,应当理解,可以在导管内发现一些癌细胞,并且本文描述的其他实施例涉及这种癌细胞的诊断和/或治疗。
技术概论
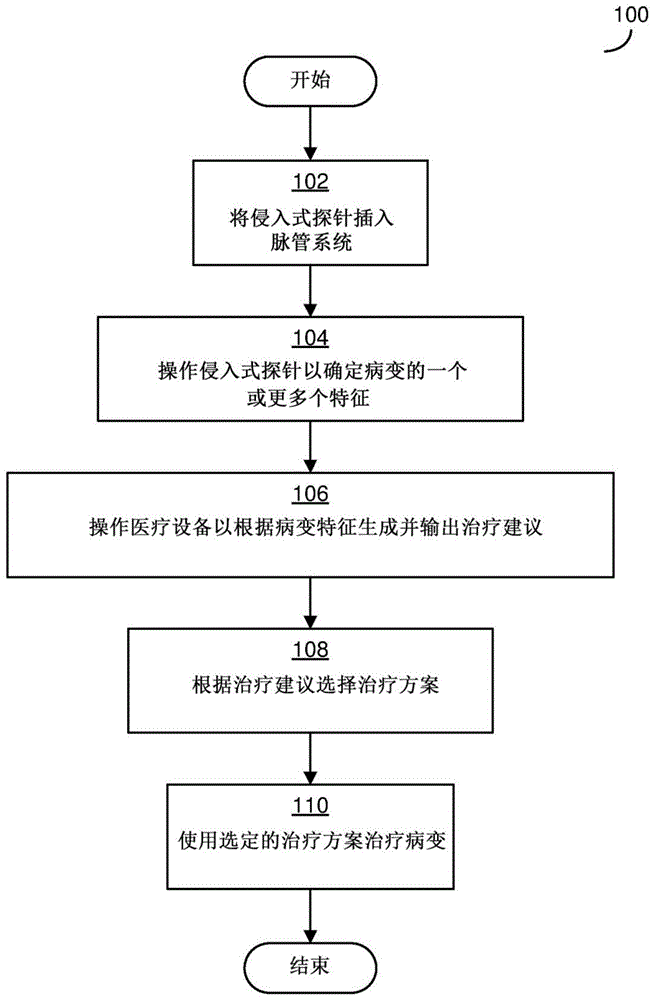
为了提供关于根据本文描述的一些实施例来操作的医疗设备的示例性组件的讨论的背景,图1是临床医生可以遵循以操作这样的医疗设备的过程的流程图。图2-3示出了医疗设备的示例,而下面的其他附图详细描述了设备的其他组件以及可以操作这种设备的方式。
过程100可用于诊断和/或治疗作为动物的受试者的病变。动物可以例如是人类或非人类动物,包括人类或非人类哺乳动物。病变可以是导管内的病变,例如动物的血管内的病变,比如静脉或动脉内的病变。导管病变可以完全或部分地阻塞导管。本文描述的实施例可以用于不同特征的病变,例如:
-在脉管系统中,血凝块(包括红细胞、白细胞、纤维蛋白、血栓和/或血小板),其在病变部位形成或在身体其他部位形成并粘在病变部位;
-从导管壁向导管中心的生长,例如受伤后疤痕组织向病变部位的内皮细胞的生长或其他生长;
-组织(例如,平滑肌细胞、弹性纤维、外弹性膜、内弹性构件、疏松结缔组织和/或内皮细胞),其也从导管壁向导管中心延伸,这对于该部位的该导管在解剖学上是不“正常”或不“健康”的;
-病变部位处斑块物质的积聚,包括胆固醇、钙、脂肪物质、细胞废物、纤维蛋白的积聚,和/或可以流过动物导管的流体中的其他物质(例如,在脉管系统病变的情况下,在动物血液中发现的物质);
-导管中的癌细胞,例如转移瘤和/或淋巴瘤等;和/或
-可能引起动物导管病变的任何其他组织和/或生物物质。
不同特征的病变可以形成在导管外。这些病变包括癌细胞,例如上皮组织来源的肿瘤(carcinoma)、骨髓瘤、黑素瘤、赘生物和/或肉瘤。在一些实施例中,可以通过基于病变的多个阻抗谱识别病变的组成来确定病变的组织结构(例如,病变具有以上列出的哪种生物物质),其中所述组成可以表示病变中存在的生物物质。生物组织的这种识别可以包括识别存在于病变中的组织和/或细胞,和/或存在于病变中的斑块物质,和/或病变中这些组织、细胞或斑块物质的相对量。在一些实施例中,识别病变中存在的生物物质可以包括识别每种生物物质的状态,例如,对于组织/细胞而言,识别组织/细胞是健康的还是不健康的。细胞的不健康状态可包括例如细胞是否发炎、病变、癌变或处于异常状态。
应当理解,实施例不限于对任何特定形式或组成的病变或在受试者的解剖结构内的任何特定位置进行操作。如上所述,为了便于描述,下面将提供各种实例,其中导管是动物的脉管系统。
在图1的过程100开始之前,受试者可能表现出脉管系统病变的症状。临床医生可以初步确定是否存在病变和病变的可能位置,例如使用诸如血管造影术的成像技术来确定。基于症状和对病变位置的初步确定,临床医生可以选择将侵入式设备插入受试者的脉管系统中以进一步诊断和/或治疗病变。临床医生可以是例如医生(例如,医师或外科医生)或可以是另一医疗专业人员,例如操作医疗设备的医疗技术人员或护士(可能在医生的监督下)。在一些实施例中,临床医生可以与受试者位于相同的房间中,包括在受试者旁边,而在其他实施例中,临床医生可以远离受试者(例如,在与患者相同的建筑物的不同房间中,或者在地理上远离患者)并且通过一个或更多个有线和/或无线网络(包括因特网或其他广域网(wan))操作控制医疗设备的用户界面。
过程100开始于框102,其中临床医生将侵入式探针插入受试者的脉管系统中。由临床医生在框102中插入的侵入式探针可以位于用于医疗设备的导丝的末端,并且其形状、尺寸和布置都设计成用于插入脉管系统。另外,在框102中,临床医生可以通过受试者的脉管系统馈送侵入式探针,直到侵入式探针位于病变附近。为此,临床医生可以使用成像技术(例如使用血管造影技术)监测受试者内的侵入式探针的位置。可以使用用于将设备插入脉管系统中的合适的技术来执行框102中的侵入式探针的插入和馈送,包括使用已知技术,实施例不限于此。
在框104中,临床医生操作侵入式探针以确定病变的一个或更多个特征。这可以包括下面详细讨论的病变的位置、病变的大小(例如,长度)、病变的组成或其他特征。为了确定特征,侵入式探针的一个或更多个传感器可以对病变的组织和/或其他生物物质进行一次或更多次测量,和/或对病变部位处的组织/物质(例如位于病变附近的健康组织)进行一次或更多次测量。
在一些实施例中,确定病变的一个或更多个特征可以包括识别病变的组成,例如识别病变中存在的不同类型的细胞或组织的量。作为一个简单的示例,可以确定探测的病变由50%的红细胞、30%的白细胞和20%的血小板组成。
下面详细描述传感器和测量的示例。为了在框104中操作侵入式探针,临床医生可以用侵入式探针的一个或更多个传感器来接触病变,和/或操作医疗设备的用户界面,以触发侵入式探针使用传感器来检测病变的特征。
在框106中,临床医生操作医疗设备以基于所确定的病变特征生成并输出针对病变的治疗建议。如下面详细讨论的,医疗设备基于病变的特征生成的治疗建议可以包括关于治疗病变的方式的建议,例如,使用哪种治疗设备来治疗病变(例如,如果要从受试者中移除病变的物质,是否使用抽吸导管或支架-取出器)和/或使用治疗设备的方式(例如,抽出支架-取出器的速度有多快)。如下面还详细讨论的,医疗设备可以基于各种分析生成治疗建议,例如,通过将病变的特征和与多种不同治疗方案中的每一种相关联的条件进行比较,当病变的特征满足治疗方案的相应条件时,输出该治疗方案的推荐。医疗设备的输出可以通过任何合适形式的用户交互实现,包括通过用户界面向临床医生提供的视觉、听觉和/或触觉反馈。在一些实施例中,在框106中医疗设备可以自动地在没有进一步用户干预的情况下分析在框104中确定的病变的特征并生成/输出治疗建议。在其他实施例中,临床医生可以操作医疗设备的用户界面以请求分析和生成/输出治疗建议。
在框108中,临床医生考虑医疗设备的治疗建议并选择治疗方案,并且在框110中,使用所选择的治疗方案来治疗病变。
在一些实施例中,所选择的治疗方案可包括将另外的侵入式医学组件插入受试者的脉管系统中。例如,如果在框102中插入的侵入式探针是导丝的组件,则可以沿着导丝插入另外的治疗设备。作为这种情况的具体示例,如果医疗设备建议使用支架-取出器完全或部分地移除病变,则可以将支架-取出器插入脉管系统中。作为另一示例,如果医疗设备建议用抽吸导管移除,则临床医生可以将抽吸导管插入脉管系统中。作为另一示例,如果医疗设备建议植入支架,则可以将支架植入器插入脉管系统中。
在其他实施例中,治疗可以不需要插入另一设备。例如,在框102中插入的侵入式探针可以不是导丝的组件,而可以是治疗设备的组件,例如支架-取出器的组件。在这种情况下,可以使用在框102中插入的治疗设备来执行框110的治疗。例如,如果在框102中插入的侵入式探针是支架取出器的组件,则框106的治疗建议可以具体到操作支架-取出器的方式,例如扩张支架的量、等待凝块与支架结合的时间量和/或用于抽出支架和凝块的力或速度。在这样的实施例中,在框110中,临床医生可以通过按照在框106中医疗设备的建议来操作支架-取出器以治疗病变。
在一些实施例中,可以生成包括不治疗病变的治疗建议,但以使病变保持完整的方式治疗受试者。例如,某些类型的血管病变可能难以有效治疗,从而阻止被病变闭塞的血管的再通。例如,在目前可用的治疗方法中,可能难以去除反映颅内动脉粥样硬化疾病的病变(icad病变)。因此,在一些实施例中,在有效的icad治疗方法可行之前,如果检测到icad病变,则医疗设备可以生成不治疗病变的治疗建议。icad病变可以通过其组成,特别是病变内生物物质的位置来识别。例如,如果医疗设备通过本文所述的技术确定血管病变包括在侵入式探针的腔侧上的凝块和在导丝的腔外侧上的动脉粥样硬化斑块物质(例如,脂质或钙化成分、平滑肌细胞、内皮缺失),则医疗设备可以确定病变是icad病变。
一旦在框110中治疗了病变,过程100就结束。下面描述在治疗病变后在一些实施例中可采取的附加动作。
医疗设备的示例
如上所述,图1讨论了可以根据本文描述的一些实施例操作医疗设备以诊断和/或治疗动物的脉管系统中的病变的一种方式。图2-3提供了包括侵入式探针的医疗设备的一些实施例的示例,作为这种诊断和/或治疗的一部分,该侵入式探针可插入脉管系统中。
图2示出了医疗设备200,其可以由临床医生202操作以诊断和/或治疗受试者204的医疗症状。动物204(例如,人)的医疗症状可以是脉管系统的病变204a,在图2的示例中示出为人的颅血管内的病变,其可以引起缺血性中风。如上所述,病变204a可以是血凝块、斑块物质的积聚、平滑肌组织的过度生长和/或血管的其他病变。
如图2所示的医疗设备200包括导丝206、手柄208和侵入式探针210。侵入式探针210和导丝206的至少一部分可以插入受试者204的脉管系统中,直到侵入式探针210位于病变204a附近。因此,侵入式探针210可以成形或布置成适于插入脉管系统(或其他导管)中。在一些实施例中,侵入式探针210会附接到直径大约300微米的导丝,或直径大约3-10fr的微导管,或具有适于插入动物导管的直径的另一设备。在一些这样的实施例中,这种设备可以是大约1或2米长,侵入式探针210位于导丝/设备的一端,例如在设备的后5厘米内。
插入到受试者204中的侵入式探针210可包括一个或更多个传感器212和测量单元214。在一些实施例中,传感器212可以测量病变204a的一个或更多个电特性,包括测量病变204a的组织和/或生物物质的一个或更多个电特性。测量单元214可以接收由传感器212生成的数据,并且在一些实施例中,可以生成要施加到病变204a的一个或更多个电信号,作为对一个或更多个电特性的测量的一部分。
下面详细描述传感器212的示例。作为一个具体示例,传感器212可以是阻抗传感器,并且测量单元214可以驱动传感器212以测量病变204a的电阻抗谱(eis)。例如,测量单元214可以包括一个或更多个振荡器以生成一个或更多个频率的电信号从而帮助识别病变204a的组成,该频率可以是被选择(并且测量单元214的振荡器被配置为生成)以用于区分不同组织和/或不同生物物质的特定频率,如下面详细讨论的。在布置成使用多个频率来测试组织/物质的实施例中,测量单元214可以包括多个振荡器,每个振荡器特定于待测试的一个频率并且被布置为生成该频率的信号。
在测量单元214生成要施加到病变204a的电信号的一些实施例中,测量单元214包含在侵入式探针210内并插入受试者204的脉管系统中可以是有利的。这可以使测量单元214紧邻传感器212和病变204a,并限制施加到病变204a的电信号中的噪声。例如,如果测量单元214位于手柄208中,则由测量单元214生成的电信号在被侵入探针210输出以施加到病变204a之前将沿着导丝206的长度行进。如果信号沿导丝206的长度行进,则电噪声可能影响信号质量。通过将测量单元214定位在侵入式探针210内,可以限制信号中的噪声。当测量单元214定位在侵入式探针210内时,它可以定位在侵入式探针210的腔中、在侵入式探针210的表面(内部或外部)上或者嵌入固定到侵入式探针210的表面(内部或外部)的膜中。
在一些实施例中,测量单元214可以被布置为专用集成电路(asic)。在一些这样的实施例中,可以使用减少硅衬底层的封装工艺来制造asic。例如,在制造期间,可以制造具有“有源”硅层的集成电路,所述“有源”硅层包括在硅衬底层之上的功能组件,该硅衬底层不包括有源组件。衬底层可以是层堆叠中的最底层,并且在一些情况下可以是最厚的层。通常,在制造之后衬底层保持完整,以使集成电路具有结构稳定性。在一些实施例中,测量电路214可以使用包括在制造有源层之后且在封装之前去除硅衬底层的工艺来制造。制造工艺可以包括从晶片的底表面去除衬底,该底表面可以是与制造有有源部件的一侧相反的一侧。在一些实施例中,可以去除所有硅衬底。在其他实施例中,可以去除基本上所有的硅衬底,其中“基本上”去除包括:仅留下足够的硅衬底以确保有源层组件的适当电功能,而不留下仅用于结构支撑的硅衬底。在去除硅衬底之后,可以将集成电路封装在包装材料中。
在一些实施例中,将测量单元214布置在传感器212和病变204a附近可以限制电信号行进的距离,从而减少信号衰减。信号衰减的减少在较高频率下可能特别显著,因为电线往往表现出低通频率响应。通过减小信号行进的距离,可以增加信号源和病变之间的电路径的截止频率,从而增加可以用于诊断或治疗的频率范围。因此,可以显著增强辨别组织或细胞类型的能力。将测量单元214布置在传感器212和病变204a附近可以在一些实施例中将截止频率增加到1mhz,在其他实施例中增加到10mhz,或者在其他实施例中增加到25mhz。为了比较,当测量单元214位于手柄208中时,截止频率可以被限制为小于500khz。
应当理解,实施例不限于传感器212是eis传感器或被驱动以执行eis操作。在一些实施例中,传感器212可以是或包括一个或更多个电、机械、光学、生物或化学传感器。这样的传感器的具体示例包括电感传感器、电容传感器、阻抗传感器、eis传感器、电阻抗断层成像(eit)传感器、压力传感器、流量传感器、剪切应力传感器、机械应力传感器、变形传感器、温度传感器、ph传感器、化学成分传感器(例如o2离子、生物标记或其他成分)、加速度传感器和运动传感器。这些传感器可包括已知的市售传感器。
在一些实施例中,包括在侵入式设备210中的测量单元214可以被配置成驱动传感器212和/或处理来自传感器的结果以生成要沿着导丝206发送回手柄208的数据。例如,在医疗设备200要生成治疗建议的实施例中可以是这种情况。指示病变204a的特征的数据可以沿着导丝206的长度传输。为了限制在这种传输期间噪声的影响,在一些实施例中,测量单元214可以包括模数转换器(adc)或其他组件,用于生成经由穿过导丝206的通信信道(例如,一根或更多根导线)进行传输的数字数据。
根据本文描述的实施例,临床医生202可以根据医疗设备200生成的一个或更多个治疗建议来治疗病变204a。尽管未在图2中示出,但是医疗设备200可以包括控制器以生成并输出用于治疗病变204a的这种治疗建议。在一些实施例中,控制器可以实现为病变分析设施,实现为由医疗设备200的至少一个处理器执行的可执行代码。病变分析设施可以结合关于一个或更多个治疗建议的配置信息来分析由医疗设备200(例如,通过侵入式探针210)确定的病变204a的特征。作为下面详细讨论的一个具体示例,病变分析设施可以将病变204a的特征和与各种治疗建议相关联的条件进行比较,并且当特征满足治疗建议的条件时输出该治疗建议。
在一些实施例中,执行病变分析设施的处理器和存储病变分析设施的存储介质(例如,存储器)和用于治疗建议的配置信息可以设置在手柄208内。因此,在手柄208中的处理器上执行的病变分析设施可以经由导丝206的通信信道从测量单元214接收指示病变204a的一个或更多个特征的数据。
然而,在其他实施例中,执行病变分析设施的处理器和存储病变分析设施的存储介质(例如,存储器)和用于治疗建议的配置信息可以与导丝206和手柄208分开设置,例如设置在单独的计算设备中。该计算设备可以位于导丝206和手柄208附近,例如位于同一房间内。或者,计算设备可以远离导丝206和手柄208,例如位于同一建筑物的不同房间中或者在地理上远离导丝206和手柄208。在处理器/介质与导丝206和手柄208分开的实施例中,计算设备可以经由一个或更多个有线和/或无线通信网络接收指示病变204a的一个或更多个特征的数据,该一个或更多个有线和/或无线通信网络包括从手柄208到计算设备的直接线、手柄208和计算设备之间的无线个域网(wpan)、手柄208和计算设备之间的无线局域网(wlan)、手柄208和计算设备之间的无线广域网(wwan)和/或因特网。相应地,在一些实施例中,手柄208可以包括一个或更多个网络适配器以通过一个或更多个网络进行通信。
当医疗设备200生成治疗建议时,医疗设备200可以输出治疗建议,以呈现给临床医生202和/或任何其他用户。可以经由一个或更多个网络输出到另一个设备和/或到一个或更多个显示器,例如显示器216,或其他形式的用户界面。在图2的示例中,病变分析设施可以在设置在手柄208内的处理器上执行并生成治疗建议,并且可以通过手柄208的无线网络适配器将建议输出到显示器216,以便呈现给临床医生202。可以使用其他形式的用户界面,实施例在这方面不受限制。可以使用任何合适的视觉、听觉或触觉反馈。例如,如果治疗建议推荐使用抽吸导管或使用支架-取出器移除病变,则手柄208可包括用于每个方案的发光二极管(led)或其他视觉元件,并通过照亮适当的led来呈现治疗建议。作为另一示例,如果治疗建议涉及操作支架-取出器的方式,特别地涉及在等待时间多久之后开始抽出的建议,则可以使用经由结合到手柄208中的振动单元提供的触觉信号来输出开始抽出的信号。本领域技术人员可以理解,与上面讨论的计算设备一样,用户界面的元件可以设置在手柄208内或与手柄208分开设置(或甚至远离)。
可以经由沿着导丝206的长度延伸的电缆向侵入式探针210供电。电缆可以连接到手柄208中的电源,该电源可以是电池、能量采集器、到电网电源的连接或其他能源,实施例在这方面不受限制。
在一些实施例中,手柄208可包括一个或更多个传感器,图2中未示出。结合在手柄208中的传感器可以监测医疗设备200的操作,以通知临床医生202执行治疗的方式。例如,可以在手柄208中布置加速度计或其他运动传感器,以检测控制导丝206和侵入式探针210的运动的手柄208的运动。例如,通过监测加速度计,可以确定临床医生202是否执行多次治疗以移除病变(例如,通过抽吸导管或支架-取出器执行多次)或仅一次就能够取出病变。
在一些实施例中,手柄208可以从导丝206拆卸,并且可以在操作之间重复使用。相应地,出于卫生原因,侵入式探针210和/或导丝206可以布置成不可重复使用,或者可以设置成一次性的,手柄208可以布置成可拆卸地附接到导丝206并且可以再与其他导丝206和侵入式探针210一起使用。例如,导丝206和手柄208可以具有互补的接口,以允许手柄208与导丝206连接并且与导丝206的组件(例如,通信通道\电缆)和侵入式探针210接合。
临床医生202可以经由医疗设备的用户界面操作医疗设备200,该用户界面包括显示器216并且可以至少部分地设置在手柄208内。例如,手柄208可使得临床医生202能够使导丝206和侵入式探针210在脉管系统内向前和向后移动和/或触发侵入式探针210的操作。
侵入式探针210的操作可取决于侵入式探针210的组件。例如,侵入式探针210可以包括传感器212以感测病变204a的一个或更多个特征。侵入式探针210还可以包括测量单元214以操作传感器来检测一个或更多个特征,例如,通过操作一个或更多个传感器以将电信号施加到病变204a并在施加电信号期间和/或之后对病变204a进行一次或更多次测量。在一些实施例中,侵入式探针210可包括一个或更多个组件以治疗病变204a,包括植入支架和/或移除病变204a。病变移除组件可包括与用于去除病变的任何合适的技术相关的那些组件,实施例在此方面不受限制。在一些实施例中,例如,侵入式探针210可包括支架-取出器组件(例如,球囊)以使用支架来取出病变,和/或包括抽吸导管组件以将病变吸入导管中。侵入式探针210还可以包括图2中未示出的其他传感器,包括例如光学相干断层扫描(oct)传感器。
因此,医疗设备的用户界面可以使临床医生202能够利用侵入式探针210执行多种不同的操作,该用户界面可以整体地或部分地并入手柄208中。例如,手柄208的用户界面可以使临床医生202能够触发传感器212和测量单元214以施加电信号和/或对病变204a进行测量,和/或执行一个或更多个治疗操作以治疗病变204a。
虽然已经描述了医疗设备200可以包括执行一个或更多个操作的治疗组件以治疗病变204a的示例,但是应当理解,实施例不限于此。在一些实施例中,医疗设备200可以是用于另外的治疗设备的导丝,所述另外的治疗设备沿着导丝插入以定位在病变204a附近并且治疗病变204a。
例如,在插入侵入式探针210和导丝206之后,临床医生202可以沿着导丝206的长度插入另一个设备,或者可以移除导丝206和侵入式探针210,然后插入新设备。新插入的设备可以是例如支架植入器、抽吸导管、支架-取出器或用于治疗病变204a的其他设备。在插入另外的设备的一些实施例中,手柄208可以与该另外的设备兼容,这样,另外的设备和手柄208可以具有兼容的接口,并且手柄208的用户界面可以用于操作该另外的设备。
另外,尽管提供了临床医生202根据治疗建议手动操作医疗设备200的示例,但实施例不限于此。在替代实施例中,医疗设备200可以基于来自传感器212的输入自动治疗病变。例如,如可以从上面的概论和下面的详细讨论中理解的,医疗设备200可以生成关于治疗病变204a的方式的治疗建议。在一些实施例中,医疗设备200根据治疗建议并且无需用户干预的情况下(但是,在一些实施例中,在临床医生202的监督下)插入和/或操作抽吸导管、支架-取出器、支架植入器或其他设备以根据治疗建议治疗病变204a。
图3示出了一些实施例可以操作的侵入式探针210的示例。图3的示例的侵入式探针210包括与支架类似布置的网状物300。在一些实施例中,侵入式探针210可以作为支架-取出器来操作。在其他实施例中,侵入式探针210可以不作为支架-取出器操作,而是可以包括网状物300或另一种结构,以提供传感器和病变之间的多个接触点,以便比仅使用单个传感器更精确地检测病变的特征。
但是,应当理解,在一些实施例(不是图3的实施例)中,侵入式探针210可以仅包括一个传感器,其可以位于例如侵入式探针210的末端。这种传感器可以实现为两个电极,其中一个电极可以向病变施加电信号,并且其中一个电极可以接收施加的信号。基于对所施加的信号与接收到的信号的比较,可以进行一次或更多次的确定,如下面详细讨论的。
然而,发明人已经认识并理解,在侵入式探针210中包括附加的传感器可以使得能够确定更详细的信息。例如,与仅单个传感器相比,在侵入式探针210中包括附加的传感器可以使得能够以更高的精度获得关于病变的成分的信息。这样的附加传感器可以例如使得能够针对沿着侵入式探针的多个位置中的每一个确定阻抗谱,使得在一些情况下,可以针对相同的病变在不同位置确定不同的阻抗谱。这可以包括,例如,使用每个传感器确定阻抗谱。在这种情况下,每个阻抗谱是传感器(利用其两个电极)接触的病变的生物物质的阻抗谱。一些病变可包括多种不同的生物物质(例如,不同的组织或细胞,或不同的斑块物质)。在侵入式探针的每个传感器接触不同的生物物质的情况下,每个传感器可以针对每种不同的生物物质确定不同的阻抗谱。但是,也可以是如下情况:对于一些病变,侵入式探针的两个或更多个传感器可以接触相同的生物物质,并且在这种情况下,可以生成相同或基本相同的阻抗谱。因此,在一些实施例中,侵入式探针可操作每个传感器以生成病变的生物物质的阻抗谱。为病变的多种生物物质中的每一种生成阻抗谱(即,为每个病变生成多个阻抗谱)与为病变整体确定单个阻抗谱形成对比。下面讨论使用多个传感器,包括通过执行eis,来确定病变组成的技术。
相应地,图3示出了具有沿探针210的外表面和/或内表面布置的多个传感器的侵入式探针210的示例。传感器302(包括传感器302a、302b、302c、302d,本文统称为传感器302)可以沿着结构300布置。在一些实施例中,每个传感器可以是或包括一个或更多个电极以施加电信号和/或检测施加的电信号。
在一些实施例中,虽然图3中未示出,但是侵入式探针210可以包括球囊,当球囊膨胀时,使结构300向外扩展,以更好地接触病变。在使用期间,例如,结构300可以整体或部分地插入病变中,例如直到位于结构300的末端的传感器检测到它们已经传递到病变的远侧,之后结构300可以使用球囊来扩展,直到传感器302检测到多个点处的接触。结构300的膨胀可以由侵入式探针210的控制器(例如,测量单元304)控制,或者可以由设置在医疗设备中其他地方的病变分析设备和/或由临床医生通过医疗设备的用户界面来控制。
在一些实施例中,测量单元304可以操作传感器302以执行一个或更多个测量,包括生成一个或更多个电信号以施加到病变并分析由传感器302生成的数据。对传感器302生成的数据进行分析可以包括对数据进行模数转换,以沿着导丝传输到患者外部,例如传输到如上所述的病变分析设施或用户界面。
虽然已经提供了传感器302是电传感器的示例,但是应当理解,实施例不限于此。例如,传感器302可以是或包括一个或更多个电、机械、光学、生物或化学传感器。这样的传感器的具体示例包括电感传感器、电容传感器、阻抗传感器、eis传感器、电阻抗断层成像(eit)传感器、压力传感器、流量传感器、剪切应力传感器、机械应力传感器、变形传感器、温度传感器、ph传感器、化学成分传感器(例如o2离子、生物标记或其他成分)、加速度传感器和运动传感器。
传感器和传感技术的示例
如上所述,在一些实施例中,侵入式探针的测量单元可以操作侵入式探针的传感器以执行电阻抗谱(eis)。图4-11描述了可以布置这种传感器和测量单元的方式的示例,并且描述了用于操作这样的传感器和测量单元的技术的示例。然而,应该理解的是,实施例不限于根据本节中描述的eis的示例进行操作。
本节中关于图4-11描述的技术允许辨别动物(包括哺乳动物,例如人)的导管病变的组织和/或生物物质。“辨别”在这里应该理解为是指通过这种方法给出的辨别不同组成的病变的可能性,例如,通过确定病变的一种或更多种类型的细胞(例如,红细胞和/或白细胞,或内皮细胞的不同类型或状态)和/或病变的一种或更多种类型的其他生物物质(例如,斑块物质,如胆固醇)。更一般地,通过本节中描述的技术实现的辨别包括确定与测试的病变相关的至少一项信息。稍后将给出可以通过这些技术确定的信息的示例。
如图4中示意性示出的,细胞辨别方法10包括确定被测病变的阻抗的频谱的第一步骤12。
这里应将频谱理解为病变阻抗的一组值对,值对能够是复杂的,并且具有相应的频率。因此,该频谱可以是离散的并且仅包括有限数量的对。这些对可以明显地隔开几hz,甚至几十hz,甚至几百hz。然而,在其他实施例中,在该步骤中确定的频谱在频带上是连续的、伪连续的或离散的。伪连续应理解为是指频谱是针对由100hz或更小、优选10hz或更小、优选甚至1hz或更小的频率间隔开的连续频率确定的。在其上确定组织阻抗的频带例如从10khz,优选100khz延伸。实际上,在低频率下,病变的组织/物质的膜充当电绝缘体,因此阻抗非常高,并且最重要的是变化很小。此外,在其上确定病变的组织/物质的阻抗的频带例如延伸至100mhz,优选地为1mhz。实际上,在高频率下,从电学角度来看,构成病变的组织/物质的壁变得透明。因此,测量的阻抗不再代表生物物质。该谱可以是病变的复阻抗的实部和/或虚部和/或模数和/或相的频谱。
如下文结合图5所述,可以特别地执行确定病变阻抗的频谱的第一步骤12。
首先,在步骤14期间,将两个、优选三个、甚至更优选四个电极布置成与待测病变接触,电极连接到交流发电机。使用四个电极的测量是优选的,因为这使得可以实现两个电极用于将电流传递到待测试的病变中并测量另外两个电极之间的电位差。这使得可以提高测量的准确性。然后,在步骤16期间,在接触病变的电极之间施加交流电。然后,通过改变在步骤18期间施加的电流的频率,在不同频率的电极的端子处测量相应的电压。最后,在步骤20期间,对于已经进行测量的每个频率,计算测量的电压与施加的电流之间的比率。该比率给出了被测病变的阻抗,其随测量频率变化。计算出的比率使得可以定义病变阻抗的频谱。
当谱是连续的或伪连续时,可以表示为如图6所示的曲线的形式,在此特定情况下,其给出随频率变化的、病变的阻抗的模,频率根据对数标度绘制。这里应该注意,在x轴上使用对数标度。
在图4的辨别方法10的步骤22中,然后选择病变阻抗的不同模型,即可以对病变进行建模的不同电路。这里,选择的模型包括恒定相位元件,而不是电容。实际上,已经发现恒定相位元件比电容更逼真地模拟病变的行为。
恒定相位元件(或cpe)具有以下形式的阻抗zcpe:
或
其中
-j是-1(j2=-1)的平方根;
-ω是电流的特定脉冲(ω=2πf,其中f是电流的频率);
-q0是恒定相位元件的实参数;以及
-α是恒定相位元件的另一实参数,介于0到1之间,使得恒定相位元件的相位
在下文中,选择阻抗由上述等式[1]给出的恒定相位元件作为示例进行描述。
病变阻抗的模型可以特别地选自下文关于图7-10描述的那些。显然,模型越简单,计算越简单。然而,复杂模型可以更好地与通过测量获得的阻抗的谱相关联,因此给出更准确的结果。
根据图7中所示的第一模型24,病变的阻抗由第一电阻26建模,第一电阻26与恒定相位元件30和第二电阻32的并联连接28串联安装。
在这种情况下,病变的总电阻ztot具有以下形式:
其中
-ztot是表示病变的第一模型24的总阻抗;
-r1和r2是第一电阻24和第二电阻30的电阻值。
这种模型特别好地描述了病变,覆盖了测量电极,像一组单独的并联安装,每个单独的安装由单独的电阻与单独的电阻和单独的电容的并联安装串联构成。这样的安装使得可以根据参数可能不同的不同的并联电路来模拟测量电极的整个表面上的时间常数的分布,这些并联电路中的每一个代表病变的不同组织/物质。因此,模拟出了病变的组织/物质可以表现出不同的电特性,特别是不同的电阻和/或电容这一事实。
图8中所示的第二模型34通过串联安装第二恒定相位元件36补充了图7的模型24。该第二恒定相位元件36的阻抗zcpe,2也可以选择为以下形式:
其中
-β是介于0和1之间的实参数,使得该第二恒定相位元件的恒定相位等于-βπ/2;并且
-q1是恒定相位元件的实参数。
因此,根据该第二模型34的病变的总阻抗ztot由以下等式给出:
图9中所示的第三模型38对应于图7的模型,第三模型38与电阻为r3的第三电阻40并联安装。在这种情况下,病变的总阻抗ztot由下式给出:
最后,图10中示出了第四示例性模型42。如图所示,该模型42包括第一电阻26,第一电阻26与恒定相位元件30和第二电阻32的串联安装并联安装。
对于该模型42,病变的总阻抗ztot通过以下等式给出:
然后,辨别方法继续到步骤44,在步骤44期间,对于在步骤22中选择的每个模型,确定恒定相位元件30的阻抗,该阻抗优化了病变阻抗模型与步骤12中确定的谱之间的相关性。
对病变阻抗模型与步骤12中确定的谱之间的相关性进行优化的步骤可以通过本领域技术人员已知的任何优化方法来实现。举例来说,可以由最小二乘法实现,这允许实际且相对简单地实现该步骤44。
显然,在实践中,除了恒定相位元件的阻抗之外,不同模型的其他参数也在该步骤44中确定。这些元件也可用于获得关于所测试的病变和/或组成病变的组织/物质的信息。
然后可以提供辨别方法10的中间步骤46。该步骤46在于确定似乎与测量的病变阻抗的谱最相关的模型。该最佳模型可以例如是使测量谱的标准偏差最小化的模型。在下文的描述中,假设模型24被认为与测量的病变阻抗的谱最佳相关。
在步骤48期间,从恒定相位元件的阻抗参数和相应模型推导出病变的有效电容(或表观电容)。
理论上,该有效电容代表病变的组织/物质的元素的一组单独的电容。组织/物质的这些元素可以特别是病变的组织/物质的全部或一些。有效电容是允许表示病变的一部分或全部的电膜行为的模型。该模型使得可以相关地辨别病变的组织/物质。
更实际地,该有效电容通过利用包括单独的并联安装的模型识别病变的阻抗来确定,每个单独的安装包括至少一个单独的电阻和一个单独的电容。每个安装可以特别地包括,优选地由以下组成:与单独电容和第二单独电阻的并联安装串联的第一单独电阻。这些单独的安装旨在模拟病变的每个组织/物质的行为。然后,有效电容是病变中存在的所有单独电容而产生的电容。
在模型24(或34)的情况下,可以特别地如下确定有效电容。将具有恒定相位元件的模型24的阻抗与等效或相同模型的阻抗进行比较,等效或相同模型中恒定相位元件由有效电容代替。严格地说,可以通过将为病变选择的具有恒定相位元件的模型的阻抗的实部和/或虚部和/或相位和/或模数与相同模型进行比较来计算有效电容,该相同模型中恒定相位元件由有效电容代替。
在模型24(或34)的情况下,例如,通过将时间常数
从中推导出有效电容的公式,形式如下:
在选择了病变的具有恒定相位元件的另一阻抗模型的情况下,可以确定有效电容的相应方程。为此,由于模型24或34在电学上等效于病变阻抗的模型,因此足以根据所选模型的参数来计算模型24或34的阻抗r1、r2、zcpe和zcpe,2(如果适用的话)。然后可以通过用相应的值代替r1、r2、z0和α来计算有效电容,其表示为所选模型的参数的函数。
然后,细胞辨别方法10继续步骤66,从先前确定的有效电容中推断出关于病变组织/物质的信息。
可以通过将在步骤48中确定的有效电容的值与预先确定的值进行比较来做出该推断。特别地,该预先确定的值可以在已知组成成分的组织、已知介质和已知测试条件下执行的测试的过程中获得。预先确定的值可以在有效电容值的数据库中一起分组,与针对不同类型的组织/物质和/或不同组织/物质的不同状态和/或在不同测试条件下测量的有效电容一起进行分组。
因此可以辨别病变的组织/物质,也就是说确定以下信息中的至少一项:
-病变中组织和/或其他生物物质的类型;
-病变的组成,特别是如果病变由不同类型的生物物质或不同状态的组织/细胞/其他生物物质组成;
-当病变由组织组成时,组织中包含的细胞类型和/或组织中存在的细胞层数;
-当病变由其他生物物质(如斑块物质)组成时,病变中包含的物质的类型;和/或
-包括在病变组织中的细胞的状态,特别地,细胞是否处于健康状态、处于发炎状态、处于退化状态(特别地,是否存在一种或更多种癌细胞)、处于感染状态。
因此,所描述的辨别方法的一个优点是,它允许根据对待测病变阻抗的频谱的简单测量来辨别接触电极的病变中的组织/物质。获得的结果是准确的。不需要对测量的阻抗进行标准化,也不需要在没有任何待测样品的情况下进行参考测量。因此,该方法可以在体内对原位病变实施,也就是说不需要对待测试的病变进行预先取样。
应当注意,在确定了有效电容的情况下,该单个值通常足以辨别病变的组织/物质。还可以将所选择的待测病变的阻抗模型的参数与预先确定的值进行比较,以明确有效电容的比较结果。例如,当组织的细胞发炎时,细胞之间的连接更松散。与健康细胞相比,低频下的电阻—例如模型24的电阻32—进而更低。将该电阻的值与针对健康的未发炎的细胞预先确定的值进行比较,可以确定这些细胞的发炎状态。
还应注意,可以考虑模型的其他参数来辨别病变的组织/物质。此外,这些其他参数还可以确定关于所测试的病变的附加信息。因此,例如,当病变包括组织时,可以考虑用模型24的电阻26、32的r2或r1+r2的和来确定细胞结构的厚度。为此,确定值r2且可能确定r1,特别是同时确定恒定相位元件的阻抗,以便优化模型24与测量的阻抗谱的相关性。然后可以将值r2或r1+r2的和与在已知条件下(例如在体外)预定的相应值进行比较。这些预定值可以特别地存储在数据存储器中。
如前所述,该方法可以容易地在可以插入动物受试者的设备的背景下实施,例如插入人类受试者的脉管系统中的设备。
作为示例,图11示出了用于实现前述方法的系统的示例100。
系统100基本上包括用于测量病变104的阻抗的器件102和连接到该测量器件102的电子控制单元106,其中病变104是融合性细胞的单层组织,其浸入介质105中,例如血液中;电子控制单元106实现该方法并根据测量的阻抗辨别病变104的组织。
这里,测量器件102包括交流电发电机108,其连接到与病变104接触的两个电极110、112。测量器件102还包括用于确定穿过病变104的强度的设备114,其通过与病变104接触的两个电极116、118连接到所述病变104。为了能够根据例如电极110、112、116、118的端子处的电压和强度的测量来确定病变104的阻抗,电子控制单元106连接到发电机108和强度测量设备114。
电极110、112、116、118由导电物质构成,例如金。
这里,有利地,测量器件102还包括可以插入动物受试者中的医疗设备120,这里是侵入式探针120。在这种情况下,电极110、112、116、118、交流电发电机和强度测量设备可以固定在该医疗设备上。
因此,例如,可以在步骤22中选择病变阻抗的单个模型。在这种情况下,不必对许多模型进行优化。因此,在这种情况下,该方法实现起来更简单、更快捷。当模型被认为更相关时,特别地可以以这种方式进行。
此外,在所描述的一些示例中,组织/物质的辨别基本上是基于所计算的有效电容以及与预先确定的值的比较。然而,作为变型,可以根据所选择的病变阻抗模型的参数来辨别组织/物质。此外,似乎只有有效电容值的比较既简单又可以可靠地区分组织/物质。
在一些实施例中,细胞辨别方法10可以配置有用于执行eis测量的特定频率,而不是在频谱上执行连续或伪连续测量。该特定频率可以是生成阻抗值的那些频率,当分析时,所述阻抗值提供不同生物物质之间的最清楚的区别。在一些实施例中,最清晰的区分可以是谱之间几乎没有重叠的阻抗谱,而在其他实施例中,最清晰的区分可以是可用于识别生物物质的值或值范围中的最小重叠或相似性。例如,在确定有效电容并将其用于识别生物物质或确定生物物质的一个或更多个特征的一些实施例中,最清楚的区分可以是与不同类型的生物物质相关联的有效电容的值或值范围中的最小重叠或相似性。
操作医疗设备的方法
以上参照图2-11详细描述了医疗设备、传感器和感测病变的组织/物质的方式的示例。以下结合图12-16描述可以由这样的医疗设备实现和/或可以操作医疗设备来执行的技术的示例。
图12示出了例如可以由根据本文描述的一些技术操作的医疗设备执行的过程1200。图12的示例的医疗设备可以是其中侵入式探针可以仅包括单个传感器的医疗设备,该传感器可以包括一个或两个电极。如从前面的讨论应当理解的,与沿着侵入式探针排列的多个传感器(例如,在图3的示例中)相比,可以从单个传感器确定关于病变的有限量的信息。在图12的示例中,侵入式探针的传感器可以设置在治疗设备中,例如在抽吸导管和支架-取出器中,和/或在插入抽吸导管或支架-取出器之前插入的导丝中。医疗设备可以基于使用该传感器确定的病变的特征来生成治疗建议。
过程1200开始于框1202,其中操作附接到导丝的传感器以检测接近该传感器的病变的一个或更多个特征。在过程1200开始之前,导丝的侵入式探针(传感器是其一部分)可以插入动物的脉管系统中并且移动到接近病变的预测位置。然后操作传感器以检测传感器何时接触病变。可以通过评估传感器输出的值随时间的变化来确定与病变的接触。例如,传感器可以在接触血液时输出一个值,这可以是当传感器布置在血管中间未被病变阻塞的区域中时的情况。当侵入式探针向前移动直到接触病变时,一旦接触,传感器输出的值可以发生改变。以这种方式,可以使用单个传感器确定病变的位置。在某些情况下,可以另外操作传感器以确定病变的长度,例如通过继续推进侵入式探针直到传感器不再接触病变并且输出值回到与接触血液相关联的值。
在图12的示例中,仅使用单个传感器,医疗设备可能不知道病变的组成,且可能无法做出关于哪种治疗方案可以最好地治疗特定病变的治疗建议。然而,医疗设备能够生成关于治疗进展或成功的信息,其可用于确定所选治疗方案是否被成功执行。基于该信息,医疗设备可以生成关于是否将正在进行的治疗改变为另一治疗的治疗建议。
在可以在诸如图12的实施例中实施的一种治疗方案中,抽吸导管可以用作治疗病变的第一选择。因此,在框1204中,将抽吸导管插入脉管系统中,直到位于导丝的侵入探针附近并因此位于病变附近。在一些实施例中,可以先不插入导丝,而是可以在框1202中插入抽吸导管,直到定位在病变附近。在这种情况下,传感器可以是抽吸导管的组件。在此方面实施例不作限制。
在框1204中,在将抽吸导管布置在病变附近之后,操作抽吸导管以尝试将病变吸入导管中。在一段时间之后,可操作抽吸导管和/或导丝的传感器以确定抽吸导管是否对病变有影响。一些病变,例如硬病变,可能无法使用抽吸导管吸出。对于这些病变,可以使用其他干预措施(例如支架-取出器)。因此,在框1204中,除了操作抽吸导管以尝试抽吸之外,还可以操作传感器以确定病变是否发生变化。例如,这可以通过以下来完成:在开始抽吸之前将传感器定位在病变内,例如在最靠近抽吸导管的病变部分处,并且在一段时间之后确定传感器输出的值是否指示传感器不再与病变接触(而是例如与血液接触)。
如果在抽吸导管的操作期间(并且可能由于抽吸导管的操作)传感器不再接触病变,则可以在框1206中确定病变是可抽吸的。在这种情况下,可以生成并且输出指示抽吸导管似乎成功地治疗病变并且推荐抽吸导管的继续操作的治疗建议。在图12的示例中,然后过程1200结束。然而,应当理解,在一些实施例中,可以随着时间连续确定抽吸导管是否继续成功地治疗了病变,以便如果适当的话可以推荐更换,或者可以确定何时病变被抽吸完。
但是,如果在抽吸期间传感器输出的值没有变化并且表明抽吸对病变没有影响,则可以生成并输出不再推荐抽吸导管,而推荐另一种治疗方案的治疗建议。在图12的示例中,用于治疗病变的第二方案可以是支架-取出器。因此,在框1208中,可以输出使用支架-取出器的建议。在框1210中,可以操作支架-取出器以通过用支架-取出器移除病变来治疗病变。例如,可以插入支架-取出器直到位于病变附近。在一些实施例中,如上所述,进行检测的传感器可以是不同于治疗设备的导丝的组件。在这种情况下,在移除抽吸导管之后,支架-取出器可以沿着导丝插入(或在移除导丝后,沿着微导管插入,其中微导管是沿着导丝插入的),直到支架-取出器定位在病变附近。作为另一示例,传感器可以与支架-取出器集成在一起,并且可以检测支架-取出器何时位于病变附近。通过使用传感器生成的值,医疗设备可以生成关于定位支架-取出器以便移除病变的治疗建议。例如,如上所述,可以使用传感器来检测侵入式探针何时穿过病变以及侵入式探针的末端何时位于病变的远侧。最好将支架-取出器的支架定位在病变上,使得支架的一端突出超过病变,以帮助确保用支架完全捕获病变。因此,通过操作传感器来检测病变的远侧,并且建议插入支架-取出器直到支架或传感器延伸通过病变,可以做出关于正确定位支架的治疗建议。
一旦在框1210中操作支架-取出器移除病变,过程1200结束。
图13示出了根据另一实施例的操作医疗设备以生成对病变的治疗建议的方式的示例。在图13的实施例中,侵入式探针可包括沿探针外部排列的多个传感器,例如在上面讨论的图3的示例。如从前述应当理解的,利用这种传感器阵列,可以确定病变的几个不同特征,包括病变的组成。病变的组成可以指示病变中存在的不同生物物质,例如不同的组织或细胞,或其他生物物质,例如斑块物质。在一些这样的实施例中,例如,每个传感器(例如,每个传感器的两个电极)可以接触病变的生物物质,相对于其他传感器,其中一些传感器接触病变的不同生物物质。然后可以根据本文描述的技术操作每个传感器,以确定该传感器接触的生物物质的阻抗谱。然后可以使用该组阻抗谱来确定病变的组成,例如识别病变中存在的不同生物物质。该组成信息可以类似于通过对病变进行组织学检查而确定的信息。根据病变的不同阻抗谱,和/或对病变中存在的不同生物物质(例如,不同的组织或斑块物质)的识别,可以确定病变整体的特征,例如识别(例如,诊断)病变的类型。
例如,通过对病变的不同生物物质进行eis处理,可以确定病变中是否存在以下任何细胞或组织:血小板、纤维蛋白、血栓、红细胞、白细胞、平滑肌细胞、弹性纤维、外弹性膜、内弹性构件、疏松结缔组织、内皮细胞、或内膜、中膜或外膜的任何其他组织。另外,通过对病变进行eis处理,可以确定当前每个细胞或组织的相对量。作为一个简单的示例,可以确定病变由50%的红细胞、30%的白细胞和20%的血小板组成。根据该信息,病变可以被归类为一组病变中的一种特定类型的病变,例如将病变诊断为一种类型的病变而不是其他类型的病变。
图13的过程1300开始于框1302,其中将医疗设备的侵入式探针插入动物受试者的脉管系统中并操作以检测病变的一个或更多个特征,包括病变的组成。基于包括组成的该特征,医疗设备可以在框1304中选择要推荐的治疗方案。医疗设备可以以任何合适的方式选择治疗方案,包括根据下面结合图14-15b描述的技术。
所选择的治疗方案可以是基于病变的组成选择的。例如,如果病变的组成表明它由平滑肌组织而不是血栓组成,则医疗设备可以确定植入支架是应该推荐的治疗方案。这可能是因为病变不是由可以取出的细胞/物质组成,而是由血管内的生长组成。作为另一示例,如果病变的组成表明它是软病变,例如由新形成的血栓产生的软病变,则医疗设备可以推荐抽吸导管。这可能是因为软病变能够被吸出。作为另一示例,如果病变的组成表明它是硬病变,例如硬血凝块,则医疗设备可以推荐支架-取出器,因为不太可能成功吸出硬病变。
一旦在框1304中推荐了治疗方案,医疗设备就可以在框1306中监测所选择的治疗方案的执行情况。医疗设备可以使用一个或更多个传感器来监测治疗,例如在框1302中确定特征的一个或更多个传感器或者操作来执行治疗的治疗设备的一个或更多个传感器。例如,在一些实施例中,遵循框1304的推荐,临床医生可以将另一设备(例如,适当情况下,抽吸导管、支架-取出器等)插入受试者的脉管系统中,并且该另一设备可包括具有如本文所述的传感器布置的侵入式探针。在这样的实施例中,医疗设备可以使用该另一设备的侵入式探针的传感器来监测治疗的执行情况。
在框1306中对治疗的监测可以生成关于治疗的状态和/或进展的信息。例如,如果用抽吸导管进行治疗,则监测可以生成关于病变已经吸出的程度和/或待吸出的病变的剩余量的信息。可以例如通过医疗设备周期性地或偶尔地使结构(例如,图3的支架状网状物)膨胀以用传感器接触病变的剩余部分来监测进展,来确定剩余病变的程度。在确定之后,可以移除结构以继续抽吸病变。另一方面,如果用支架-取出器进行治疗,则监测可以生成关于支架在膨胀期间与病变聚结的程度的信息。例如,通过监测沿着支架外部的传感器(例如,如图3的示例的支架上的传感器的布置),可以确定支架的对应于每个传感器的每个部分是否完全扩展进入到病变中。该确定可以以任何合适的方式进行,包括通过监测由每个传感器生成的值随时间的变化并确定每个传感器的值何时停止变化。当每个传感器停止改变值时,这可以指示病变和支架之间的相互作用没有进一步变化,并且因此,支架完全扩展到病变中并且病变在支架周围聚结。
做出这样的确定可以有助于治疗病变。因此,在框1308中,医疗设备经由用户界面输出关于治疗状态的信息,以呈现给临床医生。另外,在框1310中,医疗设备可以生成关于执行治疗的方式的一个或更多个治疗建议。例如,当医疗设备在支架-取出器的操作期间确定病变与支架完全聚结时,如上所述,医疗设备可以输出开始抽出支架的治疗建议。
一旦治疗执行成功,过程1300结束。
虽然在生成治疗建议的背景下给出了监测治疗的示例,但是应当理解,可以使用类似的技术向临床医生发出关于治疗状态的出错消息或其他消息。例如,如果治疗设备上的传感器在一段时间内指示存在病变,而之后传感器不再检测到病变,则医疗设备可确定治疗设备未正确定位或病变丢失。这可能表明需要重新定位该设备,或者可能更有问题地是,该病变已成为栓塞。通过用户界面向临床医生发送的消息可以指示这样的潜在问题。
另外,尽管图13的示例描述了操作医疗设备以提供与初步选择治疗方案有关的治疗建议以及与执行该治疗方案的后续方式有关的治疗建议的方式,但从上述内容应当理解,实施例不限于此。例如,在一些实施例中,医疗设备可以包括如本文所述的一个或更多个传感器,并且可以被操作以生成关于该设备的操作方式的治疗建议,而不生成使用该设备的初始建议。例如,如上所述,支架-取出器或抽吸导管可包括一个或更多个传感器,以生成关于治疗的状态或执行情况的数据,并可生成治疗建议。作为另一示例,用于治疗慢性完全闭塞(cto)的导丝可以生成关于由传感器接触的组织/物质的信息并生成治疗建议。在cto过程中,当不能穿透凝固的血栓时,可以通过平滑肌组织或血管斑块插入导丝。基于感测到的传感器接触的组织/物质的特征,可以做出如下治疗建议:导丝何时被定位成抵靠平滑肌组织并且可以推进,以及导丝何时穿过了内皮组织并再次位于血管内、位于病变的远侧。另外,在一些实施例中,可以对平滑肌组织的厚度或血管壁的其他特征进行一次或更多次测量,其可以提供导丝将刺穿组织而不是穿过组织的风险的信息。例如,如果测量结果表明导丝的侵入式探针的一侧上的平滑肌组织变薄,则这可能表明侵入式探针存在刺穿血管壁的风险。可以给出使导丝更慢地前进和/或撤回导丝的治疗建议,或者可以生成另一建议。
本领域技术人员将从本文的讨论中理解,存在多种方式,其中医疗设备可被配置成基于病变的特征和/或治疗状态生成治疗建议。图14-15b示出了可用于生成治疗建议的技术的一个示例。
图14示出了在一些实施例中可以由医疗设备实现的用于生成治疗建议的过程1400。
过程1400开始于框1402,其中医疗设备接收病变的一个或更多个特征。医疗设备可以从该医疗设备的组件接收特征,例如在使用包含在医疗设备的侵入式探针中的一个或更多个传感器确定特征的情况下,和/或在由基于该传感器生成的数据生成特征的另一个组件(例如,病变分析设施)确定特征的情况下。在一些实施例中,特征可包括病变的组成。附加地或可替代地,特征可以包括病变在体内的位置、病变的一个或更多个维度(例如,长度、厚度等)、病变的温度或可以基于上述传感器类型确定的其他信息。
在框1404中,医疗设备将在框1402中接收的特征与一个或更多个治疗方案的一个或更多个条件进行比较。医疗设备可以配置有关于多个不同的可用治疗方案的信息,每个治疗方案可以与涉及病变的一个或更多个特征的一个或更多个条件相关联。例如,医疗设备可配置有一个或更多个通过植入支架治疗病变的条件、一个或更多个不同的使用抽吸导管的条件以及一个或更多个其他不同的使用支架-取出器的条件。以上结合图13描述了与病变的组成有关的这样的条件的示例。
医疗设备可以将病变的特征与条件进行比较以确定满足哪些条件。在一些实施例中,治疗方案的各组条件可以是互斥的,使得病变可以仅满足一组条件,因此可以仅选择一种治疗方案。在其他实施例中,各组条件可以不相互排斥,并且医疗设备可以通过识别满足最相应条件的那个或者最接近满足相应条件的那个来确定推荐哪个治疗方案(例如,在条件与值范围相关联的情况下,值最匹配该范围的条件,例如,值落在该范围的中间的条件)。
在框1406中,基于比较,医疗设备可以经由医疗设备的用户界面输出治疗方案的建议,并且过程1400结束。
虽然结合基于病变的特征生成用于治疗病变的初始治疗建议描述了过程1400,但是本领域技术人员会理解如何扩展该技术以在执行治疗期间生成治疗建议,如上面结合框1310所述的。例如,在一些实施例中,基于病变的特征(例如,病变的组成)与治疗的某些参数的一个或更多个条件(例如,抽出支架-取出器的支架的速度)的比较,医疗设备可以输出关于这些参数的建议。
本领域技术人员会理解,存在多种方式来设置可以结合如图14的过程1400的过程使用的治疗方案的条件。例如,可以在至少在一些实验之后将用作条件的病变的特征值硬编码到医疗设备中,以确定值、病变类型和各种治疗方案的成功治疗之间的对应关系。此外,发明人已经认识并理解了系统基于病变的特征和关于病变的成功治疗的信息以及其他信息来学习这种关系和条件的优点。例如,在一些实施例中可以实现机器学习过程,诸如可以包括特征提取和/或分类的机器学习过程。
图15a-15b示出了可以在一些实施例中执行的机器学习过程的示例。图15a示出了可以由医疗设备实现的过程,而图15b示出了可以由与多个不同医疗设备通信的计算设备(例如,服务器)实现的过程。
图15a的过程1500开始于框1502,其中医疗设备生成关于病变特征的信息。在框1504和1506中,医疗设备可以基于病变特征与治疗方案的条件的比较生成对治疗方案的建议,以及监测治疗的进展并在整个治疗过程中生成状态信息。框1502-1506的这些操作可以类似于上面结合图13和图14描述的方式实现,因此,为了简洁起见,将不再描述。另外,在框1506中,医疗设备可以生成关于治疗结果的信息。治疗结果可以指示病变是否被成功治疗、病变是否被移位并释放到受试者的身体中、是否需要多次治疗或指示结果的其他信息。如前所述,可以使用医疗设备的传感器生成指示结果的信息。例如,使用由医疗设备的手柄中的加速度计生成的数据,医疗设备可以确定是否操作多次来移除病变。作为另一示例,如上所述,如果传感器检测到病变然后不再检测到病变,这可能表明病变在受试者中移动了,包括病变移位以及变成栓塞。
在框1508中,在框1502-1506中生成的信息经由一个或更多个有线和/或无线通信连接和/或网络(包括因特网)从医疗设备传输到计算设备。在一些实施例中,计算设备可以在地理上远离医疗设备。在框1508中,在框1506中的传输之后,医疗设备从计算设备接收(例如经由在框1508中通过其传输信息的网络)用于治疗方案的一个或更多个更新的条件。更新的条件可以识别用于评估相对于病变特征的条件的新值。医疗设备可以将其自身配置为应用一个或更多个更新的条件来生成治疗建议,例如在诸如以上结合图14讨论的过程的上下文中考虑一个或更多个更新的条件。一旦医疗设备配置了更新的条件,过程1500就结束了。
图15b示出了可以由计算设备实现的对治疗病变的报告进行学习的过程,以生成用于选择治疗建议的条件,例如通过类似于上面结合图14讨论的过程的治疗建议。具体地,在图15b的示例中,计算设备结合关于病变的特征的信息来分析关于这些病变的治疗的报告,以识别成功(和/或不成功)的治疗与病变特征之间的关系。通过识别这种关系,可以得出关于哪种治疗方案对于特定类型的病变是最佳的结论,并且根据这些结论,可以基于特定病变的特征生成用于治疗该病变的治疗建议,如在图14的示例中所述的。类似地,如上所述,基于关于治疗状态或治疗的执行情况的信息,可以确定关于执行治疗的方式的建议(例如,在支架-取出期间抽出支架的时间或速度)。虽然将在基于病变特征生成初始选择用于病变的治疗方案的条件的上下文中描述图15b的示例,本领域技术人员将从以下描述中理解如何扩展该技术以用于生成关于执行治疗的方式的建议。
发明人已经认识并理解,可以使用机器学习过程有利地确定这些条件的生成以及成功/不成功的治疗与病变特征之间的关系的识别。各种机器学习算法在本领域中是已知的,并且可以适用于该上下文。一些机器学习算法可以基于特征提取和分类技术来执行,其中识别单元的组(分类)并且分析单元的特性以确定哪些特性和/或这些特性的值最对应或预测组中的正确成员关系。基于这些所识别的特性,随后接收的具有这种特性的未分类的单元可以基于未分类单元的属性和/或属性值与每个组的属性/值的比较被“分类”到组/分类中的一个中。在一些机器学习应用中,可以在机器学习过程的配置期间手动识别组/分类。此外,或者在其他情况下,例如,当机器学习过程通过其分析发现新的分组可以更好地表征某些单元时,机器学习过程可以通过例如创建新的组/分类来随时间确定或调整组/分类。机器学习的完整讨论超出了本文的范围,并且对于理解本文描述的技术不是必需的。本领域技术人员会理解如何实现与本文描述的信息和目标结合使用的机器学习技术。
这里,组可以被定义为治疗方案或治疗结果,并且将在该上下文中描述图15b的示例。在这种情况下,可以由病变的特征和/或治疗的状态来定义组。在这种情况下,当病变的特征和/或治疗的状态与组的特征匹配时,可以选择相应的治疗方案用于输出。附加地或可替代地,在一些实施例中,组可以与不同类型的病变(每种类型具有与其他类型不同的一个或更多个特征或特征范围)和/或治疗的状态相关联,然后这些不同的组可以与特定的治疗方案或操作治疗设备的方式相关联。在后一种情况下,当特定病变的特征或治疗的状态与组匹配时,可以选择该组的相应治疗建议用于输出。
图15b的过程1520开始于框1522,其中在一个或更多个计算设备上执行的学习设施随时间接收关于医疗设备对病变的治疗的多个报告。医疗设备可以是根据上述实施例操作的医疗设备。报告可以包括关于被治疗的病变的信息,例如病变的一个或更多个特征。该报告还可以包括关于治疗病变的方式的信息,例如在一个或更多个用于治疗病变的治疗设备上以及治疗这些病变的方式的信息。在报告中还可以包括关于治疗结果的信息,例如治疗是否成功、是否需要多次治疗、病变是否移位并成为栓塞或其他结果。
报告可以包含由医疗设备的一个或更多个传感器确定的信息,包括传感器的示例和上述信息的类型。如上所述,实施例中可以包括各种类型的传感器,包括一个或更多个电、机械、光学、生物或化学传感器。这种传感器的具体示例包括电感传感器、电容传感器、阻抗传感器、eis传感器、电阻抗断层成像(eit)传感器、压力传感器、流量传感器、剪切应力传感器、机械应力传感器、变形传感器、温度传感器、ph传感器、化学成分传感器(例如o2离子、生物标记或其他成分)、加速度传感器和运动传感器。应当理解,可以从这些传感器生成各种类型的特征或其他信息。这些信息中的任何一个都可以包含在报告中并在过程1520中用于生成与治疗建议相关联的条件。例如,如上所述,设置在医疗设备的手柄内的加速度计可以跟踪医疗设备的运动并且可以用于确定是否进行了多次治疗以治疗凝块。作为另一示例,力传感器可以指示用于抽出支架-取出器的力,或者一组阻抗传感器可以基于取出期间在支架-取出器的支架的一个或更多个传感器处检测到的阻抗是否随时间变化来确定在取出期间病变是否部分地或完全地与支架分离。从上面的讨论中,本领域技术人员将理解可以由医疗设备的传感器生成不同类型的数据以包括在这样的报告中。
报告还可以包括可以由临床医生输入的信息或从可以与医疗设备交互操作的另一系统得到的信息。例如,报告可以包括关于受试者的解剖结构内的病变位置的信息,例如病变是否在颅动脉、股动脉、肺静脉、胆总管或其他导管中。该信息可以由临床医生通过用户界面输入,或者例如从诸如血管造影设备的另一系统得到。
在框1522中接收的报告可以是从多个医疗设备随时间接收的,所述医疗设备可以在地理上是分散的。通过随着时间接收这些报告以及这些报告的内容,可以生成一组条件和定义推荐的或最佳实践的治疗建议。
因此,在框1524中,学习设施对报告中的信息进行分析以识别病变特征(和/或操作治疗设备的方式)、用于治疗具有那些特征的病变的方案以及成功的治疗之间的关系。基于该分析,学习设施可以学习这些信息之间的关系。这种关系可以指示某些治疗方案何时成功或不成功,或者不同的治疗方案对于哪些类型的病变是成功的或不成功的。
基于框1524中的该分析,学习设施(通过机器学习过程的特征提取和分类过程)可以在框1526中生成针对每个治疗方案的条件。这些条件可能与病变的特征相关联,从而表明可以用每种治疗方案成功治疗的病变的不同特征或特征范围。例如,条件可以涉及病变的粘-弹性的值的范围,使得一个范围内的粘-弹性可以与使用抽吸导管的治疗相关联,而另一范围内的粘-弹性可与使用支架-取出器的治疗相关联。以这种方式,当检测到具有特定粘-弹性的病变时,可以使用与这些条件的比较(如图14的过程中)来确定为该特定病变推荐哪种治疗方案。
在框1528中,一旦在框1526中生成条件,就可以将条件分发给医疗设备,使得设备可以被配置成使用那些条件来生成治疗建议,如上面结合图15a所讨论的。一旦条件被分发,过程1520就结束。
虽然在图15b中将过程1520讨论为离散过程,但是应当理解,在一些实施例中,接受报告和确定条件可以是随时间重复的过程,包括连续地或以离散间隔随时间重复的过程。因此,在一些实施例中,可以多次执行过程1520,或者在框1528中分发条件之后,学习设施可以返回到框1522以接收附加报告并继续学习过程。
以上提供了用于在诊断和/或治疗病变期间向临床医生提供反馈的设备和过程的示例,包括在诊断和/或治疗期间提供治疗建议。在一些实施例中,除了在诊断和/或治疗期间提供这样的反馈之外或作为其替代,医疗设备可以被配置为在诊断/治疗中操作医疗设备之后向临床医生呈现关于诊断和/或治疗的信息。图16示出了诸如这种过程的示例。
过程1600在框1602、1604开始,其中操作医疗设备以生成关于病变的特征和治疗的执行情况的信息,以及关于执行治疗的方式的建议。框1602、1604的操作可以类似于上面讨论的数据生成的示例。
在框1606中,在治疗之后,在框1602、1604中生成的信息由记录生成设施使用以生成治疗的记录。治疗的记录可以包括以下信息:随时间如何操作设备的信息、检测到病变的哪些特征、医疗设备提出了什么建议以及临床医生是否遵循了这些建议。如果在治疗中检测到错误,例如丢失部分或全部病变导致例如形成栓塞或需要后续治疗,则记录生成设施可以分析该错误以确定错误的原因。例如,如果传感器在一个时刻检测到病变的一部分与支架-取出器分离,并且在紧接在前的时刻,另一个传感器检测到向支架-取出器施加了突然的力,则记录生成设施可以在记录中注明这一点。如果施加到支架-取出器的力超过了医疗设备建议的最大力,或者医疗设备以与治疗建议不一致的任何其他方式操作,则这可以在记录中注明。当这些信息包括在记录中时,可以向临床医生做出关于如何在未来过程中避免出错的建议。
另外,在一些实施例中,记录生成设施可以在记录中包括关于病变的详细信息和病变的可能原因,以帮助临床医生诊断病变。例如,虽然在一些实施例中,在治疗期间可以输出病变的简短表征(例如,病变是粘性的),但是在记录中,可以输出关于组成的更详细的信息(例如,病变主要由胆固醇组成)。另外,记录生成设施可以在受试者中病变的位置的背景下分析组成以确定,例如,病变是否由损伤形成、是否为在病变部位形成的血栓或者是否为在病变部位卡住的栓塞。例如,如果病变主要由平滑肌细胞或动脉粥样硬化等组织组成,则病变可能是受伤后部位的生长。作为另一示例,如果病变的组成表明它在具有高剪切应力的解剖结构区域中形成,但病变位于具有低剪切应力的解剖结构区域,这可能表明病变是卡在该部位的栓塞。
一旦在框1606中生成了记录,就输出记录以呈现给用户(例如,经由显示器呈现,或存储到存储器或经由网络传输),并且过程1600结束。
示例
以下描述的是可以使用医疗设备和技术的场景的各种示例。然而,应该理解的是,实施例不限于根据这些示例中的任何一个进行操作。
示例1
可以使用本文描述的技术的方式的一个示例是侵入式智能导丝。侵入式导丝可用于通过血管系统。使用本文所述的传感器和分析技术,侵入式导丝可以表征与其接触的组织/物质,并将该组织/物质的特征传达给临床医生。侵入式导丝还可以帮助附加设备到达患者体内的介入部位。
在该示例中,导丝包括传感器(优选地,eis传感器)、阻抗谱仪和手柄。导丝还可以包括可以在使用期间沿其长度插入的附加组件。传感器可用于感测和表征与其接触的组织/物质的特性。例如,当与阻抗谱仪一起使用以执行高频阻抗测量时,传感器可用于确定组织/物质组成。传感器和阻抗谱仪都优选地位于导丝的侵入尖端处,使得能够表征与尖端相邻的组织,而不需要将传感器连接到阻抗谱仪的长电线。该设计可以减少在阻抗谱仪位于受试者外部时可能插入电信号中的电子噪声。
手柄可以包含附加组件,例如用于与用户通信、在手术期间和手术后记录和传输数据、处理数据以及为设备供电的组件。这样的组件的示例包括:反馈单元,例如用户可读的显示器或指示灯;用于无线地或通过电缆传输数据的单元;数据库;处理器和电池。手柄能够从其他设备组件上拆卸;它也能够可拆卸地连接到导丝本身的电路上。
示例2
临床医生可以使用示例1中描述的导丝来确定针对动脉被阻塞的患者的最佳治疗策略。临床医生能够使用导丝来表征阻塞动脉的组织/物质,然后基于该信息在不同的可能治疗方案之间进行选择。在一些实施例中,导丝可基于其已执行的一个或更多个表征,并且可选地,基于来自借助于导丝执行的先前治疗的数据,向临床医生提供治疗建议。
在该示例中,临床医生能够使用导丝来评估和治疗动脉病变。临床医生能够首先将导丝转向血栓部位,可选地使用手柄来操作,然后穿透血栓。接下来,临床医生可以使用导丝来测量血栓和/或阻塞动脉的组织/物质的组成。然后,临床医生可以基于该测量结果确定针对被阻塞的动脉的最佳治疗。例如,如果阻塞组织由来自患者的动脉壁的细胞组成,则临床医生可以决定使用支架设备。如果阻塞组织是血栓,则临床医生能够决定测量其粘弹性,然后根据该信息确定是否使用抽吸导管或支架来移除凝块。
在一些实施例中,临床医生还可以从导丝接收治疗建议。治疗建议可以基于导丝在动脉病变上执行的表征和/或基于在导丝的先前使用期间收集的数据。
在治疗结束时,临床医生可以从导丝上移除手柄并借助导丝插入适当的介入设备。
示例3
可根据本文描述的技术使用的设备的另一个示例是智能支架-取出器。支架-取出器可用于从患者中取出血凝块。使用本文所述的传感器和分析技术,侵入式支架-取出器可以表征与其接触的凝块并将该组织/物质的特征传达给临床医生。
在该示例中,支架-取出器包括至少一个传感器(优选地至少一个eis传感器和/或eit传感器)、测量单元和手柄。支架-取出器可以包括在多个关键位置处的多个传感器,使得能够从与其接触的血凝块内的多个位置获得关于该凝块的信息。当支架-取出器包括一个以上的传感器时,传感器能够感测与其接触的凝块的不同特性。例如,支架-取出器可包括能够感测凝块与支架-取出器的结合的一个或更多个传感器,能够感测支架-取出器随时间变化的位置的一个或更多个传感器,和/或能够感测施加到凝块上的力的一个或更多个传感器。可以通过感测支架的电感和/或eit信号随时间的变化来确定支架-取出器与凝块的结合。因为支架的电感和eit值会随支架的扩张和周围环境而变化,所以这些特性的恒定值表明支架已达到其最大膨胀并结合到凝块中。运动传感器可用于感测支架-取出器随时间变化的位置。该特征能够使临床医生了解支架-取出器在患者体内的运动并确定支架-取出器在取出凝块期间所进行的通过次数。还可以包括应力传感器以测量由支架-取出器施加到凝块或组织/物质上的力。
支架-取出器的测量单元可以是阻抗谱仪和/或断层摄影单元。该单元优选地靠近支架-取出器的尖端,使得能够表征与支架-取出器相邻的凝块,而不需要将传感器连接到测量单元的长电线。该设计可以减少阻抗谱仪位于受试者外部时可能插入电信号中的电子噪声。
手柄可以包含如示例1中所述的附加组件。它还能够包括自动化的牵引机构,以允许准确和自动地取出凝块。
示例4
临床医生可以同时使用示例1中描述的导丝和示例3中描述的支架-取出器,以便为动脉阻塞的患者确定并执行最佳治疗策略。临床医生能够使用导丝来表征阻塞动脉的组织/物质,然后使用支架-取出器来取出凝块和/或血栓。可选地,能够在取出凝块期间收集数据并将其上载到数据库以供以后分析。
在该示例中,临床医生能够使用智能设备的组合来治疗动脉被阻塞的患者。临床医生可以首先利用护套插入导丝并使用导丝(如上所述使用侵入式探针)来评估病变,如示例2中所述的。如果临床医生根据导丝提供的信息和/或推荐决定接下来使用支架-取出器,临床医生移除导丝,将护套留在适当位置,并沿着护套插入支架-取出器并将其转移到凝块和/或血栓中。一旦支架穿透凝块和/或血栓,结合到支架-取出器中的传感器能够感测凝块和/或血栓的方面,并且随时间变化将该信息(例如,在外部显示器上)提供给临床医生。例如,eis和/或eit传感器能够表征支架与凝块和/或血栓的结合以及凝块和/或血栓的形状和组成。支架-取出器还可以使用来自先前取出凝块和/或血栓的数据来向临床医生提供治疗建议。治疗建议可以包括,例如,支架-取出器与凝块和/或血栓的结合是最佳的信号和/或关于拉动凝块和/或血栓的适当速度和力的建议。
此时,临床医生可以根据由支架-取出器提供的信息和/或建议来取出凝块和/或血栓。临床医生可以决定使用结合在支架-取出器中的自动牵引机构来取出凝块。然后,自动牵引机构可以使用由支架-取出器基于从先前取出凝块和/或血栓的数据库接收的数据所确定的速度和力来拉动凝块和/或血栓。如果凝块和/或血栓与支架取出器分离,则支架-取出器使用警报向临床医生发出信号。然后临床医生可以再次穿透凝块和/或血栓并重新开始取出过程。
在凝块和/或血栓的取出结束时,干预期间收集的所有数据能够传送到数据库中供以后分析。
示例5
可根据本文描述的技术使用的设备的另一个示例是智能抽吸导管。抽吸导管可用于从患者中取出血凝块。使用本文所述的传感器和分析技术,侵入式抽吸导管可以表征与其接触的凝块并将该组织/物质的特征传达给临床医生。
在该示例中,抽吸导管包括至少一个传感器(优选地至少一个eis传感器和/或eit传感器)、测量单元和手柄。类似示例3,抽吸导管可以包括在多个关键位置处的多个传感器,使得能够从与其接触的血凝块内的多个位置获得关于该凝块的信息。当抽吸导管包括多于一个的传感器时,传感器能够感测与其接触的凝块的不同特性。例如,抽吸导管可包括示例3中描述的一个或更多个传感器(即,能够感测凝块与抽吸导管的结合的一个或更多个传感器,能够感测抽吸导管随时间变化的位置一个或更多个传感器,和/或能够感测施加到凝块上的力的一个或更多个传感器)。抽吸导管还可以包括能够监测抽吸导管内的血流的附加传感器。
抽吸导管的测量单元和手柄单元与示例3中描述的支架-取出器的测量单元和手柄相同。
示例6
临床医生可以一起使用示例1中描述的导丝和示例5中描述的抽吸导管,以针对动脉被阻塞的患者确定并执行最佳治疗策略。临床医生能够使用导丝来表征阻塞动脉的组织/物质,然后使用抽吸导管来取出凝块和/或血栓。可选地,能够在凝块取出期间收集数据并将其上传到数据库以供以后分析。
在该示例中,临床医生能够使用智能设备的组合来治疗动脉被阻塞的患者。临床医生可以首先插入导丝并使用它来评估病变,如示例2中所述的。如果临床医生根据导丝提供的信息和/或建议而决定接下来使用抽吸导管,则临床医生沿着导丝插入抽吸导管,将其引导到凝块和/或血栓中,并且开始抽吸过程。在吸出凝块和/或血栓期间,外部显示器将向临床医生提供以下信息:关于移除进展的信息,由eis和/或eit传感器检测到的凝块和/或血栓的形状和组成的信息,以及凝块和/或血栓通过抽吸导管的信息。智能抽吸导管还可基于抽吸导管与凝块的结合确定开始移除凝块和/或血栓的最佳时间,并发信号将此状况通知临床医生。然后临床医生可以开始移除凝块和/或血栓。如果凝块和/或血栓与抽吸导管分离,则抽吸导管将使用警报向临床医生发出信号。然后临床医生可以再次穿透凝块和/或血栓并重新开始取出过程。当传感器检测到血栓已经被完全吸出并且沿着抽吸器的管传递时,可以生成并输出指示成功移除的另一消息。
在凝块和/或血栓的取出结束时,干预期间收集的所有数据都能够传送到数据库中供以后分析。
示例7
示例1中描述的导丝可用于治疗经受慢性完全闭塞(cto)的患者。在这种情况下,患者的动脉被时间久的和刚性的血栓阻塞,临床医生可能难以穿透血栓以重建血流。临床医生可以使用智能导丝来感测病变的位置并穿过病变。在操作期间,导丝能够向临床医生提供关于何时开始穿透病变以及何时通过病变到达动脉内腔的信息。如果血栓太硬而不能穿透,则临床医生能够将导丝穿过邻近病变的动脉壁。在这种情况下,导丝能够向临床医生提供关于其在动脉粥样硬化/斑块内的位置的连续信息。这可以帮助临床医生避免刺穿血管。
示例8
图21包括可在病变内发现的不同生物物质的值的直方图。沿x轴绘制的值是使用上述图4-11的方法生成的值,包括在这些图的描述中讨论的有效电容值。y轴示出了针对每个x轴值收集的样本数。数据是在本文所述的技术和设备的临床前动物测试期间收集的。
如图21所示,不同生物物质的有效电容值是明显可区分的,每种类型的病变明显与有效电容值的范围相关联。这些值可以从多个实验中确定,之后医疗设备可以配置成使用这些范围来诊断或以其他方式识别病变。随后,当确定生物物质的有效电容时,医疗设备可以将该有效电容与范围进行比较,以确定生物物质的有效电容值匹配哪个范围。然后,医疗设备可以基于匹配来诊断或以其他方式识别生物物质。
当对在病变内检测到的多种生物物质执行该过程时,可以以相同的方式识别该多种生物物质中的每一种。然后可以在与不同类型的病变相关的条件的背景下分析病变的多种生物物质,所述条件例如为特定类型的病变由特定生物物质集合的组成表征。一旦该组生物物质与特定类型的病变相匹配,就可以将该组生物物质所属的病变识别为该特定类型。
操作医疗设备用于肿瘤学的方法
发明人已经认识并理解用于检查潜在癌细胞的常规技术通常不令人满意。例如,一种用于检查潜在癌细胞的常规技术使用针来移除组织样本。为了帮助指导临床医生插入针,使用常规成像系统,例如x射线、超声或磁共振成像(mri)。然而,使用这些技术生成的图像通常是不准确或模糊的,因此使得临床医生难以确定针是否与目标细胞或组织接触。因此,使用这种技术诊断和/或治疗癌细胞通常是不准确的。因此,当试图确定特定病变是否是癌性时,显著的风险是用于检查潜在癌性病变的针实际上没有接触病变而是接触了附近的健康组织,从而导致不正确的样本和不正确的医学结论。类似地,当试图去除癌细胞时,可能出现两种不期望的情况:健康组织可能与癌细胞一起被移除,或者一些癌细胞可能未被去除。
因此,根据本文描述的一些实施例,医疗设备可用于确定癌细胞/组织的存在、癌细胞/组织的特征和/或癌细胞/组织的类型(例如,上皮组织来源的肿瘤(carcinoma)、淋巴瘤、骨髓瘤、赘生物、黑素瘤、转移瘤或肉瘤)。本文描述的技术类型可以至少部分地基于癌细胞/组织的特征提供关于如何治疗癌细胞/组织的建议。例如,在某些情况下,可以建议消融或去除癌细胞/组织以及消融或去除的方式。
以上参照图2-11详细描述了医疗设备、传感器和感测癌细胞的组织/物质的方式的示例。以下结合图18-20描述了可以由这样的医疗设备实现和/或可以操作医疗设备以执行的技术的示例。
图18示出了例如可以由根据本文描述的一些技术操作的医疗设备执行的过程1800。在图18的示例中,传感器可以设置在诊断和/或治疗设备中,例如在针、消融导管、射频探针、机器人探针、腹腔镜或切割设备中。在一些实施例中,传感器设置在医疗设备的末端附近。医疗设备可以基于使用传感器确定的癌细胞的特征生成治疗建议。
过程1800在框1802开始,其中,操作医疗设备的侵入式探针以检测接近传感器的病变的一个或更多个特征(例如,大小和/或组成),该病变可以是癌组织或细胞。在过程1800开始之前,可将侵入式探针插入动物体内并移动到病变的预测位置附近。然后操作医疗设备以检测传感器何时接触病变。可以通过评估传感器输出的值随时间的变化(例如,阻抗的变化)来确定与已知为或可能是癌性的病变或组织的接触。例如,当侵入式探针的传感器没有接触癌组织/细胞时,或者没有接触已知其一部分是病变的组织时,医疗设备可以(例如,通过用户界面向用户)输出一个结果。
例如,当侵入式探针通过动物朝向要研究的病变移动时,医疗设备可以输出指示其正在接触组织的值。在一些实施例中,该值可以是定性值,包括二元值,例如是/否或真/假值,以指示侵入式探针是否接触病变。
医疗设备可以通过确定侵入式探针是否接触生物物质来确定侵入式探针是否接触病变,通过分析侵入式探针接触的生物物质(包括与侵入式探针接触的组织),来确定侵入式探针是否接触任何“异常”的生物物质,因此确定任何“异常”的生物物质可能是病变的一部分。在一些实施例中,医疗设备可通过评估侵入式探针在动物内的位置来确定探针接触的生物物质是否“异常”,该位置可指示侵入式探针可预期接触的生物物质。
医疗设备可以另外地或可替代地基于对病变的预测来确定侵入式探针是否接触病变,该预测可以由临床医生作为初步诊断的结果输入。例如,临床医生可以输入初步表征病变的信息,例如,病变是在脉管系统中或是器官中的病变,或者在器官病变的情况下器官是什么,对病变组成的预测,或对病变的组织或细胞状态(例如,不健康、发炎、癌变、患病等)的预测。在输入这种信息的实施例中,临床医生可以单独地输入初步表征病变的信息,或者可以选择可以与初步表征病变的这种信息相关联的病变的初步诊断(例如,选择特定类别的动脉粥样硬化,也可以选择其他信息,如动脉粥样硬化的预期组成和它位于脉管系统中)。当侵入式探针移动通过动物时,医疗设备可将侵入式探针接触的生物物质与病变的初步表征进行比较,以确定侵入式探针是否接触病变。例如,如果病变已被初步诊断为可能是脑肿瘤的脑损伤,则医疗设备可以确定侵入式探针是否已接触异常脑组织和/或侵入式探针是否已接触癌性脑组织,并输出这个结果。
在其他实施例中,不是仅仅提供指示侵入式探针是否接触病变的二元值,医疗设备可以输出指示侵入式探针的传感器所接触的一个或多个生物物质的值,其可以随着探针移动通过身体而变化。指示物质的值可以是物质的标识,例如使用本文所述的技术确定的由阻抗谱标识的物质列表。在其他实施例中,所述值可以是数值,例如由传感器检测的值(例如,阻抗值或阻抗谱)或其他值。
可以移动探针及其传感器直到接触病变,一旦接触,此时,医疗设备输出的结果可以改变。以这种方式,可以使用侵入式探针确定病变的位置,并且可以确定侵入式探针正在接触病变。
在一些情况下,还可以操作侵入式探针来确定病变的几何形状。例如,在一些实施例中,可以通过在可能包括癌组织(例如,肿瘤)的病变附近移动侵入式探针并确定侵入式探针的传感器何时接触或未接触病变,来确定病变的几何形状。例如,如果对侵入式探针输出的值的分析确定病变包括癌组织,则可以随时间移动侵入式探针并且针对不同传感器确定各个传感器是否正在接触癌组织。然后医疗设备可以分析侵入式探针(例如,如上所述使用加速度计测量)的移动量和侵入式探针上的传感器的位置,来确定动物内的癌组织的几何形状,包括癌组织的一个或更多个维度。
在一些这样的实施例中,医疗设备可基于病变的几何形状确定针对病变的一种或更多种治疗建议。
在可以在诸如图18中所示的实施例中实施的一个治疗方案中,消融可以用作治疗癌组织的第一选择。因此,在框1804中,将诸如针或射频探针的消融设备插入动物中。在一些实施例中,消融设备可包括侵入式探针,该侵入式探针包括本文所述类型的传感器。可以移动消融设备,直到消融设备确定已经与癌细胞或组织接触。(但是,应当理解,实施例不限于使用包括侵入式探针的消融设备进行操作。在其他实施例中,侵入式探针是单独医疗设备的一部分,并且在定位侵入式探针之后,移动消融设备直到位于侵入式探针附近并因此位于癌细胞/组织附近。)
在框1804中,在将消融设备放置在癌细胞/组织附近之后,操作消融设备以消融癌细胞/组织。在一段时间之后,可以操作消融设备以确定消融设备是否对癌细胞/组织有影响。例如,在一些实施例中,可以生成治疗建议,其引导临床医生执行消融,包括消融是否有效以及是否继续消融。因此,在框1806中,传感器可以提供指示消融设备是否仍然与癌细胞或癌组织接触的信息。可以使用本文描述的技术进行该确定。可以处理该信息并且可以用于提供治疗建议,例如是停止消融还是继续消融,或者在确定是否停止消融之前检查侵入式探针的定位。
在一些实施例中,消融设备可包括用于消融的多个不同电极,例如位于不同位置的不同电极,并且不同的电极可以是可单独操作的,使得可以同时操作一些电极来执行消融而其他电极未被操作来执行消融。在一些实施例中,每个消融电极可以设置在感测电极附近,根据本文描述的技术操作感测电极以确定由感测电极接触的生物物质。消融设备可使用感测电极确定消融设备的特定部分是否接触癌组织/细胞或非癌组织/细胞。在一些这样的实施例中,响应于确定消融设备的一部分正在接触非癌组织,消融设备可以不操作消融设备的那部分的消融电极,以限制为仅消融癌组织并且最小化可能对非癌组织造成的损伤。
以这种方式,如果该治疗无效,则临床医生可以停止消融,并且临床医生可以仅在消融设备与癌细胞/组织接触时继续消融并且仅消融癌组织。因此,临床医生可以在治疗结束时对治疗是否成功并且如果成功则所有癌细胞/组织都已被消融更有信心。以这种方式,减轻了消融健康组织的风险或未消融癌细胞的风险。
因此,如图18所示,如果确定消融设备仍然与癌细胞/组织接触,则过程1800前进到框1808,其中提供继续消融的建议,并且迭代到框1804。否则,如果确定消融探针不再与癌细胞/组织接触,则在框1810中提供停止消融的建议。可以通过重新定位消融设备来重复该过程。如果即使在多次尝试重新定位消融设备之后仍不能形成与病变的接触,则过程1800结束。
图19示出了根据另一实施例的操作医疗设备以生成针对癌细胞/组织的治疗建议的方式的示例。在图19的实施例中,医疗设备可以包括沿探针外部排列的多个传感器,例如在上面讨论的图3的示例中的传感器。从前述内容可以理解,利用这种传感器阵列,可以确定癌性病变的几种不同特征,包括癌性病变的组成。例如,如上所述,通过对癌性病变进行eis处理,可以确定癌性病变的组成。
图19的过程1900开始于框1902,其中将医疗设备插入动物受试者的身体中并操作以检测癌性病变的一个或更多个特征,包括癌性病变的组成。基于包括组成的特征,医疗设备可以在框1904中选择要推荐的治疗方案。基于组成,过程1900可以确定被探测的癌性病变的类型,并且可以提供适当的治疗建议。例如在以上其他实施例中描述的,医疗设备可以配置有关于不同生物物质的阻抗谱和其他电特性(例如,有效电容)的信息以及关于不同病变的组成的信息,这样可以使用阻抗谱识别生物物质,并且可以基于生物物质识别病变。医疗设备可以进一步配置有针对不同类型病变的不同治疗建议,例如对不同类型的癌性病变的治疗建议。在一个示例中,如果使用病变的不同生物物质的阻抗谱确定癌性病变是上皮组织来源的肿瘤或是其一部分,则可以提供移除癌性病变的建议。在另一示例中,如果确定癌性病变是黑素瘤的一部分,则可以推荐射频消融。医疗设备可以以任何合适的方式选择治疗方案。
一旦在框1904中推荐了治疗,医疗设备可在框1906中监测所选治疗方案的执行情况。医疗设备可以使用一个或更多个传感器监测治疗,例如在框1902中用于确定特征的一个或更多个传感器或者操作以执行该治疗的治疗设备的一个或更多个传感器。例如,如果在框1904中建议消融,则临床医生可以插入消融设备。消融设备可以具有传感器,例如温度传感器,用于在进行消融时感测癌性病变的状态。传感器可以通过确定癌性病变是否被燃烧或冷冻来检测消融是否成功。
在框1908中,医疗设备经由用户界面输出关于治疗状态的信息,以呈现给临床医生。然后,过程1900结束。
虽然在生成治疗建议的背景下给出了监测治疗的示例,但是应当理解,可以使用类似的技术来向临床医生发出关于治疗状态的出错消息或其他消息。例如,如果治疗设备上的传感器在一段时间内指示存在癌性病变,而之后传感器不再检测到癌性病变,则医疗设备可以确定治疗设备未正确定位或者癌性病变丢失。这可能表明需要重新定位该设备或癌性病变已经移动。通过用户界面向临床医生发送的消息可以指示这样的潜在问题。
另外,尽管图19的示例描述了操作医疗设备以提供与初步选择治疗有关的治疗建议以及与执行该治疗的后续方式有关的治疗建议的方式,但从上述内容应当理解,实施例不限于此。例如,在一些实施例中,医疗设备可以包括如本文所述的一个或更多个传感器,并且可以被操作以生成关于该设备的操作方式的治疗建议,而不生成使用该设备的初步建议。例如,如上所述,针或射频探针可包括一个或更多个传感器,以生成关于治疗的状态或执行情况的数据,并可生成治疗建议。
图20示出了在一些实施例中可以由医疗设备实现的用于生成治疗建议的过程2000。
过程2000开始于框2002,其中使用本文所述的技术来操作医疗设备以确定癌性病变的一个或更多个特征(例如,大小和/或组成)。例如,在如下情况下:使用包括在医疗设备中的一个或更多个传感器来确定特征和/或由基于传感器生成的数据生成特征的另一个组件来确定特征,医疗设备可以从医疗设备的组件接收特征。在一些实施例中,特征可包括癌性病变的组成。特征可以附加地或可替代地包括癌性病变在体内的位置、癌性病变集合的一个或更多个维度(例如,长度、厚度等)、癌性病变的温度或可以基于上述不同类型的传感器确定的其他信息。
在框2004中,医疗设备将在框2002中接收的特征与一个或更多个治疗方案的一个或更多个条件进行比较。医疗设备可以配置有关于多个不同的可用治疗方案的信息,每个治疗方案可以与涉及癌性病变的一个或更多个特征的一个或更多个条件相关联。治疗方案可包括消融、去除和活组织检查。以上结合图19描述了与癌性病变的组成有关的这样的条件的示例。
医疗设备可以将癌性病变的特征与条件进行比较以确定满足哪些条件。在一些实施例中,治疗方案的各组条件可以是互斥的,使得癌性病变可以仅满足一组条件,因此可以仅选择一种治疗方案。在其他实施例中,各组条件可以不是相互排斥的,并且医疗设备可以通过识别满足最相应条件的方案或者最满足相应条件的方案来确定推荐哪个治疗方案。例如,在不同条件与不同的值范围(例如阻抗谱的范围)相关联的情况下,可以通过识别病变的值最接近匹配的范围来确定条件。最接近的匹配可以是例如病变的阻抗谱或其他值落入范围内,或病变的阻抗谱或其他值离该范围的边界值最远,或者与该范围重叠最多。
在框2006中,基于比较,医疗设备可以经由医疗设备的用户界面输出治疗方案的建议,并且过程2000结束。
本领域技术人员理解,存在多种方式来设置可以结合如图20的过程2000的过程使用的治疗方案的条件。例如,可以在至少一些实验之后将作为条件的、癌性病变的特征值硬编码到医疗设备中,以确定值、癌细胞/组织的类型和各种治疗方案的成功治疗之间的对应关系。此外,发明人已经认识并理解系统基于癌细胞/组织的特征和关于癌细胞/组织的成功治疗的信息以及其他信息来学习这种关系和条件的优点。例如,在一些实施例中可以实现诸如可以包括特征提取和/或分类的机器学习过程。
计算机实施方式
根据本文描述的原理操作的技术可以以任何合适的方式实现。以上讨论中包括一系列流程图,其示出了表征导管病变和/或生成用于治疗病变的一种或更多种治疗建议的各种过程的步骤和动作。上面的流程图的处理和决策块表示可以包括在执行这些各种过程的算法中的步骤和动作。从这些过程导出的算法可以实现为与一个或更多个单用途或多用途处理器集成并指导其操作的软件,可以实现为功能等效电路,例如数字信号处理(dsp)电路或专用集成电路(asic),或者可以以任何其他合适的方式实现。应当理解,本文包括的流程图不描绘任何特定电路或任何特定编程语言或编程语言类型的语法或操作。相反,流程图示出了本领域技术人员可以用来制造电路或实现计算机软件算法的功能信息以实现对执行本文所述类型的技术的特定装置的处理。还应当理解,除非本文另有说明,否则每个流程图中描述的特定步骤和/或动作的顺序仅仅是对可以实施的算法的说明,并且在本文描述的原理的实现方式和实施例中可以是不同的。
因此,在一些实施例中,本文描述的技术可以体现为计算机可执行指令,该指令可以实现成软件,包括应用软件、系统软件、固件、中间件、嵌入代码或任何其他合适类型的计算机代码。这样的计算机可执行指令可以使用许多合适的编程语言和/或编程或脚本工具中的任何一种来编写,并且还可以被编译为在框架或虚拟机上执行的可执行机器语言代码或中间代码。
当本文描述的技术体现为计算机可执行指令时,这些计算机可执行指令可以以任何合适的方式实现,包括作为多个功能设施,每个功能设施提供一个或更多个操作以完成根据这些技术操作的算法的执行。然而,实体化的“功能设施”是计算机系统的结构组件,当与一个或更多个计算机集成并由一个或更多个计算机执行时,使得该一个或更多个计算机执行特定的操作任务。功能设施可以是软件元件的一部分或整个软件元件。例如,功能设施可以实现为过程的函数、单独的过程或任何其他合适的处理单元。如果本文描述的技术被实现为多个功能设施,则每个功能设施可以以其自己的方式实现;并非所有这些都需要以同样的方式实现。另外,这些功能设施可以在适当情况下并行和/或串行执行,并且可以使用它们在其上执行的计算机上的共享存储器、使用消息传递协议或以任何其他合适的方式在彼此之间传递信息。
通常,功能设施包括执行特定任务或实现特定抽象数据类型的例程、程序、对象、组件、数据结构等。通常,可以根据需要将功能设施的功能组合在或分布在它们运行的系统中。在一些实施方式中,执行本文技术的一个或更多个功能设施可以一起形成完整的软件包。在可替代实施例中,这些功能设施可以适于与其他不关联的功能设施和/或过程交互,以实现软件程序应用。
本文已经描述了用于执行一个或更多个任务的一些示例性功能设施。然而,应当理解,所描述的功能设施和任务划分仅仅是可以实现本文所述的示例性技术的各类功能设施的说明,而实施例不限于以任何特定数量、划分或类型的功能设施实现。在一些实施方式中,所有功能可以在单个功能设施中实现。还应当理解,在一些实施方式中,本文描述的一些功能设施可以与其他功能设施一起实施或与其他功能设施分开实施(即,作为单个单元或单独的单元),或者可以不实施这些功能设施中的一些。
在一些实施例中,实现本文描述的技术的计算机可执行指令(当实现为一个或更多个功能设施或以任何其他方式实施时),可以被编码在一个或更多个计算机可读介质上以向介质提供功能。计算机可读介质包括诸如硬盘驱动器之类的磁介质、诸如光盘(cd)或数字通用盘(dvd)之类的光学介质、蓝光盘、持久性或非持久性固态存储器(例如,闪存、磁性ram等)或任何其他合适的存储介质。这样的计算机可读介质可以以任何合适的方式实现,包括实现为下面描述的图17的计算机可读存储介质1706(即,实现为计算设备1700的一部分)或实现为独立的单独存储介质。如本文所使用的,“计算机可读介质”(也称为“计算机可读存储介质”)指的是有形存储介质。有形存储介质是非暂时性的并且具有至少一个物理结构组件。在如本文所使用的“计算机可读介质”中,至少一个物理结构组件具有至少一个如下的物理特性:可在创建具有嵌入信息的介质的过程中、在其上记录信息的过程中或用信息编码介质的任何其他过程中该特性可以以某种方式改变。例如,可以在记录过程期间改变计算机可读介质的物理结构的一部分的磁化状态。
在其中技术可以体现为计算机可执行指令的一些但非全部的实施方式中,这些指令可以在任何合适的计算机系统中操作的一个或更多个合适的计算设备上执行,或者一个或更多个计算设备(或一个或更多个计算设备的一个或更多个处理器)可以被编程为执行该计算机可执行指令。计算设备或处理器可以被编程为当指令以计算设备或处理器可访问的方式存储时,例如存储在数据存储器(例如,片上高速缓存或指令寄存器、可通过总线访问的计算机可读存储介质等)中时,来执行指令。包括这些计算机可执行指令的功能设施可以与以下设备集成并指导其操作:单个多用途可编程数字计算设备、共享处理能力并联合执行本文所述的技术的两个或更多个多用途计算设备的协同系统、专用于执行本文所述的技术的单个计算设备或(共址或地理上分布的)计算设备的协同系统、用于执行本文所述的技术的一个或更多个现场可编程门阵列(fpga)或者任何其他合适的系统。
图17示出了计算设备1700形式的计算设备的一个示例性实现,该计算设备1700可以在实现本文描述的技术的系统中使用,然而其他示例也是可行的。应当理解,图17既不是用于计算设备根据本文描述的原理来操作的必要组件的描述,也不是全面描述。
计算设备1700可以包括至少一个处理器1702、网络适配器1704和计算机可读存储介质1710。计算设备1700可以是例如如上所述的医疗设备、台式或膝上型个人计算机、个人数字助理(pda)、智能移动电话、服务器或任何其他合适的计算设备。网络适配器1704可以是任何合适的硬件和/或软件,以使计算设备1700能够通过任何合适的计算网络与任何其他合适的计算设备进行有线和/或无线通信。计算网络可以包括无线接入点、交换机、路由器、网关和/或其他网络设备以及用于在两个或更多个计算机之间交换数据的任何合适的有线和/或无线通信介质,包括因特网。计算机可读介质1710可以适于存储处理器1702要处理的数据和/或要执行的指令。处理器1702能够处理数据和执行指令。数据和指令可以存储在计算机可读存储介质1710上。
在设备1700是如本文所述的医疗设备的实施例中,设备1700可包括插入到受试者的解剖结构中以诊断和/或治疗受试者的侵入式医疗设备1706。如上所述,设备1706包括侵入式探针1708。
存储在计算机可读存储介质1710上的数据和指令可以包括实现根据本文描述的原理操作的技术的计算机可执行指令。在图17的示例中,计算机可读存储介质1710存储实现各种功能设施并存储如上所述的各种信息的计算机可执行指令。计算机可读存储介质1710可以存储病变分析设施1712以分析病变的一个或更多个特征(包括病变的组成),和/或基于该分析确定治疗建议。计算机可读存储介质1710还可以存储可由设施1712使用的治疗方案的条件1714。计算机可读存储介质1710还可以存储学习设施1716和记录生成设施1718。
虽然在图17中未示出,但是计算设备可以另外具有一个或更多个组件和外围设备,包括输入和输出设备。除其他之外,这些设备可用于呈现用户界面。能够用于提供用户界面的输出设备的示例包括用于视觉输出的打印机或显示器和用于声音输出的扬声器或其他声音生成设备。能够用于用户界面的输入设备的示例包括键盘和指示设备,诸如鼠标、触摸板和数字化写字板。作为另一示例,计算设备可以通过语音识别或其他可听格式接收输入信息。
已经描述了以电路和/或计算机可执行指令实现这些技术的实施例。应当理解,一些实施例可以是方法的形式,其中已经提供了至少一个示例。作为方法的一部分执行的动作可以以任何合适的顺序执行。因此,可以构造其中以不同于所描述的顺序来执行动作的实施例,即可以包括同时执行一些动作,即使在示例性实施例中描述为顺序动作。
上述实施例的各个方面可以单独使用、组合使用或者以前面描述的实施例中没有具体讨论的各种布置使用,因此,不限于在前面的描述中阐述的或在附图中示出的部件的细节和布置。例如,一个实施例中描述的方面可以以任何方式与其他实施例中描述的方面组合。
在权利要求中使用诸如“第一”、“第二”、“第三”等的序数术语来修改权利要求要素本身并不意味着一个权利要求要素先于另一个的任何优先权、次序或顺序,也不意味着执行方法步骤的时间顺序,而仅用作标签来区分具有特定名称的一个权利要求元素与具有相同名称的另一个元素(不过使用序数术语)以区分权利要求元素。
此外,这里使用的措辞和术语是出于描述的目的,而不应被视为限制。本文中“包括”、“包含”、“具有”、“含有”、“涉及”及其变化形式的使用旨在涵盖在其后列出的项目及其等同物以及附加项目。
本文使用的“示例性”一词意味着用作示例、实例或说明。因此,在本文中描述为示例性的任何实施例、实施方式、过程、特征等应当被理解为说明性示例,除非另有说明,否则不应被理解为优选或有利示例。
已经如此描述了至少一个实施例的若干方面,应当理解,本领域技术人员将容易想到各种替代、修改和改进。这些替代、修改和改进旨在成为本公开的一部分,并且旨在落入本文描述的原理的精神和范围内。因此,前面的描述和附图仅是示例性的。
- 还没有人留言评论。精彩留言会获得点赞!