具有奇数碳的脂类化合物及其作为医药组合物或者营养补充剂的用途的制作方法
本申请要求2016年6月8日提交的美国临时申请62/347,103的优先权,在本文中以引用的方式包括其全部内容。
本发明涉及脂类化合物及其作为医药组合物或者营养补充剂的用途。特别地,本发明涉及具有奇数碳原子脂肪酸的脂类的新用途,特别是十五烷酸甘油三酯,其表现出非常有效的神经保护、抗凋亡、神经修复、促进轴突生长的作用。该脂类可用作药物,用于治疗或预防神经退行性疾病,视网膜或视神经退行性疾病,脱髓鞘疾病,神经肌肉疾病和肌营养不良,脑或脊髓神经损伤,淀粉样蛋白相关疾病,其他慢性疾病如肾脏病、糖尿病或哮喘。该脂类也可用作营养补充剂和/或功能食品,用于人类和/或动物的抗衰老、延长寿命和改善脑功能。此外,本发明涉及瓶尔小草和/或其提取物在治疗和/或预防上述疾病和病症中的新用途。
背景技术:
全世界数以亿计的人受到神经系统疾病的影响。神经系统疾病包括中枢和周围神经系统疾病,包括脑、脊髓、颅神经、周围神经、神经根、自主神经系统、神经肌肉连接和肌肉。
本发明涉及不同神经系统疾病和相关慢性疾病的治疗,具体如下:
a.神经退行性疾病
神经退行性疾病是神经元结构或功能的逐渐丧失,包括神经元死亡所引起的一类疾病。神经元的损伤或死亡导致神经系统受影响的部分所控制的机体功能逐渐恶化。所选择的神经退行性疾病包括阿尔茨海默病(ad),帕金森病(pd),亨廷顿病(hd),肌萎缩性侧索硬化症(als),痴呆,路易体痴呆(dlb),额颞叶痴呆(ftd),库兹菲德-雅各氏症或克雅氏病(creutzfeldt-jakob病cjd),和脑萎缩。
大多数神经变性疾病也被归类为蛋白质病,因为它们与错误折叠的蛋白质的聚集相关。蛋白质错误折叠和聚集是神经变性疾病的主要组织病理学标志。所有神经变性疾病的主要病理学机制现在都是称为寡聚体的小蛋白质聚集体。这些聚集体可能是β-淀粉样蛋白,α-突触核蛋白,朊病毒等毒性物质。β-淀粉样蛋白的沉积是阿尔茨海默病中老年斑的主要成分,并且与ad的发病机制有很强的相关性;tau蛋白是涉及ad发病机理的神经原纤维缠结的主要成分;α-突触核蛋白可以在路易体病理状态下聚集形成不溶性原纤维,如帕金森病,路易体痴呆和多系统萎缩,并且与pd和dlb的发病机制有很强的相关性;朊病毒是朊病毒疾病和传染性海绵状脑病的主要病理物质,与海绵状脑病(克雅氏病)有很强的相关性。
细胞凋亡或程序性细胞死亡在生理和病理状态中起重要作用。越来越多的证据表明,在各种急性和慢性神经系统疾病(包括神经退行性疾病)中凋亡细胞死亡率增加。细胞凋亡的特征在于神经元收缩,染色质凝集和dna断裂,而坏死细胞死亡与细胞质和线粒体肿胀相关,随后细胞膜溶解。在几种退行性神经障碍(包括ad、hd和als)中都发现了dna断裂的证据。
目前没有针对神经退行性疾病病因的有效治疗方法。
痴呆被定义为认知能力的获得性恶化,记忆丧失是最常见的症状。据估计,全球有3560万痴呆症患者-ad是痴呆症的最常见原因,占所有患者的60-70%(世界卫生组织在线问答,2014年2月)。痴呆症的最大危险因素是老龄化。ad的特征在于大脑皮层和某些皮质下区域中的神经元和突触的损失。这种损失导致受影响区域的大面积萎缩,包括颞叶和顶叶,以及部分额叶皮质和扣带回的退化。越来越多的证据表明,称为可溶性淀粉样物质的寡聚物,是引起ad的早期毒素,可引起细胞功能障碍。神经炎斑块中含有β-淀粉样蛋白(aβ)。aβ是一种39-42个氨基酸的蛋白质,它是由较大的跨膜蛋白-淀粉样蛋白前体蛋白(app)被切割和分泌时所产生的。目前没有一种药物能够有效地针对疾病的潜在病理生理过程。
帕金森病是中枢神经系统的退行性疾病,由于中脑的黑质区中的多巴胺生成细胞的死亡而引起,细胞死亡的原因未知。帕金森病是第二常见的神经退行性疾病,表现为运动迟缓,僵硬,静息震颤和姿势不稳定。在全球范围约有700万pd患者,美国约有100万。pd每年的新增病例数目在每十万病人年中约为8至18人。30多年来,左旋多巴被广泛使用的治疗方法,但是疗效十分有限。pd研究前沿是神经保护。
亨廷顿舞蹈病(hd)引起星形胶质细胞增多和中棘神经元的丧失。大脑的区域根据其结构和它们所含的神经元的类型而受到影响,这些区域因为丢失细胞而变小。受影响的区域主要是纹状体,也包括额叶和颞叶皮质。纹状体的下丘脑核向发起和调节运动的苍白球发送控制信号。来自下丘脑核的较弱的信号就导致运动的发起和调节减少,导致亨廷顿舞蹈病典型的运动失调症状。目前hd没有治疗方法。
肌萎缩性侧索硬化症(als),有时称为鲁盖瑞氏症(lougehrig’sdisease),是一种快速发展并且绝对致命的神经系统疾病,它攻击负责控制自主肌肉的神经细胞。该疾病属于运动神经元类疾病,其特征是运动神经元逐渐变性和死亡。目前治疗als的方法是试图缓解症状并延长预期寿命。已发现利鲁唑可延长生存期大约几个月。als的主要病理特征是含有tdp-43,fus或sod1蛋白的蛋白体的异常积累。体外和细胞实验证据表明sod1,tdp-43和fus形成不溶性纤维聚集体。值得注意的是,这些蛋白聚集体可以作为种子来触发进一步聚集。很多证据支持引起als的主要相关蛋白的朊病毒样特性。(grad,lesliei;etal,neurobiologyofdisease.2015;77:257-265.)
b.视网膜或视神经退行性疾病
b-1.视神经有关的退行性疾病
视神经萎缩是一种影响视神经的病症。视神经传递从眼睛到脑部的脉冲。视神经萎缩是由多种病变引起的视神经损伤导致的。这种情况可能导致视力问题包括失明,青光眼,以及被称为前部缺血性视神经病变的视神经中风;压迫视神经的肿瘤;由多发性硬化引起的视神经炎;以及一种称为leber遗传性视神经病(lhon)的遗传性疾病。
视神经炎(on)是可导致部分或完全视力丧失的视神经炎症。视神经包括从眼睛视网膜起始并将视觉信息传递到主视觉核的轴突,其中大部分视觉信息被传递到脑的枕叶皮层以加工成视觉。视神经炎症导致视力丧失,通常是因为覆盖视神经的髓鞘的肿胀和破坏。直接轴突损伤也可能在神经破坏中起作用。
常染色体显性视神经萎缩(doa)是以视神经双侧退化为特征的神经眼科疾病,通常在生命的头十年开始会导致潜在的视力丧失。该疾病影响视网膜神经节细胞(rgc)及其形成视神经的轴突,他们将视觉信息从光感受器传递到脑的外侧基底。世界各地患病率从1/10000到1/30000不等。
b-2.视网膜退行性疾病
黄斑变性,也称为年龄相关黄斑变性(amd或armd),是一种可能导致视野中心模糊或视力丧失的医疗状况。这是造成全球近5000万人不可逆失明的最常见原因之一。视网膜衰老和大脑的退行过程显示出惊人的相似之处,并提供了鉴定新靶标和致病机制的线索。在阿尔茨海默病大脑中蓄积的β淀粉样蛋白是amd中累积的蛋白质之一,这是amd被称为“眼睛的阿尔茨海默病”或“视网膜的阿尔茨海默氏症”的原因。目前,大多数amd患者没有得到有效治疗。
青光眼是全球范围造成失明的主要原因,通常与升高的眼内压(iop)相关。可是,iop导致视网膜神经节细胞(rgc)发生不可逆的损伤的确切原因远不清楚。导致青光眼视力不可逆损失的主要原因是rgc凋亡。据报道aβ与青光眼rgc凋亡的发生有关,证据包括:实验性青光眼中rgcs中aβ的表达增加,在青光眼患者中显示出与视网膜aβ沉积一致的玻璃体aβ水平降低。来自青光眼动物模型的强有力证据表明,支持aβ参与青光眼诱导的rgc细胞凋亡。因此,使用针对aβ途径的多个阶段的药物提高了用神经保护方法治疗青光眼的可能性。(guol,etal.targetingamyloid-βinglaucomatreatment.procnatlacadsciusa.2007;104(33):13444-13449)
视网膜色素变性(rp)是一种遗传性退行性眼病,由于视网膜中的杆状感光细胞的进行性退化而导致严重的视力障碍。继发于视杆细胞进行性变性的是邻近视网膜色素上皮(rpe)的异常和视锥细胞的退化。rp患者由于视杆细胞的退化而导致周围视野受损和视野昏暗,进而导致失明。全世界约有1/4,000(150万)人受到影响。大多数患者没有得到有效治疗。
c.脱髓鞘性神经功能障碍
脱髓鞘神经障碍包括肾上腺脑白质营养不良,多发性硬化(ms),视神经炎,急性炎症性脱髓鞘性多发性神经病(aidp),慢性炎症性脱髓鞘性多发性神经病(cidp),格林巴利综合征(gbs),与zika病毒相关的脑炎,神经性脊髓炎(nmo),急性播散性脑脊髓炎,急性坏死性出血性脑炎,同心硬化,弥漫性硬化,异染性脑白质营养不良,球状细胞脑白质营养不良,中枢神经系统海绵状变性,佩里梅病,亚历山大病,放射性损伤性脑白质病,缺氧性脑白质病,脑室周围白质软化症,脑病动脉硬化性皮质,进行性多灶性脑白质病,和中央脑桥髓样溶解综合征。
c-1.肾上腺脑白质营养不良
肾上腺脑白质营养不良(也称为x连锁肾上腺脑白质营养不良,ald,x-ald,西梅林-克罗伊茨费尔特病(siemerling-greutzfeldtdisease)或希尔德病(schilderdisease))是与x染色体有关的疾病。这是由于相关酶不能正常运行而引起的脂肪酸积累的结果,然后对神经的髓磷脂造成损害,并导致癫痫发作和多动症。其他症状包括说话,听力和理解语言指令等问题。ald是最常见的过氧化物酶体代谢的异常,发病率估计在1:18,000到1:50,000之间。
ald初步饮食治疗涉及限制非常长链脂肪酸(vlcfa)的摄入,但是它并不影响血浆和其他身体组织中vlcfa的水平。ald男孩lorenzoodone的父母带头努力开发饮食治疗来减缓疾病进展。他们开发了不饱和脂肪酸(甘油三油酸酯和三烯酸甘油酯,其比例为4:1)的混合物,称为罗伦佐油,它抑制体内饱和脂肪酸的延长。已经发现补充洛伦佐油已经使体内vlcfa浓度正常化,尽管其在治疗该疾病的脑部表现方面的有效性仍然存在争议和未经证实。罗伦佐油的试验表明,它不能阻止症状患者的神经系统退化,也不会改善肾上腺功能。
c-2.多发性硬化症
全球诊断为多发性硬化症(ms)的患者总人数约130万人。ms是一种消耗性的,致残的神经系统疾病,其特征在于中枢神经系统神经髓鞘的多灶性破坏。由于中枢神经系统白质中轴突髓鞘产生脱髓鞘性病变,髓磷脂被损坏或破坏,神经冲动变慢或根本不传播,导致大脑与身体其他部位之间的通信受阻。每个新形成的ms病变都发生轴突损伤,累积轴突损失是ms进行性和不可逆神经功能障碍的主要原因。来自ms的晚期瘫痪患者中多达70%的轴突从外侧皮质脊髓区域(例如,运动)中丢失,并且纵向mri研究表明在已经发生的无活性病变中存在进展性的轴突损失。
c-3.其他脱髓鞘疾病
其他脱髓鞘疾病包括急性炎症性脱髓鞘性多发性神经病(aidp),慢性炎症性脱髓鞘性多发性神经病变(cidp),吉利亚-巴利综合征(gbs),由zika病毒引起或与之相关的脑炎,神经性脊髓炎(nmo),急性播散性脑脊髓炎,急性坏死性出血性脑炎,同心硬化,弥漫性硬化,异染性脑白质营养不良,球状细胞白质营养不良,中枢神经系统海绵状变性,佩里梅病,亚历山大病,放射性损伤性脑白质病,缺氧性脑白质病,脑室周围白质软化症,动脉硬化性皮质脑病,进行性多灶性脑白质病和中枢脑桥髓样溶解综合征。
d.神经肌肉疾病和肌营养不良症
神经肌肉疾病是由于神经、肌肉或神经肌肉接头的病理改变,直接或间接地损害肌肉功能的许多疾病。脊髓性肌萎缩是下运动神经元的疾病,而肌萎缩性侧索硬化是上下运动神经元的混合状况。重症肌无力和lambert-eaton综合征是神经肌肉接头障碍的例子。这些神经肌肉疾病都无法治愈。目前的治疗方法主要是对症治疗,疗效甚微。
肌营养不良(md)是一组肌肉疾病,这些疾病随着时间的推移会导致骨骼肌的衰弱和分解。这些疾病的区别在于受到主要的影响的肌肉、无力程度、恶化程度以及症状开始时间。最常见的类型是杜氏肌营养不良症(dmd),它通常会影响四岁左右的男孩。其他类型包括贝克肌营养不良症,面肩胛肱型肌营养不良症和肌强直性营养不良症。许多人最终无法走路。一些类型也与其他器官的问题有关。恰克-马利-杜斯氏病(charcot-marie-toothdisease,cmt)以三位首次发现此病的医生命名,它是最常见的遗传性神经障碍之一。在美国每2500个人中估计有1人患cmt,全世界有260万人,但是专家认为这个数字实际可能要高得多。
目前,肌营养不良症无法治愈。治疗方法有物理治疗、职业治疗、矫形手术(例如脚踝矫形器)、言语治疗和呼吸治疗等,可能有帮助。
e.脑损伤或脊髓神经损伤,颅神经障碍或癫痫发作
脑损伤是脑中发生的任何损伤。脑损伤可以分为几个维度。原发性和继发性脑损伤是对脑损伤发生的损伤过程进行分类的方法,而局灶性和弥漫性脑损伤则是对脑损伤程度或位置进行分类的方式。由于大脑控制身体,脑损伤具有深远和多样的后果。患者经常存在记忆问题,根据损伤的位置和严重程度,可以是长期或短期记忆问题。记忆可以通过康复而改善,但在某些情况下,损伤会是永久性的。
脊髓损伤(sci)是对脊髓的损伤,导致其功能暂时性或永久性的变化。这些变化转化为损伤位置以下的脊髓所服务的身体部位的肌肉功能,感觉或自主功能的丧失。
颅神经疾病是一种功能障碍,它涉及从脑部(包括脑干)直接出现的十二个颅神经中的任何一个,包括嗅神经(i),视神经(ii),眼动神经(iii),滑车神经(iv),三叉神经(v),外展神经(vi),面神经(vii),前庭神经(viii),舌咽神经(ix),迷走神经(x),副神经(xi)和舌下神经(xii)。这些颅神经功能的异常无法治愈。目前的治疗方法主要是对症治疗。
癫痫是一组以癫痫发作为特征的神经系统疾病。全球约有1%的人(6500万人)患有癫痫症,近80%的病例发生在发展中国家。在癫痫发作中,一组神经元以异常,过度和同步的方式开始放电,导致了一种去极化波,被称为阵发性去极化移位。癫痫或癫痫发作无法治愈。神经元周围的因素包括突触可塑性和离子浓度等是可能的发病机制。目前的治疗方法主要是对症治疗。
f.淀粉样蛋白沉积相关疾病
淀粉样蛋白沉积相关疾病包括糖尿病,心脏淀粉样变性,原发性淀粉样变性,家族性淀粉样变性,老年性全身性淀粉样变性(ssa),继发性淀粉样变性和血液透析相关的淀粉样变性。
淀粉样变性是一组相关疾病,其中称为淀粉样蛋白的蛋白质在一个或多个器官(通常为肾脏,心脏,中枢神经系统和/或肝脏)中积聚,并干扰器官功能,最终导致器官功能衰竭。原发性淀粉样变性(al,淀粉样蛋白轻链)与克隆浆细胞疾病和由异常浆细胞产生的免疫球蛋白轻链相关。al也发生在与多发性骨髓瘤相关的淀粉样变性。
家族性淀粉样变性(af)与可遗传的基因异常有关。af引起肝脏产生称为甲状腺素的异常蛋白质。
继发性淀粉样变性(aa)与炎症引起的血清淀粉样蛋白a水平升高相关。
g.其他慢性病
本发明的其它慢性疾病包括肾脏疾病,糖尿病和哮喘。
慢性肾脏疾病(ckd)是指在几个月或几年的时间内肾功能逐渐丧失。在第5期ckd中,肾脏替代疗法通常需要透析或移植的形式。慢性肾脏疾病是2013年全球956,000人死亡的原因。肾脏是几种遗传性淀粉样变性中淀粉样蛋白沉积最常见的部位之一。肾脏疾病是系统性淀粉样变性的常见表现,通常是患有这些疾病的个体发病的主要来源。如果没有治疗,淀粉样变性相关的肾脏疾病通常发展到终末期肾脏疾病(esrd)。(demberlm.jamsocnephrol.2006;17(12):3458-71.)
糖尿病(dm)是一组长期存在高血糖水平的代谢性疾病。胰岛淀粉样多肽(amylin)与2型糖尿病的发展有关。衍生自胰岛淀粉样蛋白多肽(iapp或胰岛淀粉样多肽)的淀粉样蛋白沉积物通常存在于患有2型糖尿病或含有胰岛素瘤的患者的胰岛中。最近的研究结果表明,胰岛淀粉样多肽类似于与阿尔茨海默病有关的β-淀粉样蛋白(abeta),可以在产生胰岛素的β细胞中诱导凋亡细胞死亡,从而引起糖尿病。(lorenzoa,etal.nature.368(6473):756–60.)
哮喘是肺部气道常见的长期炎症性疾病。其特征为可变和复发症状,可逆性气流阻塞和支气管痉挛。症状包括喘息,咳嗽,胸闷和气短。病人的情况在晚上或运动时可能会变得更糟。没有治愈哮喘的有效药物。可通过避免触发因素(如过敏原和刺激物)和吸入性皮质类固醇来预防症状发作。
h.抗衰老或寿命延长
人类最长寿命(最大报告死亡年龄或mrad)是衡量一个群体中一个或多个成员在出生和死亡之间生存的最长时间的量度。该术语还可以表示给定物种的成员在出生和死亡之间可以生存的最长时间的估计,如果该成员的寿命是最佳的。目前没有有效的方法来延长人类的寿命。
i.大脑功能
基本的大脑功能包括视觉,记忆,学习,成像,判断,阅读,感知,思维和创造等。不同的人可能会有不同程度的智商(iq)。还有很多尚未发现的领域,关于大脑如何工作,人脑功能还没有完全发展。如何进一步开发人类的大脑功能是神经科学的尚未开发的领域。
技术实现要素:
本发明的目的是提供一种用于治疗和预防人类和动物神经系统疾病的药物。这些疾病包括神经退行性疾病,视网膜或视神经退行性疾病,脱髓鞘疾病,神经肌肉疾病和肌营养不良,脑脊髓神经损伤,颅神经障碍或癫痫发作,淀粉样沉积相关疾病,以及包括肾脏病、糖尿病和哮喘的慢性疾病。本发明的另一个目的是提供一种用于抗衰老或延长寿命和改善大脑功能的功能性食品或营养补充剂。此外,本发明涉及使用瓶尔小草和/或其提取物在治疗或预防神经退行性疾病,视网膜或视神经退行性疾病,脱髓鞘疾病,神经肌肉疾病和肌营养不良,脑或脊髓神经损伤,淀粉样蛋白相关疾病,和包括肾脏病、糖尿病和哮喘的其它慢性疾病,还可用于人类抗衰老或寿命延长和脑功能改善的功能性食品。
本发明基于令人惊奇的发现:即具有奇数碳原子脂肪酸的脂类化合物,以及瓶尔小草和/或其提取物可用于治疗或预防中枢神经系统的疾病。
附图说明
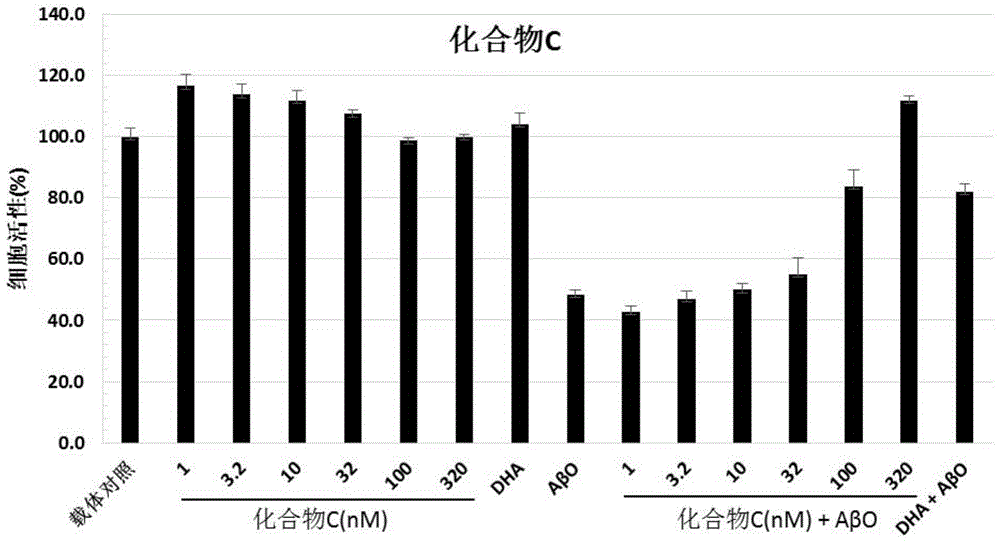
图1示出与示例i-1相关的化合物c的神经保护作用(aβo处理前48小时加入),mtt法评估细胞活力。
图2示出与示例i-1相关的化合物c的神经保护作用–小鼠原代皮质神经元的显微镜照片。
图3示出与示例i-2相关的化合物c的轴突生长效应。
图4示出与示例i-3相关的化合物c在小鼠原代皮质神经元模型中的神经保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入化合物c)。
图5a至5c示出与示例i-4相关的化合物c对从人多能干细胞(ipsc)诱导分化的神经细胞的保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入化合物c)。
图6a至6i示出与示例i-5相关的化合物c对多种毒素处理的小鼠原代神经元的神经保护、抗凋亡和神经修复作用(在毒素处理后3小时加入化合物c)。
图7示出与示例i-6相关的具有奇数碳原子的脂肪酸对aβo处理的小鼠原代神经元中的效果(当在aβo处理之前48小时加入)。
图8示出与示例i-7相关的化合物c对喜树碱处理的小鼠原代神经元中的神经保护作用在喜树碱前48小时加入。
图9a至9d示出与示例i-8相关的化合物c和草药b提取物对酿酒酵母细胞的年龄诱导蛋白质聚集体的作用。
图10示出与示例iv-1相关的草药b提取物的神经保护作用(aβo处理前48小时加入),mtt法评估细胞活力。
图11示出与示例iv-1相关的草药b提取物的神经保护作用–小鼠原代皮质神经元的显微镜照片。
图12示出与示例iv-2相关的草药b提取物在小鼠原代皮质神经元模型中的神经保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入草药b提取物)。
图13a至13c示出与示例iv-3相关-草药b提取物对从人多能干细胞(ipsc)诱导分化的神经细胞的保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入草药b提取物)。
图14a至14f示出与示例iv-4相关的草药b提取物对多种毒素处理的小鼠原代神经元的神经保护、抗凋亡和神经修复作用(在毒素处理后3小时加入草药b提取物)。
图15a和15b示出与示例iv-5相关的草药b提取物对双氧水(h2o2)处理的小鼠原代神经元中的神经保护、抗凋亡和神经修复作用(在h2o2处理前48小时或3小时后加入)。
图16示出与示例iv-6相关的草药b提取物对喜树碱处理的小鼠原代神经元中的神经保护和抗凋亡作用(在喜树碱处理前48小时加入)。
具体实施方式
i.一般定义
“治疗”是指任何治疗,包括但不限于缓解疾病、病症或疾病状况的症状,临时或永久地消除疾病,疾病和病症的病因;或减缓、减少或抑制无症状个体的病理过程的进行。
“防止”和/或“预防”是指抑制病理过程的初始发作,使得最终导致症状发展的病理过程不会发生(以预防方式防止疾病、病症或疾病状况的发展)。
“治疗有效量”是指有效治疗或预防特定疾病和病症的药物的量。
“药学上可接受的载体”是用于形成药物组合物的无毒溶剂、分散剂、赋形剂或其他材料,即能够给予受试者或患者的剂型。
术语“药学上可接受的盐”是指保留目标化合物所需生物活性并表现出最小的不希望的毒理作用的盐。这些盐包括无机或有机酸和/或碱加成盐,这取决于本发明化合物中碱性和/或酸性基团的存在。参见例如“handbookofpharmaceuticalsalts.properties,selectionanduse”,p.heinrichstahl,camilleg.wermuth(eds.),wiley-vch,2008;和“pharmaceuticalsaltsandco-crystals”,johanwoutersandlucquéré(eds.),rsc出版社,2012年。
如本文所用,“修复”意味着将目前的病理结构,状态,疾病或病症或功能返回或恢复到以前较年轻或更好的结构、状态、疾病状态或功能状态。
如本文所用,“再生”意味着重新生长新组织以代替丢失或损伤的组织或人体的功能。
(1)在第一实施方案中,本发明涉及表达式(i)化合物,
其中r1,r2和r3分别独立地表示h或者-c(o)r4,其中r4表示
-(c5-c20)烷基,也可以被oh,nh2,nhch3,n(ch3)2,f或者cl等一次,两次或者三次取代;或者
-(c5-c20)烷基,带有1,2或3个双键;
而且至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基;
或者是药学上可接受的盐,用作人和/或动物的药物。
(2)在进一步的施例方案中,本发明涉及实施方案(1),其中r1,r2和r3分别独立地表示h或者-c(o)r4,其中r4表示
-(c5-c20)烷基,也可以被oh,f或者cl等一次,两次或者三次取代;或者
-(c5-c20)烷基,带有1,2或3个双键;
而且至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(3)在进一步实施方案中,本发明涉及实施方案(1)或(2),其中r1,r2和r3分别独立地表示h或者-c(o)r4,其中r4表示
-(c5-c20)烷基,也可以被oh,f或者cl等一次,两次或者三次取代;
而且至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(4)在进一步实施方案中,本发明涉及任意实施方案(1)到(3),其中r1,r2和r3分别独立地表示h或者-c(o)r4,其中r4表示
-(c5-c20)烷基,也可以被oh或者f等一次,两次或者三次取代;或者
-(c5-c20)烷基,带有1,2或3个双键;
而且至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(5)在进一步实施方案中,本发明涉及任意实施方案(1)到(4),其中r1,r2和r3分别独立地表示h或者-c(o)r4,其中r4表示
-(c5-c20)烷基,也可以被oh或者f等一次,两次或者三次取代;
而且至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(6)在进一步实施方案中,本发明涉及任意实施方案(1)到(5),其中r1,r2和r3分别独立地表示h或者-c(o)r4,其中r4表示
-(c5-c20)烷基,也可以被f一次,两次或者三次取代;或者
-(c5-c20)烷基,带有1,2或3个双键;
而且至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(7)在进一步实施方案中,本发明涉及任意实施方案(1)到(6),其中r1,r2和r3分别独立地表示h或者-c(o)r4,其中r4表示
-(c5-c20)烷基,也可以被f一次,两次或者三次取代;
而且至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(8)在进一步实施方案中,本发明涉及任意实施方案(1)到(7)
其中r1,r2和r3分别独立地表示h或者-c(o)r4,而且
至少一个r1,r2和r3是-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(9)在进一步实施方案中,本发明涉及任意实施方案(1)到(8),其中
r1,r2和r3分别独立地表示-c(o)r4,r4是(c6-c20)具有偶数个碳原子的烷基。
(10)在进一步实施方案中,本发明涉及任意实施方案(1)到(9),其中r4是h或者-c(o)r4(这里r4表示c12-烷基,c14-烷基,c16-烷基,c18-烷基或c20-烷基),另外r1,r2和r3不能同时都是h。
(11)在实施方案(10)中,r1,r2和r3之一是h,其它的是-c(o)r4(这里r4表示c12-烷基,c14-烷基,c16-烷基,c18-烷基或c20-烷基)。
(12)在实施方案(10)中,r1,r2和r3之中有两个是h,另外一个是-c(o)r4(这里r4表示c12-烷基,c14-烷基,c16-烷基,c18-烷基或c20-烷基)。
(13)在实施方案(10)中,r1,r2和r3各自独立。其中-c(o)r4里r4表示c12-烷基,c14-烷基,c16-烷基,c18-烷基或c20-烷基。应当这样理解,r4的每个烷基可以与烷基彼此组合。作为特例,全部r1,r2和r3可以是同一种-c(o)r4。优选情况是,r1,r2和r3要么各自独立要么全部一起是-c(o)r4(其中r4是c14-烷基或者c16-烷基)。
(14)在特别优选的实施方案中,本发明涉及表达式(i)化合物,其中r4是-c(o)c14-烷基,比如一个表达式(i)的化合物中r1,r2和r3都是-c(o)c14-烷基。该实施方案的化合物与下述化合物c相同。化合物c的化学名称是十五烷酸甘油三酯,也称为1,2,3-丙烷三基三(十五烷酸)酯;1,2,3-丙烷三基三(十五烷酸)酯;或1,2,3-三(十五烷酸)甘油酯。
(15)在一个进一步的实施方案中,本发明涉及表达式(i)化合物,其中r1,r2和r3之一是h,另外两个是-c(o)c14-烷基。
(16)在一个进一步的实施方案中,本发明涉及表达式(i)化合物,其中r1,r2和r3之中有两个是h,另外一个是-c(o)c14-烷基。
(17)在进一步的实施方案中,本发明涉及实施方案(12)的化合物的代谢物或药物前体,即hoc(o)c12-烷酸,hoc(o)c14-烷酸,hoc(o)c16-烷酸,hoc(o)c18-烷酸和hoc(o)c20-烷酸。
本发明涉及表达式(i)化合物,其中r1,r2和r3之中有两个是h,另外一个是-c(o)c14-烷基。
(18)应当这样理解,所有实施方案(1)至(17)涉及的所述化合物或其药学上可接受的盐,是用于人和/或动物的药物。
(19)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗和/或预防神经退行性疾病,视网膜或视神经退行性疾病,脱髓鞘疾病,神经肌肉疾病和肌营养不良,脑或脊髓神经损伤,颅神经障碍或癫痫发作,淀粉样蛋白沉积相关疾病,和包括肾脏病、糖尿病和哮喘的慢性疾病;以及用于抗衰老或寿命延长和改善脑功能。
(20)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,其用于治疗或预防神经退行性疾病,包括阿尔茨海默病(ad),帕金森病(pd),亨廷顿病(hd),肌萎缩性侧索硬化(als),痴呆,路易体痴呆(dlb),额颞痴呆(ftd),克雅氏病和脑萎缩。
(21)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗或预防视网膜或视神经退行性疾病包括视神经萎缩,leber遗传性视神经病变(lhon),常染色体显性视神经萎缩(doa),年龄相关的黄斑变性,青光眼和视网膜色素变性。
(22)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗和/或预防脱髓鞘疾病,包括肾上腺脑白质营养不良,多发性硬化症,视神经炎,急性炎症性脱髓鞘性多发性神经病变(aidp),慢性炎症性脱髓鞘性多发性神经病(cidp),吉利安-巴利综合征,zika病毒引起或相关的脑炎,颅神经麻痹,神经性脊髓炎(nmo),急性播散性脑脊髓炎,急性坏死性出血性脑炎,同心硬化,弥漫性硬化,异染性脑白质营养不良,球状细胞白质营养不良,中枢神经系统海绵状变性,佩里梅病,亚历山大病,放射性损伤性脑白质病,缺氧性脑白质病,脑室周围白质软化症,动脉硬化皮质脑病,进行性多灶性脑白质脑病,和中央脑桥髓样溶解综合征。特别是,用于治疗和/或预防多发性硬化症,视神经炎,急性炎症性脱髓鞘性多发性神经病(aidp),慢性炎症性脱髓鞘性多发性神经病(cidp),吉利安-巴利综合征,由zika病毒引起或与之相关的脑炎,颅神经麻痹和神经脊髓炎(nmo)。
(23)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗或预防神经肌肉疾病和肌营养不良,其中包括重症肌无力,朗伯-伊顿综合征,杜氏肌营养不良症,贝克肌营养不良症,面肩胛肱型肌营养不良症,肌强直性营养不良症,charcot-marie-tooth病(cmt)。
(24)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗或预防神经损伤相关疾病或混合神经系统疾病,包括急性或慢性脑损伤或脊髓或神经损伤,颅神经障碍和癫痫发作。
(25)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗或预防淀粉样蛋白沉积物相关疾病,其中包括糖尿病,心脏淀粉样变性,原发性淀粉样变性病,家族性淀粉样变性,老年性系统性淀粉样变性(ssa),继发性淀粉样变性和血液透析相关的淀粉样变性。
(26)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗或预防慢性疾病包括肾脏病、糖尿病和哮喘。
(27)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗或预防中枢神经系统疾病或者障碍。
(28)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗和/或预防在实施方案(19)至(27)中涉及到的疾病和病症。
本发明特别优选的实施方案涉及实施方案(14)中描述的化合物中的任何一种,用于治疗和/或预防在实施方案(19)至(27)中涉及到的疾病和病症。
(29)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,用于治疗和/或预防在实施方案(19)至(27)中涉及到的疾病和病症。其中的治疗剂量包括1mg/天到1000mg/天。在进一步的实施方案中,治疗剂量为1mg/天至1000mg/天。下限为例如1mg/天,5mg/天,10mg/天,20mg/天,25mg/天或50mg/天。上限为例如为1000mg/天,900mg/天,800mg/天,750mg/天,700mg/天,600mg/天,500mg/天,250mg/天,200mg/天。可以这么理解,每个上限可以与每个下限组合。在优选的实施方案中,剂量为10mg/天至200mg/天。
在一个实施方案中,给定剂量特别适用于根据实施方案(8)至(17)中任一项的化合物,特别是实施方案(14)。
(30)本发明的进一步实施方案涉及特别是用于治疗和/或预防实施方案(19)至(27)中任一项的疾病和病症的这样药物组合物,其中所述组合物含有任何实施方案(1)至(17)中的一个和药学上可接受的载体。尤其是组合物中包含实施方案(8)至(17)中,特别是实施方案(14)中描述的化合物。
(31)在进一步的实施方案中,实施方案(30)的药物组合物中含有实施方案(1)至(17)中任一项的化合物的含量达到1mg/天至1000mg/天的量。下限为例如1mg/天,5mg/天,10mg/天,20mg/天,25mg/天或50mg/天。上限为例如为1000mg/天,900mg/天,800mg/天,750mg/天,700mg/天,600mg/天,500mg/天,250mg/天,200mg/天。可以这么理解,每个上限可以与每个下限组合。在优选的实施方案中,剂量为10mg/天至200mg/天。
在一个实施方案中,给定剂量特别适用于根据实施方案(8)至(17)中任一项的化合物,特别是实施方案(14)。
(32)在一个实施方案中,实施方案(30)的药物组合物涉及含有实施方案(32)或(34)的活性成分制剂(尤其是其中所述剂量),并且可以以任何形式制备,例如口服剂型(粉剂,片剂,胶囊,软胶囊,含水药,糖浆,酏剂,粉剂,香囊,颗粒剂)或局部制剂(乳膏,软膏,洗剂,凝胶,香膏,贴剂,糊剂,喷雾溶液,气雾剂等)或可注射制剂(溶液,悬浮液,乳液)。
在一个实施方案中,给定剂量特别适用于根据实施方案(8)至(17)中任一项的化合物,特别是实施方案(14)。
(33)本发明的进一步实施方案涉及把实施方案(1)至(17)中任一项的化合物用于制备治疗和/或预防实施方案(19)至(27)中任何一种疾病和病症的药物。应当这样理解,所有实施方案与实施方案(1)至(17)的化合物相关的用于治疗和/或预防实施方案(19)至(27)中列出的疾病,并且可以以相应的治疗和/或预防形式的方法重新设计药物制剂。剂量与实施方案(29)或(31)中所公开的相同。
尤其是,实施方案(1)至(17),特别是实施方案(8)至(17)中任一项的化合物在药物中的含量如实施方案(29)和(31)所述。此外,药物可以如实施方案(32)所述来配制。
(34)本发明的进一步的实施方案涉及用于治疗和/或预防实施方案(19)至(28)中任一项的疾病和病症的方法,包括向患者使用实施方案(1)至(17)中任一项的化合物的有效剂量。此“有效剂量”如上所述。具体而言,有效剂量如实施方案(29)和(31)所述。应当这样理解,所有实施方案与实施方案(1)至(17)的化合物相关的用于治疗和/或预防实施方案(19)至(27)中列出的疾病,并且可以以相应的治疗和/或预防形式的方法重新设计药物制剂。剂量与实施方案(29)或(31)中所公开的相同。此外,可以用如实施方案(32)所述配制的药物进行治疗和/或预防。
尤其是,实施方案(1)至(17),特别是实施方案(8)至(17)中任一项的化合物在药物中的含量如实施方案(29)和(31)所述。此外,药物可以如实施方案(32)所述来配制。
(35)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,并用作人类和/或动物的功能性食物或食物补充剂。这种意义上的功能性食品或食品补充剂是具有生理益处和/或降低实施方案(18)至(27)的疾病和病症风险的食品或食品补充剂。功能性食物或食物补充剂可以作为正常饮食的一部分。
(36)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的任何一种化合物用于人和动物的抗衰老,寿命延长或改善脑功能。
(37)本发明的进一步实施方案涉及实施方案(35)的用途,其中所述功能食品或所述食物补充剂用于人和动物用于抗衰老,寿命延长或改善脑功能。
(38)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,并用作人类和/或动物的功能性食物或食物补充剂,其中功能食品用于改善大脑功能,包括视觉,记忆,学习,成像,判断,阅读,感知,思考,创造和提高智商(iq)。
(39)本发明的进一步实施方案涉及实施方案(1)至(17)中描述的化合物中的任何一种,并用作人类和/或动物的功能性食物或食物补充剂,其中功能食品用于神经退行性疾病,视网膜或视神经退行性疾病,脱髓鞘疾病,神经肌肉疾病和肌营养不良,脑或脊髓神经损伤,淀粉样蛋白沉积相关疾病,和包括肾脏病、糖尿病和哮喘的慢性疾病。
(40)本发明的进一步实施方案涉及把实施方案(1)至(17)中任一项的化合物作为功能食品或食品补充剂用于特定疾病和病症的人和/或动物,其中疾病和病症如实施方案(19)到(27)所述。
(41)根据实施方案(35)至(40),本发明的一个进一步的实施方案涉及实施方案(8)至(17)中描述的化合物中的任一种,作为用于人和/或动物的功能性食品或食品补充剂。
本发明的一个特别优选的实施方案涉及实施方案(14)中描述的化合物,作为根据实施方案(35)至(40)的人和/或动物的功能食品或食品补充剂。
在一个实施方案中,该化合物指实施方案(8)至(17),特别是实施方案(14)中所述的任何一种化合物。
(42)本发明的进一步实施方案涉及实施方案(1)至(17)中任一项的化合物用于人和/或动物的功能食品或食品补充剂的,其中所述剂量为1μg(微克)/天至50mg/天。在进一步实施方案中,剂量为1μg(微克)/天至20mg/天。下限为例如1μg(微克)/天,2μg(微克)/天,3μg(微克)/天,4μg(微克)/天,5μg(微克)/天,7μg)/天,10μg(微克)/天,20μg(微克)/天,25μg(微克)/天,50μg(微克)/天,100μg(微克)/天,200μg(微克)天,300μg(微克)/天,400μg(微克)/天或500μg(微克)/天)。上限为例如50mg/天,40mg/天,30mg/天,20mg/天,10mg/天,5mg/天,3mg/天,2mg/天,1mg/天,900μg(微克)/天。应当理解,每个上限可以与每个下限组合。在一个实施方案中,剂量为1μg(微克)/天至20mg/天。在一个进一步的实施方案中,剂量为1μg(微克)/天至900μg(微克)/天)。
在一个实施方案中,给定剂量特别适用于实施方案(8)至(17)中任一项的化合物,特别是实施方案(14)。
(43)本发明的进一步实施方案涉及制备实施方案(1)至(17)中任一项的表达式(i)的化合物,制备方法包括甘油与表达式(ii)hoc(o)r4脂肪酸的酯化,其中r4相互独立
-(c5-c20)烷基,也可以被oh,nh2,nhch3,n(ch3)2,f或者cl等一次,两次或者三次取代;或者
-(c5-c20)烷基,带有1,2或3个双键;
其中至少一个hoc(o)r4的r4是具有偶数个碳原子的(c6-c20)烷基;
甘油的酯化是本领域技术人员已知的。例如,酯化可以是酸催化的,例如用盐酸甲醇,硫酸甲醇,三氟化硼作为路易斯酸和其它酸性催化剂。此外,酯制备可以通过活性脂肪酸如酰基卤,脂肪酸酐,咪唑化物和其它众所周知的偶联剂如dcc(n,n’-二环己基碳二亚胺)或edc(1-乙基-3-(3-二甲氨基丙基)碳化二亚胺)来完成。
此外,可以使用保护组策略用期望的脂肪酸在期望的位置酯化。合适的保护基团可以形成5-或6-元1,2-二醇,例如甘油与苯甲醛的反应,导致1,3-亚苄基衍生物,或含有丙酮的1,2-丙酮酸。1,2-二醇也可以用光气(cocl2)或三光气(ccl3oc(o)occl3)来制备的环状碳酸酯保护起来。保护组策略是本领域技术人员已知的,例如参见资料“protectivegroupsinorganicsynthesis”,t.w.greene,p.g.m.wuts,wiley-interscience,1999。
(44)本发明的进一步的实施方案涉及通过甘油与十五烷酸酯化来制备实施方案(14)中的化合物。
(45)本发明的进一步的实施方案中,实施方案(14)中的化合物可以从植物或人/动物的奶中获得。
(46)可以说,在植物瓶尔小草属的中含有实施方案(14)中的化合物。
(47)在本发明中,可以这么理解,瓶尔小草包括所有属于瓶尔小草属的瓶尔小草种类。特别包括:瓶尔小草(ophioglossumsp.)、钝头瓶尔小草(ophioglossuml.)、东亚瓶尔小草(ophioglossumthermalekom)、狭叶瓶尔小草(ophioglossumthermalekomarov)、高山瓶尔小草(ophioglossumaustro-asiaticumnishida)、钝头瓶尔小草(ophioglossumaustroasiaticumnish.)、锐头瓶尔小草(ophioglossumpetiolatuml.)、带状瓶尔小草(ophioglossumpenduluml.)、带状瓶尔小草(ophiodermapendula(l.)presl.)、网脉瓶尔小草(ophioglossumreticulatuml.)、高山瓶尔小草(ophioglossumvulgatuml.)、尖头瓶尔小草(ophioglossumpedunculosumdesv.)、小叶瓶尔小草(ophioglossumparvifoliumgrev.ethk.)、钝头瓶尔小草(ophioglossumpetiolatumhook.)、柄叶瓶尔小草(ophioglossumpetiolatumhooker)、柔弱瓶尔小草(ophioglossumtenerum)、高瓶尔小草(ophioglossumpycnostichum)、北卡罗来纳瓶尔小草(ophioglossumpycnostichum(fern.)a.&d.love、ophioglossumpycnostichum(fernald)
优选的瓶尔小草包括狭叶瓶尔小草(ophioglossumthermale)、钝头瓶尔小草(ophioglossumpetiolatum)、心脏叶瓶尔小草(ophioglossumreticulatum)、小叶瓶尔小草(ophioglossumparvifolium)、瓶尔小草(ophioglossumvulgatum)、钝头瓶尔小草(ophioglossumaustroasiaticum)、瓶尔小草(ophioglossumazoricum)、加州瓶尔小草(ophioglossumcalifornicum)、中肋瓶尔小草(ophioglossumcostatum)、球茎瓶尔小草(ophioglossumcrotalophoroides)、钙生瓶尔小草(ophioglossumengelmanii)、矮瓶尔小草(ophioglossumlusitanicum)、裸茎瓶尔小草(ophioglossumnudicaule)、多叶瓶尔小草(ophioglossumpolyphyllum)、微小瓶尔小草(ophioglossumpusillum)、和/或长柄瓶尔小草(ophioglossumpycnosticum)。
特别优选的瓶尔小草包括狭叶瓶尔小草(ophioglossumthermale)、钝头瓶尔小草(ophioglossumpetiolatum)、心脏叶瓶尔小草(ophioglossumreticulatum)、瓶尔小草(ophioglossumvulgatum)和/或高山瓶尔小草(ophioglossumaustro-asiaticumnishida)。
(48)因此,本发明的一个实施方案涉及把瓶尔小草用于治疗和/或预防实施方案(19)至(27)中描述的疾病,即把瓶尔小草用于治疗和/或预防实施方案(19)至(27)中任一项的疾病和病症。
(49)本发明的一个实施方案涉及使用的瓶尔小草中含有1mg/天至1000mg/天的实施方案(14)中的化合物,即十五烷酸甘油三脂或化合物c。
进一步实施方案涉及使用的瓶尔小草中含有1mg/天至1000mg/天的实施方案(14)中的化合物,即十五烷酸甘油三脂或化合物c,化合物的量从1mg/天至1000mg/天。瓶尔小草中化合物c的含量下限是例如1mg/天,5mg/天,10mg/天,20mg/天,25mg/天或50mg/天.瓶尔小草中化合物c的含量上限是例如为1000mg/天,900mg/天,800mg/天,750mg/天,700mg/天,600mg/天,500mg/天,250mg/天,200mg/天。应当理解,每个上限可以与每个下限组合。在优选的实施方案中,剂量为10mg/天至200mg/天。
(50)本发明的进一步实施方案涉及用于治疗或预防实施方案(19)至(27)中任一项的疾病和病症的药物组合物,其中所述组合物含有瓶尔小草。
(51)本发明的进一步实施方案涉及用于治疗或预防实施方案(19)至(27)中任一项的疾病和病症的药物组合物,其中所述组合物含有瓶尔小草,并且含有以下1mg/天至1000mg/天的实施方案(14)中的化合物,即十五烷酸甘油三脂或化合物c。
本发明的进一步实施方案涉及所述药物组合物中含有1mg/天至1000mg/天的实施方案(14)中的化合物,即十五烷酸甘油三脂或化合物c。瓶尔小草中化合物c的含量下限是例如1mg/天,5mg/天,10mg/天,20mg/天,25mg/天或50mg/天.瓶尔小草中化合物c的含量上限是例如为1000mg/天,900mg/天,800mg/天,750mg/天,700mg/天,600mg/天,500mg/天,250mg/天,200mg/天。应当理解,每个上限可以与每个下限组合。在优选的实施方案中,剂量为10mg/天至200mg/天。
(52)本发明的进一步实施方案涉及含有瓶尔小草的制剂,制剂中优选考虑实施方案(49)或(51)所述的量,并且可以以任何形式制备,例如口服剂型(粉末,片剂,胶囊,软胶囊,含水药物,糖浆,酏剂,粉末,小药囊,颗粒剂),或局部制剂(乳膏,软膏,洗剂,凝胶,香膏,贴剂,糊剂,喷雾溶液,气雾剂等),或可注射制剂(悬浮液,乳液)。
(53)本发明的进一步实施方案涉及用瓶尔小草制备用于治疗和/或预防实施方案(19)至(27)中任一项的疾病和病症的药物。可以这样理解,涉及用于治疗和/或预防实施方案(19)至(27)中给出的疾病的瓶尔小草的所有实施方案都被公开,并且可以重新配置瓶尔小草来制备药物以治疗和/或预防所公开的疾病和病症。
尤其是,瓶尔小草中含有实施方案(14)的化合物,即十五烷酸甘油三脂或化合物c,化合物含量如实施方案(49)和(51)所述。此外,药物可以如实施方案(52)所述来配制。
(54)本发明的一个进一步的实施方案涉及用于治疗和/或预防实施方案(19)至(27)中任一项的疾病和病症的方法,包括向患者施用有效量的瓶尔小草。因此,“有效量”如上所述。具体而言,有效量如实施例(49)和(51)所述。可以这样理解,与把瓶尔小草用于治疗和/或预防实施方案(19)至(27)中的疾病相关的所有实施方案都公开,并且可以根据相应的治疗和/或预防形式来重新设计配置。剂量如实施方案(49)或(51)中所述。此外,可以用实施方案(52)所述来配制药物用于疾病的治疗和/或预防。
优选地,瓶尔小草含有实施方案(14)的化合物,即十五烷酸甘油三脂或化合物c,化合物含量如实施方案(49)和(51)所述。此外,药物可以如实施方案(52)所述来配制。
(55)此外,本发明的一个进一步的实施方案涉及把瓶尔小草作为功能性食品或食物补充剂给人类和/或动物使用。
(56)本发明的一个进一步的实施方案涉及把瓶尔小草用于人和动物的抗衰老,寿命延长或改善脑功能等用途。
(57)本发明的一个进一步的实施方案涉及实施方案(55)的用途,其中所述功能食品或食品补充剂用于人和动物的抗衰老,寿命延长或改善脑功能等用途。
(58)本发明的一个进一步的实施方案涉及把瓶尔小草作为人类和/或动物的功能食品或食品补充剂,其中功能食品或食品补充剂用于改善脑功能,包括视力,记忆,学习,成像,判断阅读,感知,思维,创造,提升智商(iq)。
(59)本发明的一个进一步的实施方案涉及把瓶尔小草作为人类和/或动物的功能食品或食品补充剂,其中功能食品或食品补充剂用于神经退行性疾病,视网膜或视神经变性疾病,脱髓鞘疾病,神经肌肉疾病和肌肉营养不良,脑或脊髓神经损伤,淀粉样蛋白沉积相关疾病,和包括肾脏病、糖尿病和哮喘的慢性疾病。
(60)本发明的一个进一步的实施方案涉及把瓶尔小草作为人类和/或动物的功能食品或食品补充剂,用于实施方案(19)至(27)中所述的那些疾病和病症。
(61)本发明的一个进一步的实施方案涉及把瓶尔小草作为人类和/或动物的功能食品或食品补充剂,其中瓶尔小草用量中所含的实施方案(14)的化合物,即十五烷酸甘油三脂或化合物c,的量为1μg(微克)/天至50mg/天。在一个进一步的实施方案中,剂量为1μg(微克)/天至20mg/天。下限为例如1μg(微克)/天,2μg(微克)/天,3μg(微克)/天,4μg(微克)/天,5μg(微克)/天,7μg)/天,10μg(微克)/天,20μg(微克)/天,25μg(微克)/天,50μg(微克)/天,100μg(微克)/天,200μg(微克)天,300μg(微克)/天,400μg(微克)/天或500μg(微克)/天)。上限为例如50mg/天,40mg/天,30mg/天,20mg/天,10mg/天,5mg/天,3mg/天,2mg/天,1mg/天,900μg(微克)/天。可以这样理解,每个上限可以与每个下限组合。在一个实施方案中,剂量为1μg(微克)/天至20mg/天。在一个进一步的实施方案中,剂量为1μg(微克)/天至900μg(微克)/天)。
在草药中使用草本植物的方法是本领域众所周知的。因此,本领域的技术人员知道根据实施方案(48)到(61)来处理瓶尔小草。
瓶尔小草可以以干燥的全株植物或部分植物部位的粉末的形式使用,特别是植物的根,茎,叶,花,花粉,孢子,表皮或种子。此外,提取物可以用有机溶剂,特别是与亲脂性有机溶剂来制备。有用的是etoh,dmso,氯仿,二氯甲烷,甲醇,2-丙醇,脂族烃,丙酮,乙酸甲酯等。提取物也可以被干燥,或者可以是油的形式。制备提取物和酊剂的一般方法例如在r.voigt“pharmazeutischetechnologie”,deutscherapothekerverlagstuttgart,isbn978-3-7692-6194-3,2015中公开。
因此,根据本发明的瓶尔小草是指植物本身为干燥形式的粉末,作为提取物或油,整个植物或其部分,特别是根,茎,叶,花,花粉,孢子,表皮或种子。在任何情况下,上述列出的所有种类的瓶尔小草都包含在此定义之内。
结论
令人惊奇的是,本发明人已经发现给予具有奇数个碳原子的脂肪酸侧链的脂类具有神经保护作用。特别是起源于称为瓶尔小草或人/动物奶的化合物c(sbc003,十五烷酸甘油三脂)在神经元模型中特别有效,显示出非常有效的神经保护,抗凋亡,神经修复,促进轴突生长和潜在的神经再生作用。化合物c在正常酵母老化期间对预防和/或清除年龄诱导的蛋白质聚集具有很强的作用。喜树碱模型的结果表明,化合物c可能在基因水平上起着重要的保护作用。含有化合物c(sbc003,十五烷酸甘油三脂)的功能性食品在患有不治之症的患者的志愿者中特别有效,显示出非常有效的神经保护,抗凋亡,神经救援和神经再生作用,因此它有可能被用作用于治疗和预防神经退行疾病和其它慢性疾病的药物和/或功能性食品。
令人惊奇的是,发明人还表明,称为瓶尔小草的草药(草药b,sbc002)在神经元模型和患者中特别有效,显示出非常有效的神经保护,抗凋亡,神经修复,抗氧化和神经再生作用。瓶尔小草提取物对正常酵母老化期间预防和/或清除年龄诱导的蛋白质聚集具有很强的作用。喜树碱模型的结果表明,瓶尔小草提取物可能在基因水平上起着重要的保护作用。它有可能用作治疗和预防神经退行性疾病和其他慢性疾病的药物和功能性食物。
图例
图1示出与示例i-1相关-化合物c的神经保护作用(aβo处理前48小时加入),mtt法评估细胞活力
先用0.05μmdha(用作阳性对照)或不同浓度的化合物c预处理小鼠原代皮质神经元48小时。然后,皮质神经元用载体(图i-1左)或1μmaβo(图i-1右)处理24小时,并使用mtt测定细胞活力(每个条件n=3次测定,1次独立实验)。数据表示为载体对照的百分比(均数±标准差)。
图2示出与示例i-1相关-化合物c的神经保护作用–小鼠原代皮质神经元的显微镜照片
左:加入载体48小时后加入aβo孵化24小时对照;右:加入320nm的化合物c48小时后加入aβo孵化24小时
图3示出与示例i-2相关-化合物c的轴突生长效应
小鼠原代皮质神经元与载体,60nmsappα(阳性对照)或不同浓度的化合物c预孵育48小时。然后,皮质神经元用载体处理。数据表示为载体对照的百分比(均数±标准差)。
图4示出与示例i-3相关-化合物c在小鼠原代皮质神经元模型中的神经保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入化合物c)用载体或1μmaβo处理小鼠原代皮质神经元(t0)。在aβo同时(t0),aβo处理后3小时(t3)或6小时(t6),加入不同浓度的化合物c或hng(0.1μm用作阳性对照)。然后,将皮质神经元孵育24小时,并使用mtt测定(每个条件n=3次测定,1次独立实验)测定细胞存活力。数据表示为载体对照的百分比(均数±标准差)。
图5(图5a,5b和5c)示出与示例i-4相关-化合物c对从人多能干细胞(ipsc)诱导分化的神经细胞的保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入化合物c)皮质神经元用载体或1μmaβo处理(t0)从人多能干细胞(ipsc)诱导分化的神经细胞。在aβo同时(t0),aβo处理后3小时(t3)或6小时(t6),加入不同浓度的化合物c或hng(0.1μm用作阳性对照)。然后,将从人多能干细胞(ipsc)诱导分化的神经细胞孵育24小时,并使用nseelisa测定(每个条件n=6次测定,1次独立实验)测定细胞存活力。数据表示为载体对照的百分比(均数±标准差)。
图6(图6a,6b,6c,6d,6e,6f,6g,6h,6i)示出与示例i-5相关-化合物c对多种毒素处理的小鼠原代神经元的神经保护、抗凋亡和神经修复作用(在毒素处理后3小时加入化合物c)
小鼠原代皮质神经元用载体或或多种神经元毒素处理。在毒素处理后3小时(t3)加入不同浓度的化合物c或hng(0.1μm用作阳性对照)。然后,与皮质神经元孵育24小时,并使用mtt测定(每个条件n=3次测定,1次独立实验)测定细胞存活力。数据表示为设计为载体对照的百分比(均数±标准差)。
图7示出与示例i-6相关-具有奇数碳原子的脂肪酸对aβo处理的小鼠原代神经元中的效果(当在aβo处理之前48小时加入)将小鼠原代皮质神经元暴露于载体或1μm奇数碳原子的脂肪酸48小时,然后加入1μmaβ1-42寡聚体24小时。使用mtt测定评估aβo诱导的神经毒性。数据表示为设计为载体对照的百分比(均数±标准差)。
图8示出与示例i-7相关-化合物c对喜树碱处理的小鼠原代神经元中的神经保护作用在喜树碱前48小时加入将小鼠原代皮质神经元暴露于载体或化合物c48小时,然后加入喜树碱(1μm)24小时。使用mtt测定评估喜树碱诱导的神经毒性。数据表示为设计为载体对照的百分比(均数±标准差)。
图9(图9a,9b,9c和9d)示出与示例i-8相关-化合物c和草药b提取物对酿酒酵母细胞的年龄诱导蛋白质聚集体的作用
图9a:未处理或用herbb(10μg/ml)或化合物c(30μm)处理的年轻细胞或老细胞的代表性图像。上图是使用荧光增白剂28染色的z-系列堆叠的细胞的最大投影,并在dapi通道中成像以显示芽瘢痕。下面是表示hsp104-gfp并在gfp通道中成像的相同细胞的单焦平面图像。箭头点在hsp104-gfp焦点。
图9b:在所有测试条件下获得老细胞的年龄定量。通过指数生长培养获得的年轻细胞平均年龄为0.383±0.5952。分析的细胞数量从73到342。
图9c:具有hsp104-gfp焦点的细胞的百分比。细胞用相同的照射条件成像。包括所有成像的老细胞(75和94细胞之间)。检查所有焦平面。平均值±sd。p值仅与载体对照相比。从anova调整p值。
图9d:细胞中hsp104-gfp的平均荧光强度作为hsp104-gfp浓度的代表。平均值±sd。p值是仅与载体对照相比。从anova获得调整的p值。
图10示出与示例iv-1相关-草药b提取物的神经保护作用(aβo处理前48小时加入),mtt法评估细胞活力
先用0.05μmdha(用作阳性对照)或不同浓度的草药b提取物预处理小鼠原代皮质神经元48小时。然后,皮质神经元用载体(图iii-1左)或1μmaβo(图iii-1右)处理24小时,并使用mtt测定细胞活力(每个条件n=3次测定,1次独立实验)。数据表示为载体对照的百分比(均数±标准差)。
图11示出与示例iv-1相关-草药b提取物的神经保护作用–小鼠原代皮质神经元的显微镜照片
左:加入载体48小时后加入aβo孵化24小时对照;右:加入32ng/ml的草药b提取物48小时后加入aβo孵化24小时
图12示出与示例iv-2相关-草药b提取物在小鼠原代皮质神经元模型中的神经保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入草药b提取物)
用载体或1μmaβo处理小鼠原代皮质神经元(t0)。在aβo同时(t0),aβo处理后3小时(t3)或6小时(t6),加入不同浓度的草药b提取物或hng(0.1μm用作阳性对照)。然后,将皮质神经元孵育24小时,并使用mtt测定(每个条件n=3次测定,1次独立实验)测定细胞存活度。数据表示为载体对照的百分比(均数±标准差)。
图13(图13a,13b和13c)示出与示例iv-3相关-草药b提取物对从人多能干细胞(ipsc)诱导分化的神经细胞的保护、抗凋亡和神经修复作用(aβo处理同时,或处理后3,6小时加入草药b提取物)
皮质神经元用载体或1μmaβo处理(t0)从人多能干细胞(ipsc)诱导分化的神经细胞。在aβo同时(t0),aβo处理后3小时(t3)或6小时(t6),加入不同浓度的草药b提取物或hng(0.1μm用作阳性对照)。然后,将从人多能干细胞(ipsc)诱导分化的神经细胞孵育24小时,并使用nseelisa测定(每个条件n=6次测定,1次独立实验)测定细胞存活力。数据表示为载体对照的百分比(均数±标准差)。
图14(图14a,14b,14c,14d,14e,14f)示出与示例iv-4相关-草药b提取物对多种毒素处理的小鼠原代神经元的神经保护、抗凋亡和神经修复作用(在毒素处理后3小时加入草药b提取物)
小鼠原代皮质神经元用载体或或多种神经元毒素处理。在毒素处理后3小时(t3)加入不同浓度的草药b提取物或hng(0.1μm用作阳性对照)。然后,与皮质神经元孵育24小时,并使用mtt测定(每个条件n=3次测定,1次独立实验)测定细胞存活力。数据表示为设计为载体对照的百分比(均数±标准差)。
图15(15a,15b)示出与示例iv-5相关-草药b提取物对双氧水(h2o2)处理的小鼠原代神经元中的神经保护、抗凋亡和神经修复作用(在h2o2处理前48小时或3小时后加入)
图15a,将小鼠原代皮质神经元暴露于载体或h2o2(0.25mm),3小时后加入不同浓度的草药b提取物或1mmtrolox(阳性对照)共同培养24小时。使用mtt测定(每个条件n=3次测定,1次独立实验)h2o2诱导的神经毒性。数据表示为设计为载体对照的百分比(均数±标准差)。
图15b,将小鼠原代皮质神经元暴露于载体或不同浓度的草药b提取物或1mmtrolox(阳性对照)48小时,然后加入h2o2(0.25mm)共同培养24小时。使用mtt测定(每个条件n=3次测定,1次独立实验)h2o2诱导的神经毒性。数据表示为设计为载体对照的百分比(均数±标准差)。
图16示出与示例iv-6相关-草药b提取物对喜树碱处理的小鼠原代神经元中的神经保护和抗凋亡作用(在喜树碱处理前48小时加入)将小鼠原代皮质神经元暴露于载体或草药b提取物48小时,然后加入喜树碱(1μm)24小时。使用mtt测定评估喜树碱诱导的神经毒性。数据表示为设计为载体对照的百分比(均数±标准差)。
实验部分
缩写和定义
aβoβ-淀粉样蛋白寡聚体
dha二十二碳六烯酸
hng神经保护肽humanin的缩写
ipsc诱导的多能干细胞
mtt3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑溴化物;简称:溴化噻唑蓝四氮唑
nse神经元特异性烯醇化酶
elisa酶联免疫吸附测定
sappα分泌淀粉样蛋白前体蛋白α
sd标准差
sbc003化合物c,十五烷酸甘油三酯
sbc002草药b
sbc001包含sbc002(草药b)和sbc003(化合物c)的一种植物混合物
化合物c(sbc003)的历史
本发明的一个实施方案涉及本文中也称为“sbc003”的实施方案(14)中的化合物。这种化合物最初是从草药b中发现的,即sbc002,它是一种瓶尔小草。ophioglossum在全世界分布在适宜的热带和亚热带栖息地。
提取过程示例
1.首先,sbc003从瓶尔小草分离如下:
1.1取瓶尔小草的干品50克,使用四倍体积的95%的工业乙醇浸取液在室温下提取三次,进一步在减压下浓缩,得到乙醇提取物a(估计10g)。
1.2取乙醇提取物a,用乙酸乙酯(2l)萃取4次,得到乙酸乙酯提取物b(估计10g)。
1.3取乙酸乙酯提取物b,使用硅胶柱色谱法(石油醚:丙酮20:1至1:1梯度洗脱),获得c1带(估计为0.1g)。
1.4通过硅胶柱色谱法取c1条(氯仿:甲醇30:1~10:1梯度洗脱),获得c1i条
1.5以薄层色谱法取c1i条(氯仿:甲醇9:1),获得sbc003(估计0.02-0.1g),具有以下化学结构:
化学式是c48h92o6,这里也叫化合物c,sbc003,十五烷酸甘油三酯,也称为1,2,3-丙烷三基三(十五烷酸)酯;1,2,3-丙烷三基三(十五烷酸)酯;或1,2,3-三(十五烷酸)甘油酯。分子量是765.24g/mol(参见示例(14))。
化合物c(sbc003)的细胞实验的示例(i)
化合物c的示例i-1
在aβo处理前48小时加入化合物c(十五烷酸甘油三酯,sbc003)对小鼠原代皮层神经元的影响
研究目的是确定化合物c是否可能拯救体外神经元模型中的神经元死亡。为此,用aβ1-42寡聚体(aβo)攻击的小鼠原代皮层神经元作为研究模型,研究化合物c在六种浓度下的神经保护作用。β-淀粉样蛋白引发多种病理改变,最终导致多种神经系统疾病(包括ad)的神经元功能障碍和变性(deshpandeetal.thejournalofneuroscience,2006;26(22):6011-6018)。
按照现成的方法,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。简言之,将解离的皮层细胞在预涂有1.5μg/ml聚鸟氨酸(sigma)的48孔板中铺板(50.000个细胞/孔)。细胞在不含血清的dulbecco's改良的eagle/f12培养基中培养,并补充有激素,蛋白质和盐。细胞在35℃,6%co2的加湿环境中保存培养。小鼠皮质神经元在载体或不同浓度的化合物c预培养48小时后,暴露于1.0μmaβo中24小时。使用mtt法来测定aβo诱导的神经毒性。
如预期的,用1.0μmaβo处理24小时的皮质神经元细胞活力降低为48.6±1.4%。dha(0.05μm,阳性对照)降低aβo诱导的神经元死亡,剩余细胞活力为对照组的82.0±2.6%。对照数据表明:i)如预期的那样,dha保护神经元,和ii)通过dha预处理可以成功地预防aβo引起的细胞凋亡,验证了实验模型的有效性。
神经元与不同浓度的化合物c预培养48小时,然后用1μmaβo处理24小时。结果是,在不同浓度的化合物c作用下,表现出剂量依赖性神经保护作用(图1右和图2)。在对应于320nm的悬浮液达到最大的神经保护作用(细胞存活率为111.9±1.5%)。预期ec50约为66nm。
当只用不同浓度的化合物c培养神经元48小时,化合物c的浓度是1nm时就显示高达116.6±3.7%的细胞活力(图1左)。请注意,化合物c在溶液中不完全溶解。
总之,数据表明化合物c不仅对aβo诱导的神经毒性提供了强有力的保护作用,而且观察到化合物c有促进神经元生长的作用。
化合物c的示例i-2
化合物c(十五烷酸甘油三酯)对小鼠原代神经元模型中轴突生长的影响
研究目的是测试化合物c在不同浓度下对小鼠原代皮质神经元的神经营养作用。
如示例i-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。培养96小时后,记录轴突长度。简言之,用冷pbs洗涤细胞并用冷甲醇固定。固定后,使用特异性抗体免疫标记检测细胞的总map2蛋白。map2抗体是神经元、轴突和神经元树突非常好的免疫标记物。为了测量轴突的长度,使用倒置显微镜捕获标记细胞的六个独立图像。使用neuron-j软件分析细胞图像,手动记录轴突长度。每组大约100个独立神经元被测试。数据表示为平均轴突长度(均数±标准差)(μm)。使用t检验分析载体处理组和不同化合物处理组之间的统计学差异。
如预期的那样,sappα(阳性对照)强烈刺激了神经元轴突生长,长度达到264.63±157.51μm,而载体对照长度是165.96±90.18μm(p<0.0001);化合物c在浓度为10000nm时,神经元轴突生长长度达到304.27±149.60μm(与载体对照比,p<0.0001);浓度为1000nm时长度为199.93±101.17μm(p<0.05)。(图3)
总之,数据表明化合物c有显著促进小鼠原代神经元轴突生长和神经营养作用。
化合物c的示例i-3
化合物c(十五烷酸甘油三酯)在小鼠原代神经元模型中的作用-与aβo同时添加或在aβo处理后3和6小时再添加时
研究目的是确定化合物c是否能在体外神经毒素诱导的神经元死亡模型中具有保护、抗凋亡和修复作用。为此,用aβ1-42寡聚体(aβo)攻击的小鼠原代皮层神经元,研究了六种浓度下化合物c的神经保护作用。在不同的时间点(和aβo同时添加t0,aβo添加之后3个小时t3,aβo添加之后6个小时t6)添加化合物c,检测其修复作用或抗凋亡作用。
如示例i-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。
在不同的时间点(和aβo同时添加t0,aβo添加之后3个小时t3,aβo添加之后6个小时t6)添加化合物c。将小鼠皮层神经元暴露于1.0μmaβo中24小时,再使用mtt测定aβo诱导的神经毒性。如预期的那样,皮质神经元在1.0μmaβo中培育24小时,结果细胞活力降低为50.9±2.0%,51.3±2.0%和51.7±4.2%。(图4)
如预期的那样,在t0时刻添加神经保护肽humanin(hng肽的s14g变体,阳性对照)大大降低aβo诱导的神经元死亡,细胞活力为对照组的91.6±2.1%(图4);而在aβo之后3或6小时加入时,hng并没有能保护细胞死亡,这与历史数据吻合。对照数据表明:如预期的那样,hng可以在而且仅在与aβo同时添加成功地拯救用aβo攻击的细胞,验证了测试系统。
分别在加aβo的同时(t0),3小时后(t3)和6小时后(t6)这三个时间点添加不同浓度的化合物c。结果是:在所有实验条件(即t0,t3和t6)中,化合物c显示剂量依赖性的神经保护作用。当浓度是1000nm时,化合物c与aβo同时添加时可以防止aβo诱导的细胞死亡(细胞活力为94.5±4.6%)。化合物c在添加aβo之后3小时才添加时,仍然可以保护并减少aβo诱导的细胞死亡(浓度为320和1000nm时,细胞活力分别为65.3±2.6%和76.6±2.9%);化合物c在添加aβo之后6小时才添加时,也可以保护并减少aβo诱导的细胞死亡(当浓度为1000nm时,细胞活力为62.4±3.5%)。(图4)
总之,数据表明化合物c对aβo诱导的神经毒性提供了强有力的保护、抗凋亡和修复作用。化合物c与humanin比较起来,能比humanin更有效地拯救aβo诱导的神经元死亡。
化合物c的示例i-4
化合物c(十五烷酸甘油三酯)对aβo处理后的人多能干细胞(ipsc)诱导分化的神经细胞的作用-与aβo同时添加或在aβo处理后3和6小时再添加
实验目的是为了检测化合物c是否可能拯救受aβ1-42寡聚体(aβo)攻击的人ipsc诱导分化的神经元死亡。在这种细胞模型中,aβo诱导快速和大量的神经元死亡,神经元活性可以通过使用特异性elisa测定法检测神经元特异性烯醇化酶(nse)水平来判断。化合物c将在不同的时间点(同时和加aβo之后)加入,目的是识别是否有拯救效应。
将细胞(hip-neuronalprogenitors,globalstem,cat#gsc-4312,lot#20010260)以60.000个细胞/孔的密度接种在96孔板中并培养。在实验之前,用5周时间培养成熟的人神经细胞,并保存在37℃加湿5%co2的环境中。
将细胞在载体或1μmaβo中培育,不同浓度化合物c(即10,100,1000和10000nm)在不同时间点添加:和aβo同时添加(t0),加aβo后3小时添加(t3)或6小时后添加(t6)。将细胞在最终体积100μl孔中培育24小时。阳性对照0.1μmhng(即humanin肽的s14g变体)类似地处理细胞。此外,根据供应商的建议(clonecloud,cat#sea537hu),通过elisa测定,使用神经元特异性烯醇化酶(nse)检测来检测神经元的活性。这里每个实验条件总共产生六个数据点。
将人ipsc暴露于1.0μmaβo中24小时。使用nse测定评估aβo诱导的神经毒性。如预期,神经元在1.0μmaβo中培育24小时分别导致1,2和3板的细胞活力降低为49.7±5.5%,37.5±3.0%和46.9±1.9%。
如预期的那样,在t0添加的humanin肽(hng,阳性对照)强烈地降低aβo诱导的神经元死亡,神经元存活率为对照的85.3±5.6%。但是在aβo后3或6小时加入时,hng并没有保护细胞死亡。这些对照数据表明:i)如预期的那样,hng仅在与aβo同时添加时保护神经元细胞,并且ii)可以成功地拯救用aβo攻击的细胞,验证了测试系统的有效性。(图5)
使用不同浓度化合物c(即10,100,1000和10000nm)在不同时间点处理ipsc:和aβo同时添加(t0),加aβo后3小时添加(t3)或6小时后添加(t6)。结果如下:所有实验条件(即t0,t3和t6)中的化合物c显示剂量依赖性的神经保护和神经修复作用,可以保护aβo诱导的细胞死亡。例如,在10000nm的浓度,化合物c与aβo同时添加,可以阻止aβo诱导的细胞死亡(细胞存活率为76.7±2.7%);加aβo后3小时添加(t3)(细胞存活率为94.2±7.1%)或6小时后添加(t6)(细胞存活率为88.8±1.3%)。(图5)
总之,化合物c对aβo诱导的源自ipsc的人神经元的毒性提供强有力的保护、修复和抗凋亡作用。化合物c与humanin有显著差别,比humanin更有效地抑制aβo在这种细胞模型中的诱导的毒性。
化合物c的示例i-5
化合物c(十五烷酸甘油三酯)在多种神经元毒素处理的小鼠原代神经元模型中的作用-在毒素处理后3小时加入
为测试化合物c是否能在多种毒素处理的体外神经元模型中拯救神经元死亡,使用不同类型毒素攻击的小鼠原代皮层神经元,研究不同浓度的化合物c的神经保护作用。在毒素加入3小时后(t3)加入化合物c,目的在于识别修复和抗凋亡作用。使用mtt测定法研究用毒素处理24小时后的细胞活力。
如示例i-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。
根据历史方案制备稳定的寡聚体或纤维制剂。不同毒素的来源如下:
·aβ1-42和aβ25-35(bachem参考号分别为h1368和h1192)
·人tau蛋白(evotec参考号为2n4r)
·人α-突触核蛋白(r-peptide参考号为0101008603)
·胰岛淀粉样多肽(amylin)(bachem参考号为h-7905.1000)
·朊病毒蛋白118-135(bachem参考号为h-4206)
所有处理组在div6/7的48孔板中进行。将细胞与载体或毒素(指定的最终浓度)一起培育,在毒素加入3小时后加入不同浓度化合物c(100,1000,1000nm)。然后将细胞培育24小时,最终体积为140μl/孔。
使用的阳性对照(在t3添加)为0.1μmhng(humanin肽的s14g变体),hng是众所周知的抗凋亡肽。
在使用mtt测定法监测细胞活力之前,将细胞培养24小时。简而言之,将细胞在35℃下用mtt(sigma,cat#m2128-10g,lot#mkbh7489v)培养1小时。为此,在每个孔中加入14μl5mg/mlmtt(溶解于pbs中)。培养后,除去培养基,细胞用150μldmso溶解10分钟,避光。完全溶解甲
化合物c的抗凋亡和神经保护作用的百分比被定义为(化合物c组的神经元活力-毒素治疗组的神经元活力)/(100-毒素治疗组的神经元活力)×100%。
·抗aβ1-42原纤维诱导的神经细胞凋亡(浓度为10000nm时为22.3%)(图6a);抗aβ25-35原纤维诱导的神经凋亡(浓度为10000nm时为32.1%)(图6b)。
·保护细胞抵抗人类tau寡聚体诱导的神经凋亡(在浓度为10000nm时为46.8%)(图6c);抗tau原纤维诱导的神经凋亡(在浓度为10000nm时为23.1%)(图6d)。
·保护细胞抵抗人类α-突触核蛋白寡聚体诱导的神经凋亡(在浓度为10000nm时为45.8%)(图6e);抗α-突触核蛋白原纤维诱导的神经凋亡(在浓度为10000nm时为34.0%)(图6f)。
·保护细胞抵抗人胰岛淀粉样多肽(amylin)寡聚体诱导的神经凋亡(在浓度为1000,10000nm时分别为30.8%,37.3%)(图6g);抗人胰岛淀粉样多肽(amylin)原纤维诱导的神经凋亡(在浓度为1000,10000nm时分别为45.3%,52.6%)(图6h)。
·保护细胞抵抗朊病毒蛋白寡聚体诱导的神经凋亡(在浓度为1000,10000nm时分别为23.5%,53.8%)(图6i)。
总之,化合物c对多种毒素(aβ1-42原纤维-,aβ25-35原纤维-,人tau寡聚体-,人tau原纤维-,人alpha-突触核蛋白寡聚体-,alpha-突触核蛋白原纤维-,人胰腺淀粉不溶素寡聚体-,人胰腺淀粉不溶素原纤维-和朊病毒蛋白寡聚体)诱导的神经元毒性提供强有力的保护、修复和抗凋亡作用。在毒素处理后的3小时,化合物c与humanin有显著差别,比humanin更有效地抑制多种神经毒素在这种细胞模型中的诱导的毒性。
奇数碳脂肪酸的示例i-6
含不同奇数碳脂肪酸对aβo处理的小鼠原代神经元模型的影响
-在aβo处理前48小时加入
研究目的是测试含不同奇数碳脂肪酸对aβo攻击的小鼠原代皮层神经元的是否有保护作用。在用1μmaβo处理48小时之前加入化合物,目的是预防性保护作用。在用aβo处理24小时后,使用mtt法测定细胞活力。
如示例i-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的原代皮质神经元。
所有处理在48孔板中进行。细胞用载体或1μmaβo培育,在加入aβo之前48小时加入3种不同脂类。将细胞与aβo培养24小时,最终体积为140μl/孔。
阳性对照,0.05μmdha,处理细胞(aβo前48小时)。
在aβo处理后,使用mtt测定法测量细胞活力。简而言之,将细胞在35℃下用mtt(sigma,cat#m2128-10g,lot#mkbh7489v)培养1小时。为此,在每个孔中加入14μl5mg/mlmtt(溶解于pbs中)。培养后,除去培养基,细胞用150μldmso溶解10分钟,防止光照。完全溶解甲
将小鼠原代皮质神经元暴露于载体或1μmaβ1-42寡聚体24小时。使用mtt测定评估aβo诱导的神经毒性。如预期的那样,用aβo培养24小时导致对照的存活率降低为59.9±1.7%。(图7)
如预期的那样,用50nmdha预处理细胞可以防止aβo诱导的细胞死亡。实际上,用50nmdha预培养48小时并用1μmaβo攻击原代神经元显示出90.9±3.1%的细胞活力。
总之,具有奇数个碳原子的脂肪酸gg05,gg07或gg09提前48小时预培养细胞,在0.01和0.1μm下具有剂量依赖的轻度的神经保护作用,但在1μm时失去神经保护作用(图7)。
所选脂肪酸的名称和编号如下:
化合物c的示例i-7
化合物c在喜树碱处理的小鼠原代神经元模型中的作用
-在喜树碱处理前48小时加入
研究不同浓度的化合物c对喜树碱诱导的小鼠原代皮质神经元凋亡的保护作用。喜树碱是抑制dna酶拓扑异构酶i(topoi)的细胞毒性喹啉生物碱。
如示例i-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。
喜树碱来自sigma(sigma参考号c9911-(s)-(+)-camptothecin)。
在不存在或添加不同浓度的化合物c(毒素攻击前48小时添加)的情况下,将细胞在载体或毒素中培养。加入毒素后,将细胞进一步培养24小时,最终体积为140μl/孔。
如预期,细胞与喜树碱孵育24小时导致细胞活力降低为对照的57.7±1.6%。在喜树碱处理前48h加入化合物c,化合物c表现剂量依赖性神经保护作用(钟形曲线),剂量为10和100nm时具有最大作用(细胞活力为73.5±1.5%和73.4±5.9%)。(图8)
总之,研究表明,化合物c具有保护喜树碱诱导的神经元死亡的作用。
化合物c(sbc003)和草药b(sbc002)的示例i-8
化合物c和草药b对酿酒酵母年龄诱导的蛋白质聚集体的影响
研究背景:在大多数生物中,老齡化与损伤和错误折叠的蛋白质聚积有关。
研究目的:为了解化合物c(sbc003)和草药b(sbc002)的作用机制,测试化合物c(sbc003)和草药b(sbc002)提取物对芽殖酵母系统中年龄诱导蛋白质聚集体形成和维持的影响。
研究方法:在老化酵母细胞中,年龄诱导的蛋白聚集体招募一组特定的伴侣和共伴侣,因此可以在显微镜下容易呈现。hsp104内源表达,能与绿色荧光蛋白标记(hsp104-gfp)融合,在这些细胞中形成聚集中心。(图9a)
为了测试对年龄诱导的hsp104-gfp形成的影响,获得了老化酵母细胞,并在化合物c(1μm,10μm和30μm),herbb(10μg/ml),乙醇(0.3%,载体)或没有任何治疗。未经处理的年轻细胞通过简单的指数生长获得。
酵母细胞年龄通过用荧光增白剂28来确定染色芽瘢痕。在所有条件下,老细胞具有相似的年龄分布,平均年龄为10代(n>73个细胞)。(图9b)
未处理或用载体处理的大部分老酵母细胞仅含有一个hsp104-gfp聚集中心(比例分别为68.2±3.7%和58.7±10.6%)。用10μm或30μm的化合物c(sbc003)处理细胞显著降低具有hsp104-gfp聚集中心的细胞比例(37.5±6.0%,34.3±13.7%,p<0.001)。用1μm的化合物c处理可以降低hsp104-gfp聚集中心的细胞的比例,但是这一减少无统计学意义(46.2±4.8%,p>0.05)。用草药b提取物(sbc002)处理细胞呈现出含有hsp104-gfp中心的细胞比例显著降低(29.7±5.5%,p<0.01)。(图9c)
hsp104属于蛋白质聚集体沉积物,并能抵抗病理性的蛋白质聚集,将其转化成单个蛋白质。测定了所有条件下老细胞中hsp104-gfp的浓度。老细胞中hsp104-gfp的密度高于年轻细胞。然而,化合物c和草药b均减少了hsp104-gfp密度,这表明暴露于化合物c和草药b的细胞中的hsp104-gfp密度减少。与最高测试浓度(30μm)和草药b处理相比,在较低的化合物c浓度(1和10μm)下,hsp104-gfp密度较高,与这些处理对具有hsp104-gfp聚集中心的细胞的百分比有关。(图9d)
总之,化合物c和草药b提取物对于在正常酵母老化期间年龄诱导的蛋白质聚集具有很强的预防和/或清除作用。
功能性食品的示例(ii)(sbc003)
化合物c(十五烷酸甘油三酯)是一种天然的脂类,可以在特定的植物中发现,而且在人/动物的奶中也有。示例ii中描述的患者患有不可治愈的疾病,在没有任何有效的治疗的情况下,自愿请求服用含有sbc003的功能性食物。
功能性食品的示例ii-1
本案例为一名49岁的台湾女性,诊断为视神经萎缩8年,几乎失明。在第1天,当她服用一种含有sbc003的功能食物时,觉得视觉更加明亮,可以更好地区分出黑白的对比。她觉得精神变好,感到手掌和脚部发热。然后她食用含有sbc003的功能食物,约7毫克/天。持续7天后,吃饭的时候,她可以看到筷子。洗碗时可以看到她的手。她感觉到对黑暗中的灯光敏感。她的手掌和脚部感到温暖。大约一个月后,她的视野更明亮。
功能性食品的示例ii-2
这是一名49岁的台湾男性。他被诊断患有肌萎缩性侧索硬化(als)9年。他躺在床上,依靠呼吸机辅助呼吸,连一根手指都无法移动。他每天最多可以自主呼吸30分钟。他开始食用含有sbc003的功能性食品约10mg/天,大约一个月后,他可以自己呼吸约55分钟/天。他的背部感到温暖。
功能性食品的示例ii-3
这是一名48岁的中国男性。他被确诊为原发性帕金森病9年,走路摇晃,肢体动作僵硬,运动缓慢,步行困难。他用左旋多巴和三己烯苯酯治疗8年,开始有效,但逐渐无效。三年前,因为药物失效,他被放置了深部脑刺激微电极,以减少运动症状。他仍然出现异动,僵硬,运动缓慢,走路困难。他开始食用一种含有sbc003的功能食物,约10mg/天。大约一个星期后,异动的症状明显改善约2周。然后由于一些原因停用了,之后又重新开始服用约半个月,再次出现症状改善。
功能性食品的示例ii-4
这是一名49岁的台湾男性。他被诊断为小脑萎缩,肢体痉挛,并在床上瘫痪需要24小时的护理。他不能微笑或说话,不能与他人沟通。人们跟他说话的时候,他没有表情。他开始食用一种含sbc003的功能食物,约10mg/天。大约一个月后,他开始微笑,脸上有表情,甚至在人们跟他说话的时候也似乎要说话。
功能性食品的示例ii-5
这是一名出生日期为1959年9月22日的中国男性。在2015年12月,由于从10米高的建筑物上意外跌落,他的胸椎和腰椎受到严重的断裂性骨损伤和骨折。然后,他不能走路,不能坐,床上瘫痪,腰部感觉不舒服,腰部疼痛。大约6个月后,他有一点改善,可以坐1个小时左右,但其他症状仍然存在。他开始服用含sbc003的功能食物(约20毫克/天)。第一天,他在食用sbc003后,感觉到脊髓区域发热。约10天后,他在以下症状方面有很大的改善:1)与服用sbc003相比,腰痛明显减轻;2)在服用sbc003之前,他只可以坐1个小时左右,服用之后,可以坐2个小时/次。此外,他经常在脊髓区感到温暖的热流,他的小腿比以前痉挛次数减少。
功能性食品的示例ii-6
这是一名1936年11月30日出生的80岁中国女性。患额颞叶痴呆约10年。性格比较孤僻,喜欢独处,脾气较暴躁,人际交流有障碍。开始食用一种含sbc003的功能食物,约20mg至30mg/天。约1-3个月后,精神状态开始变好,与人交流开始变得自然。
功能性食品的示例ii-7
这是一名70岁的台湾女性。患有慢性肾功能衰竭10年,每周三次接受血液透析治疗2-3年。她没有尿。她的血清肌酐维持在非常高的水平,平均值为9.21mg/dl。她开始食用一种含sbc003的功能食物,约10mg/天至25mg/天。约2个月后,每天尿一次,量约10ml;每天增加到50-100毫克/日后,她每天尿量约2-3次,总体积约为50ml。复查四次,血清肌酐为8.88,8.97,8.559.12mg/dl,平均水平8.88mg/dl。她的血糖水平降至70-105mg/dl,而治疗前为130-180mg/dl。
功能性食品的示例ii-8
这是一名1974年9月12日出生的台湾男性,诊断患有哮喘约29年。每当感冒或早晨或喝冷水或爬楼梯时,哮喘会发作。在过去29年中,如果哮喘发作,他就服用皮质类固醇或支气管扩张剂。他开始食用一种含sbc003的功能食物,一两次,每次约5mg,他觉得症状大大改善。即使在有诱发因素,例如饮用了大量的冷水或感冒的时候,也不会发生哮喘症状。
功能性食品的示例ii-9
这是一名台湾男性,其出生日期为1977年7月4日,诊断为哮喘约20年。哮喘频发。哮喘发作,大约每两周一次,发作时就用支气管扩张剂治疗。他开始食用一种含sbc003的功能食物,约5mg/次,几次。即使在有诱发因素,也不会发生哮喘症状。
草药b(sbc002)的示例(iii)
示例iii中描述的患者都是使用选择sbc002一些品种的一些部位制成的干燥粉末。
用sbc002治疗的患者的病例研究
示例iii-1案例sbc002-001
1.2002年诊断:视神经炎(左)
病例sbc002-001是一名出生日期为1966年9月22日的女性。她于2002年第一次发生左眼视力模糊,发病7天后进行类固醇冲击治疗。然而视力没有改善,她的残余视力可以看到20厘米的手动。没有四肢无力症状。
2.2007年诊断:视神经炎(右);视神经萎缩(左)
2007年3月2日,她因为右眼视力严重模糊两天而入住中国医科大学医院(cmuh)。相对传入瞳孔缺陷征(rapd)呈阳性。怀疑有视神经炎。她接受了类固醇脉冲治疗。
3.2008年5月诊断:视神经萎缩(左);视神经炎(右),多发性硬化;胸脊髓炎
2008年3月26日,rnfl平均厚度分析显示43.51μm(左),77.60μm(右);2008年5月19日,rnfl平均厚度分析显示不可检测(<10μm)(左),72.33μm(右)。
2008年5月24日,右眼视力模糊,眼睛运动相关的眼部疼痛5天。诊断为视神经炎(od),接受了类固醇脉冲治疗。磁力运动诱发电位(mep)研究表明病变高于左c5脊椎水平;右侧c5和l2脊椎水平之间的病变,以及低于双侧l2脊椎水平的病变。
2008年5月27日,模式和护目镜视觉诱发电位(vep)研究表明,左眼没有正确p100刺激波,右眼p100刺激波延迟,波幅减小。vep提示双侧视交叉前病变,左侧更突出。体感诱发电位(ssep)研究显示两肢上肢周围神经损伤;双侧c5和l2脊椎水平之间的病变;以及低于左侧l2脊椎的水平病变。
脑部mri与右视神经炎的诊断相符,并显示出高信号。脉冲治疗后,怀疑多发性硬化。2008年5月31日,她被诊断为视神经萎缩(os);视神经炎(od),可能多发性硬化症;胸脊髓炎出院后,使用泼尼松龙5mg每天两次,甲钴胺250mgqd;维生素b12qid。
4.2008年8月诊断:多发性硬化;复发右视神经炎;既往左视神经炎伴视神经萎缩后遗症;多发性硬化相关性脊髓病
2008年8月1日,她右眼视力恶化了一个月。通过模式移位法进行vep研究:左眼或右眼均没有观察到vep波。她接受了类固醇脉冲治疗和ifn-1b治疗。给予类固醇脉冲治疗和ifn治疗,症状得到改善。
5.2009年1月诊断:多发性硬化(急性复发);横贯性颈髓病;失眠;神经源性膀胱。
2009年1月10日,她出现颈部疼痛,右侧无力3天,有疑似复发性颈髓性脊髓炎。第二天,她感到右腿容易痉挛,右手感觉麻木,右脚柔软。右手拿笔和筷子有困难,行走时右脚困难,上下楼梯难度大。接受类固醇脉冲治疗。感到颈部疼痛消退,但右侧依然无力。
6.2013年6月诊断为皮层萎缩
2013年6月,脑mri显示脑室和脑沟扩张。被诊断为大脑萎缩。
7.从2014年1月起诊断为干燥综合征
2014年1月,由于双侧失明,视力模糊,疲劳,四肢感觉异常和左前臂瘙痒的进行性恶化,她在卫生和福利部台中医院进行了随访。她被诊断为干燥综合征,湿疹,主要接受geniquin(硫酸羟氯喹)200mgbid治疗。
8.sbc002(草药b)治疗从2015年12月21日至2016年1月5日
在2015年12月21日之前,她双目失明。2015年12月21日,她以0.01-0.02g/天的剂量,开始使用第一剂sbc002。她的两只眼睛后部有强烈的能量运行的感觉。
在第一次给药后的第5天,她可以看到在眼前的手指。
在第17天,她可以在吃饭的时候看到筷子移动。同一天,她去了卫生和福利部台中医院,vep研究(通过护目镜法)分别显示左眼或右眼潜伏期延长的p100波(测量的延迟时间:左=190.3ms;右=190.8ms)。眼底摄影显示没有明显的视网膜病变。
在第27天,她可以在30厘米的距离内看到白皮书,可以识别白天和黑夜,街上的斑马人行横道和建筑物的轮廓。她可以看到红色,白色,黑色和橙色的颜色;她可以在晚上看路灯。
在第32天,rnfl厚度平均分析显示32μm(左);38μm(右)。
在第120天,她的脑mri显示,sylvian裂缝和大脑脑沟没有扩大。脑室未扩张。脑mri没有被诊断为“皮层萎缩”。
sbc002治疗14个月后,rnfl厚度平均分析显示71μm(左);49μm(右)。
9.评论
在服用sbc002之前,从2002年到2015年,这位50岁的女性患者已经患有多发性硬化症和相关并发症13年,左视神经萎缩7年和右视神经炎8年;脑萎缩2.5年。2007年8月左眼或右眼vep波完全消失,左眼rnfl为10μm。尽管已经用类固醇,干扰素,免疫抑制治疗5年治疗,多发性硬化持续发展到神经退行性病变。
服用5天sbc002,她的视力部分恢复;17天后,vep研究显示左眼或右眼p100波重新出现,表明双侧视神经功能恢复;32天后,左眼rnfl从<10μm增加到32μm;14个月后,左眼rnfl厚度增加到71μm。脑萎缩在4个月的草药b治疗后消失。主要的伴随用药硫酸羟氯喹具有不可逆的视网膜损伤,视网膜病变,色素沉着和视野缺陷的改变的警告。在13年的疾病发展和视神经萎缩的背景下,仔细检查视力恢复前的重要事件,她的视力和皮质恢复不可能被疾病本身的病程或其他药物的作用解释。这个案例中,根据这种意想不到的视力恢复和使用sbc002之间的明确的时间关系,sbc002与视力恢复、视神经的生长和原来萎缩的大脑皮质的恢复有非常直接的因果关系。
示例iii-2案例sbc002-002
本例是指1966年6月22日出生的女性。2016年2月,她出现脑卒中(脑出血)。中风后,她很快康复,但仍有偏盲症状,而且晚上睡觉不好(只能间断的睡2-3个小时)。她服用了sbc00210毫克。在吃这种草药的晚上,她整夜睡了8个小时,直到早上被人叫醒。
示例iii-3含有sbc002的草药混合物(sbc001)的作用和安全性的观察性案例研究
多发性硬化(ms),视神经炎(on),急性炎性脱髓鞘性多发性神经病(aidp)和颅神经疾病等神经系统疾病存在未满足的医疗需求。我们进行了回顾性和前瞻性病例研究,以观察作为治疗神经系统疾病的含有关键成分sbc002的草药混合物sbc001的临床疗效和安全性(含有约5-10%的sbc002)。
回顾性(n=8)或前瞻性(n=1)地收集了9例具有保存完整的医院病历的案例。收集并记录有关疾病发病日期,医院诊断治疗,症状,疗效和安全性的信息。对于前瞻性随访的一名患者,使用日记收集记录患者的每日症状。对所有参数进行了描述性分析。
发病年龄在14-71岁。男:女比例为4:5。5例患有ms,2例患有aidp,2例患颅神经麻痹。8名患者出现视觉症状;6例患者出现肢体虚弱或麻木症状。治疗前疾病持续时间为4天至5年,大部分(6/9)小于<6个月。所有患者医院的诊断明确,具备临床病程、症状、神经系统检查和mri检查结果的支持。
其中6/9例患者接受了医院标准治疗(类固醇,免疫抑制剂,非甾体抗炎药);3/9名患者提供营养或辅助疗法(例如维生素)。其中6/9例患者症状在医院治疗后暂时改善,但后来复发,因此寻求替代药物;而3/9名患者对医院治疗没有应答。
sbc001中sbc002的等效剂量为0.05-0.2g/次,3-5次/日。6名患者仅用该药物混合物治疗;3例患者伴随类固醇使用约2周,然后服用草药混合物。其中7名患者可以遵守治疗方案;和2人无法遵循治疗方案。
本药治疗后共有7/9例患者症状完全恢复,其中1/9例有改善;1/9没有应答。起效时间是1天到2个月。完成恢复的时间为25天至6个月。
视觉症状(n=8):6/8例患者视力症状在25天至6个月内完全康复;而起效时间是1天到2个月。1名患者未改善;1名患者有改善。
肢体症状(n=6):3/6患者肢体无力或麻木症状在3-6个月内完全康复。起效时间为1天至1.5个月。
医学影像(n=3):治疗前后3例患者具有配对脑mri检查结果,其中2例表现为mri改善。
4名患者在1-2个月后也有记忆改善。
治疗应答的持久性:直到最后一次随访,5例完全恢复并且停药。在6例患者中,他们分别报告了1.5年,1.5年,3.8年,4.5年,4.5年,22年的无症状生存期。
5例患者曾经自行停止治疗,症状有复发;恢复治疗后,症状再次好转。症状的出现/消退与停药/用药之间的时间关系表明,治疗症状改善与用药的因果关系不能排除。
总体而言,含有sbc002的草药混合物(sbc001)安全性和耐受性好。一名患者在治疗开始时报告呕吐,治疗暂停后3天内完全回复。没有观察到其他不良事件或毒性
根据病例观察,含sbc002的草药混合物(sbc001)对ms,on,aidp,颅神经疾病等神经系统疾病具有良好的效果和安全性。
用sbc002治疗的健康志愿者的案例研究
示例iii-4案例sbc002-003
这是一名1974年9月12日出生的健康男性。服用sbc0020.005g一次,约过10-30分钟,他觉得视力变得更加明亮。他的记忆力和反应速度也有提高。
示例iii-5案例sbc002-004
这是一名1983年5月16日出生的健康女性。服用sbc0020.002g一次,她觉得自己的思想状态更清晰,思维变得更快。
示例iii-6案例sbc002-005
这是一名1977年7月4日出生的健康男性。服用sbc0020.005g一次,他觉得他的视力变得更加明亮。他的记忆变得更好了,反应更快。
示例iii-7案例sbc002-006
这是一名1970年7月30日出生的健康男性。服用sbc0020.01g一次,他的视力更亮,视觉灵敏度更高;长时间看电脑后疲劳感减轻。他觉得他的思想提升到了一个更高的水平(思维更快,思维更清晰,判断更快,决策更快),持续约5天。
示例iii-8案例sbc002-007
这是一名1974年7月29日出生的健康女性。其双眼900-950度近视。在第一次服用sbc0020.01g后的第一天,20分钟内,感觉到她的左眼被热的能量包围,30分钟内,右眼被热的能量包围;在40分钟内,全脑充满热能量,她开始感到大脑非常安静。然后,她每天服用0.01g,之前在经过4-5小时面对电脑工作之后,她经常感到视力疲劳;现在即使面对电脑工作7小时之后,她很少感觉到视力疲劳。在服用sbc002的一个月内,她感觉到视力更清晰,视觉疲劳更少。sbc002停用后,视力下降,视力疲劳感与使用sbc002之前相似。
草药b提取物(sbc002)细胞实验的示例(iv)
草药b提取物的示例iv-1
aβo处理前48小时加入草药b(sbc002)提取物对小鼠原代皮质神经元的影响
研究目的是确定草药b提取物是否可能拯救体外神经元模型中的神经元死亡。为此,用aβ1-42寡聚体(aβo)攻击的小鼠原代皮层神经元作为研究模型,研究草药b提取物在六种浓度下的神经保护作用。β-淀粉样蛋白引发多种病理改变,最终导致多种神经系统疾病(包括ad)的神经元功能障碍和变性。
按照现成的方法,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。简言之,将解离的皮层细胞在预涂有1.5μg/ml聚鸟氨酸(sigma)的48孔板中铺板(50.000个细胞/孔)。细胞在化学意义上的不含血清的dulbecco's改良的eagle/f12培养基中培养,并补充有激素,蛋白质和盐。细胞在35℃,6%co2的加湿环境中保存培养。小鼠皮质神经元在载体或不同浓度的草药b提取物预培养48小时后,暴露于1.0μmaβo中24小时。使用mtt法来测定aβo诱导的神经毒性。
草药b提取物的制备:
i.准备母液(10mg/ml),在1.5mleppendorf管中加入1mldmso到草药b(10mg)中,然后在30-37℃的温度下旋转ep管过夜。
ii.取母液上清液,然后通过细胞培养基将溶液稀释至1000倍;获得最高剂量的工作液(10μg/ml)。
iii.通过使用细胞培养基3倍倍比稀释最高剂量的工作液,以达到3.2μg/ml,1μg/ml,320ng/ml,100ng/ml,32ng/ml的其他5种剂量。
如预期的,用1.0μmaβo处理24小时的皮质神经元细胞活力降低为48.6±1.4%。dha(0.05μm,阳性对照)降低aβo诱导的神经元死亡,剩余细胞活力为对照组的82.0±2.6%。对照数据表明:i)如预期的那样,dha保护神经元,和ii)通过dha预处理可以成功地预防aβo引起的细胞凋亡,验证了实验模型的有效性。
神经元与不同浓度的草药b提取物预培养48小时,然后用1μmaβo处理24小时。结果是,在不同浓度的草药b提取物作用下,表现出剂量依赖性神经保护作用(图10右和图11)。在10000ng/ml的悬浮液浓度时达到最大的神经保护作用(细胞存活率为119.5±6.4%)。
当用不同浓度的草药b提取物培养神经元48小时,草药b提取物的浓度是32或10000ng/ml时就显示高达111.4±3.2%或112.9±4.1%的细胞活力(图10左)。
总之,研究表明草药b提取物不仅对aβo诱导的神经毒性提供了强有力的保护作用,而且观察到草药b提取物有促进神经元生长的作用。
草药b提取物的示例iv-2
草药b提取物在小鼠原代神经元模型中的作用-与aβo同时添加或在aβo处理后3和6小时再添加时
研究目的是确定草药b提取物是否能在体外神经毒素诱导的神经元死亡模型中具有保护、抗凋亡和修复作用。为此,用aβ1-42寡聚体(aβo)攻击的小鼠原代皮层神经元,研究了六种浓度下草药b提取物的神经保护作用。在不同的时间点(和aβo同时添加t0,aβo添加之后3个小时t3,aβo添加之后6个小时t6)添加草药b提取物,检测其修复作用或抗凋亡作用。
如示例iv-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。草药b提取物类按照示例iv-1中所述同样方法来制备。
在不同的时间点(和aβo同时添加t0,aβo添加之后3个小时t3,aβo添加之后6个小时t6)添加草药b提取物。将小鼠皮层神经元暴露于1.0μmaβo中24小时,再使用mtt测定aβo诱导的神经毒性。如预期的那样,皮质神经元在1.0μmaβo中培育24小时,结果1,2,3这三块板中细胞活力分别降低为50.9±2.0%,51.3±2.0%和51.7±4.2%。(图12)
如预期的那样,在t0添加神经保护肽humanin(hng肽的s14g变体,阳性对照)大大降低aβo诱导的神经元死亡,细胞活力为对照组的91.6±2.1%(图12);而在aβo之后3或6小时加入时,hng并没有能保护细胞死亡,这与历史数据吻合。对照数据表明:如预期的那样,hng可以在而且仅在与aβo同时添加成功地拯救用aβo攻击的细胞,验证了测试系统。
分别在加aβo的同时(t0),3小时后(t3)和6小时后(t6)这三个时间点添加不同浓度的草药b提取物的结果是:在所有实验条件(即t0,t3和t6)中,草药b提取物显示剂量依赖性的神经保护作用。草药b提取物与aβo同时添加时可以完全防止aβo诱导的细胞死亡(浓度是100和1000ng/ml时,细胞活力分别为93.3±2.5%和102.2±6.3%)。草药b提取物在添加aβo之后3小时才添加时,仍然可以保护并减少aβo诱导的细胞死亡(浓度是100和1000ng/ml时,细胞活力分别为77.5±1.5%和91.6±4.9%);草药b提取物在添加aβo之后6小时才添加时,也可以保护并减少aβo诱导的细胞死亡(浓度是100和1000ng/ml时,细胞活力分别为59.9±2.2%和72.1±2.0%)。(图12)
总之,研究表明草药b提取物对aβo诱导的神经毒性提供了强有力的保护、抗凋亡和修复作用。草药b提取物与humanin比较起来,能比humanin更有效地拯救aβo诱导的神经元死亡。
草药b提取物的示例iv-3
草药b提取物对aβo处理后的人多能干细胞(ipsc)诱导分化的神经细胞的作用-与aβo同时添加或在aβo处理后3和6小时再添加
实验目的是为了检测草药b提取物是否可能拯救受aβ1-42寡聚体(aβo)攻击的人ipsc诱导分化的神经元死亡。在这种细胞模型中,aβo诱导快速和大量的神经元死亡,神经元活性可以通过使用特异性elisa测定法检测神经元特异性烯醇化酶(nse)水平来判断。草药b提取物将在不同的时间点(同时和加aβo之后)加入,目的是识别是否有拯救效应。
将细胞(hip-neuronalprogenitors,globalstem,cat#gsc-4312,lot#20010260)以60.000个细胞/孔的密度接种在96孔板中并培养。在实验之前,用5周时间培养成熟的人神经细胞,并保存在37℃加湿5%co2的环境中。
草药b提取物类按照示例iv-1中所述同样方法来制备。
将细胞在载体或1μmaβo中培育,不同浓度草药b提取物(即10,100,1000和10000ng/ml)在不同时间点添加:和aβo同时添加(t0),加aβo后3小时添加(t3)或6小时后添加(t6)。将细胞在最终体积100μl孔中培育24小时。阳性对照0.1μmhng(即神经保护肽humanin的s14g变体)类似地处理细胞。此外,根据供应商的建议(clonecloud,cat#sea537hu),通过elisa测定,使用神经元特异性烯醇化酶(nse)检测来检测神经元的活性。这里每个实验条件总共产生六个数据点。
将人ipsc暴露于1.0μmaβo中24小时。使用nse测定评估aβo诱导的神经毒性。如预期,神经元在1.0μmaβo中培育24小时分别导致1,2和3板的细胞活力降低为49.7±5.5%,37.5±3.0%和46.9±1.9%。
如预期的那样,在t0添加的humanin肽(hng,阳性对照)强烈地降低aβo诱导的神经元死亡,神经元存活率为对照的85.3±5.6%。但是在aβo后3或6小时加入时,hng并没有保护细胞死亡,这与历史数据吻合。这些对照数据表明:i)如预期的那样,hng仅在与aβo同时添加时保护神经元细胞,并且ii)可以成功地拯救用aβo攻击的细胞,验证了测试系统的有效性。(图13)
使用不同浓度草药b提取物在不同时间点处理ipsc:和aβo同时添加(t0),加aβo后3小时添加(t3)或6小时后添加(t6)。结果如下:所有实验条件(即t0,t3和t6)中的草药b提取物显示剂量依赖性的神经保护和神经修复作用。例如,在100,1000,10000ng/ml的浓度,草药b提取物与aβo同时添加,可以阻止aβo诱导的细胞死亡(细胞存活率分别为69.0±6.3%,72.7±2.4%,78.6±5.4%);加aβo后3小时添加(t3)(细胞存活率为70.6±7.7%,71.1±3.4%,86.0±6.1%)或6小时后添加(t6)(细胞存活率分别为56.6±5.0%,53.9±14.9%,74.9±6.7%)。(图13a,4b,4c)
总之,草药b提取物对aβo诱导的源自ipsc的人神经元毒性提供强有力的保护、修复和抗凋亡作用。草药b提取物与humanin有显著差别,比humanin更有效地抑制aβo在这种细胞模型中的诱导的毒性。
草药b提取物的示例iv-4
草药b提取物在多种神经元毒素处理的小鼠原代神经元模型中的作用
-在毒素处理后3小时加入
为测试草药b提取物是否能在多种毒素处理的体外神经元模型中拯救神经元死亡,使用不同类型毒素攻击的小鼠原代皮层神经元,研究不同浓度的草药b提取物的神经保护作用。在毒素加入3小时后(t3)加入草药b提取物,目的在于识别修复和抗凋亡作用。使用mtt测定法研究用毒素处理24小时后的细胞活力。
如示例iv-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。草药b提取物类按照示例iv-1中所述同样方法来制备。
根据历史方案制备稳定的寡聚体或纤维制剂。不同毒素的来源如下:
·aβ25-35(bachem参考号为h1192)
·人重组tau蛋白(evotec参考号为2n4r)
·人重组α-突触核蛋白(r-peptide参考号为0101008603)
·胰岛淀粉样多肽(amylin)(bachem参考号为h-7905.1000)
·朊病毒寡聚体118-135(bachem参考号为h-4206)
所有处理组在div6/7的48孔板中进行。将细胞与载体或毒素(指定的最终浓度)一起培育,在毒素加入3小时后加入不同浓度草药b提取物(1000,10000ng/ml)。然后将细胞培育24小时,最终体积为140μl/孔。
使用的阳性对照(在t3添加)为0.1μmhng(神经保护肽humanin的s14g变体),hng是众所周知的抗凋亡肽。
在使用mtt测定法监测细胞活力之前,将细胞培养24小时。简而言之,将细胞在35℃下用mtt(sigma,cat#m2128-10g,lot#mkbh7489v)培养1小时。为此,在每个孔中加入14μl5mg/mlmtt(溶解于pbs中)。培养后,除去培养基,细胞用150μldmso溶解10分钟,避光。完全溶解甲
草药b提取物的抗凋亡和神经保护作用被定义为(草药b提取物组的神经元活力-毒素治疗组的神经元活力)/(100-毒素治疗组的神经元活力)×100%:
·抗10μmaβ25-35原纤维诱导的神经细胞凋亡,浓度为10000ng/ml时的剩余细胞活力为82.9±2.2%,抗凋亡和神经保护作用为39.9%。(图14a)
·抗1μm人类tau寡聚体诱导的神经细胞凋亡,浓度为10000ng/ml时的剩余细胞活力为59.4±2.1%,抗凋亡和神经保护作用为34.0%。(图14b)
·抗α-突触核蛋白原纤维或聚集体诱导的神经细胞凋亡,浓度为10000ng/ml时的细胞活力分别为82.5±2.6和82.2±2.2%,抗凋亡和神经保护作用分别为46.6%和62.5%。(图14c和14d)
·抗5μm胰岛淀粉样蛋白原纤维引起的神经细胞凋亡,浓度为10000ng/ml时的细胞活力为81.1±2.5%,抗凋亡和神经保护作用为27.9%。(图14e)
·抗2μm朊病毒寡聚体118-135诱导的神经细胞凋亡,浓度为10000ng/ml时的细胞活力为66.2±3.3%,抗凋亡和神经保护作用为23.5%。(图14f)
总之,研究表明,草药b提取物对aβ25-35原纤维,人tau寡聚体,人tau原纤维,人α-突触核蛋白寡聚体,α-淀粉样蛋白,突触核蛋白原纤维,人胰岛淀粉样蛋白原纤维和朊病毒蛋白寡聚体诱导的小鼠原代皮层神经元中的神经毒性,有强大的神经保护、修复和抗凋亡作用。草药b提取物与人神经保护肽蛋白humanin区分开来,因为它比人源蛋白更有效地抑制这些细胞模型中多种毒素诱导的神经元死亡。
草药b提取物的示例iv-5
草药b提取物对h2o2处理的小鼠原代神经元模型的影响
-当在毒素处理48小时前或3小时后加入
研究目的为了确定草药b提取物是否可以在h2o2体外模型中拯救神经元死亡。在毒素之前的48小时或3小时(t3)之后加入草药b提取物,目的是鉴定拯救效果。在毒素中培养24小时后,使用mtt测定法研究细胞活力。
如示例iv-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。草药b提取物类按照示例iv-1中所述同样方法来制备。
小鼠原代皮质神经元用0.25mmh2o2处理24小时。草药b提取物和1mmtrolox(阳性对照)在h2o2后3小时加入。使用mtt测定评价毒素的神经毒性。如预期的那样,细胞在h2o2毒素中培养24小时细胞活力降低为36.2±3.0%。trolox用作阳性对照,部分抑制h2o2诱导的细胞死亡。草药b提取物表现剂量依赖性神经保护作用,并且在10000ng/ml浓度时具有最大作用,细胞活力为56.8±2.4%。(图15a)
小鼠原代皮质神经元用0.25mmh2o2处理24小时。草药b提取物和1mmtrolox在h2o2前48小时加入,使用mtt测定评估h2o2的神经毒性。如预期的那样,用h2o2孵育24小时导致细胞活力降低61.7±2.5%。trolox部分抑制h2o2引起的细胞死亡。草药b提取物在10000ng/ml的剂量预防h2o2诱导的细胞死亡,细胞活力为76.7±2.4%。(图15b)。
总之,数据表明,草药提取物在h2o2处理前48小时加入时或在加入h2o2后3小时加入时,对h2o2诱导的神经毒性有保护作用和抗氧化作用。
草药b提取物的示例iv-6
草药b提取物在喜树碱处理的小鼠原代神经元模型中的作用
-在喜树碱处理前48小时加入
研究不同浓度的草药b提取物对喜树碱诱导的小鼠原代皮质神经元凋亡的保护作用。喜树碱是抑制dna酶拓扑异构酶i(topoi)的细胞毒性喹啉生物碱。
如示例iv-1所述,获取c57bl6/j胎鼠(胎龄16-17天)的皮质神经元。喜树碱来自sigma(sigma参考号c9911-(s)-(+)-camptothecin)。草药b提取物类按照示例iv-1中所述同样方法来制备。
在不存在或添加不同浓度的草药b提取物(毒素攻击前48小时添加)的情况下,将细胞在载体或毒素中培养。加入毒素后,将细胞进一步培养24小时,最终体积为140μl/孔。
如预期,细胞与喜树碱孵育24小时导致细胞活力降低为对照的57.7±1.6%。在喜树碱处理前48h加入草药b提取物,草药b提取物表现剂量依赖性神经保护作用,剂量为10000ng/ml时具有最大作用(细胞活力为84.0±6.4%)。有趣的是,草药b提取物的神经保护作用似乎是双相的。事实上,在10ng/ml的剂量下,草药b提取物的神经保护作用低于草药b提取物在1和100ng/ml剂量下的作用。(图16)
总之,研究表明草药b提取物对喜树碱诱导的神经元死亡提供有强大的神经保护、修复和抗凋亡作用。
- 还没有人留言评论。精彩留言会获得点赞!